|
PRODUCCIÓN DE FITOPLANCTON ABAJO COSTO. 1. AISLAMIENTO Y CULTIVO DE MONORAPHIDIUM SP (CHLOROPHYCEAE) EN UN SISTEMA ESTÁTICO EN MEDIO F Y CUATRO A BASE DE FERTILIZANTES AGRÍCOLAS PHYTOPLANKTON PRODUCTIVITY LOW CAST. 1. ISOLATED AND CULTURE OF Monoraphidium sp.(CHLOROPHYCEAE) IN A STATIC SYSTEM OF A CONTROL CULTURE "F" MEDIUM AND FOUR ALTERNATIVE CULTURE MEDIA WITH AGRICULTURAL FERTILIZERS
Marío Nieves-Soto
Escuela de Ciencias del Mar-Uni. Autón. Sin.,
México
Roberto Cortés-Altamirano
Estación Mazatlán (ICMyL-UNAM) Apdo.
811, Mazatlán 82240, Sin., México.
Claudia G. Gutiérrez-Corona
Estación Mazatlán (ICMyL-UNAM) Apdo.
811, Mazatlán 82240, Sin., México.
Ma. Del Rosario Pacheco-Marges
Estación Mazatlán (ICMyL-UNAM) Apdo.
811, Mazatlán 82240, Sin., México.
Se aisló la clorofila de agua dulce
Monorajohidium sp. por la técnica de resistencia.
Posteriormente, se evaluó el efecto de un medio control (MEDIO F) y
cuatro medios alternativos enriquecidos con EDTA-Fe y vitaminas, en un sistema
de cultivo estático. La mayor tasa de crecimiento se logró con el
foliar NIFOKAN (1.0193). Sin embargo, la mayor densidad, al final de la fase
exponencial, fue con el foliar FERTIFOLEN (2,035,833 cels·ml-1). La
mayor densidad de células lograda al final del experimento fue con
NIFOKAN (6,862,167 cels·ml-¹), seguido de FERTIFOLEN (5,890,000
cels·ml-¹ Se concluye que los foliares NIFOKAN y FERTIFOLEN son
adecuados para el cultivo de Monoraphidium sp.,
además de que son una opción de bajo costo en comparación
con el MEDIO F.
PALABRAS-CLAVE: Cultivo
estático, fertilizantes agrícolas, medio "F",
Monoraphidium sp.
The freshwater élilorophyte
Monoraphidium sp. was isolated by the resistence technical,
and the effect of a control culture medium "F" and four alternative culture
media enriched with EDTA-Fe and vitamins in a static: system were assesed. The
highest growth rate was obtained using the fertilizer NIFOKAN (1.0193). The
highest density at the end ofthe exponential stage, however, was reached with
the fertilizer FERTIFOLEN (2,035,833 cels·ml-¹) On the other hand,
the highest densities at the end of the experiment were obtained using the
NIFOKAN (6,862,167 cels·ml-¹) and the FERTIFOLEN (5, 890,000
cels·ml-¹). Therefore, it is concluded that the fertilizaras
NIFOKAN and FERTIFOLEN are appropiate for culture of
Monoraphidium sp. These also represent an best option when
compared to the "F" medium.
KEY WORD: Static culture,
Agricultural fertilizers, "F" medium, Monoraphidium
sp.
El cultivo de microalgas en la acuicultura estriba en que éstas son las primeras formadoras de materia orgánica y, por su tamaño reducido, fácilmente capturables y digeridas por multitud de larvas y estadios juveniles de moluscos, crustáceos y peces (Stanley y Jones, 1976). La capacidad que poseen de convertir sales inorgánicas en compuestos orgánicos, por medio de la fotosíntesis, las hace imprescindibles como alimento vivo (Eddy, 1956; Tamiya, 1957, 1960; Ramos y Salazar, 1990). La clorofita Monoraphiaium sp. no está al margen de esto (Nascimiento, 1989), debido a que es una fuente de proteínas de buena calidad (Zahid et al., 1981). La producción de grandes cantidades de fitoplancton de buena calidad para alimentar diferentes organismos de importancia en la acuicultura, ha traído como consecuencia la aplicación de diferentes métodos para el cultivo de microalgas, de tal manera que algunas veces se obtiene buena calidad pero generalmente ésta es muy variable. Se ha establecido que la composición bioquímica de determinada especie de fitoplancton puede ser modificado bajo diferentes condiciones de cultivo (Webb y Chu, 1982; Fábregas et al., 1985). La clorofila de agua dulce Monoraphidium sp. es un género relativamente nuevo (Legnerová, 1969). Este es muy conocido por ser microalga abundante y distribuida en lagos y presas mexi canos (Ortega, 1984; Téllez y Motte, 1980); además, se ha encontrado en contenidos digestivos de varios peces herbívoros. El presente estudio aborda la hipótesis de utilizar medios de cultivos hechos con fertilizantes de uso común en agricultura, por ser más baratos y de semejante rendimiento que los medios de cultivo con base en sales puras químicamente. MATERIALES Y MÉTODOS
AISLAMIENTO DE LA MICROALGALa técnica de aislamiento de Monoraphidium sp. fue descrita por Martí en 1973 (citado en San Feliu, 1986), consiste básicamente en enriquecer la muestra de agua con determinado conjunto de especies de fitoplancton, dejando envejecer el cultivo, para después reaislarlo y transferirlo nuevamente; a esta estrategia se le conoce como técnica de la resistencia. El alga se obtuvo de un purificador para agua de uso doméstico, la cual se trasladó a medio F de Guillard y Ryther (1962); se cubrió el cultivo parcialmente con papel aluminio y posteriormente se introdujo al cuarto de cultivo de microalgas. Después de 40 días se procedió a hacer diluciones seriadas inoculando con la especie incógnita volúmenes de 0.51 de medio de cultivo; este procedimiento se llevó a cabo paralelamente en tubos de ensaye. MEDIOS DE CULTIVOSe desarrollaron cinco experimentos, con medio F y los foiaresl bayfolan, nifokan y fertifolen muy utilizados en la horticultura, y el fertilizante agrícola triple 17 que es de uso común en la agricultura; se realizaron tres repeticiones en cada uno. El tipo de cultivo usado fue el sistema estático; esto se llevó a cabo en garrafones de 20 l de capacidad con un volumen funcional de 15 l, con fuente de iluminación de tres lámparas fluorescentes de luz blanca fria de 75 Watts; para la aireación de los cultivos se empleó un compresor con un filtro de aire en la entrada del mismo. Para el mantenimiento de las cepas se utilizó medio F como control; el manejo de la misma se hizo de acuerdo con los procedimientos descritos por Voltolina et al. (1989, 1991). Los medios de cultivo formados por los foliares y el fertilizante agrícola, usados como fuentes de nitrógeno y fósforo, se prepararon según lo descrito por López-Elías (1990), que consiste en obtener una solución, a partir de la composición química de las fuentes de nutrientes, con una concentración equivalente de nitrógeno de 1 M·1-¹ en agua destilada. A estos medios alternativos se les agregaron EDTA-Fe y vitaminas del medio F a razón de 1 ml*1-¹ posteriormente se les añadieron 2 ml·1-¹ de agua dulce filtrada y esterilizada. El agua utilizada para los cultivos se pasó a través de filtros de cordoncillo (tipo cuno) de 5 y 1µm de porosidad y colocados en serie; esterilizada químicamente con hipoclorito de sodio al 5% a razón de 0.5 ml·1-¹ se deja reposar 24 horas; para eliminar el cloro residual se empleó un gramo de tiosulfato de sodio por cada 14.5 l; inmediatamente después el agua se aireó durante 24 horas (Hemerick, 1973; Breese y Malouf, 1974; Pruder y Bolton, 1978). Esterilizada el agua, se procedió a agregar los nutrientes correspondientes y a inocular los garrafones con 0.5 l de inoculo previamente homogeneizado, en un matraz de cuatro litros. La duración de cada bioensayo fue de 15 días y en este perlodo se registraron diariamente la temperatura y el pH de cada uno de los cultivos; éste último fue medido con un potenciometro Beckman modelo 76 y un electrodo Corning. PARAMETROS POBLACIONALESCada 24 horas se obtuvieron muestras de 40 ml de la microalga, que fueron fijadas con una solución de lugol. El conteo de microalgas se hizo con un hematocitómetro marca Fuchs-Rosenthal de 0.2 mm de profundidad y los datos obtenidos se expresaron en células por militro. La tasa constante de crecimiento se estimó utilizando el modelo matemático que describe la fase de crecimiento exponencial: Nt = No e Ke t. La tasa de crecimiento Ke se estimó en intervalos de tiempo unitarios usando logaritmos naturales, aunque en algunas ocasiones se emplean logaritmos de base dos (k) o diez (K10) (Guillard, 1973). Particularmente, cuando se usan logaritmos de base dos, el valor de k estima el número de divisiones por día (div·día-¹). El tiempo de duplicación de la biomása T. D. (dias*div-1) se determinó con la siguiente expresión: T.D.=In(2) ÷Ke La producción diaria P. D. (cels·ml-1) se determinó a partir de la diferencia entre dos concentraciones sucesivas: P.D.= (cels · ml-¹) i+1 -(cels · ml-¹) i Finalmente la variación porcentual V. P. se calculó con la ecuación: V.P.= (cels · ml-¹) i+1 -(cels · ml ¹) i ÷ (cels · ml ¹) i ANÁLISIS ESTADISTICOLos datos se sometieron a las pruebas estadísticas de normalidad de Lilliefors, (Conover, 1980) y homocedasticidad de Bartlett (Zar, 1974), con la finalidad de decidir el uso de métodos estadísticos paramétricos o no paramétricos. La fase de crecimiento exponencial se determinó de acuerdo con lo propuesto por Guillard (1973), de tal forma que se graficaron en un plano semilogaritmico las concentraciones promedio de cada uno de los tratamientos; posteriormente se seleccionaron los puntos de la gráfica cuya tendencia es aproximadamente lineal. Detectada la fase de crecimiento exponencial, se compararon las estimaciones de las tasas de crecimiento poblacionales de la especie y entre tratamientos, mediante la técnica de análisis de covarianza (ANCOVA) (Zar, 1974). Los datos de las concentraciones fueron transformados previamente con el uso de resarcimos naturales [ln(cels·ml-¹]; enseguida fueron ajustados a una recta por el método de mínimos cuadrados, en donde b es la tasa de crecimiento y es equivalente a Ke; en la aplicación de esta prueba, se utilizaron las concentraciones celulares de cada una de las repeticiones correspondientes a cada tratamiento. Se aplicó un análisis de varianza de una vía (ANALIZA) (Sokal y Rohlf, 1979) a las concentraciones obtenidas al final de la fase de crecimiento exponencial. Este mismo análisis se hizo con las concentraciones máximás alcanzadas en los cultivos durante los 15 días de experimentación. Para determinar entre cuáles tratamientos hubo diferencias significativas, se aplicó la prueba de comparaciones múltiples de Student-Newnian-Keuls (SABE). Si el tamaño de los grupos involucrados en el análisis era diferente se aplicaba la prueba SNK modificada por Kramer (1956), Steel y Torrie (1960). RESULTADOS Y DISCUSIÓNDe acuerdo con Legenrová (1969), se encontró que la microalga aislada pertenece al género Monoraphidium sp. y es considerada como una clorofita de agua dulce. Antiguamente colocada dentro del género Ankistrodesmus (Corda, 1838; Legenrová, 1965), posteriormente Kützing (1845) la presenta como Raphidium y más recientemente se han separado las formas coloniales y solitarias (Chodat, 1931). Sin embargo, gracias a su fácil manejo en cultivos, estas algas han sido estudiadas detalladamente, presentando una gran variabilidad en su forma y dimensiones, con la consecuencia de que varias especies Regaron a formar variedades (Fresenius, 1856) y posteriormente cayeron en sinonimia en Rabenhorts (1868). Actualmente, las especies solitarias y sin mucílago fueron separadas del género Ankistrodesmus y corresponden a Monoraphidium sp. (Legnerová, 1969). Debido a esta gran variabilidad y a la escasez de información que existe sobre cultivos de Monoraphidium sp., se dificulta hacer un análisis comparativo del presente estudio con trabajos anteriores. La cepa aislada se encuentra depositada en el Laboratorio de Cultivo de Algas de la Escuela de Ciencias del Mar de la Universidad Autonóma de Sinaloa, registrada con la Clave: MN-X  TABLA 1 Valores mínimos y máximos del pH registrados en los diferentes medios de cultivo de Monoraphidium sp. 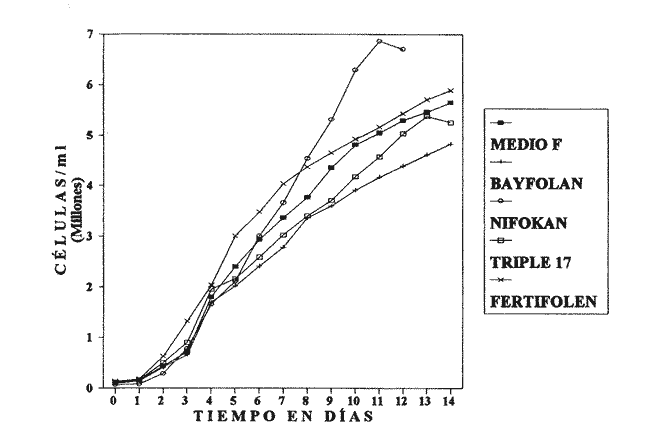 Figura 1. Durante el desarrollo de los experimentos, la temperatura del cuarto de microalgas osciló entre los 17 y 22ºC y la registrada para los medios de cultivo permaneció entre un rango de 19 y 22ºC. En la tabla 1 se presentan los valores de pH obtenidos durante los bioensayos. Los diferentes medios de cultivo mostraron un amplio intervalo de variación, en donde se obtuvo, con el medio E, el intervalo más amplio, mientras que el más estrecho fue el obtenido con el fertilizante agrícola triple 17. En este trabajo, los valores de PH fueron altos, debido al aumento de la producción de bramáse, de tal forma que el consumo de CO2 se incrementa y la disminución de éste trae como consecuencia un aumento del pH, alterando el sistema CO2>HCO3>CO3 (Darley, 1987). Consecuentemente, algunos cultivadores de microalgas agregan como suplemento hasta un 5% de CO2, pero a concentraciones altas esto puede tener efectos inhibitorios (Fogg y ThanTun, 1960), ya que el pH actúa como un regulador de la bramáse (Goldman et al., 1982a). Con respecto al género Monoraphidium sp., no es posible afirmar si el pH fue un factor Bastante debido a que se desconoce el rango óptimo para el cultivo de esta microalga; sin embargo, por el comportamiento típico de crecimiento que presentó, es seguro que el pH conjuntamente con el agotamiento de los nutrientes afectaron el crecimiento a partir del inicio de la fase estacionaria, ya que de acuerdo con Goldman et al. (1982b) las microalgas de agua dulce crecen 7.9 a 10.6; aquí se obtuvieron valores máximos de pH 11 (Tabla 1). 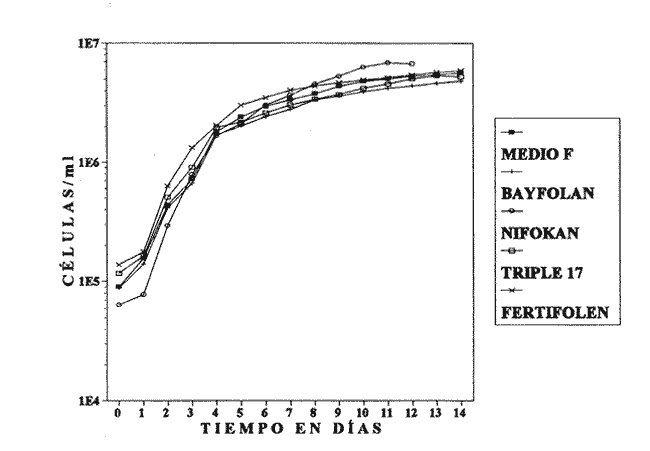 Figura 2. TASAS DE CRECIMIENTO POBLACIONALEn el sistema de cultivo estático el crecimiento exponencial está limitado por varios factores (Fase, 1975), como son: el agotamiento de los nutrientes, la deficiencia de CO2 (Fogg y Than-Tun, 1960), alteración del pH (Hutchens, 1948) y la reducci6n de la penetración de la luz (Myers, 1953), además de que modifican la composición bioquímica de las microalgas (Goldman, 1979a, b). En la figura 1, en el crecimiento poblacional promedio de Monoraphidium sp., en los cultivos realizados con el medio F y los folletos bayfolan y fertifolen, la bramáse tuvo una tendencia a seguir incrementándose, mientras que cuando se experimentó con nifolcan y el fertilizante agrícola triple 17, se obtuvo una biomása máxima en el decimoprúner y decimotercer días, respectivamente. En estas curvas promedio se observa que con nifokan se logró la mayor biomása y la más baja con bayfolan, mientras que el fertifolen, medio F y triple 17 se encuentran ubicados entre los dos medios antes mencionados. Al llevar los valores promedios a una gráfica semilogarítmica (Fig. 2) se observa que no hubo fase de retraso para el medio F; en cambio para bayfolan, nifokan, triple 17 y fertifolen fue de un día. Por otra parte se observa que la fase de crecimiento exponencial concluyó en el cuarto día de cultivo (Tabla 2). 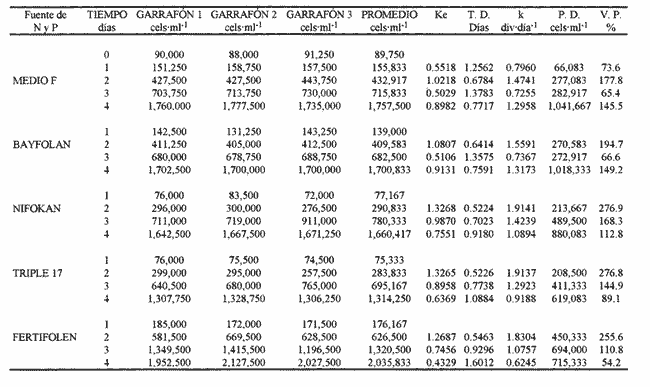 TABLA 2 Estimación promedio de los parámetros poblacionales básicos de Monoraphidium sp. en un sistema de cultivo estático con diferentes fuentes de nitrógeno y fósforo, durante la fase de crecimiento exponencial. 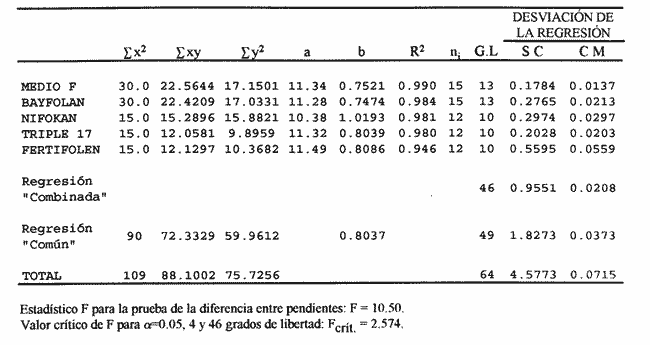 TABLA 3 Análisis de covarianza aplicado a las regresiones lineales de Monoraphidium sp. para probar las diferencias entre tasas de crecimiento en la fase exponencial. 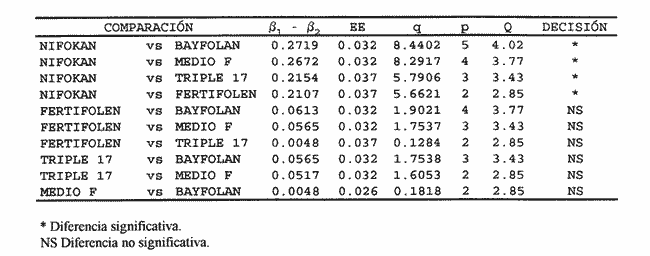 TABLA 4 Prueba de comparaciones múltiples de Student-Newman-Keuls (SNK) para grupos desiguales con un nivel de significancia del 5% aplicada a las tasas de crecimiento poblacional de Monoraphidium sp. cultivada en diferentes medios de cultivo usados como fuentes de nitrógeno y fósforo. 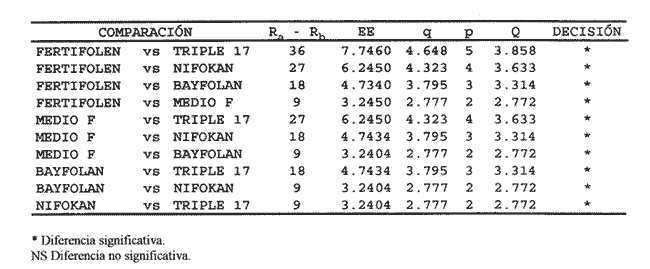 TABLA 5 Prueba estadística no paramétrica de comparaciones múltiples de Student-Newman-Keuls (SNK) con un nivel de signifilcancia del 5% aplicada a las concentraciones de Monoraphidium sp. obtenidas al final de la fase exponencial con diferentes medios de cultivo utilizados como fuentes de nitrógeno v fósforo. Los logaritmos naturales de las concentraciones promedios (Y) y el tiempo del cultivo (X) fueron ajustados por el método estadístico de mínimos cuadrados, para determinar los valores promedios de las tasas de crecimiento (b) de cada uno de los tratamientos. Para determinar entre qué pares de tratamientos hubo diferencias entre las tasas, se efectuó un ANCOVA aplicado a las regresiones (Tabla 3); el estadístico F fue altamente significativo (F = 10.50; Fo.05j4,461 = 2.574). Con base en lo anterior se aplicó la prueba SNK de comparaciones múltiples; ésta indicó que únicamente hubo diferencias significativas entre Uniforman con respecto a los otros medios (Tabla 4). Lo anterior implica una correspondencia directa con relación a las densidades, ya que fue en este medio de cultivo donde se obtuvo la mínima biomása de células, a partir de la fase exponencial hasta la estacionaria; mientras que la máxima tasa de crecimiento promedio correspondió al foliar nifolcan (Tabla 3: b = 1.0193 este valor cataloga a este medio como adecuado en relación con los demás medios experimentados, a pesar de las deficiencias de calcio, el cual es considerado como elemento importante en el crecimiento poblacional de especies de agua dulce (Nichols y Bold, 1965). La hipótesis anterior se refuerza con los resultados de las densidades obtenidas al final del periodo experimental del cultivo de Monoraphidium sp., en donde la máxima densidad alcanzada fue con nifokan, seguido de ferti- debido a la constitución química de los folíares, ya que ambos contienen calcio, y en el caso de nifokan que contiene vitaminas y, por supuesto, una mayor cantidad de nitrógeno y fósforo disponibles. 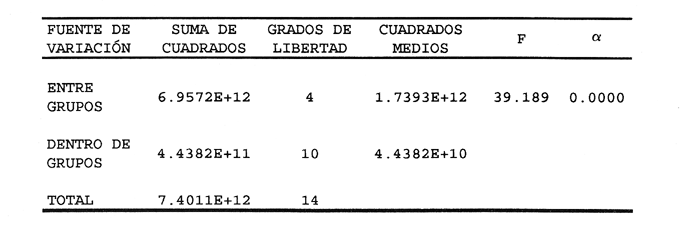 TABLA 6 Análisis de varianza de una vía aplicado a los valores máximos de las concentraciones de Monoraphidium sp. obtenidos en un período de experimentación de 15 días. 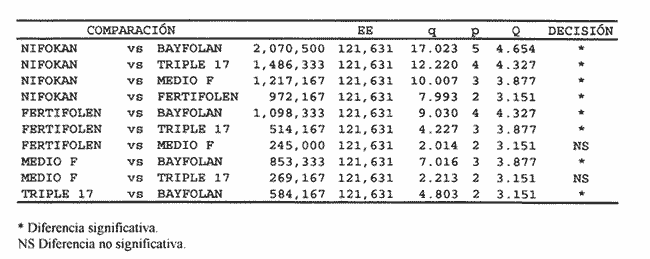 TABLA 7 Prueba estadística de comparaciones múltiples de Student-Newman-Keuls (SNK) con un nivel de significancia del 5% aplicada a los promedios de las concentraciones de Monoraphidium sp. durante 15 días de experimentación con diferentes medios de cultivo utilizados como fuentes de nitrógeno y fósforo. Antes de aplicar el ANAVA a los datos de las concentraciones obtenidas al final de la fase exponencial, se les aplicó la prueba de normalidad de Lilliefors y homocedasticidad de Bartlett; estas pruebas indicaron que los datos son normales (Dmax. = 0. 1644; T0.05[15] = 0.220) y no homocedásticos (Bc = 17.8974; α< 0.01); por lo tanto, se procedió a aplicar la prueba por rangos de KruskalWallis, en donde el estadístico Hc indicó diferencias altamente significativas entre las concentraciones de la bramáse, registradas en cada uno de los tratamientos (He = 13.5242;α = 0.009). Concomitantemente se procedió a aplicar la prueba no paramétrica de comparaciones múltiples SNK, en donde resultó que hubo diferencias entre todos los medios de cultivo, aunque en algunos casos la diferencia no es tan notoria (Tabla 5). La importancia de analizar el cultivo entre la fase de retraso y el final de la fase de crecimiento exponencial está relacionada con la calidad de la microalga. (López-Elías, 1990); es en esta fase donde el cultivo se aprovecha o se transfiere a volúmenes de cientos o miles de litros. Aunque en esta etapa del cultivo hubo diferencias significativas entre la biomása alcanzada en los diferentes medios, es necesario mencionar que las densidades correspondientes a los medios alternativos se pueden considerar como inóculos para desdoblar el cultivo. Se compararon los valores máximos de las concentraciones de Monoraphidium sp. al final del experimento, los cuales fueron normales (Dmax. = 0. 1585; T0.05 [15] = 0.220) y homocedásticos (Be = 9.1765;oc = 0.0568). Estos resultados difieren de los obtenidos al final de la fase exponencial, ya que la máxima biomása se alcanzó con el foliar nifokan y la mínima con el foliar bayfolan. En la Tabla 6 se observa que el valor del estadístico F demuestra que hay diferencias altamente significativas (F 39.189;α<0.01) entre los promedios de las concentraciones; la prueba de comparación múltiple (SNK) demostró que no existen diferencias significativas entre los siguientes medios fertifolen vs medio F y medio F vs triple 17 (Tabla 7). Aunque el objetivo en acuicultura no es el de mantener los cultivos por un período de 8 a 15 días, es importante observar que la capacidad de carga de cada uno de los medios alternativos formulados es competitiva con respecto al medio F. Finalmente, Nieves-Soto y Vega-Pérez (1994) afirman que los costos para producir 1000 1 de medio F tomando en cuenta nutrientes mayores, metales traza, amortiguador y vitaminas es de 14.84 dólares, mientras que para cultivar dia- es de 19.94 dólares; en cambio los costos de producción con bayfolan, nifokan y triple 17 sin silicatos ni vitaminas equivalen a 0.23, 0.14 y 0.05 dólares respectivamente. Por otra parte, cuando se agregan silicatos y vitaminas a los tres medios alternativos anteriores, los costos ascendieron a 5.62, 5.52 y 5.44 dólares, lo que implica un ahorro excelente en los gastos derivados de los reactivos, inclusive si la biomása producida por el medio F fuera el doble con respecto a los medios de cultivo alternativos a escala másiva, el uso de éstos es una opción adecuada, ya que esto repercute directamente en los costos de producción de los organismos a cultivarse. ConclusionesEl pH y el agotamiento de los nutrientes afecta el crecimiento de Monoraphidium sp. cuando se cultivó con el foliar NIF0KAN y el fertilizante agrícola TRIPLE 17. El foliar NIFOKAN produjo una mayor biomása comparada con el resto de los medios de cultivo. -El foliar NIFOKAN es un medio alternativo adecuado para el cultivo de este género, debido a que con éste se obtienen mejores tasas de crecimiento, lo que implica un mayor número de divisiones por día. -El fertilizante agrícola TRIPLE 17 y los foliares BAYFOLAN y FERTIFOLEN son adecuados para el cultivo de Monoraphidium sp., ya que comparados con el MEDIO F son altamente competitivos. AgradecimientosEste trabajo es parte del programa de investigación titulado: "Producción del fitoplancton abajo costo y evaluación de sus efectos nutritivos en condiciones de laboratorio", Escuela de Ciencias del Mar (UAS). Parte del financiamiento proviene del proyecto: Efectos de la calidad del agua y composición biológica sobre la producción en granjas camaronícolas", apoyado por el CONACyT (ref. 0625-N9110). Se agradece también al laboratorio de plancton y el cepario de la Estación Mazatlán, perteneciente al Instituto de Ciencias del Mar y Limnología (UNAM), todas las facilidades brindadas. LITERATURABresse W. P. y R. E. Malouf Hatchery manual for the pacific Oysten Sea Graat College Program, Oregon State University 1974 21 p Chodat, R. Mater Fl. crypiog. Suisse Monographies d´ Algues en culture pure 1931 1-226p 4 Conover, W. J. Practicar Nonparanwtrie Startistics John Wiley Son 2th edition. New Jersey 1980 495 p Corda, J. Alm. Carlsbad Nouvelles Observations Mieroscopiques 1838 197-198 8 Darley, W. M. Biología de las algas enfoque fisiológico Ed. LIMUSA Madrid 1987 27 p Eddy, B. P. J. Exp. Bot With species reference to Dunaliella bioculata The suitability of some algae for máss cultivation for food 1956 21-7 7 Fábregas, J., C. Herrero, B. Cabezas y J. Abalde Acuaculture Mass cultura and Biochemical variability of the marine mieroalga 7ktraselmis suecica Kylin (Butch) with high nutrieras concentration. 1985 231-244 49 Fresenius,G. Abhandl. Senckenberg. natural Ges Ueber die Algengattun gen Pandorina, Gonium und Raphidium. 1856 187-200 2 Fogg, G. E. Algal cultures andphytoplankton ecology The University of Wisconsin Press Wisconsin 1 1975 175 p Fogg, G.E. y Than-Thun, Proc. R. Soc., B Interrelations of pliotosynthesis and assimilation ofelementarynitrogen inblue-green algae 1960 111-127 153 Goldman, J. C. Water Res. Outdoor algal máss culture. I Applications 1979a 1-19 13 — J.C., Water Res. Outdoor algal máss culture II Photosynthetic yield limitations 1979b 119-136 13 Goldman, J. C., Y Azotea, C.B. Riley y M.R. Dennett Exp. Mar. Biol. Ecol The effect of pH in intensive mieroalgal cultures. I biomass regulation. J 1982a 1-13 57 Goldman, J.C., C Riley y MIL. Dennett J. Exp.Mar.Biol.Ecol.,:. The effect of pH in intensive mieroalgal cultures. II Species competition. 1982b 14-24 57 Guillard, R. R. L. y J. H. Ryther Con. J. Microbiol. Studies of marine planktonic diatoms. I Cyclotella nana Hustedt and Detonula confervacea (Cleve) Gran. 1962 229-39 8 Guillard, R. R. L Handbook of phycological methods. J. R. Stein Cambridge University press, London. Division rates. 1973 p.289-311 Hemerick, G., Handbook of Phycological Methods. Mass culture. Stein, J. R. Cambridge University press, London. 1973 p.255-273. Hutchens, J. O. J. cell comp. Physiol. Growth of Chilomonas paramecium in máss cultures. 1948 105-116 32 Kramer, C. Y Biometrics Extension of multiple range tests to group means with unequal numbers of replications. 1956 307-310 12 Kützing, F. Phycologia germanica d.i. Deutsclilands Algen in büdingen Besclireibungen. Nordhausen, 1845 240 p Legnerová, K. J. Preslia The genera Ankistrodesmus (Corda 1838) yRajohidium (Kützing 1845) and their position in the family Ankistrodesmaceae 1965 1-8 37 —, K. J. Studies in Phycology, The systematies and ontogenesis of the genera Ankistrodesmus Corda and Monoraphidium gen. nov. Bohuslav fott Caroline University of Prague, Czechoslovak. 1969. p.75-144 López-Elías, J. A. Tesis de maestría en ciencias Cultivos semicontinuos de cuatro especies de mieroalgas con medios simplificados: Evaluación de técnicas analíticas y de producción. CICESE México 1990 105 p. Myers, J., Physiology and Biochemistry of algae Laboratory culture. Lewin, R. A. New York and London. 1962 p. 603-615. Nascimento, V. M. da Bol. Tec. Cepta. Growth curves of Moina micrura and Ceriodaphnia, silvestris reared in laboratory. 1989 53-59 2 Nichols, H. W. y Bold, H. C. J. Phycol. Trichosarcina polymorpha gen. et sp. nov. 1965 34-8 1 Nieves-Soto, M. y C. Vega-Pérez. Rev. Ciencias del Mar Univ. Autón. de Sin., México Tasas de crecimiento, biomása y costos de producción de Tetraselmis suecica (Chlorophyceae y Chactoceros sp. (Bacillarophyceae) cultivado con el medio F y tres medios alternativos 1994 39-53 13 Ortega, M. M. Catálogo de algas continentales recientes de México Univ. Nal. Autón. de Mex. DirecciónGeneral de Publicaciones 1984 566 p Pruder, G. D. y E. T. Bolton Proc. Ann. Meeting World Maric. Soc System configuration and performance: Bivalve molluscan mariculture. 1978 747-759 9 Rabenhorst L. Kryjotogamenflora von Sachsen, der Obrer. Thuringen, etc. Leipzig 1868 400 p Ramos, A. y M. Salazar La acuicultura en México: De los conceptos a la producción. Uso potencial de los cultivos másivos de microalgas. Instituto de Biología. Univ. Nal. Autón. de México. 1990 p.274-288. San Felíu, J. M. La acuacultura marina en la comunidad valenciana. Publicaciones del excelentísimo ayuntamiento de Castellón de la Plana. Valencia España 1986 406 p Stanley, J. G. y J. B. Jones Acuaculture Feeding algae to fish 1976 219-223 7 Steel, R. G. D. y J. H. Torrie Principies and procedures of statisties. McGraw-Hill Book Company, New York. 1960 481 p Sokal, R. R. y F. J. Rohlf Biometría. Principios y métodos estadísticos en la investigación biológica. H. Blume Ediciones, Madrid 1979 832 p Tamiya, H. Annu. Plant. Physiol Mass culture of algae. 1957 309-33 8 —, Proceedings, Symposium on Algology. Role of algae as food. Kachroo, P. p.379-89 Indian Council Agric. Res. and UNESCO. South Asia Sci. Coop. Office Nueva Delhi. 1960 Tellez-Ríos C. y G.O. Motte Memorias del Segundo Simposio Latinoamericano de Acuicultura Estudio planctonológico preliminar del Lago de Pátzcuaro Mich. Méx. 1980 p.1799-1836. tomo III. mayo de 1976. Voltolina, L. D., L. F. Bückle-Ramirez y G. E. R. Morales Manual de metodología y alternativas para el cultivo de microalgas. Informe especial Centro de Investigación Científica y de Educación Superior de Ensenada 2da. edición. Baja California, México. 1989 70 p Oct.-89-01. Voltolina, L. D., V. M. L. Trujillo y L. M. I. González Colección de cepasde microalgas del Departamento de Acuicultura del C,I.C.E.S.E Comunicaciones Académicas, CTATCT9101. Centro de Investigación Científica y de Educación Superior de Ensenada Baja California, México. 1991 51 p. Webb, K. L. y F. L. Chu Proceedings of the Second International Conference on Aquaculture Nutrition: Biochemical and Physiological Approroaches to Shellfish nutrition. 2. Phytoplankton as a food sourse of Bivalve larvac. G. Pruder, C. J. Langdon and D. E. Conklin Lousiana State University, Baton Rongen, L. A. 1982 pp 272-291 Zahid, P.B.; T. Sultana y W. Hussain Pak. J. Sci.Ind. Res A simplified technique for máss culture of unicellular algae 1981 145-147 24 (4) Zar J. H. Biostatistical Analysis. Prentice Hall New Jersey 1974 636 p
|

