|
ESTRUCTURA DE LAS COMUNIDADES DE PECES EN LAGUNAS COSTERAS
DE LA ISLA DE MARGARITA, VENEZUELA
Trabajo recibido el 25 de abril de
1993 y aceptado para su publicación el 30 de octubre de
1993.
Pablo Ramírez-Villarroel
Universidad de Oriente, Núcleo de Nueva
Esparta, Apartado 147 Porlamar, Isla de Margarita, Venezuela.
El estudio en un ciclo anual reveló que el
sistema lagunar costero de Los Portillos, Boca de Palo, Laguna de Raya, Punta
de Piedras y Punta de Mangle (Isla de Margaritas) tiene una alta diversidad de
especies. En este ecosistema fueron capturados 115, 376 peces, que representan
88 especies, 65 géneros y 37 familias, en 240 colectas con un chinchorro
playero durante 1990. El índice H'n fluctuó de 1.0 a 3.5
bits/ind; la H'w varió entre 0.91 y 3.96 bits/ind. Entre todas las
lagunas destaca la de Punta de Piedras, donde se obtuvo el mayor número
de peces, con 49,826 especímenes y 225.627 kg; mientras que en la Laguna
de Raya se presentaron los promedios más altos de diversidad
numérica (2.79 bits/ind), diversidad en peso (3.39 bits/ind), riqueza de
especies (3.94) y equitatividad (0.59). Se ofrecen algunos resultados que
permiten afirmar la existencia de una relación inversa entre la
diversidad y las condiciones de fuerte dominancia por parte de algunas
especies. Dominaron en la comunidad las visitantes ocasionales, seguidas por
las visitantes cíclicas y las residentes permanentes. El bajo porcentaje
de especies residentes permanentes refleja la inestabilidad del área.
Asimismo, las consumidoras de primer orden (46.59%) son más abundantes
que las de segundo (34.09%) y las de tercer orden (19.32%). Existe una elevada
afinidad ambiental para todo el sistema lagunar, con la mayor similitud
observada en la boca y el interior de Laguna de Raya.
PALABRAS-CLAVE: Peces, laguna,
comunidad, diversidad, Isla de Margarita.
A one year study revealed that the coastal lagoon
systems of Los Portillos, Boca de Palo, Laguna de Raya, Punta de Piedras and
Punta de Mangle (Margarita Island) have a big diversity of species. In this
ecosystem, 115,376 fishes representing 88 species, 65 genera and 37 families
were captured in 240 collections with a beach seine during 1990. The H'n index
fluctuated from 1.0 to 3.5 bits/ind; the H'w var¡es between 0.91 and 3.96
bits/ind. Of the total lagoons studied Punta de Piedras lagoon stands out with
the highest number of fishes with 49,826 specimens and 225.63 kg, while Laguna
de Raya presents the highest average of H'n (2.79 bits/ind), H'w
(3.39bits/ind), D' (3.94) and F (0.59). The recorded data lead to suppose the
existence of an inverse relationship between diversity and the conditions of
strong dominance by some species. Occasional visitor species were dominant in
the community, fallowed by cyclical and permanent residents. The low percentage
of permanent residents presents during the entire year shows the inestability
of the ecological system. Also, the primary order consumers (46.59%) are more
abundant than second order consumers (34.09%) and third order consumers
(19.32%). There is a high environmental affinity in the entire coastal lagoon
system, with the highest similarity observed in the mouth and the inner part of
Laguna de Raya.
KEY WORDS: Fishes, lagoon,
communíty, diversity, Isla de Margarita.
Desde hace tres décadas se ha observado un interés creciente, de la comunidad científica, por los ecosistemás costeros importantes. Ellos conforman un amplio complejo ecológico integrado, donde sobresalen las lagunas litorales. Una gran variedad de actividades son llevadas a cabo por el hombre en las lagunas costeras: desde economías de subsistencia y refugios, pesca y acuicultura, producción de energía y depósito y extracción de minerales, hasta las actividades portuarias, urbanas y turísticas. 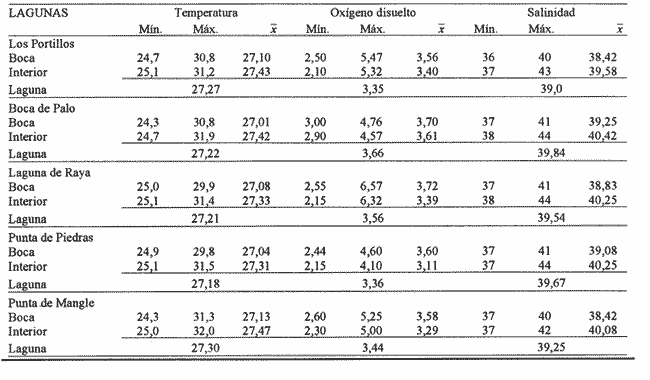 Tabla 1 Mínima, media y máxima temperaturas (oC), oxígeno disuelto (ml/l) y salinidad en las lagunas de Los Portillos, Boca de Palo, Laguna de Raya, Punta de Piedras y Punta de Mangle, Isla de Margarita, durante 1990 Las lagunas costeras están en capacidad de albergar muchos peces que pueden resultar de gran beneficio para la economía pesquera, además de servir como lugar de desove y cría para las especies migratorias. El estudio de las comunidades de peces permite conocer su verdadero rol ecológico en esos ecosistemás. Yáñez-Arancibia y Nugent (1977) afirman que los peces tienen roles ecológicos críticos en las lagunas costeras. Ellos transforman la energía a través del consumo directo de productos primarios, detritus y otras materias, o a través de la depredación de detritívoros, y hacen disponible esta energía a niveles tróficos más altos. Numerosos trabajos sobre ictiofauna de lagunas y estuarios se han realizado en diferentes regiones del mundo, especialmente en las costas del Atlántico occidental, Golfo de México, Pacífico e islas del Mar Caribe. Con respecto a las lagunas costeras venezolanas, áreas de rica producción pesquera de importancia local por las facilidades naturales que ofrecen para su mejor y total aprovechamiento, sólo han sido investigadas parcialmente desde el punto de vista físico-químico del agua y de los sedimentos, así como también biológico, en lo referente a la taxonomía de plantas y fauna. El conocimiento íctico ha sido conccntrado en la sistemática y biología de algunas especies y es poca la información de la estructura ecológica de las comunidades de peces. En relación con las lagunas costeras de la Isla de Margarita, en las últimás décadas distintos autores han realizado investigaciones: la mayoría orientada hacia la descripción de sus condiciones físicas y químicas, y hacia algunos aspectos de índoles biológica y ecológica, los cuales permiten conocer sus caractcrísticas generales. De manera particular, cabe destacar la obra "Las lagunas litorales de la Isla de Margarita, sus recursos y su conservación", publicada por Cervigón y Gómez (1986), quienes las definen como formaciones geomorfológicas de tipo albufera, es decir, separadas del mar por una barra de arena más o menos extensa, excepto por una boca o canal de comunicación relativamente estrecho por donde circula el agua debido al flujo y reflujo de las corrientes de marea. 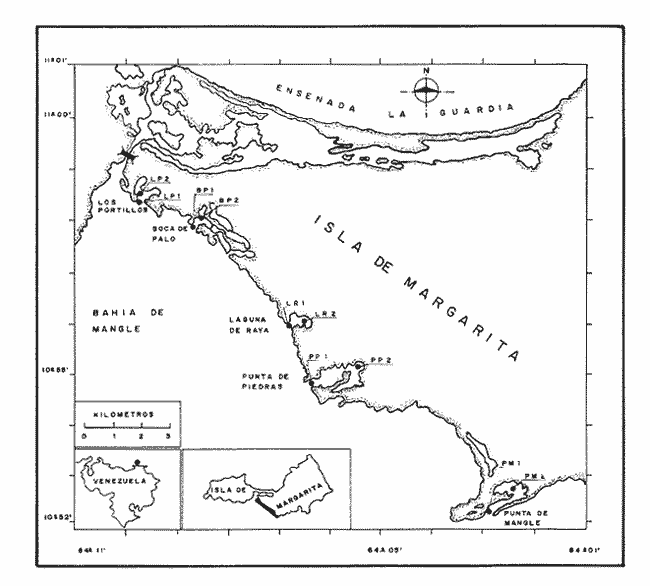 Figura 1. Ubicación de las lagunas de Los Portillos, Boca de Palo, Laguna de Raya, Punta de Piedras y Punta de Mangle, Isla de Margarita. Los trabajos que se han publicado sobre la estructura de las comunidades ictiofaunísticas de las lagunas costeras venezolanas son escasos. Se conocen los de Gómez (1981) y Jory (1988) para la Laguna de la Restinga. En este sentido, la presente investigación tiene como finalidad, en primer lugar, caracterizar la estructura de las comunidades de peces en un ciclo anual, en términos de composición de especies, abundancia, distribución, diversidad, riqueza, equitatividad, redundancia, dominancia, componentes comunitarios y categorías ictiotróficas de las lagunas de Los Portillos, Boca de Palo, Laguna de Raya, Punta de Piedras y Punta de Mangle; en segundo lugar, determinar la afinidad ecológica de las estaciones de muestreo y la afinidad entre especies para analizar la heterogeneidad del sistema ecológico.  Figura 2. Abundancia relativa de las 15 especies de peces más frecuentemente capturadas en las lagunas de Los Portillos, Boca de Palo, Laguna de Raya, Punta de Piedras y Punta de Mangle,Isla de Margarita, durante 1990. ÁREA DE ESTUDIOEl área de estudio lo constituye un complejo de cinco lagunas costeras: Los Portillos, Boca de Palo, Laguna de Raya, Punta de Piedras y Punta de Mangle, separadas por pequeños caseríos y ubicadas en el sector suroriental de la Isla de Margarita, a los 10° 52' y 10° 59' de latitud septentrional y entre 64° 2' y 64° 10' de longitud occidental (Fig. 1). Son lagunas de aguas someras y de nivel variable de acuerdo con las estaciones del año, con máximos durante los meses de octubre, noviembre, diciembre, enero, febrero y marzo; con temperaturas que oscilan entre 24.3 y 32.0°C; oxígeno disuelto entre 2.15 y 6.57 ml/l, y salinidades que fluctúan entre 36 y 44%. Los valores mínimos, máximos y medios para cada una de las lagunas se señalan en la tabla 1 (Ramírez, 1991). Su único suministro de agua dulce es a través de las precipitaciones. Los fondos son predominantemente fangosos y con características de topografía y superficies muy irregulares. Las cinco lagunas presentan un área total de 7.51 km². Un rasgo notable de la vegetación costera emergente en sus márgenes consiste en que éstas están casi cubiertas por manglares de las especies Rhizophora mangle y Avicennia germinans. En toda la zona prevalece un clima semidesértico. El promedio anual de precipitación es de 715 mm; la temperatura oscila entre 24 y 32°C, con una media de 27.8°C; la humedad relativa anual fluctúa entre 56 y 97%, con una media de 82%; la evaporación media es de 40 mm; la presión atmosférica varía entre 126 y 167 mmb, con una media de 148 mmb. La dirección prevaleciente del viento es de ENE, con una velocidad media de 22.5 km/h. El área en que se encuentran situadas las lagunas en estudio presenta un incipiente desarrollo. Sus asentamientos en los márgenes son pequeños y escasos, así como el desarrollo industrial. MATERIAL Y MÉTODOSDesde enero hasta diciembre de 1990 se efectuaron, mensualmente, muestreos para la captura de peces en dos estaciones previamente seleccionadas en cada una de las cinco lagunas; una demarcada en la boca de las lagunas y otra en su interior. Las capturas se efectuaban durante el día con un chinchorro playero de 31 m de longitud, 2.15 m de altura y 6 mm de abertura de malla; en cada estación se realizaban dos caladas con área de arrastre de aproximadamente 200 m². Con los ejemplares en el laboratorio, se procedía a su separación, identificación, conteo, pesaje y medición. Se identificaron utilizando las claves y descripciones de la literatura básica, principalmente los trabajos de Cervigón (1966), y Bohlke y Chaplin (1968). ABUNDANCIAPara el análisis de la abundancia relativa se consideró la relación entre el número de especímenes de una especie y el total de individuos de todas las especies. Este valor puede ser calculado para un muestreo en particular o para todos y se expresa en porcentaje: A = Ni ÷Nt x 100 donde: Ni = número de individuos de una especie i. Nt = total de individuos de todas las especies. Para calcular la abundancia relativa en biomása se emplea la misma fórmula anterior, sólo que ésta no utiliza individuos sino gramos. DIVERSIDADLa diversidad se consideró como el número de especies y la proporción de los individuos dentro de ellas para cada una de las colectas. Para su estimación se utilizó la expresión de Shannon-Weaver (1963). Aun cuando esta función considera diversidad y abundancia, también se usaron otros índices. Se calculó el índice de biomása según Wilhm (1968), quien realizó una modificación de la expresión de Shannon-Weaver (1963), en la que se evalúa la diversidad por medio de la biomása, reemplazando el número de individuos por su peso. Así, para el cálculo de la riqueza de especies como componente de la diversidad, se usó la expresión de Margalef (1968). Asimismo se consideró el índice de equitatividad propuesto por Lloyd y Ghelardi (1964). REDUNDANCIALa redundancia es una medida útil del grado relativo de dominancia en la muestra. Se obtuvo usando la fórmula (Main y McIntire, 1974; Margalef, 1980): R= D’M-D’÷ D'M-D'm donde: R = Redundancia (varía de 0 a 1 y no tiene unidad de medida). D' = Diversidad numérica calculada con el inventario. D'M = Diversidad máxima = Log² del número de especies colectadas. D'm = Diversidad mínima. Se supone que todas las especies, menos una, están representadas por un solo individuo y a la especie restante pertenecen todos los que quedan. ÍNDICE DE DOMINANCIASe refiere a abundancia numérica de las especies y su influencia en la naturaleza de la comunidad; se calculó usando la fórmula propuesta por McNaughton (1968). I. D.= 100 x Y1 + Y2 ÷ Y donde: Y1 = número de individuos de la especie más abundante en la estación de muestreo. Y2 = segunda especie con mayor número de individuos. Y = número total de individuos de todas las especies. ÍNDICE DEMOGRÁFICO, TRÓFICO Y BIOLÓGICO TOTALLos índices demográfico y trófico se determinaron siguiendo la técnica de Sanders (1960), teniendo en cuenta la abundancia relativa de las diez especies más comunes en cada muestreo realizado. Así, a la especie que ocupó el primer lugar se le asignó un valor de 10; la del segundo lugar, uno de 9; la del tercer lugar, 8, y así sucesivamente hasta 1; de tal manera que el índice biológico total de cada especie es la suma obtenida por ésta en relación con el número de individuos y la biomása en cada inventario mensual (Índice Demográfico + Índice Trófico). COMPONENTES COMUNITARIOSLas comunidades de peces están integradas por diversos componentes, los cuales fueron determinados de acuerdo con su origen y frecuencia de aparición en los muestreos; pueden ser agrupadas en tres componentes comunitarios, de acuerdo con la clasificación propuesta por Yáñez-Arancibia et al. (1980): 1. Especies visitantes ocasionales o accidentales. A este grupo corresponde una frecuencia entre 1 y 30%. 2. Especies visitantes cíclicas o estacionales. A este grupo corresponde una frecuencia de 31 a 70%. 3. Especies residentes permanentes. A este grupo corresponde una frecuencia de 71 a 100%. Los valores de las tres categorías se obtienen de acuerdo con la relación: F = NVA ÷ NTC x 100 donde: F = Porcentaje de frecuencia; NVA = Número de veces de aparición de una especie en una estación dada, y NTC = Número total de colectas en la estación correspondiente. CATEGORÍAS ICTIOTRÓFICASLa categorización ictiotrófica de las especies fue hecha sobre la base de las categorías descritas para peces de ambientes lagunares-estuarinos por Yáñez-Arancibia (1978). Tales categorías son: 1. Consumidores primarios: en ésta se incluyen peces plactófagos (fito y zoo), detritívoros y omnívoros que consumen detritus, vegetales y fauna de tamaño pequeño. 2. Consumidores secundarios: aquí se incluyen peces, predominantemente carnívoros, aun cuando pueden incluir en su dieta algunos vegetales y detritus, pero con poco significado cuantitativo. 3. Consumidores del tercer orden: incluye peces exclusivamente carnívoros, donde los vegetales y el detritus son alimentos accidentales. Los hábitos alimenticios de las diferentes especies colectadas se obtuvieron de la revisión bibliográfica. AFINIDAD ENTRE ESTACIONES DE MUESTREO Y ENTRE ESPECIESLas afinidades entre estaciones de muestreos y especies fueron obtenidas mediante el índice de Sorensen: Ccs = 2c ÷ S1+S2 donde: S1 = número de especies en estación "a". S2 = número de especies en estación "b". C = número de especies comunes en ambas estaciones. Los valores así calculados fueron llevados a una matriz y con base en ella se construyó un dendrograma de afinidad, según la técnica de Sokal y Sneath (1963). 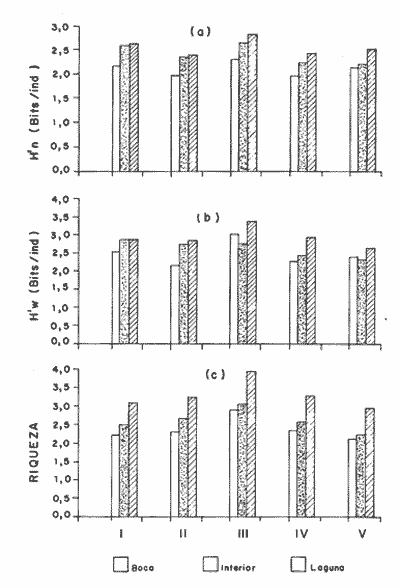 Figura 3. Distribución de la diversidad numérica (a), diversidad con base en el peso (b) y riquezas de especies (c) de las comunidades de peces de las lagunas de Los Portillos(I), Boca de Palo (II), Laguna de Raya (III), Punta de Piedras (IV) y Punta de Mangle (V), Isla de Margarita, durante 1990. 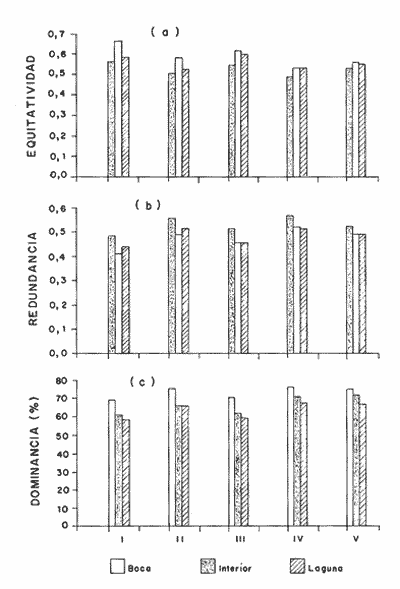 Figura 4. Distribución de la equitatividad (a), redundancia (b) y dominancia (c) de las comunidades de peces de las lagunas de Los Portillos (I), Boca de Palo (II), Laguna de Raya (III), Punta de Piedras (IV) y Punta de Mangle (V), Isla de Margarita, durante 1990. RESULTADOS Y DISCUSIÓN
DISTRIBUCIÓN Y ABUNDANCIA DE LA FAUNA ICTIOLÓGICALos conceptos de distribución y abundancia están estrechamente relacionados, aunque a simple vista pudieran ser considerados como diferentes (Andrewartha y Birch, 1954). Un punto importante en el estudio de las comunidades es conocer la distribución de las especies, las cuales varían de manera considerable dependiendo de factores ambientales, biológicos y ecológicos. Por otra parte, la abundancia fluctúa desde especies muy comunes hasta muy raras, y tanto unas como las otras pueden ser abundantes en peso, pero diferir sustancialmente en su abundancia en número de individuos. Del análisis de 115,376 ejemplares, obtenidos en 240 capturas efectuadas en dos estaciones demarcadas en cada una de las lagunas (Los Portillos, Boca de Palo, Laguna de Raya, Punta de Piedras y Punta de Mangle), fueron identificadas 88 especies, agrupadas en 37 familias y 65 géneros. Las familias representadas por un mayor número de especies fueron: Gobiidae, con 10; Engraundae, Carangidae, Gerreidae y Pomadasydae, con 6 c/u; Clupcidae, con 5; Syngnatidae, con 4; Ariidae, Atherinidae, Scienidae y Batrachoidae, con 3 c/u. 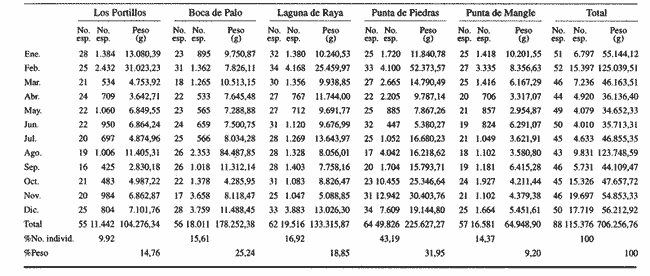 Tabla 2 Variación mensual del número de especies de peces, número de individuos y la biomasa total en las lagunas muestreadas de la Isla de Margarita, durante 1990. La variación mensual del número de especies, de individuos y biomása para las cinco lagunas estudiadas se indica en la tabla 2. Igualmente, en la figura 2 se presenta la abundancia relativa de las 15 especies más abundantes colectadas en todo el sistema lagunar. Las comunidades ictiológicas variaron tanto en número como en composición. Del total de especies que se registran para el presente estudio, 55 se encontraron en Los Portillos, 56 en Boca de Palo, 62 en Laguna de Raya, 64 en Punta de Piedras y 57 en Punta de Mangle. Estos números se consideran bastante moderados al comparárseles con otras lagunas costeras venezolanas previamente estudiadas: para la Laguna de Tacarigua se han citado 15 especies (Rohl, 1942; Hildebrand, 1943; Weibezahn, 1949; Schultz, 1949); 40 para la Laguna de Unare (Mago, 1965); 23 para las lagunas vecinas a Cumaná (Carvajal, 1965). Específicamente, para las lagunas de la Isla de Margarita se tiene que en La Restinga se han obtenido 92 especies (Cervigón, 1966; Padrón, 1976; Gómez, 1981; Jory, 1988), en Las Marites se han encontrado 75 especies (Salazar, 1978) y en la Laguna de Raya y la de Punta de Piedras se han citado 47 y 60 especies, respectivamente (Salaya, 1968). Cabe destacar que, de las diez estaciones demarcadas en el sistema lagunar muestreado, se observó que el menor número (42 especies) se reporta para el interior de la Laguna de Los Portillos y el mayor (54 especies) para la boca de la Laguna de Punta de Piedras. Igualmente, se evidencia que el menor número de especies colectadas mensualmente fue de diez, en septiembre, en el interior de Los Portillos; diez en enero en el interior de Boca de Palo, y diez en octubre en el interior de Punta de Mangle. También se encontró que el mayor número de especies obtenido fue 28, en diciembre, en la boca de la Laguna de Punta de Piedras. Gómez (1981) reporta que para dos localidades de La Restinga el número de especies colectadas mensualmente varió de 15 a 21. Se pudo constatar que 18 de las 88 especies colectadas se encontraron tanto en la boca como en el interior de las cinco lagunas: Eucinostomus gula, Eucinostomus argenteus, Diapterus rhombeus, Gerres cinereus, Diapterus plumier¡, Archosargus rhomboidalis, Lile piquitinga, Xenomelaniris brasiliensis, Batrachoides manglae, Anchoa hepsetus Sphoeroides testudinus, Oligoplites palometa,Strongylura marina, Centropomus undecimalis, Caranx hippos, Mugil curema, Achirus lineatus y Anchoa parva. DIVERSIDADLa diversidad es una característica importante en las comunidades y, por lo general, está relacionada con otras propiedades, así como con su estabilidad y las condiciones a que está expuesta (Pianka, 1966; Pielou, 1975; Krebs, 1975, Álvarez-Rubio et al., 1986). En general, a través del ciclo anual, se observó que la diversidad numérica (H'n) y la diversidad con base en el peso (H'w) fueron variables en cada una de las lagunas (Fig. 3a y b). El comportamiento de los índices (diversidad y biomása) presentó un patrón definido en relación con las propiedades intrínsecas; las cuales tienen variaciones de acuerdo con el número de especies, individuos y pesos. Estos parámetros ecológicos están influidos por diversos factores, como época climatica, lugar de muestreo y la selectividad de las redes de muestreo. En efecto, se encontró que las lagunas muestreadas soportan, por su propia configuración, un gradiente elevado de presiones ambientales, como: los amplios rangos de salinidades, gran evaporación, temperaturas variadas y poca profundidad. Estos factores dan como resultado unos ambientes donde la diversidad numérica (H'n) osciló entre 1.0 y 3.5 bits/ind, la cual es coincidente con los valores dados por Margalef (1980) para comunidades de peces, y la diversidad en peso (H'w) entre 0.91 y 3.96 bits/ind, los cuales son comparativamente mayores que los reportados en otras áreas con características similares. El promedio general de la diversidad numérica en las cinco lagunas fue de 2.52 bits/ind, siendo Laguna de Raya la que presentó el mayor promedio anual (H'n = 2.79), luego le siguen los Portillos (2.61), Punta de Mangle (2.46), Punta de Piedras (2.38) y Boca de Palo (2.36); mientras que el promedio de diversidad en biomása anual tiene el siguiente orden decreciente: Laguna de Raya (H'w = 3.39 bits/ind), los Portillos (2.90), Boca de Palo (2.87), Punta de Mangle (2.70) y Punta de Piedras (2.43). La diversidad numérica total por estaciones osciló entre 2.18 y 3.05 bits/ind, notándose igual que en el interior de las lagunas; los promedios anuales fueron más altos que en las bocas (2.62 vs. 2.51). En general, la diversidad muestra cambios a lo largo del año, pero éstos no siguen un patrón estacional bien marcado, pues sólo parece vislumbrarse una ligera tendencia oscilatoria entre los meses de muestreo. Se cree que el aumento o disminución de este índice no presentó asociación particular con alguna época del año y sus valores se mantuvieron dentro de un estrecho rango de fluctuaciones. Se afirma más bien que estas variaciones son debidas, principalmente, a la presencia de especies dominantes durante el muestreo, como lo señalan Yáñez-Arancibia y Lara-Domínguez (1983), y Yañez-Arancibia et al., (1988). Es decir, cuando sus valores son mínimos, se debe a la presencia de especies dominantes, ya sea por número (disminuye H'n) o por peso (disminuye H'w). Así se tiene que en la boca de la Laguna de Los Portillos se obtuvo en febrero una diversidad numérica de 0.75 bits/ind, siendo notoria la dominancia de Cetengraulis edentulus, con 2, 070 individuos de un total de 2, 279 colectados en ese muestreo; en marzo, en la boca de la Laguna de Boca de Palo, se observó una H'n mínima de 0.64 bits/ind, dominando Lile piquitinga con 838 individuos de 916 que se capturaron en ese muestreo; en Laguna de Raya, en diciembre, se obtuvo una H'n mínima de 1.37 bits/ind y una dominancia de Anchoa hepsetus, con 2, 5 10 individuos de 3, 137 colectados en ese mes; en la Laguna de Punta de Piedras, en agosto, se obtuvo una H'n mínima de 0.84 bits/ind y elmuestreo fue dominado por Lile piquitinga, con 672 individuos de un total de 760; en la Laguna de Punta de Mangle, en mayo, se registró una H'n mínima de 1.43 bits/ind, siendo dominado el muestreo por Lile piquitinga, con 360 individuos, y Xenomelaniris brasiliensis, con 207 individuos de 603 capturados. En el interior de las lagunas se presentó el mismo comportamiento de la diversidad: en Los Portillos, en septiembre, se dio una H'n mínima de 1.85 bits/ind, siendo dominado el muestreo por Xenomelaniris brasiliensis, con 123 individuos de 208 que se capturaron; en Boca de Palo, en septiembre, se encontró una mínima de 1.83 bits/ind, notándose la dominancia de Eucinostomus gula, con 177 ejemplares de un total de 252 del muestreo; en Punta de Piedras, en agosto, se obtuvo una H'n mínima de 0.86 bits/ind, predominando Xenomelaniris brasiliensis con 3, 830 especímenes de 3,282 que integraron el muestreo; en la Laguna de Punta de Mangle se observó una H'n mínima de 0.99 bits/ind, encontrándose que el muestreo fue donúnado por Anchoa parva, con 994 individuos de 1,186 que se colectaron. El caso inverso al ya mencionado, es decir, en el que son máximos los valores de H'n y H'w, se presenta cuando las especies están homogéneamente distribuidas por peso y/o número. RIQUEZA DE ESPECIESEl índice de riqueza de especies relaciona el número total de éstas con la captura total y le da el mismo valor a cada una. Al igual que la diversidad numérica y la diversidad con base en el peso, la riqueza de especie también varió en cada una de las zonas de muestreo (Fig. 3c). Al comparar las cinco lagunas, la que presentó el índice con mayor promedio anual fue Laguna de Raya (3.94), seguido por el de Punta de Piedras (3.28), Boca de Palo (3.24), Los Portillos (3.10) y Punta de Mangle (2.95); mientras que el índice anual por estación osciló entre 2.18, encontrado en el interior de la Laguna de Punta de Mangle, y 3.08, adentro de Laguna de Raya; además se notó que en el interior de las lagunas el promedio fue más alto que en las bocas (2.60 vs. 2.39), como sucedió con el índice de diversidad. La riqueza de especies no mostró una tendencia estacional definida, parecida a lo observado en el índice de diversidad, debido quizá al uso secuencia¡ de la laguna por diferentes especies. En general, los índices de riqueza de especies encontrados son altos si se les comparan con los reportados para otras áreas: Warburton (1978) publicó un intervalo de OA-0.9 para el sistema lagunar Huizache-Caimanero; Amezcua-Linares y Yáñez-Arancibia (1980) registraron un índice que varió de 1.48-4.01 en un sistema fluvio-lagunar asociado a la Laguna de Términos; Álvarez-Guillén et al. (1985) obtuvieron un intervalo de 2.24.40 para la boca del Carmen en la Laguna de Términos; Álvarez-Rubio et al. (1986), para el sistema lagunar Teacapán-Agua Brava. reportaron un índice de 0.32-3.08; Ruiz y Elquezabal (1990) anotaron un índice que varió entre 2.18 y 3.85 en el Saco del Golfo de Caríaco. EQUITATIVIDADLas cinco lagunas presentaron un promedio anual moderado y muy similar entre sí, con el siguiente orden decreciente: Laguna de Raya (0.59), Los Portillos (0.58), Punta de Mangle (0.54), Boca de Palo (0. 5 2) y Punta de Piedras (0. 5 2). La equitatividad anual por estación osciló entre 0.48 y 0.66; donde, al igual que la diversidad y la riqueza de especies, el promedio anual fue más alto en las estaciones del interior que en las de las bocas de las lagunas [0.58 vs. 0.52 (Fig. 4a)]. Durante el ciclo anual de muestreo el promedio más alto de equitatividad se registró en enero (0.62) y el más bajo en noviembre (0.48). El intervalo de equitatividad global de las lagunas encontrado (0. 17-0.85) guarda relación o semejanza con los reportados para otras áreas: Allen y Horn (1975) hallaron un rango de 0.01-0.57 para la Laguna de Colorado; Amezcua-Linares y Yáñez-Arancibia (1980) reportaron 0.22-0.88 en cuatro sistemás fluvio-lagunares de la Laguna de Términos; Gómez (198 1) publicó un intervalo de 0.42-0.76 para dos localidades de la Laguna de La Restinga; Yáñez-Arancibia y Lara-Domínguez (1983) reportaron un intervalo de 0.50-0.73 para la boca de Estero Pargo de la Laguna de Términos; Álvarez-Guillén et al. (1986) publicaron un rango de 0.04-1.0 para el sistema lagunar de Teacapán-Agua Brava. REDUNDANCIAAl comparar los índices de redundancia promedios de las cinco lagunas, se observa que presentan bastante similaridad; sin embargo, las de Boca de Palo y Punta de Piedras tuvieron un índice de 0.51, el cual fue superior a los 0.48 de la Laguna de Punta de Mangle, 0.45 de Laguna de Raya y 0.44 de Los Portillos. Igualmente, se encontró que las estaciones de las bocas presentaron mayor promedio anual que las del interior [0.52 vs. 0.46 (Fig. 4b)]. En relación con el ciclo anual, se encontró que en abril se registró el promedio mínimo (0.38), mientras que el máximo (0.53) fue en los meses de octubre, noviembre y diciembre. 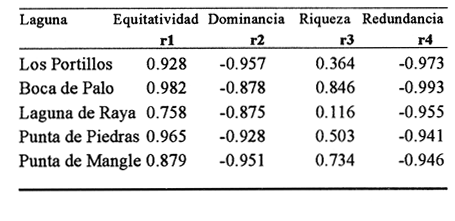 Tabla 3 Correlación entre los índices de diversidad numérica y la equitatividad (rl), dominancia (r2), riqueza de especies (r3) y redundancia (r4) en las lagunas de los Portillos, Boca de Palo, Laguna de Raya, Punta de Piedras y Punta de Mangle, Isla de Margarita. El intervalo de redundancia anual de las cinco lagunas (0. 19-0.86) es levemente superior a los encontrados (0.20-0.61 y 0.29-0.66) por Gómez (198 1) para poblaciones de peces de dos localidades de la Laguna de La Restinga, y al rango registrado (0.30m0.46) por Maples (1983) para diatomeas epifitas sobre el mangle negro (Avicennia germinans) en una marisma de Louisiana. De manera global, la redundancia muestra cambios a lo largo del año, principalmente en las lagunas de Boca de Palo, Laguna de Raya y Punta de Piedras, pero éstos no siguen un patrón estacional bien marcardo. ÍNDICE DE DOMINANCIALos índices de dominancia promedio en las lagunas tuvieron el siguiente orden decreciente: 66.79% en Punta de Piedras, 66.27% en Punta de Mangle, 65.58% en Boca de Palo, 58.75% en Laguna de Raya y 58.17% en Los Portillos (Fig. 4c). Las bocas de las lagunas presentaron valores promedio más altos que los registrados para el interior (72.26% vs 65.90%), lo cual refleja la captura, durante meses, de alto número de ejemplares de una o dos especies sobre el resto. Así, se tiene que en la boca de la Laguna de Los Portillos se obtuvo, en el muestreo de febrero, una dominancia de 93.21%, con predominio de Cetengraulis edentulus. Igualmente, en dos oportunidades se registró alta dominancia en la boca de la Laguna de Boca de Palo: 93.63% en marzo, con predominio de Lile piquitinga, y 94.46% en noviembre, con predominio de Anchoa hepsetus. En la boca de Laguna de Raya se detectó durante julio una dominancia de 93.14%, producto de una alta captura de Eucinostomus gula. Las más altas dominancias registradas en la boca de la Laguna de Punta de Piedras fueron de 96.0% en octubre, 93.48% en abril, 91.71% en agosto y 90.40% en noviembre, con predominio de Anchoa parva, Anchoa hepsetus, Lile piquitinga y Anchoa parva, respectivamente. En la boca de la Laguna de Punta de Mangle, la más alta dominancia, 94.03%, se detectó en mayo, con predominio de Xenomelaniris brasiliensis. En general, el promedio más alto de dominancia se presentó en agosto con un valor de 71.36%, y el más bajo con 51.86%, en abril. La dominancia mostró cambios a lo largo del período de muestreo, producto de la captura de juveniles de algunas especies en particular o de la presencia de especies pelágicas que se movilizan con mayor facilidad de un lugar a otro, lo que trae como consecuencia que en un muestreo dado se modifique la estructura de la comunidad; tal es el caso de que entre las especies que se reportan como dominantes en los muestreos mensuales aparezcan Cetengraulis edentulus, Lile piquitinga, Anchoa hepsetus, Eucinostomus gula, Anchoa parva y Xenomelaniris brasiliensis. La presencia de especies dominantes en aguas estuarinas tiene antecedentes en múltiples estudios, entre ellos están: Dahlbcrg y Odum (1970); Turricr y Jolinson (1973). CORRELACIÓN ENTRE LOS ÍNDICES DE DIVERSIDAD NUMÉRICA Y LA EQUITATIVIDAD, DOMINANCIA, RIQUEZA DE ESPECIES Y REDUNDANCIAEn la tabla 3 se muestran los valores de las correlaciones existentes entre los índices de diversidad numérica y la equitatividad, dominancia, riqueza de especies y la redundancia en cada una de las cinco lagunas. DIVERSIDAD-EQUITATIVIDAD (R1)Se encontró una alta correlación positiva entre estos dos parámetros. La mayor correlación se dio en la Laguna de Boca de Palo, seguida por las lagunas de Punta de Piedras, Los Portillos, Punta de Mangle y Laguna de Raya. 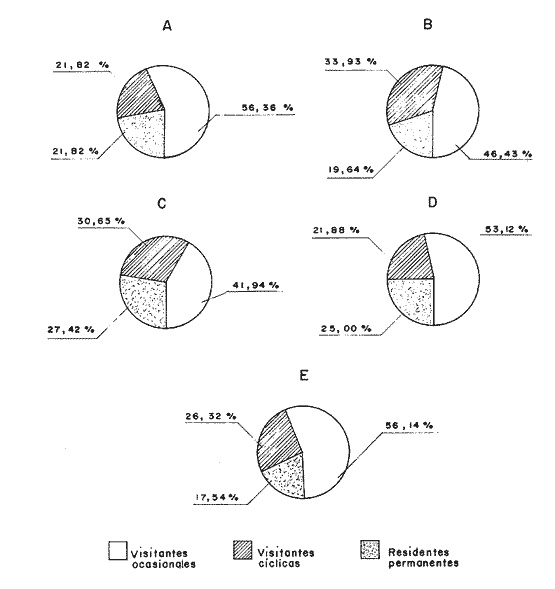 Figura 5. Distribución porcentual de los componentes comunitarios de la estructura íctica de las lagunas de Los Portillos (A), Boca de Palo (B), Laguna de Raya (C), Punta de Piedras (D) y Punta de Mangle (E), Isla de Margarita, durante 1990. A una mayor equitatividad de los individuos entre las especies representadas, esto es, pocas o muchas pero con una buena proporcionalidad de individuos, se provoca un incremento del índice J; por el contrario, éste disminuye cuando no hay armonía en la uniformidad de la proporción, lo cual explica la relación directa que la equitatividad tiene con la diversidad numérica en los muestreos realizados. Yáñez-Arancibia y Lara-Domínguez (1983) afirman que el componente que predomina en la diversidad es la distribución por peso y número dentro de las especies, no así por el número de ellas. Este hecho es muy característico en áreas lagunares costeras donde existen altos niveles de dominancia y bajos números de especies, de aquí que la diversidad esté regulada por la equitatividad. Al igual que en este estudio, Méndez et al. (1988) también encontraron correlación entre estas dos variables en la ictiofauna de la Bahía de Mochima. 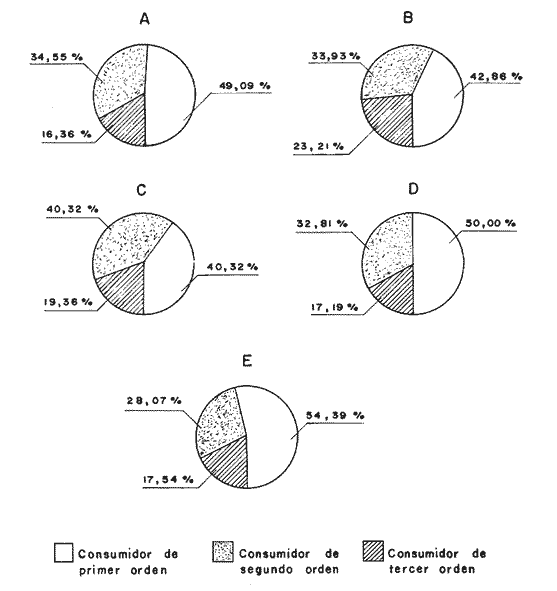 Figura 6. Distribución porcentual de las categorías ictiotróficas en las lagunas de Los Portillos (A), Boca de Palo (B), Laguna de Raya (C), Punta de Piedras (D) y Punta de Mangle (E), Isla de Margarita, durante 1990. DIVERSIDAD-DOMINANCIA (R2)Se encontró que la diversidad está correlacionada con la dominancia en forma negativa, con valores muy similares, siendo las lagunas Los Portillos, Punta de Mangle y Punta de Piedras donde se reportan los valores más altos, seguidos por la de Boca de Palo y Laguna de Raya. Méndez et al. (1988) obtuvieron, igualmente, correlación en siete estaciones de nueve que muestrearon en la Bahía de Mochima. DIVERSIDAD-RIQUEZA DE ESPECIES (R3)La correlación existente entre estos dos índices presenta bastante variabilidad entre las lagunas, encontrándose que el mayor valor lo presenta la de Boca de Palo, seguida por Punta de Mangle, Punta de Piedras, Los Portillos y Laguna de Raya. La diversidad numérica y la riqueza de especies se relacionan directamente en términos generales. En todas las cinco lagunas se encontró una correlación positiva, con una mínima de 0.166 y una máxima de 0.846. Méndez et al. (1988) también encontraron una correlación positiva para la ictiofauna de la Bahía de Mochima. Gage (1972) afirma que una correlación negativa entre el índice de diversidad y el de riqueza de especies es poco probable; esto indicaría que son muestras de diferentes hábitats y de muestreos espaciados. Douglass (1981) agrega que las correlaciones positivas son el reflejo de un hábitat similar o de muestras poco espaciadas. Asimismo, Douglass concluye que la "tendencia de incremento en dominancia con aumento de la riqueza de especies es producto de factores importantes, como competencia y depredación, que conducen a una mejor distribución equitativa de la abundancia en la riqueza de especies de comunidades marinas". 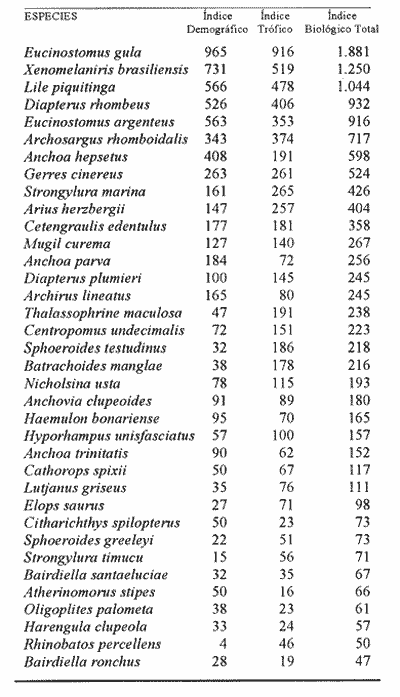 Tabla 4 Índice biológico total de las especies de peces más comunes colectadas en las lagunas de Los Portillos, Boca de Palo, Laguna de Raya, Punta de Piedras y Punta de Mangle, Isla de Margarita, durante 1990 DIVERSIDAD-REDUNDANCIASe encontró una alta correlación negativa igual a la manifestada entre la diversidad y la dominancia en todo el sistema lagunar estudiado, con valores muy similares, donde el más alto se encontró en Boca de Palo, seguido de Los Portillos, Laguna de Raya, Punta Mangle y Punta de Piedras. ÍNDICE DEMOGRÁFICO, ÍNDICE TRÓFICO E ÍNDICE BIOLÓGICO TOTALLa tabla 4 muestra que las diez especies que alcanzaron el índice demográfico más alto fueron: Eucinostomus gula, Xenomelaniris brasiliensis, Lile piquitinga, Diapterus rhombeus, Eucinostomus argenteus, Archosargus rhomboidalis, Anchoa hepsetus, Gerres cinereus, Strongylura marina y Arius herzbergii; las cuales constituyeron el 87.80% del total de individuos colectados en el período de muestreo y conformaron el 61.19% de frecuencia de aparición,entre los muestreos mensuales. Por otro lado, la misma tabla indica que estas especies obtuvieron los índices tróficos más altos, constituyendo el 55.69% de la biomása total de los peces capturados en las cinco lagunas y abarcaron el 55.51 % de frecuencia de aparición total entre los primeros lugares de los muestreos mensuales. En relación con el índice biológico total, se evidencia que las mismás diez especies presentan los valores más altos, por lo que conforman las más típicas y dominantes de todo el sistema lagunar estudiado. Dentro del grupo destaca la Familia Gerreidae con cuatro representantes. Gómez (1981) encontró como dominantes para dos localidades de la Laguna de la La Restinga a las especies: Lile piquitinga, Eucinostomus argenteus, Diapterus rhombeus, Mugil curema y Xenomelaniris brasiliensis, lo cual pone de manifiesto el predominio de la Familia Gerreidae. 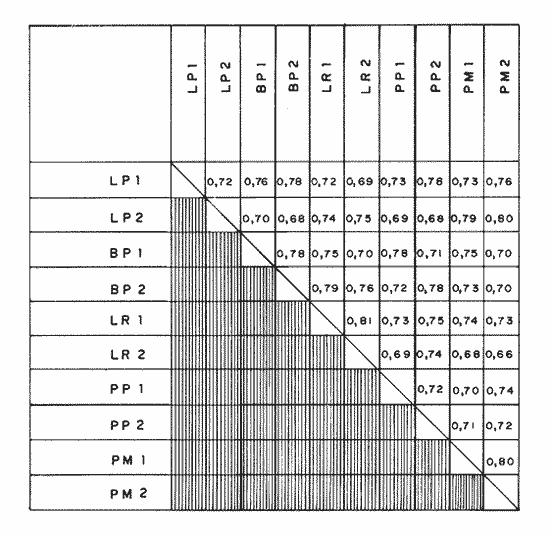 Figura 7. Diagrama de enrejado que muestra el grado de afinidad entre estaciones de las lagunas de Los Portillos (LPI, LP2), Boca de Palo (BP 1, BP2), Laguna de Raya (LR 1, LR2), Punta de Piedras (PPI, PP2) y Punta de Mangle (PMI, PM2), Isla de Margarita, durante 1990. COMPONENTES COMUNITARIOSLa figura 5 muestra los porcentajes de los componentes comunitarios. En forma general, los visitantes ocasionales predominan en todas las estaciones de las lagunas, seguidos por los visitantes cíclicos y los residentes permanentes. Una misma especie se puede comportar de diferente manera en cada una de las lagunas, en los meses del año y en cuanto al tipo de componente. El porcentaje más alto de visitantes ocasionales lo presenta la Laguna de Los Portillos (56.36%) y el más bajo, Laguna de Raya (41.94%). El mayor porcentaje de visitantes cíclicos se da en la Laguna de Boca de Palo (33.93%) y el menor, en la Laguna de Los Portillos (21.82%). El más alto porcentaje de especies residentes permanentes ocurre en Laguna de Raya (27.42%) y el menor (17.54%), en la Laguna de Punta de Mangle. Álvarez-Rubio et al. (1986) afirman que el aumento, disminución o incluso la ausencia de algún componente está en función de la época del año, lugar de muestreo (próximo a la playa, bajo el manglar o en el canal del sistema), afinidad o comportamiento, arte de pesca utilizado, ciertas estrategias reproductivas y alimenticias o las relaciones predador-presa. Las especies residentes permanentes sólo representan un pequeño porcentaje como componentes comunitarios; pero su adaptación amplia en el medio, su abundancia y distribución son las que intercambian y conducen, en gran parte, la energía dentro del sistema. Los bajos porcentajes de residentes permanentes observados indican lo inestable que son las lagunas estudiadas. Los visitantes cíclicos y residentes permanentes varían de un mes a otro, ya que unas especies van sucediendo a otras; por esto, la mayor parte de la comunidad es fluctuante. Sin embargo, existe un grupo que se registra todos los meses del año. Estas especies se caracterizan como dominantes. El predominio de los componentes comunitarios varía de un lugar a otro. Así se tiene que Amezcua-Linares y Yáñez-Arancibia (1980) encontraron en los sistemás fluvio-lagunares asociados a la Laguna de Términos un mayor predominio de visitantes ocasionales (55.30%), luego le siguen los visitantes cíclicos (36.20%) y los residentes permanentes (8.50%). Yáñez-Arancibia et al. (1988) reportan para la Laguna de Términos un 79% de visitantes ocasionales, 16% de visitantes cíclicos y 15% de residentes permanentes; Yáñez-Arancibia y Lara-Domínguez (1983) hallaron el 57% de visitantes ocasionales, 23% de visitantes cíclicos y 20% de residentes permanentes. Este orden de: 1) visitantes ocasionales; 2) visitantes cíclicos, y 3) residentes permanentes concuerda con el orden encontrado en las lagunas del presente estudio. En otros ambientes los visitantes cíclicos son mayoría, como lo señala Stoner (1986), quien encontró en la Laguna La Joyuda que esta categoría predominó con un 56.10%, luego siguieron los visitantes ocasionales con 31.70% y los residentes permanentes con 12.20 %; Álvarez-Rubio et al. (1986) reportaron para el sistema lagunar Teacapán-Agua Brava un 65.30% de visitantes cíclicos, 21.0% de visitantes ocasionales y 13.70% de residentes permanentes. Por otro lado, también se ha encontrado predominio de las especies residentes permanentes, como lo obtenido por Yáñez-Arancibia (1978), quien halló un 48% de residentes permanentes, 31% de visitantes cíclicos y 21 % de visitantes ocasionales para diez lagunas costeras del Pacífico de México, y Jory (1988) catalogó 54.55% de residentes permanentes, 28.79% de visitantes ocasionales y 16.66% de visitantes cíclicos para la Laguna de La Restinga.  Tabla 5 Categoría ictiotrófica de las lagunas de Los Portillos, Boca de Palo, Laguna de Raya, Punta de Piedras y Punta de Mangle, Isla de Margarita, durante 1990. CATEGORÍAS ICTIOTRÓFICASLa figura 6 muestra la categorización por tipo de alimentación para las diferentes especies encontradas: 41 quedaron incluidas como consumidoras de primer orden (46.59%), 30 (34.09%) de segundo y 17 (19.32%) de tercer orden. La tabla 5 muestra en detalle esta distribución. Las categorías ictiotróficas presentan el mismo patrón en la totalidad de las lagunas, tanto en la boca como en el interior. En general, los consumidores de primer orden predorninan en todas las estaciones de las lagunas, seguidos por los de segundo y tercer orden. Yáñez-Arancibia (1978) afirma que los peces consumidores de tercer orden no siempre son fáciles de determinar, por cuanto muchos consumidores secundarios pueden cambiar a este nivel de acuerdo con la disposibilidad de alimento y aun estacionalmente. Mientras que Álvarez-Guillén et al. (1985) agregan que algunas especies pueden cambiar de primer a segundo orden o bien de segundo a tercero, dependiendo de la disponibilidad de alimento y edad. El porcentaje más alto de consumidores de primer orden lo presentó la Laguna de Punta de Mangle (54.39%) y el más bajo en Laguna de Raya (40.32%). El mayor porcentaje de consumidores de segundo orden se registró en Laguna de Raya (40.32%) y el menor en la de Punta de Mangle (28.07%). El más alto porcentaje de consumidores de tercer orden se presentó en la Laguna de Boca de Palo (23.21%) y el más bajo (16.36%) en Los Portillos. De esta manera, los consumidores de primer orden constituyen el componente ictiotrófico más importante por su amplio espectro trófico en el sistema lagunar estudiado. Los resultados estudiados obtenidos al tratar cada una de las estaciones en particular, a través del ciclo anual completo, mostraron que las especies más abundantes fueron las consumidoras de primer orden, le siguieron las de segundo y las menos numerosas fueron las de tercer orden. Por otra parte, el porcentaje individual de consumidores varía en cada laguna dependiendo de sus características ecológicas. 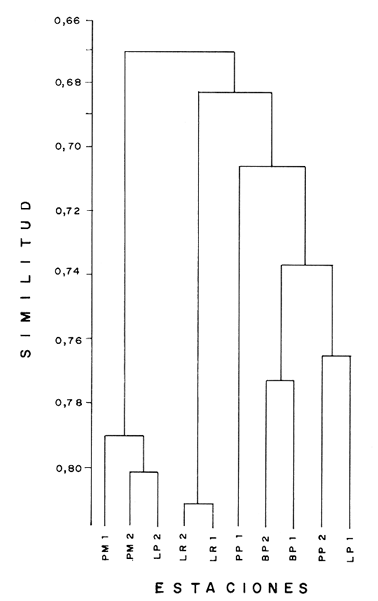 Figura 8. Dendrograma de similitud entre comunidades de peces en las diferentes estaciones de las lagunas de Los Portillos (LPI,LP2), Boca de Palo (BP 1, BP2), Laguna de Raya (LR 1, LR2),Punta de Piedras (PP 1, PP2) y Punta de Mangle (PM 1, PM2). Isla de Margarita, durante 1990. Álvarez-Rubio et al. (1986) afirman que las fluctuaciones en los niveles tróficos están en función del comportamiento de las especies, lugar de muestreo, ambiente y selectividad de las redes. Agregan que al ciclo anual completo, mostraron que las especies más abundantes fueron las consumidoras de primer orden, le siguieron las de segundo y las menos numerosas fueron las de tercer orden. Por otra parte, el porcentaje individual de consumidores varía en cada laguna dependiendo de sus características ecológicas. Álvarez-Rubio et al. (1986) afirman que las fluctuaciones en los niveles tróficos están en función del comportamiento de las especies, lugar de muestreo, ambiente y selectividad de las redes. Agregan que algunos niveles tróficos tipifican a determinadas artes de pesca; así se tiene que los consumidores de primer orden abundan en chinchorro, primero y segundo en la red de arrastre, y los de tercer orden en agallera. Esta afirmación concuerda con los datos reportados en el presente estudio, donde el arte de muestreo utilizado fue un chinchorro playero, en el cual se obtuvo la mayor cantidad de consumidores de primer orden. Este mismo comportamiento fue visualizado en estudios efectuados con chinchorro en el sistema Huizache-Caimanero (Warburton, 1978). Álvarez-Rubio et al. (1986) añaden que las especies consumidoras de segundo orden tienen un espectro trófico amplio, lo cual les permite ser dominantes, por tener distintas alternativas de alimentación ante situaciones diversas, como respuesta a capacidades adaptativas. Algunas investigaciones afirman que la dominancia de consumidores de segundo orden puede ser la respuesta a una alta disponibilidad de maerofauna en todo el aflo, apoyada por la estabilidad de corrientes, sustrato, temperatura y salinidad. Éste no es el caso observado en las lagunas muestreadas en el presente estudio, ya que en todas dominaron las especies consumidoras de primer orden y no se detectaron condiciones ambientales estables.  Figura 9. Dendrograrna de afinidad entre las especies de peces capturadas en las lagunas Los Portillos, Boca de Palo, Laguna de Raya,Punta de Piedras y Punta de Mangle, Isla de Margarita, durante 1990. Los componentes tróficos pueden variar de una laguna a otra, o de una estación a otra en la misma laguna, ya que, como se expresó anteriormente, dependen de varios factores. Así se tiene que Yáñez-Arancibia (1978) encontró en un sistema lagunar conformado por diez lagunas costeras del Pacífico de Méxíco un mayor predominio de consumidores de primer orden (38%), luego le siguen los de segundo (32%) y los de tercer orden (30%). En otros ambientes los consumidores de segundo orden son mayoría, como lo citan Yáñez-Arancibia y Lara-Domínguez (1983), quienes encontraron en la boca de Estero Pargo, de la Laguna de Términos, que los consumidores secundarios predominaron con 46% sobre los terciarios con 36% y los primarios con 18%; Álvarez-Rubio et al. (1986) obtuvieron para el sistema lagunar Teacapán-Agua Brava 55% para los consumidores de segundo orden, 34% para los de primer y 18% para los consumidores de tercer orden; Amezcua-Linares y Yáñez-Arancibia (1980) reportaron 42.5% de consumidores de segundo orden, 34% de primer y 23.5% de consumidores de tercer orden; Álvarez-Guillén et al. (1985) encontraron 32% de consumidores de segundo orden, 21% de primer y 26% presentó un comportamiento tanto de segundo como de tercer orden. Los aspectos trofodinámicos de la ecología no habían sido abordados en los estudios de comunidades lagunares de Venezuela hasta que Jory (1988) obtuvo para la Laguna de La Restinga 46% de especies consumidoras de primer orden, 36% de segundo y 18% de tercer orden, porcentajes muy similares a los encontrados en la presente investigación. AFINIDAD ENTRE ESTACIONESEntre las diez estaciones de muestreo se encontró que existe un alto grado de afinidad en relación con las especies comunes. Esta afinidad se manifiesta principalmente entre la boca (LR1) y el interior (LR2) de Laguna de Raya, con un valor de afinidad de 0.81; luego le siguen el interior de Los Portillos (LP2) y el interior de Punta de Mangle (PM2), la boca y el interior de Punta de Mangle (PMI y PM2), con un valor de 0.80 (Fig.7). Igual afinidad se encontró con los resultados del dendrograma (Fig. 8), donde se observan tres grupos de estaciones: el primero conformado por las estaciones LR1 y LR2, el segundo por las estaciones PMI, PM2 y LP2, y el tercer grupo por las estaciones LPI BPI, BP2, PPI, PP2. La comparación de la afinidad entre las estaciones de colecta mostró que las más semejantes son la boca y el interior de Laguna de Raya (LR2), y el interior de Punta de Mangle (PM2). La afinidad entre las estaciones es alta, ya que varió entre 0.66 y 0.81. Este rango manifiesta gran similitud entre ellas, lo cual puede deberse a ciertas características ecológicas comunes en el sistema lagunar. El análisis detallado de la diagnosis ecológica permite apreciar que las lagunas responden a un esquema general. El ciclo de fisiología ambiental de sus períodos ecológicos, por el cual pasan anualmente las cinco lagunas muestreadas, tiene mayor o menor influencia en cada una de las áreas y es lo que básicamente determina un patrón de comportamiento general de las lagunas. Las bocas de las lagunas pudieran estar estrechamente relacionadas con las aguas de la plataforma; de allí el alto porcentaje de especies visitantes ocasionales que se detectan en estas áreas, superior al interior de las lagunas. AFINIDAD ENTRE ESPECIESCon base en el dendrograma de afinidad que se originó por especies, a un nivel de similitud de uno, se formaron doce grupos con las especies discriminadas según se muestra en la figura 9. El más numeroso está constituido por 18 especies, le siguen dos grupos con cuatro especies cada uno, tres con tres especies cada uno, seis con dos especies cada uno, las cuales tienen afinidades taxonómicas o ecológicas. A un nivel de 0.94 se integraron dos grupos: el conformado por Hyporhampus unifasciatus y Sphoeroides greeleyi, las cuales están presentes en todas las estaciones y lagunas, menos en la boca de la Laguna de Raya, y el grupo formado por Lutjanus griseus y Haemulon bonariense. Conclusiones1. Se reportan 88 especies de peces repartidas entre 37 familias y 65 géneros; la Laguna de Punta de Piedras fue la que presentó el mayor número, con 64 especies, seguida por Laguna de Raya con 62, la de Punta de Mangle con 57, la de Boca de Palo con 56 y la de Los Portillos con 55. Las familias más representadas son: Engraulidae, Gerreidae, Gobiidae, Atherinidae, Carangidae, Bothidae y Diodontidae. 2. En total se capturaron 115, 3 76 ejemplares con un peso total de 706, 256.36 g, de los cuales el mayor número y peso se obtuvieron en la Laguna de Punta de Piedras, con 49, 286 individuos y 225, 627.27 g. 3. Los peces representan una parte importante del sistema lagunar estudiado. El papel ecológico del sistema para estas comunidades es proveer alimento, protección y/o crianza, y servir como patrón para las migraciones, como lo revelan los resultados de los parámetros ecológicos de la comunidad, los componentes comunitarios y las categorías ictiotróficas. 4. Los componentes comunitarios presentan una dinárnica que es el reflejo de la época del año, comportamiento de las especies y el arte de pesca utilizado. Los más frecuentes son los visitantes ocasionales, seguido por los visitantes cíclicos y los residentes permanentes. El bajo porcentaje de especies residentes permanentes que se encuentran todo el año es el reflejo de la inestabilidad del ambiente. 5. Las fluctuaciones en los niveles tróficos se dan en función del comportamiento de las especies y el lugar de muestreo. Las categorías ictiotróficas más frecuentes son las de primer orden, seguidas por las de segundo y tercer orden. 6. La diversidad ictiofaunística numérica (H'n) total anual osciló entre 1.0 y 3.5 bits/ind; mientras que la diversidad en peso varió entre 0.91 y 3.96 bits/ind. Cabe destacar que en Laguna de Raya se obtuvieron los promedios más altos de diversidades numérica (2.79 bits/ind) y en peso (3.39 bits/ind), riqueza de especies (3.94) y equitividad (0.59). Por otro lado, se encontró que Boca de Palo y Punta de Piedras presentaron el promedio más alto de redundancia, con 0.51. Igualmente, se observó que la diversidad numérica muestra una estrecha relación con la equitatividad, dominancia, riqueza y redundancia. 7. Las especies mejor representadas en número y biomása durante la mayor parte del año son: Anchoa parva, Anchoa hepsetus, Eucinostomus gula, Lile piquitinga, Xenomelaniris brasiliensis, Diapterus rhombeus, Cetengraulis edentulus, Eucinostomus argenteus, Gerres cinereus, Arius herzbergii, Archosargus rhomboidalis y Anchovia clupeoides. 8. Diez especies son consideradas dominantes en el área por número, peso e índice biológico total, éstas son: Eucinostomus gula, Xenomelanirís brasiliensis, Lile piquitinga, Diapterus rhombeus, Eucinostomus argentus, Archosargus rhomboidalis, Anchoa hepsetus, Gerres cinereus, Strongylura marina y Arius herzbergii. 9. La afinidad entre las diez estaciones es alta a nivel de especies totales, con mayor similitud entre la boca y el interior de Laguna de Raya (0.81). La más alta afinidad entre especies se encontró dentro de un grupo conformado por 18 que estuvieron representadas en todas las estaciones de muestreo. AgradecimientosEl autor desea expresar su más sincero agradecimiento a las personas que contribuyeron de una u otra forma a la realización de este estudio. A Pedro José González, José Francisco Franco, Sergio García, Luis Lucrecio Marín, Luis Marín y Aníbal Salomé por su colaboración durante las campañas de muestreos. A Fidel Lárez por su ayuda en el procesamiento de las muestras y separación de los organismos. A Efigenio Velásquez por su contribución en la identificación de las muestras. A Leo Walter González, Alfredo Gómez y José Millán por su valiosa colaboración y disponibilidad de instalaciones y equipos. A Jesús Suniaga y Pablo José Ramírez por su ayuda en los programás de computación. A Raimundo Ramírez por la realización de los gráficos. A Luis Marcano y Rifka Sarshalom por la revisión critica del manuscrito. Este trabajo fue parcialmente financiado por el Consejo de Investigación de la Universidad de Oriente, a través del Proyecto CI-4-002-00425-90, institución a la que queremos dejar testimonio de nuestro agradecimiento. LITERATURAALLEN, L. y M. HORN, Estuar. Coast. Mar. Sci., Abundance, diversity and seasonality of fishes in Colorado Lagoon, Alamitos Bay, California. 1975. 371-380 3 ÁLVAREZ-GUILLÉN, H., A. YÁÑEZ-ARANCIBIA y A. L. LARA-DOMÍNGUEZ An. Inst. Cienc. del Mar y Limnol Univ. Nal. Autón. México, Ecología de la Boca del Carmen, Laguna de Términos. El hábitat y estructura de las comunidades de peces. 1985 107-144 12 (1) ÁLVAREZ-RUBIO, M., F. AMEZCUA-LINARES y A. YÁÑEZ-ARANCIBIA, An. Inst. Cienc. del Mar y Limnol. Univ. Nal. Autón. México, Ecología y estructura de las comunidades de peces en el sistema lagunar Teacapán-Agua Brava, Nayarit, México. 1986 185-242 13 (1) AMEZCUA-LINARES, F. y A. YÁÑEZ-ARANCIBIA An. Centro Cienc. del Mar y Limnol. Univ. Nal. Autón. México, Ecología de los sistemás fluvio-lagunares asociados a la Laguna de Términos. El hábitat y estructura de las comunidades de peces. 1980 69-118 7 (1) ANDREWARTHA, H. G. y L. C. BIRCH, The distribution and abundance of animals. University of Chicago, Chicago Press, Chicago. 1954. BÓHLKE, J. E. y C. C. G. CHAPLIN, Fishes of the Bahamás and adjacent tropical waters. Livingston Publ. Co., Pittsburgh. 1968. CARVAJAL, J., Bol. Inst. Oceanogr. Univ. Oriente Estudio ecológico de las lagunas litorales vecinas a la ciudad de Cumaná, Venezuela. 1965. 266-311. 4 (2) CERVIGÓN, F Los peces marinos de Venezuela. Estación de Investigaciones Marinas de Margarita, Fundación La Salle de Ciencias Naturales. Caracas. Monogr. 11 y 12 1966. (2 volúmenes) CERVIGÓN, F. y A. GÓMEZ, Las lagunas litorales de la Isla de Margarita: sus recursos y su conservación. Centro de Investigaciones Científicas, Universidad de Oriente, Ed. Arte, Caracas. 1986 DAHLBERG, M. y E. ODUM, Am. Midl. Nat Annual cycles of species occurrence, abundance and diversity in Giorgia estuarine fish populations. 1970. 382-392. 83 (2) DOUGLASS, W. B Am. Nat. Dominance in Marine Ecosysteni. 1981 262-274 118 GAGE, J. Mar. Biol. Community structure of the benthos in Scttish sealochs. I. Introduction and species diversity. 1972 281-297 14 GÓMEZ, A. Bol. Inst. Oceanogr., Univ. Oriente Estudio sobre las comunidades de peces en dos localidades de la Laguna de La Restinga. 1981 91-112 20 (1-2) HILDEBRAND, S. Bull. Birgham Oceanogr. Coll. A review of the American anchovies (Family Engraulidae). 1943. 1-165 8 (2) JORY, D. E. Rosenstiel School of Marine Science and Atmospheric Science, University of Miami, Miami. Biology and community structure of the ichthyofauna of La Restinga lagoon (Margarita Island, Venezuela). Doctoral dissertation. 1988. KREBS, CH. J. Ecología Estudio de la distribución y la abundancia. Harla S. A. de C.V. México, D.F 1985 LLOYD, M. y R. J. GHELARDI J. Anim. Ecol. A table for calculating the equitability component of species diversity. 1964. 217-225 33 MAGO, L. F. Bull. Mar. Sci. Contribución a la sistemática y ecología de los peces de la Laguna de Unare, Venezuela. 1965 274-330 15 (2) MAIN, S. P. y C. D. MEINTIRE Bot. Mar. The distribution of epiphytic diatoms in Yaquina Estuary, Oregon. 1974. 88-99 17 MAPLES, R. Gulf Research Report Community structure of diatonis epiphytic on pneurnatophores of the black mangrove, A vicennia germinans, in a Louisiana salt marsh. 1983 255-259. 7 (3) MARGALET, R. Perspectives in the ecological theory. Univ. Chicago Press, Chicago. 1968 ---, Ecología Ediciones Omega, S. A. Barcelona, España 1980 McNAUGHTON, S. J. Ecology Structure and function in California grassland. 1968 962-972 49 MÉNDEZ, E., R. MANRIQUE y F. CERVIGÓN, La ictiofauna de la Bahía de Mochima Fundaciencia, Caracas. 1988. PADRÓN, M. Universidad de Oriente, Centro de Investigaciones Científicas, Boca del Río, Nueva Esparta. Aspectos de la biología de la lisa, Mugil curema Valenciennes, y el robalo, Centropomus undecimalis (Bloch), en la Laguna de La Restinga, Isla de Margarita, Venezuela. Trabajo de ascenso. 1976 PIANKA, E. Am. Nat. Latitudinal gradients in a species diversity. A review of concepts. 1966 33-46 100 PIELOU, E. C. Ecological diversity John Wiley and Sons New York, N. Y 1975 RAMÍREZ, P. Ecología y estructura de las comunidades ¡etiofaunísticas de las lagunas Los Portillos, Boca de Palo, Laguna de Raya, Punta de Piedras y Punta de Mangle, Isla de Margarita. Trabajo de ascenso para optar a la categoría de Profesor Titular. Universidad de Oriente, Núcleo de Nueva Esparta. Departamento de Ciencias, Guatamare. 1991 ROHL, E. Fauna descriptiva de Venezuela Tipografía Americana, Caracas. 1942 RUIZ, I. y E. De ELQUEZABAL, II Congreso de Ciencias del Mar Diversidad y abundancia de peces en el Saco del Golfo de Cariaco, Venezuela. La Habana, Cuba 1990 128-129 18 al 22 de junio de 1990 SALAYA, J. Trabajo de grado, Facultad de Ciencias, UCV, Caracas Contribución al estudio de la ictiofauna de los manglares de la Isla de Margarita, Venezuela. 1968 SALAZAR, F. Universidad de Oriente, Núcleo de Nueva Esparta, Guatamare Ictiofauna y aspectos ecológicos de la Laguna de Las Marites, Margarita. Trabajo de ascenso. 1978 SANDERS, H. L. Limnol. Oceanogr. Benthic studies in Buzzards Bay III. The structure of the soft bottom community. 1960 138-153 5 SCHULTZ, L. P. Nat. Mus. A further contribution to the ichthyology of Venezuela, Proc. U. S. 1949 1-211 99 (3235) SHANNON, E. C. y N. WEAVER University of filinois Press. The rnathematical theory of communication. Urbana. 1963 SOKAL, R. y F. ROHLF Biometry. W. L. Freeman and Comp. San Francisco. 1969. STONER, A. W. Fish Bull. U.S. Distribution of fishes on seagrass meadows: role of macrophyte and species composition. 1983 837-846 81 TURNER, W. R. y G. N. JOHNSON Technical Report, NMFS/SSRF-666 Distribution and relative abundance of fishes in Newport River, North Carolina. NOAA, 1973 1-23 WARBURTON, K. Coast. Mar. Sci. Community structure, abundance and diversity of the fish in a Mexican coastal lagoon system. Estuar. 1978 497-519 7 WEIBEZAHN, F. Mem. Soc. Cienc. Nat. La Salle Contribución al estudio de la fauna ictiológica de la Laguna de Tacarigua. 1949 213-219 9 (24) WILHM, J. L. Ecology Use of biomass units in Shannon's formula. 1968 153-156 49 (1) YÁÑEZ-ARANCIBIA, A. An. Centro Cienc. del Mar y Limnol., Univ. Nal. Autón. México Patrones ecológicos y variación cíclica de la estructura tráfica de las comunidades nectónicas en lagunas costeras del Pacífico de México. 1978 287-306 5 (1) YÁÑEZ-ARANCIBIA, A. y R. S. NUGENT An. Centro Cienc. del Mar y Limnol. Univ. Nal. Autón. México El papel ecológico de los peces en estuarios y lagunas costeras. 1977. 107-114 4 (1) YÁÑEZ-ARANCIBIA, A., F. AMEZCUA-LINARES y J. W. DAY Academic Press In: U.S. Kennedy Fish community structure and function in Terminos Lagoon. Gulf of Mexico. Estuarine Perspectives. New York 1980. 465-482. YÁÑEZ-ARANCIBIA, A. y A. L. LARA-DOMÍNGUEZ An. Inst. Cienc. del Mar y Limnol. Univ. Nal. Autón. México, Dinámica ambiental de la Boca de Estero Pargo y estructura de sus comunidades de peces en cambios estacionales y cielos de 24 horas (Laguna de Términos). 1983 85-116 10 (1) YÁÑEZ-ARANCIBIA, A., A. L. LARA-DOMÍNGUEZ, P. SÁNCHEZ-GIL, J. L. ROJAS-GALAVIS, H. ÁLVAREZ-GUILLÉN, G. SOBERÓN-CHÁVEZ y J. W. DAY, Jr. Ecología de los ecosistemás costeros en el sur del Golfo de México: La región de la Laguna de Términos In: A. Yáñez-Arancibia y J. W. Day, Jr., Dinámica de las comunidades nectónicas costeras en el sur del Golfo de México. Inst. Cienc. del Mar y Limnol. UNAM, Coast. Ecol. Inst. LSU., Editorial Universitaria México, D.F. 1988 357-380
|

