|
ESTUDIO DE LA FAUNA DE POLIQUETOS (ANNELIDA) Y MOLUSCOS
(GASTROPODA Y BIVALDIA) ASOCIADA CON AMBIENTES DE PASTOS MARINOS (Thalassia
testudinum) y MANGLARES (Rhizophora mangle) EN LA LA GUNA DE TÉRMINOS,
CAMPECHE, MÉXICO
Trabajo recibido el 7 de febrero de 1992 y
aceptado para su publicación el 8 de mayo de 1994.
Flor Marina Cruz-Ábrego
Estación Puerto Morelos, Instituto de
Ciencias del Mar y Limnología, Universidad Nacional Autónoma de
México. Apartado Postal 1152. Cancún 77500, Quintana Roo.
MÉXICO.
Pablo Hernández-Alcántara
Instituto de Ciencias del Mar y Limnología,
Universidad Nacional Autónoma de México. Apartado Postal 70-305,
México, D.F. 04510, MÉXICO. Contribución No. 740 del
Instituto de Ciencias del Mar y Limnología.
Vivianne Solís-Weiss
Instituto de Ciencias del Mar y Limnología,
Universidad Nacional Autónoma de México. Apartado Postal 70-305,
México, D.F. 04510, MÉXICO. Contribución No.740 del
Instituto de Ciencias del Mar y Limnología.
Se analizó la distribución de poliquetos
y moluscos asociados a ambientes de pastos marinos (Thalassia
testudinum) y manglares (Rhizophora mangle) en la
Laguna de Términos, Campeche. La colecta de organismos se realizó
entre 1981 y 1984, con un cuadrante de 0.3 m de lado y un nucleador de 0.2 m de
diámetro interno. Se identificó un total de 113 especies, 4,890
ejemplares pertenecen a 72 especies de poliquetos y 1,260 a 41 especies de
moluscos. Dominan los poliquetos tanto en abundancia como en riqueza
específica. Las especies más numerosas son Capitella
capitana (Fábricius ), Terebella lapidaria
Linnaeus, Neanthes succinea Frey y Leuckart,
Marphysa sanguinea (Montagu), Melinna
maculata Webster, Neanthes caudata (delle Chiaje),
Crepidula maculosa Conrad, Tellina alternata
tayloriana Say, Lucina pectinata (Gmelin),
Chione cancellata (Linnaeus), Anachis
seiniplicata Stearns y Tellina lineata (Turton).
Esta fauna tolera condiciones ambientales fluctuantes, que varían desde
24 a 34.5°C, salinidades oligobalinas a eurihalinas y sedimentos desde
lodosos hasta areno-lodosos con grava. Se registraron preferencias de
hábitat de las especies de ambos taxa: a) 63 especies
están presentes en T. testudinunt; b) 23 sólo
en R. mangle, y c) 27 especies en ambas zonas. El desarrollo
de las poblaciones y la riqueza específica en las praderas de
Thalassia se relacionan con la heterogeneidad de
hábitats que tienen una riqueza y abundancia de organismos mayores que
las zonas de manglar.
PALABRAS-CLAVE: Poliquetos,
moluscos Thalassia testudinum, Rhizophora mangle, Laguna de
Términos.
The distribution of polychaetes and mollusks in the
Terminos Lagoon, State of Campeche, in the seagrass beds (Thalassia
testudinum) and mangroves (Rhizophora mangle) was
analyzed. The organismos collection was made from 1981 to 1984. The sampling
was done with a frame of 0.3 m by side and with a corer of 0.2 m of internal
diameter. A total of 113 species was identified based on 6,150 specimens, of
which 4,890 individuals corresponded to 73 polychaete species and 1260 to 41
mollusk species. Polychaetes dominate both abundance and species diversity. The
most abundant species are: Capitella capitata (Fabricius),
Terebella lapidaria Linnaeus, Neanthes
succinea Frey and Leuckart, Marphiysa sanguinea
(Montagu), Molinna maculata Webster, Neanthes
caudata (delle Chiaje), Crepidula maculosa Conrad,
Tellina alternata tayloriana Say, Lucina
pectinata (Gimelin), Chione cancellata (Linnaeus),
Anachis semiplicata Stearns and Tellina
lineata (Turton). Those species tolerates environment fluctuations
between 24 and 34.5oC and oligohaline to curihaline water conditions and muddy
sediments to sandy muddy with gravel ones. Three habitat preferences were found
among both classified species: a) 63 species were found only in T.
testudinum; b) 23 species present only in R.
mangle sites, and c) 27 species present in both zones. In Thalassia
seagras beds, specific diversity and populations, development are related with
very differents habitats. These zones are more fecund in big organisms than
mangroves.
KEY WORDS: Polychaetes, Mollusks,
Thalassia testudinum, Rhizophora mangle,Terminos
Lagoon.
Las especies de poliquetos y moluscos de las zonas litorales y sublitorales mexicanas son poco conocidas, a pesar de tener una gran importancia ecológica (por su distribución) en el medio marino, a su elevada abundancia y su amplia flexibilidad adaptativa a los diferentes ambientes que en él existen. Son pocos los estudios en que se han analizado las poblaciones de poliquetos en la Laguna de Términos, Campeche: Marrón (1975), Reveles (1984), Ibáñez-Aguirre y Solís-Weiss (1986), Solís-Weiss y Carreño (1986) en praderas de T. testudinum, y Hernández y Solís-Weiss (1991) en zonas de manglar. Acerca de los moluscos se han elaborado trabajos descriptivos y ecológicos como los de Espinosa (1980), García-Cubas (1981), Escobar (1984), Cruz-Ábrego y Solís-Weiss (1987), y Hérnández-Alcántara et al. (1988). Lara-Domínguez et al. (1990) han aportado gran parte de la información de esta laguna referente a aspectos biológicos, químicos, físicos, geológicos, etc. El objetivo principal de este trabajo es proporcionar la composición faunística de poliquetos y moluscos en dos ambientes de la Laguna de Términos: las praderas de Thalassia testudinum y los manglares dominados por Rhizophora mangle. ÁREA DE ESTUDIOLa Laguna de Términos, Campeche, se localiza en el sureste del Golfo de México frente a la Bahía de Campeche, se encuentra ubicada entre los paralelos 18° 00' y 18° 25' de latitud septentrional y los meridianos 91° 15' y 91° 55' de longitud occidental, es una de las zonas más productivas de recursos del mar en el país, como el camarón, diversas pesquerías, asimismo en actividad petrolera (Fig. 1). Es una laguna tropical caracterizada por poseer extensas praderas de pastos marinos, zonas de manglar y fondos desprovistos de vegetación. La laguna está separada del mar por la Isla del Carmen, con comunicación permanente con aquél por medio de las bocas de Puerto Real y del Carmen. Existe un flujo neto de agua en sentido este-oeste a una velocidad promedio de 5 a 7 cm/seg (Vargas, 1977). Los vientos del este dominan durante casi todo el año, pero durante el invierno se producen los llamados "nortes" (Graham et al., 1981). La laguna recibe agua dulce de los ríos Palizada, Chumpan, Candelaria y Mamantel. Es somera y con una profundidad promedio de 2.5 m; la máxima se localiza en el centro de la cuenca (Gracia-Gasca y Soto, 1990) y en la boca del Carmen donde alcanza 12 m. La salinidad más alta registrada en la zona fue de 35.5%, descendiendo hasta 4% en las áreas con influencia fluvial (Hernández-Alcántara y Solís-Weiss, 1991). La temperatura del agua fluctuó entre 23°C durante el invierno, aumentando hasta 34.5°C en el verano. Un delta interno se forma en la Boca de Puerto Real y uno externo en la del Carmen. En el área se presentan tres épocas climáticas: a) sequía de marzo a mayo; b) lluvias de junio a octubre, y c) "nortes" de noviembre a febrero, época en que dominan los vientos provenientes del norte, frecuentemente acompañados por lluvias. Las praderas de pastos marinos más extensas están ampliamente distribuidas al sur de la Isla del Carmen, bajo condiciones eurihalinas y en las que predomina la especie T. testudinum, aunque en algunas áreas también se puede encontrar Halodule wrightii y Syringodium filiforme, principalmente a lo largo de la costa oeste y en el delta interno en Puerto Real. Los terrenos que circundan el sistema lagunar están cubiertos por R. mangle (mangle rojo); en algunas áreas, como ríos y lagunas asociadas al sistema, se localiza Avicennia germinans. Otras especies como Laguncularia racemosa (en pantanos) y Conocarpus erectus ocurren ocasionalmente. 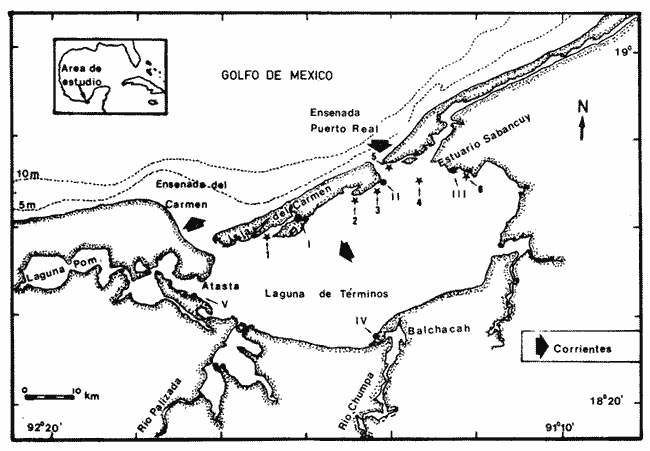 Figura 1. Laguna de Términos. Ubicación de los sitios de muestreo en zonas de Thalassia testudinum (números arábigos) y Rhizophora mangle (números romanos). MATERIAL Y MÉTODOSCon el propósito de obtener el mayor número de individuos y especies de ambos grupos de organismos, se efectuaron cuatro colectas en zonas de pastos marinos durante los meses de agosto y octubre (lluvias) de 1981, y febrero (nortes) y marzo (secas) de 1982. En las zonas de manglar, en fondos blandos, se recolectó también en cuatro temporadas: mayo (secas), agosto y noviembre (lluvias) de 1983, y febrero (nortes) de 1984. En cada temporada se tomaron muestras en seis localidades de pastos marinos y en cinco de manglar. La zona de estudio con pastos marinos comprende la parte sur de la Isla del Carmen; las áreas de muestreo de manglar se ubicaron tanto en zonas de influencia marina como dulceacuícola (Fig. 1). La toma de muestras en pastos marinos se realizó por medio de un cuadrante de 30 cm de lado (0.09 m²), con una penetración en el fondo de 20 cm e incluyó el sedimento y la vegetación sumergida. Se tomaron cuatro cuadrantes por localidad equivalentes a una área total de 0.36 m². En el manglar las muestras de sedimento se obtuvieron con un nucleador de 20 cm de diámetro interno (0.03 m²) y con una penetración de 20 cm. Se extrajeron diez núcleos por localidad, por lo que se analizó un total de 0.31 m . En cada estación se registraron los parámetros abióticos, como la salinidad, con un refractómetro de mano y la temperatura con un termómetro de cubeta de 50°C (±0. 1). El tipo de sedimento se determinó por tamizado en húmedo y análisis por pipeta (Hernández-Alcántara, 1985). Para la obtención de los poliquetos y moluscos los sedimentos para análisis biológico se lavaron a través de un tamiz de 0.5 mm de luz de malla. Los organismos se fijaron con una solución de formol al 10% y se preservaron en alcohol etílico al 70%. En el caso de los moluscos sólo se consideraron los ejemplares vivos. La determinación de las especies se basó, en el caso de los poliquetos, principalmente en la literatura especializada de Day (1967). Fauvel (1923, 1927) y Fauchald (1977): para los moluscos se utilizó básicamente a Abbott (l974), Andrews (1977) y García-Cubas (1981). RESULTADOS Y DISCUSIÓN
ANÁLISIS DE LA FAUNA.En este estudio, la riqueza específica de los poliquetos fue superior a la de los moluscos, registrándose 72 y 41 especies, respectivamente. En total se identifico a 6,150 organismos pertenecientes a 113 especies de ambos taxa (Tablas 1-4). 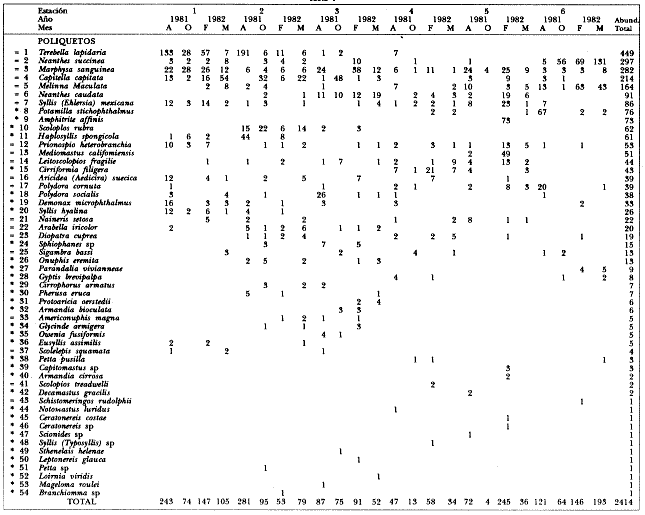 Tabla 1 Abundancia y distribución de poliquetos en las localidades de Thalassia testudinum durante los períodos de estudio. * Especies sólo en Thalassia, = especies en Thalassia y manglar. A= agosto, O= octubre, F= febrero, M= marzo El grupo de los poliquetos fue el más abundante en todos los sitios de muestreo y comprendió el 79% (4, 890) del total de organismos. La abundancia total de moluscos fue de 1,260 organismos (21%). 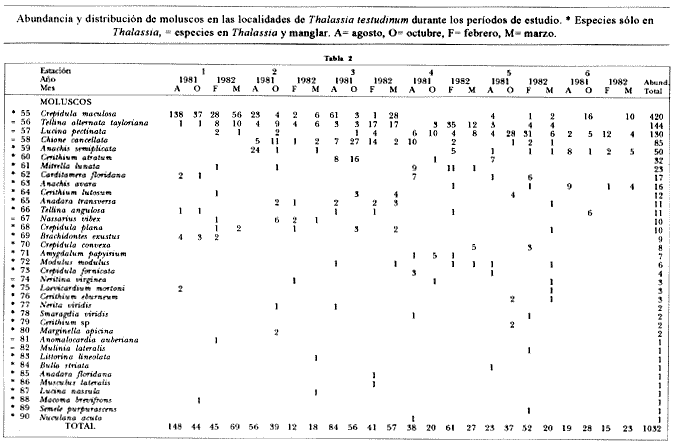 Tabla 2 Abundancia y distribución de moluscos en las localidades de Thalassia testudinum durante los períodos de estudio. * Especies sólo en Thalassia, = especies en Thalassia y manglar. A= agosto, O=octubre, F=febrero, M=marzo De los poliquetos, las especies con mayor frecuencia de aparición fueron Marphysa sanguinea (Montagu), Syllis (Ehlersia) mexicana Rioja y Prionospio (Prionospio) heterobranchia Moore y de los moluscos: Crepidula maculosa Conrad, Tellina alternata tayloriana Say y Lucina pectinata (Gmelin) (Tablas 1-4). De las 113 especies de poliquetos y moluscos identificadas en este estudio, 34 de poliquetos (60.06 ej/m²) y 29 de moluscos (76.2 ej/m²) se encontraron únicamente en los pastos marinos. La abundancia de estas especies constituye el 34% del total de organismos obtenidos en este ambiente. Entre las especies más abundantes se encuentran los poliquetos: Potamilla stichopthalmos, Amphitrite affinis, Scoloplos rubra, HaplosyIlis spongicola, Cirriformia filigera, Polydora socialis y Demonax microphthalmus, y los moluscos: Crepidula maculosa, Anachis semiplicata,Cerithium atratum (Born), Mitrella lunata (Say), Crepidula convexa (Say) y Carditamera floridana Conrad (Tablas 1 y 2). Las especies reconocidas únicamente en zonas de manglar fueron 23. Se cuantificó un total de 94.2 ej/m² (21%) principalmente de las especies de poliquetos: Streblospio benedicti Webster y Laeonereis culveri (Webster), y del bivalvo Tellina lineata (Turton) (Tablas 3 y 4). 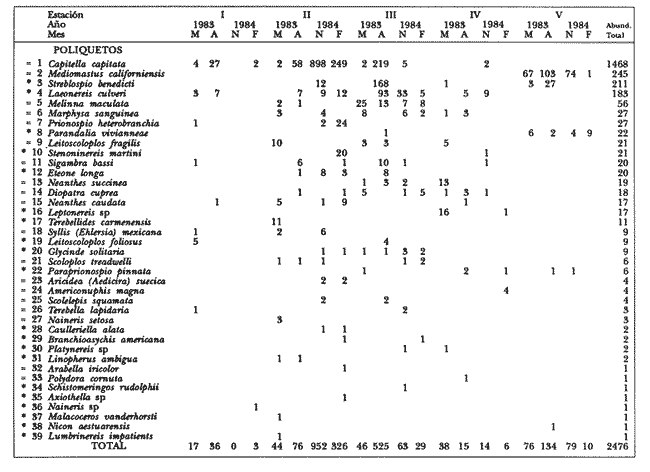 Tabla 3 Abundancia y distribución de poliquetos en las localidades de Rhiziphora mangle durante los períodos de estudio. * Especies sólo en manglar, = especies en Thalassia y manglar. M= mayo, A= agosto, N= noviembre, F=febrero.  Tabla 4 Abundancia y distribución de moluscos en las localidades de Rhizophora mangle durante los períodos de estudio. * Especies sólo manglar, = especies en Thalassia y manglar. M= mayo, A= agosto, N=noviembre, F=febrero. El último grupo obtenido incluye a las especies comunes que a través del estudio se recolectaron tanto en zonas de pastos marinos como en áreas de manglar que de manera natural están cercanas entre sí. Se identificaron 27 especies comunes en ambos hábitats siendo las más abundantes los poliquetos siguientes: Capitella capitata (Fabricius), Terebella lapidaria (Linnaeus), Mediomástus californiensis Hartman, y Marphysa sanguinea (Montagu), así como los moluscos Lucina pectinata y Tellina alternata tayloriana (Tablas 1-4). 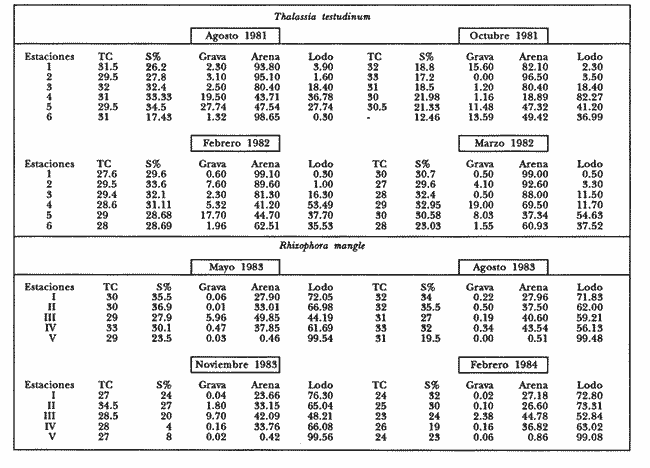 Tabla 5 P arámetros ambientales y percentiles de grava, arena y lodo en las localidades de T testudinum y R. mangle durante los períodos de estudio . M=mayo, A= agosto, N=noviembre,F=febrero. Los resultados indican una preferencia de hábitat por las especies. Debido a la baja abundancia en el manglar de los poliquetos Arabella iricolor (Montagu), Polydora cornuta Bosc, Aricidea (Aedicira) suecica (Eliason), Terebella lapidaria Verril y Naineris setosa se consideran especies ocasionales en ese hábitat. De la misma forma, los moluscos Chione cancellata, (filtrador), Nerifina virginea (herhivoro raspador) y Nassarius vibex (Say) (carnivoro), presentes tanto en las praderas de Thalassia como en el manglar, son considerados especies ocasionales en ambientes de manglar. La mayor riqueza de especies se registró en el ambiente de pastos marinos, ya que si agrupamos las exclusivas de este ambiente y las comunes a áreas de Thalassia y manglar, el porcentaje presente en los pastos marinos alcanza el 79%. La abundancia de las diferentes especies está relacionada directamente con la presencia de T. testudinum. De acuerdo con Heck y Wetstone (1977) y Lewis y Stoner (1983), las praderas de Thalassia contienen mayor biomasa vegetal, la cual propicia la presencia de mayor número de especies y en general mayor abundancia de invertebrados. Existe también una relación directa con la complejidad del hábitat, es decir, las praderas de pastos proveen de más "espacio habitable" a juveniles y adultos, de invertebrados, principalmente, además de servir como áreas de refugio, alimentación y reproducción. Se registraron más especies y mayor variabilidad de hábitos alimenticios que contribuyen a un ambiente más estable (Hutchings y Recher, 1974) (filtradores, de depósitos, herbívoros y camívoros) en praderas de T. testudinuni que en los ambientes de manglar. A pesar de que las zonas de manglar son áreas muy productivas, debido al depósito de sedimentos que ocurre en ellas, son un ambiente habitado por especies que se alimentan principalmente de materiales depositados como los poliquetos C. capitata, M. californiensis, S. benedicti y L. culveri, que muestran en estas zonas una abundancia mayor que la de los moluscos. Las especies de poliquetos más abundantes en ambos tipos de hábitat fueron Capitella capitata, Mediomástus californiensis, Streblospio benedicti, Laeonereis culveri, Terebella lapidaria, Neantes succinea, Marphysa sanguinea, Melinna maculata y Neanthes caudata. A los moluscos correspondieron Crepidula maculosa, Anachis semiplicata, Tellina alternata tayloriana, Lucina pectinata, Chione cancellata y Tellina listeri. La abundancia de estas 15 especies constituye el 62% del total de organismos. La distribución geográfica y características bioecológicas de las especies dominantes, así como las condiciones ambientales de las zonas donde fueron recolectadas se describen a continuación (Tabla 5). POLIQUETOSCapitella capitata (Fabricius). Habita una variedad de tipos sedimentarios y a menudo es abundante en sedimentos con alto contenido de materia orgánica. Es una especie cosmopolita que se localiza desde la zona interinareal hasta profundidades de 917 m (Ewing, 1984). Área de estudio: es la especie más abundante entre las poblaciones de poliquetos, tanto en ambientes de pastos marinos como de manglar. Hábitat: temperatura de 24 a 34.5°C, salinidad de 12 a 36.9%o y sedimentos principalmente lodoarenosos en el manglar, y arenoso y areno-lodoso en los pastos marinos. Terebella lapidaria Linnaeus. Esta especie se ha registrado básicamente en zonas intermareales, donde forma galerías en las fisuras rocosas. Se distribuye en el Océano Atlántico y en los mares Mediterráneo y Adriático (Fauvel, 1927). Área de estudio: es una especie abundante y se localiza preferentemente en los ambientes de pastos marinos al sur de la Isla del Carmen. En áreas de manglar se localizó ocasionalmente al noreste y suroeste de la laguna. Hábitat: temperaturas de 27 a 32°C, salinidad de 18 a 32%o y en sedimentos arenosos en Thalassia, y arenolodosos y lodosos en manglares. Melinna maculata Webster. Habitat en sedimentos arenosos desde la zona intermareal hasta profundidades de 35 m (Uebelacker, 1985). Se distribuye desde el estado de Virginia en los Estados Unidos hasta el norte del Golfo de México. Área de estudio: es muy abundante y de amplia distribución en los ambientes de pastos marinos; en áreas de manglar únicamente se registró al noreste. Hábitat: en temperaturas de 24 a 33°C y salinidad de 12.46 a 35.5%o; principalmente en sedimentos arenosos en Thalassia y lodo-arenosos en manglares. Mediomástus californiensis Hartman. Se localiza en sedimentos de arena fina lodosa, desde zonas intermarcales hasta profundidades de 517 m. Se distribuye en el Atlántico noreste, desde Carolina del Norte hasta el Golfo de México. En el Océano Pacífico se localiza en Estados Unidos desde el estado de Oregon al de California, y en Australía inclusive (Ewing, 1984). Área de estudio: es una especie abundante, aunque se restringe a zonas específicas: Boca de Puerto Real en ambientes de pastos marinos y en la porción suroeste en manglar. Hábitat: en temperaturas de 24 a 32°C, salinidad de 24.0 a '35.5%o; en sedimentos lodo-arenosos en manglar y arenolodosos con grava en Thalassia. Marphysa sanguinea (Montagu). Se ha registrado en zonas intermarcales hasta los 65 m de profundidad, en sedimentos de arena lodosa mezclada con arcilla y fragmentos de conchas (Gathof, 1984). Área de estudio: es una de las especies más abundantes y se distribuye en casi toda la región de pastos marinos; en los ambientes de manglar no es tan abundante. Se localizó al noreste y al sur. Hábitat: temperatura de 27 a 33.6°C, salinidad de 4 a 33.6%o; en sedimentos arenosos y areno-lodosos en Thalassia y lodo-arenosos en manglares. Neanthes succinea (Frey y Leuckart). Se localiza en diversos tipos sedimentarios, sobre vegetación y objetos sumergidos. Habita desde zonas intermareales hasta a más de 50 m de profundidad (Taylor, 1984). Área de estudio: es abundante en praderas de T. testudinum; se localizó en casi todas las localidades de muestreo. En áreas de manglar se registró ocasionalmente al sur y al este. Hábitat: temperatura de 27.6 a 33.6°C, salinidad de 18 a 30.7%o; en fondos arenosos en Thalassia y areno-lodosos en manglares. Streblospio benedicti Webster. Esta especie se ha registrado en áreas intermareales y sublitorales someras, frecuentemente en bancos del bivalvo Mytilus y bajo condiciones estuarinas (Foster, 1971). Su distribución es dispersa: se encuentra en el Golfo de Maine., Dinamarca, Francia, Suramérica. En los Estados Unidos: desde Washington a California y en su costa oriental en los estados de Virginia, Florida y Texas (Foster, 1971). Área de estudio: esta especie es abundante, aunque únicamente se localiza en los ambientes de manglar de la porción noreste y suroeste. Hábitat: temperatura de 28 a 30°C, salinidad entre 4 y 36.9%o; en sedimentos lodo-arenosos. Laeonereis culveri (Webster). Especie típica intermareal de aguas cálidas y salobres. Ocupa extensos bancos de arena y es una fuente importante de alimento para las aves costeras (Hartman, 1951, 1959). Se distribuye en parches y es muy abundante en zonas intermareales en los primeros 10 cm de sedimento fino en áreas donde la salinidad es fluctuante (de 0.5 a 30%o) (Pettibone, 1971). Se ha registrado en la costa este de los Estados Unidos, Golfo de México y El Salvador. En la costa este de Suramérica desde la Guinea francesa hasta Uruguay (Pettibone, 197 1). Área de estudio: muy abundante, aunque se distribuye sólo en las zonas de manglar de la parte central y este de la Isla del Carmen, y al noreste y suroeste de la laguna. Hábitat: temperatura entre 24 y 34.5°C, salinidad de 4 a 35.5%o; en sedimentos lodo-arenosos. Neanthes caudata (delle Chiaje). Habita en sedimentos gruesos y finos, frecuentemente asociados a vegetación u objetos sumergidos. Es una especie cosmopolita en zonas tropicales (Taylor, 1984). Área de estudio: es una especie abundante y ampliamente distribuida en los pastos marinos de la región norte; en zonas de manglar sólo se localizaron organismos en la parte central y este de la Isla del Carmen. Hábitat: en temperaturas de 26 a 33°C, salinidad de 4 a 32.5%o y en sedimentos principalmente arenosos en Thalassia y lodo-arenosos en manglares. MOLUSCOSCrepidula maculosa Conrad. Habita desde la zona intermareal hasta profundidades moderadas, sobre otros moluscos, piedras y pastos. Es una especie fíltradora epifaunal (Andrews, 1977). Su distribución abarca las Islas Bahamás y el Golfo de México. Área de estudio: se registró en la mayoría de las estaciones de pastos, siendo más abundante en la parte sur de la Isla del Carmen; no se localizó en las de manglar. Hábitat: temperatura de 27 a 33°C, salinidad de 17.7 a 32.4%o y en sedimentos principalmente arenosos. Lucina pectinata (Gmelin). Se localiza en praderas de pastos marinos, en las márgenes de bahías abiertas y en lagunas hipersalinas. Es un bivalvo de la infauna superficial (Morton, 1983). Se distribuye en la costa este de Estados Unidos, Texas; Quintana Roo, Mar de las Antillas y desde América Central hasta Brasil (Andrews, 1977). Área de estudio: se registró en todas las localidades de T. testudinum. En el manglar no fue muy abundante y se encontró preferentemente en la Boca de Puerto Real y al sur. Hábitat: temperaturas de 29 a 3 l°C, salinidad de 12.46 a 32.95%o; en diversos tipos de sedimento entre lodo-arenoso y arena lodosa con grava. Tellina alternata tayloriana Say. Es un excavador activo de la infauna superficial (Yonge y Thompson, 1976; Vermeij, 1978). Se le ha identificado desde las costas del estado de Texas, en Estados Unidos, hasta México [Tampico (Abbott, 1974; Andrews, 1977). Área de estudio: se encontró ampliamente distribuida en las localidades de pastos y en el manglar al noreste y sur de la laguna. Hábitat: temperaturas de 25 a 33°C, salinidad de 17.2 a 33.6%o; en sedimentos arenosos y areno-lodosos en Thalassia y lodo-arenoso en manglares. Chione cancellata (Linnaeus). Habita entre la infauna de bahías abiertas y en las cercanías de las bocas de ríos. Se le ha identificado en la costa este de Estados Unidos, del Golfo de México a Quintana Roo, Costa Rica, Mar de las Antillas y Brasil (Andrews, 1977). Área de estudio: se encontró ampliamente distribuida y abundante en las praderas de pastos marinos. Hábitat: temperatura de 27 a 33°C, salinidad de 17.2 a 34.5%o; en sedimentos donde predomina la arena. Tellina lineata (Turton). Esta especie habita mar adentro, lejos de la playa, en sedimentos lodosos y en ocasiones en la infauna de la vegetación sumergida de la Península de la Florida y Texas, en los Estados Unidos; en Yucatán, México: Mar de las Antillas y Brasil (Abbott, 1974; Andrews, 1977). Área de estudio: su distribución en la Laguna de Términos se restringe a las estaciones de manglar situadas al noreste y sur, donde es abundante. Hábitat: en temperaturas de 23 a 32°C, salinidades de 20 a 3 3.5%o y en sedimentos lodo-arenosos con grava. Anachis semiplicata Steams. Este gasterópodo carnívoro habita entre fragmentos de conchas y piedras de zonas arenosas. Su distribución se ha seiftalado en los estados de Florida y Texas en Estados Unidos y el de Yucatán en México (Andrews, 1977). Área de estudio: es una especie abundante en las zonas de Thalassia ubicadas al noreste de la laguna, en las inmediaciones de la Boca de Puerto Real. Hábitat: temperaturas de 27.5 a 33°C, salinidad de 12.46 a 34.5%o; en sedimento areno-lodoso, con grava. Las especies más abundantes y el número de organismos identificados en cada ambiente se presenta a continuación:  La distribución de estas especies en las zonas de pastos marinos fue variable; sin embargo, se observó una mayor concentración de organismos al sur de la Isla del Carmen. Sólo M. sanguinea se registró en las seis localidades de muestreo; la mayor abundancia por especie se obtuvo en la estación I. En el caso de los moluscos la mayor abundancia se encontró al suroeste de la Isla del Carmen. Lucina pectinata se identificó eníoda el área de estudio, sin embargo, fue más abundante en las estaciones 4, 5 y 6. Para los poliquetos la mayor abundancia se obtuvo en la estación II, con influencia marina, al sur de la laguna, en la que Capitella capitata, la especie más numerosa en el manglar, registró la mayor cantidad de organismos. Por el contrario, M.califiorniensis fue más abundante en la estación V, de influencia dulceacuícola, al suroeste de la Isla de¡ Carmen. En general hubo más moluscos en la estación II. Un factor que influye en la riqueza y abundancia de las especies es el tipo de sedimento. Al respecto, en zonas más arenosas como la costa sur de la Isla del Carmen, donde se desarrollan las praderas de T. Testudinun, se recolectó la mayoría de las especies más abundantes, En general, se observa que las poblaciones de poliquetos y moluscos se desarrollan en diferentes tipos de sedimento; sin embargo, la riqueza específica y la abundancia es menor cuando la proporción de lodo se incrementa, como en las estaciones 4 y 5. En las zonas de manglar el sedimento es principalmente lodoso, lo cual indica una baja velocidad de la corriente, que es de 6 a 17 cm/seg al sur y suroeste de la Isla del Carmen, y de 2 a 3 cm/seg al este (Yáñez-Arancibia et al., 1988), sobre todo en las estaciones V, II y III. La IV y I poseen mayor cantidad de arenas determinada por su cercanía a la Boca de Puerto Real y el flujo neto de agua en dirección este-oeste, que transporta sedimentos y materiales en suspensión. El establecimiento de los moluscos en los hábitats de manglar obedece a la presencia de algunas adaptaciones de las especies a condiciones extremas (VermeiJ, 1978; Cruz-Ábrego, 1991), como son sifones largos, conchas que faciliten el movimiento entre el sedimento, etc., que están presentes en las especies que habitan esas áreas, en este caso las dominantes, como L. pectinata. ConclusionesDe acuerdo con la abundancia y distribución de las especies de los taxa en estudio, se observó que el hábitat más adecuado para el desarrollo de las poblaciones de poliquetos y moluscos que habitan la Laguna de Términos son las praderas de Thalassia testudinum. Resultados similares a los aquí obtenidos se han reportado en la Florida y el Caribe por Heck y Orth (1980), Lewis y Stoner (1983), Zieman et al. (1984), Virnstein et al. (1984), etc. De este estudio se desprende que las especies más abundantes de poliquetos y moluscos en la Laguna de Términos tienen una extensa distribución en los dos ambientes, ya que toleran amplios intervalos de variación de los componentes ambientales del Golfo de México. Así también se sabe que las praderas de pastos están estrechamente relacionadas con los hábitats que las rodean y probablemente algunas especies tengan cierta migración entre ambos hábitats (Heck, 1977), propiciada por las variaciones ambientales que se registran durante el año. La reducida riqueza de especies de moluscos registrada en el manglar se atribuye a que el fondo es muy inestable y con poca solidez. Sólo Lucina pectinata fue abundante, ya que es una excavadora activa que se alimenta de detritos. Los fondos con altas proporciones de lodo afectan los procesos fisiológicos de las especies restantes que no toleran dichas condiciones: sus hábitos alimenticios y formas de vida no son adecuados para este hábitat. AgradecimientosLos autores manifiestan su agradecimiento a Eucario López-Ochoterena, Felipe Flores Andolais, Arturo Toledano; además a tres revisores anónimos por sus acertadas críticas y comentarios al escrito. Al personal de la Estación "El Carmen" del Instituto de Ciencias del Mar y Limnología por el apoyo logístico prestado durante los muestreos, en especial al Técnico Académico Andrés Reda Deara. LITERATURAABBOTT, R.T. American Seashells. The.Marine Mollusca of the Atlantic and Pacific Coast of North Ainerica Van Nostrand Reinhold Co. 2 ed. New York 1974 666 p. ANDREWS, J. Shells and Shores of Texas University of Texas Press. Austin and London. Austin, Texas 1977 365 p CRUZ-ÁBREGO, F.M. y V. SOLÍS-WEISS Memorias del IV Congreso Nacional de Zoología, I Estudio comparativo de los moluscos de las áreas de Tamiahua, Términos y Sonda de Campeche. Villahermosa, Tabasco 1987 91-97 13 al 16 de octubre de 1987 Tesis Dr. en Ciencias (Biología) Análisis de la distribución de los moluscos bentónicos en los abanicos costeros de los principales ríos del Golfo de México (Tuxpan, Papaloapan, Coatzacoalcos, Grijalva-San Pedro y San Pablo) y su relación con condiciones ambientales y sedimentos. Fac. Ciencias. Univ. Nal. Autón. México. 1991 103 p y 39 figs. DAY, J. H. A monograph on the Pol chaeta of Southern y Africa. Part 1 Errantia, Part 2 Sedentaria. Trustees of the British Museum (Natural History)1-458: 59-842. London 1967 ESCOBAR, E.G. Tesis maestría UACPyP-CCH. . Comunidades de maero invertebrados bentónicos en la Laguna de Términos, Campeche. Composición y estructura. Inst. Cienc. del Mar y Limnol. Univ. Nal. Autón. México 1984 191 p. ESPINOZA, M. G. Memorias del Seminario Organizado por la UNESCO Fauna sésil intermareal del manglar relacíonado con algunos parámetros ambientales de la Laguna de Términos, Campeche, México .Montevideo, 1 1980 102-120 EWING, R.M Final Report to the Minerals Managment Service, Contract 14-12001-29091. Chapter 14 Capitellidae. In: Taxonomic Guide to the Polychaetes of the Nortem Gulf of Mexico. Barry A. Vittor and Associates, Inc. Mobile, Alabama. 1984 FAUCHALD, K Natural History Museum of Los Angeles Country The polychaete worins, definitions and keys to the orders, families and genera. Sci., 8: 1977 188 p. FAUVEL, P Polychétes Errantes. Faune de France (5). Ed. Paris, Francia. Le Chevalier. 1923 488 p Polychetes Sedentaríes. Faune de France (16). Ed. Paris, Francia. Le Chevalier. 1927 494 p FOSTER, N. M. Studies on the Fauna of Curapao and other Caribbean Islands, 37 (129) Spionidae (Polychaeta) of the Gulf of Mexico and the Caribbean Sea. 1971 1-183 GARCÍA-CUBAS, A. Moluscos de un sistema lagunar tropical en el sur del Golfo de México (Laguna de Términos, Campeche). An. Inst. Cienc. del Mar y Limnol. Univ. Nal. Autón. México. Publ. Esp., 5: 1981 1-182 GATHOF, J. M. Final report of the Minerals Managment Service. Phyllocidae Chapier 19; Chrysopetalidae Chapter 26; Amphinomidae Chapter 37; Euphrosinidae Chapter 38; Onuphidae Chapter 39; Eunicidae Chapter 40; In: J.M. Uebelacker, and P.G. Johnson (Eds.). Taxonomie Guide to the Polychaetes of the Nortern Gulf of Mexico.Contract 14-12-001-29091. Barry A Vittor and Asociates Inc., Mobile Alabama. 1984. GRACIA-GASCA, A. y L.A. SOTO Populations study of the penaeíd shrimp of Terminos Lagoon, Campeche, Mexico. An. Inst. Cienc. del Mar y Limnol. Univ. Nal. Autón. México, 17 1990 (2): 241-256 GRAHAM, D.S., J.P. DANIELS, J.M. HILL y J.W. DAY Jr. A preliminary model of the circulation of Laguna de Terminos, Campeche. An. Inst. Cienc. del Mar y Limnol. Univ. Nal. Autón. México, 8 1981 (1): 51-62. HARTMAN, O. The littoral marine annelids of the Gulf of Mexico. Publ. Inst. Mar. Sci. Univ. Tex. 1951 2: 7-124. Catalogue of the polychactous annelids of the world. Part II. Allan Hancock Found. Occ. Pap., 3 1959 355-628 HECK, K.L., Jr. Marine Biology, 41 Comparative species richness, composition abundance of invertebrates in Caribbean seagrass (Thalassia testudinum) meadows (Panama). 1977 335-348 HECK, K.L., Jr. y O.S. WETSTONE Habitat complexity and invertebrate species richness and abundance in tropical seagrass meadows. J. Biogeograf., 4 1977 135-142 HECK, K.L. y R.J. ORTH Estuaries, 3 Structural components of seagrass (Zostera marina) meadows in the lower Chesapeake Bay-decapod Crustacea. 1980 289-295 HERNÁNDEZ-ALCÁNTARA, P. Tesis profesional ENEP-Zaragoza Variación anual de la macrofauna béntica asociada al mangle rojo (R-hizophora mangle) en la Laguna de Términos, México. Univ. Nal. Autón. México. 1985 105 p HERNÁNDEZ-ALCÁNTARA, P., F.M. CRUZ-ÁBREGO, A.L. IBÁÑEZ-AGUIRRE y V. SOLÍS-WEISS Comparative study of the polychaete and mollusk populations associated to mangroves and seagrass beds in a tropical mexican coastal lagoon in the Gulf of Mexico. Abstracts Joint Oceanographic Assembly. Acapulco, Mexico 1988 August 23-31, 1988. HERNÁNDEZ-ALCÁNTARA, P. y V. SOLíS-WEISS, Ecological aspects of the Polychaete populations associated with the red mangrove Rhizophora mangle at Laguna de Terminos, southern part of the Gulf of Mexico. Ophelia Suppl.,5 1991. 451-462 HUTCHINGS, P. y H. F. RECHER The fauna of Careel Bay with comments on the ecology of mangrove and seagrass communities. Aus. Zool., 18 (2): 1974. 99-128. IBÁÑEZ-AGUIRRE, A.L. y V. SOLÍS-WEISS Anélidos poliquetos de las praderas de Thalassia testudinum del noroeste de la Laguna de Términos, Campeche, México. Rev. Biol. Trop., 34 (1) 1986 35-47. LARA-DOMÍNGUEZ, G., J. VILLALOBOS y E. RIVERA EPOMEXSerie Científica, 1. Catálogo bibliográfico de la región de la Sonda de Campeche. . Univ. Autón. Camp. 1990. 150 p. LEWIS, F.G. III y A.W. STONER, Distribution of maerofauna within seagrass beds: an explanation for patterns of abundance. Bulletin of Marine Science, 33 (2) 1983. 296-304. MARRÓN, A. M.A. Tesis doctoral. Fac. Ciencias Estudio cuantitativo y sistemático de los poliquetos (Annelida: Polychaeta) bentónicos de la Laguna de Términos, Campeche, México. Univ. Nal. Autón. México. 1975. 143 p. MORTON, B., Physiology, Part 2 Feeding and digestion in Bivalvia.The Mollusca 5. Academic Press Inc. 1983. 65-148. PETTIBONE, M.H. Smithsonian Contrib. Zool. (109) Partial revision of the genus Sthenelais Kinberg (Polychaeta: Sigalionidae) with diagnosis of two new genera. 1971. 1-40. REVELES, G. M.B. Tesis profesional. Fac. Ciencias. Contribución al estudio de los anélidos poliquetos asociados a praderas de Thalassia testudinum en la porción este-sur de la Laguna de Términos, Camp. Univ. Nal. Autón. México. 1984. 170 p. SOLÍS-WEISS, V. y S. CARREÑO-LÓPEZ, An. Inst. Cienc. del Mar y Limnol. Estudio prospectivo de la macrofauna béntica asociada a las praderas de Thalassia testudinum en la Laguna de Términos, Campeche. Univ. Nal. Autón. México, 13 (3) 1986. 201-216. TAYLOR, J.L. Taxonomic Guide to the Polychaetes of the Northern Gulf of Mexico. Final Report to the Minerals. Managment Service, Contract 14-12-001-29091. Chapter 1. Orbiniidae; Chapter 31 Nereidae; Chapter 35 Nephtyidae. In: J.M. Uebelacker and P. G. Jolinson (Eds.). Barry A. Vittor and Associates, Inc. Mobile, Alabama. 1984. UEBELACKER, J.M. Taxonomic Guide to the Polychaetes of the Northem Gulf of Mexico. Final Report to the Minerais Managment Service, Contract 14-12-001-29091. Chapter 10 Heterospionidae; Chapter 17 Ophelidae; Chapter 24 Eulepethidae; Chapter 28 Hesionidae; Chapter 30 Syllidae; Chapter 41 Lumbrineridae; Chaper 42 Arabellidae; Chapter 51 Ampliaretidae; Chapter 54 Sabellidae. In: Barry A. Vittor and Associates, Inc.. Mobile, Alabama 1985. VARGAS, F. M. Tesis profesional. Fac. Ingeniería. Las corrientes y el transporte neto de agua en la Laguna de Términos, Camp. Univ. Nal. Autón. México. 1977. 94 p. VERMEU, G.J. Biogeography and Adaptation. Harvard University Press. 1978. 332 p. VIRNSTEIN, R.W., W.G. NELSON, F. G. LEWIS y R.K. HOWARD Estuaries, 7 Latitudinal patterns in seagrass epifauna: Do patterns exist, and Can they be Explained?,(4A). 1984. YÁÑEZ-ARANCIBIA, A., A.L. LARA-DOMÍNGUEZ, P. CHAVANCE y D. FLORES Ecology of coastal ecosystems in the southern Gulf of Mexico: Environmental behavior of Terminos Lagoon ecological system Campeche, Mexico.The Terminos Lagoon Region. In: A. Yáñez-Arancibia y J.W. Day Jr. (Eds.) Univ. Nal. Autón. México. 1988. 518 p. YONGE, C. M. y T.E. THOMPSON, Living Marine Mollusca. Willianis Collins Sons de. Ltd Glasgow. 1976. 270 p. ZIEMAN, J.C., S.A. MACKO y A.L. MILLS, Role of seagrasses and mangroves in estuarine food webs: temporal and spatial changes instable isotope composition and aminoacid content during decomposition. Bull. Mar. Sci., 35 (3) 1984. 380-392.
|

