|
MOLUSCOS DE LA LAGUNA PUEBLO VIEJO,VERACRUZ, MÉXICO: SISTEMÁTICA Y ECOLOGÍA MOLLUSK OF PUEBLO VIEJO LAGOON, VERACRUZ, MEXICO: SYSTEMATICS AND ECOLOGY
Martha Reguero y Antonio García-Cubas.
Trabajo recibido el 16 de agosto de
1993 y aceptado para su publicación el 28 de septiembre de 1993.
Laboratorio de Malacología, Instituto de Ciencias del Mar y
Limnología, UNAM. Apartado postal 70-305, México, D.F.04510,
MÉXICO.
En
este trabajo se describen las características sobresalientes de la
Laguna Pueblo Viejo, ubicada en el litoral del estado de Veracruz, y se
presentan los resultados del análisis efectuado sobre la comunidad de
moluscos que habita en ella. El cuerpo de agua, de acuerdo con los
parámetros hidrológicos registrados, es somero, con salinidades
que varían entre 18 y 25‰ lo cual le confiere un carácter
polihalino. Para el estudio de la malacofauna béntica se revisaron
15,564 ejemplares, recolectados en 22 localidades de muestreo. Se
encontró una comunidad constituida por 35 especies de las Clases
Gastropoda y Bivalvia, con una diversidad promedio de 1.85 bits/individuo y en
donde los cambios en los valores de este índice se explican en mayor
medida por las variaciones en la equitatividad. Las poblaciones de
gasterópodos que habitan esta laguna son en su mayoría
epifaunales, colectoras de depósito, en tanto que los bivalvos son
principalmente infaunales y se nutren de partículas suspendidas en la
columna de agua. Por otra parte, la presencia de especies comunes entre las
distintas estaciones de muestreo se manifiesta en un porcentaje promedio de
similitud, equivalente al 60% para el total de los
moluscos.
The
main characteristics of Laguna Pueblo Viejo on the coast of the siete of
Veracruz are described in this paper together with the results of the analysis
of the community of mollusks. With respect to the hydrological variables that
were resistered this lagoon is shaflow, and salinity varies between 18 and
25‰ which characterises it as polyhaline. ]le study of the benthic
malacofauna included the analysis of 15,564 organisms collected in 22 sampling
Tocantes. A community of 35 species of the classes Gastropoda and Bivalvia was
found, with an average- diversity of 1.85 bits/individual. Changes in the value
of this index are explained mainly by the variations in the equitability. The
gastropods that inhabit this lagoon are mainly epifaunal and deposit feeders,
whereas the bivalves are mainly infaunal and suspension feeders. The presence
of species in more than one sampling locality is reflected in an average
percentage of similarity of
60%.
Estuarios y lagunas conforman gran parte de la línea costera del litoral mexicano, especialmente en el Golfo de México; numerosas comunidades ribereñas se establecen en estos sistemas debido a que la fertilidad de sus aguas proporciona estabilidad pesquera, lo cual representa la principal actividad económica para los pobladores de esas áreas. Todo ello haría pensar que, dada su importancia, se tendrían amplios conocimientos sobre los diversos aspectos relacionados con la pesca, como hidrología, biología, contaminación, etc. No obstante, lo que se sabe en general de estos sistemas es muy pobre, o nulo en ocasiones. Debido a lo anterior, se emprendió el estudio de la fauna malacológica que habita en estos cuerpos de agua, como un programa a largo plazo del laboratorio de malacología, en el cual se han reunido los registros hidrológicos y malacofaunísticos de los diferentes sistemas lagunares del Golfo de México, como base de análisis ecológicos y biosistemáticos, con los que se han elaborado contribuciones parciales para esta revista. ANTECEDENTESLa revisión de los materiales bibliográficos que se refieren a esta área ha permitido identificar como antecedentes siete trabajos relacionados con ostricultura (De Buen, 1957; García, 1967, 1972, 1977: Camachoet al., 1980; Villarreal, 1980; García y Ramírez, 1981, la mayoría de ellos publicados en memorias de congresos y symposia; cinco artículos científicos sobre contaminación (Vázquez-Botello, 1978, 1979; Rosales-Hozet al., 1979; Rosales- Hoz y Álvarez León, 1979. Vázquez Botello y Mandelli, 1980), que no hacen referencia exclusiva a esta laguna, sino que su aplicación es válida para los diferentes sistemas estuarinos del Golfo de México, y seis que tratan otros aspectos, como análisis de plancton, ictiofauna, factores físicoquímicos y productividad (De la Lanza, 1965, 1966; Cruz Romero, 1973; Sánchez Hidalgo, 1974; Reséndez, 1981 y Contreras, 1984). DESCRIPCIÓN DEL ÁREA DE ESTUDIOEsta laguna se localiza al norte del estado de Veracruz se encuentra ubicada entre los paralelos 22ºO5'- 22º 13' de latitud septentrional y los meridianos 97º 50'- 97º 57' de longitud occidental. Se halla en el municipio de Villa Cuauhtémoc, en la parte oriental de la cuenca Tampico-Misantla, que limita geológicamente al norte con la Sierra de San Carlos, al sur con Tezuitlán y al occidente con la Sierra Madre Oriental (Contreras, 1985). La superficie que abarca el sistema lagunar es aproximadamente de 93.7 km², Con longitud de 15 km y anchura máxima de 9.5 km. Incluye varias islas pequeñas y una de 1 km de longitud, denominada Isleta Grande (Contreras, 1985). Con el propósito de estudiar la fauna malacológica se establecieron 22 estaciones de muestreo se efectuaron tres arrastres y se recolectó a mano en dos localidades (Fig. 1). 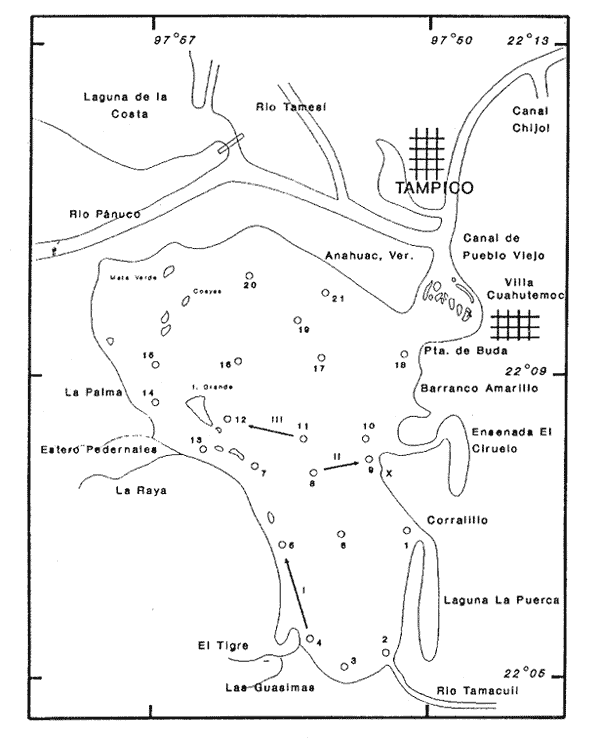 Figura 1. Toponimia y distribución de las estaciones de muestreo. CLIMATOLOGÍADe acuerdo con García (1988, 1990), el clima de la región es de tipo Aw 1, que corresponde a caliente subhúmedo, de humedad intermedia, con lluvias en verano, temperatura media anual entre 22 y 26ºC y un cociente de Lang (Precipitación/Temperatura) entre 43.2 y 55.3. No obstante, atendiendo a la clasificación citada por Contreras (1985), puede presentarse una oscilación de las temperaturas medias mensuales entre 7 y 14ºC, lo que le confiere un carácter extremoso (e). HIDROGRAFÍALa Laguna Pueblo Viejo se comunica hacia el noroeste con el Río Panuco mediante un canal, en donde confluyen las aguas del Río Tamesí. En el área desembocan los ríos La Tapada, Pedernales, Tigre, Guásimas, La Puerca y Tamacuil; este último es el más importante por su longitud. El sistema es tuarino-lagunar está integrado por ensenadas y lagunetas que protegen, tanto a la laguna como a la desembocadura del Río Pánuco, de azolves durante la temporada de "nortes" (Contreras, 1985). HIDROLOGÍAEl aporte principal de agua dulce procede del Río Pánuco, el cual condiciona en gran medida las características hidrológicas y fisicoquímicas del sistema; aunque las porciones occidental y sur se ven influidas por el flujo de los otros ríos y por escurrimientos temporales. El sistema recibe el aporte de aguas marinas mediante el canal de navegación Pueblo Viejo, localizado en la parte noreste de la laguna. BATIMETRÍAContreras (1985) la caracteriza como un sistema somero, con profundidad promedio menor a un metro en sus extremos y con máxima de 1.5 m en la zona central y canales de navegación. TRANSPARENCIAEn el área la turbiedad es elevada, con transparencia media de 0.18 m. TEMPERATURA DEL AGUALos valores mínimos y máximos registrados por Contreras (1985) son de 26.6 y 30.4ºC, respectivamente. SALINIDADEl mismo autor señala un intervalo halino entre 11.9 y 27.3‰ para el cuerpo lagunar. SEDIMENTOSEl sustrato predominante en la laguna es principalmente de tipo fino, constituido por limos y arcillas, aunque en algunas localidades se encuentra mezclado con concherío. VEGETACIÓNLas zonas de inundación están cubiertas en gran parte por mangle y tule;Conocarpus erecta (mangle blanco) es la especie dominante. La vegetación circundante está representada por matorrales y pastizales, debido al deterioro de las especies que conformaban la selva baja, propia de la zona (Contreras, 1985). MATERIAL Y MÉTODOSLa recolecta del material biológico y el registro de datos ambientales se llevaron a cabo durante una campaña realizada a la zona de estudio, en mayo de 1980, por personal del Laboratorio de Malacología del Instituto de Ciencias del Mar y Limnología, de la UNAM. La descripción del área estudiada se basó en información bibliográfica disponible, complementando algunos aspectos con las observaciones efectuadas durante el muestreo. Se hizo un reconocimiento del cuerpo de agua para excluir zonas con presencia de bancos de ostión y almeja, y se estableció una red de 22 estaciones, distribuidas en el sistema lagunar. En cada una de las localidades de muestreo se midió la temperatura, la salinidad -con un salinómetro de inducción Beckman- y la profundidad con una sondaleza de mano. Por medio de una draga van Veen, con capacidad de dos litros, se efectuaron las réplicas necesarias para extraer cinco litros de sedimento superficial húmedo. Los datos de salinidad registrados se utilizaron para elaborar el perfil halino del área, con base en la clasificación que García-Cubas propone para ambientes lagunares (Reguero et al.,1991). Los sedimentos obtenidos se tamizaronin situ, a través de una malla de plástico, con abertura de 1.5 mm. Las muestras se preservaron en bolsas de polietileno con formaldehído al 10%, neutralizado con borato de sodio y, debidamente etiquetadas, se trasladaron al Laboratorio de Malacología; allí se lavaron con agua corriente y se secaron a temperaturas inferiores a 70ºC. A los espéciménes recolectados vivos se les separó de los exoesqueletos para proceder a su identificación y cuantificación a nivel específico. En el caso de los bivalvos con conchas desarticuladas se adoptó el criterio de García-Cubas (1963), quien considera cada valva como un organismo. Para fines cualitativos, se efectuaron tres arrastres mediante una red biológica con boca de 300 cm² y malla de 2 cm, durante 5 min, a una velocidad promedio de 2 nudos; en otras dos localidades se recolectó a mano, con el fin de evitar alguna omisión a nivel específico. Las especies obtenidas fueron incluidas en la lista sistemática, aunque no se consideraron para el análisis cuantitativo de la comunidad, salvo que también se hubieran recolectado con draga van Veen, ya que las otras técnicas de captura no son las más adecuadas para ese propósito. Los ejemplares representativos se incorporaron a la colección malacológica del Instituto de Ciencias del Mar y Limnología, de la UNAM. La comunidad de moluscos se caracterizó mediante los componentes de abundancia, frecuencia y densidad de las especies (individuoS/m²) , de donde se derivó el valor de importancia relativo a cada una de ellas y el índice de similitud entre las estaciones de muestreo (Arcos, 1972). Lo anterior se complementó con indicaciones de distribución geográfica y local, mediante una revisión bibliográfica para tambíén determinar el tipo de nutrición y relación con el sustrato de cada una de las familias de moluscos identificadas. Asimismo, se calcularon los índices de diversidad (H´n), diversidad máxima (Hmáx), equitatividad (J) y riqueza de especies (D) para cada una de las clasés de moluscos por estación, por laguna y por ambiente halino, mediante las expresiones matemáticas propuestas por Shannon y Wiener (1963), Pielou (1975) y Margalef (1958), respectivamente. El análisis incluyó también la estimación de los coeficientes de determinación entre los valores de H'nvs. J y H'n vs. D, para establecer la diversidad de cada taxón; se trabajaron por separado la comunidad viva y la total. RESULTADOS
CONSIDERACIONES A LA SISTEMÁTICAA continuación se presenta la sistemática de las especies encontradas en el cuerpo lagunar, conforme al arreglo propuesto por Keen (1971). Las indicaciones sobre distribución geográfica, hábitat y tipo de nutrición fueron extraídas de Purchon (1968), Andrews (1971), Abbott (1974), García-Cubas (1981), Antolí y García-Cubas (1985), Reguero y García-Cubas (1989, 1991), García-Cubaset al., (1990), García-Cubas y Reguero (1990). Los organismos quedaron ubicados sistemáticamente en 2 clases, 11 órdenes, 24 familias, 31 géneros y 35 especies. SISTEMÁTICA DE MOLUSCOS PRESENTES EN LA LAGUNA PUEBLO VIEJO
Clase GastropodaSubclase Prosobranchia Orden Archaeogastropoda Superfamilia Neritacea Familia Neritidae GéneroNeritinaLamarck, 1816 1.Neritina reclivata(Say, 1822) Distribución local: estaciones 1, 8, 9, 12, 13, 15 y 19. Arrastre 1 y playa frente a la estación 9. 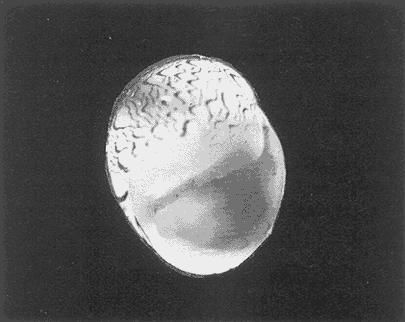 Distribución geográfica: de Florida (EE.UU. de A.), Golfo de México al Mar de las Antillas. Hábitat y tipo de nutrición: es una especie común en aguas salobres a dulces, frecuentemente se le encuentra sobre la vegetación sumergida, debido a sus hábitos micrófagos. SubgéneroVittaMörch, 1852 2.Nerkina (Vitta) virginea(Linnaeus, 1758) Distribución local: estaciones 5, 7, 10, 11, 17, 18, 19, 20 y 21. Arrastres 1 y 3, playa frente a la estación 9 y playa de los Mogotes. Distribución geográfica: de Florida hasta Brasil. Hábitat y tipo de nutrición: especie epifaunal entre la vegetación. Muy frecuente en zonas de intermareas y aguas salobres; micrófaga raspando la vegetación. 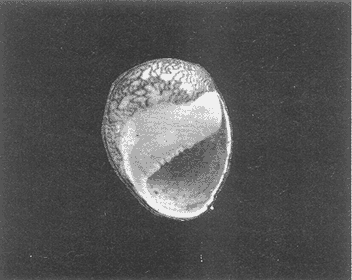 Orden Mesogastropoda Superfamilia Rissoacea Familia ? Hydrobiidae Género? HydrobiaHartman, 1821 3.? Hydrob¡a totteniMorrison 1954 Distribución local: estación 13. Distribución geográfica: de la Península del Labrador al Golfo de México. Hábitat y tipo de nutrición: especie epifaunal, abundante en aguas someras y estancadas; micrófaga, asociada con algas verdes. 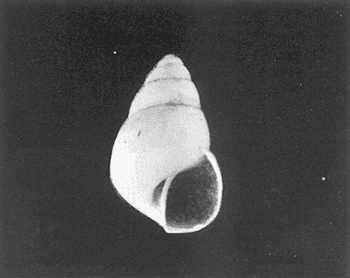 Género? LittoridinaEydoux y Souleyet, 1852 Subgénero ? TexadinaAbbott y Ladd, 1951 4.? Littoridina (Texadina) sphinctostoma Abbott y Ladd, 1951 Distribución local: estaciones 1, 3, 4, 5, 6, 7, 8, 9, 10, 11, 12, 13, 14, 15, 16, 17, 18, 19, 20, 21 y 22. Arrastres 1, 2, 3 y playa de los Mogotes. Distribución geográfica: de Mississippi a Texas (EE.UU. de A.) y Golfo de México. Hábitat y tipo de nutrición: es muy común en aguas someras y salobres hasta casi dulces; vive en fondos arenolímosos; epifaunal, se alimenta de materia orgánica depositada en el sustrato. 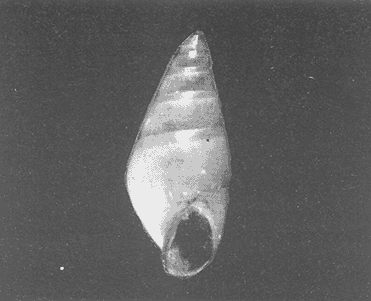 Género? PotamopyrgusStimpson, 1887 5.? Potamopyrgus coronatus(Pfeiffer, 1840) Distribución local: estaciones 1, 3, 6, 9, 13, 15 y 19. Distribución geográfica: Golfo de México, América Central y Mar de las Antillas. Hábitat y tipo de nutrición: especie epifaunal en aguas dulces a salobres de baja salinidad; raspadora de vegetación sumergida. 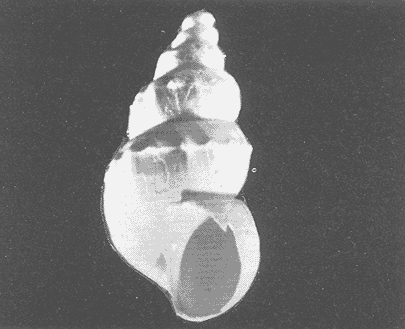 Familia Vitrinellidae Subfamilia Vitrinellinae GéneroVitrinellaC. B. Adams, 1850 SubgéneroVitrinella s. s. 6.Vitrinella (Vitrinella) floridana Pilsbry y McGinty, 1946 Distribución local: estación 5. Distribución geográfica: desde la Florida (EE.UU. de A.) hasta el sur del Golfo de México (Laguna de Términos, Campeche, México). Hábitat y tipo de nutrición: aguas someras; epifaunal entre rocas, microfagia de materia orgánica depositada. 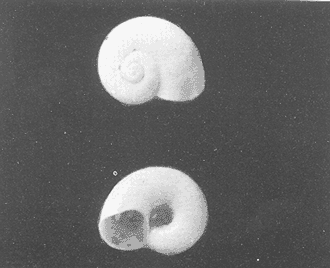 GéneroCyclostremiscusPilsbry y Olsson, 1945 SubgéneroPonocyclusPilsbry, 1953 7.Cyclostremiscus.(Ponocyclus) suppressus (Dall, 1889) Distribución local: estación 22. Distribución geográfica: costas de Florida y Texas (EE.UU. de A.); costas del Golfo de México. Hábitat y tipo de nutrición: especie de aguas someras, epifaunal sobre rocas o vegetación sumergida; herbívora.  Subfamilia Cerithiopsinae GéneroCerithiopsisForbes y Hanley, 1849 8.Cerithiopsis greeni(C. B. Adams, 1839) Distribución local: playa de los Mogotess. Distribución geográfica: de Cabo Cod a Brasil. Hábitat y tipo de nutrición: especie epifaunal de aguas costeras y lagunares; carnívora. 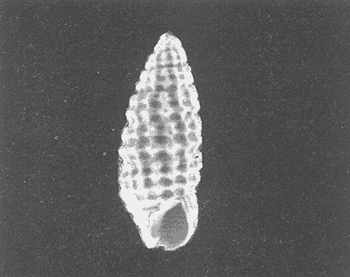 Subfamilia Diastominae GéneroDiastomaDeshayes, 1850 9.Diastoma varium(Pfeiffer, 1840) Distribución local: estación 13 y playa de los Mogotes. Distribución geográfica: comprende desde Maryland (EE.UU. de A.), costas del Golfo de México hasta Brasil. Hábitat y tipo de nutrición: epifaunal entre la vegetación sumergida en bahías y lagunas costeras: herbívora. 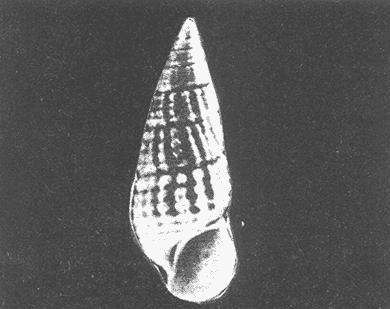 Familia Potamididae GéneroCerithideaSwainson, 1840 SubgéneroCerithideopsisThiete, 1929 10.Cerithidea (Ceyithideopsis) pliculosa (Menke, 1829) Distribución local: estaciones 1, 3, 5, 6, 9, 13 y 19. Arrastre 3, playa frente a la estación 9 y playa de los Mogotes. Distribución geográfica: desde Louisiana (EE.UU. de A.), Golfo de México a Centroamérica. Hábitat y tipo de nutrición: se encuentran en bahías y lagunas costeras donde predominan los pastos marinos; seminfaunales en fondos fangosos; se alimentan de materia orgánica depositada en el fondo. 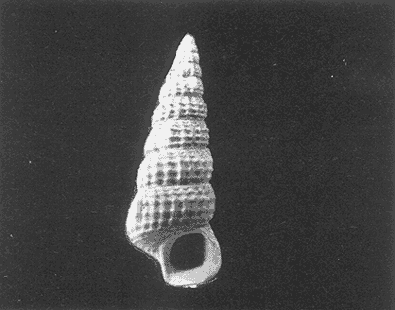 Superfamilia Calyptraeacea Familia Calyptracidae Subfamilia Crepidulinae GéneroCrepidulaLamarck, 1799 SubgéneroIanacusMörch, 1852 11.Crepidula (Ianacus) planaSay, 1822 Distribución local: estaciones 5, 8, 20 y 21. Arrastre 1 y playa de los Mogotes. Distribución geográfica: desde Canadá, costas del Golfo de México, Mar de las Antillas hasta Brasil. Hábitat y tipo de nutrición: especie epifaunal sobre objetos duros, en aguas marinas someras y salobres; se alimenta mediante filtración de partículas orgánicas en suspensión. 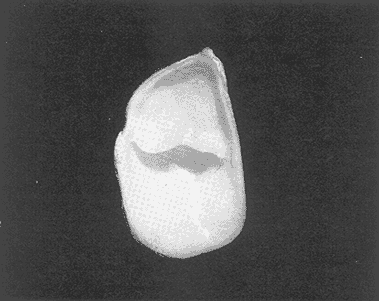 Superfamilia Naticacea Familia Naticidae Subfamilia Polinicinae GéneroPolinicesMontfort, 1810 SubgéneroNeveritaRisso, 1826 12.Polinices (Neverita) duplicatus (Say, 1822) Distribución local: frente a la estación 9 y en la playa de los Mogotes. Distribución geográfica: Massachusetts, Cabo Cod, Florida (EE.UU. de A.) y costas del Golfo de México. Hábitat y tipo de nutrición: se encuentran en la zona litoral, así como en aguas marinas profundas, en bahías y lagunas formando parte de la infauna; carnívoros y activos depredadores de bivalvos y otros caracoles. 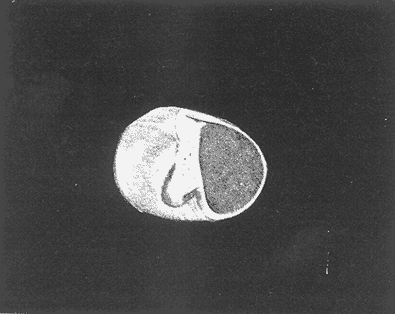 Orden Neogastropoda Superfamilia Muricacea Familia Thaididae GéneroThaisRöding, 1798 SubgéneroStramonitaSchumacher, 1817 13.Thais (Stramonita) haemastoma floridana (Conrad, 1837) Distribución local: playa de los Mogotes. Distribución geográfica: desde Carolina del Norte a Florida, costas del Golfo de México, el Mar Caribe hasta Brasil. Hábitat y tipo de nutrición: presente en aguas someras; epifaunal sobre rocas; carnívora. 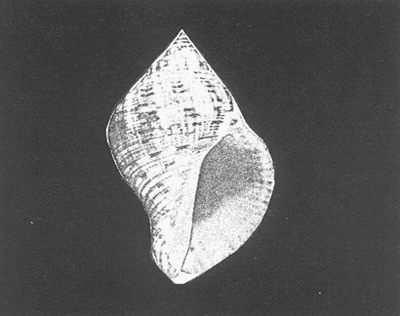 Superfamilia Buccinacea Familia Nassariidae GéneroNassariusDuméril, 1806 SubgéneroNassarius s. s. 14.Nassaris (Nassarius) vibex (Say, 1822) Distribución local: estación 19. Distribución geográfica: de Cabo Cod al Golfo de México y Mar de las Antillas. Hábitat y tipo de nutrición: Especie seminfaunal en sustratos arenosos y fangosos de bahías someras y lagunas; carnívora y ocasionalmente carroñera. 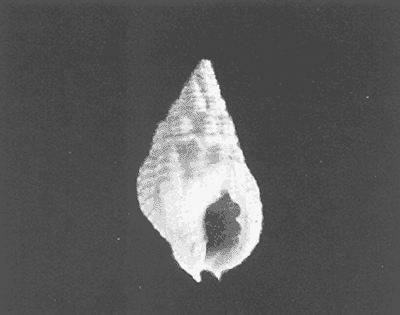 Superfamilia Conacea Familia Turridae Subfamilia Mangeliinae GeneroPyrgocytharaWoodring, 1928 15.Pyrgocythara plicosa(C. B. Adams, 1850) Distribución local: playa de los Mogotes. Distribución geográfica: Massachusetts, Cabo Cod, oeste de Florida y Texas (EE.UU. de A.), costas del Golfo de México. Hábitat y tipo de nutrición: organismos de aguas salobres, son frecuentes en bancos de ostión, en sustratos arenosos; epifaunales, carnívoros. 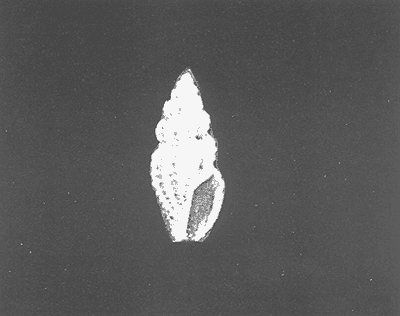 Subclase Opisthobranchia Orden Entomotaeniata Superfamilia Pyramidellacea Familia Pyramidellidae Subfamilia Odostomiinae GéneroOdostomiaFleming, 1813 16.Odostomia canaliculataC. B. Adamas, 1850 Distribución local: estaciones 9 y 21. Distribución geográfica: costas del Golfo de México y Mar de las Antillas. Hábitat y tipo de nutrición: organismos epifaunales en fondos de arena. Son ectoparásitos de otros moluscos; salobres y marinos de aguas someras. 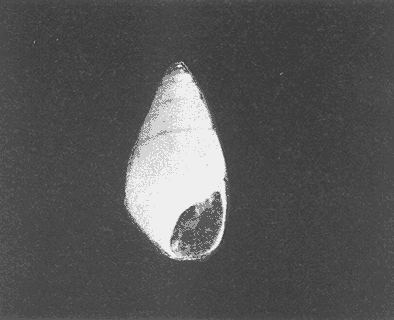 17.Odostomia weberiMorrison, 1965 Distribución local: estación 5. Arrastre 1. Distribución geográfica: desde Louisiana (EE.UU. de A.) hasta el sur del Golfo de México. Hábitat y tipo de nutrición: epifaunal de aguas salobres, especialmente en bancos ostrícolas, como ectoparásito. 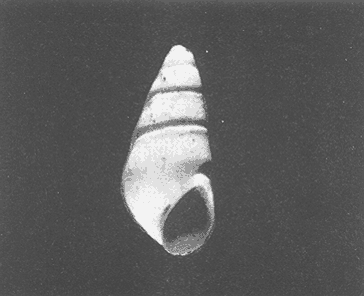 SubgéneroMenesthoMöller, 1842 18. Odostomia (Menestho) impressa (Say, 1822) Distribución local: estaciones 3, 5, 6, 7, 8, 9, 10, 11, 12. 13, 15, 17, 18, 19, 20, 21 y 22. Arrastres 1, 2, 3, playa frente a la estación 9 y playa de los Mogotes. Distribución geográfica: de Massachusetts a Florida y Golfo de México. Hábitat y tipo de nutrición: epifaunal, de aguas salobres, especialmente en bancos ostricolas, como ectoparásito.  Orden Cephalaspidea Superfamilia Acteonacea Familia Acteonidae GéneroActeonMontfort, 1810 19.Acteon punctostriautus(C. B. Adams, 1840) Distribución local: estación 15. Distribución geográfica: de Cabo Cod a Florida, Golfo de México y Mar de las Antillas. Hábitat y tipo de nutrición: especie infaunal en bahías y lagunas costeras; carnívora.  Familia Acteocinidae GéneroActeocinaGray, 1847 20.Acteocina canaliculata(Say, 1822) Distribución local: estaciones 3, 4, 5, 7, 8, 11, 13, 14, 15, 16, 18, 19 y 22. Playa de los Mogotes. Distribución geográfica: de Nueva Escocia a Florida, Golfo de México, Mar de las Antillas hasta Brasil. Hábitat y tipo de nutrición: especie epifaunal en bahías y lagunas costeras; carnívora. 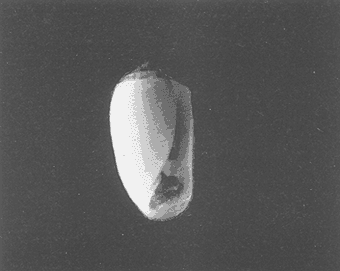 Subclase Pulmonata Orden Basommatophora Superfamilia Physacea Familia Physidae GéneroPhysaDraparnaud, 1801 21.Physa gyrina Say, 1821 Distribución local: estación 19. Distribución geográfica: aguas interiores de Canadá, desde las Islas Belcher al delta del Río Mackenzie; Grandes Lagos-San Lorenzo; Mississippi-Missouri y cuencas en el Golfo de México. Hábitat y tipo de nutrición: especie epifaunal en sustrato suave, asociada a plantas vasculares acuáticas sumergidas; herbívora.  Clase BivalviaSubclase Pteriomorphia Orden Arcoida Superfamilia Arcacea Familia Arcidae Subfamilia Anadarinae GéneroAnadaraGray, 1847 SubgéneroLarkiniaReinhart, 1935 22.Anadara ( Larkinia) transversa (Say, 1822) Distribución local: estación 21. Playa de los Mogotes. Distribución geográfica: desde el sur de Cabo Cod (EE.UU. de A.) al Mar de las Antillas; del Golfo de México a la Laguna de Términos, Campeche (México). Hábitat y tipo de nutrición: de la zona litoral hasta 11 m de profundidad; forma parte de la infauna; filtrante de partículas en suspensión. 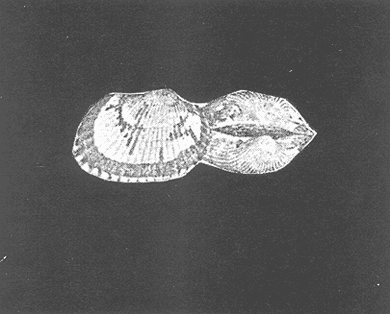 Familia Noetiidae Subfamilia Noetiinae GéneroNoetiaGray, 1857 SubgéneroEontiaMacNeil, 1938 23.Noetia (Eontia) ponderosa(Say, 1822) Distribución local: playa de los Mogotes. Distribución geográfica: desde Virginia (EE.UU. de A.) al Golfo de México. Hábitat y tipo de nutrición: forma parte de la infauna en aguas someras; suspensivora. 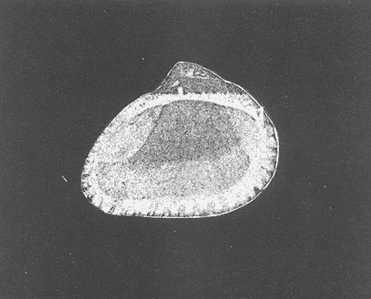 Orden Mytiloida Superfamilia Mytilacea Familia Mytilidae Subfamilia Mytilinae GéneroBrachidontesSwainson, 1840 SubgéneroHormomyaMörch, 1835 24.Brachidontes (Hormomya) exustus (Linnaeus, 1758) Distribución local: estaciones 2, 4, 5, 6, 7, 8, 9, 10. 12, 13, 15, 18, 19, 20 y 21. Arrastre 1. playa frente a la estación 9 y playa de los Mogotes. Distribución geográfica: de Carolina del Norte al Golfo de México, Mar de las Antillas hasta Brasil y Uruguay. Hábitat y tipo de nutrición: epifaunal, se fija mediante m biso, a rocas y bancos de ostión; muy frecuente en aguas someras salobres suspensívora. 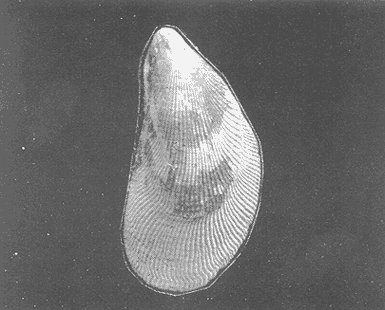 GéneroIschadiumJukes-Brown, 1905 25.Ischadium recurvum(Rafinesque, 1820) Distribución local: estaciones 1, 5, 7, 8, 9, 10, 11, 13, 18, 20 y 21. Arrastres 1, 2, 3 y playa frente a la estación 9. Distribución geográfica: Cabo Cod (EE.UU. de A.), Golfo de México y Mar de las Antillas. Hábitat y tipo de nutrición: forman parte de la epifauna en aguas salobres y someras, viven adheridas mediante un biso fibroso a rocas y bancos de ostras; filtran partículas suspendidas. 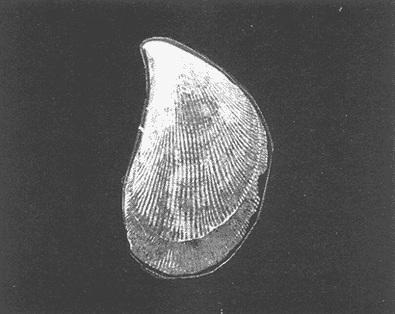 Orden Pteroidea. Suborden Ostreina Superfamilia Ostreacea Familia Ostreidae GéneroCrassostreaSacco 1897 26.Crassostrea virginica(Gmelin, 1791) Distribución local: estaciones 1, 2, 5, 6, 7, 8, 9, 10, 11, 17, 18, 19, 20, 21 y 22. Arrastres 1, 2, 3 y playa frente a la estación 9. Esta especie constituye numerosos bancos en diversas etapas de producción, distribuidos en el sistema lagunar. Distribución geográfica: desde el Golfo de San Lorenzo (Canadá) al Golfo de México y Mar de las Antillas. Hábitat y tipo de nutrición: especie característica de aguas salobres, se le encuentra en lagunas y esteros formando parte de la epifauna cementante; son filtrantes de particulas orgánicas en suspensión. 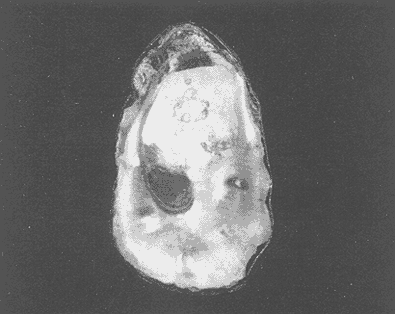 Superfamilia Corbiculacea Familia Corbiculidae GéneroPolymesodaRafinesque, 1820 27.Polymesoda carofiniana(Bosc, 1802) Distribución local: estación 13. Arrastre 1, playa frente a la estación 9 y playa de los Mogotes. Distribución geográfica: desde Virginia a Florida, Texas (EE.UU. de A.) y costas del Golfo de México. Hábitat y tipo de nutrición: en zonas estuarinas, forman parte de la infauna en fondos blandos; suspensívoros. 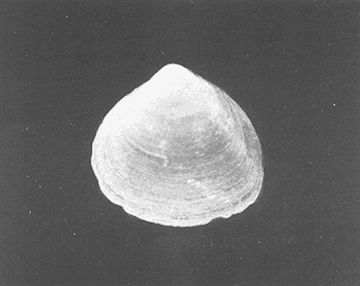 Subclase Heterodonta Orden Veneroida Superfamilia Dreisseniacea Familia Dreissenidae GéneroMytilopsisConrad 1858 28.Mytilopsis leucophaeata(Conrad, 1831) Distribución local: estaciones 1, 2, 3, 4, 5, 6, 7, 8, 9, 10, 11, 12, 13, 14, 15, 18, 19, 20, 21 y 22. Arrastres 1, 2, 3, playa frente a la estación 9 y playa de los Mogotes. Distribución geográfica: de Nueva York hasta Florida, Texas (EE.UU. de A.) y costas del Golfo de México. Hábitat y tipo de nutrición: especie epifaunal fija sobre rocas, de aguas dulces a salobres, se alimenta de partículas en suspensión.  Superfamilia Cyrenoidacea Familia Cyrenoididae GéneroCyrenoidaJoannis, 1835 29.Cyrenoida floridanaDall, 1889 Distribución local: estaciones 1, 2, 3, 4, 5, 8, 9, 10, 11, 12, 13, 14, 15, 18, 19, 21 y 22. Arrastres 1,2. Distribución geográfica: de las costas de Georgia (EE.UU. de A.) al Golfo de México. Hábitat y tipo de nutrición. comunes en aguas salobres a dulces; forman parte de la infauna superficial y son filtradores suspensívoros.  Superfamilia Veneracea Familia Veneridae Subfamilia Chioninae GéneroChioneMühlfeld, 1811 SubgéneroChione s. s. 30.Chione (Chione) cancellata (Linnaeus, 1767) Distribución local: playa frente a la estación 9. Distribución geográfica: de Carolina del Norte a Florida, Golfo de México, Mar de las Antillas hasta Brasil. Hábitat y tipo de nutrición: Especie infaunal en sustratos arenosos. de aguas someras; suspensívora.  Superfamilia Mactracea Familia Mactridae Subfamilia Mactrinae GéneroMuliniaGray, 1837 31.Mulinia lateralis(Say, 1822) Distribución local: estaciones 1, 2, 3, 4, 5, 6, 8, 9, 10, 11, 12, 13, 14. 15, 16, 17, 18, 19, 20, 21 y 22. Arrastres 1, 2, 3 y playa de los Mogotes. Distribución geográfica: desde Maine hasta el Golfo de México. Hábitat y tipo de nutrición: especie infaunal de sustratos arenosos y fangosos, en aguas someras templadas y cálidas; suspensívora.  GéneroRangiaDesmoulins, 1832 SubgéneroRangianellaConrad, 1863 32.Rangia (Rangianella) flexuosa(Conrad, 1839) Distribución local: estaciones 1, 9 y 14. Arrastre 1, playa frente a la estación 9 y playa de los Mogotes. Distribución geográfica: de Louisiana (EE.UU. de A.) hasta el sur del Golfo de México. Hábitat y tipo de nutrición: especie infaunal en sustratos blandos, en aguas salobres influidas por ríos. Nutrición mediante partículas orgánicas en suspensión.  Superfamilia Tellinacea Familia Tellinidae Subfamilia Macominae GéneroMacomaLeacb, 1819 33. Macoma tenta (Say, 1834) Distribución local: estaciones 1, 6, 14, 19, 21 y 22. Arrastre 1. Distribución geográfica: de Cabo Cod a Florida, Islas Bermudas, Golfo de México hasta Brasil. Hábitat y tipo de nutrición: especie infaunal de aguas someras; se alimenta de partículas depositadas en el sustrato.  SubgéneroRexithaerusTryon 1869 34. Macoma (Rexithaerus) mitchelli Dall, 1895 Distribución local: estaciones 3, 4, 112. 15 y 16. Distribución geográfica: de Carolina del Sur (EE.UU. de A.) hasta el sur del Golfo de México. Hábitat y tipo de nutrición: frecuente en lagunas y esteros con influencia de ríos, forma parte de la infauna; se alimenta de materia orgánica depositada en el fondo.  Orden Myoida Superfamilia Myacea Familia Corbulidae GéneroCorbulaBruguière, 1792 SubgéneroCaryocorbulaGardner, 1926 35.Corbula (Caryocorbula) swiftianaC. B. Adams, 1852 Distribución local: estaciones 21 y 22. Distribución geográfica: de Massachusetts a Florida, Texas (EE.UU. de A.); Golfo de México, Mar de las Antillas. Hábitat y tipo de nutrición: forman parte de la infauna en fondos arenosos de márgenes de bahías y áreas protegidas con influencia marina; suspensívoros.  HIDROLOGÍALos registros de temperatura, salinidad y profundidad en el área variaron de 27 a 33.1oC, de 18.2 a 24.8 ‰ y de 0.60 a 1.20 m, respectivamente. En la tabla 1 se concentran los datos detallados de estos parámetros, para cada una de las estaciones de muestreo. La ausencia del perfil halino correspondiente a esta laguna se debe a que la salinidad registrada durante la época de muestreo, mayo de 1980, la caracteriza en su totalidad como un ambiente polihalino de tipo "A" (18-25‰ ). 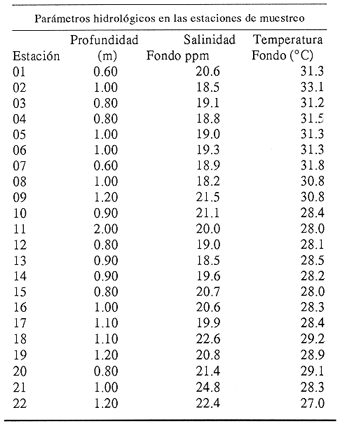 TABLA 1 ANÁLISIS CUANTITATIVO Y PORCENTUALEn el ecosistema estudiado se identificaron 21 especies de la Clase Gastropoda y 14 se ubicaron en la Clase Bivalvia. De un total de 35 especies, sólo 6 (Cerithiopsis greeni, Polinices duplicatus, Thais hemastoma floridana, Pyrgocythara plicosa, Noetia ponderosa yChione cancellata)se excluyeron del análisis cuantitativo por haber sido capturadas manualmente o con red de arrastre biológica y no mediante draga van Veen (Tabla 2).  TABLA 2 En un total de 22 estaciones de muestreo se cuantificaron 15,564 individuos, de los cuales 220 (1.4%) fueron capturados vivos y 15,344 (98.6%) correspondieron a conchas vacías. Por lo que se refiere a la abundancia (Tabla 3), la Clase Bivalvix representó el 51.4% (7,994 ejemplares) del total de organismos recolectados y en la Clase Gastropoda el valor porcentual resultó de 48.6% (7,570 individuos). 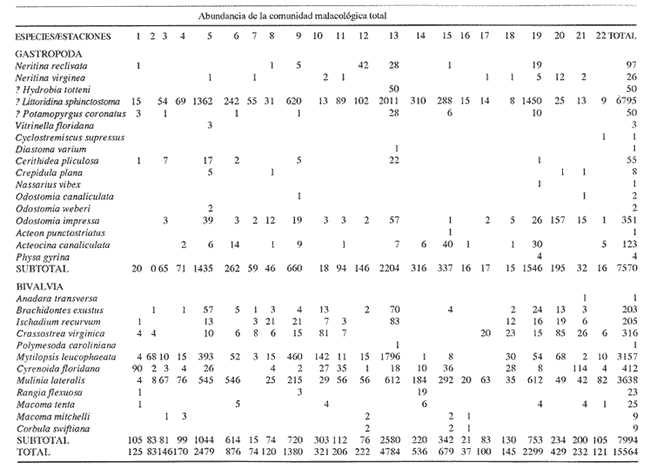 TABLA 3 Las estaciones con mayor cantidad de especímenes fueron la 15 y la 5, con 4,784 y 2,479 individuos, respectivamente; mientras que el menor número de organismos se registró en las estaciones 16 (37 ejemplares) y 7 (74 ejemplares). Las estaciones con el número más elevado de especies fueron la 19, 5, 9, 13 y 21, con 16 en la primera y 14 en cada una de las restantes; en las que se capturó menor cantidad fueron la 16, con 4 especies, así como la 2 y 17, con 5 en cada caso. De las 29 especies a las que se les aplicó análisis cuantitativo, ocho (27.6%) tuvieron representantes vivos, todas ellas pertenecientes a la Clase Bivalvia; hubo mayor abundancia en las estaciones 1, 21 y 5 (Tabla 4).  TABLA 4 ESPECIES CARACTERÍSTICAS DEL ÁREA DE ESTUDIOEn la laguna se localizaron áreas donde especies de ostión y almeja(Crassostrea virginicay Rangia cuneata)constituyen bancos que son explotados re gionalmente. Sin embargo, tanto en la recolección de las muestras como en los resultados que se exponen a continuación, se eliminaron esas poblaciones y se encontró que entre los moluscos bellacos más impor tantes, por su abundancia, frecuencia y densidad en el cuerpo lagunar (Tablas 5 y 6), figuran las especies siguientes.  TABLA 5 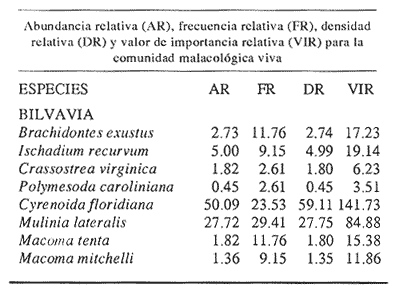 TABLA 6 COMUNIDAD MALACOLÓGICA TOTAL:? Littoridina sphinctostoma Mulinia lateralis Mytilopsis leucophaeata Cyrenoida floridana Odostomia impressa Crassostrea virginica. Esta comunidad agrupó al 94.2% del total de individuos recolectados; las tres primeras fueron más importantes (87.3 %) que el resto de las especies en conjunto. COMUNIDAD MALACOLÓGICA VIVA:Cyrenoida floridana Midinia lateralis En estostaxa se cuantificó al 86.8% del total de individuos vivos; quedó incluida más de la mitad en la primera especie. ÍNDICES DE SIMILITUDCon el fin de establecer una relación de la distribución y asociaciones de las especies que integran la comunidad de moluscos, se aplicó porcentualmente el índice de similitud de Krebs (1972), el cual permite evaluar la semejanza entre los componentes de las muestras o estaciones del sistema. Con los valores obtenidos de comparar la concurrencia de especies en las diferentes localidades de muestreo, se elaboraron diagramas de enrejado referentes a las comunidades malacológicas total y viva, se confrontó la afinidad para las Clases Gastropoda y Bivalvia, así como la del phylum. en conjunto. Las figuras 2 y 3 muestran gráficamente grupos de estaciones con porcentajes de similitud comprendidos en los intervalos de 0 a 24, 25 a 49, 50 a 74 y 75 a 100, así como el porcentaje que representan con respecto al número total de combinaciones posibles. COMUNIDAD MALACOLÓGICA TOTAL:Con base en las especies de gasterópodos identificadas, la semejanza calculada para las estaciones de muestreo (Fig. 2A) indica que 51.4% ocupa el intervalo 50-74, con 108 combinaciones, de un total de 210; 33.3%, con 70 combinaciones, se encuentra en el rango 25-49; 14.8% en el intervalo 75-100, con 31 combinaciones, y 0.5%, con 1 combinación, dentro del rango 0-24. El valor medio de afinidad para este conjunto es de 55.6%. Considerando al total de bivalvos, la semejanza calculada entre pares de estaciones, a partir de 231 combinaciones posibles (Fig. 2B), muestra que el 49.8% se ubica dentro de los límites 50-74, con 115 combinaciones; el 33.8% en el intervalo 75-100, con 78 combinaciones; el 13.4% en el rango 25-49, con 31 combinaciones, y 3% dentro del intervalo 0-24, con 7 combinaciones. En este caso la semejanza media es de 65.5%. 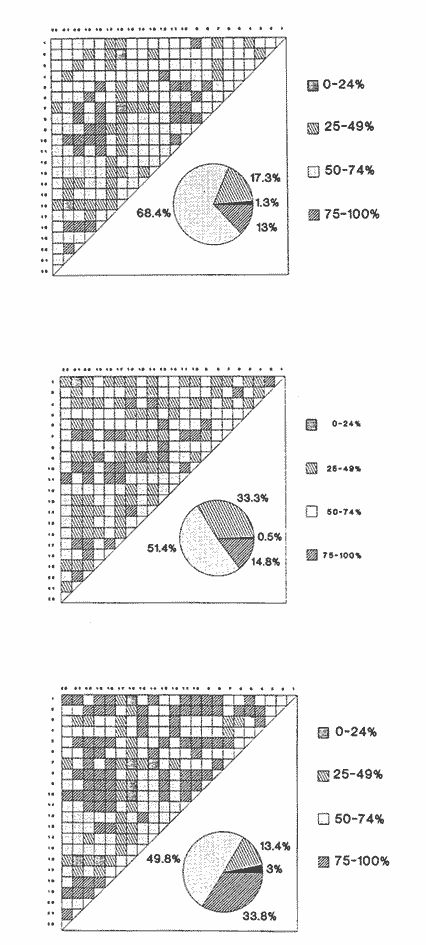 Figura 2. Diagramas de enrejado de similitud entre estaciones de muestreo para la comunidad malacológica total. A) Clase Gastropoda, B) clase Bivalvia, C) Phylum Mollusca 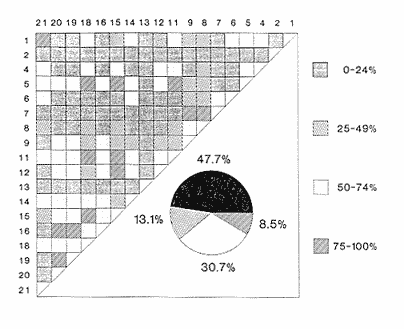 Figura 3. Diagrama de enrjado de similitud entre estaciones de muestreo para la comunidad malacológica viva de la Clase Bivalvia Al considerar la similitud del phylum en conjunto (Fig. 2C), se observa que la matriz de estaciones incluye 231 combinaciones posibles, de las cuales 158 representan 68.4% y corresponden al rango de 50-74; 40 agrupan al 17.3% y se ubican en el intervalo 2549; 30 equivalen al 13%, en los límites de semejanza 75-100, y sólo el 1.3%, con 3 combinaciones, tienen una afinidad de 0-24. El promedio de similitud para todo el conjunto de estaciones es de 59.9%. COMUNIDAD MALACOLÓGICA VIVA:Las formas vivas capturadas en esta laguna se identificaron en su totalidad como pertenecientes a la Clase Bivalvia, de manera que el cálculo de los porcentajes de afinidad se efectuó solamente para los miembros de esa categoría taxonómica. Si se considera a la comunidad viva de la Clase Bivalvia (Fig. 3), la semejanza resultante indica que de las 153 combinaciones posibles, dadas por la cantidad total de estaciones, 47.7% se ubica en el rango 0-24, con 73 combinaciones; 30.7% corresponde al intervalo 50-74, con 47; a los rangos de 25-49 y 75-100 corresponden porcentajes de 13. 1 % y 8.5%, con 20 y 13 comrespectivamente. La similitud promedio para todo el conjunto de estaciones es de 30.2%. 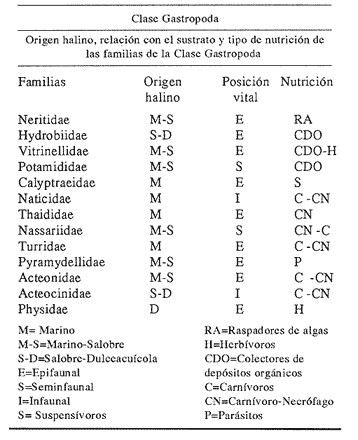 TABLA 7 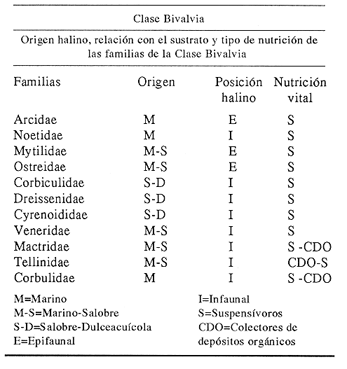 TABLA 8 NUTRICIÓN Y HÁBITATEn las tablas 7 y 8 se enlistan las familias de moluscos presentes en el sistema lagunar, relacionándolas con su origen halino, posición respecto al sustrato y tipos de nutrición, de acuerdo con la información bibliográfica (Purchon, 1968; Andrews, 1971; Abbott, 1974; García-Cubas, 1981; Pistola y García-Cubas, 1985; Reguero y García-Cubas, 1989, 1991; Garcia-Cubas et al., 1990; García-Cubas y Reguero, 1990). En la tabla 9 se incluye el número y porcentaje, tanto de familias como de especies, asignados a cada rubro. 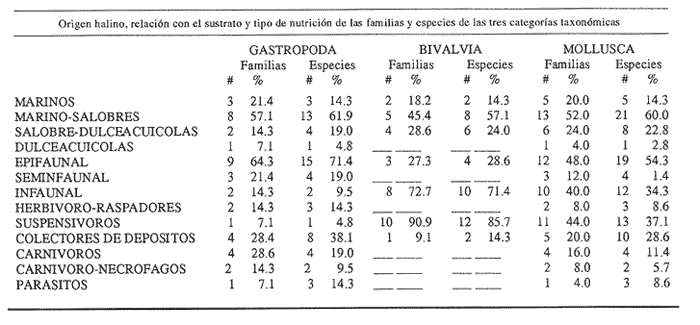 TABLA 9 En los trestaxa analizados para esta área se observa que abundan las especies de origen marino-salobre.  TABLA 10.  Figura 4. Indices de diversidad máxima (Hmáx), diversidad (H'n), equitatividad (J) y riqueza de especies (D) para la comunidad malacológica total. 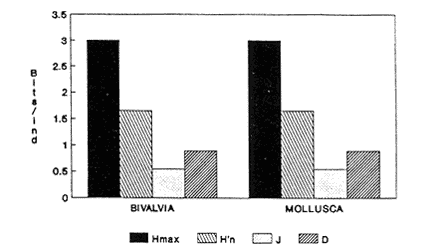 Figura 5. Indices de diversidad máxima (Hmáx), diversidad (H,n), equitatividad (J) y riqueza de especies (D) para la comunidad malacológica viva. 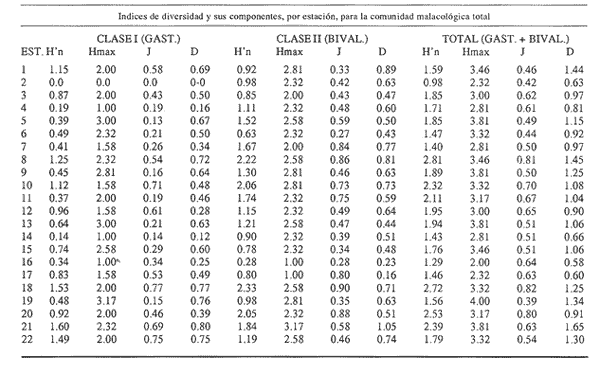 TABLA 11. Respecto a su relación con el sustrato, el phylum en conjunto y la Clase Gastropoda incluyen un porcentaje mayor de formas epifaunales, mientras que en la Clase Bivalvia abundan las especies infaunales. El tipo de nutrición más frecuente, tanto para el phylum como para la Clase Bivalvia, corresponde a la filtración de partículas suspendidas, mientras que la mayoría de los gasterópodos son colectores de depósitos. 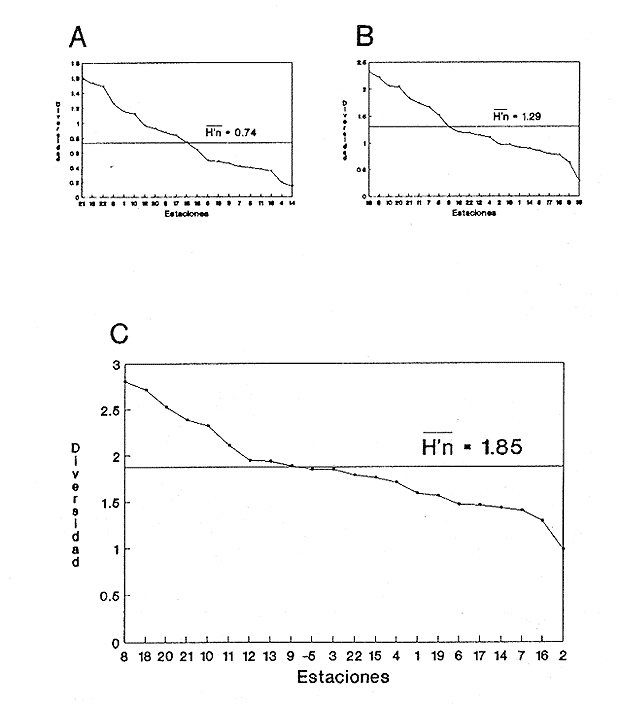 Figura 6 . Curvas de valores de diversidad en cada estación de muestreo, para comunidades totales. A) Clase Gastropoda. B) Clase Bivalvia, C) Phylum Mollusca DIVERSIDADEl análisis de la estructura comunitaria a partir de los índices de diversidad (H´n), diversidad máxima (Hmáx), equitatividad (J) y riqueza de especies (D) se llevó a cabo tanto de manera general, considerando la suma de organismos vivos y muertos, como enforma particular, tomando en cuenta sólo los ejemplares recolectados vivos.  TABLA 12. 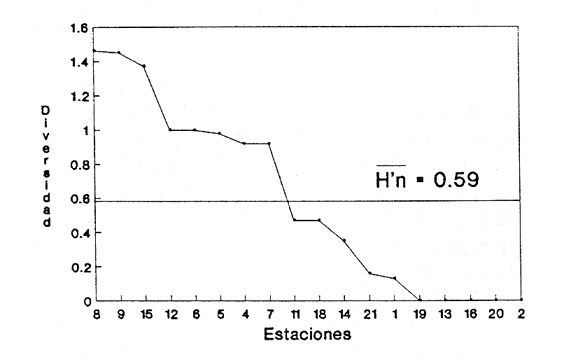 Figura 7. Curva de valores de la diversidad en cada estación de muestreo, para la comunidad viva de la Clase Bivalvia. En los dos casos, los registros más altos se observan en el phylum; respecto a las clases, los índices más elevados corresponden a los bivalvos, y nulos a las comunidades vivas de la Clase Gastropoda, por lo que los resultados son los mismos en poblaciones vivas de moluscos y en las de bivalvos (Tabla 10; Figs. 4 y 5). El análisis de resultados en cada una de las estaciones de muestreo indica que, entre las poblaciones totales de moluscos (vivos + muertos), la diversidad se determinó en un intervalo de 0.19 a 1.60 bits/individuo en la Clase Gastropoda, de 0.28 a 2.33 en la Clase Bivalvia y de 0.98 a 2.81 el Phylum Mollusca, con medias de 0.74, 1.29 y 1.85. respectivamente. La equitatividad presenta fluctuaciones que van de 0.13 a 0.77, de 0.27 a 0.90 y de 0.39 a 0.82, mientras que la riqueza de especies registró valores en intervalos de 0.12 a 0.80, de 0.16 a 1.05 y de 0.60 a 1.65 bits/individuo, según el conjunto analizado (Tabla 11; Fig. 6 A-C). 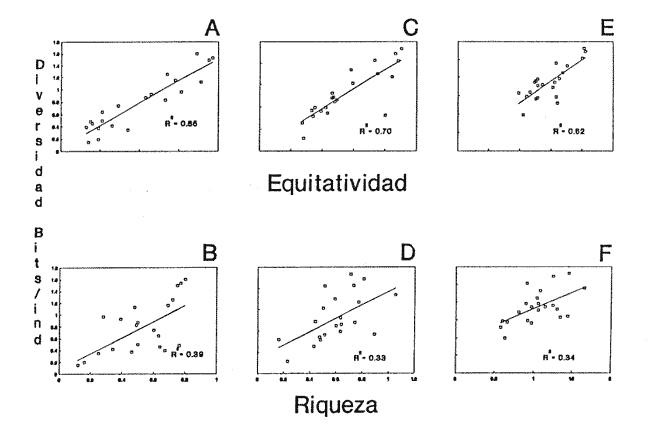 Figura 8. Coeficientes de determinación (R) entre la diversidad y los componentes de equitatividad y riqueza de especies, para comunidades totales.A-B) Clase gastropoda, C-D) Clase Bivalvia, E-F) Phylum Mollusca 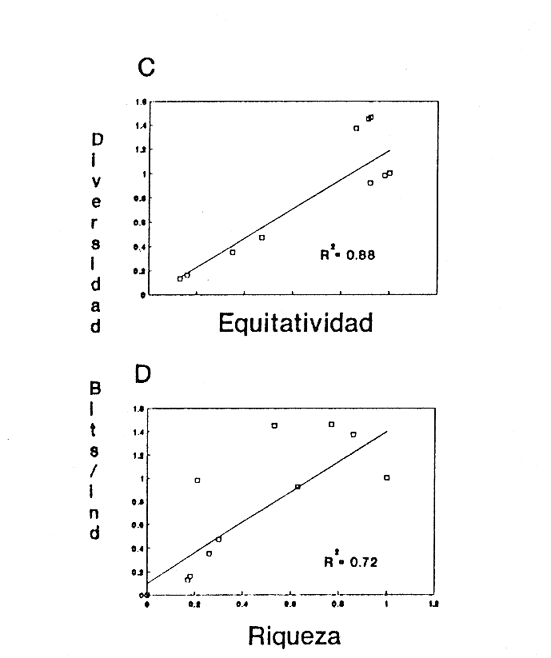 Figura 9. Coeficientes de determinación (R) entre la diversidad y los componentes de equitatividad y riqueza de especies, para comunidades vivas. 8C-D) Clase Bivalvia. En cambio, en el caso de la comunidad viva no se identificó ningún miembro de la Clase Gastropoda, por lo que la diversidad mostró resultados de 0 a 1.46 bits/individuo para la Clase Bivalvia, con una media de 0.59; la equitatividad fue de 0 a 1, al igual que la riqueza específica (Tabla 12; Fig. 7). Por otra parte, los coeficientes de determinación (R 2 ) entre H'nvs. J y H'n vs. D señalan que la equitatividad explica en un porcentaje mayor los cambios en la diversidad calculada, tanto para la comunidad total como para la viva (Figs. 8 A-F y 9 C-D). El comportamiento espacial de la diversidad se determinó, también, con base en su variación por ambiente halino, observándose que la salinidad registrada en las diferentes estaciones de muestreo, durante la época de sequía, define el área lagunar en su totalidad como un ambiente polihalino de tipo "A" (18-25‰ Es por ello que los valores de diversidad extraidos en el análisis general (vivos + muertos), al igual que en el de vivos, se conservan debido a la imposibilidad de agrupar las estaciones conforme a diferencias marcadas en el régimen halino. DISCUSIÓN Y CONCLUSIONESLos resultados de temperatura y profundidad concuerdan con los reportados por Contreras (1985) para el área de estudio, se observa que los valores térmicos registrados en el fondo son muy similares a los de la superficie. Con base en la salinídad determinada durante el muestreo y adoptando el criterio de García-Cubas (Regueroet al., 1991), Pueblo Viejo se caracteriza como un cuerpo lagunar polihalino de tipo "A" (18.2-24.8‰ Sin embargo, Contreras (1985) señala un régimen que varía desde el mesohalino "B" hasta el polihalino "B" (11.9-27.3‰. Esta diferencia se atribuye a que los valores señalados por Contreras se refieren a un ciclo anual, mientras que los anotados aquí son producto de registros instantáneos y puntuales efectuados en época de sequía (mayo). Respecto a la transparencia del agua, se obtuvo un valor promedio de 18 cm y se aprecia que se trata de un sistema de elevada turbiedad, con alto contenido de materiales en suspensión. En general, los datos obtenidos de parámetros y muestran uniformidad, tanto en su distribución horizontal como en la vertical, lo cual indica la ausencia de un patrón de estratificación. Es importante destacar la función que la índole del sedimento ejerce en la comunidad en estudio. En este caso, el sustrato estaba constituido principalmente por limos y arcillas combinados con conchas, los cuales están ligados íntimamente a los hábitos de vida de los moluscos que se establecen en él. Por otra parte, se tiene conocimiento de que la producción de ostión(Crassostrea virginica) en el área ascendía a casi 5,000 toneladas en el año en que se efectuó el muestreo (Departamento de Pesca, 1980). No obstante, ésta ha decrecido en cantidad y calidad a causa de la contaminación por bacterias coliformes, procedentes de descargas de aguas negras de las ciudades de Tampico, Ciudad Madero y Villa Cuauhtémoc (Contreras, 1985). En lo que concierne al análisis de abundancia en la comunidad malacológica total, ésta fue similar entre miembros de las Clases Gastropoda y Bi- en tanto que en la comunidad viva sólo se identificaron organismos pertenecientes a este último taxón. Las estaciones en las que la diversidad y abundancia son elevadas se ubican en zonas influidas por agua dulce procedente de los ríos y cuerpos de agua circundantes, rica en materia orgánica, o en áreas cercanas a la desembocadura del Río Pánuco en donde la marea deja sentir su efecto hacia la parte interna de la laguna, lo cual le confiere características de estuario a esa región. Además, el patrón de circulación del agua permite tanto la redepositación de remanentes esqueléficos como el transporte y establecimiento de formas vivas. Por otra parte, la Clase Bivalvia exhibe una variedad restringida de relaciones con el sustrato y tipos de alimentación: los hábitos infaunales y suspensivoros son dominantes en ese conjunto, tanto a nivel de familia como de especie (cfr. Tabla 9), y se ven favorecidos por las características ambientales de esta laguna costera. El predominio de las especies ?Littoridina sphinctostoma, Mulinia lateralis, Mytilopsis leucophaeata, Cyrenoida floridanayOdostomia impressa se refleja no sólo en el número de individuos, sino también en la amplia distribución que tienen dentro de la laguna. En el caso de Littoridina sphinctostoma, su abundancia relativa elevada y distribución amplia obedecen a que es una forma común en aguas someras, salobres a dulces y en fondos arenolimosos, requerimientos ambientales que concuerdan con las características del área. Mulinia lateralisyCyrenoida floridana tuvieron mayor abundancia en estaciones con influencia fluvial, que favorece a estas especies características de aguas salobres de baja salinidad típicas de la laguna. Además, esta región ofrece el sustrato limoarcilloso adecuado para inf auna somera. La distribución de formas vivas de las especies Mytilopsis leucophaeatay Odostomia impressa concuerda generalmente con la de los bancos ostrícolas, y cuando se trata de exoesqueletos se les localiza en áreas lagunares cercanas a ellos, por efecto de redepositación postmortem y debido a su condición epifaunal o parásita, respectivamente. El cálculo de similitud entre pares de estaciones sumistra valores altos de este índice en localidades marcadas por la presencia de especies abundantes y de distribución amplia, como ? Littoridina sphinctostoma, Odostomia impressa, Mulinia lateralis, Mytilopsis leucophaeata, Cyrenoida floridanayCrassostrea virginica; en cambio, las especies del géneroNeritina y otras como ? Potamopyrgus coronatus, Cyclostremiscus suppressusyCerithidea pliculosa,que son menos abundantes y de distribución restringida, aportan semejanzas menores debido a su baja concurrencia en las distintas estaciones de muestreo. Es importante señalar que aunque los gasterópopresentan una cantidad mayor de especies en relación con los bivalvos, estos últimos los superan por más del 40% en la cantidad de información que aportan al sistema y cuyo valor, expresado en bits/individuo corresponde al índice de diversidad. En consecuencia, la equidad en la distribución de los individuos al interior de las especies de la Clase Bivalvia es más grande que en las correspondientes de la Clase Gastropoda. Por tanto, la dominancia de algunas especies es la condición que explica en mayor medida los cambios en la diversidad, tanto de la comunidad total como de la viva. AgradecimientosLos autores tienen en gran aprecio la ayuda del M. en C. Gerardo Barrientos Mac Gregor en la preparación del material gráfico y agradecen la participación de los Biólogos Francisco Escobar de la Llata y Vicente Antolí Figuerola durante el trabajo de campo. LITERATURAABBOTT, R. T., American seashells. The marine Mollusca of the Atlantic and Pacific coast of North America.Van Nostrand Reinhold Co.,2a. ed.,New York,1974.666 p. ANDREWS, J., Sea shells of the Texas coast.University of Texas Press, Austin,1971.298 p. ANTOLÍ, F. V. y A. GARCÍA-CUBAS, An. Inst. Cienc. del Mar y Limnol. Sistemática y ecología de los moluscos en las lagunas costeras Carmen y Machona, Tabasco, México.Univ. Nal. Autón. México,1985.145-198.12(1): CAMACHO, B. E., M. PALACIOS, M. CORTINA, E. AGUILAR, H. ZAMUDIO y H. GARCÍA, Mem. II Simp. Latinoamer. AcuaculturaResultados preliminares al cultivo del ostión en la laguna de Tamiahua, Pueblo Viejo y Tampamachoco, Ver.1980.897-942. CONTRERAS, E. F., Lagunas costeras y su productividad potencial: el caso del estado de Veracruz. Reunión Nal. de Inv. y Tecnol. Pesquera. México, D. F.,1984.Noviembre, 1984 CONTRERAS, E. F., Las lagunas costeras mexicanas.Centro de Ecodesarrollo,Secretaría de Pesca, D. F.,1985.253 p. CRUZ ROMERO, M., Rev. Soc. Mex. Hist. Nat.,Análisis parcial del microplancton de la laguna de Pueblo Viejo, Ver., México.1973.327-368.34: DE BUEN, F., Crisis ostrícola en México y su recuperación. Sría. de Marina, Dir. Gral. Pesca e Ind. Conexas, México,1957.1-46.5: DE LA LANZA, E. G., Tesis Profesional. Estudio preliminar de algunos factores físicos y químicos de las aguas costeras de Veracruz, Ver.Fac. de Química, UNAM,1965.17 p. DE LA LANZA, E. G., An. Inst. Biol.Algunas características hidrográficas del sistema litoral de Veracruz, Ver. Univ. Nal. Autón. México,1966.47-52.36(1-2): GARCÍA, E., Modificaciones al sistema de clasificación climática de Koppen. (Para adaptarlo a las condiciones de la República Mexicana). Ed. Enriqueta García de Miranda, 4a. ed.,México, D. F.,1988.220 p. GARCÍA, E., Carta de Climas. Atlas Nacional de México Instituto de Geografía, UNAM.1990. GARCíA-CUBAS, A., Bol. Inst. Geol. Sistemática y distribución de los micromoluscos recientes de la Laguna de Términos, Campeche, México.Univ. Nal. Autón. México,1963.155, 24 figs., 4 láms.67(4): GARCÍA-CUBAS, A., An. Inst. Cienc. del Mar y Limnol.Moluscos de un sistema lagunar tropical en el sur del Golfo de México (Laguna de Términos, Campeche).Univ. Nal. Autón. México,Publ. Esp.1981.1-182.5: GARCÍA-CUBAS, A., F. ESCOBAR DE LA LLATA, L. V. GONZÁLEZ ANIA y M. REGUERO.,An. Inst. Cienc. del Mar y Limnol.Moluscos de la Laguna Mecoacán, Tabasco, México: sistemática y ecolegía. Univ. Nal. Autón. México,1990.1-30.17(1): GARCÍA-CUBAS, A. y M. REGUERO, An. Inst. Cienc. del Mar y Limnol.Moluscos del sistema lagunar Tupilco-Ostión, Tabasco, México: sistemática y ecología.Univ. Nal. Autón. México,1990.309-343.17(2): GARCÍA, S. S., III Congreso Nacional de Oceanografía. Datos hidrológicos de la laguna de Pueblo Viejo y su desarrollo ostricola.Campeche, Camp.1967. GARCÍA, S. S., Mem. IV Congreso Nacional de Oceanografía. México, D. F., Dinámica de los bancos ostricolas en relación con los factores del ambiente y el control ejercido mediante obras hidráulicas en la Laguna de Pueblo Viejo, Ver., Méx.1972.429 - 442.1969:Nov. 17-19, GARCÍA, S. S., Mem. V Congreso Nacional de Oceanografía. Guaymas, Son., México, Aprovechamiento de la fijación de larvas de ostión (Crassostrea virginica Gmelin) en Laguna de Pueblo Viejo, Ver. de 1964 a 1973.1977.259-270.Oct. 22-25, 1974: GARCÍA, S. S. y A. RAMÍREZ,Biología del ostión en su etapa de fijación en la Laguna de Pueblo Viejo, Ver.Ser. Cient.,Inst. Nal. Pesca México1981.91-98.(1): KEEN, M. A. Sea shells of tropical west America. Marine mollusks from Baja California to Peru. Stanford University Press, Stanford,2a. ed.,1971.1065 p., 22 láms. KREBS, J. C., Ecology. The experimental analysis of distribution and abundance. Harper International Edition, New York,1972.694 p. MARGALEF, R., Mem. R. Acad. Cienc. Artes, Barcelona,La teoría de la información en ecología.1957.(13):3279 p. PIELOU, E. C., Ecological diversity. Ed. Wiley, New York1975.165p. PURCHON, R. D., The Biology of the Mollusca.Pergamon Press, New York,1968.560 p. REGUERO, M. y A. GARCÍA-CUBAS, An. Inst. Cienc. del Mar y Limnol. Moluscos de la Laguna de Alvarado, Veracruz: sistemática y ecología.Univ. Nal. Autón. México,1989.279-306.16(2): REGUERO, M. y A. GARCÍA-CUBAS, An. Inst. Cienc. del Mar y Limnol.. Moluscos de la Laguna Camaronera, Veracruz: sistemática y ecología Univ. Nal. Autón. México,1991.1-23.18(1): REGUERO, M., A. GARCíA-CUBAS y G. ZÚÑIGA, An. Inst Cienc. del Mar y Limnol. Moluscos de la Laguna Tampamachoco, Veracruz, México: sistemática y ecología. Univ. Nal. Autón. México,1991.289-328.18(2): RESÉNDEZ MEDINA, A., VII Simp. Latinoamer. Oceanogr. Biol.Análisis de faunas de peces en lagunas costeras del Golfo de México y Mar Caribe.Acapulco, Gro. México.1981. ROSALES-HOZ, M., A. V. BOTELLO, H. BRAVO and E. F. MANDELLI, Bull. Environ Contam Toxicol., PCB´S and organoctilorinc insecticidas in oysters from coastal lagoons of the Gulf of Mexico.1979.652-656.21(4): ROSALES-HOZ, M. y R. ÁLVAREZ LEÓN, An. Centro Cien. del Mar y Limnol. Niveles actuales de hidrocarburos organoclorados en sedimentos de lagunas costeras del Golfo de MéxicoUniv. Nal. Autón. México,1979.1-5.6(2): SÁNCHEZ HIDALGO, M., Tesis Profesional. Diatomeas planctónicas de la laguna de Pueblo Viejo, Ver., México.Escuela Nacional de Ciencias Biológicas, IPN, México, D. F.1974. SHANNON, E. C. and N. WIENER, The mathematical theory of comunicalion. University of Illinois Press, Urbana,1963.117 P VÁZQUEZ BOTELLO, A., Rev. Biol. Trop., Presencia de hidrocarburos fósiles en ecosistemas estuarinos del Golfo de México.1978.135-151.26(1): VÁZQUEZ BOTELLO, A., An. Centro Cienc. del Mar y Limnol.Niveles actuales de hidrocarburos fósiles en ecosistemas estuarinos del Golfo de México. Univ. Nal. Autón. México1979.,7-14.6(1): VÁZQUEZ BOTELLO, A. and A. F. MANDELLI, Cosmochim Acta,Organic carbon isotope ratios of recient sediments from coastal lagoons of the Gulf of Mexico. Geochim.1980.557-559.44: VILLARREAL ORTIZ, A., Mem. II Simp. Latinoamer. Acuacultura: Captación de semilla de ostión empleando colectores en suspensión en la laguna de Pueblo Viejo, Ver., México.1980.943-994.
|

