|
DESARROLLO LARVARIO Y CLAVE DE IDENTIFICACIÓN
DE ALGUNAS ESPECIES DE LA FAMILIA CARANGIDAE (PISCES) DEL SUR DEL GOLFO DE
MEXICO
Trabajo recibido el 26 de agosto de 1991 y aceptado para su
publicación el 12 de abril de 1993.
Marina Sánchez-Ramírez y César Flores-Coto
Instituto de Ciencias del Mar y
Limnología, Universidad Nacional Autónoma de México,
Apartado Postal 70-305, México, D.F., 040510, MÉXICO.
Contribución No. 736 del Instituto de Ciencias del Mar y
Limnología.
Se
describe el desarrollo larvario deChloroscombrus chrysurus,Decapterus
punctatus, Trachurus lathami, Selene setapinnis, S. spixii, Selar
crumenophthalmus, Caranx hippos(y/olatus) y
C. crysoscon organismos capturados en el sur del Golfo de
México. Las larvas deT. lathami yS.
spixii se describen por primera vez. La identificación de la
cresta supraocular, no empleada en las descripciones anteriores, permite mejor
definición de las especies. El desarrollo en los ejemplares del sur del
Golfo de México es más rápido que en latitudes mayores. Se
ofrece una clave para la identificación de las larvas de la
mayoría de las especies de carángidos registradas en esta
zona.
The
larval development ofChloroscombrus chrysurus, Decapterus punctatus,
Trachurus lathami, Selene setapinnis, S. spixii, Selar crumenophthalmus, Caranx
hippos(and/orlatus) andC.
crysos is described, with organisms caught in southern Gulf of
México. T. lathami and S.
spixiihave her their first description. Supraocular crest, not used
in previous descriptions, lets a better definition of our species. The larvae
of southern Gulf of México show a faster development than in greater
latitudes. An identification larvae key is presented, which includes the
majority of the recorded carangid in southern Gulf of
México.
La identificación correcta de los organismos en los estudios ictioplanctónicos representa un gran problema, particularmente en el Golfo de México y en el Mar Caribe, puesto que las descripciones del desarrollo larvario de los peces de estas zonas son muy escasas. Por otro lado, muchas de las descripciones han sido incompletas, e incluso incorrectas, lo que ha generado trabajos de revisión, como el de Ditty (1989) acerca de las etapas larvarias de los sciaenidos del norte del Golfo de México. Actualmente se tienen registros de 27 especies de carángidos en el Golfo de México, de las cuales 17 se presentan en la porción del sur (Ginsburg, 1952; Reséndez-Medina, 1970, 1973, 1981, Walls, 1975; Hoese y Moore, 1977; Berry y Smith-Vaniz, 1978; Castro-Aguirre, 1978; Nakamura, 1980: Yáñez-Arancibia y Sánchez-Gil, 1986). De las 27 especies, se conoce parcial o totalmente el desarrollo larvario de 19, cuyas descripciones han sido realizadas, entre otros autores, por Hildebrand y Cable (1930), Sanzo (1931), Padoa (1956), McKenney et al., (1958), Berry (1959), Fields (1962), Okiyama (1970), Conand y Franqueville (1973), Aprieto (1974), Aboussouan (1968, 1975), Montolio, (1976), Tsokur (1977), Miller et al.,(1979) y Laroche et al.,(1984). Estas descripciones se han elaborado con larvas de la costa atlántica de los Estados Unidos de América, del norte del Golfo de México y de otras regiones; aunque en un principio son útiles para la identificación de los organismos, se ha encontrado que muchas están incompletas, sobre todo en las etapas iniciales del desarrollo, y que existen diferencias con los especimenes recolectados en el sur del Golfo de México, hecho que se extiende a otras familias. Por lo anterior, se ha considerado conveniente hacer la redescripción o la descripción, en su caso, del desarrollo larvario de las especies de carángidos, cuyas larvas se han capturado en el sur del Golfo de México; así como una clave de identificación de estos estadíos, la cual incluye otras especies no descritas aquí, pero que en estado adulto se han registrado en la zona. MATERIAL Y MÉTODOSEl material empleado en este trabajo se recolectó en 1983 y 1984, en la porción meridional del Golfo de México, en latitudes inferiores a la del paralelo 21° N, en un área que abarca la plataforma continental de los estados de Veracruz, Tabasco y Campeche, así como la zona oceánica adyacente (Fig.1). Flores-Coto y Sánchez-Ramírez (1989) han presentado detalles de la metodología de colecta.  Figura 1. Área de estudio En la descripción del desarrollo larvario se consideraron tres etapas, atendiendo a la flexión del urostilo (Moser y Ahstrom, 1970, Kendall et al.,1984): - Preflexión. Desde la absorción completa del saco vitelino hasta antes de iniciarse la flexión del urostilo. - Flexión. Etapa comprendida entre el inicio y el término del proceso de flexión del urostilo. - Postflexión. Desde que el urostilo se encuentra totalmente flexionado hasta que la larva adquiere las características de juvenil. Para la descripción del desarrollo larvario se utilizaron series secuenciales de organismos de la menor a la mayor talla registrada. A las larvas incluidas en las series se les tomaron sus características merísticas (incluyendo espinas preoperculares, supracleitrales y postemporales) y morfométricas; es conveniente establecer las convenciones siguientes: LP= longitud patrón, LN= longitud notocordal, LHA= longitud hocico-ano, LC= longitud de la cabeza, PC= profundidad del cuerpo, DO= diámetro del ojo, y FP= fórmula preopercular (Fig. 2). Para la elaboración de la clave se tomaron en consideración las características de la larvas colectadas en el sur del Golfo de México, salvo en los casos de las especies que en el área se han registrado sólo en sus etapas adultas. En tales ocasiones se tomaron como base las descripciones realizadas por otros autores en otras regiones.  Figura 2. Esquema de un carángido en el que se muestran las medidas y características morfológicas principales. RESULTADOSDe las 17 especies de carángidos registradas en estado adulto en el sur del Golfo de México por Castro-Aguirre (1978), Reséndez-Medina (1970, 1973, 1981), y Yáñez-Arancibia y Sánchez-Gil (1986), se determinó la presencia de larvas deChloroscombrus chrysurus, Decapterus punctatus, Trachurus lathami, Selene setapinnis, S. spixii, Selar crumenophthalmus, Caranx hippos(y/o latus) yC. crysos, cuyo desarrollo larvario se redescribe o describe en párrafos siguientes.Trachinotus falcatus, T. carolinus, S. vomer, Hemicaranx amblyrhynchus, C. bartholomaei, C. ruber, D. tabl yOligoplites saurus son especies cuyas larvas no se encontraron en los muestreo s realizados. Chloroscombrus chrysurus (Linnaeus, 1776),"horqueta"
Morfología (Figs.3,4 y 5)La talla más pequeña incluida en esta serie fue de 1.8 mm, quizá próxima a la talla de eclosión. Cuerpo moderadamente profundo (Tabla I). La cresta supraoccipital es evidente, aunque muy pequeña desde los 1.8 mm; al aumentar de tamaño se mantiene generalmente más larga que alta; es bastante aserrada y desaparece alrededor de los 9.1 mm. A los 3.3 mm aparece la cresta supraocular, la cual, a diferencia de las otras especies de carángidos, muestra una serie de espinas pequeñas; desaparece aproximadamente a los 10.0 mm. La fórmula preopercular fue de 1+1+1 a los 1.8 mm, hasta 7-8+1+4-5. A los 11.8 mm las espinas ventrales han desaparecido, al igual que las laterales, y las dorsales se reducen a cuatro (Tabla II). A los 2.4 mm aparecen una espina supracleitral y una postemporal; esta última aumenta hasta dos a los 3.7 mm; a partir de los 6.8 mm se tiene un máximo de cuatro supracleitrales. A los 13.3 mm ambos tipos de espinas persisten. El brote de las aletas pectorales acaece desde los 1.8 mm y el de las pélvicas hacia los 4.7 mm. El desarrollo de las aletas dorsal y anal inicia a los 2.7 mm; sus primeros radios y/o espinas surgen a alrededor de 3.4 mm y concluyen a los 6.8 mm. La aleta caudal se inicia en tomo a los 3.4 mm y el número completo de radios ocurre a los 8.8 mm (Tabla II). 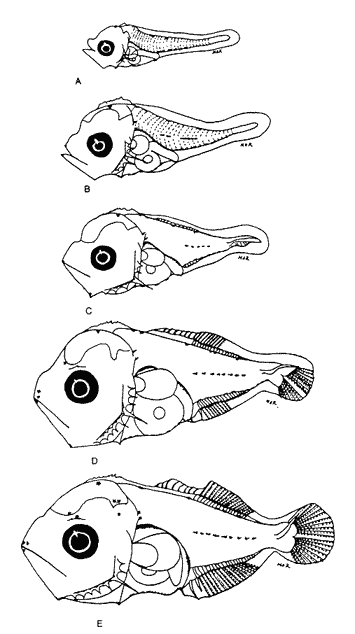 Figura 3. ChIoroscombrus chrysurus: (A) 1.8 mm; (B) 2.5 mm;(C) 2.7 mm; (D) 3.5 mm; (E) 4.0 mm. Pigmentación (Figs. 3, 4 y 5)Los primeros estadíos presentan un patrón de pigmentación característico que consiste generalmente de cuatro melanóforos, en ocasiones tres, en la parte media dorsal del cuerpo y uno en la cabeza, pigmentación peritoneal y una serie de melanóforos en la región media ventral que comienza en la sínfisis cleitral y concluye én las dos terceras partes del cuerpo. Durante el desarrollo, los melanóforos se incrementan cuantitativamente en la parte media dorsal del cuerpo. En una secuencia de crecimiento cabe hacer notar la aparición de pigmentos en: la línea media lateral, a los 2.1 mm, la punta del hocico, a los 2.4 mm; la parte distal de los pterigóforos de la aleta anal, a los 3.1 mm; los mioseptos de la porción ventrolateral, la mandíbula y la zona lateral del cuerpo a la altura del tracto digestivo, a los 5.0 mm; la región dorsolateral del cuerpo, a los 6.2 mm; las espinas y los radios de la aleta anal y los radios de la aleta cau dal, a los 6.8 mm. Alrededor de esta última talla al canzan un patrón característico que consiste en una gran cantidad de pigmentos en las partes dorsolateral y ventrolateral; los primeros sin arreglo alguno, mientras que los segundos se ubican en dirección de los mioseptos, además, sobre los radios y espinas de la aleta anal y los radios de la caudal; este patrón se incrementa notablemente en tallas mayores. 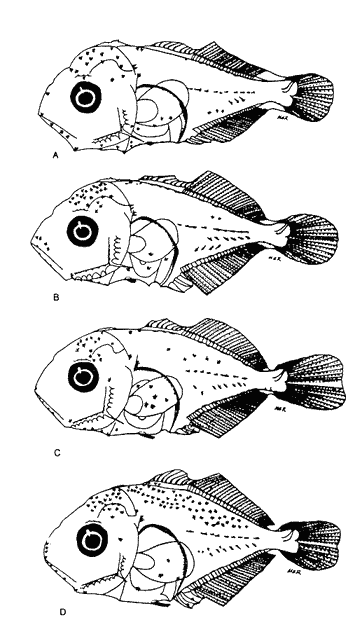 Figura 4. ChIoroscombrus chrysurus: (A) 5.2 mm; (B) 6.2 mm; (C) 7.4 mm; (D) 8.6 mm. 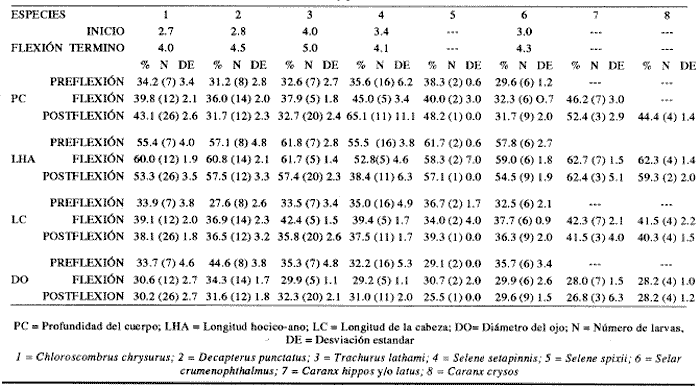 TABLA 1. Proporciones del cuerpo de las larvas de algunas especies de la Familia Carangidae en el sur del Golfo de México. PC, LHA y LC se expresan como porcentajes promedio de la longitud patrón, y DO como porcentaje promedio de la longitud de la cabeza en preflexión, flexión y postflexión Decapterus punctatus (Agassiz, 1829), "antonino"
Morfología (Figs. 6, 7 y 8)La eclosión probablemente ocurre a los 1.4 mm, talla que corresponde a la larva más pequeña capturada. Su cuerpo es poco profundo, con escasa variación en todo el desarrollo (Tabla I). La cresta supraoccipital, se, presentó desde 1.6 mm, generalmente es más larga que alta y poco aserrada; la supraocular, que tiene una espina pequeña en su parte media, aparece alrededor de los 3.8 mm; ambas crestas están presentes aún a los 9.0 mm, pero a los 13.8 han desaparecido. 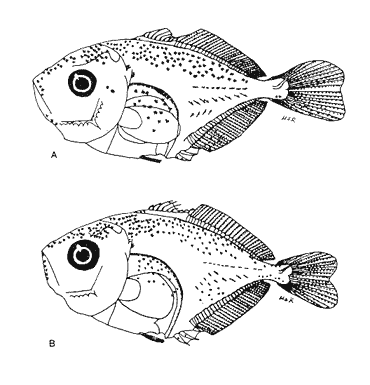 Figura 5. Chloroscombrus chrysurus: (A) 10.0 mm; (B) 13.3 mm.  Figura 6. Decapterus punctatus: (A) 1.6 mm; (B) 1 - 8 mm; (C) 2.8 mm; (D) 3.3 mm. Las espinas laterales del preopérculo persisten durante todo el desarrollo a partir de 1.6 mm; a esta talla la fórmula preopercular es 2+1+1; desde 6.9 mm se incrementa a 6-7+1+3-4 (Tabla III). A los 2.8 mm se perciben una espina supracleitral y otra postemporal, que aumentan a dos hacia los 3.5 mm y a tres entre 8.0-9.0 mm, pero a los 13.8 mm únicamente se reducen a dos de cada una. Las aletas pectorales brotan a los 1.4 mm y las pélvicas a los 4.4 mm. El desarrollo de las aletas dorsal y anal se inicia alrededor de 3.5 mm y concluye aproximadamente a los 9.0 mm, sus primeros radios, así como los de la aleta caudal, son visibles cuando la larva alcanza cerca de 4.0 mm; los de esta última se encuentran completos a los 13.8 mm (Tabla III). Pigmentación (Figs. 6,7 y 8)Es escasa; en los primeros estadíos se observan pigmentación peritoneal, un melánoforo en la parte dorsal del cuerpo, anterior a la posición del ano, y una serie en la parte media ventral que a partir de éste se presenta como puntos pequeños que se suceden hasta el extremo de la cola. Algunos melanóforos aparecen alrededor de 1.8 mm, en la cabeza; hacia los 3.0 mm, en la punta del hocico, en el ángulo inferior de la mandíbula y en la porción lateral del cuerpo; en torno a los 5.2 mm, sobre la parte lateral del cuerpo, a la altura del intestino, y, hacia los 6.9 mm, sobre el pedúnculo caudal. Este patrón se incrementa durante el crecimiento. A diferencia de otras especies, no hay melanóforos entre la cresta supraoccipital y la aleta dorsal, al menos hasta los 9.0 mm. Trachurus lathami Nichols, 1920, "charrito"
Morfología (Figs. 9, 10 y 11)Es probable que la eclosión se realice alrededor de los 2.1 mm, que fue la talla de la larva más pequeña capturada. El cuerpo es poco profundo (Tabla I). La cresta supraoccipital se encontró a partir de los 2.1 mm; es poco aserrada, más larga que alta; aunque muy pequeña, persiste hasta los 12.4 mm. No existe cresta supraocular. Las espinas laterales del preopérculo se encuentran en todo el desarrollo, pero en 12.4 mm casi han desaparecido. La fórmula preopercular fue 2+1+1 a los 2.1 mm; hasta 7-8+1+4-6 a partir de los 6.8 mm (Tabla IV). Alrededor de 3.8 mm se observan una espina postemporal y una supracleitral, que aproximadamente a los 5.0 mm son dos de cada una, y a los 12.4 mm todavía se encuentran. El brote de las aletas pectorales ocurre desde los 2.1 mm, y el de las pélvicas a los 5.5 mm. Las aletas dorsal y anal empiezan a desarrollarse hacia los 3.5 mm; espinas y radios aparecen alrededor de los 4.5 mm; su número completo se alcanza aproximadamente a los 10.5 mm. 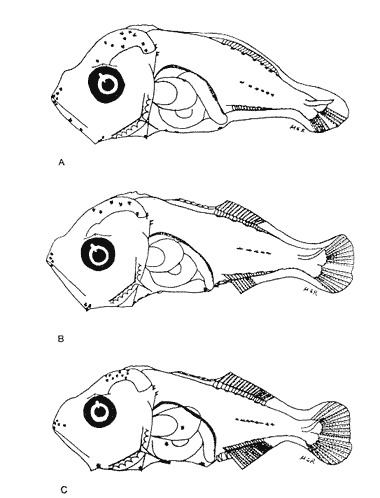 Figura 7. Decapterus punctatus: (A) 3.8 mm; (B) 4.4 mm; (C) 5.2 mm. Los primeros radios de la aleta caudal surgen desde los 3.8 mm; a los 12.4 mm han emergido todos (Tabla IV). Pigmentación (Figs. 9, 10 y 11)Es muy abundante desde los primeros estadíos. Los melanóforos se observan a los 2.1 mm en la cabeza, la punta del hocico, la pared dorsal del peritoneo y en las líneas medias dorsal y ventral. Estos últimos se reducen a puntos pequeños a partir del ano. Alrededor de los 3.0 mm aparecen otros melanóforos en las líneas medias laterales del cuerpo; a los 4.0 mm surgen sobre las partes laterales del cuerpo y a lo largo de las mandíbulas. A excepción de los pigmentos de la línea media ventral, que se observan hasta el urostilo y/o la placa hipural, los demás se interrumpen antes del pedúnculo caudal, lo que propicia que, a medida que avanza el desarrollo y aumenta su pigmentación, el pedúnculo aparezca contrastantemente claro con respecto al resto del cuerpo. Este patrón se incrementa notablemente, con algunas modificaciones: a los 5.0 mm aparecen pigmentos en la parte final de los pterigóforos anales; a los 6.0 mm, sobre los radios caudales; a los 8.0 mm, en el pedúnculo caudal y en las espinas anales; a los 9.0 mm, en la parte lateral del cuerpo a la altura del intestino; a los 10.5 mm, sobre los radios anales y espinas dorsales, y, alrededor de los 11.0 mm, en la parte distal de los pterigóforos dorsales. 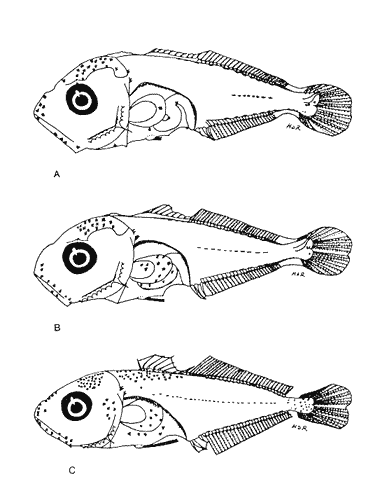 Figura 8. Decapterus punctatus: (A) 6.9 mm; (B) 8.2 mm; (C) 13.8 mm. Selene setapinnis (Mitchill, 1815), "papelillo"
Morfología (Figs. 12, 13, 14 y 15)La larva más pequeña (1.7 mm) registrada se debe encontrar muy cercana a lo que podría ser la talla de eclosión. La profundidad del cuerpo aumenta con el desarrollo; la longitud hocico-ano disminuye en la última etapa; esta disminución se debe a que el segmento terminal del intestino se curva hacia la parte anterior, de manera que la posición del ano es cercana al origen de las aletas pélvicas (Tabla I). 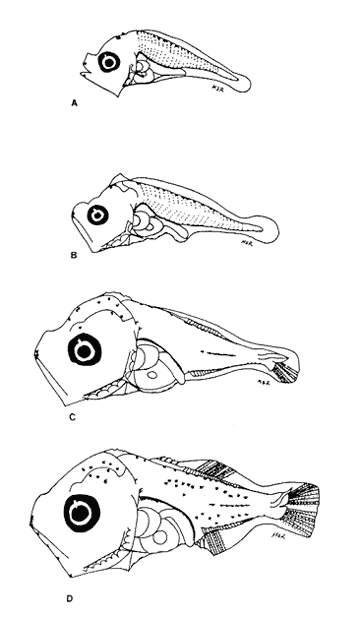 Figura 9. Trachurus lathami: (A) 2.1 mm; (B) 2.7 mm; (C) 3.8 mm; (D) 4.6 mm. La cresta supraoccipital, aunque pequeña, se presenta ya a los 1.7 mm; en el transcurso del desarrollo se hace más conspicua; a los 4.6 mm comienza a disminuir y hacia los 5.9 mm desaparece completamente. Existe una cresta supraorbital con una espina pequeña en su parte media, que aparece alrededor de los 3.0 mm, se hace mas evidente después de la flexión y se conserva aún a los 11.4 mm. 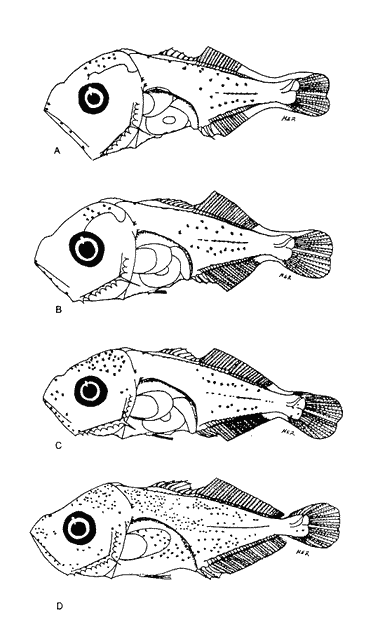 Figura 10. Trachurus lathami: (A) 5.7 mm; (B) 6.8 mm; (C) 8.2 mm; (D) 9.5 mm. Las espinas laterales del preopérculo, aunque son muy pequeñas y disminuyen cuantitativamente, se encuentran presentes durante todo el desarrollo de la larva; las del margen preopercular en las larvas menores de 2.2 mm se encuentran en un número de 2+1+1, aumentan hasta un máximo de 7+1+3 a los 8.3 mm; a partir de esta talla empiezan a disminuir, y a los 11.4 mm se tiene únicamente 3+1+1 (Tabla V). Alrededor de los 2.5 mm se observan una espina postemporal y una supracleitral; de este último tipo aparece una segunda espina hacia los 6.5 mm, pero a los 8.3 mm persiste solamente una. 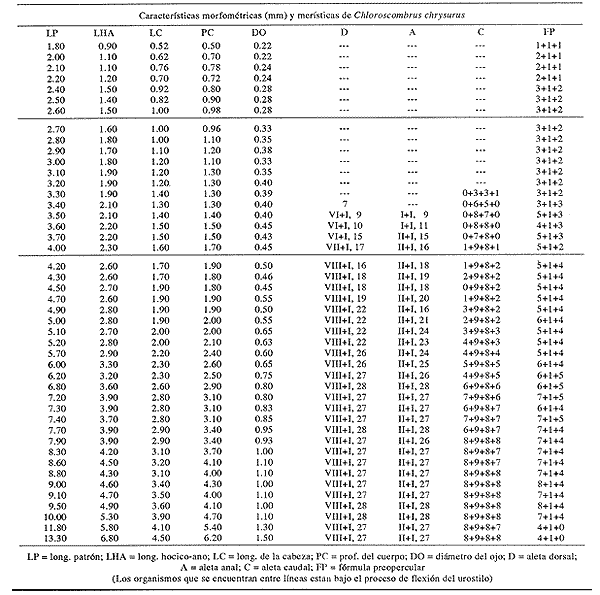 TABLA II. Características morfométricas (mm) y merísticas de Chloroscombrus chrysurus 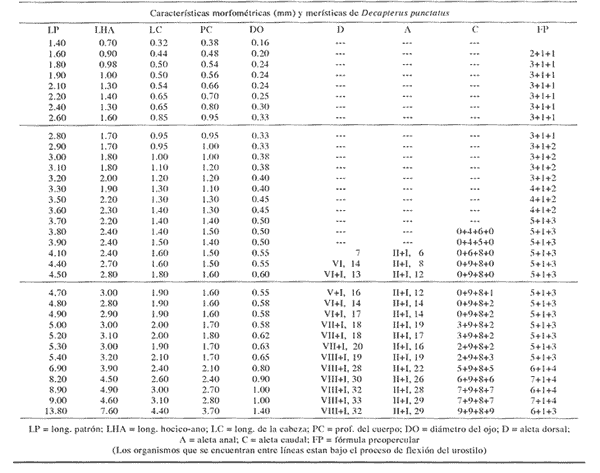 TABLA III. Características morfométricas (mm) y meristicas de Decapterus punctatus A los 1.7 mm ya se nota el brote de las aletas dorsal y pectorales y los rudimentos de las pélvicas. Estas últimas aparecen formadas por completo a los 2.3 mm. Su longitud se incrementa notablemente durante el desarrollo hasta alcanzar los primeros radios de la aleta anal, aunque posteriormente disminuye a partir de los 8.3 mm de LP. Las primeras espinas de la aleta dorsal aparecen a los 2.2 mm; éstas son muy largas durante todo el desarrollo. Hacia los 7.6 mm la aleta dorsal culmina su fórmula radial definitiva. Los primeros radios caudales y espinas anales emergen a los 3.0 mm. La aleta anal se encuentra formada totalmente alrededor de los 6.5 mm. A los 11.4 mm los radios secundarios de la aleta caudal aún no han terminado de constituirse (Tabla V). Pigmentación (Figs. 12,13,14 y 15)Es relativamente escasa en los primeros estadíos (preflexión y flexión); las larvas presentan pigmentos en la punta de las mandíbulas, la parte superior de la órbita del ojo, la línea media ventral de la región del tronco, la base de las aletas dorsal, anal y caudal, y la parte posterior de la línea lateral. Las aletas pélvicas se encuentran pigmentadas alrededor de los 2.0 mm de talla, y las primeras espinas dorsales aproximadamente a los 3.5 mm; asimismo, en la región dorsal de la cavidad peritoneal. Además poseen un melanóforo abajo del ano. A los 3.4 mm empieza a aparecer una serie de pigmentos en la parte lateral del cuerpo, a la altura de los de la línea media, los cuales aumentan en número notablemente durante el desarrollo. A los 7.6 mm empiezan a concentrarse y forman una gran mancha, que se localiza aproximadamente a la altura de la 15a. vértebra, y a partir de los 8.3 mm se hace muy evidente; esta mancha es característica exclusiva de esta especie. En este mismo período aparecen pigmentos en la parte media del cerebro, sobre el intestino, en la región dorsolateral del cuerpo, a la altura de las primeras espinas dorsales, y en la parte distal de los pterigóforos anales. Contrario al aumento general de los pigmentos, los de la línea media ventral, muy evidentes en las primeras etapas, disminuyen hasta prácticamente desaparecer hacia los 7.6 mm. Alrededor de los 11.4 mm el organismo es intensamente báfico (pigmentado). 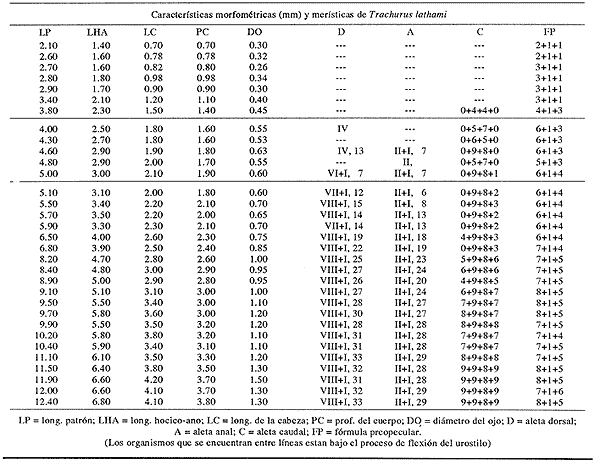 TABLA IV. Características morfométricas (mm) y merísticas de Trachurus lathami Selene spixii (Swainson, 1839), "jorobado luna"Berry y Smith-Vaniz (1978) y Larocheet al., (1984) mencionan tres especies deSelene del Atlántico occidental:S. vomer, S. setapinnisyS. spixii, de las cuales sólo de las dos primeras se conoce el desarrollo larvario. Los organismos capturados de este género no corresponden a las descripciones de S. vomer yS. setapinnis, particularmente por su pigmentación, la cual es abundante, uniforme y no muestra los patrones específicos propios de las especies ya descritas. Por tal motivo es muy probable que se trate de S. spixii. La escasez de organismos capturados, cuyas tallas fluctuaron entre 3.1 mm y 5.6 mm, impidió establecer la secuencia completa del desarrollo; por esta razón se hacen descripciones de las tallas en las que se observaron cambios notables (Tablas I y VI). Morfología (Fig. 16)Son de cuerpo profundo (Tabla I). La talla más pequeña registrada fue de 2.9 mm. En ésta el urostilo no había iniciado su flexión. Posee crestas supraoccipital y supraocular, esta última con una espina pequeña. Las espinas preoperculares laterales y marginales (2+1+1) también están presentes; a los 3.1 mm se aprecian una espina postemporal y una supracleitral. Ocurre el brote de las aletas pectorales, la aleta dorsal tiene dos espinas, las aletas pélvicas son muy grandes, con el número completo de espinas y radios (I, 5). A los 4.5 mm el urostilo se encuentra en proceso de flexión. El número de espinas preoperculares en el margen ha aumentado: 3+1+2. Las aletas pélvicas se han desarrollado mucho y alcanzan más allá del origen de la aleta anal; las espinas dorsales tercera y particularmente la segunda muestran gran crecimiento; el número de espinas dorsales está completo y se observan algunos radios (VIII+I, 7); la caudal tiene ya sus primeros radios (0+2+2+0). A los 5.6 mm el proceso de flexión ha concluido. La cresta supraoccipital ha desaparecido. Las aletas dorsal, anal y caudal no han terminado su desarrollo (D.: VIII+I, 12; A.: II+I, 11; C.: 0+9+8+1). Las espinas dorsales segunda y tercera continúan su gran crecimiento, característica que resulta muy conspicua en la morfología del género. 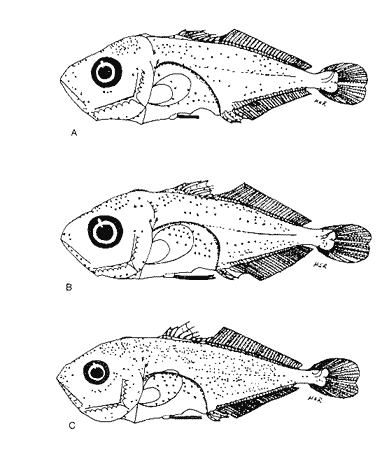 Figura 11. Trachurus lathami: (A) 10.4 mm; (B) 11.9 mm; (C) 12.4 mm. Pigmentación (Fig. 16)Desde 2.9 mm se observan líneas de melanóforos en la base de las aletas dorsal y anal, en la región media ventral desde la sínfisis cleitral hasta el ano, en la parte media lateral del cuerpo y en la parte dorsal de la cavidad abdominal. Algunos melanóforos aparecen en las mandíbulas, en la parte dorsal de la cabeza y en la porción dorsolateral del cuerpo. Las primeras espinas dorsales y las aletas pélvicas están muy pigmentadas. A los 4.5 mm han aparecido nu merosos melanóforos en toda la superficie lateral del cuerpo, en la cabeza, tanto en la parte del cerebro como en el preopérculo, las mandíbulas y algunos en el conjunto hipural. A los 5.6 mm. la pigmentación es más densa y algunos melanóforos se agregan sobre el pendúculo caudal, los primeros radios dorsales y la parte externa de los pterigóforos anales. Es particularmente notoria una gran cantidad de melanóforos sobre las primeras espinas dorsales y las aletas pélvicas. 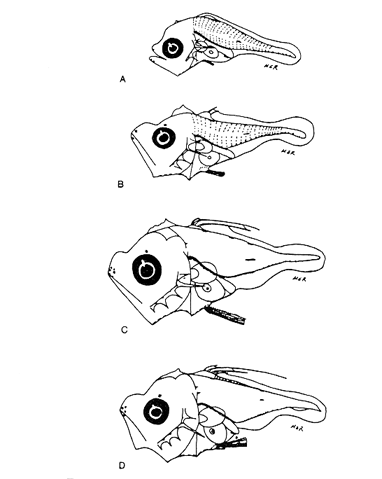 Figura 12. Selena setapinnis: (A) 1.7 mm; (B) 2.2 mm; (C) 2.4 mm; (D) 2.8 mm. Selar crumenophthalmus (Bloch, 1793), "ojotón"
Morfología (Figs. 17 y 18)Las larvas de esta especie presentan cuerpo poco profundo (Tabla I). La cresta supraoccipital se observa desde los 2.1 mm, es poco aserrada y más larga que alta; a los 7.6 mm todavía persiste y a los 14.3 mm ya no. 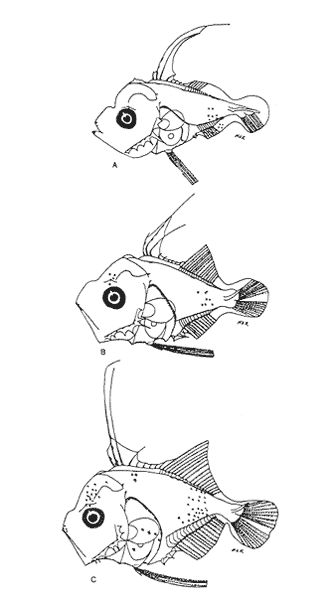 Figura 13. Selene setapinnis: (A) 3.4 mm; (B) 4.0 mm; (C) 4.6 mm. Las espinas preoperculares laterales surgen hasta los 7.6 mm, pero en 14.3 mm desaparecen. Las espinas preoperculares del margen en 2.1 mm fueron 3+1+1, alcanzan el mayor número (6-7+1+3) a los 4.5 mm y a los 14.3 mm hay sólo 1+1+0 (Tabla VII). Alrededor de los 4.0 mm aparecen una espina postemporal y una supracleitral; otra supracleitral emerge hacia los 7.0 mm. Ambos tipos de espinas se observan aún a los 7.6 mm, pero a los 14.3 mm ya no existen. 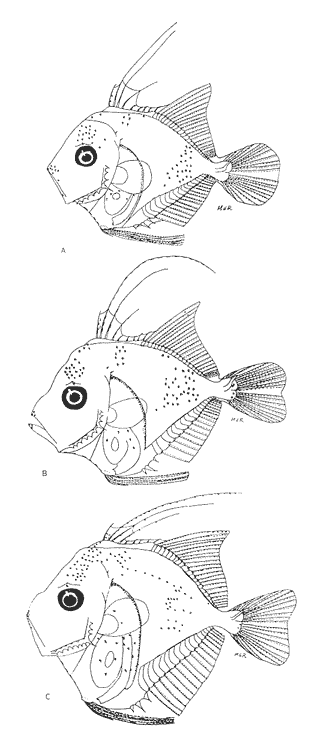 Figura 14. Selene selapinnis: (A) 5.9 mm; (B) 7.0 mm; (C) 7.6 mm. 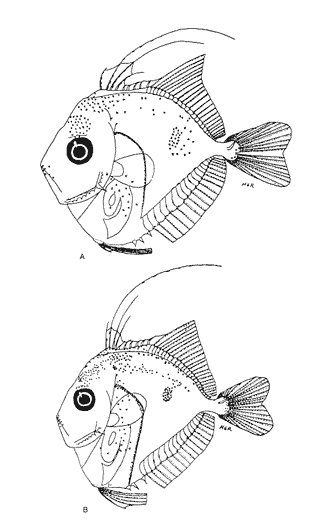 Figura 15. Selene setapinnis: (A) 8.3mm; (B) 9.7 mm. Las primeras aletas que se desarrollan son las pectorales; su brote ocurre desde los 2.1 mm y el de las aletas pélvicas aproximadamente a los 5.0 mm. El desarrollo de las aletas dorsal y anal se inicia hacia los 3.0 mm; los primeros radios y/o espinas, tanto de éstas como de la aleta caudal, se observan entre 3.7 y 4.0 mm; la fórmula radial de las tres aletas sucedió en un ejemplar de 14.3 mm (Tabla VII). Pigmentación (Figs. 17 y 18)Es escasa. A los 2.1 mm se presenta una concentración de melanóforos en la región media dorsal del cuerpo posterior al ano; una línea de aquéllos a lo largo de la porción media ventral, que a partir del ano se reducen a puntos pequeños, algunos en la región posterior de la cabeza y muchos en la parte dorsal del peritoneo. Alrededor de los 2.5 mm aparecen melanóforos sobre la cabeza, en la porción media lateral y en el tercio posterior ventral del cuerpo; estos últimos se disponen en dirección de los mioseptos y son característicos de la especie. Alrededor de los 3.0 mm se perciben melanóforos en la parte externa de los pterigóforos anales y, aproximadamente a los 4.0 mm, sobre la porción dorsolateral, los radios caudales, el pedúnculo caudal, las espinas anales y las mandíbulas. Este patrón se incrementa en el transcurso del desarrollo y, finalmente, a los 14.3 mm, surgen sobre las espinas dorsales. 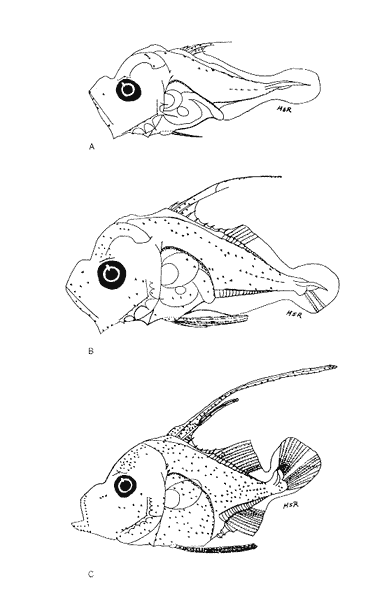 Figura 16. Selene spixii: (A) 3.1 mm; (B) 4.5 mm; (C) 5.6 mm. 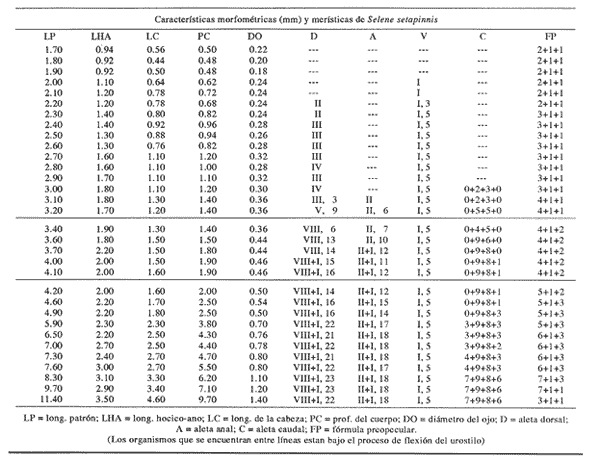 Tabla V. Características morfométricas (mm) y merísticas de Selene setapinnis Caranx hippos (Linnaeus, 1766), "jurel". Caranx latus (Agassiz, 183 l), "ojón"Las larvas deC. hippos no pudieron distinguirse de las deC. latus, debido a ello, y considerando el trabajo de Berry (1959), se tratan como complejoCaranx hipposy/olatus. Estas larvas también fueron escasas en el área, por lo que solamente se describen ejemplares en los que se encontraron cambios notables en el desarrollo dentro de los límites de tallas colectadas (3.1-6.3 mm) (Tabla VIII). Morfología (Figs. 19 y 20)El cuerpo de las larvas de esta especie es profundo (Tabla I). A los 3.1 mm el urostilo ya ha iniciado su flexión. Presenta una cresta supraoccipital alta, una espina postemporal y una supracleitral. Las espinas laterales del preopérculo están presentes, al igual que las del margen, cuya fórmula es 3+1+2. Ya se nota el brote de las aletas pectorales, y las aletas dorsal y anal han iniciado su desarrollo. A los 3.6 mm el número de espinas preoperculares del margen ha aumentado (4+1+2). Las aletas dorsal, anal y caudal muestran ya espinas y/o radios. A los 4.1 mm el número de espinas preoperculares marginales es de 3+1+2. Las aletas dorsal, anal y caudal no muestran gran avance. A los 4.6 mm el urostilo se encuentra totalmente flexionado. Las espinas preoperculares del margen han aumentado a 4+1+3, la postemporal ha desaparecido y la supracleitral aún se conserva. Son visibles los rudimentos de las aletas pélvicas; los radios centrales de la aleta caudal se han terminado de formar (0+9+8+0), pero las espinas y/o radios de las aletas dorsal (VII+I, 12) y anal (II+I, 9) están aún incompletos. A los 6.3 mm la cresta supraoccipital ha desaparecido por completo. Las espinas preoperculares marginales se incrementaron (5+1+4) y la supracleitral aún persiste. Las aletas dorsal y anal contienen su fórmula radial definitiva, pero los radios de la caudal todavía se encuentran incompletos.  TABLA VI. Caraterísticas morfométricas (mm) y merísticas de Selene spixii 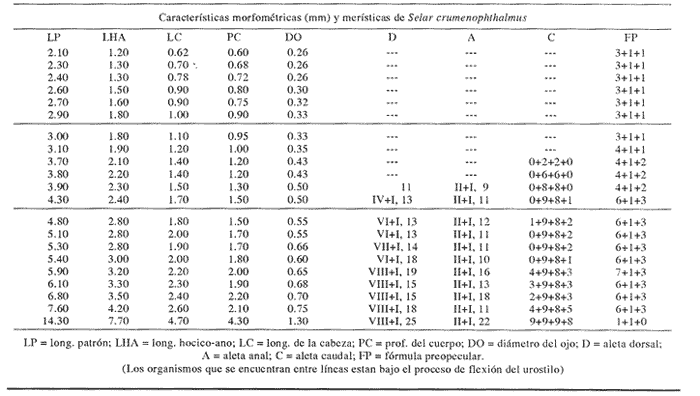 TABLA VII. Características morfométricas (mesa) y merísticas de Selar crumenophthalmus Pigmentación (Figs. 19 y 20)A los 3.1 mm existe una serie de líneas de melanóforos en:a) la base de las aletas segunda dorsal y anal;b) en la línea media ventral, desde la sínfisis cleitral al ano; c) en la parte dorsal de la cavidad abdominal; d) en la parte distal de los pterigóforos anales, que continúa hasta el complejo hipural, ye) en las mandíbulas. Aunque escasos, también hay melanóforos en la cabeza y en las partes dorsolateral y ventrolateral del cuerpo. Entre 3.6 y 4.6 mm el patrón de pigmentación se incrementa; particularmente en la parte superior de la cabeza, el opérculo, las regiones dorsal y ventral del cuerpo, la parte anterior de la base de la aleta dorsal, en la región media ventral -desde el opérculo hasta la aleta anal-, y sobre las espinas y los pterigóforos anales.  TABLA VIII Características morfométricas (mm) y merísticas de Caranx hippos y/o latus 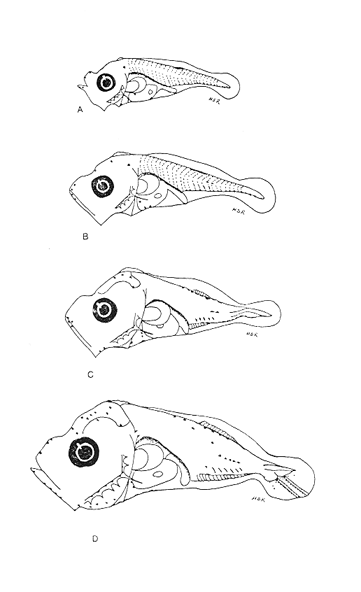 Figura 17. Selar crumenophthalmus: (A) 2.1 mm; (B) 2.7 mm;(C) 3.0 mm; (D) 3.7 mm. 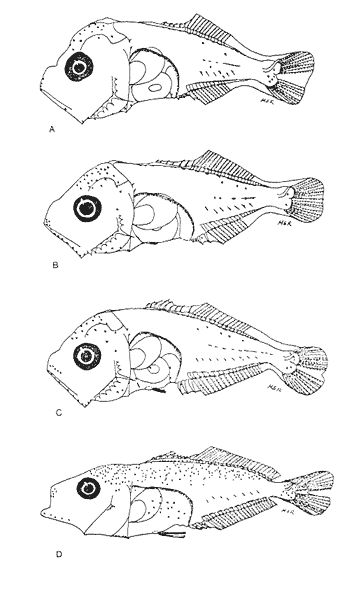 Figura 18. Selar crumenophthalmus: (A) 4.3 mm; (B) 5.4 mm; (C) 6.8 mm; (D) 14.3 mm. 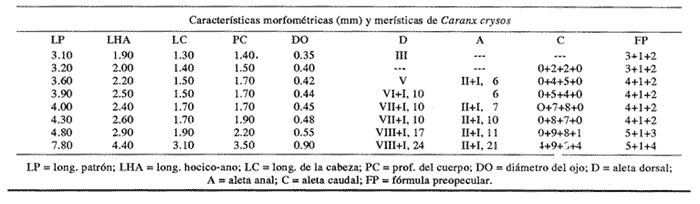 TABLA IX Características morfométricas (mm) y merísticas de Caranx crysos 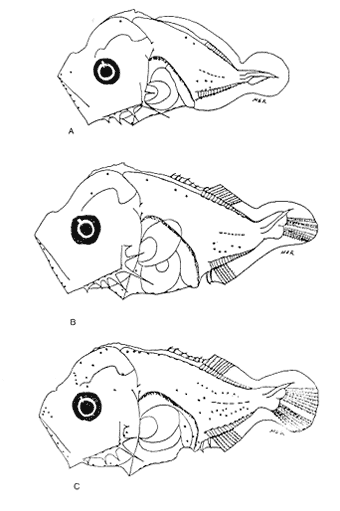 Figura 19. Caranx hippos y/o ratus: (A) 3.1 mm; (B) 3.6 mm; (C) 4.1 mm. A los 6.3 mm la bafia (pigmentación) aumenta considerablemente sobre todo el cuerpo, en la parte superior de la cabeza y en los pterigóforos dorsales. Las aletas pélvicas son abáficas (carecen de pigmento). Un cúmulo característico de melanóforos se dipone sobre la membrana de las cuatro primeras espinas de la aleta dorsal. 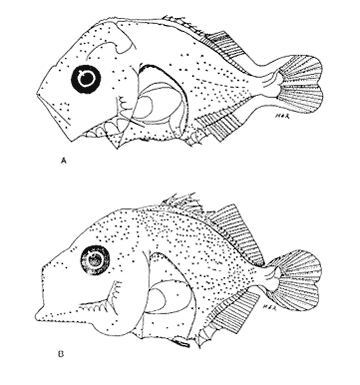 Figura 20. Caranx hippos y/o latus: (A) 4.6 mm; (B) 6.3 mm. Caranx crysos (Mitchill, 1815), "cojinuda"Las larvas deC. crysosfueron muy escasas, lo cual impidió establecer una secuencia de organismos para su descripción, por lo que ésta se limita a las tallas entre 3.1 mm y 7.8 mm, en las que se encontraron cambios notables. El organismo más pequeño midió 3.1 mm; el más grande, 7.8 mm (Tabla IX). 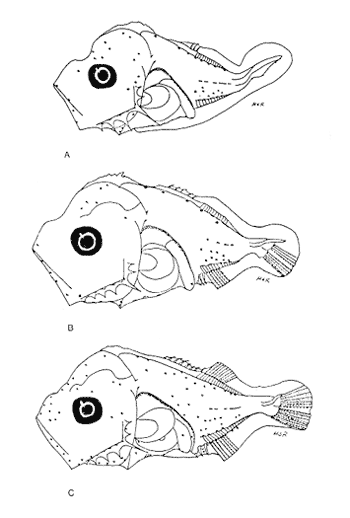 Figura 21. Caranx crysos: (A) 3.1 mm; (B) 3.6 mm; (C) 4.0 mm. Morfología (Figs. 21 y 22)Las larvas poseen cuerpo profundo (Tabla I). A los 3.1 mm el urostilo ya ha iniciado su flexión, tienen una cresta supraoccipital alta, una espina supracleitral y otra postemporal. Las espinas preoperculares de la superficie lateral y las del margen están presentes (3+1+1). Se observa el brote de las aletas pectorales. El desarrollo de las aletas dorsal y anal ya se ha iniciado; la dorsal tiene tres espinas. Entre 3.6 y 4.0 mm no hay cambios grandes en las proporciones del cuerpo, pero la cresta occipital se ha reducido. A los 3.6 mm se nota el brote de las aletas pélvicas y a los 4.0 mm emergen las aletas dorsal, anal y caudal. A los 4.8 mm el urostilo se encuentra totalmente flexionado; aumentó el número de espinas preoperculares del margen (5+1+3) y de las supracleitrales (2). Se perciben los rudimientos de las aletas pélvicas; pero las aletas dorsal, anal y caudal aún no terminan su desarrollo. A los 7.8 mm las espinas preoperculares marginales han aumentado a 5+1+4. La cresta supraoccipital ha desaparecido. Las aletas dorsal y anal han finalizado su desarrollo; no lo ha hecho aún la caudal. 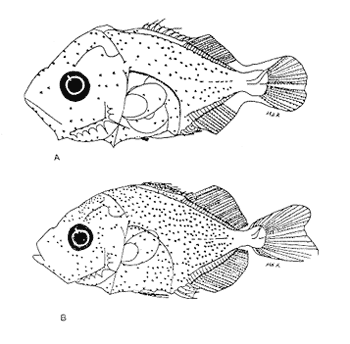 Figura 22. Caranx crysos: (A) 408mm; (B) 7.8mm. Pigmentación (Figs. 21 y 22)A los 3.1 mm se observan líneas de melanóforos en la parte dorsal de la cavidad abdominal, así como en la base de las aletas dorsal y anal, en la línea media ventral (desde la sínfisis cleitral hasta el ano) y sobre la cabeza, las mandíbulas y la línea media lateral del cuerpo. También son notorios pigmentos en la región ventrolateral del cuerpo y en la parte final de algunos pterigóforos anales. En general la pigmentación aumenta paulatinamente a medida que la larva crece. Además, a los 4.0 mm aparecen algunos melanóforos en la región dorsolateral del cuerpo, sobre la parte lateral del intestino y entre las espinas de la aleta anal; a los 4.8 mm resulta característica la bafia (pigmentación) de los rudimentos de las aletas pélvicas, y a los 7.8 mm se añaden pigmentos en las espinas, en la parte interna de los primeros radios y en los pterigóforos de las aletas dorsal y anal. Es notable la abafia (falta de pigmentación) del pedúnculo caudal en todo el desarrollo. DISCUSIÓNLas larvas deChloroscombrus chrysurus tienen cuerpo profundo, cresta supraoccipital muy denticulada y, a diferencia de otras especies, una cresta supraocular con una serie de espinas. Generalmente, en los primeros estadíos poseen cuatro melanóforos en la región media dorsal; hacia los 6.8 mm de talla muestran ya un patrón característico, el cual consiste en gran cantidad de pigmentos en la parte dorsolateral, sin arreglo aparente alguno, y otros en la región ventrolateral, ubicados en dirección de los mioseptos. En la descripción realizada por Aboussouan (1968) con organismos del oeste de África no se menciona la presencia de espinas supracleitrales ni de cresta supraocular, probablemente por no considerarlas características sobresalientes; en aquel caso, el número de espinas preoperculares del margen a los 2.35 mm es 2+1+1, en tanto que en el caso presente se registraron 3+1+2. Aboussouan (op. cit.) refiere que el proceso de flexión del urostilo se inicia antes de los 4.8 mm, en cambio, en los del sur del Golfo de México se inicia a los 3.0 mm y concluye a los 4.0 mm, aproximadamente. Las larvas de C. crysos menores de 3.5 mm se parecen a las de C. chrysurus, según las descripciones realizadas por McKenney et al., (1958) y Aboussouan (1968), respectivamente, pero la descripción aquí elaborada ayudará a identificar a esta especie, aun en sus etapas iniciales. Las larvas de Decapterus punctatuspresentan cuerpo poco profundo, la cresta supraoccipital es poco denticulada y la supraorbital con una espina pequeña. La pigmentación es escasa en casi todo el desarrollo. A diferencia de otras especies, las larvas de tallas inferiores a 9.0 mm carecen de melanóforos entre las cresta supraoccipital y la aleta dorsal. El desarrollo larvario de esta especie se ha descrito en organismos de la costa atlántica de los Estados Unidos de América y del Golfo de México (Hildebrand y Cable, 1930; Aprieto, 1974 y Montolio, 1976); en ningún caso se menciona la presencia de las espinas supracleitrales y postemporales referidas aquí. Aprieto (1974) refiere que la flexión ocurre entre los 4.0 y 8.0 mm, y que el desarrollo de las aletas dorsal y anal acontece entre los 5.0-10.0 mm. y 4.9-9.0 mm, respectivamente. Estos eventos pueden apreciarse en tallas menores en larvas colectadas en el sur del Golfo de México (la flexión entre 3.0-4.5 mm y el desarrollo de las aletas dorsal y anal entre 4.0-9.0 mm de talla, aproximadamente). Las larvas de Trachurus lathamison de cuerpo poco profundo y presentan cresta supraoccipital, pero, a diferencia de otras especies de la familia, no poseen cresta snpraocular. Desde sus primeras etapas están muy pigmentadas, por lo que hacia los 4.0 mm el pedúnculo caudal, que es abáfico (carece de pigmento), contrasta notablemente con el resto del cuerpo. Las larvas de Selene setapinnisposeen cuerpo notablemente profundo, con crestas supraoccipital y supraorbital. Una característica muy notable es el desarrollo precoz de las aletas dorsales y pélvicas, cuyos primeros radios y espinas, respectivamente, son muy largos. El intestino es masivo en la porción anterior. Una característica exclusiva de esta especie, a la cual se ha referido Ginsburg (1952), para individuos juveniles radica en la aparición, hacia los 8.3 mm de talla, de una gran mancha de melanóforos en la parte anterior del cuerpo, aproximadamente a la altura de la 15a. vértebra. Conand y Franqueville (1973) describieron parcialmente el desarrollo larvario de S. setapinnis (de 3.1 a 6.7 mm) con organismos del oeste de África; aunque su descripción se ajusta a la del presente trabajo, no hace referencia a la existencia de la cresta supraocular El cuerpo de las larvas de S. spixii es profundo, con crestas supraoculares; su desarrollo es precoz; las aletas dorsal y pélvica están pigmentadas. Se distinguen de las otras especies deSelenepor la pigmentación abundante en todo el cuerpo Las larvas de Selar crumenophthalmusson de cuerpo poco profundo. Cuentan con cresta supraoccipital pero carecen de la supraocular. Su pigmentación es escasa, aunque característica, principalmente porque los melanóforos dorsolaterales no presentan arreglo alguno, y los ventrolaterales se localizan en dirección a los mioseptos (presentes estos últimos desde la talla de 2.5 mm). El desarrollo de las larvas de esta especie es precoz respecto al referido por Miller et al., (1979) para organismos de aguas circundantes a las islas Hawaii, tanto por la pigmentación como por la flexión del urostilo (3.0 y 4.5 mm.) y la aparición de radios dorsales y anales (4.9 mm). En sus primeras etapas, las larvas de Caranx hipposy/o latus tienen el cuerpo moderadamente profundo. Carecen de cresta supraocular, pero la cresta supraoccipital y las espinas del margen preopercular son muy grandes, en comparación con las de los primeros estadíos de otros géneros de carángidos. Tanto las espinas postemporales y las supracleitrales como la cresta supraoccipital son de existencia efimera. La pigmentación es abundante a partir de los 6.3 mm, con gran cúmulo de melanóforos entre las cuatro primeras espinas dorsales, y la parte lateral del cuerpo parcialmente pigmentada a la altura del intestino. El desarrollo larvario de Caranx hipposy/olatus es más rápido en el sur del Golfo de México que en la costa atlántica de los Estados Unidos de América, en cuya descripción Berry (1959) no menciona la presencia de una espina supracleitral pequeña. El cuerpo de Caranx crysos es moderadamente profundo, con cresta supracleitral muy alta pero efímera y sin la supraocular. A diferencia de los otros géneros, las espinas preoperculares del margen son de gran tamaño en los primeros estadíos. Contienen espinas postemporales y supracleitrales. La pigmentación es abundante en las últimas etapas, excepto en el pedúnculo caudal. El desarrollo de esta especie en el sur del Golfo de México también es precoz en relación con otras áreas. Las descripciones anteriores (McKenneyet al., 1958; Berry, 1959, Montolio, 1976) no mencionan la presencia de espina supracleitrales y postemporales. El análisis de las etapas larvarias de las especies de caránidos descritas, con especímenes del sur del Golfo de México, muestra que su desarrollo es más rápido en relación con los que habitan en el norte del Golfo de México y en la costa atlántica de los Estados Unidos de América; se asume que esto es válido para T. lathami y S. spixii, de cuyas etapas larvarias se hace aquí la primera descripción. Las espinas supracleitrales y postemporales, a pesar de estar presentes en la mayoría de los carángidos, raramente se mencionan; algo similar ocurre con la cresta supraocular, la cual permitirá una mejor definición de las especies en el área referida. Por otro lado, se pretende que la clave haga más fácil y rápida la determinación específica de las etapas larvarias de los carángidos del sur del Golfo de México. CLAVE PARA LA IDENTIFICACIÓN DE LARVAS DE LA FAMILIA CARANGIDAE DEL SUR DEL GOLFO DE MÉXICO1 . a) Aletas pélvicas, primeras espinas y primeros radios dorsales notoriamente desarrollados desde las primeras Etapas..................2 b) Aletas pélvicas, primeros radios y primeras espinas dorsales sin desarrollo extraordinario desde las primeras etapas............... 3 2. a) Pigmentación abundante en la punta del hocico, a lo largo de las mandíbulas y particularmente sobre los primeros radios pélvicos y espinas dorsales ..............Selene spixii b) Pigmentación escasa en la punta del hocico; pocos pigmentos o ausentes a lo largo de la mandíbula ..... ........................Selene setapinnis/S. vomer 3. a) Cresta supraoccipital presente.................................. 4 b) Cresta supraoccipital ausente.................................. 15 4. a) Organismos menores de 3.5 mm de LP.......................................... 5 b) Organismos mayores de 3.5 mm de LP.......................................... 9 5. a) A los 3.5 mm de LP los primeros radios y/o espinas dorsales y anales, presentes............. 6 b) A los 3.5 mm de LP los primeros radios y/o espinas dorsales y anales, ausentes..............7 6. a) Profundidad del cuerpo, mayor que el 40% de la LP. La cresta supraoccipital es más alta que ancha y poco denticulada, con más de cinco melanóforos en la región media dorsal........................Caranx b) Profundidad del cuerpo, menor que el 40% de la LP. La cresta supraoccipital es más ancha que alta y bastante denticulada. De tres a cuatro melonóforos en la parte media dorsal.....................Chloroscombrus chrystirus 7. a) Pigmentación a todo lo largo de la línea media dorsal. ...............................Trachurus lathami b) Pigmentación sólo en una porción de la línea media dorsal .........................................8 8. a) Pterigóforos dorsales y anales presentes, o melanóforos dorsales posteriores al ano o con pigmentos en la región ventrolateral...................Selar crumenophthalmus b) Pterigóforos dorsales y anales ausentes, o melanóforos dorsales anteriores al ano o sin pigmentos en la región ventrolateral ....................Decapterus punctatus 9. a) Profundidad del cuerpo, mayor que el 40% de la LP. 10 b) Profundidad del cuerpo, menor que el 40% de la LP. 12 10. a) Cresta supraocular presente, con una serie de espinas. Cresta supraoccipital ancha, corta y muy aserrada........................Chloroscombrus chriysliriís b) Sin cresta supraocular. La cresta supraoccipital es estrecha, alta y poco aserrada............................ 11 11. a) En larvas de 4 a 8 mm de LP. la profundidad del cuerpo es mayor que el 45% de LP. Cuerpo parcialmente pigmentado, melanóforos ausentes en el pedúnculo caudal y en la parte lateral del cuerpo a la altura de la cavidad abdominal............................ Caranx hippos y/o latus b) En larvas de 4 a 8 mm de LP la profundidad del cuer po es menor que el 45% de la LP .Cuerpo altamente pigmentado con excepción del pedúnculo caudal .............................. Caranx crysos 12. a) Cresta supraocular presente, con una espina pequeña. Pigmentos únicamente sobre la línea media lateral del cuerpo. En tallas menores de 9.0 mm de LP la pigmenta ción media dorsal se inicia en la 5a. espina de la aleta dorsal...........................Decapterus punctatus b) Sin cresta supraocular. Con pigmentos sobre el cuerpo. La pigmentación dorsal se inicia en la cresta supraoccipital, en todas las tallas .............................13 . 13. a) Pigmentos ventrolaterales arreglados en dirección a los mioseptos; los dorsolaterales sin arreglo alguna..............................................................Selar crumenophthalmus b) Pigmentos ventrolaterales y dorsolaterales no arreglados en dirección a los mioseptos. La pigmentación se interrumpe abruptamente antes del pendúnculo caudal.................................................. Trachurus lathami 14. a) Espina del ángulo preopercular, aserrada ......................Oligoplites saurus b) Espina del ángulo propercular, no aserrada ....................................15 15. a) Crestas supraorbital y ótica, presentes................................16 b) Crestas supraorbital y ótica ausentes .... .............................17 16. a) Profundidad del cuerpo, generalmente mayor que el 40% de la LP, entre 7.0 y 20.0 mm. de LP. Pigmentación abundante en todo el cuerpo...................... Trachinotus falcatus b) Profundidad del cuerpo, generalmente menor que el 40% de la LP. entre 7.0 y 20.0 mm de LP. Pigmentación escasa. Alrededor de los 15 mm de talla se observa pigmentación en la parte distal de la aleta dorsal, entre los radios sexto y séptimo.......................................... Trachinotus carolinus 17. a) Profundidad del cuerpo, mayor que el 40% de la LP..18 b) Profundidad del cuerpo, menor que el 40% de la LP..20 18. a) Profundidad del cuerpo, mayor que el 50% de la LP ..................Carcanx hippos y/o latus b) Profundidad del cuerpo, menor que el 50% ...................................19 19. a) La pigmentación ventrolateral sigue la dirección de los mioseptos..........................Chloroscombrus chrysurus b) Pigmentación ventrolateral que no sigue la dirección de los mioseptos...........................................Caranx crysos 20. a) Con pigmentación en la línea media lateral.............................. 21 b) Sin pigmentación bajo la línea media lateral ........................... Decapterus punctatus 21. a) La pigmentación ventrolateral sigue la dirección de los mioseptos..................................... Selar crumenophtlialmus b) La pigmentación ventrolateral no sigue la dirección de los mioseptos.......................... Trachurus lathami AgradecimientosLos autores desean expresar su agradecimiento al M. en C. Faustino Zavala García por su colaboración en el desarrollo de este trabajo; de igual manera, al revisor anónimo por las acertadas sugerencias para la mejoría del mismo. LITERATURAABOUSSOUAN, A., Bull. Inst. Fondam.Oeufs et larves de Téléostéens de l'Ouest Africain. VI. Larves de Chlorosccombrus chrysurus et de Blepharius crinitus (Mitchill). (Carangidae). Ale. Noire, Ser. A Sci. Nat.,1968.226-237.30(1): _____,Bull. Ins. Fondam. Oeufs et larves de Téléostéens de I´Ouest Africain. XIII. Contribution á I´identification des larves de Carangidae.,Afr. Noire, Ser. A Sci. Nat.1975.899-938.37(4): APRIETO, V. L., Fish. Bull., Early development of five carangid fishes of the Gulf of Mexico and the South Atlantic coast of the United States, U. S. Natl. Mar. Fish. Serv,1974.415-44472(2): BERRY, F. F., Fish. Bull. Young Jack crevalles (Caranx species) off the Southeastern Atlantic coast of the United States. U. S. Fish. Wildl. Serv.1959.417-535.59(152): BERRY, F. H. and W. F. SMITH-VANIZ, CarangidaeFAO species identification sheets for fisheries purposes Western Central Atlatic, Fishing Area 31. W. FischerFAO,Rome.1978. . Vol. I, II CASTRO-AGUIRRE, J. L., Catálogo sistemático de los peces marinos que penetran a las aguas continentales de México, con aspectos zoogeográficos y ecológicos. Serie Científica. Dir. Gral. Inst. Nal. Pesca, México1978.78-85.19 CONAND, F. and C. FRANQUEVILLE, Bull. Inst. Fondam.Identification et distribution saisonniére de larves de Comandadas au large du Sértégal et de la Gambie. Afr. Noire, Ser. A Se¡. Nat.,1973.951-978.35: DITTY, J. G., Bull. Mar. Sci.,Separating early larvae of sciaenids from. the Western North Atlantie: a review and comparison of larvae off Louisiana and Atlantic coast of the U. S.Aquel. Mar. Sci.,1989.1083-1105.44:(3) FIEELDS, H. M., Fish. Bull., Pampanos (Trachinotus spp.) South Atlantic coast of the United States. U.S.Fish Wildl. Serv1962.189-22262:(207) FLORES-COTO, C. and M. SÁNCHEZ-RAMÍREZ, Larval distribution and abundance of Carangidae (Pisces), from the Southern Gulf of Mexico. 1983-1984. Gulf Res. Rep.1989.117-128.8(2): GINSBURG, I., Fishes of the Family Comandadas of the northem Gulf of Mexico and three related species.Publ. Inst. Mar. Sci. Univ. Tex.,1952.43-117.2: HILDEBRAND, S. F. and L. E. CABLE, Bull. Bur. Fish Wash.,Development and life history of fourteen teleostean fishes at Beaufort, N. C.1930.383-488.46(1093): HOESE, H. D. and R. H. MOORE, Fishes of the Gulf of Mexico (Texas, Lousiana and adjacent waters).Texas A & M University Press, College Station.Texas:1977182-189. KENDALL, Jr., A. W., E. H. AHLSTROM and H.G. MOSER, Ontogeny and Systematics of fishesd.Early life history stages of fishes and their characters. In: Moser, H.G., W. J. Richardson, D. M. Cohen, M. P. Fahay, A. W. Kendall, Jr., and S. L. Richardson (Eds.) Amer. Soc. Ichthyol. Herpetol., Allen Press. Spec. Publ. 1,Lawrence, Kansas:1984.11-22. LAROCHE, W. A., W. F. SMITH-VANIZ and S. L. RICHARDSON, Ontogeny and Systematics of fishes. Carangidae: Development. In: Moser, H. G., W. J. Richardson, D. M. Cohen, M. P. Fahay, A. W. Kendall, Jr., and S. L. Richardson (Eds.). Amer. Soc. Ichthyol. Herpetol., Allen Press. Spec. Publ. 1, Lawrence, Kansas:1984.510-522 McKENNEY, T. W., E. C. ALEXANDER and G. L. VOSS, Bull. Mar. Sci. Gulf. & Caribb., Early development and larval distribution of the carangid fish, Caranx crysos (Mitchill)1958.167-200.8(2) MILLER, J. M., W. WATSON and S. M. LEIS, University of Hawaii. Sea Grant College Program An atlas of common nearshore marine fish larvae of the Hawaiian islands.USA.1979.179 p MONTOLIO, M. A., Rev. Invest. Inst. Nac. Pesca,Estudio taxonómico y morfométrico de los estadios larvales de dos especies de Carangidae: Decapterus punctatus (Agassiz, 1829) y Caranx crysos (Mitchill, 1815), y su distribución en el Golfo de México.1976.85-1252:(2) MOSER, H. G. and E. H. AHLSTROM, Bull. Los, Ang. Cty.Development of lanterrifishes (Family Myetophidae) in the California Current. Part l. Species with narrow-eyed larvac. Mus. Nat. Hist. Sci.,1970.145 p.7. NAKAMURA, E. L., Mississippi-Alabama Sea Grant ConsortiumCarangids of the northern Gulf of Mexico. In: M. Flandorfer and L. Kupien (Eds.). Proceedings of a workshop for potential fishery resources of the northern Anula of Mexico..Mississippi:1980.18-33 OKIYAMA, M., Bull. Far. Seas lista. Res. Lab.Studies on the early Aire history of the rainbow runner, Elagatis bipinnulatus (Quay and Gaimard) in the Indo-Pacific Ocasos.(Shimizu)1970.167-186.3 PADOA, E., Fauna Flora Golfo Napoli, Divisione: Carangiformes In: Uova, larve e stadi giovanili di Teleostei.1956.548-57238: RESÉNDEZ-MEDINA, A., An. Inst. Briol. Estudio de los peces de la Laguna de Tamiahua, Veracruz, MéxicoSer. Cienc. del Mar. y Limnol.,Univ. Nal. Autón. México.1970.79-146.41(1): _____,Rev. Soc. Mex. Hist. Nat., Estudio de los peces de la Laguna de Atontado, Veracruz, México.1973.183-281.34: _____,Biótica. Estudios de los peces de la Laguna de Términos, Campeche, México. I.1981.351-356.6(3): SANZO, L., Uova, stadi embrional¡ e post-embrional¡ di Naucrates ductor.L. Mem. R. Com. Talassogr. Ital.1931.185p. TSOKUR, A. G., In: Ichthyoplankton of tropical waters of the world ocean. Larvae of caran gid fishes (Carangidae, Piof the Arabian Sea.Acad. Sei. U.S.S.R., Porc. P. P. Shirshov Inst. Oeeanol.1977.149-227.109: WALLS, J. G. Fishes of Northern Gulf of MéxicoT. F. H. Publications, New Jersey,USA.1975.195-212. YASEZ-ARANCIBIA, A. y P. SÁNCHEZ-GIL, An. Inst. Cienc. del Mar y Limnol. Los peces demersales de la plataforma continental del sur del Golfo de México. I. Caracterización ambiental, ecología y evaluación de las especies, poblaciones y comunidades. Univ. nal. Autón. México. Publ. Esp.,1986.1-230.9:
|

