|
ALIMENTACIÓN Y
REPRODUCCIÓN DEL SOL Achirus mazatlanus (Steindachner, 1869) EN EL
SISTEMA LAGUNAR COSTERO DE AGUA BRAVA, PACÍFICO DE
MÉXICO
Trabajo recibido el 14 de enero de 1992 y aceptado para su
publicación el 17 de diciembre de 1992.
FEEDING AND REPRODUCTION OF THE SOLE Achirus mazatlanus (Steindachner, 1869) IN THE AGUA BRAVA COASTAL LAGOON SISTEM, MEXICAN PACIFIC
Felipe Amezcua-Linares y Zoila G. Castillo-Rodriguez
Instituto de Ciencias del Mar y
Limnología, Universidad Nacional Autónoma de México
Apartado Postal 70-305, México, D.F. 04510, MÉXICO.
M. Álvarez-Rubio
Colegio de Ciencias y Humanidades, Plantel Sur, UNAM.
Contribución No. 728 del Instituto de Ciencias del Mar y
Limnología.
En el sistema de Agua Brava, la dinámica de la cumunidad de
peces se encuentra en relación estrecha con la descarga fluvial y otros
componentes ambientales. Existen más de 76 especies, dentro de las
cuales 18 son dominantes por su amplia distribución, alta frecuencia y
abundancia. Dentro de éstas, el Sol Achirus
mazatlanus ocupa un lugar preponderante en la dinámica
ecológica y utiliza al sistema como área natural de crianza,
protección, alimentación y maduración. La
información procede de cuatro campañas efectuadas en el ciclo
anual 1979-1980. Se realizaron capturas con una red de arrastre de fondo de 13
m de longitud y 2.5 m de abertura de trabajo, en lances de 15 minutos. Se
analizó y cuantificó el contenido de 107 estómagos en
diferentes épocas y localidades, por medio del índice de
importancia relativa (IIR) de Pinkas et al., (1971). La
especie se distribuye de acuerdo con los cambios climático-ambientales
del sistema. En verano, el espectro trófico es amplio, representado por
17 grupos, destacan poliquetos, anfípodos gamáridos, materia
orgánica y algas rodofíceas. Los juveniles de 49 a 79 mm
prefieren poliquetos, anfípodos pequeños, algas rodofíceas
y cumáceos mientras que los adultos incluyen además camarones y
estomatópodos; desaparecen los cumáceos. El considerable aporte
fluvial de otoño reduce significativamente el espectro trófico a
sólo 10 grupos. Los principales son poliquetos, eufásidos y
restos de otros crustáceos. Juveniles de 60 a 79 mm consumen poliquetos,
algas rodofíceas y clorofíceas; los de talla mayor incluyen en su
dieta poliquetos eufásidos y braquiuros. En invierno, el espectro
alcanza hasta 16 grupos, principalmente poliquetos, camarones peneidos y
ascidias. Dominan juveniles, cuyos grupos tróficos más
importantes son: copépodos, cumáceos, materia orgánica y
poliquetos, mientras que los adultos ingieren poliquetos grandes, ascidias,
otros tunicados, peces, camarones y algunas medusas. En primavera, durante el
estiaje, el espectro trófico se reduce a sólo seis grupos; los
más importantes son anchoas, otros peces, anfípodos
gamáridos y materia orgánica. La proporción de juveniles
se reduce, consumen crustáceos pequeños y algas, La
mayoría tiene de 120 a 139 mm de longitud total; el contenido estomacal
consiste de anfípodos y anchoas. Los grupos tróficos de mayor
importancia durante el ciclo anual fueron poliquetos, materia orgánica y
anfípodos, por lo que se considera que A. mazatlanus
es consumidor de segundo orden, que prefiere poliquetos y crustaceos, y
ocasionalmente ingiere algas. Se reproduce todo el año; posiblemente
existen dos períodos intensivos de maduración: uno en el verano,
y otro menor en invierno. La talla de la primera madurez se presenta entre los
140 y 159 mm de longitud total. Esta especie pasa gran parte de su ciclo
biológico en el sistema, lo abandona sólo para reproducirse en la
plataforma.
In the Agua Brava system, the fish community dynamics is
closely related to the fluvial discharge and other environmental parameters.
There are more than 76 species, 18 of them are dominant, due to their wide
distribution, high frequency and abundance. Among these species, the Sole fish
Achirus mazatlanus occupies a preponderant place in the
ecological dynamics, since it uses the system as a natural area for nursing,
protection, feeding and maturing. This information comes from 4 campaigns that
were performed along the 1979-1980 annual cycle. Captures were carried out with
a 2.5 m working opening and 13 m long botton trawl, in castings of 15 minutes
cach. The contents of 107 stomachs were analyzed and quantified according to
time and locality by means of the Pinkas Index of Relative Importance (IRI),
Pinkas et al., (1971). The species is distributed according
to environmental and climatic changes of the sistem. During the summer the
trophic spectrum is extensive, represented by 17 groups, being the prominent
ones: polychaetous, gamarid amphipods, organic matter and rhodophicean sea
weeds. Juveniles from 49 to 79 mm lt. prefer polychaetous, small amphipods
rhodophicean sea weeds and cumaceans, while the adults include, besides the
above ones, shrimps and stomatopods, but the cumaceans disappear. In the
autumn, the fluvial discharge is considerable, reducing significantly the
tropitic spectrum to 10 groups. The most important ones are polychaetous,
eufasids, and other crustacean remains. Youngs from 60 to 79 mm eat
polychaetous, rhodophicean and chlorophicean sea weeds; those with a bigger
size include in their diet eufasids and brachiurans. In the winter the spectrum
reaches up to 16 groups being the prominent ones polychaetus, peneid shrimps
and ascidians. Juveniles are the predominant ones; their more important trophic
groups are copepods, cumaceans, organic matter and polychaetous, while adults
feed on big polychaetous, ascidians, other tunicates, fishes, shrimps and some
jellyfish. In the spring, during the dry season, the trophic spectrum is
reduced to only 6 groups, the main ones being anchovies, other fishes, gamarid
amphipoda and organic matter. The rate of juveniles decreases and they eat
small crustaceans and sea weeds. Most of them are 120 to 139 mm length, and the
stomach content consists of amphipods and anchovies. The most important trophic
groups during the annual cycle were: polychaetous, organic matter and
amphipods; thus A. mazatlanus is considered as a second
order consumer, that prefers polychaetous and crustaceans, occasionaly
including sea weeds in its diet. It is reproduced practically the whole year,
with two maturing massive periods: the first one during the summer, and the
other one, less intensive during the winter. The first maturity size is betweem
140 and 159 mm tl. This species spends a great part of its biological cycle
within the system, leaving it only to reproduce in the continental
shelf.
El sistema de Agua Brava se localiza en la costa noroccidental del Pacífico mexicano, es uno de los más importantes de la zona por sus extensos bosques de manglar, productividad y producción pesquera elevadas. El sistema está integrado por tres partes fundamentales: el estuario (parte baja del estero), el estero y la laguna, así como dos bocas, Teacapan en el norte y el canal artificial de Cuautla en el sur (Fig. 1). La dinámica y estructura de la ictiofauna, están en relación estrecha con las condiciones climaticas y ambientales, especialmente con el aporte fluvial (Amezcua-Linares et al.,1987). La salinidad y la temperatura son los factores más indicativos de los cambios que ocurren. Los valores de temperatura más bajos (23ºC) se registran en el invierno, y los más altos (hasta 32ºC) en primavera. La salinidad desciende bruscamente (a 8‰) en otoño durante las lluvias, y se reducen hasta 0‰ en la laguna y sus afluentes (Álvarez et al., 1986). Las áreas cercanas a las bocas son menos cambiantes, tanto en época de lluvias como en el estiaje. La ictiofauna es de alta diversidad; se han registrado más de 76 especies, aunque la mayoría son visitantes ocasionales y sólo una cantidad reducida se puede considerar como residente del sistema (Amezcua-Linares, 1977). Dentro de éstas, 18 se han identificado como especies-tipo o dominantes, por su distribución amplia, alta abundancia y notable frecuencia (Yáñez-Arancibia et al., 1980). El Sol mexicano A. mazatlanus es una de ellas dentro de la dinámica del ecosistema y constituye un elemento importante porque lo utiliza como área de crianza, alimentación y maduración (Amezcua-Linares, 1977, y Weinstein, 1978). El conocimiento de los cielos de vida, y estrategias biológicas de estas especies, así como su función ecológica en el sistema serán la base para el mejor aprovechamiento de los recursos y administración adecuada de la zona costera. OBJETIVOS-Determinar los patrones de distribución y abundancia de la especie, en relación con el ambiente, durante un ciclo anual. - Caracterizar los hábitos alimentarios, con base en el contenido estomacal, según la estación del año, la localidad y el intervalo de talla. 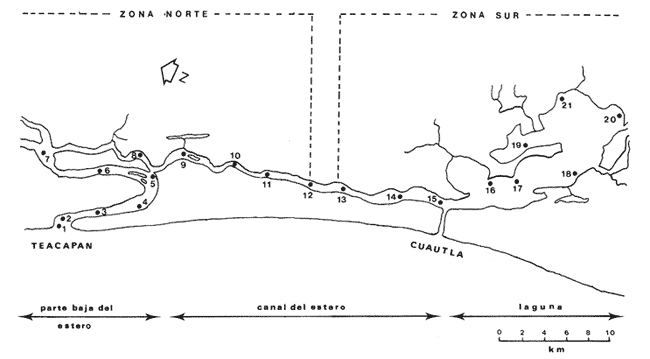 Figura 1. Sistema lagunar de Agua Brava; semuestran las estaciones de colecta, regiones y zonas. -Estimar el factor de condición relativa, que caracteriza el estado fisiológico del pez. -Caracterizar la época de reproducción, la proporción de sexos y la talla de la primera madurez. ÁREA DE ESTUDIOEl sistema lagunar de Agua Brava se localiza en la planicie costera de Nayarit y sur de Sinaloa, entre los paralelos 22º 04' y 22º 35´ latitud norte y los meridianos 105º 20' y 105º 5O´ longitud oeste. Al norte está limitado por el Estero del Mezcal y la Laguna de Agua Grande, Sinaloa, y al sur por las marismas de Canoas y la Laguna de Pericos, Nayarit (Fig. 1). Geomorfológicamente, el sistema se puede dividir en: Boca de Teacapan (estaciones de muestreo 1 y 2), que es la comunicación natural del sistema con el océano; en el lado norte hay un canal cuya profundidad varía entre 4 y 9 m, según la época del año. Parte baja del estero (estaciones 3 a 6); es un canal perpendicular a la costa, con profundidad máxima de 10 m. Estero (estaciones 7 a 14); es un canal angosto, paralelo a la línea de costa, separado del océano por una barra arenosa, con profundidad máxima de 4 m. Boca de Cuautla (estación 15); es un canal artificial abierto en 1977, que comunica a la laguna con el océano; en los últimos años se ha extendido considerablemente por efecto de las corrientes de marea, que han provocado acarreo notable de sedimentos hacia el interior sobre el estero. Laguna de Agua Brava (estaciones 16 a 21); es un embalse somero cuyo eje mayor se orienta diagonalmente a la línea de costa, de la cual se separa por una faja de terrenos bajos. Amezcua Linares et al., (1987) hacen una a descripción similar y con más detalle sobre aspectos ecológicos.  TABLA 1. Parámetros ambientales del sistema de acuerdo con los dos ambientes identificados, durante el ciclo anual En la mayor parte del sistema existen grandes bosques de manglar, donde domina Laguncularia racemosa, con una zonación clásica de Rhizophora mangle, Avicennia nitida y Conocarpus erectus desde la orilla hacia tierra adentro, que en algunos lugares penetra más de 10 km. Sin embargo, los cambios provocados por la apertura de la boca artificial han modificado esta zonación al permitir colonización de plántulas de Laguncularia racemosa y Avicennia nitida. MATERIAL Y MÉTODOSLa información procesada proviene de cuatro campañas efectuadas durante el ciclo anual 1979-1980. Para efectuar las capturas se utilizó una lancha de 5 m de eslora con motor fuera de borda; se realizaron lances de 15 minutos con una red de arrastre de fondo de 13 m de longitud, luz de malla de 1.9 cm, y abertura de trabajo de 2.4 m. 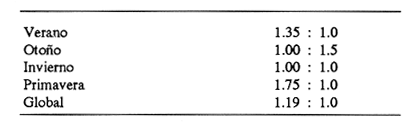 TABLA 2. Proporción de hembras y machos de Achirus mazatlanus durante el ciclo anual En las cuatro campañas efectuadas se obtuvieron 130 individuos, distribuidos en 20 estaciones de captura, durante el ciclo anual. Se analizó y cuantificó el contenido de 107 estómagos por el método del índice de importancia relativa (IIR), de Pinkas et al., (1971), que integra los métodos numérico, gravimétrico y de frecuencia. 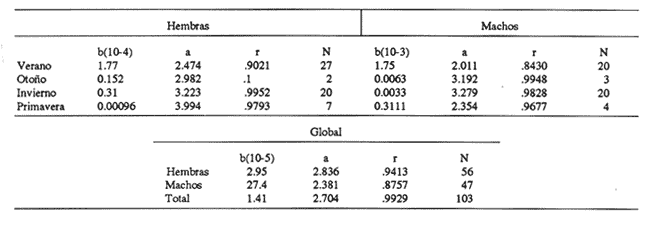 TABLA 3. Constantes de la relación talla peso (P = b lª) de A . mazatlanus durante el período de muestreo: P = peso vacío, L = longitud total, b = factor de condición promedio, a = coeficiente de alometría, r = coeficiente de correlación y N = nùmerode individuos La determinación de sexo y de estadio gonádico se hizo por medio de la observación de formas, textura, consistencia y color de las gónadas, tomando en consideración la escala de Hilge (1977), que se refiere a estados gonádicos de especies tropicales y subtropicales. Se consideró la época de reproducción cuando existe mayor porcentaje de hembras maduras con respecto al total de hembras. La talla de primera madurez se determinó por la clase de talla en que el 50% de las hembras se encuentran maduras, los intervalos se elaboraron de acuerdo con la regla: 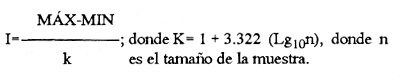 k, es el número de clases, que se conoce como la regla Sturgest. Se utilizó una prueba de x² para hacer el ajuste entre la proporción de sexos. La relación talla-peso se calculó: P= aLb; donde b= factor de condición de promedio; a = coeficiente de alometría; L = Longitud total. Así mismo se determinó su coeficiente de asociación entre el peso y longitud (coeficiente de correlación de Pearson). Se calculó el factor de condición relativo (Ricker, 1975) de cada clase de talla de toda la colecta.  TABLA 4. Grupos Tróficos RESULTADOSA.mazatlanus se encuentra en el sistema durante todo el año; ocurren fluctuaciones de distribución y abundancia, reguladas por factores fisicos, químicos, y principalmente biológicos, en especial la disponibilidad de alimento. El porcentaje mayor de adultos se presenta en verano, mientras que en invierno la densidad y la biomasa aumentan como resultado del reclutamiento de juveniles al sistema. De acuerdo con Amezcua-Linares et al., (1987), se pueden distinguir dos ambientes (Tabla 1), que difieren fundamentalmente en cuanto a los parámetros, ambiente I, que se localiza en el norte del sistema, y ambiente II, en el sur, aunque en primavera el sistema se uniformiza en un solo ambiente, de características relativamente homogéneas. 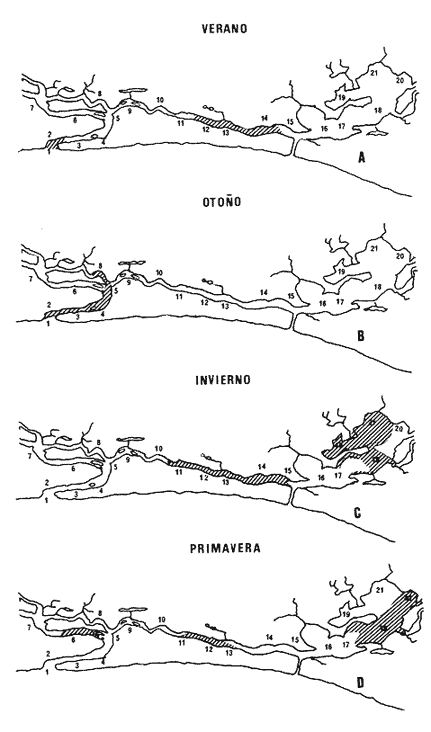 Figura 2. Distribución de Achirus mazatlanus durante el ciclo anual. La correspondencia de los grupos tróficos se señala en la tabla 4. VERANOSe caracteriza por cierta homogeneidad ambiental; dominan condiciones marinas, con valores de salinidad entre 32 a 35 ‰. Aunque la temperatura es factor fundamental para la supervivencia de postlarvas y juveniles, las variaciones son poco marcadas durante el ciclo anual. Los adultos poseen mayor capacidad para afrontar estas fluctuaciones. La distribución de la especie A. mazatlanus es reducida dentro del sistema, ya que se localiza en la porción sur del canal del estero; es más abundante en la estación 13, donde dominan condiciones marinas y poca turbidez. En proporción menor se localiza en la boca de Teacapan en aguas claras (Fig. 2a). Se registró densidad de 7.6 X 10-3 individuos por m² y biomasa de huta 2.3 x 10-1 g por m². ALIMENTACIÓNSe analizaron 49 ejemplares, 26 con el estómago lleno y 23 con éste vacío. En esta época se presenta un espectro trófico amplio, 17 grupos, entre los que destacan: poliquetos, materia orgánica, anfípodos gamáridos y algas rodofíceas. Por el método numérico los grupos más importantes son poliquetos y anfípodos; por el método gravimétrico son materia orgánica, poliquetos y estomatópodos, y por frecuencia poliquetos, materia orgánica y anfípodos. La diversidad más, alta se registra en el canal del estero, estación 13, y decrece hacia la boca de Teacapan, en el sur del sistema, donde existe menor densidad de población. En cuanto a la clase de talla, el espectro trófico más amplio se presenta entre 140 a 159 mm de longitud total (lt), que consumen estomatópodos, peces y camarones, mientras que los juveniles, entre 40 y 79 mm de lt se alimentan de poliquetos, anfípodos, algas rodofíceas, cumáceos y camarones pequeños, que en general son el alimento común en estos ecosistemas [Carr y Adams, 1973 (Fig. 3)]. OTOÑOEsta época se caracteriza por la temporada de lluvias y aporte fluvial considerable, que ocasiona flujo abundante e introducción de nutrientes, materia orgánica y gran cantidad de sedimentos, con el consecuente abatimiento de la salinidad a valores dulceacuícolas en gran parte del sistema, así como turbidez alta (Tabla 1). En ambas bocas se presenta la cuña salina, cuyo alcance está en función de la intensidad de la marea. La especie se localiza solamente en la parte baja del estero, con más abundancia en la estación 8, donde existe mayor influencia marina que en el resto del sistema, por la cercanía con la boca de Teacapan (Fig. 2b). 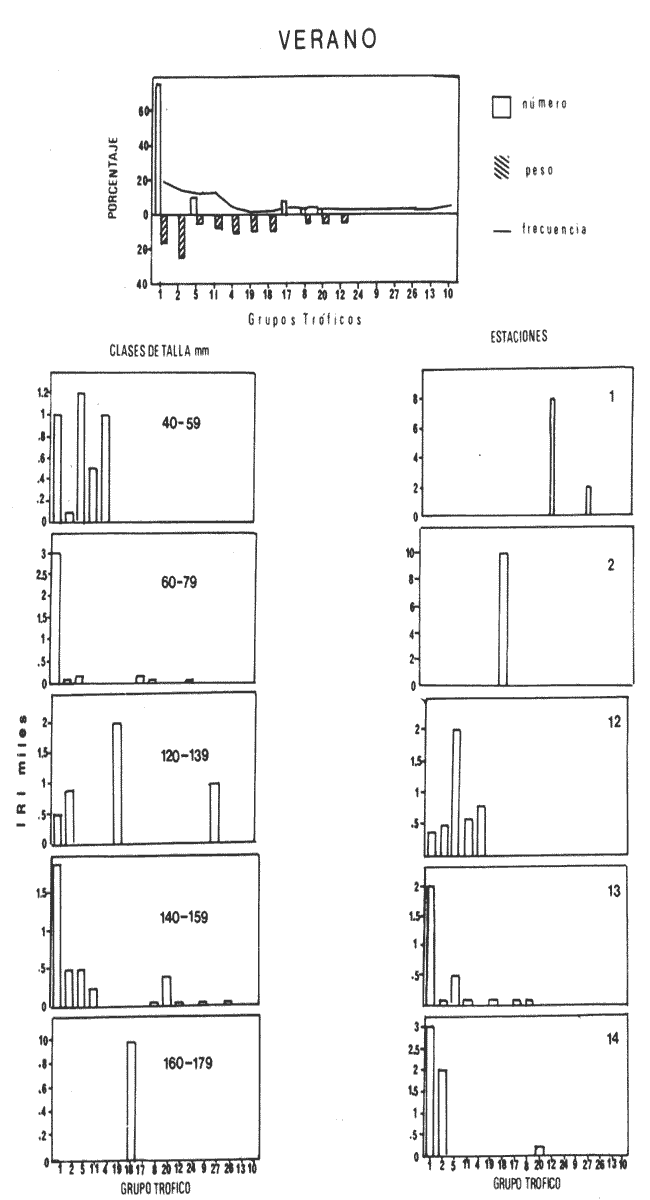 Figura 3. Espectro trófico de Achirus mazatlanus en verano. Número, peso, frecuencia eI IR por clases de talla y estaciones. Los valores de densidad son bajos, 9x 10-4 ind/m² mientras que los de biomasa son de 6.64 x 10-2 g/m²'. Aunque en esta época existe la posibilidad de aparición de especies dulceacuícolas en abundancia (Lowe-McConnell, 1987), en el sistema éstas prácticamente no aparecen, a pesar de que en la mayor parte existe agua dulce. Sin embargo, la cuña de agua salada que se introduce por ambas bocas puede penetrar hasta las zonas altas del sistema durante las marcas vivas. La aparición de especies dulceacuícolas durante otoño era mucho más frecuente cuando no existía la boca artificial de Cuautla, y la cuenca lagunar se mantenía con influencia marina mucho menos directa. ALIMENTACIÓNSe analizaron siete ejemplares, seis con estómagos llenos y uno vacío. El espectro tráfico se reduce a 10 grupos (Fig. 4); de éstos destacan poliquetos, camarones no peneidos y restos de otros crustáceos. Numéricamente son importantes poliquetos y camarones no peneidos gravimétricamente restos de crustáceos y poliquetos, y por frecuencia poliquetos y camarones no peneidos. La reducción del espectro trófico se relaciona con el abatimiento de la salinidad por el considerable aporte fluvial que tiene lugar en esta época, e influye en la distribución de la especie, que se localiza sólo en zonas reducidas donde la salinidad es superior a 10‰, boca y estuario de Teacapan (estaciones 1 -5). Los juveniles, entre 60 y 79 mm de lt se alimentan de poliquetos y algas rodofíceas y clorofíceas (Fig. 4). Los ejemplares de 140 y 159 mm de lt presentan mayor diversidad trófica como en la época anterior, los grupos principales son macrocrustáceos y aumentan los poliquetos. INVIERNOEl aporte fluvial disminuye considerablemente y se restablece el ambiente marino, aunque con un rango amplio de salinidad: de 22 a 38‰, y poca turbidez (Tabla 1). Durante esta época, la distribución de la especie es amplia, sobre todo en el ambiente II, zona sur, pues se le encuentra en gran parte de la laguna y en casi todo el estero, con mayor abundancia en la estación 19 (Fig. 2c). Los valores de densidad fueron de 6.3 x 10-3 ind/m², y la biomasa de 10.34 x 10-1 g/m². ALIMENTACIÓNDe 40 ejemplares estudiados, 26 estómagos se encontraban llenos y 14 vacíos. Se presenta un espectro trófico amplio con 16 grupos (Fig. 5), dentro de los cuales destacan poliquetos, ascidias, camarones y, por peso, peces ofíctidos, mientras que, por frecuencia, poliquetos y materia orgánica. La alta diversidad trófica se debe al ambiente marino que domina en el sistema al reducirse las lluvias considerablemente, por lo que la distribución de la especie tiene mayor amplitud (Springer y Woodburn, 1960). Por clase de talla, al igual que en las épocas anteriores, la diversidad trófica más alta ocurre entre individuos de 140 y 159 mm de lt; en comparación, los juveniles entre 40 y 79 mm de lt, que representaron alto porcentaje de la población, el espectro trófico es reducido: poliquetos, crustáceos pequeños como copépodos y cumáceos (Fig. 5); no incluyen peces, macrocrustáceos ni ascidias que si consumen los adultas. 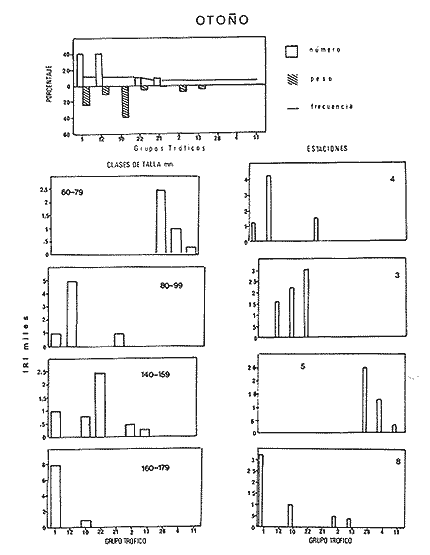 Figura 4. Espectro trófico de Achirus mazatlanus en otoño. Número, peso, frecuncia eI IR por clases detalla y estaciones. PRIMAVERACorresponde a la temporada de secas, ya que la precipitación pluvial es casi nula y el aporte fluvial mínimo; se genera un gradiente térmico y uno salino, desde la boca de Teacapan, donde se registran los valores más bajos, 24°C y 34‰, hasta la porción interna de la laguna, con valores de 31°C y 41 ‰. El sistema se caracteriza por una mayor homogeneidad, donde domina el ambiente marino con aguas claras y evaporación alta; sólo en algunas áreas someras ocurre hipersalinidad. La especie se distribuye en áreas amplias del sistema: parte baja del estero, porción media del estero y porción sur de la laguna; ambientes I y II. La mayor abundancia se registra en la estación 12 (Fig. 2d). La densidad es baja 2.7 x 10-3 ind/m², y la biomasa de 1.13 x 10-1g/m². En esta época se incrementan las especies marinas y existe mayor concentración de larvas de peces y camarones provenientes de las áreas reproductivas aledañas dentro de la plataforma. En general éstas dominan todo el año; regularmente se presentan tanto juveniles como adultos; sólo pocas especies marinas se encuentran exclusivamente durante el estío (Lowe-McConnell, 1987). ALIMENTACIÓNSe analizaron 11 ejemplares, de los cuales siete estómagos se encontraban llenos y cuatro vacíos. A. mazatlanus se encuentra en todo el sistema, aunque en áreas reducidas: porción sur de la laguna, parte del canal y en la parte baja del estero. Durante el estiaje, el espectro trófico es muy reducido, sólo seis grupos a diferencia de los 10 registrados en otoño (Fig. 6). Los grupos tróficos más importantes son anchoas, restos de otros peces, anfípodos y materia orgánica. La especie se localiza principalmente en el sur del estero y de la laguna (Fíg. 2d). El sistema se comporta como cuenca de evaporación con altos valores salinos (Amezcua-Linares et al., 1987). En esta temporada la población de juveniles fue poco numerosa, y la mayoría de los estómagos se encontraron vacíos. El contenido estuvo representado por anfípodos y anchoas (Fig. 6). El espectro trófico de A. mazatlanus es reducido en otoño, pero sobre todo enprimavera -cuando existe mayor presión ambiental-, durante los períodos de lluvias y secas, respectivamente, mientras que en verano e invierno, que son épocas intermedias y dominan las condiciones marinas, hay mayor disponibilidad de alimento, debido a la incorporación de macrofauna béntica marina. Esta presión ambiental incide fuertemente en los juveniles, que tienen que ampliar sus límites tolerantes o efectúan movimientos entre los diversos habitats del sistema (Miller y Dunn, 1980). 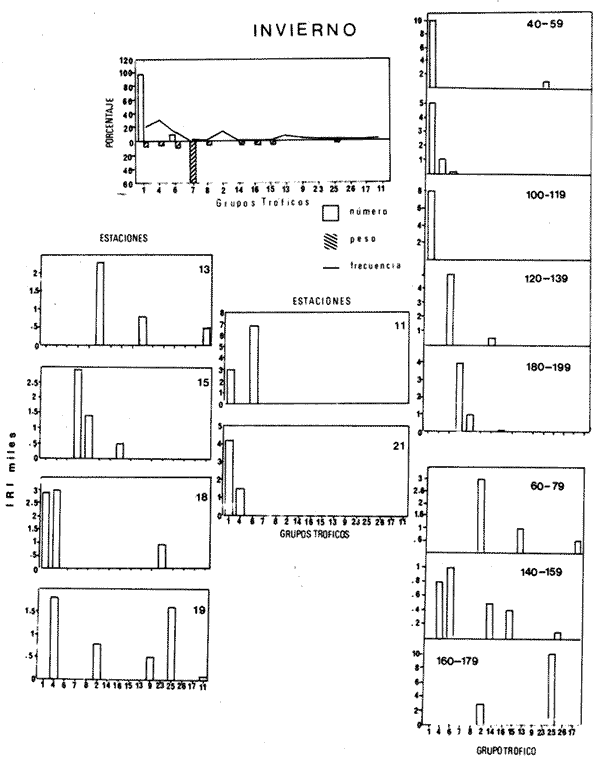 Figura 5. Espectro trófico de Achirus mazatlanus en invierno. Número, peso, frecuencia eI IR por clases detalla y estaciones. Los juveniles, de 40 a 79 mm lt, consumieron algas, poliquetos y crustáceos pequeños, como copépodos, anfipodos cumáceos y larvas de otros crustáceos. Los de tallas mayores, entre 89 y 99 mm de lt, consumen macrocrustáecos, poliquetos en mayor cantidad y ascidias; los de tallas superiores ingieren peces y camarones con más frecuencia, por lo que se les puede considerar carnívoros (Warburton, 1978). 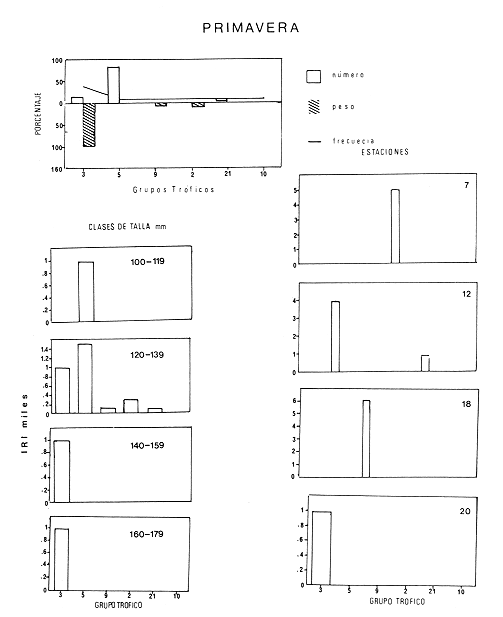 Figura 6. Espectro trófico de Achirus mazatlanus en primavera. Número, peso, frecuencia eI IR por clases de talla y estaciones. Los grupos tróficos de mayor importancia durante el ciclo anual, en todas las localidades y clase de talla fueron: poliquetos, materia orgánica, restos de poliquetos y anfípodos. Este comportamiento alimentario es característico de sistemas costeros similares (Odum y Heald, 1972). En Agua Brava la asociación Centropomidae-Gerreidae, común en estos sistemas de aguas tropicales americanas, se puede complementar con un tercer componente: Soleidae, representada por A. mazatlanus; en su conjunto constituyen la asociación más importante de peces dominantes dentro del sistema. REPRODUCCIÓNLos estuarios no constituyen un ambiente óptimo para el desarrollo de huevos y larvas de peces, principalmente por los cambios constantes y rápidos, así como la elevada actividad microbiana. Por esto, la mayoría de las especies que habitan en estos sistemas emigran al mar o al agua dulce para desovar, por lo que numerosas especies de ambos ambientes utilizan a las lagunas costeras y a los estuarios como zonas de protección, crianza y alimentación. Por lo tanto, se considera actitud regular que postlarvas de peces, sobre todo marinos, ingresen a sistemas estuarinos con pocas semanas de edad, donde pasan la mayor parte de su ciclo de vida. 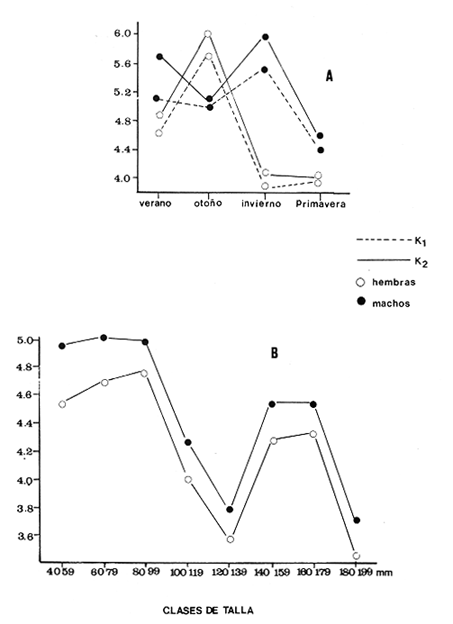 Figura 7. Factor de condición de Fulton, por época y por clase de talla, para cada sexo. PROPORCIÓN DE SEXOSAunque la proporción de sexos es equilibrada durante el ciclo anual en verano y primavera la proporción de hembras es mayor, justamente en la temporada de reproducción (Tabla 3). Las pruebas de X² para cada estación indican que no hay diferencia significativa entre la proporción de sexos: p < 0.01, gl=3,X²= 11.34. ÉPOCA DE REPRODUCCIÓNLa más alta proporción de hembras maduras (55%) se registró en verano, en otoño no aparecieron, y en primavera volvieron a aparecer. Esto indicaría que la época de reproducción comienza en la primavera (mayo) y se extiende hasta el verano, cuando alcanza su mayor intensidad. En invierno sucede otro período de maduración, aunque de menor importancia. Lo anterior indica que existen dos posibles épocas reproductivas: uno masivo, durante la primavera, y otro en invierno, aunque podría ser uno solo, interrumpida en otoño durante las lluvias. Wallace [1975 (en Dando, 1984)] indica que especies de peces dominantes en estuarios de Sudáfrica extienden su época de reproducción por más de 8 meses. La estrategia de un período reproductivo amplio puede estar relacionada con una disminución del reclutamiento, como lo sugiere el citado autor para la ictiofauna estuarina sudafricana. A. mazatlanus permanece gran parte de su vida dentro del sistema, por lo que se le considera componente estuarino (Dando, 1984), pues sólo durante períodos cortos deja el sistema para reproducirse, y reingresa nuevamente. Así, utiliza al sistema como área de crianza, crecimiento y alimentación, debido a la protección y a la abundancia de alimento que existe. Este fenómeno constituye un flujo energético importante con respecto a la plataforma continental por medio de los movimientos migratorios. Aunque no existe evidencia de la localización de las áreas de desove, es muy probable que éstas se encuentren dentro de la línea de la costa, e incluso dentro del sistema, en zonas cercanas a las bocas, ya que la incidencia de juveniles así lo indica La primera madurez se pudo determinar entre los 140 y 159 mm de lt, aunque en verano se encontró una hembra madura de 95 mm, y en invierno otra de 128 mm de lt. FACTOR DE CONDICIÓNEn la tabla 3 se presenta el factor de condición promedio b, donde se muestra que en verano es alto para las hembras y decrece en primavera, cuando existe mayor cantidad de hembras maduras. Por otro lado, para los machos los valores son altos en primavera y verano, y alcanzan el máximo en invierno. Durante el ciclo anual, la correlación del factor de condición relativa fue negativa entre hembras y machos (Fig. 7a), lo que podría estar relacionado con el hecho de que en verano existe un porcentaje elevado de hembras juveniles (72%), mientras que el de machos es de sólo 30%. En otoño fueron juveniles todas las hembras y sólo el 27% de los machos. En invierno la proporción cambia, ya que el 45% son hembras juveniles, mientras que el 70% son machos. Finalmente, en primavera el 47% de las hembras y el 75% de machos son juveniles. Lo anterior muestra desproporción entre juveniles y adultos de los dos sexos, lo que se refleja en los factores de condición relativa en ambos sexos. Esto puede deberse a una estrategia reproductiva de la especie en la que la maduración ocurre en tallas menores sin reducir la aptitud reproductora que podría ser causada por el menor desarrollo (Stearns y Crandall, 1984), o bien que el arte de pesca es más eficiente para capturar estas tallas y los ejemplares más grandes eludan la red con mayor facilidad, aunque esto es menos probable. Si la maduración dependiera de las condiciones demográficas de la especie, dentro de la laguna se podría esperar menor población que en la plataforma continental adyacente, sin embargo, parece haber equilibrio entre ambas poblaciones. En general, a los juveniles corresponde mayor factor de condición que a los adultos durante el ciclo anual; esto se verifica al analizar los factores k¹ y k² de condición relativa en cada clase de talla (Fig. 7b), donde se observa mayor condición en organismos juveniles que en adultos. Además, se muestra que de 40 a 99 mm de lt este valor es elevado, mientras que de 100 a 139 mm es menor, lo que coincide con la primera madurez, que se presenta entre los 140 y 159 mm de lt. El factor de condición relativa muestra una correlación inversa al ciclo reproductor, mientras que el factor de condición promedio es directamente proporcional. DISCUSIÓNSe ha planteado que los cambios salinos en sistemas lagunares costeros, son los parámetros hidroquímicos principales que afectan la distribución, densidad y biomasa de las especies; no obstante, durante el ciclo anual, la dinámica de la especie está relacionada con el proceso climático ambiental del sistema. Este comportamiento se puede atribuir a dos causas: la presión ambiental y la búsqueda de alimento. El primer aspecto se basa en que los cambios ambientales ejercen presión en la especie, la que tratan de compensar con movimientos hacia áreas o ambientes más favorables. Es de notar, que tanto altas salinidades (+ de 35‰) como el agua dulce causan el mismo comportamiento en esta especie, sobre todo durante el otoño, cuando las condiciones son dulceacuícolas, como se observa en la figura 2a. Lo anterior da como resultado un confinamiento provocado por el gradiente salino que se presenta (Guelorget et al., 1983). De hecho se plantea que una zonación ambiental (salina) conduce necesariamente a una zonación biológica, donde las especies se establecen de acuerdo con las condiciones ambientales y reaccionan con estos cambios. El problema es definir si la comunidad de peces reacciona conjuntamente, o bien cada especie lo hace independientemente. El estudio de su comportamiento en el sistema, indica que existen variedad de estrategias según el papel ecológico que desempeñan. Las especies típicamente estuarinas, que pasan gran parte de su ciclo en el sistema, se consideran generalistas, ya que aprovechan al máximo el recurso alimentario disponible, y sus movimientos están definidos por el uso óptimo de este recurso. Por lo tanto, cabe definir hasta qué punto las especies se distribuyen en una zonación de acuerdo con el gradiente ambiental (salino), o bien simplemente estos movimientos reflejan la búsqueda de la fauna béntica de la que se alimentan. La densidad más baja se registró en otoño durante las lluvias y la más alta en verano durante el estío, es decir que este parámetro está relacionado directamente con los cambios salinos provocados por el aporte fluvial. Durante las lluvias la presión ambiental es muy fuerte, ya que la mayor parte del sistema posee características dulceacuícolas, lo que ocasiona un estres ambiental (Guelorget et al., 1983), no tanto a la especie en cuestión, sino sobre la fauna béntica de la que se alimenta. Por otro lado, la biomasa más baja se observa casualmente en otoño, durante la época de lluvias, mientras que la más alta se registra en verano e invierno. En otoño y primavera se registraron los valores más bajos de abundancia; por lo tanto, la cantidad disponible de ejemplares para análisis de estómagos fue también limitada, por lo que un tratamiento estadístico, aun mediante un método no paramétrico, no sería del todo aceptable; sin embargo, los resultados obtenidos permiten presentar de manera global los hábitos alimentarios de la especie estudiada, y se encuadran dentro del contexto de especies similares en áreas tropicales y subtropicales. Esta especie tiende a distribuirse en áreas de poca transparencia, profundidades someras (1-5 m), temperatura de 24 a 32ºC y salinidad entre 32 y 35‰ aunque hay registros de hasta 41‰ y fondo fangoso. En este ambiente (II), A. mazatlanus encuentra los grupos principales de los cuales se alimenta, y por lo tanto en éste existen densidad y biomasa mayor. Cervigón (1967) menciona que, en mayor o menor grado las especies de este género caracterizan a la ictiofauna de fondos fangosos y/o arenosos en ambiente de manglares. Las tallas de las especies que se capturaron dentro del sistema fueron de 54 a 184 mm de lt. Si se toma en cuenta que la primera madurez ocurre entre los 140 y 159 mm lt, se puede considerar que la especie realiza la mayor parte de su ciclo vital dentro del sistema, ya que sólo durante la época de desove lo abandona, cuando se desplaza a zonas cercanas de la plataforma continental adyacente. Este comportamiento concuerda con las observaciones efectuadas por Amezcua-Linares (1977) y Warburton (1978) en el sistema de Huizache y Caimanero. La capacidad reproductiva de A. mazatlanus comprende todo el año, aunque con mayor intensidad en primavera y verano, cuando el porcentaje de hembras maduras es de 49.2 y 55.5, respectivamente, y se distribuyen en casi todo el sistema, a excepción de la laguna. Si bien la información disponible no es determinante para establecer un comportamiento reproductivo aplicable a cualquier ciclo anual, al menos en lo que corresponde al ciclo estudiado y en las poblaciones del sistema, se determinaron dos períodos de mayor cantidad de hembras maduras, lo que es indicativo de al menos dos períodos de desove. Por otro lado, el desove fraccionado y los períodos largos de desove son característicos de las áreas tropicales, ya que constituyen una estrategia adaptativa bajo condiciones ambientales desfavorables (Nikolsky, 1963). La maduración depende de las condiciones ambientales por lo que el tamaño y la edad de la primera madurez pueden variar según las condiciones climáticas a las que se encuentre sometida la especie. Es de notarse que en invierno se registró un porcentaje elevado de juveniles, tal vez como consecuencia de un desove tardío en otras áreas de la costa. Esto sugiere una interrelación estrecha entre los diversos sistemas lagunares de la zona y una aparente programación secuencial en la reproducción de la especie. Amezcua-Linares (1990), reporta adultos de esta especie de hasta 188 mm de lt en la plataforma continental frente a este sistema. ConclusionesEl comportamiento de la especie en relación con el ambiente está influido principalmente por los cambios salinos que se suceden durante el ciclo anual, reflejo de las circunstancias climático-ambientales. Es manifiesta la preferencia de A. mazatlanus por permanecer en la zona sur (ambiente II), a excepción del otoño durante la temporada de lluvias, que se le localiza en el norte, en la parte baja del estero. Los patrones de distribución y abundancia de la especie se definen fundamentalmente por la dinámica ambiental y la búsqueda de alimento. La densidad y la biomasa más alta se registran en verano, durante el estío, y en menor grado en invierno. La frecuencia y la abundancia de los grupos troficos están en función de la disponibilidad del alimento en las diferentes localidades del sistema, y no existe preferencia alguna por determinado alimento. El espectro trófico está integrado fundamentalmente por macrofauna del bentos, donde dominan poliquetos y anfípodos. En otoño, durante las lluvias, y sobre todo en primavera, en el estío, el espectro trófico es reducido, mientras que en verano e invierno, que son épocas intermedias durante las cuales dominan condiciones marinas, el espectro trófico es diverso. Existe diferencia de alimentación entre los juveniles, de 40 a 79 mm de lt, y los adultos, de más de 89 mm de lt, ya que los primeros consumen regularmente algas, poliquetos y crustáceos pequeños, como copépodos, anfípodos cumáceos y larvas, mientras que los adultos ingieren poliquetos en mayor cantidad, macrocrustáceos y ascidias, y los mayores de 99 mm de lt incluyen peces y camarones con más frecuencia. Durante el ciclo anual, los grupos tróficos de mayor importancia para todas las localidades y clases de talla fueron: poliquetos, materia orgánica, restos de poliquetos y anfípodos. Achirus mazatlanus es un consumidor de segundo orden, que se alimenta básicamente de poliquetos, crustáceos y peces, y ocasionalmente incluye algas en su dieta. La reprodución puede ocurrir casi todo el año, con dos períodos principales: primavera-verano e invierno, como lo muestra la frecuencia de hembras maduras. Ésta se realiza en la plataforma continental, en zonas cercanas al sistema. La talla de primera madurez se registra entre los 140 y 159 mm de lt, después de la cual el incremento en peso es proporcionalmente igual al de la longitud. El coeficiente de condición relativa muestra correlación inversa al ciclo reproductor, mientras que la del coeficiente de condición promedio es directamente proporcional. En los juveniles la condición relativa es mayor que la de los adultos. Achirus mazatlanus es un componente estuarino que la mayor parte de su ciclo de vida permanece en sistemas lagunares, y que utiliza al sistema de Agua Brava como área de crianza, crecimiento, protección alimentación y maduración. AgradecimientosLos autores desean expresar su gratitud a todo el personal del Laboratorio de Ictiología y Ecología Estuarina que de uno u otro modo colaboró en la realización de esta investigación. Al Instituto de Ciencias del Mar y Limnología por el apoyo financiero. LITERATURAÁLVAREZ-RUBIO, M., F. AMEZCUA-LINARES, y A. YÁNEZ-ARANCIBIA An. Inst. Cienc. del Mar y Limnol. Ecología y estructura de las comunidades de peces en el sistema lagunar Teacapan-Agua Brava, Nayarit, México. Univ. Nal. Autón. México 1986 185-242 13 1 AMEZCUA-LINARES, F., Tesis profesional. Aportación al conocimiento de los peces del sistema de Agua Brava, Nayarit. Facultad de Ciencias, Univ. Nal. Autón. México 1972 209 p., 113 lam _____, An. Centro Cienc. del Mar y Limnol. Generalidades ictiológicas del sistema lagunar costero de Huizache-Caimanero, Sinaloa, México. Univ. Nal. Autón. México, 1977 1-25 4 1 _____, Tesis Doctoral. Los peces demersales de la plataforma continental del Pacífico Central de México. Unidad Académica de los Ciclos profesional y de Posgrado, CCH, Univ. Nal. Autón. de México. 1990 261, 16 figs. AMEZCUA-LINARES, F., M. ÁLVAREZ-RUBIO, y A. YÁÑEZ-ARANCIBIA, An. Inst. Cienc. del Mar y Limnol. Dinámica y estructura de las comunidades de peces en un sistema ecológico de manglares en la costa del Pacífico de México, Nayarit. Univ Nal. Autón México 1987 221-224 14 2 ARAGÓN, P. M. Tesis profesional Biología y ecología de los peces dominantes en el sistema Teacapan Agua Brava, Nayarit, evaluada con red de arrastre. Facultad de Ciencias, Univ. Nal. Autón. México. 1989 124, 39 figs. CERVIGÓN, F., Ecología Marina. Los Peces. Cap. 10:308-355. En: Margalef (Ed.). Fundación La Salle de Ciencias Naturales. Caracas. 1967 CARR, W. F., and C. A. ADAMS Food habits of juvenile marine fishes occupying seagrass bed in the estuarine zone near Cristal River, Florida. Trans. Amer. Fish. Soc., 1973 511-540 102 DANDO, P. R., Fish Reproduction: Strategies and tactics. Reproduction in estuarine fish. Cap. 9:154-170. In: Potts, and Wootton (Eds.). 1984 403 DE SYLVA, D. P. Fish community ecology in estuaries and coastal lagoons: Towards an ecosystem integration, Nektonic food webs in estuaries. Cap. 11:233-246 In: A. Yáñez-Arancibia (Ed.) Univ. Nal. Autón. de México. 1985 654 GUELORGET, O., G. F. FRISONI, J. P. PERTHUISOT, et M. AMANIEU Le rôle du confinement dans l'écosistême lagunaire méditerranéen. Rapp. Comm. Int. Mer Médit., 1983 337-340 28 6 HILGE, V., Sonderdruck aus Bd. On determination of the stages of gonad ripeness in female bony fishes. 1977 149-155 25 LOWE-McCONNELL, R. H., Ecological studies in tropical fish communities Cambrige University Press, London, 1987 223-225 Mc LUSKY, D., Ecology of estuaries. Heineman Ed. London. 1974 141 MILLER, J. M., and M. L. DUNN, Estuarine Perspectives. Feeding strategies and patterns of movement in juvenile estuarine fishes, pp. 437-448. In: V. Kenedy (Ed.). Academic Press. New York 1980 533 ODUM, W. E., and E. J. HEALD Bull. Mar. Sci., Trophic analysis of an estuarine mangrove community. 1972 671-738 22 3 PINKAS, L. M., M. S., OLIPHANT, and I. L. IVERSON, Dept. Fish & Game Cal, Fish Bull., Food habits of albacore bluefin Tuna and Bonito in California waters 1971 1-105 152 RICKER, W.E., Bull. Fish, Res. Bd Can, Computation and interpretation of biological stadistics of fish population. 1975 1-382 191 SPRINGER, V. G., and K. D. WOODBURN An ecological study of the fishes of the, Tampa Bay area. Prof. Pap. Ser. Mar. Lab. Florida, 1960 1-104 1 STEARNS, S. C., and R. E. CRANDALL, Fish Reproduction: Strategies and tactics. Academic Press, London. Plasticity for age and size at sexual maturity: A life-history response to una voidable stress, Cap. 2: 13-31. In: Potts, and Wootton (Eds.). 1984 410 WEINSTEIN, M.P. Fish communiry ecology in estuaries and coastal lagoons: Towards an ecosystem integration, Distributional ecology of fishes inhabiting warm-temperature and tropical estuaries: Community relationships and implications, Chap. 14:285-310. In: Yáñez-Arancibia (Ed.). Univ. Nal. Autón. de México. 1985 654 p. WARBURTON, K., Estuar. Coast Mar. Sci., Community structure, abundance and diversity of fish in a Mexican coastal lagoon system. 1978 497-519 7 YÁÑEZ-ARANCIBIA,.A., F. AMEZCUA-LINARES, and J. W. DAY, Estuarine Perspectives. Fish community structure and function in Terminos lagoon, a tropical estuary in the southem Gulf of México. pp. 465-482. In: V. Kennedy (Ed.). Academic Press. New York. 1980 533
|

