|
MOLUSCOS DE LA LAGUNA TAMPAMACHOCO, VERACRUZ,
MÉXICO: SISTEMÁTICA Y ECOLOGÍA
Trabajo recibido el 26
de agosto de 1991 y aceptado para su publicación el 10 de diciembre de
1991.
Martha Reguero y Antonio García-Cubas
Laboratorio de Malacología, Instituto de
Ciencias del Mar y Limnología, UNAM. Apartado Postal 70-305,
México, D.F. 04510, México. Contribución No. 710 del
Instituto de Ciencias del Mar y Limnología.
Guadalupe Zúñiga Moluscos, sistemática, ecologia, laguna, Veracruz Mollusks, systematics, ecology, lagoon, Veracruz.
Se expone la complejidad estructural de la comunidad
de moluscos bénticos presentes en la Laguna Tampamachoco, con base en
abundancia, frecuencia y densidad de 66 especies de las Clases Gastropoda y
Bivalvia. El 64% de éstas fueron de origen marino-salobre. Entre los
gasterópodos abundaron los organismos epifaunales, colectores de
depósitos y herbívoro-raspadores; mientras que los miembros de la
Clase Bivalvia fueron en su mayoría infaunales y suspensivoros. En la
comunidad total (vivos + conchas) se registraron valores cercanos en el
número de especies asignadas a ambas Clases, aunque por cantidad de
individuos dominaron los gasterópodos; por su valor de importancia
relativa destacaron: Cerithidea pliculosa, Acteocina canaliculata,
Mulinia lateralis, Littoridina sphinctostoma, Mytilopsis leucophaeata
y Neritina reclivata. La biocenosis se
encontró integrada por 13 especies de bivalvos y sólo una de la
Clase Gastropoda; resultaron características Mulinia lateralis,
Anadara transversa, Lucina pectinata y Neritina
reclivata. La diversidad calculada para la comunidad total fue de
3.23 y de 2.83 bits/individuo para la viva. El valor medio de similitud entre
estaciones de muestreo fue de 48% para todo el conjunto, y de 30% para la
biocenosis. Los. registros de salinidad efectuados se ubican en los
límites correspondientes a régimen euhalino
(30-40‰).
Structural complexity of the benthic mollusk community
inhabitant of Tampanlachoco Lagoon is presented, based on the abundance,
frequency and density of 66 species of Gastropoda and Bivalvia Classes. 64% of
these were marine-brackish in origin. Epifaunal, deposit-feeders and
herbivorous-scrapers forms predominated among gastropods, whereas the Bivalvia
Class members were mainly infaunal and filterfeeders. Similar number of species
assigned to both Classes were recorded within the total community (live +
shells), although therewas a significant predominance of gastropods considering
the number of individuas. Cerithidea pliculosa, Acteocina
canaliculata, Mulinia lateralis, Littoridina sphinctostoma, Mytilopsis
leucophacata and Neritina reclivata were the most
important species in terms of their relative importance value. 13 species of
bivalves and only one of gastropods composed the biocenosis. Mulinia
lateralis; Anadara transversa, Lucina pectinata and
Neritina reclivata were the most important species. The
diversity index value computed for the total community was 3.23 bits/individual
and 2.83 bits/individual for the live community. The average similarity value
among sample locations was 48% for the whole assemblage, and 30% for the
biocenosis. Salinity records corresponded to the euhaline regime (30-40
‰).
Según Lankford (1977), México cuenta con 125 lagunas costeras distribuidas a lo largo de sus 10 mil kilómetros de litoral, del que abarcan aproximadamente un 30 a 35%, incluyendo tanto el Océano Pacífico como el Golfo de México, Mar Caribe y Golfo de California. En el litoral mexicano del Golfo de México se reconocen alrededor de 32 lagunas costefas, entre las que figura Tampamachoco, la cual se encuentra ubicada en el estado de Veracruz y es objetivo del presente estudio. Desde los puntos de vista físico, climático, hidrológico, geológico, químico y biológico, los ecosistema estuarino-lagunares poseen características propias; figuran entre los sistemas naturales más productivos del mundo, pues fungen como refugio de juveniles de diversos organismos marinos y son sitios intermedios en la migración o en el ciclo de vida de numerosos peces y crustáceos, debido a la disponibilidad de alimento y a condiciones hidrológicas que influyen sobre los procesos fisiológicos de los organismos. En estas áreas habitan algunas especies que se aprovechan como recursos alimentarios; tal es el caso de ostiones, almejas, mejillones y caracoles, los cuales son integrantes de cadenas tróficas complejas, en las que fungen como consumidores, a la vez que forman parte de la dieta de peces, aves acuáticas, crustáceos y de los propios moluscos. El conocimiento de la malacofauna béntica de las lagunas costeras del Golfo de México es el objetivo central de un proyecto que desarrolla el personal adscrito al laboratorio de Malacología, en el Instituto de Ciencias del Mar y Limnología, de la Universidad Nacional Autónoma de México; dentro del que se incluyen, hasta la fecha, ocho contribuciones al respecto. ANTECEDENTESLa Laguna Tampamachoco ha sido objeto de investigaciones escasas, entre las cuales pueden citarse las de Arat-Espinosa (1946, 1948) y Camacho et al. (1980) acerca de cultivo de ostión; los trabajos de Chávez (1972), González (1981) y Kobelkowsky (1981, 1985) relaciónados con ictiofauna; la investigación de Contreras (1983) referente a hidrología; el estudio monográfico de Mercado (1980) y el trabajo de Quintana, Molina y Mulia (1981) relativo a poblaciones bentónicas. Algunos de ellos son sólo resúmenes presentados en congresos y otros, cuya aplicación es válida para diferentes sistemas lagunares del Golfo de México, como los de Vázquez Botello (1978, 1979), Vázquez Botello y Mandelli (1980), abordan temas de contaminación y el de Contreras (1985) concentra información en torno a características bióticas y abióticas de distintas lagunas de los litorales de México. DESCRIPCIÓN DEL ÁREA DE ESTUDIOEsta laguna se localiza en la llanura costera del estado de Veracruz, a 9 km al noroeste de la ciudad de Tuxpan; se encuentra ubicada entre los 20° 57"- 21° 04" de latitud septentrional y los 97° 19" - 97° 23" de longitud occidental. El área está limitada al norte por la Sierra Otontepec, al sur por la Sierra de Papantla y al poniente por la Sierra Madre Oriental, en las porciónes de Huayacocotla y Chicontepec (Departamento de Pesca, 1977). La laguna es de forma alargada y paralela a la línea de costa, con longitud de 10.6 km anchura máxima de 2.7 km; ocupa un área de 15 km² , aproximadamente. Está separada del Golfo de México por una barrera arenosa de nombre "Barra Galindo", situada al norte de la laguna, con anchura máxima de 2.67 km y mínima de 1.3 km. Para su estudio se establecieron 18 estaciones de muestreo (Fig. 1). 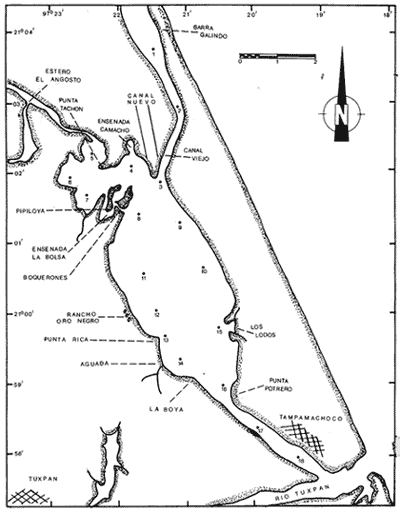 Figura 1. Toponimia y distribución de las estaciones de muestreo. CLIMATOLOGÍADe acuerdo con García (1971), el clima de la región es del tipo Aw" z (e), que corresponde a cálido-subhúmedo con régimen de lluvias en el verano, temperatura y precipitación pluvial medias anuales de 24.2°C y 1,350 mm, respectivamente. La época de lluvias comprende los meses de junio a diciembre (verano y otoño); el mes más lluvioso es septiembre, con precipitación media mensual de 349 mm (Departamento de Pesca, 1977). Los vientos dominantes provienen del este; su velocidad máxima es de 48 km/h, desde parte de marzo hasta parcialmente en septiembre; los vientos secundarios proceden del norte y del noroeste, durante la parte complementaria de septiembre hasta el resto de marzo; ocasionalmente alcanzan velocidades hasta de 150 km/h. En el Golfo (de México) los denominan nortes; su frecuencia mayor es durante noviembre. HIDROGRAFÍAEl sistema lagunar se comunica hacia el norte con la Laguna de Tamiahua mediante un canal de navegación natural llamado El Viejo y uno artificial de nombre El Nuevo; al noroeste se ubica la desembocadura del estero El Angosto y al sur la del Río Tuxpan. HIDROLOGÍALa Laguna Tampamachoco recibe aportes de agua dulce en su porción septentrional por el estero El Corral, que vierte su contenido en los canales de navegación El Viejo y El Nuevo; del noroeste provienen de los esteros El Corral y El Angosto; de este último existen escurrideros estacionales entre el rancho Oro Negro y Punta Potrero y frente al poblado de Tampamachoco. En la parte meridional se ubica la desembocadura del Río Tuxpan. Según Contreras (1983), por la influencia de las mareas en la laguna, el agua adopta forma de cuña, que ejerce efecto hasta una distancia aproximada de 30 km hacia la parte interna del Río Tuxpan. BATIMETRÍALa laguna es somera, con profundidad promedio de un metro; en los canales de acceso se registran valores de más de 3 m. TRANSPARENCIAEn el área la turbiedad es elevada, con transparencia media de 0.30 m. TEMPERATURA DEL AGUALa temperatura mínima del agua se registra en febrero, con un valor de 18.3°C; la máxima se presenta en julio, con 32. 1°C, y la media es de 26.4°C (Contreras, 1983). SALINIDADEl valor máximo de salinidad obtenido es de 36.58 ‰, en mayo; el mínimo es de 15.33 ‰, durante octubre, con una media de 30.21 ‰ (Contreras, op. cit.). SEDIMENTOSEl sustrato existente en la laguna es principalmente de tipo fino, constituido por limos, arcillas y arenas (Mercado, 1980). VEGETACIÓNLa vegetación circundante está representada por bosques de manglar de especies diversas. MATERIAL Y MÉTODOSLa recolecta del material biológico y el registro de los datos ambientales se llevaron a cabo durante una campaña realizada a la zona de estudio, en julio de 1980, por personal del laboratorio de Malacología del Instituto de Ciencias del Mar y Limnología, de la UNAM. Se hizo un reconocimiento del área para excluir zonas con presencia de bancos de ostión y almeja y se estableció una red de 18 estaciones, distribuidas en el sistema lagunar. En cada una de ellas se midió la temperatura, la salinidad -con un salinómetro de inducción Beckman-, la transparencia -con un disco de Secchi- y la profundidad, con una sondaleza de mano. Por medio de una draga van Veen, con capacidad de dos litros, se efectuaron los lances necesarios para extraer cinco litros de sedimento superficial húmedo. Los sedimentos obtenidos se tamizaron in situ, con una malla de plástico, con abertura de 1.5 mm. El material resultante se preservó en bolsas de polietileno con formol al 10%, neutralizado con borato de sodio; las bolsas se etiquetaron debidamente para su traslado al laboratorio de Malacología, donde se lavaron con agua corriente, se secaron a temperaturas inferiores a 70°C; los individuos vivos se separaron de los exoesqueletos para proceder a su identificación y cuantificación a nivel específico. En el caso de los bivalvos con conchas desarticuladas se adoptó el criterio de García-Cubas (1963), quien considera cada valva como un organismo. Los ejemplares representativos se incorporaron a la colección malacológica del Instituto de Ciencias del Mar y Limnología, de la UNAM. La comunidad de moluscos se caracterizó mediante los componentes de abundancia, frecuencia y densidad de las especies (individuos/m²) , de donde se derivó el valor de importancia relativo a cada una de ellas y el índice de similitud entre las estaciones de muestreo (Krebs, 1972). Lo anterior se complementó con indicaciónes de distribución geográfica y local, mediante una revisión bibliográfica para determinar también el tipo de nutrición y relación con el sustrato de cada una de las familias de moluscos identificados. Así mismo, se calcularon los índices de diversidad (H´n), diversidad máxima (H máx), equitatividad (J) y riqueza de especies (D) para cada una de las Clases de moluscos, por estación, por laguna y por ambiente halino, mediante las expresiónes matemáticas propuestas por Shannon-Wiener (1963), Pielou (1966) y Margalef (1958), respectivamente. La caracterización halina de las localidades de muestreo se hizo con base en la clasificación (ad usum desde 1981) que García-Cubas propone hic et nunc, para ambientes lagunares, modificada de Válikangas (1933), que en partes por millar comprende los intervalos siguientes: El análisis incluyó también el cálculo de los coeficientes de determinación entre los valores de H'n vs. J y H'n vs. D, para establecer el factor dominante sobre la diversidad en cada taxón; se trabajaron por separado la comunidad viva y la total. 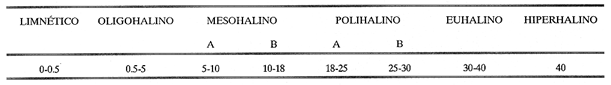 RESULTADOS
HIDROLOGÍALos registros de temperatura, salinidad y profundidad en la Laguna de Tampamachoco ocurrieron entre los límites de 26.7 a 34° C, de 30 a 34.3 ‰ y de 0.40 a 3.60 m, respectivamente. En la tabla 1 se concentran los datos detallados de estos parámetros, para cada una de las estaciones analizadas. CONSIDERACIONES A LA SISTEMÁTICALa identificación de la fauna malacológica, enlistada a continuación, se hizo con base en caracteres conquiliológicos, como bibliografía de apoyo se utilizaron los trabajos de Purchon (1968), Andrews (1971), Abbott (1974), García-Cubas (1981), Antolí y García-Cubas (1985), Reguero y García-Cubas (1989), García-Cubas y Reguero (1990), y García-Cubas et al. (1990), de cuya consulta se derivaron también los datos de hábitos de vida y distribución geográfica de las especies. Para el arreglo sistemático se adoptó el criterio de Keen (1971); los organismos quedaron agrupados en: 2 clases, 10 órdenes, 34 familias, 46 géneros y 66 especies. SISTEMÁTICA DE MOLUSCOS PRESENTES EN LA LAGUNA TAMPAMACHOCO
CLASE GASTROPODASubclase Prosobranchia Orden Archaeogastropoda Superfamilia Neritacea Familia Neritidae Género Neritina Lamarck, 1816 1. Neritina reclivata (Say, 1822) Distribución local: estaciones 4, 5, 6, 8, 9, 10, 11, 12, 13, 14, 15, 16 y 17. Distribución geográfica: Florida (EE.UU de A) y Golfo de México al Mar de las Antillas. Habitat y tipo de nutrición. Es común en aguas salobres a dulces; frecuentemente se le encuentra sobre la vegetación sumergida, debido a sus hábitos alimentarios micrófagos. CLASE GASTROPODASubclase Prosobranchia Orden Archaeogastropoda Superfamilia Neritacea Familia Neritidae Género Neritina Lamarck, 1816. 1. Neritina reclivata (Say, 1822) Distribución local: estaciones 4, 5, 6, 8, 9, 10, 11, 12, 13, 14, 15, 16 y 17. Distrbución geográfica: Florida (EE.UU de A) y Golfo de México al Mar de las Antillas. Habitat y tipo de nutrición: Es común en aguas salobres a dulces; frecuentemente se le encuentra sobre la vegetación sumergida, debido a sus hábitos alimentarios micrófagos.  Subgénero Vitta Mörch, 1852 2. Neritina (Vitta) virginea (Linnaeus, 1758) Distribución local: estaciones 4, 5, 6, 7, 8, 9, 10, 11, 13, 14, 16, 17 y 18. Distribución geográfica: Florida, Golfo de México, Mar de las Antillas y de Islas Bermudas a Brasil. Habitat y tipo de nutrición. Especie epifaunal entre la vegetación. Muy frecuente en zonas de intermareas y aguas salobres; nutrición micrófaga, raspando la vegetación.  Orden Mesogastropoda Superfamilia Littorinacea Familia Littorinidae Género Littorina Férussac, 1822 Subgénero Melarhaphe Menke, 1828 3. Littorina (Melarhaphe) meleagris (Potiez y Michaud, 1838) Distribución local: estación 18. Distribución geográfica: Islas Bermudas, costas del Golfo de México, Mar Caribe y costas occidentales de África. Habitat y tipo de nutrición. Común en zonas de intermareas, sobre rocas en aguas tranquilas; epifaunal de nutrición herbívora. 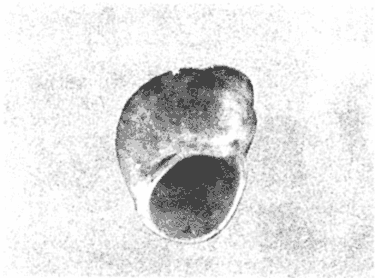 Superfamilia Rissoacea Familia Rissoinidae Subfamilia Rissoininae Género Rissoina Orbigny, 1840 Subgénero Schwatuiella Nevil, 1884 4. Rissoina (Schwartziella) catesbyana Orbigny, 1842 Distribución local: estación 16. Distribución geográfica: Islas Bermudas a Florida (EE.UU. de A.), costas del Golfo de México, y Mar Caribe hasta Brasil. Habitat y tipo de nutrición. Se encuentra comúnmente en bahías y lagunas, en aguas salobres y marinas; prospera en praderas de Thalassia, sobre fondos arenosos; epifaunal; es micrófaga de materia orgánica depositada. 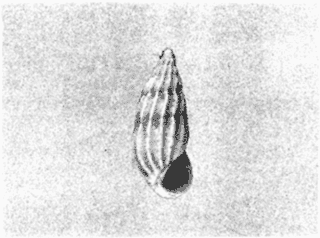 Familia Hydrobiidae Género Littotidina Eydoux y Souleyet, 1852 Subgénero Texadina Abbott y Ladd, 1951 5. Littoridina (Texadina) sphinctostoma Abbott y Ladd, 1951 Distribución local: estaciones 4, 5, 6, 7, 8, 9, 11, 12, 13, 14, 15, 16 y 18. Distribución geográfica: De Mississippi a Texas (EE.UU. de A.) y parte mexicana del Golfo de México. Habitat y tipo de nutrición. Es muy común en aguas someras y salobres hasta casi dulces; vive en fondos arenolimosos; epifaunal; se nutre de materia orgánica depositada en el sustrato. 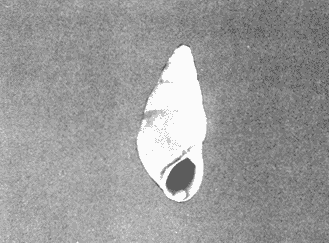 Familia Truncatellidae Género Trucatella Risso, 1826 6. Trucatella cazibaeensis Reeve, 1842 Distribución local: estación 7. Distribución geográfica: Carolina del Norte, Florida, Texas (EE.UU. de A.); costas mexicanas del Golfo de México, Mar de las Antillas, Islas Bermudas y Brasil. Habitat y tipo de nutrición. Sobre rocas en la zona intermareal, epifaunal, micrófaga. 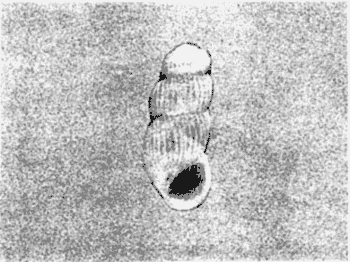 Familia Vitrinellidae Subfamilia Vitrinellinae Género Vitrinella C. B. Adams, 1850 Subgénero Vitrinella s. s. 7. Vitrinella (Vitrinella) flotidana Pilsbry y McGinty, 1946. Distribución local: estaciones 4, 5, 6, 7, 8, 11, 12, 13, 14, 15, 17 y 18. Distribución geográfica: desde Florida (EE.UU. de A.) hasta el sur del Golfo de México (Laguna de Términos, Campeche, México). Habitat y tipo de nutrición. Aguas someras; epifaunal entre rocas; micrófaga de materia orgánica depositada.  Género Cyclostremiscus Pilsbry y Olsson, 1945 Subgénero Ponocyclus Pilsbry, 1953 8. Cyclostremiscus (Ponocyclus) pentagonusnus (Gabb, 1873) Distribución local: estaciones 8, 9, 10, 11, 14, 16 y 18. Distribución geográfica: Carolina del Norte a Florida, Golfo de México y Mar de las Antillas. Habitat y tipo de nutrición. Epifaunal, en zonas de rompientes y lagunas costeras. Herbívora. 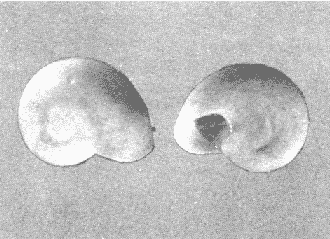 Subfamilia Teinostomatinae Género Teinostoma H. y A. Adams, 1854 9. Teinostoma biscaynense Pilsbry y McGinty, 1945 Distribución local: estaciones 6, 9, 11, 14, 15, 16, 17 y 18. Distribución geográfica: Sur de Florida y costas del Golfo de México. Habitat y tipo de nutrición Se encuentra en bahías y lagunas costeras; en fondos de arena, epifaunal; micrófoga de materia orgánica depositada. 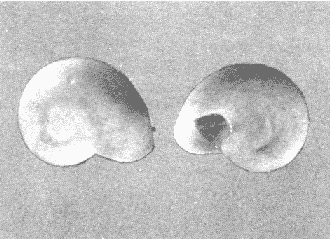 Superfamilia Cerithiacea Familia Cerithiidae Subfamilia Cerithiopsinae Género Cetithiopsis Forbes y Hanley, 1849 10. Cerithiopsis greeni (C. B. Adams, 1839) Distribución local: estaciones 16, 17 y 18. Distribución geográfica: de Cabo Cod (Massachusetts) a Florida, Islas Bermudas y Golfo de México hasta Brasil. Habitat y tipo de nutrición. Especie epifaunal de aguas costeras y lagunares. Nutrición carnívora. 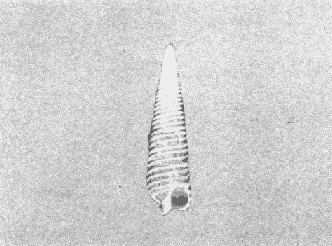 Género Seila A. Adams, 1861 11. Seila adamsi (H. C. Lea, 1845) Distribución local: estaciones 9 y 14. Distribución geográfica: Texas, parte mexicana del Golfo de México, Mar de las Antillas, Islas Bahamas, Centroamérica, Brasil, e Islas Bermudas. Habitat y tipo de nutrición. Se encuentra en bahías, esteros y lagunas costeras de aguas salobres hasta hiperhalinas, adherida a la vegetación, sumergida o en fondos limoarenosos. Su nutrición es fitófaga macrófaga; forma parte de la epifauna. 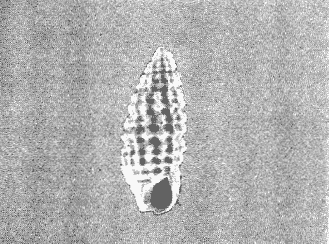 Subfamilia Diastominae Género Diastoma Deshayes, 1850 12. Diastoma varium (Pfeiffer, 1840) Distribución local: estaciones 4, 5, 6, 7, 8, 9, 10, 11, 12, 13, 14, 15 y 17. Distribución geográfica: comprende desde Maryland (EE.UU. de A.) y costas del Golfo de México hasta Brasil. Habitat y tipo de nutrición. Epifaunal, entre la vegetación, sumergida en bahías y lagunas costeras. Herbívora.  Familia Potamididae Género Cerithidea Swainson, 1840 Subgénero Cetithideopsis Thiele, 1929 13. Cerithidea (Cerithideopsis) pliculosa (Menke, 1829) . Distribución local: estaciones 1, 4, 5, 6, 7, 8, 9, 10, 11, 12, 13, 14, 15, 16, 17 y 18. Distribución geográfica: desde Louisiana (EE.UU. de A.), Golfo de México a Centroamérica. Hábitat y tipo de nutrición. Se encuentran en bahías y lagunas costeras donde dominan los pastos marinos; seminfaunales, en fondos fangosos; se nutren de materia orgánica depositada en el fondo.  Superfamilia Calyptracacea Familia Calyptraeidae Subfamilia Crepidulinae Género Crepidula Lamarck, 1799 Subgénero Ianacus Mörch, 1852 14. Crepidula (Ianacus) plana Say, 1822. Distribución local: estaciones 5, 6, 7, 8, 11, 14, 17 y 18. Distribución geográfica: desde la costa oriental de Canadá, costas del Golfo de México, Mar de las Antillas hasta Brasil. Habitat y tipo de nutrición. Especie epifaunal, sobre objetos duros, en aguas marinas someras y salobres. Nutrición por filtración de partículas orgánicas en suspensión.  Orden Neogastropoda Superfamilia Muricacea Familia Muricidae Subfamilia Ocenebrinae Género Urosalpinx Stimpson, 1865 15. Urosalpinx tampaensis (Conrad, 1846). Distribución local: estaciones 11, 14 y 17. Distribución geográfica: costas del Golfo de México. Habitat y tipo de nutrición. Aguas someras; carnívora, depredadora de almejas y de organismos jóvenes de ostiones y mejillones, mediante perforación de las conchas y succión de las partes blandas; seminfaunal.  Superfamilia Buccinacea Familia Buccinidae Género Phos Montfort, 1810 Subgénero Antillophos Woodring, 1928 16. Phos (Antillophos) candei (d'Orbigny, 1845). Distribución local: estación 8. Distribución geográfica: desde Carolina del Norte hasta Brasil. Habitat y tipo de nutrición. Especie epifaunal, en fondos arenosos de aguas someras. Nutrición carnívora y carroñera.  Subgénero Etigotziophos Woodring, 1928 17. Phos (Etigotiiophos) unicinctus (Say, 1825). Distribución local: estaciones 8 y 17. Distribución geográfica: Golfo de México, Mar de las Antillas o Caribe. Habitat y tipo de nutrición. Aguas someras en bahías y lagunas costeras; epifaunales; de nutrición carnívora.  Familia Columbellidae Género Anachis H. y A. Adams, 1853 Subgénero Costanachis Sacco, 1890 18.Anachis (Costanachis) avara (Say, 1822). Distribución local: estación 14. Distribución geográfica: Massachusetts, Florida, Texas (EE.UU de A.); Mar de las Antillas a Brasil. Habitat y tipo de nutrición. En zonas de bajamar, entre vegetación sumergida; epifaunales; carnívoras.  19.Anachis (Cóstanachis) semiplicata (Stearns, 1873) Distribución local: estación 14. Distribución geográfica: Comprende desde Florida (EE.UU de A.), costas del Golfo de México, Islas Bermudas hasta Uruguay. Habitat y tipo de nutrición. Epifaunal; frecuentemente se localiza sobre la vegetación sumergida, en lagunas costeras y bahías; especie carnívora.  Subgénero Parvanachis Radwin, 1968 20. Anachis (Parvanachis) obesa (C. B. Adams, 1845) Distribución local: estaciones 17 y 18. Distribución geográfica: costas de Virginia, Florida (EE.UU de A.); Golfo de México, Mar de las Antillas hasta Brasil. Habitat y tipo de nutrición. Se presentan con cierta abundancia en aguas salobres, en bancos de ostión, praderas de pastos marinos, tanto en las proximidades de las costas como en lagunas. Son carnívoras, epifaunales.  Género Mitrella Risso, 1826 Subgénero Astyris H. y A. Adams, 1853 21. Mitrella (Astyris) lunata (Say, 1826). Distribución local: estación 14. Distribución geográfica: Massachusetts a Florida (EE.UU de A.), Islas Bermudas, Golfo de México hasta Brasil. Habitat y tipo de nutrición. Especie epifaunal, sobre fondos arenosos y entre la vegetación sumergida, en aguas marinas y salobres. Nutrición carnívora.  Familia Nassariidae Género Nassarius Duméril, 1806 Subgénero Nassarius s. s. 22. Nassarius (Nassarius) acutus (Say, 1822) Distribución local: estaciones 2, 5, 6, 7, 8, 9, 11, 14 y 16. Distribución geográfica: Carolina del Norte a Florida y Golfo de México. Habitat y tipo de nutrición. Especie seminfaunal en sustratos arenosos y fangosos, en bahías someras y lagunas. Nutrición carnívora, en ocasiones carroñero.  23. Nassarius (Nassarius) vibex (Say, 1822) Distribución local: estaciones 7 y 13. Distribución geográfica: Cabo Cod (Massachusetts) al Golfo de México y Mar de las Antillas. Habitat y tipo de nutrición. Especie seminfaunal, en sustratos arenosos y fangosos de bahías someras y lagunas. Nutrición carnívora, ocasiónalmente carroñera.  Familia Fasciolariidae Subfamilia Fasciolariinae Género Latirus Montfort, 1810 24. Latirus angulatus (Röding, 1798) Distribución local: estaciones 7 y 8. Distribución geográfica: Sur de Florida (EE.UU de A.), costas del Golfo de México, Mar Caribe hasta Brasil. Habitat y tipo de nutrición. Se les encuentra en lagunas abiertas y bahías, formando parte de la epifauna. Son de nutrición carnívora.  Superfamilia Volutacea Familia Olividae Subfamilia Olivellinae Género Olivella Swainson, 1831 Subgénero Niteoliva Olsson, 1956 25. Olivella (Niteoliva) mimuta (Link, 1807) Distribución local: estación 11. Distribución geográfica: Golfo de México, Mar de las Antillas hasta Brasil. Habitat y tipo de nutrición. Especie infaunal en fondos arenosos, en aguas someras. Alimentación carnívora y carroñera.  Familia Turriidae Subfamilia Mangeliinae Género Pyrgocythara Woodring, 1928 26. Pyrgocythara plicosa (C. B. Adarns, 1850) Distribución local: estaciones 6, 8, 11, 13, 14 y 18. Distribución geográfica: Cabo Cod (Massachusetts) a Florida y Golfo de México. Habitat y tipo de nutrición. Especie epifaunal, sobre Iodos y entre la vegetación, en lagunas costeras. Nutrición carnívora.  Subclase Opisthobranchia Orden Entomotaeniata Superfamilia Pyramidellacea Familia Pyramidellidae Subfamilia Odostomiinae Género Odostomia Fleming, 1813 27. Odostomia canaliculata C. B. Adams, 1850. Distribución local: estaciones 5, 6, 7, 8, 9, 11, 13, 14 y 15. Distribución geográfica: costas del Golfo de México y Mar de las Antillas. Habitat y tipo de nutrición. Organismos epifaunales; en fondos de arena. Son ectoparásitos de otros moluscos; en aguas someras salobres y marinas. 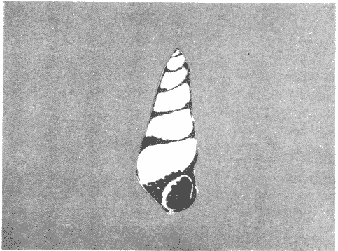 28. Odostomia weberi Morrison, 1965 Distribución local: estaciones 5, 9 y 13. Distribución geográfica: desde Louisiana (EE.UU de A.) hasta el sur del Golfo de México. Habitat y tipo de nutrición. Epifaunal, de aguas salobres, especialmente en bancos ostrícolas, como ectoparásita de bivalvos. 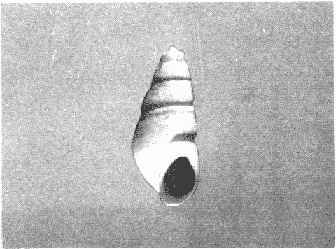 Subgénero Odostomia s. s. 29. Odostomia (Odostomia) gibbosa Bush, 1909. Distribución local: estaciones 5, 6, 8, 9, 11 y 13. Distribución geográfica: Massachusetts a Florida (EE.U U de A.) y costas del Golfo de México. Habitat y tipo de nutrición. Organismos epifaunales, en fondos de arena en aguas someras de salobres a marinas. Son ectoparásitos de otros moluscos e invertebrados. 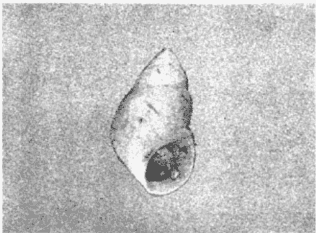 30. Odostomia (Odostomia) laevigata (d'Orbigny, 1842). Distribución local: estación 11. Distribución geográfica: Carolina del Norte a Florida, Golfo de México, Mar de las Antillas hasta Brasil. Habitat y tipo de nutrición. Especie epifaunal, en aguas marinas y salobres someras. Ectoparásita. 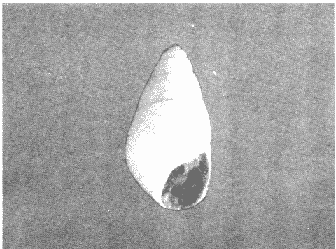 Subgénero Chrysallida Carpenter, 1857 31. Odostomia (Chrysallida) seminuda (C. B. Adams, 1837). Distribución local: estación 18. Distribución geográfica: Nueva Escocia (Canadá) a Florida (EE.UU de A.) y costas del Golfo de México. Habitat y tipo de nutrición. Se le encuentra en bahías y aguas someras de salobres a marinas, como ectoparásito de otros moluscos. Es epifaunal. 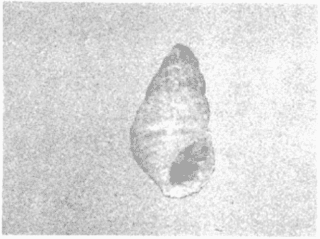 Subgénero Menestho Möller, 1842 32. Odostomia (Menestho) bisuturalis (Say, 1822). Distribución local: estaciones 5, 6, 7, 8, 9, 11, 14, 16 y 17. Distribución geográfica: Golfo de San Lorenzo (Canadá) a Delaware; costas del Golfo de México. Habitat y tipo de nutrición. Común bajo la línea de la marea baja, adherida a las rocas, epifaunal. Se alimenta de ostiones y gasterópodos herbívoros. 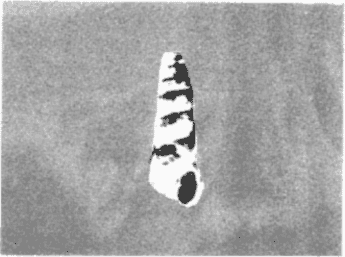 33. Odostomia (Menestho) ímpressa (Say, 1822) Distribución local: estaciones 4, 5, 6, 7, 8, 9, 10, 11, 12, 14, 15, 16, 17 y 18. Distribución geográfica: mássachusetts a Florida y Golfo de México. Habitat y tipo de nutrición. Epifaunal, de aguas salobres, especialmente en bancos ostrícolas, como ectoparásito. 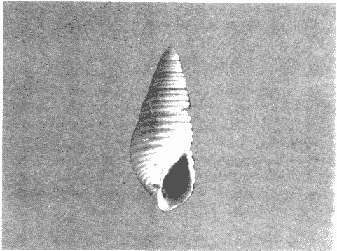 Subfamilia Turbonillinae Género Turbonilla Risso, 1826 Subgénero Pyrgiscus Philippi, 1841 34. Túrbonilla (Pyrgiscus) interrupta (Totten, 1835). Distribución local: estaciones 8, 11, 14, 17 y 18. Distribución geográfica: desde Maine (EE.UU de A.) al Golfo de México, Mar de las Antillas hasta Brasil. Habitat y tipo de nutrición. Especie epifaunal, frecuente en aguas someras marinas y salobres. Ectoparásita.  Orden Cephalaspidea Superfamilia Acteonacea Familia Acteonidae Género Acteon Montfort, 1810 35. Acteon punctostriatus (C. B. Adams, 1840). Distribución local: estaciones 5, 6, 7, 8, 9, 11, 12, 14 y 15. Distribución geográfica: Cabo Cod (Massachusetts) a Florida (EE.UU de A.) , Golfo de México y Mar de las Antillas. Hábitat y tipo de nutrición. Especie infaunal, en bahías y lagunas costeras. Hábitos alimentarios carnívoros. 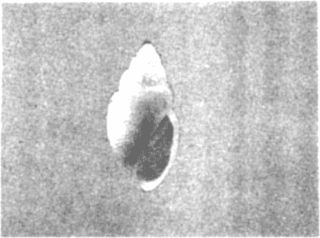 Superfamilia Bullacea Familia Atydae Género Haminoaea Turton y Kingston, 1830 36. Haminoea succinea (Conrad, 1846). Distribución local: estaciones 2, 4, 5, 6, 7, 8, 11, 12 y 14. Distribución geográfica: Florida, Golfo de México, Islas Bermudas, Mar de las Antillas hasta Brasil. Habitat y tipo de nutrición. Especie seminfaunal, en aguas someras y protegidas. Alimentación carnívora. 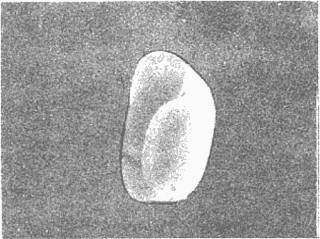 Familia Acteocinidae Género Acteocina Gray, 1847 37.Acteocina canaliculata (Say, 1822) Distribución local: estaciones 1, 2, 3, 4, 5, 6, 7, 8, 9, 10, 11, 12, 13, 14, 15, 16, 17 y 18. Distribución geográfica: Nueva Escocia (Canadá) a Florida, Golfo de México, Mar de las Antillas hasta Brasil. Habitat y tipo de nutrición. Especie epifaunal, en bahías y lagunas costeras. Alimentación carnívora. 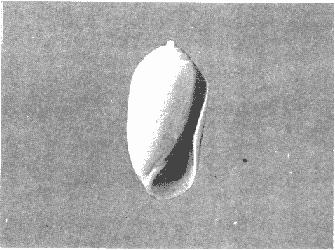 CLASE BIVALVIA.Subelase Palaeotaxodonta Orden Nuculoida Superfamilia Nuculanacea Familia Nuculanidae Género Nuculana Link, 1807 Subgénero Saccella Woodring, 1925 38. Nuculana (Saccella) concéntrica Woodring, 1925 Distribución local: estaciones 9, 10, 11, 13 y 17. Distribución geográfica: costas del Golfo de México, Mar Caribe hasta Brasil. Habitat y tipo de nutrición. Infaunal, en sedimentos blandos, arenosos o limoarenosos; su nutrición consiste de materia orgánica depositada en el sustrato; en aguas marinas. 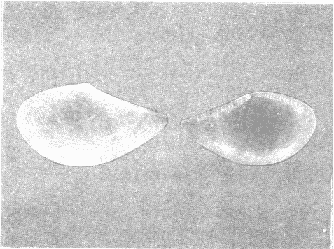 Subclase Pteriomorphia Orden Arcoida Superfamilia Arcacea Familia Arcidae Subfamilia Anadarinae Género Anadara Gray, 1847 Subgénero Larkinia Reinhart, 1935 39. Anadara (Larkinia) transversa (Say, 1822). Distribución local: estaciones 9, 11, 14, 16, 17 y 18. Distribución geográfica: desde el sur de Cabo Cod (Massachusetts), Golfo de México a la Laguna de Términos, Campeche (México) hasta el Mar de las Antillas. Habitat y tipo de nutrición. De la zona litoral hasta 11 m de profundidad; forma parte de la infauna; hábitos alimentarios filtrantes de partículas en suspensión. 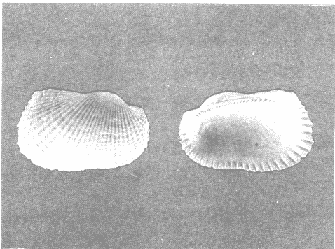 Orden Mytiloida Superfamilia Mytilacea Familia Mytilidae Subfamilia Mytilinae Género Brachidontes Swainson, 1840 Subgénero Hormomya Morch, 1835 40. Brachidontes (Hormomya) exustus (Linnaeus, 1758) Distribución local: estaciones 2, 10, 11, 13, 14, 17 y 18. Distribución geográfica: Carolina del Norte al Golfo de México, Mar de las Antillas hasta Uruguay. Habitat y tipo de nutrición. Organismo epifaunal, sobre rocas y bancos de ostión, fijo mediante un biso; muy frecuente en aguas someras salobres. Nutrición suspensivora. 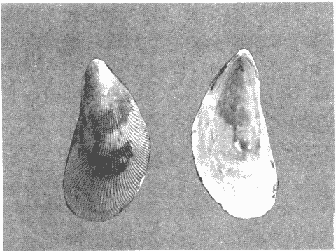 Género Ischadium Jukes-Brown, 1905 41. Ischadiuni recurvum (Rafinesque, 1820) Distribución local: estaciones 2, 4, 6, 8, 11, 13, 17 y 18. Distribución geográfica: Cabo Cod (Massachusetts), Golfo de México y el Mar de las Antillas. Habitat y tipo de nutrición. En aguas salobres y someras; forman parte de la epifauna; mediante un biso fibroso viven adheridas a rocas y bancos de ostras; su nutrición es filtrante. 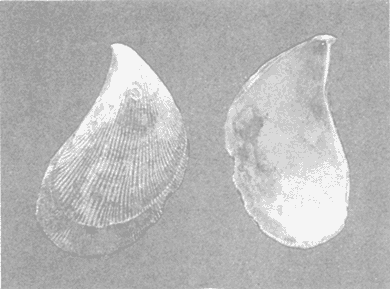 Subclase Heterodonta Orden Veneroida Superfamilia Crassatellacea Familia Crassatellidae Subfamilia Scambulinae Género Crassinella Guppy, 1874 42. Crassinella lunulata (Conrad, 1834) Distribución local: estaciones 17 y 18. Distribución geográfica: Massachusetts a Florida (EE.UU de A.), Islas Bermudas, Golfo de México hasta Brasil. Habitat y tipo de nutrición. Especie infaunal superficial, entre concherios, de aguas someras a profundas. Se alimenta de partículas orgánicas en suspensión.  Superfamilia Dreisseniacea Familia Dreissenidae Género Mytilopsis Conrad, 1858 43. Mytilopsis leucophaeata (Conrad, 1831) Distribución local: estaciones 1, 2, 4, 5, 6, 7, 8, 9, 10, 11, 12, 13, 14, 17 y 18. Distribución geográfica: Nueva York hasta Florida, Texas (EE.UU de A.) y costas del Golfo de México. Habitat y tipo de nutrición. Especie epifaunal, fija sobre rocas; de aguas dulces a salobres. Nutrición por medio de partículas en suspensión. 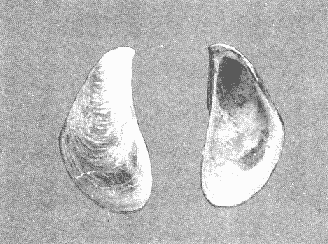 Superfamilia Lucinacea Familia Lucinidae Género Lucina Bruguiere, 1797 Subgénero Phacoides Blainville, 1825 44. Lucina (Phacoides) pectinata (Gmelin, 1791) Distribución local: estaciones 1, 2, 4, 5, 6, 7, 8, 9, 10, 11, 12, 13, 14, 15 y 16. Distribución geográfica: Carolina del Norte a Florida (EE.UU. de A.), Golfo de México, Mar de las Antillas hasta Brasil. Habitat y tipo de nutrición. Forma parte de la infauna superficial en aguas someras de lagunas y estuarios. Nutrición mediante partículas orgánicas en suspensión.  Superfamilia Galeornmatacea Familia Montaculidae Subfamilia Kellinae Género Aligena H. C. Lea, 1843 45. Aligena texasiana Harry, 1969 Distribución local: estación 17. Distribución geográfica: de Louisiana a Texas (EE.UU de A.); hasta el sur del Golfo de México. Habitat y tipo de nutrición. Desde la línea de bajamar hasta dos metros de profundidad; probablemente comensales de poliquetos; infaunales; nutrición suspensívora mícrófaga. 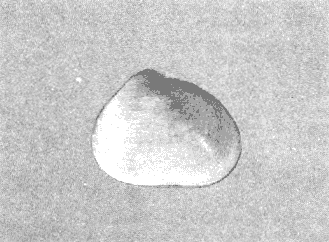 Subfamilia Montacutinae Género Mysella Angas, 1877 46. Mysella planulata (Stimpson, 1857) Distribución local: estaciones 5 y 8. Distribución geográfica: Nueva Escocia (Canadá) a Florida (EE.UU de A.) hasta el Mar de las Antillas. Habitat y tipo de nutrición. Forma parte de la epifauna; permanece adherida a la vegetación, en bahías y aguas poco profundas, de marinas a salobres. Su nutrición es suspensivora. 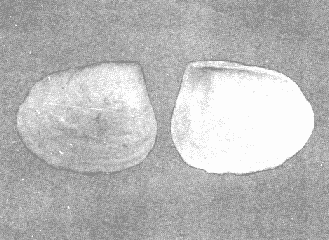 Superfamilia Veneracea Familia Veneridae Subfamilia Chioninae Género Chione Mühlfeld, 1811 Subgénero Chione s. s. 47. Chione (Chione) cancellata (Linnaeus, 1767) Distribución local: estación 14. Distribución geográfica: de Carolina del Norte a Florida, Golfo de México, Mar de las Antillas hasta Brasil. Habitat y tipo de nutrición. Especie infaunal, en sustratos arenosos de aguas someras. Nutrición suspensivora.  Subgénero Lirophora Conrad, 1863 48. Chione (Lirophora) clenchi Pulley, 1952 Distribución local: estación 11. Distribución geográfica: costas del Golfo de México. Habitat y tipo de nutrición. Especie infaunal de sustratos arenosos y aguas marinas someras. Nutrición suspensivora.  Subgénero Timoclea Brown, 1827 49. Chione (Timoclea) grus (Holmes, 1858) Distribución local: estaciones 17 y 18. Distribución geográfica: Carolina del Norte, Florida y Golfo de México. Habitat y tipo de nutrición. Especie infaunal superficíal de fondos arenosos, en aguas marinas someras. Suspensivora.  Género Anomalocardia Schumacher, 1817 50. Anomalocardia auberiana (d'Orbigny, 1842) Distribución local: estaciones 4, 6, 8, 9, 11, 13 y 14. Distribución geográfica: sur de Florida, Texas (EE.UU de A.); costas del Golfo de México; Centroamérica, Mar de las Antillas hasta Uruguay. Habitat y tipo de nutrición, Es común en aguas salobres; forma parte de la infauna en fondos de arena y fango. Se localiza en bahías abiertas, típicamente marinas, así como en lagunas y esteros; tolera rangos amplios de salinidad. Su nutrición es suspensivora.  Género Mercenaria Schumacher, 1817 51. Mercenaria campechiensis (Gmelin, 1791) Distribución local: estación 18. Distribución geográfica: sur de Nueva Jersey a Florida, Golfo de México y Cuba. Habitat y tipo de nutrición. Especie infaunal en sustratos arenosos, de aguas marinas. Nutrición mícrófaga.  Superfamilia Mactracea Familia Mactridae Subfamilia Mactrinae Género Mulinia Gray, 1837 52. Mulinia lateralis (Say, 1822) Distribución local: estaciones 2,4,5,6,7,8,9, 10, 11, 12, 13, 14, 15, 16, 17 y 18. Distribución geográfica: desde Maine (EE.UU. de A.) hasta el Golfo de México. Habitat y tipo de nutrición. Especie infaunal de sustratos arenosos y fangosos, en aguas someras templadas y cálidas. Nutrición suspensívora. 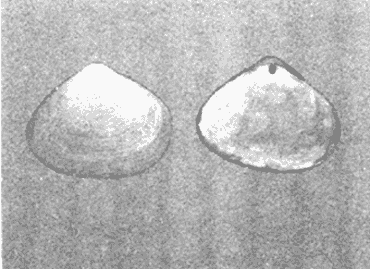 Género Rangia Desmoulins, 1832 53. Rangia cuneata (Gray, 1831) Distribución local: estaciones 14 y 15. Distribución geográfica: de Virginia (EE.UU de A.) al sur del Golfo de México. Habitat y tipo de nutrición. Especie típicamente estuarina, en fondos limoarcillosos; forma parte de la infauna superficial. Nutrición filtrante, saprófaga.  Subgénero Rangianella Conrad, 1863 54. Rangia (Rangianella) flexuoso (Conrad, 1839) Distribución local: estaciones 4, 5, 6, 7, 8, 9, 11, 13 y 17. Distribución geográfica: de Louisiana (EE.UU. de A.) hasta el sur del Golfo de México. Habitat y tipo de nutrición. Especie infaunal en sustratos blandos, en aguas salobres influidas por ríos. Nutrición mediante partículas orgánicas en suspensión. 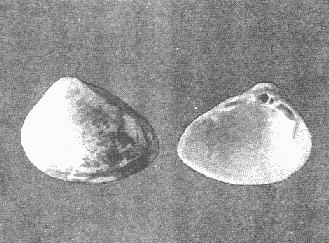 Superfamilia Tellinacea Familia Tellinidae Subfamilia Macominae Género Macoma Leach, 1819 55. Macoma tenta (Say, 1834) Distribución local: estación 1. Distribución geográfica: Cabo Cod (Massachusetts) a Florida, Islas Bermudas, Golfo de México hasta Brasil. Habitat y tipo de nutrición. Especie infaunal de aguas someras. Nutrición por medio de partículas depositadas en el sustrato. 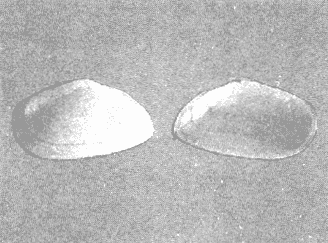 Subgénero Austromacoma Olsson, 1961 56. Macoma (Austroinacoma) constricta (Bruguiére,1799). Distribución local: estación 11. Distribución geográfica: Carolina del Norte, Golfo de México, Mar de las Antillas hasta Brasil. Habitat y tipo de nutrición En bahías y lagunas costeras; tolera intervalos amplios de salinídad; forma parte de la infauna. Nutrición mediante partículas orgánicas depositadas en el sustrato. 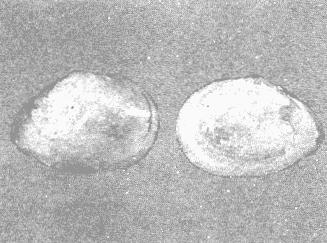 Subgénero Psammacoma Dall, 1900 57. Macoma (Psammacoma) brevifrons (Say, 1834) Distribución local: estación 2. Distribución geográfica: Carolina del Sur, Golfo de México, Mar de las Antillas hasta Brasil. Habitat y tipo de nutrición. Especie infaunal de aguas someras. Nutrición por medio de partículas orgánicas depositadas en el sustrato.  58. Macoma (Psammacoma) tageliformis Dall, 1900 Distribución local: estación 5. Distribución geográfica: Louisiana, Golfo de México, Mar de las Antillas hasta Brasil. Habitat y tipo de nutrición. Especie infaunal en fondos arenosos y fangosos de costas someras. Se alimenta de partículas depositadas en el sustrato. 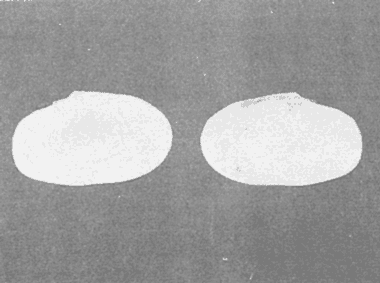 Subgénero Rexithaerus Tryon, 1869 59. Maccoma (Rexithaerus) mitchelli Dall, 1895 Distribución local: estaciones 1, 2, 5, 6, 7, 11 y 13. Distribución geográfica: de Carolina del Sur (EE.UU de A.) hasta el sur del Golfo de México. Habitat y tipo de nutrición. Frecuente en lagunas y esteros con influencia de ríos; forma parte de la infauna. Nutrición mediante materia orgánica depositada en el fondo. 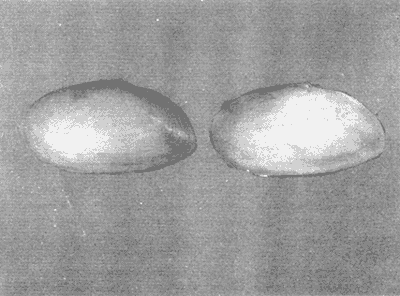 Familia Donacidae Género Donax Linnaeus, 1758 60. Donax variabilis Philippi, 1847 Distribución local: estación 2. Distribución geográfica: desde el norte de Texas hasta el sur del Golfo de México. Habitat y tipo de nutrición. Especie infaunal en sustratos arenosos. Nutrición filtrante de partículas en suspensión. 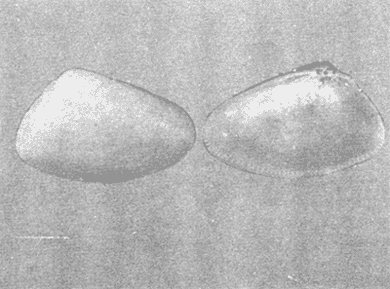 Familia Solecurtidae Género Tagelus Gray, 1847 Subgénero Mesopleura Conrad, 1868 61. Tagelus (Mesopleura) divisus (Spengler, 1794) Distribución local: estaciones 2, 11, 14 y 16. Distribución geográfica: Cabo Cod (Massachusetts) a Florida, Islas Bermudas, Golfo de México hasta Brasil. Habitat y tipo de nutrición. Especie infaunal, común en aguas someras. Nutrición por medio de partículas depositadas en el sustrato.  62. Tagelus (Mesopleura) plebeius (Lightfoot, 1786) Distribución local: estación 8. Distribución geográfica: Cabo Cod (Massachusetts) a Florida, Golfo de México, Brasil y Argentina. Habitat y tipo de nutrición. Especie infaunal de aguas someras a moderadamente profundas. Alimentación por medio de partículas depositadas en el sustrato.  Familia Semelidae Subfamilia Scrobiculariinae Género Abra Lamarck, 1818 63. Abra aequalis (Say, 1822) Distribución local: estaciones 2, 4, 6, 7, 8, 9, 10, 11, 12, 13 y 14. Distribución geográfica: Carolina del Norte a Florida, Texas; costas del Golfo de México, Mar de las Antillas, Brasil. Habitat y tipo de nutrición. Bahías abiertas, áreas centrales de lagunas o próximas a la costa. Viven enterradas en los sedimentos limosos y arenosos como infauna superficial; nutrición suspensivora.  Género Semele Schumacher, 1817 64. Semele proficua (Pulteney, 1799) Distribución local: estaciones 17 y 18. Distribución geográfica: Carolina del Norte, Islas Bermudas, Golfo de México hasta Brasil. Habitat y tipo de nutrición. Especie infaunal de aguas someras. Alimentación mediante partículas orgánicas depositadas.  Orden Myoida Superfamilia Myacea Familia Corbulidae Género Corbula Bruguière, 1792 Subgénero Caryocorbula Gardner, 1926 65. Corbula (Caryocorbula) contracta Say, 1822 Distribución local: estación 18. Distribución geográfica: Cabo Cod (Massachusetts) a Florida, Golfo de México, Mar de las Antillas hasta Brasil. Habitat y tipo de nutrición. Especie infaunal de sustratos arenosos, aguas someras. Nutrición suspensivora.  66. Corbula (Caryocorbula) dietziana C. B. Adams, 1852 Distribución local: estaciones 14, 16, 17 y 18. Distribución geográfica: de Carolina del Norte hasta Florida, Texas (EE.UU. de A.); Golfo de México, Mar de las Antillas hasta Brasil. Habitat y tipo de nutrición. Individuos marinos, ínfaunales, en arenas calcáreas; alimentación suspensívora.  ANÁLISIS CUANTITATIVO Y PORCENTUALEn un total de 18 estaciones de muestreo se cuantificaron 15,141 individuos, de los cuales 107 (0.7%) integraron la biocenosis y 15,034 (99.3%) la tanatocenosis. En el ecosistema estudiado se identificaron 37 especies de la Clase Gastropoda y 29 se ubicaron en la Clase Bivalvia, que totalizan las 66 del análisis cuantitativo, en virtud de que no se efectuaron arrastres en el área. Por lo que se refiere a abundancia (Tabla 2), la Clase Bivalvia representó el 19% (2,877 ejemplares) del total de organismos recolectados y en la Clase Gastropoda el valor porcentual resultó de 81% (12,264 individuos). Las estaciones con mayor cantidad de especímenes fueron la 11 y la 7, con 4,851 y 2,128 individuos, respectivamente; mientras que el menor número de organismos se registró en las estaciones 3 (1 ejemplar) y 1 (14 ejemplares). Las estaciones con el número más elevado de especies fueron las 11, 14 y 8, con 36, 34 y 30 especies; en las que se capturaron en cantidad menor fueron la 3 y la 1, con 1 y 6 de estos taxa, respectivamente. De las 66 especies a las que se les aplicó análisis cuantitativo, 14 (21.2%) tuvieron representantes vivos: 13 pertenecientes a la Clase Bivalvia y 1 a la Gastropoda. El porcentaje de bivalvos capturados vivos se eleva a 82.2% (88 individuos) sobre 17.8% (19 individuos) de gasterópodos; en las estaciones 1-8, 13 y 7 hubo mayor abundancia (Tabla 3). ESPECIES CARACTERISTICAS DEL ÁREA DE ESTUDIOEn la laguna se reconocieron y excluyeron del muestreo las áreas donde las especies sujetas a extracción comercial constituyen agregados en etapas diversas de producción. Así, en la figura 2 se observa la ubicación de bancos ostrícolas en la Laguna Tampamachoco, de los que, sin embargo, no se obtuvieron muestras biológicas. A continuación se mencionan las especies que, por su valor de importancia relativa, integran las comunidades dominantes del sistema lagunar, sin tomar en cuenta los conjuntos arrecifales. 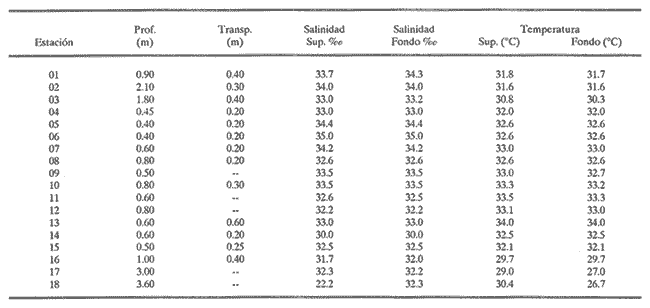 TABLA 1 Parámetros hidrológicos en las estaciones de muestreo 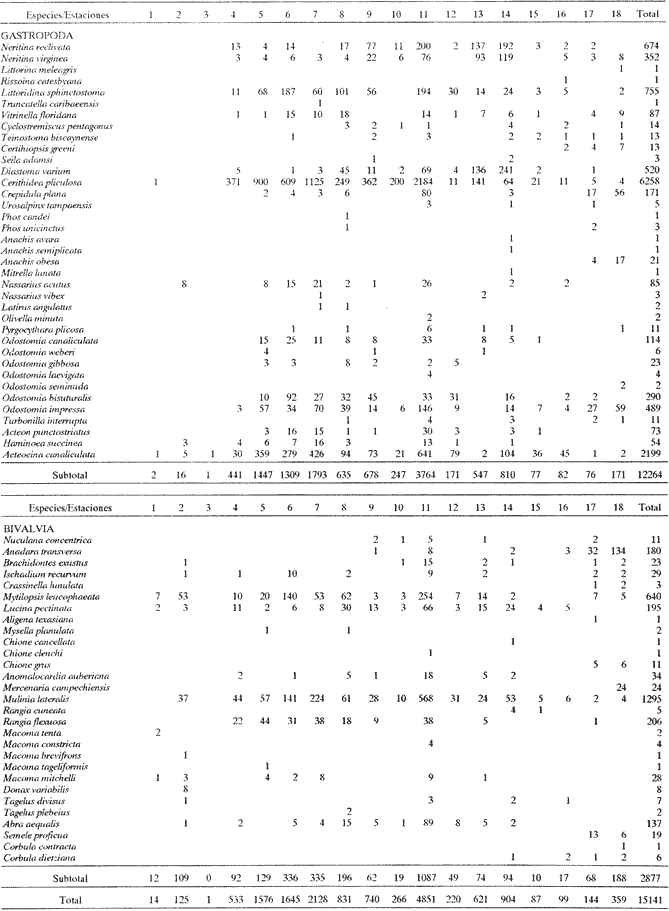 TABLA 2 Abundancia de la comunidad melacológica total 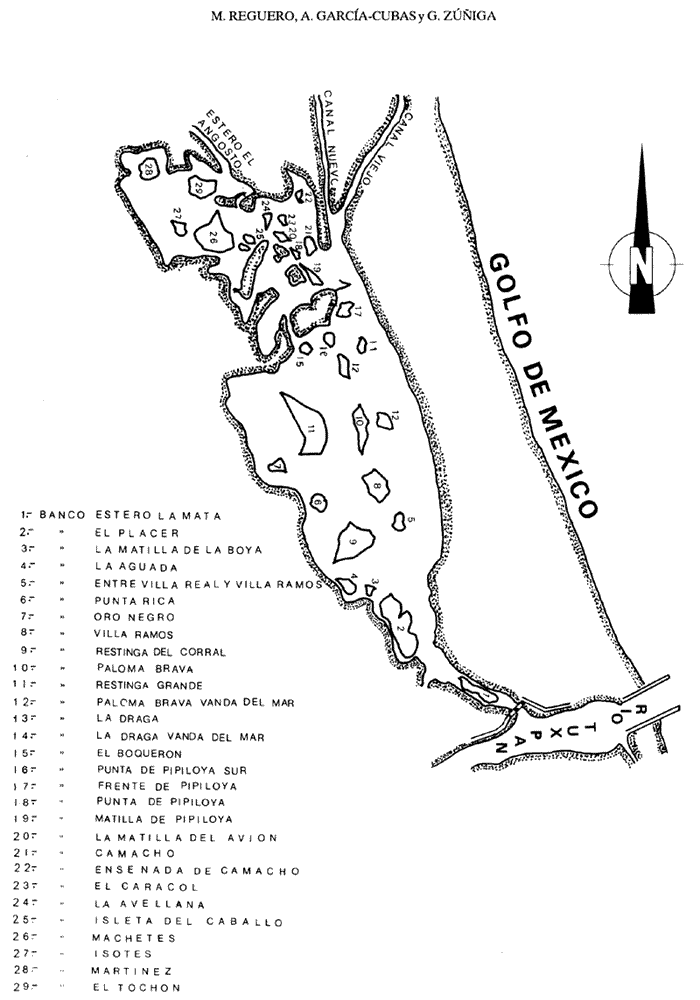 Figura 2. Ubicación de bancos ostrícolas en la Laguna Tampamachoco. (Tomado de SEPESCA, Centro de Acuacultura, Tuxpan). COMUNIDAD MALACOLÓGICA TOTAL:Cerithidea pliculosa Acteocina canaliculata Mulinia lateralis Littoridina sphinctostoma Mytilopsis leucophaeata Neritina reclivata Esta comunidad agrupó al 71.8% del total de individuos recolectados; porcentualmente, Cerithidea pliculosa y Acteocitia canaliculata fueron más importantes (55.8%) que el resto de las especies en conjunto. COMUNIDAD MALACOLÓGICA VIVA:Mulinia lateralis Anadara transversa Lucina pectinata Neritina reclivata En estos taxa se cuantificó al 82.2% del total de individuos vivos; la mitad de ellos quedó incluida en M. lateralis y A. transversa. Los valores de abundancia, frecuencia, densidad e importancia relativas de las especies, que sustentan esta caracterización del área de estudio, se encuentran detallados en las tablas 4 y 5, conforme a su arreglo sistemático. ÍNDICES DE SIMILITUDLa semejanza en cuanto a especies presentes en las diferentes localidades muestreadas se calculó mediante el índice propuesto por Krebs (1972), en su expresión porcentual. Los valores obtenidos de comparar la composición específica entre pares de muestras se agruparon en intervalos de similitud (0-24, 25-49, 50-74, 75-100) que, al transcribirse en una matriz para cada taxón (Figs. 3 y 4), hicieron posible observar gráficamente el porcentaje que representan con respecto a la cantidad de combinaciones posibles. COMUNIDAD MALACOLÓGICA TOTALEste análisis permitió apreciar una asociación de aproximadamente 15 especies de gasterópodos en las estaciones 6, 11 y 5, que las ubica en el rango de semejanza de 50-74%; mientras que en las estaciones 3, 2 y 1 los porcentajes de afinidad son bajos, porque tienen sólo una especie en común (Acteocina canaliculata), sin asociación definida, pues en esa área concurre indistintamente con Cerithidea pliculosa, Nassarius acutus y/o Haminoea succinea. No obstante, el valor medio de similitud de la Clase Gastropoda, inferido de 1-53 combinaciones posibles (Fig. 3A), es de 49.8%. 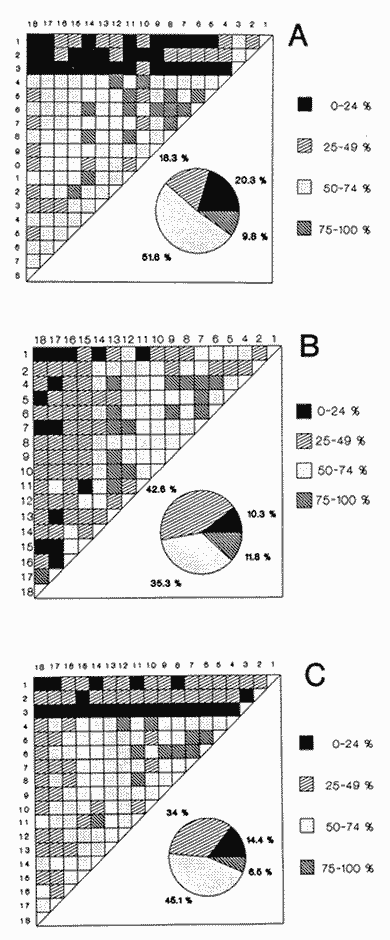 Figura 3. Diagramas de enrejado de similitud entre estaciones de muestreo para la comunidad malacológica total. A) Clase Gastropoda, B) Clase Bivalvia, C) Phylum Mollusca.  TABLA 3 Abundancia de la comunidad malacológica viva 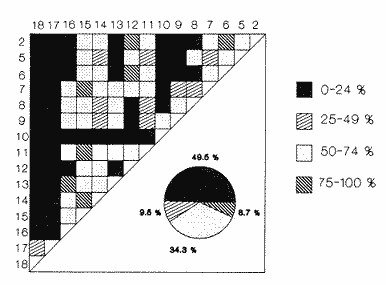 Figura 4. Diagramas de enrejado de similitud entre estaciones de muestreo para la comunidad malacológica viva de la Clase Bivalvia. En el caso de los bivalvos, los valores porcentuales de afinidad entre pares de estaciones, obtenidos a partir de 136 combinaciones posibles (Fig. 3B), muestran que el 42.6% se ubica dentro del rango 25-49, con 58 combinaciones; el 35.3% en el intervalo 50-74, con 48 combinaciones; el 11.8% en el rango 75-100, con 16 combinaciones; finalmente, el 10.3% dentro del intervalo 024, con 14 combinaciones. El valor medio de semejanza en este caso es de 48.7%. Considerando al phylum en conjunto (Fig. 3C), la afinidad resultante indica que de las 153 combinaciones posibles, determinadas por la cantidad total de estaciones, el 45.1% se ubica dentro del rango 50-74, con 69 combinaciones; el 34% corresponde al intervalo 2549, con 52, quedando los rangos de 0-24 y 75-100 con porcentajes de 14.4% y 6.5%, con 22 y 10 combinaciones, respectivamente. El valor medio de similitud para todo el conjunto de estaciones es de 48%. COMUNIDAD MALACOLÓGICA VIVA:Para los organismos vivos de la Clase Gastropoda no se pudieron calcularlos porcentajes de afinidad, a causa de que los gasterópodos vivos correspondieron a una sola especie y se capturaron en la misma estación. Considerando a la comunidad viva de la Clase Bivalvia (Fig. 4), la semejanza resultante indica que de las 105 combinaciones posibles, deducidas según la cantidad total de estaciones, el 49.5% se ubica en el rango 0-24, con 52 combinaciones; el 34.3% corresponde al intervalo 50-74, con 36, quedando los rangos de 25-49 y 75-100, con porcentajes de 9.5% y 6.7%, con 10 y 7 combinaciones, respectivamente. El valor medio de afinidad para todo el conjunto de estaciones es de 29.6%. 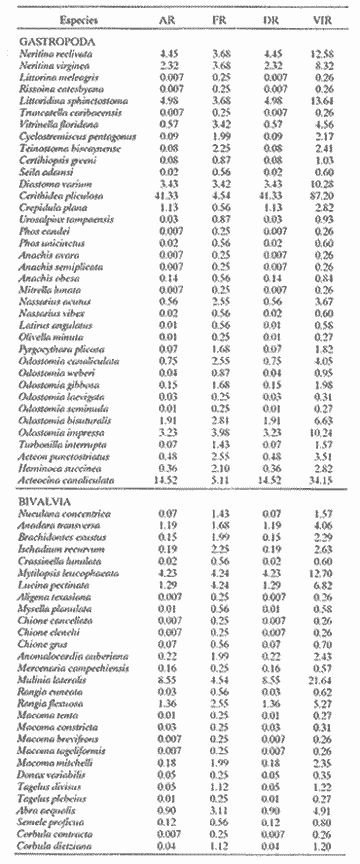 TABLA 4 Abundancia relativa (AR), frecuencia relativa (FR) densidad reltaiva (DR) y valor de importancia relativa (VIR) para la comunidad malacológica total 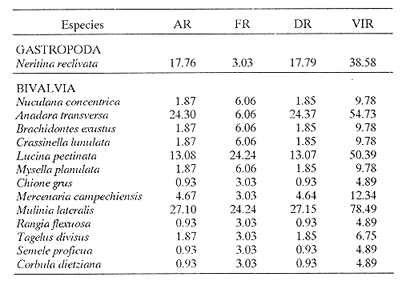 TABLA 5 Abundancia relativa (AR), frecuencia relativa (FR) densidad reltaiva (DR) y valor de importancia relativa (VIR) para la comunidad malacológica viva Dentro de esta biocenosis se observa la presencia constante de dos especies: Lucina Pectinata y Mulinia lateralis, asociadas alternadamente con Brachidontes exustus, Rangia flexuosa o Tagelus divisus, en estaciones cuya semejanza media está comprendida entre 42 y 52%; mientras que la concurrencia de Anadara transversa y Crassinella lunulata parece limitar la distribución de Chione grus, Mercenaria canipechiensis, Semele proficua y Corbula dietziana a la zona de desembocadura del Río Tuxpan, único sitio en el que se presenta esta asociación múltiple, y determina un promedio de. sólo 3% de similitud entre las estaciones 17-18 y el resto de las localidades de muestreo. No se infirió la semejanza, por estaciones de muestreo, entre miembros del phylum, debido a que se conservarían casi los valores calculados para la Clase Bivalvia, pues se alterarían sólo con respecto a la estación 13, donde se capturó una especie de la Clase Gastropoda. NUTRICIÓN Y HABITATLa distribución y asociación de los organismos dependen tanto de sus hábitos de vida como de las condiciones ambientales que regulan su presencia, aun cuando se sabe que interactúan de maneras múltiples, utilizando vías alternas diversas o sobrepuestas en sus relacionales con los otros elementos del sistema. 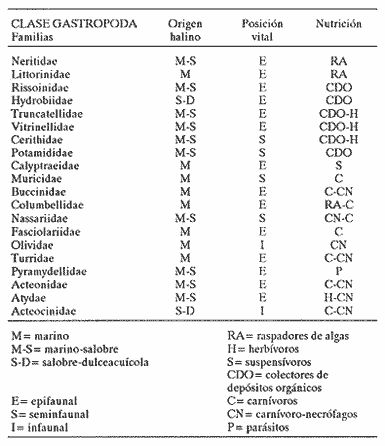 TABLA 6 Origen halino, relación con el sustrato y tipo de nutrición de las familias de la Clase Gastropoda 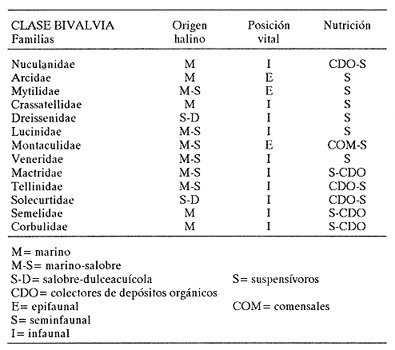 TABLA 7 Origen halino, relación con el sustrato y tipo de nutrición de las familias de la Clase Bivalvia En las tablas 6 y 7 se resumen los registros efectuados por distintos autores respecto a origen halino, posición vital y tipos de alimentación de las familias de moluscos identificadas en esta laguna (Purchon, 1968; Andrews, 1971; Abbott, 1974; García-Cubas, 1981; Antolí y García-Cubas, 1985; Reguero y García-Cubas, 1989; García-Cubas y Reguero, 1990; García-Cubas et al., 1990); en la tabla 8 se señalan la cantidad y el porcentaje que representan, tanto en el rango de familia como en el de especie. Así, en los tres taxa analizados de esta área, se observa que abundan las especies de origen marino-salobre. Respecto a su relación con el sustrato, el phylum en conjunto y la Clase Gastropoda incluyen un porcentaje mayor de individuos epifaunales, mientras que en la Clase Bivalvia abundan las especies infaunales. El tipo de alimentación más frecuente, tanto del phylum como de la Clase Bivalvia, corresponde a la filtración de partículas en suspensión, en tanto que la mayoría de los gasterópodos son colectores de depósitos. DIVERSIDADPara obtener un cálculo estadístico de la aportación que las comunidades malacológicas total (biocenosis + tanatocenosis) y viva hacen al sistema ecológico analizado, se determinaron: diversidad promedio (H´n), diversidad máxima (Hmáx), equitatividad (J) y riqueza de especies (D), relativas a comunidades de las Clases Gastropoda y Bivalvia, así como a la de los moluscos en conjunto. En los dos casos, los registros mayores se observan en el phylum respecto a las clases, los índices más elevados corresponden a los bivalvos, y nulos (cero) a las comunidades vivas de la Clase Gastropoda (Tabla 9, Figs. 5 y 6). Así mismo, estos parámetros presentaron fluctuaciones notables en las distintas estaciones de muestreo: en el análisis general (vivos + muertos) se encontró que la diversidad (bits/individuo) se determinó en el intervalo de 0 a 3.01 para la Clase Gastropoda, en el de 1.36 a 2.48 para la Clase Bivalvia, y en el de 0 a 3.76 para el Phylum Mollusca, con medias de 1.96, 1.84 y 2.55, respectivamente. La equitatividad varió de 0 a 1, de 0.47 a 0.90 y de 0 a 0.82, mientras que la riqueza de especies registró valores en intervalos de 0 a 2.28, de 0.53 a 1.81 y de 0 a 3.63, según el conjunto analizado (Tabla 10; Fig. 7 A-C). 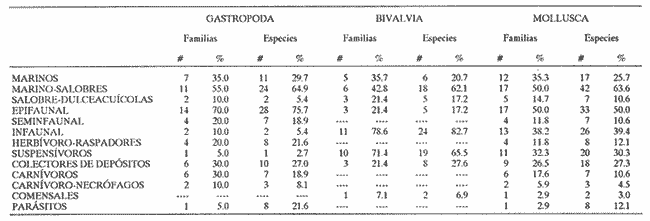 TABLA 8 Origen halino, relación con el sustrato y tipo de nutrición de las familias y especies de las tres categorías taxonómicas 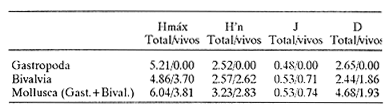 TABLA 9 Índices de diversidad máxima (Hmáx), diversidad (H´n), equitatividad (J) y riqueza de especies (D) por taxón 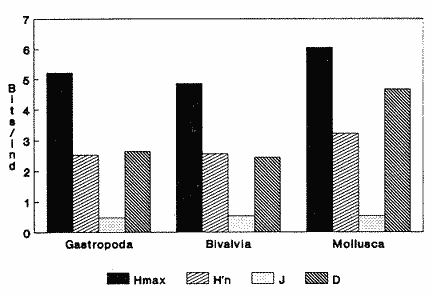 Figura 5. Índices de diversidad máxima (Hmáx). diversidad (H'n), equitatividad (J) y riqueza de especies (D) para la comunidad malacológica total. 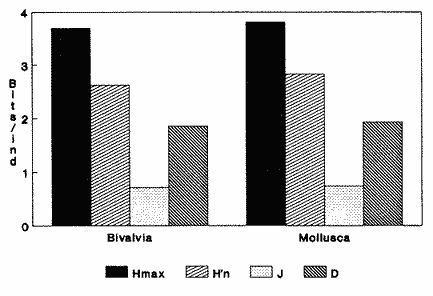 Figura 6. Índices de diversidad máxima (Hmáx), diversidad (H´n), equitatividad (J) y riqueza de especies (D) para la comunidad malacológica viva. En cambio, en el caso de la comunidad viva, la diversidad mostró resultados de cero para la Clase Gastropoda y de 0 a 1.5 tanto para la Clase Bivalvia como para el phylum, con medias de 0, 0.67 y 0.70 bits/ind, respectivamente; la equitatividad fue de 0 para gasterópodos y, al igual que la riqueza específica, de 0 a 1, tanto para bivalvos como para el total de moluscos vivos (Tabla 11; Fig. 8 B-C). Por otra parte, los coeficientes de determinación (R²) entre H'n vs. J y H'n vs. D señalan que la adición de especies tuvo mayor influencia sobre la diversidad calculada, tanto para la comunidad total como para la viva (Figs. 9 y 10). Además, se observó que el trazo espacial de la diversidad no varía con respecto al antedicho, pues en el análisis general (vivos + muertos), al igual que en el de vivos, las comunidades conservan los valores ya señalados, debido a que el régimen de salinidad en la época de muestreo fue euhalino (30-40 ‰) en todo el sistema lagunar. 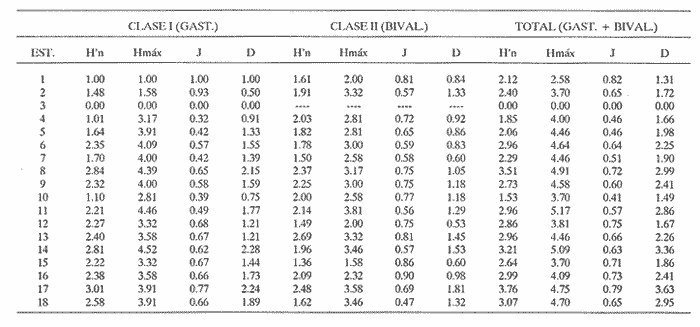 TABLA 10 Índices de diversidad y sus componentes, por estación, para la comunidad malacológica total 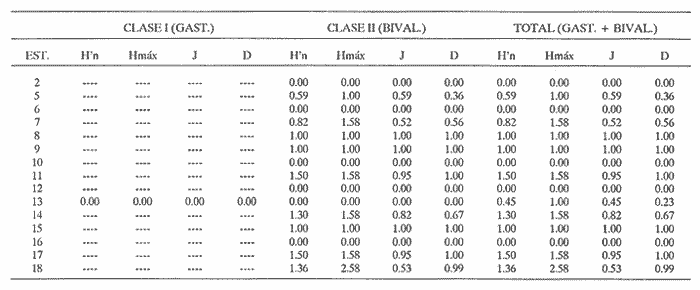 TABLA 11 Índices de diversidad y sus componentes, por estación, para la comunidad malacológica viva 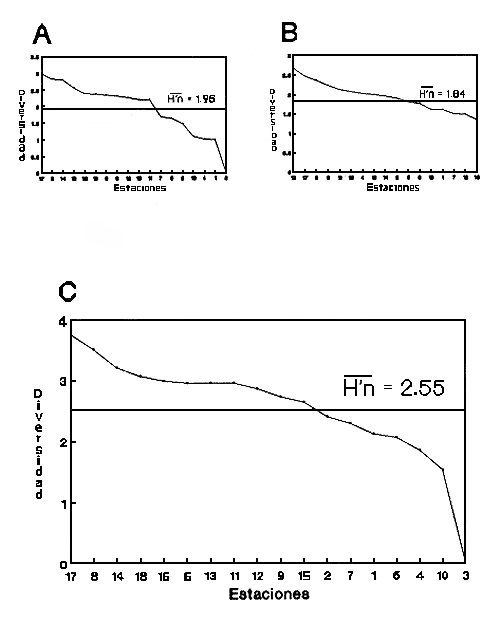 Figura 7. Curvas de valores de la diversidad en cada estación de muestreo, para comunidades totales. A) Clase Gastropoda, B) Clase Bivalvia, C) Phylum Mollusca. 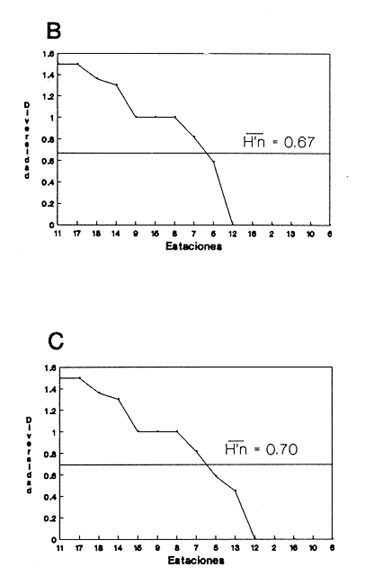 Figura 8. Curvas de valores de la diversidad en cada estación de muestreo, para comunidades vivas. B) Clase Bivalvia, C) Phylum Mollusca. 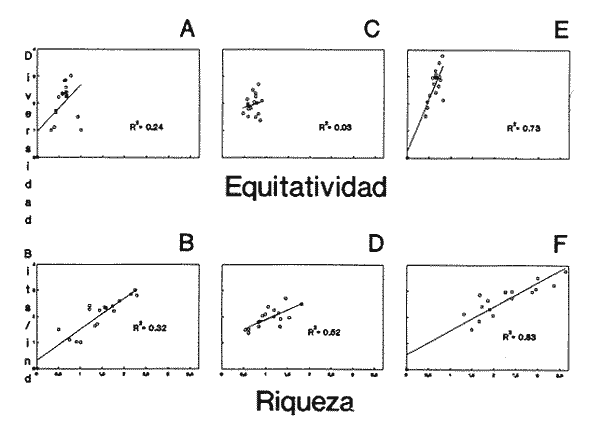 Figura 9. Coeficientes de determinación (R²) entre la diversidad y los componentes de equitatividad y riqueza de especies, para comunidades totales. A-B) Clase Gastropoda, C-D) Clase Bivalvia, E-F) Phylum Mollusca. 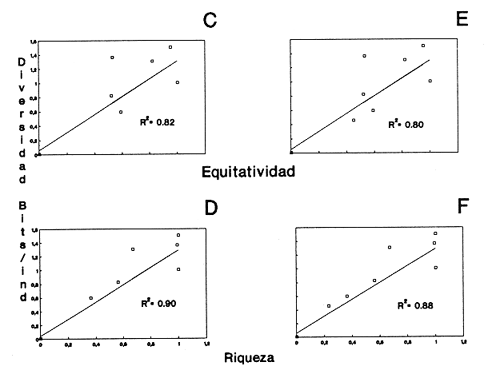 Figura 10. Coeficientes de determinación (R²) entre la diversidad y los componentes de equitatividad y riqueza de especies, para comunidades vivas. C-D) Clase Bivalvia, E-F) Phylum Mollusca. DISCUSIÓN Y CONCLUSIONESEn el área, el registro de datos hidrológicos indica una temperatura media superficial de 32.1°C; la mínima, 29°C se localizó en la estación 17, ubicada entre Punta Potrero y el poblado de Tampamachoco; la máxima de superficie, 34°C, correspondió a la estación 13, situada frente a Punta Rica. Hay poca diferencia entre estos valores y los del fondo, que fluctuaron entre 26.7°C y 34°C, con promedio de 31.7°C; los registros térmicos mínimos y máximos coincidieron en las mismas localidades. Con base en la salinidad determinada durante el muestreo y adoptando el criterio de García-Cubas, incluido en la parte metodológica, durante la época de lluvias (julio) la Laguna Tampamachoco se caracteriza por ser euhalina (30-40 ‰). Sin embargo, Contreras (1983) señala un régimen mesohalino "B" (10-18 ‰) para esa época del año y euhalino para la temporada de sequía. De acuerdo con la profundidad registrada en la red de estaciones, la laguna puede dividirse en tres zonas: a) La parte septentrional, que corresponde al canal de navegación "El Viejo", con profundidad media de 1.26 m (estaciones 1 a 3). b) En la porción central, el promedio batimétrico es de 0.59 m (estaciones 4 a 15). c) La región meridional, representada por el canal de comunicación al mar, con registro medio de 2.53 m (estaciones 16 a 18). La transparencia del agua en la laguna varió de 0.20 a 0.60 m, media de 0.30 m, como resultado de contenido abundante de material en suspensión. En general, los datos obtenidos de parámetros hidrológicos muestran uniformidad, lo cual indica carencia de un patrón de estratificación, excepto en la estación 18, pues debido a profundidad mayor por su proximidad a la boca, hay estratificación salina. Es importante destacar la función que la índole del sedimento ejerce en la comunidad en estudio. En este caso, el sustrato estaba constituido principalmente por limos y arcillas, los cuales están ligados íntimamente a los hábitos de vida de los moluscos que se establecen en él. Por otro lado, también es importante el aporte de materia orgánica proveniente de los acarreos fluviales, ya que sirve como fuente de alimento. En el análisis de la comunidad malacológica total hubo abundancia mayor de miembros de la Clase Gastropoda; mientras que los bivalvos dominaron en la comunidad viva. Las estaciones en las que la diversidad y la abundancia son elevadas se ubican en zonas influidas por agua dulce procedente de los esteros y canales, rica en materia orgánica, o en áreas cercanas a la desembocadura del Río Tuxpan donde, según Contreras (1983), la marea funge como cuña que ejerce su efecto hacia la parte interna del río, lo cual confiere características de estuario a la región austral de la laguna. Además, el patrón de circulación del agua permite tanto la redepositación de remanentes esqueléticos como el transporte y el establecimiento de organismos tolerantes a gradientes ambientales. Por otra parte, la Clase Gastropoda tiene diversidad de alternativas para alimentarse, en tanto que las de la Clase Bivalvia son pocas: el hábito suspensivoro es dominante. Cabe destacar que en la Laguna Tampamachoco se registraron valores altos de diversidad para las tres categorías taxonómicas analizadas, cuyos cambios se encontraron influidos por la riqueza de especies, pues en esta zona se reconocieron 66 especies. En este cuerpo de agua fue notable la presencia de gasterópodos asociados a bivalvos: se encontraron nueve especies del género Odostomia, las cuales parasitan bancos de ostión. El cálculo de similitud entre pares de estaciones suministra valores altos de este índice en localidades marcadas por la presencia de especies abundantes y de distribución amplia, como Cerithidea pliculosa, Acteocina canaliculata, Odostomia impressa, Mulinia lateralis y Mytilopsis leucophaeata, mientras que el de los miembros de las Familias Tellinidae, Donacidae y Semelidae, de distribución restringida, aporta semejanza menor, debido a que en las distintas estaciones de muestreo no hay especies comunes. AgradecimientosLos autores manifiestan su reconocimiento a Gerardo Barrientos Mac Gregor, por asesoría en el manejo de programas de cómputo y elaboración de material gráfico. Así mismo, agradecen la participación de Francisco Escobar de la Llata, Felipe Flores Andolais y Vicente Antolí Figuerola en la recolección de material biológico. LITERATURAABBOTT, R. T., American seashells. The marine Mollusca of the Atlantic and Pacific coast of North America. Van Nostrand Reinhold Co., New York 2a. ed., 1974. 666 p. ANDREWS, J., Sea shells of the Texas coast. University of Texas Press, Austin 1971. 298 p. ANTOLI, V. y A. GARCIA-CUBAS, An. Inst. Cienc. del Mar y Limnol. Sistemática y ecología de los moluscos en las lagunas costeras Carmen y Machona, Tabasco, México. Univ. Nal. Autón. México, 1985. 145-198. 12 (1): ARAT-ESPINOZA, G., Investigaciones ostrícolas en la laguna de Tampamachoco Ver. Secretaría de Marina. 1946. ARAT-ESPINOZA, G., Rev. Gra. Marina, El ostión de Tampamachoco. 1948. 5-7. (3): CAMACHO, E., M. R. PALACIOS, J. M. CORTINA, J. E. AGUITAR, H. ZAMUDIO y H. E. GARCIA, Mem. 2o. Simp. Latinoamer. Acuacultura. Resultados preliminares al cultivo del ostión en la laguna de Tamiahua, Pueblo Viejo y Tampamachoco, Ver. II. Depto. de Pesca. 1980. pp. 897-942. CONTRERAS, F., Biótica, Variaciones en la hidrología y concentraciónes de nutrientes del área estuarino-lagunar de Tuxpan, Tampamachoco, Veracruz, México. 1983. 201-213. 8 (2): CONTRERAS, F., Las lagunas cosieras mexicanas. Centro de Ecodesarrollo, Secretaría de Pesca, D. F. 1985. 253 p. CHAVEZ, E. A., Mem. IV Congreso nacional de Oceanografía. México. Notas acerca de la ictiofauna del Río Tuxpan y sus relacionales con la temperatura y salinidad. 1972. DEPARTAMENTO DE PESCA, Monografía del Puerto de Tuxpan, Veracruz, 1977. 1-30. (14): GARCÍA, E., An. Inst. Biol. Univ. Nal. Autón. México. Los climas del Estado de Veracruz (según el sistema de clasificación climática de Köppen modificado por la autora). Ser. Botánica, 1971. 342. 41 (1): GARCÍA-CUBAS, A., Bol. Inst. Geol. Univ. Nal. Autón. México, Sistemática y distribución de los micromoluscos recientes de la Laguna de Términos, Campeche, México. 1963. 1-55, 24 figs., 4 láms. 67 (4): GARCIA-CUBAS, A., An. Inst. Cienc. del Mar y Limnol. Moluscos de un sistema lagunar tropical en el sur del Golfo de México (Laguna de Términos, Campeche). Univ. Nal. Autón. México, Publ. Esp., 1981. 1-182. 5: GARCIA-CUBAS, A., F. ESCOBAR DE LA LLATA, L.V. GONZÁLEZ-ANIA y M. REGUERO, An. Inst. Cienc. del Mar y Limnol. Moluscos de la Laguna Mecoacán Tabasco, México: sistemática y ecología. Univ. Nal. Autón. México 1990. 1-30. 17 (1): GARCÍA-CUBAS, A. y M. REGUERO, An. Inst. Cienc. del Mar y Limnol. Moluscos del sistema lagunar Tupilco-Ostión, Tabasco, México: sistemática y reelegía. Univ. Nal. Autón. México 1990. 309-343. 17 (2): GONZÁLEZ, S. A. E., VII Simp. Latinoamer. Oceanogr. Biol. Histología de los ovarios durante el ciclo biológico de Arius melanopus y Bardiella ronchus en Tampamachoco, Veracruz México. Acapulco, Guerrero., México. 1981. KEEN, M. A. Sea shells of tropical west Attierica. Marine mol- from Baja Califorrnia to Peru. Stanford University Press, 2a. ed., Stanford. 1971. 1065 p., 22 láms. KOBELKOWSKY, A., VII Simp. Latinoámer. Oceanogr. Biol. Estudio de los peces de la laguna de Tampamachoco, Veracruz México. Acapulco, Guerrero México 1981. KOBELKOWSKY, A., Biotica Ictiofauna de la laguna de Tampamachoco, Veracruz. 1985. 10. KREBS, J. C., Ecology: The experimental analysis of distribution and abundance. Harper International Edition, New York. 1972. 694 P LANKFORD, R. R., Estuarine Processes. Coastal lagoons of Mexico: Their origin and classification. In: M. L. Wiley (Ed.), Academia Press Inc., New York, 1977. 182-215. 2: MARGALEF, D. R., Transl. from Mem. Real Acad Cienc. Arts. Barcelona, Information theory in ecology. General systems. 1958. 373-449. 32: MERCADO, V. L., Monografía de la laguna de Tampamachoco. Universidad Autónoma Metropolitana, Iztapalapa, Grupo BL-05, Trimestre Julio 1980. Licenciatura de Hidrobiología (Mimeografiado). 1980. PIELOU, E. C., Ecological diversity. Ed. Wiley, New York. 1975. 165 p. PURCHON, R. D., The Biology of the Mollusca. Pergamon Press, New York. 1968. 560 p. QUINTANA y MOLINA, J. y M. MULIA, VII Simp. Latinoamer. Oceanogr. Biol. Estudio de las poblaciones bentónicas del sistema estuarino Tuxpan-Tampamachoco, Veracruz, México. Acapulco, Guerrero México. 1981. REGUERO, M. y A. GARCÍA-CUBAS, An. Inst. Cienc. del Mar y Limnol. Moluscos de la Laguna de Alvarado, Veracruz: sistemática y ecología. Univ. Nal. Autón. México, 1989. 279-306. 16 (2): SHANNON, E. C. y N. WIENER, The mathematical theory of communication. University of Illinois Press, Urbana. 1963. 117 p. VÄLIKANGAS, I., Über die Biologie der Ostsee als Brackwassergebiet. Verhandl. intern. Ver. Limnol., 1933. 62-112. 6: VÁZQUEZ-BOTELLO, A., Rev. Biol. Trop., Presencia de hidrocarburos fósiles en ecosistemas estuarinos del Golfo de México. 1978. 135-151. 26 (1): VÁZQUEZ-BOTELLO, A., An. Centro Cienc. del Mar y Limnol. Niveles actuales de hidrocarburos fósiles en ecosistemas estuarinos del Golfo de México. Univ. Nal. Autón. México, 1979. 7-14. 6 (1): VÁZQUEZ-BOTELLO, A. y A. F. MANDELLI, Geochim. Cosmochim Acta, Organic carbon isotope rratios of recient sediments from coastal lagoons of the Gulf of México. 1980. 557-559. 44:
|

