|
MADUREZ GONÁDICA Y CICLO REPRODUCTOR DEL CARACOL
PANOCHA (Astraea undosa WOOD, 1828; GASTROPODA: TURBINIDAE) EN BAHÍA
TORTUGAS, B.C.S.
Trabajo recibido el 23 de enero de 1991 y aceptado para
su publicación el 21 de mayo de 1991.
J. Belmar-Pérez
Escuela nacional de Ciencias Biológicas,
Laboratorio de Ecología, IPN. Apartado Postal 63-383, México,
D.F. 02800, México.
S. A. Guzmán del Próo e I Martínez-Morales
Becarios COFAA.
Se estudió la biología reproductiva del
gasterópodo Astraea undosa (caracol panocha) que
habita en la zona de Bahía Tortugas, B.C.S., durante el período
comprendido entre noviembre de 1985 y noviembre de 1988. El análisis
histológico de 195 individuos permitió determinar los intervalos
de talla en que ocurren los diferentes estadios de madurez gonádica que
se describen: organismos indiferenciados, todos los juveniles hasta con una
talla máxima de 54 mm de diámetro basal de la concha; organismos
en vías de madurez, de 51 a 60 mm en el caso de las hembras y de 61 a 70
mm en los machos, y adultos reproductores, con frecuencia máxima a
partir del intervalo 91-100 en las hembras y de 81-90 en el caso de los machos.
La población mostró cuatro diferentes patrones de comportamiento
de desove: desovadores totales, desovadores parciales, desovadores incompletos
y no desovadores. La especie presentó signos de actividad reproductiva
durante todo el año; la primavera y el otoño resultaron las
épocas de mayor expulsión. Los desoves totales ocurrieron con
mayor frecuencia a los 18 m de profundidad, en tanto que los desoves parciales
sucedieron en aguas más someras. Los resultados indican que la talla
mínima de captura podría situarse alrededor de los 96 mm de
diámetro basal.
Astraea undosa, locally known as
caracol panocha, is a gastropod of commercial value in the
central Pacific coast of Baja California. Reproductive biology studies were
conducted in Bahía Tortugas between November 1985 to November 1988.
Histological examination of 195 organisms showed three different gonadic stages
along the life span: imnmature (Stage I), juveniles up to 54
mm basal diameter organisms; early gametogenic stage (Stage
II), from 51 to 60 mm in females and 61 to 70 mm for males;
full maturity (Stage III), with a maximum frequency starting
from 91 to 100 mm size class for females, and 81 to 90 mm size class for males.
Along three seasonal annual cycles, population showed four different spawning
patterns: total spawning, partial spawning, incomplete spawning, and no
spawning. There was reproductive activity during all the year. However, spring
and autumn seem to be the major intensive spawning seasons. Total spawners
oceurred more regularly at 18 m depth, whereas partial spawners were dominant
in shallower waters. Resuits suggest that the minimum legal size could be close
to 96 mm of basal diameter for this species.
Astraea undosa, conocido como caracol panocha, es un gasterópodo que cohabita con el abulón (Haliotis spp) en las costas rocosas del Pacífico de Baja California, y cuya pesquería ha empezado a desarrollarse en los últimos 10 años en la zona de Bahía Tortugas, B.C.S. Hasta hace poco se empleaba como carnada en la pesca de langosta; actualmente constituye una pesquería establecida y su importancia radica en el hecho de que el recurso se comercializa enlatado como producto sucedáneo del abulón. La información biológica antecedente acerca de Astraea en general es escasa. Juber (1970) publica: "La Estructura de la Concha de Astraea olfersi"; Mc Lean (1970) propone un nuevo subgénero para el género Astraea de la parte oriental del Pacífico; Vovelle (1973) se refiere a la transferencia de calcio a través del epitelio del repliegue opercular en Astraea rugosa, y Flores y Cáceres (1980) dan a conocer la presencia del género Astraea en aguas costeras de Venezuela. En relación con Astraea undosa, son también pocos los trabajos publicados; Schmitt (1981) hace una comparación de las defensas antidepredatorias de gasterópodos marinos simpátricos, y Yool et al. (1986) estudian el exceso de potasio como inductor en la metamorfosis larval en cuatro invertebrados marinos. Para el caso de Astraea undosa de Baja California, hasta el momento no existe ningún estudio previo, a excepción de informes técnicos que evalúan las poblaciones de esta especie (Pineda, inédito) y algunas contribuciones a congresos, no publicadas (Cupul-Magaña y Torres-Moye, 1989; Silva-Loera y Guerrero-Martínez, 1990). Los autores de este trabajo iniciaron en 1986 una serie de estudios acerca de la ecología de las comunidades bentónicas de Baja California, incluyendo una línea de investigación relaciónada con la biología reproductiva de Astraea undosa, cuyos primeros resultados se presentan en este artículo. El objetivo del presente trabajo fue el de aportar información relativa a la madurez sexual y al ciclo reproductor de Astraea undosa, y la variación de éstos en el transcurso de tres cielos estacionales, como una primera aproximación al conocimiento de la biología reproductiva de este gasterópodo. ÁREA DE ESTUDIOEl trabajo de campo se realizó en la zona de Bahía Tortugas, B.C.S. Las muestras se obtuvieron en el infralitoral rocoso de un sitio denominado "Los Morros", el cual se localiza en el extremo suroriental de la boca de la bahía; es una cadena de tres islotes que resultan de la prolongación de una de las puntas que cierran la bahía (Fig. 1). El área de "Los Morros" constituye, hacia barlovento, un banco pesquero de alta productividad donde se pesca abulón, langosta, caracol y algas Gelidium; cubre un área aproximada de 0.4 km , y es característica la presencia de mantos de algas, conocidas como sargazo gigante (Macrocystis pyrifera), que se extiende desde la orilla de los islotes hasta una profundidad de 18 a 20 metros. MATERIAL Y MÉTODOSEl trabajo se basó en el análisis de 11 muestras estacionales comprendidas entre 1985 y 1988, correspondientes a los meses y años siguientes: noviembre de 1985; enero, mayo y agosto de 1986; febrero, abril, agosto y noviembre de 1987, y mayo, agosto y noviembre de 1988. Se colectaron mediante buceo autónomo, a lo largo de una franja sublitoral ubicada a una profundidad aproximada de 10 a 12 metros muestras de entre 8 y 17 organismos, hembras y machos, en un intervalo de talla comprendido entre los 38 y los 130 mm. El último año (1988) se decidió ampliar la zona de muestreo hacia los 6 y 18 metros, con el objetivo de cubrir toda el área de distribución batimétrica de la especie, y determinar si existían diferencias en la madurez gonádíca y en el cielo reproductor de la especie, a diferentes cotas de profundidad. 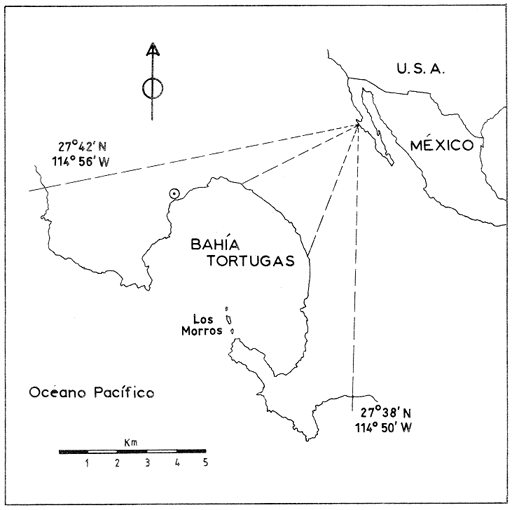 Figura 1. Área de estudio: Los Morros, Bahía Tortugas, Baja California Sur. Antes de extraer la gónada, los organismos se pesaron y midieron talla está referida al diámetro mayor de la base de la concha. Desconchado el animal, la determinación de los sexos se hizo por apreciación visual de acuerdo con la coloración del cono gonadal; posteriormente se corroboró mediante análisis histológico. Se realizó un análisis histológico prospectivo de las porciónes apical, media y basal de la gónada, con el fin de establecer si había diferencias en la imagen microscópica de cada una de ellas. Al no encontrarlas se decidió trabajar únicamente con la porción media (Fig. 2). Un fragmento de esta porción se incluyó en parafina para obtener cortes de ocho µm que se tiñeron con hematoxílina-eosina. Simultáneamente al análisis histológico se calculó un índice gonádico (I.G.). Para dicho cálculo se aplicó, con algunas modificaciónes, el método descrito por Hayashi (en Prince, 1987). Dichas modificaciónes consistieron en que de cada uno de los ejemplares analizados histológicamente se proyectaron sobre papel las siluetas de los cortes ya teñidos y se dibujó el contorno correspondiente a toda la glándula hepatogonadal y el de la porción gonádica. Ambas siluetas se recortaron y pesaron; el peso se estableció entre la relación del área gonádíca y el de la superficie total, de esta manera se obtuvo el I.G. respectivo, que se expresó como porcentaje relativo. RESULTADOS
DESCRIPCIÓN MACROSCÓPICAAstraea undosa posee una sola gónada, cuya forma es semejante a la de un cono enrollado sobre sí mismo a manera de espiral; a lo largo de éste, el tejido gonádico se mantiene en contacto íntimo con el hepatopáncreas o divertículo digestivo, formando el llamado cono hepatogonadal. La consistencia de este cono varía de laxa a compacta, según sea el estado reproductivo del organismo. El tejido gonádico se encuentra ocupando principalmente la parte exterior de la espira, y su volumen está en relación con el grado de madurez del organismo; el hepatopáncreas se localiza en la porción ventral de la propia espira (Fig. 2). 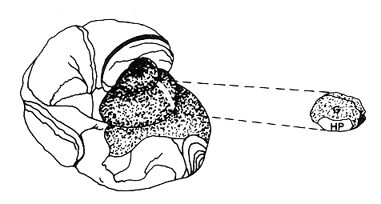 Figura 2. Astraea undosa. Esquema de un organismo desconchado mostrando la masa muscular y la visceral Sección transversal del cono hepatogonadal. G = gónada, HP = hepatopáncreas. La gónada está limitada en su parte anterior por la porción final del estómago y la inicial del hepatopáncreas, y se encuentra encerrada totalmente en el interior de la concha ocupando toda la espira. En esta especie hay diferenciación sexual; la diferencia gonadal entre hembras y machos es muy evidente en la etapa adulta; la gónada de las hembras es de color verde musgo, en tanto que la de los machos es de color crema. Sin embargo, es importante señalar que esta coloración en ocasiónes puede engañar al observador si se trata de un organismo recién desovado, en el cual la gónada puede ser de apariencia hialina donde no existe una coloración definida. DESCRIPCIÓN MICROSCÓPICAEn ambos sexos, el cono hepatogonadal está limitado por un epitelio cilíndrico simple en el que se encuentra gran cantidad de células caliciformes; este epitelio se apoya sobre una capa de tejido conjuntivo en el que se observan fibras musculares lisas. Bajo esta capa muscular se desarrolla el tejido gonadal, que se encuentra separado del hepatopáncreas por una capa delgada de tejido conjuntivo y algunas fibras musculares lisas. Una serie de trabéculas, del mismo tipo de tejido, se extienden de la periferia hacia el centro en disposición radial, e integran el sistema trabecular, típico de organismos adultos. En este sistema se localiza el epitelio germínal, caracterizado por células de forma redonda u oval, de 5 a 8 µm de diámetro, con núcleos grandes, nucleolos prominentes y cromatina densa; en este sitio se efectúa la gametogénesis. En las hembras, al desarrollarse las células del epitelio germinal incrementan su tamaño y adoptan formas irregulares; en las más jóvenes existen un citoplasma intensamente basófilo, un núcleo grande que contiene un nucleolo fuertemente basófilo y cromatina densa. A medida que el grado de madurez avanza, el citoplasma empieza a ser ocupado por plaquetas vitelinas ligeramente acidófilas; en ese momento se observa menos densa la cromatina del núcleo; al concluir su desarrollo, los ovocitos son células esféricas cuyo tamaño varía entre 180 y 269, µm de diámetro. Los ovocitos maduros están rodeados por el corion, el cual se observa como una membrana de espesor variable e índole débilmente basófila; el núcleo es generalmente excéntrico, bien definido, con nucleolo intensamente basófilo y cromatina laxa débilmente basófila; el citoplasma se encuentra ocupado por gran cantidad de plaquetas vitelinas ligeramente acidófilas. En los machos, las células del epitelio germinal modifican también su forma y su tamaño, que da como resultado espermatozoides cuya cabeza mide entre 4.7 y 7.8 µm de longitud. El flagelo, que es visible únicamente en material reciente, se observa como un filamento refringente muy delgado cuya longitud aproximada es de cinco a seis veces la de la cabeza. En el extremo anterior de ésta se encuentra el acrosoma, una estructura de naturaleza acidófila y forma triangular con el ápice redondeado. El núcleo es de forma rectangular y de carácter intensamente basófilo; en su base se aprecia una protuberancia pequeña semicircular acidófila, de la que surge el flagelo. ESTADIOS DE MADUREZ GONÁDICALos resultados del análisis histológico nos permitieron establecer los diferentes estadios de madurez gonádica que corresponden a diferentes intervalos de talla de los individuos estudiados. Estadio I. Organismos indiferenciados. En esta etapa no es posible diferenciar el sexo de los individuos; macroscópicamente, el cono hepatogonadal presenta un color verde oscuro, típico del hepatopáncreas; consistencia bastante compacta. Microscópicamente tampoco es posible la determinación del sexo, debido a que las células del epitelio germinal están totalmente indiferenciadas. La ausencia del tejido conjuntivo que forma las trabéculas es evidente, por lo que el epitelio germinal está confinado exclusivamente a una capa delgada localizada en los márgenes externos de la glándula hepatogonadal. En este estadio se encuentran los organismos juveniles de la especie, desde los más pequeños hasta los de una talla máxima de 54 mm; esto último como casos aislados (Tabla 1). Estadio II.Organismos en vía de madurez. La gónada de las hembras es de color verde grisáceo, en tanto que la de los machos es ligeramente gris crema; en ambos casos, la consistencia del cono hepatogonadal es moderadamente compacta. Microscópicamente, las gónadas son claramente ditinguibles; la presencia de gametos femeninos o másculinos, aun en las fases tempranas de este estadio, es evidente. Se inicia la formación del sistema trabecular, y el volumen de tejido gonádico aumenta como consecuencia del incremento, en número y tamaño, de las células del tejido germinal. En el caso de las hembras, el tejido gonádico se encuentra ocupado en su mayoría (más del 60 %) por células inmaduras, cuya talla fluctúa entre los 15 y los 100 µm de diámetro. En los machos predominan los gametos inmaduros (espermatogonias), y los espermatozoides aparecen libres o ligeramente empaquetados. El intervalo de talla de frecuencia máxima (62%) de esta categoría fue de 51 a 60 mm en el caso de las hembras; en el de los machos, el 37% de la población se encontraba en el intervalo 61 a 70 mm (Tabla 2). Estadio III. Adultos reproductores. Son organismos en los que, en general, la determinación macroscópica de los sexos no se presta a confusión. Las hembras muestran coloración gonadal verde musgo; los machos, de color crema. La consistencia de la gónadas es turgente. La imagen microscópica del ovario muestra al tejido trabecular dispuesto en forma radical debidamente organizado. Los ovocitos han alcanzado su desarrollo máximo: diámetro superior a 180 µm. No se observan espacios o huecos, pues la cavidad gonádica está totalmente llena de productos terminales, por lo que la actividad gametogénica, si existe, está reducida a la periferia de la pared gonadál,de índole más residual que activa. Por otra parte, los testículos se observan llenos de espermatozoides dispuestos en racimos apretados de forma plumosa; las trabéculas y el tejido germinal están reducidos a canales estrechos, con espermátidas abundantes (Figs. 3 y 4) 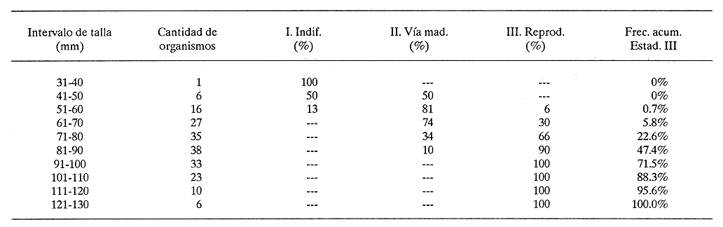 TABLA 1 Frecuencia relativa de estadios de desarrollo gonádico por intervalo de talla en muestras de Astraca undosa (ambos sexos) de Bahía Tortugas, B.C.S. 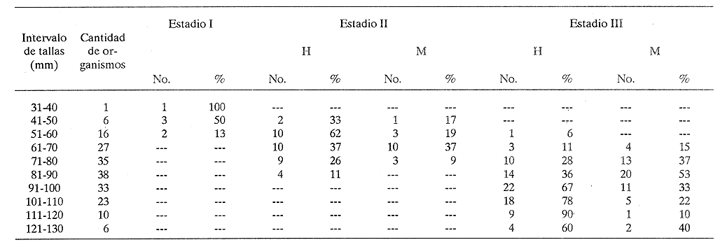 TABLA 2 Frecuencia de estadios de desarrollo gonádico por intervalo de talla en machos (M) y hembras (H) de Astraea undosa. Estadio I(indiferenciado), Estadio II (en vías de madurez) y Estadio III (madurez total, adultos reproductores) En las hembras, este estadio puede ocurrir desde los 58 mm, aunque esta talla es poco frecuente (6%); a partir de los 91 mm, todas las hembras alcanzaron este estadio. Los machos llegaron a esta etapa a partir de los 63 mm, aunque también como casos aislados (15%); empero, desde los 81 mm todos los individuos de la muestra habían logrado esta fase (Tabla 2). CICLO REPRODUCTIVO
Una vez alcanzado el estadio III ,
los individuos reproductores exhibieron diferentes imágenes
histológicas, correspondientes a diversos tipos de
desove
Convencionalmente, en este trabajo, el término desove se usa
para referirse a la liberación de gametos, tanto en hembras como en
machos
Desove total. La mayor parte de la gónada se halla vacía o con espacios libres muy grandes. La presencia de gametas maduras es residual y sumamente escasa, particularmente en el caso de las hembras. El sistema trabecular se observa completamente desorganizado y la pared externa de la gónada aparece colapsada (Figs. 5 y 6). Los organismos que presentan este tipo de desove exhiben una sonado que a simple vista es de aspecto hialino sin coloración definida. Desove parcial. Caracterizado por la presencia de ovocitos o espermatozoides maduros que llenan parte de la gónadas; la existencia de huecos en el tejido, principalmente hacia las proximidades del hepatopáncreas, es típica en este tipo de desove. En las hembras, el tejido trabecular empieza a desorganizarse y una matriz gelatinosa ocupa los espacios dejados por los ovocitos; éstos pueden estar sueltos o poseer todavía cierto grado de compactación (Fig. 7). Es difícil determinar si la gónada continuará expulsando gametos o, en su defecto, sufrirá un proceso de reabsorción. En los machos, los racimos espermáticos se observan desarreglados y con cierta laxitud, como resultado de la liberación de gametos; espermatocitos y espermatogonias también Muestran desarreglo- la presencia de células germinales es escasa. El tejido conjuntivo que sostiene a los espermatozoides semeja canales muy anchos (Fig. 8). Desove incompleto. En la gónada de las hembras se observan ovocitos maduros que llenan la mayor parte de la cavidad, pero hacia el hepatopáncreas se distinguen espacios pequeños que indican desove previo muy reducido (Fig. 9). El resto de las células inicia un proceso de necrosis y reabsorcion, el cual se manifiesta como pérdida de ¡urgencia celular, vacuolización del citoplasma y ruptura de la membrana nuclear (Fig. 10), características similares a las descritas por Young y DeMartini (1970), en relación con los procesos de necrosis observados en abulón rojo (Haliotis rufescens). 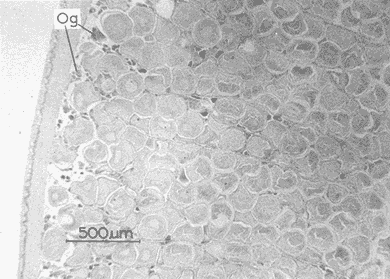 Figura 3. Ovario en madurez total (Estadio III), Cavidad gonádica llena de ovocitos maduros. Ovogonias Residuales (Og) hacia la base de la gónada. Espécimen de 112 mm, colectado en enero de 1986. La presencia de células necróticas es la única característica que permitió distinguir el desove incompleto del parcial. Desove nulo. En las hembras, la imagen característica es la de individuos maduros cuyos ovocitos, al no ser expulsados, en la mayoría de los casos muestran procesos de necrosis. No se observan espacios que denoten pulsos de liberación (Fig. 11). En el caso de los machos, el proceso necrótico no fue evidente. Gametogénesis, o fase activa.Este proceso se desarrolla con mayor o menor intensidad en los diferentes patrones reproductivos observados en organismos adultos. En todos los casos de desove parcial, incompleto e incluso del nulo, se notó como un proceso continuo limitado a la parte periférica de la gónada. únicamente en los casos de desove total se observó la gametogénesis como proceso activo que inicia el restablecimiento del tejido gonádico y un ciclo nuevo. En los ovarios, la gametogénesis se caracterizó por la presencia de gran cantidad de ovogonias unidas a las trabéculas; éstas muestran tendencia a restablecer la disposición radial típica observada en organismos maduros (Fig. 12). En el caso de los testículos, el proceso gametogénico se manifestó por profusión de espermatogonias y espermatocitos, que se hizo más evidente en los individuos recién desovados, total o parcialmente. VARIACIÓN ESTACIONAL DEL CICLO REPRODUCTIVOEn las figuras 13a y 13b se combinan los resultados del análisis histológico (barras) y del índice gonádico (línea continua) relativos a organismos mayores de 80 mm de talla. En estas figuras se integraron los tres ciclos de observación; destaca lo siguiente: CICLO PRIMEROOtoño 1985 - Otoño 1986. En este primer ciclo (noviembre de 1985 a noviembre de 1986) dominaron adultos con signos de madurez avanzada. Una cantidad importante de hembras mostraron una imagen con ovocitos desarrollados plenamente, que llenaban por completo la cavidad gonádica y procesos incipientes de necrosis y reabsorción en las contigüidades del hepatopáncreas. Las imágenes de madurez y nulo desove dominaron durante el invierno tardío de 1985 y el verano de 1986, mientras que en otoño de 1985 y la primavera de 1986 prevaleció desove incompleto, especialmente en el caso de las hembras.  Figura 4, Testículo en madurez total, Espermatozoides dispuestos en paquetes plumosos que llenan la Cavidad gonádica, Trabéculas (T) con sistema espermatogénico en estadio terminal, Espécimen de 74 mm, colectado en agosto de 1986, HP=hepatopáncreas. En los machos, desde el otoño de 1985 al verano de 1986 se observaron sólo dos categorías: individuos maduros y desovadores parciales; estos últimos incrementaron su frecuencia desde el otoño hasta la primavera siguiente, en tanto que los estadios de madurez tuvieron tendencia inversa. Durante el verano de 1986 hubo únicamente adultos maduros. Lo anterior indica que la población estudiada alcanzó la madurez gonádica pero no hubo desoves, o bien éstos fueron parciales y muy reducidos. CICLO SEGUNDOOtoño de 1986 - Otoño de 1987. Durante el cielo anual siguiente (noviembre de 1986 a noviembre de 1987), en primavera y verano la población mostró evidencias más claras de desoves parciales abundantes en ambos sexos. En el otoño de 1987, por vez primera las hembras realizaron algunos desoves totales, y gran cantidad de ellas no desovó. En esta misma estación se notaron organismos con gametogénesis activa, posiblemente a consecuencia de desoves totales previos. En los machos ocurrieron las mismas fases del ciclo anterior: madurez total y desoves parciales; a finales del invierno de 1986 acaeció una frecuencia máxima de organismos maduros, en tanto que en la primavera de 1987 los casos de desove fueron solamente parciales, los cuales disminuyeron progresivamente hacia el verano y el otoño inmediatos, mientras que la frecuencia de organismos maduros aumentó del verano al otoño de ese ciclo. CICLO TERCEROOtoño de 1987 - Otoño de 1988. En el tercer año de Observaciones (noviembre de 1987 a noviembre de 1988), la presencia de desovadores totales se hizo más frecuente, con incremento de hembras del verano al otoño. En los machos, por el contrario, la frecuencia máxima de desovadores totales surge en la primavera y desciende hacia el verano. Sin embargo, la frecuencia de desovadores parciales en este sexo sigue un patrón opuesto, con incremento progresivo desde la primavera hasta el otoño siguientes. 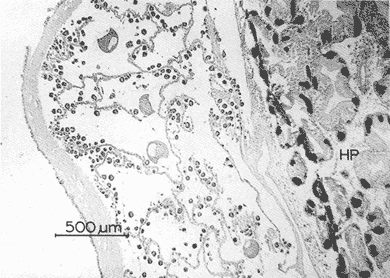 Figura 5. Ovario luego del desove total. Gónada vacía; tejido trabecular desorganizado; la membrana externa pierde turgencia. Ovocitos residuales escasos. Espécimen de 101 mm colectado en mayo de 1988.HP = hepatopánereas. 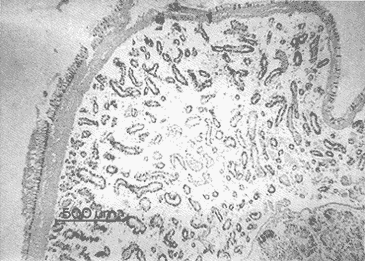 Figura 6 Testículo luego del desove total. Grandes huecos vacíos. Tejido trabecular como islas dispersas sin orden en la cabidad gonádica. Espécimen de 96 mm; mayo de 1988. 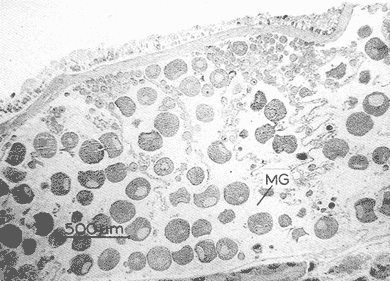 Figura 7. Ovario luego del desove parcial. Espacios vacíos notorios; matriz gelationsa (MG) que rodea al resto de ovocitos maduros; trabéculas desorganizadas. Espécimen de 92 mm; agosto de 1988.  Figura 8. Testículo con desove parcial. Espacios libres grandes; tejido trabecular parcialmente desorganizado. Paquetes espermáticos residuales (PER) adheridos a las trabéculas. Espécimen de 78 mm; agosto de 1988. 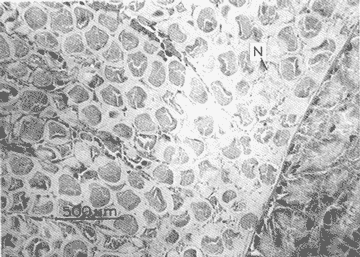 Figura 9. Ovario que muestra desoye incompleto. En la base de la gónada contigua al hepatopáncreas se observan espacios libres pequeños y una matriz gelatinosa. Trabéculas interrumpidas y células necróticas (N) que caracterizan este patrón reproductor. Espécimen de 115 mm; mayo de 1986. 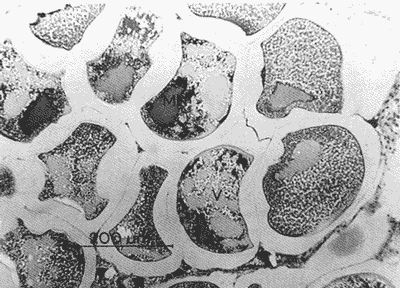 Figura 10. Detalle de células necróticas. Nótense los procesos de vacuolización citoplásmica (V) y ruptura de la membrana nuclear (MN). Espécimen de 107 mm; noviembre de 1987. 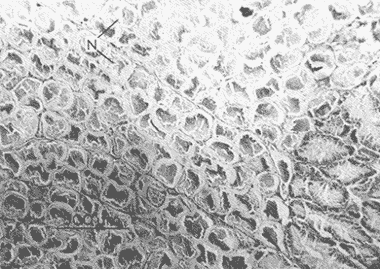 Figura 11. Ovario que muestra desove nulo, caracterizado por gran cantidad de ovocitos necróticos (N) a lo largo de la gonáda en proceso de reabsorción. Nótece que, a diferencia del desove incompleto, no hay espacios vacíos en el tejido ni desarreglo de las trabéculas. Espécimen de 108 mm; enero de 1986 En primavera es notoria en las hembras la elevada frecuencia de organismos con gametogénesis activa, probablemente como consecuencia de desoves totales ocurridos durante la estación prevía o en semanas anteriores. La resultante general de estos tres cielos de observación es que, en el transcurso del año, Astraea undosa tiene más de un período de desove; sin embargo, de un año al siguiente el patrón reproductivo es diferente. Esta diversidad de frecuencia de los cuatro tipos de desove indica que, de una estación a otra o de un año a otro, en esta especie pueden concurrir cualquiera de ellos, si bien el más frecuente es el parcial. ÍNDICE GONÁDICOEn las figuras 13a y 13b se presentan los valores del índice gonádico (1.G.). Las fluctuaciones estacionales y la tendencia general de este indicador durante los tres años son muy semejantes en ambos sexos. Los valores máximos de I.G. durante cada ciclo ocurrieron regularmente en verano y, excepto el otoño de 1985, los mínimos sucedieron en primavera y otoño. La ausencia de muestras en el otoño de 1986 y el invierno de 1988 impidió cerrar el ciclo de los tres años; sin embargo, los resultados indican que de la primavera al verano las gónadas tienden a madurar, en tanto que del verano al otoño ocurre la expulsión de gametos. Este último proceso parece prolongarse hasta los meses de invierno, como fue evidente en 1985; no obstante, en los dos ciclos siguientes sólo se insinuó. Al confrontar los resultados de este índice con los del análisis histológico, no siempre se encontraron las coincidencias esperadas. Solamente en casos particulares como el de 1988, durante el cual acontecieron desoves abundantes, hubo coincidencia entre ambos fenómenos. Lo mismo se puede decir para el caso partícular de los machos entre el otoño de 1985 y el verano de 1986, pues la frecuencia de madurez y el desove parcial siguen el mismo patrón delineado por el I.G. 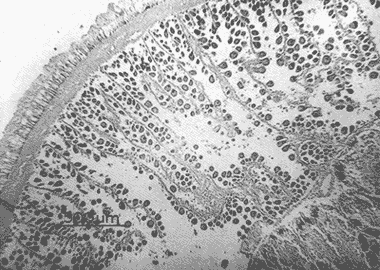 Figura 12 Ovario con gemetogénesis activa, posterior a un desove total. Las trabéculas se disponen nuevamente en posición radial; se observa profusa formación de ovogonias a lo largo de las mismas. Espécimen de 96 mm de mayo de 1988. VARIACIÓN DEL CICLO REPRODUCTIVO EN FUNCIÓN DE LA PROFUNDIDADLas observaciones de 1988, tendientes a determinar la posible influencia de la profundidad en los patrones de desove de Astraea undosa, se resumen en las figuras 14 y 15. Destacan varios hechos:a) Parece evidente que la gran mayoría de los desovadores totales se localizan preferentemente en profundidades mayores, como ocurrió con individuos de cada uno de los sexos a los 18 metros. b) En el caso de los machos, hacia aguas más someras (6 metros) se observó frecuencia elevada de organismos con madurez total, durante los tres ciclos. c) Una alta frecuencia de desovadores parciales, principalmente de machos, se concentraron en profundidades de 12 metros. d) Como en el caso de la variación estacional, hay poca coincidencia entre el I. G. y la imagen histológica; únicamente en otoño existe cierta congruencia, tanto en hembras como en machos. TALLAS DE MADUREZ SEXUAL Y SU RELACIÓN CON UNA PRIMERA TALLA DE CAPTURAUna de las derivaciones prácticas de este tipo de trabajos es su aplicación a la determinación de tallas mínimas de captura, las cuales, independientemente de otros parámetros poblacionales (como tasas de crecimiento y mortalidad), se basan también en las tallas de madurez sexual para la población en su conjunto. En incisos anteriores ha quedado establecido que la aparición más temprana de gametos diferenciados en A. undosa ocurrió en las hembras a partir de los 43 mm de diámetro basal, y en los machos a los 50 mm. Estas cifras pueden considerarse como las tallas mínimas de actividad gametogénica. Sin embargo, con el objetivo de tener una primera aproximación acerca de la primera edad o talla de captura, en términos biológicos pesqueros, en la figura 3 se integraron los datos de frecuencia de madurez. Puede observarse que en el intervalo 31-40 mm ningún organismo presentó signos de madurez; ésta se inicia de los 41 mm en adelante. En este intervalo (41-50), el 50% de los organismos muestreados presentaron ciertas características de madurez incipiente. 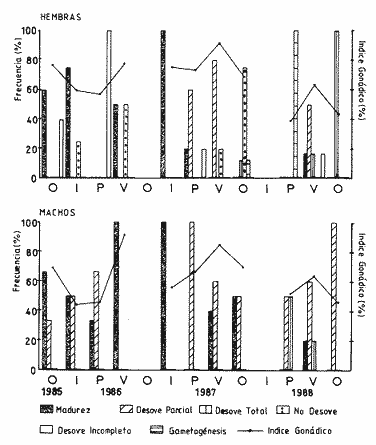 Figura 13 (a y b). Variación estacional del ciclo reproductor de Astraea undosa en Bahía de Tortugas, B.C.S., del otoño de 1985 al otoño de 1988. Análisis histológico (barras) e índice gonadal (línea continua). P = primavera; V = verano; 0 = otoño; I = invierno. 6a:hembras: 6b: machos. Los primeros casos de madurez plena ocurrieron en las hembras antes que en los machos, a los 51 y 61 mm, respectivamente; sin embargo, este fenómeno se invierte casi inmediatamente y los machos alcanzan más rápidamente que las hembras la madurez total (Fig. 16). Como se observa en la curva de frecuencia acumulada (Fig. 17), correspondiente a individuos reproductores, a los 86 mm (valor medio del intervalo 81-90) el 50% de los organismos se han incorporado al grupo reproductor. Considerando que a partir del intervalo siguiente (91-100) organismos de cada uno de los sexos, como lo muestra la tabla 1, se han agregado totalmente a dicho grupo, en esta zona la talla mínima de captura para esta especie podría situarse, como primera aproximación, en algún punto entre el valor medio de estos dos intervalos. En términos generales, se acepta que una protección al 50% de los desovadores resulta suficiente para mantener la capacidad de remplazo de la población, sin merma de su existencia (talla crítica de madurez). Sin embargo, prevíamente a emprender estudios más amplios acerca de: biología, tasa de mortalidad, tasa de natalidad, crecimiento y reclutamiento de la especie, preliminarmente sería más prudente optar por los 96 mm como talla mínima de captura, con riesgo menor. DISCUSIÓNEl estudio de la madurez sexual y del ciclo reproductivo de Astraea undosa en el área de Bahía Tortugas constituye una primera aportación al conocimiento de la biología básica de esta especie, la cual promete ser en el futuro una pesquería de gran importancia en las zonas abuloneras, que en la actualidad se encuentran deprimidas en su producción (Guzmán del Próo, 1989). Las cooperativas de esa zona buscan productos pesqueros que puedan suplir la escasez que afecta al abulón; en este sentido, el caracol panocha (A. undosa) constituye una especie alternativa. A pesar de que en el presente estudio no fue posible realizar observaciones con periodicidad mensual, los tres ciclos anuales estacionales cubiertos permiten tener una sinopsis suficientemente ilustrativa de los procesos de madurez sexual, y una primera aproximación a los diferentes patrones de comportamiento reproductivo de la especie. En términos de las características macro- y microscópicas de la gónada y sus productos sexuales, el desarrollo es semejante al de otros gasterópodos, como Haliotis sp; en este sentido, hay gran semejanza con lo observado por Young y De Martini (1970), Sevilla (1971), y Tutschulte y Connel (1981). Las dimensiones promedio de ovocitos y espermatozoides, de 225 y 5.5 µm respectivamente, son muy similares a las que citan Giorgi y De Martini (1977) para Haliotis rufescens de California. El diámetro máximo conocido de los ovocitos -de hasta 250 µm- del abulón está cerca de las 269 µm máximas observadas en A.undosa. En relación con los primeros signos de madurez de esta especie, y la mayor precocidad de hembras respecto de los machos, Giorgi y De Martini (1977) informan de un comportamiento similar de Haliotis rufescens (abulón rojo) de Punta Cabrillo. 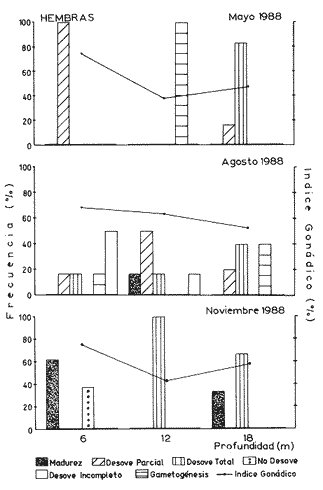 Figura 14. Variación del patrón reproductivo de hembras de Astraca undosa según la profundidad y la estación del año. Baía Tortugas, B.C.S. Los diversos tipos de desove y la distinta frecuencia con que se presentaron cada año indican que A. undosa de Bahía Tortugas es fundamentalmente desovador parcial. Sin embargo, bajo ciertas condiciones ambientales puede comportarse con una gran plasticidad reproductora y actuar, como ya se mencionó, como desovador incompleto, o como desovador total o, incluso, no desovar. Esta distinta actitud reproductiva se ha descrito también para Haliotis rufescens (Giorgi y De Martini 1977), en poblaciones cuya ubicación latitudinal es más septentrional, con respecto a la de Bahía Tortugas. La falta de muestras de otoño de 1986 e invierno de 1988 afecta un tanto los resultados obtenidos en este trabajo, pues no es muy claro en qué época del año ocurren los máximos desoves. Aparentemente los de primavera y otoño son los de mayor intensidad; sin embargo, en ciertos casos, como el de 1987, en verano 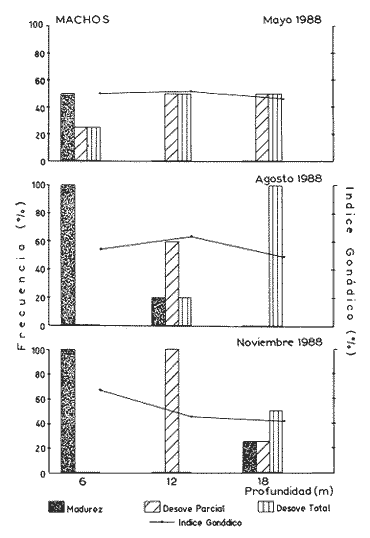 Figura 15.Variación del patrón reproductivo de machos de Astraea undosa según la profundidad y la estación del año. Bahía Tortugas, B.C.S. puede acontecer una elevada frecuencia de desovadores (Figs. 15a y 15b). La relativa constancia de desovadores totales en la cota batimétrica de 18 m, indistintamente del sexo, indicaría que los desoves más significativos parecen ocurrir a mayor profundidad. Estas Observaciones son preliminares pero sugieren que podría haber cierta separación batimétrica de fajas reproductoras de la población, y que de alguna manera los desoves parciales o totales estarían influidos por las condiciones de oleaje y la estabilidad, mayor o menor, de la masa de agua. Esta gran plasticidad reproductiva podría explicarse por la ubicación de esta especie en el centro de una zona extensa de transición, como es la Península de Baja California, la cual se encuentra bajo la influencia de las aguas templadas de la corriente de California y del clima tropical marino de la Provincia Panámica. Cuando las condiciones de una u otra provincia dominan sobre el clima y los procesos oceanográficos de la región, debe suceder una diferente respuesta reproductiva de la población, independientemente de otros factores internos de la propia población, como factores de densodependencia y disponibilidad de recursos no detectados que, no obstante, deben tener también cierta influencia en el ciclo reproductivo y en los diferentes tipos de pulsos de desove de esta especie. 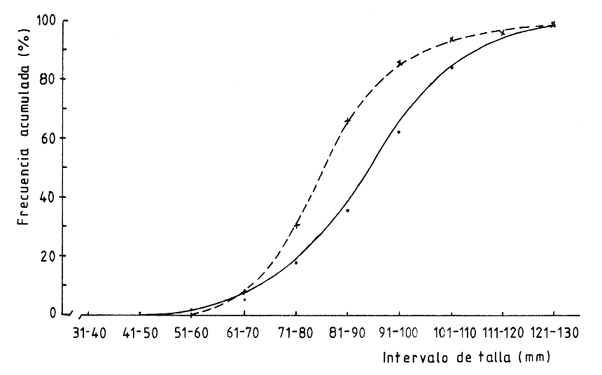 Figura 16. Frecuencia acumulada, por intervalos de talla, de reproductores (maduros, Estadio III) de Astrea undosa en muestras poblaciones de Bahía Tortugas, B.C.S. Machos(+); hembras (.). Las fluctuaciones del ciclo reproductivo determinadas mediante el índice gonádico mostraron consistencia en cuanto al patrón estacional vigente durante los tres cielos anuales; sin embargo, fue muy escasa su correspondencia con las Observaciones histológicas dentro de cada ciclo. La hipótesis de los autores planteaba que los valores máximos de I.G. del verano coincidirían con las frecuencias máximas de individuos maduros histológicamente hablando y, a la inversa, que los mínimos del I.G. deberían estar en relación con frecuencias elevadas de organismos en desove. Sin embargo, en muchos de los casos dichas coíncidencias no ocurrieron. Por tanto, el I.G. no es una medida lo suficientemente sensible para detectar los desoves, particularmente los parciales y los incompletos, que, como se describió, ocurrieron con gran frecuencia en A.undosa. Aun en los casos de desove total - gónada vacía de ovocitos - el I.G. no fue congruente, ya que en el tejido gonádico existía cierto volumen ocupado por un mucílago remanente, con lo cual se obtuvo un valor sobrestimado de I.G. Este tipo de problemas también los han encontrado Webber y Giese (1969), quienes, trabajando con Haliotis cracherodii, postulan que es un poco inadecuado utilizar el índice gonadal como medida del estado reproductivo, pues no ofrece información acerca de la cantidad de otros tejidos, aparte de las gametas, y tampoco revela el momento en el cual la gametogénesís se inicia nuevamente después de un desove, y concluyen que la única manera de conocer estos estados reproductivos es mediante estudios histológicos, como ocurrió en nuestro estudio. Puesto que siempre es conveniente no capturar individuos hasta que el grado de desarrollo de madurez sexual sea adeacuado, se recomienda no extraer los que sean menores de 91 mm, pues aún no se ha incorporado el 100% de los reproductores. 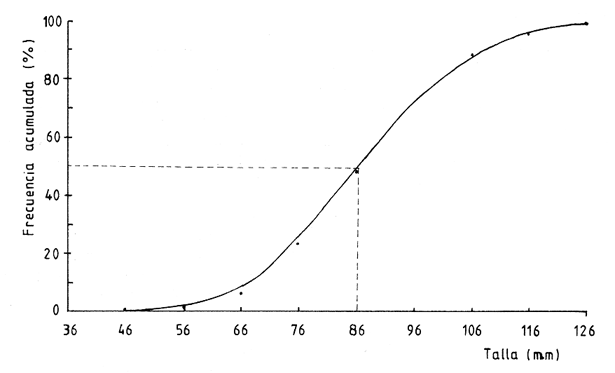 Figura 17.Curva de organismos reproductores (adultos maduros, Estadio III, machos y hembras) de Astraea undosa. La línea al 50% indica la talla crítica de madurez. Bahía Tortugas, B.C.S. La talla está referida al punto medio del intervalo de clase. Conclusiones1.Astraea undosa es una especie dioica cuya gónada, en las hembras, es de color verde musgo, en tanto que la de los machos presenta una coloración crema. 2. La imagen histológica de la gónada y sus productos sexuales es semejante a la que diversos autores encontraron en varias especies de abulón (Haliotis spp). 3. A partir de los 43 y 50 mm de longitud, hembras y machos, respectivamente, mostraron los primeros signos de madurez sexual. La madurez total ocurrió en las hembras desde los 58 mm, en tanto que en los machos se presentó desde los 63 mm. 4. Poblacionalmente hablando, los machos se incorporan más pronto que las hembras al grupo reproductor. 5. Astraea undosa de Bahía Tortugas se comporta fundamentalmente como desovador parcial; sin embargo, también ocurrieron los otros tres procesos de desove: total, incompleto y nulo. 6. La actividad gametogénica ocurre como un proceso continuo que en la mayoría de los casos está limitado a la parte periférica de la gónada. 7. Aunque Astraea undosa muestra actividad reproductiva durante todo el año, los mayores pulsos de desove se observan en primavera y otoño. 8. El tipo de desove parece estar determinado por la profundidad; en particular, el desove total ocurre preferentemente a los 18 metros. 9. Los valores de índice gonádico determinados en esta especie tienen relación escasa con la evidencia histológica, por lo que este índice es poco conflable, tanto de la actividad reproductiva como de las épocas de desove. 10. En términos de aprovechamiento de este recurso, los resultados determinan, preliminarmente, que la talla mínima aconsejable de captura es de 96 mm. AgradecimientosEl presente trabajo forma parte de los proyectos de investigación "Ecología de Comunidades Bentónicas del Pacífico de Baja California" e "investigaciones Biológico-Pesqueras de Recursos Bentónicos de Baja California", financiados por el Consejo Nacional de Ciencia y Tecnología y la Dirección de Graduados e Investigación del Instituto Politécnico nacional, bajo los convenios CONACYT-PCECBNA-021110 y 85116- DGI-IPN, respectivamente. Se desarrolló en el Laboratorio de Ecología de la Escuela Nacional de Ciencias Biológicas, con la colaboración del Laboratorio de Citoquímica de la propia escuela. Los resultados de este estudio se presentaron en la IV Reunión Nacional de Malacología y Conquiliología, en la ciudad de La Paz, B.C.S., gracias al apoyo económico recibido de la Comisión de Operación y Fomento de Actividades Académicas (COFAA), del IPN, y del Consejo del Sistema Nacional de Educación Tecnológica (COSNET). Los autores queremos expresar nuestro agradecimiento a la Secretaría de Pesca, que mediante sus Centros Regionales de Investigación Pesquera y Acuacultura en Bahía Tortugas nos brindó todo género de facilidades para la realización del trabajo de campo. Especial mención merece la Sociedad Cooperativa Bahía Tortugas, S.C.L., por el apoyo desinteresado ofrecido por sus directivos durante todo el desarrollo del proyecto. No queremos pasar por alto a quienes de una u otra manera colaboraron con nosotros, principalmente a Luis Bazúa, Jerónimo Espinosa, José Turrubiates, Armando Piñuelas (El Cache), Jesús García, Ramón Ayala, Bernardo Gómez, Agustín del Valle, Ramón Quezada y Oscar Alvarez Patrón (El Bacoco); a nuestros alumnos de la carrera (hoy biólogos): Job Alcántara, Raúl Mateos, Mario Rojas, Arturo Flores, Carlos Zamora, Alejandro Marmolejo, Antonio Estrada y Luis Guzmán, quienes con gran entusiasmo participaron en los arduos trabajos de muestreo subacuático. Finalmente, a los habitantes de Bahía Tortugas, por su hospitalidad. LITERATURACUPUL-MAGAÑA, F. G. Y G. TORRES-MOYE, 1ra. Reunión de Resultados de Actividades Oceanográficas a Nivel Nacional. CIIO. Edad y crecimiento del caracol comestible Astraea undosa (Wood, 1828) en Bahía de Todos Santos, B.C. México. 1989. FLORES, C. y R. CÁCERES, Bol. Inst. Oceanogr. Cumaná, El género Astraea Rocamez 1978, en las aguas costeras de Venezuela. 1980. 59-72. 19 (1-2): GIORGI, A. E. and J. D. DEMARTINI, Calif. Fish and Game, A study of the reproductive biology of the red abalone, Haliotis rufescens Swainson, near Mendocino, California. 1977. 80-94. 63 (2): GUZMÁN DEL PRÓO, S.A. En Proceedings of the Workshop Australia-México on Marine Sciences Problemas y Perspectivas de las Investigaciones Pesqueras sobre Abulones de México. (Editado por E. A. Chávez). 1989 México. 197-310. JUBERG, P., Malacology, The shell structure of Astraea olfersi (Gastropoda: Turbinidae). 1970. 415-421. 10 (2): MARTIN, G. G., K. ROMERO and C. MILLER-WALKER, Zoomorpholog. Fine structure of the ovary in the red abalone Haliotis rufescens (Mollusca: Gastropoda). 1983. 89-102. 103. MCLEAN, J. H., New Eastern Pacífic subgenera of Turbo Linnaeus, 1758 and Astraea Roding, 1798. Veliger, 1970. 71-72. 13 (1): PRINCE, J. D., T. L. SELLER, W. B. FORD and S. R. TALBOT, Experimental evidence for limited dispersal, of haliotid larvae (genus Haliotis; Mollusca: Gastropoda). J. Exp. Mar. Biol. Ecol, 1987. 243-263. 106: SCHMITT, R. J., J. Exp. Mar. Biol. Ecol., Contrasting anti predator defense of sympatric marine gastropods family Thochidae. 1981. 251-264 54 (3): SEVILLA, M. L., Revista de la Sociedad Mexicana de Historia Natural Desarrollo gonádico del abulón azul Haliotis fulgens (Philippi). 1971. 129-139. XXXII: SILVA-LOERA, A. y L. GUERRERO-MARTÍNEZ, En el IV Congreso nacional de Acuicultura. Desarrollo embriológico y larval del caracol marino Astraea undosa (Wood 1828, Mollusca: Gastropoda) en el laboratorio. Centro de investigaciones Científicas y Tecnológicas de la Universidad de Sonora. Hermosillo, Sonora, México. 1990. TUTSCHULTE, T. H. and J. H. CONNELL, Reproductive biology of three species of abalone (Haliotis) in Southem California. Veliger, 1981. 195-206. 23 (3): VOVELLE, J., Malacología, Transfer du calcium a traverse l'epithelium du reply operculaire chez Astraea rugosa L. (Turbinidae). 1973. 47-51. 14. YOOL, A. J., S. M. GRAU, M. G. HADFIELD, R. A. JENSEN, D. A. MARKELL and D. E. MORSE, Biol. Bull, Excess potassium induces larval metamorphosis in four marine invertebrate species. 1986. 255-266. 170 (2): YOUNG, J. S. and J. D. DEMARTINI, The reproductive cycle, gonadal histology, and gametogenesis of the red abalone, Haliotis rufescens (Swainson). Calif. Fish and Game, 1970. 298-309. 56 (4):
|

