|
HALLAZGO DE Gnathostoma binucleatum n. sp. (NEMATODA:
SPIRURIDA) EN FELINOS SILVESTRES Y EL PAPEL DE PECES DULCEACUÍCOLAS Y
OLIGOHALINOS COMO VECTORES DE LA GNATOSTOMIASIS HUMANA EN LA CUENCA BAJA DEL
RÍO PAPALOAPAN, OAXACA-VERACRUZ, MÉXICO
Trabajo recibido el
21 de agosto de 1991 y aceptado para su publicación el 13 de diciembre
de 1991.
Roberto Javier Almeyda-Artigas
Laboratorio de Sanidad Acuícola, Departamento
de El Hombre y su Ambiente, Universidad Autónoma
Metropolitana-Xochimilco, Calzada del Hueso 1100, Col. Villa Quietud, 04960,
México, D. F.
En el presente trabajo se describe una nueva especie
de Gnathostoma Owen, 1836 (Nematoda: Spirurida), de la que
ya se conocía su tercer estadio larvario. Utiliza como hospederos a
ocelotes, gatos ferales y peces cíclidos de agua dulce de la presa
"Presidente Miguel Alemán", Temascal Oaxaca, y a un pez oligohalino del
Río Papaloapan, Veracruz. Las diferentes prevalencias se deben a la
categoría ictiotrófica que ocupan en la trama; las más
bajas, encontradas en Oreochromis spp., al fenómeno
de la transfaunación. Es la cuarta especie confirmada como agente causal
de la gnatostomiasis humana, común en pobladores de la cuenca baja,
descubierta en México hace 26 años. El hombre adquiere la
infección por el consumo de la carne cruda de dichos peces, en especial
Oreochromis spp. (tilapias), en
cebiche, hábito muy arraigado en la región. La
presencia de dos núcleos en más del 30% de células
intestinales larvarias le da nombre a esta nueva especie tropical
americana.
A new species of Gnathostoma Owen,
1836 (Nematoda: Spirurida) is described, of whích its third-stage larva
was already studied. Ocelots, feral cats, and fresh-water cichlid fishes froni
the "Presidente Miguel Alemán" dam, Temascal, Oaxaca, and one
oligohaline fish common in the Papaloapan river, Veracruz, serve as hosts.
Differences in prevalences are due to its ecosystein food web ichthyotrophic
level; the lowest ones, yielded for Oreochromis spp., to the
transfaunation phenomenon. It is the fourth confirmed species as the causal
agent of human gnathostomiasis, common in lower Papaloapan river basin
inhabitants, discovered in Mexico 26 years ago. Raw fish flesh consumption,
mostly of Oreochromis spp. (tilapias) as
cebiche, produces man infection due to the fixed habit in
the arca. The presence of two nuclei in more than 30% of the larval intestinal
cells gives name to this new American tropical species.
El género Gnathostoma, erigido por Owen, tiene como especie-tipo a G. spinigerum Owen, 1836. Este nemátodo espirúrido fue descubierto en el estómago de un tigre de Bengala muerto en el zoológico de Londres. A partir de entonces, se han descrito 22 especies en varios taxa de mamíferos de diversos países del mundo, de las cuales el autor considera únicamente a diez como válidas. De éstas, cuatro son endémicas del continente americano, en las que su fase adulta es de alta especificidad hospedatoria: G. miyazakii Anderson, 1964, localizada en tejido fibroso renal de Lutra c. canadensis, en Canadá; G.procyonis Chandler, 1942, en tumores gástricos de Procyon lotor, en el sureste de EE. UU. de A.; G. turgidum Stossich, 1902, redescrita por Travassos (1925), en nódulos estomacales de Didelphis spp., del sur de EE.UU. de A. y de Sudamérica y de Philander laniger pallidus de Centroamérica (= G. didelphis Chandler, 1932), y G. americanum Travassos, 1925, en el mismo órgano, en Felis tigrina de Sudamérica. Gnathostoma spinigerum ha sido citada en este continente como parásito de mamíferos (tlacuaches, mapaches, ocelotes y visones); sin embargo, debido a que las diagnosis de los gusanos son tan parcas o a que algunos especímenes se encuentran en tan mal estado, la presencia de esta especie en América ha sido puesta seriamente en duda (Kirkpatrick et al., 1987). Así, por ejemplo, la comparación de especímenes aislados por Babero y Shepperson (1959) de Procyon lotor de Georgia, EE.UU. de A., con ejemplares de G. spinigenum de Japón, reveló características idénticas a las de G. procyonis (Ash, 1962b), mientras que los gnatostómidos extraídos de tlacuaches de Georgia y Louisiana por Flores-Barroeta et al. (1961), podrían corresponder a G. turgidum, ya que los caracteres que invocan para sinonimizarlos con la especie asiática de ninguna manera apoyan dicha conclusión. En vista de tales consideraciónes, no existe evidencia aceptable que demuestre su existencia en América. A pesar de lo anterior, Ollague et al. (1988a y 1988b) concluyeron que la especie responsable de infestaciones naturales de peces dulceacuícolas nativos de Ecuador con larvas de tercer estadio avanzado (larvas III) era G. spinigerum, mediante la infestación experimental de un gato doméstico con 12 de éstas y la confirmación específica de adultos obtenidos de un tumor estomacal. A la fecha, existen sólo cuatro hallazgos documentados de este género en México (en peces de agua dulce y en mamíferos no homínidos). El primero fue realizado por Caballero y Caballero (1958), al colectar tres ejemplares del estómago de un tlacuache (Didelphis marsupialis tabascensis) de Chiapas, e identificarlos como G. spinigerum. Sin embargo, tanto la descripción como las figuras que la ilustran se apartan de modo tan notable de los caracteres consignados por Miyazaki (1960) para esta especie, que podrían atribuirse a al guna de las ya descritas de marsupiales americanos (G. turgidum o G. didelphis), puesto que los hospederos definitivos de G. spinigerum son perros, gatos domésticos y felinos silvestres (Peláez y Pérez-Reyes, 1970). Los tres restantes pertenecen a la presa "Presidente Miguel Alemán" y a Temascal, Oaxaca. Acevedo-Hernández et al. (1988) observaron huevos con un tapón polar en heces frescas de perros (identificados como de Gnathostoma sp.) y de cerdos (quizás de G. hispidum). Por su parte, Martínez-Cruz et al. (1989) y Lamothe-Argumedo et al. (1989) menciónaron y describieron, respectivamente, una larva III aislada de peces cíclidos alóctonos y autóctonos, que se aprovechan en el embalse; en cuanto a sus características morfológicas, la gran mayoría concordaron con las de la larva III de G. spinigerum, aunque las diferencias que los segundos autores encontraron indican que puede tratarse de una especie diferente, endémica de México. Durante más de cinco lustros, hasta 1986, en Japón, Tailandia, China, Islas Filipinas, Vietnam, Israel y Australia, médicamente se consideró a G. spinigerum la especie más importante del género Gnathostoma debido a la creencia de que era la única capaz de invadir al hombre (Miyazaki, 1960). En 1889, Levinsen (fide Peláez y Pérez-Reyes, 1970) describió el primer caso de gnatostomiasis humana al estudiar una hembra extraída de una mujer tailandesa; en la publicación apareció como Cheiracanihus siamensis n. sp. Tiempo después esta designación devino en sinonimia, al comprobarse que 53 años antes Owen ya había denominado a la especie. Después de éste, se han citado muchos más de este importante padecimiento, en su mayoría del sureste de Asia. Sin embargo, las áreas de mayor incidencia son Tailandia (Daengsvang, 1981) y Japón (Miyazaki, 1960 y 1966). En el pasado, la gran mayoría de los casos humanos en Japón se habían atribuido sólo a una de las tres especies nativas, G. spinigerum, por ingestión de carne cruda de una especie de pez - Ophiocephalus argus - muy apreciada preparada en sashimi (Miyazaki, 1960). Sin embargo, a partir de 1976 se presentó un aumento considerable de casos, presumiblemente por ingestión de otra especie íctica, Misgurnus anguillicaudatus, importada del sureste de Asia, en la que no se detectaron larvas III de G. spinigerum (Akahane et al., 1986). Aunque estos autores estimaron que la mayor parte habían sido causados por G. hispidum, no la pudieron identificar con certeza, por la dificultad para hallar a las larvas en biopsias cutáneas. Sin embargo, de las otras dos especies japonesas, G. doloresi (Ogata et al., 1988; Nawa et al., 1989) y G. nipponicum (Ando et al., 1988 y 1990), si ha sido posible confirmar los primeros casos de gnatostomiasis humana, con fundamento en los caracteres morfológicos de los ganchos del bulbo cefálico y en la distribución de los núcleos de las células epiteliales intestinales de larvas III. Con estas mismas bases, es casi seguro que en Japón se confirme muy pronto el primer caso de gnatostomiasis humana provocado por G. hispidum, por la comparación entre los cortes histológicos de larvas obtenidas de pacientes con los de larvas III extraídas de M. anguillicaudatus, importadas de China (Akahane y Mako, 1987). Peláez y Pérez-Reyes (1970) registraron las primeras dos infestaciones en el continente americano, contraídas en México entre 1965 y 1967. Los pacientes, de 25 y 27 años de edad, eran del sexo másculino. El primero, habitante de la ciudad de México, era portador de una larva III alojada en la pared abdominal; el segundo, residente en varios estados, ingirió pescado preparado en cebiche en Guanajuato un mes antes de que se iniciaran los síntomas. De la cámara anterior de su ojo izquierdo se extrajo otra larva III. Con base en la observación de cortes histológicos, en su descripción y medidas, estos autores concluyeron que "... pudiera corresponder a la especie Gnathostoma spinigerum, ya que es bien diferente en sus características de la larva de tercer estadio de G. procyonis, aunque cabe la posibilidad de que pertenezca a alguna otra de las descritas de América o quizás a una nueva forma..." Doce años después, Hernández-Ortiz et al. (1982) publicaron el segundo caso antes mencionado como el primero de gnatostomiasis ocular en México; aseveraron que se trataba de la larva III de G. spinigerum. Desde 1975 se empezó a observar en ciudades de la parte baja de la cuenca del Río Papaloapan (principalmente en Temascal, Oaxaca y Tierra Blanca, Veracruz), un incremento de enfermos con edemas migratorios, característicos de la gnatostomiasis humana (Martínez-Cruz et al., 1989). Ésta se relacionó con la ingestión de carne cruda de peces ciclidos alóctonos (tilapias) de la presa "Presidente Miguel Alemán", preparada en cebiche, y se suponía que era causada por larvas III. Los autores concluyeron que " ... la especie implicada, aunque aún no identificada con absoluta seguridad, debe ser muy cercana a G. spinigerum..." Aunque el tercer hallazgo en el continente americano data de 1980, en Ecuador, sólo 8 años después Ollague et al. (1988a) aparentemente confirmaron por vez primera que la presencia de la paniculitis eosinofílica migratoría nodular en ese país (y al parecer también en América), se debía a G. spinigerum, al concluir que era el agente causal de las infestaciones. Debido a la deficiencia con la que presentaron el examen taxonómico, el autor duda de la autenticidad de dicha identificación. Con base en lo expuesto en párrafos anteriores, el presente estudio tiene como objetivos: a) describir a la fase adulta del agente causal de la gnatostomiasis humana en la parte baja de la cuenca del Río Papaloapan; b) contribuir al conocimiento de su ciclo de vida y de sus hospederos intermediarios y definitivos; c) determinar su distribución en México y en el continente americano; d) investigar las posibles vías de infestación hacia la especie humana, y e) proponer acciónes profilácticas que eviten el contagio por larvas III, ya que el padecimiento podría constituir un problema de salud pública mayor al valorado en la actualidad. MATERIAL Y MÉTODOS
INVESTIGACIÓN DE Gnathostoma binucleatum n. sp.
EN EL CAMPO
Entre marzo de 1989 y junio de 1991, en el transcurso de 14 visitas efectuadas a la presa "Presidente Miguel Alemán" y en las inmediaciónes del poblado de Temascal (norte del estado de Oaxaca), que comprendieron 9 estaciones, se adquirieron más de 1,300 peces producto de la captura comercial realizada en el embalse, pertenecientes a seis especies de la Familia Cichlidae. Las primeras tres eran alóctonas, de la Tribu Tilapiini: Oreochromis aureus , O. mossambicus y O. niloticus (mojarras tilapia); una nativa: Cichlasoma fenestratum (mojarra de morro colorado) y dos autóctonas transplantadas: C. urophthalmus (castarrica) y Petenia splendida (tenguayaca). Así mismo, en junio de 1991, se revisaron cuatro peces de la Familia Gobiidae, especie Gobiomorus dormitor (guavino), capturados en el Río Papaloapan, en la periferia de Cosamaloapan, Veracruz. Después de registrar datos merísticos y sexo, se obtuvieron filetes de su musculatura; tanto éstos como los esqueletos se revisaron a contraluz, bajo presión ligera, entre dos vidrios gruesos, con un foco de 100 vatios. Para su división en seis secciónes, se siguió el esquema presentado por Miyazakí (1966). Una vez anotada la región del pez en la que se localizaban, las larvas III se colocaron en solución Ringer. De la misma área que la que contenía peces infestados, se disectaron y examinaron hígados y estómagos de 31 mamíferos del Orden Carnivora: nueve gatos domésticos (Felis catus), nueve gatos ferales - no domesticados, montaraces o alzados - (F. catus), cuatro cachorros de ocelote (Felis p. pardalis), siete mapaches (Procyon lotor hernandezi) y dos perros (Canis familiaris), en busca de la fase adulta. Además, se revisaron las heces recién eliminadas de once perros y siete cerdos (Sus scrofa domestica por la técnica de flotación con salmuera. Tanto las larvas III como los adultos hallados se fijaron en alcohol etílico caliente, al 70%. Para su estudio morfométrico, se transparentaron con lactofenol de Amman. Las medidas, obtenidas con un ocular micrométrico, se dan en milímetros; se señalan el mínimo, el máximo y, entre paréntesis, el promedio. Por último, se aplicaron más de 100 cuestionarios epidemiológicos entre los habitantes de Temascal y de San Pedro lxcatlán - poblados enclavados en la ribera del embalse -, y de algunos aledaños a Cosamaloapan, Veracruz, con la finalidad de detectar casos probables del padecimiento mencionado por Martínez-Cruz et al. (1989) para la zona y de establecer su relación con la ingestión de cíclidos no tratados térmicamente. INFESTACIÓN EXPERIMENTAL DE GATOS DOMÉSTICOSEn abril de 1989 y 1990 y febrero de 1991, mediante una sonda de poliuretano y con 7, 16, 12 y 20 larvas III, se infestaron respectivamente cuatro gatos domésticos de 45 días de edad, adquiridos por donación. Las larvas se obtuvieron de 60 tenguayacas (Petenia splendida) parasitadas provenientes de la presa "Presidente Miguel Alemán", cuya morfología era indistinguible de las descritas por Lamothe-Argumedo et al., (1989). Se mantuvieron en un bioterio a base de alimento balanceado y leche. Se estudiaron sus heces a intervalos regulares, por la técnica de flotación con salmuera. Se disectaron a los 275, 133, 99 y 48 días postinfestación, respectivamente. OBTENCIÓN DE CORTES TRANSVERSALES DEL INTESTINO DE LARVAS DE TERCER ESTADIO AVANZADOLas larvas III a ser incluidas en parafina, se obtuvieron de la musculatura de tenguayacas parasitadas de manera natural en el embalse (idénticas en cuanto a morfología se refiere a las estudiadas por Lamothe-Argumedo et al., 1989) y, por extracción quirúrgica, de un edema abdominal detectado en un paciente másculino de San Pedro Ixcatlán (al suroeste de Temascal), con antecedentes de ingerencia, durante los 13 años previos, de carne de tilapia preparada en cebiche. Una vez fijadas con formol al 10%, se procesaron conforme a la técnica descrita por Akahane et al., (1986). Los cortes transversales resultantes se examinaron con el objetivo seco fuerte (43x) de un microscopio de contraste de fases. RESULTADOS Y DISCUSIÓN
INVESTIGACIÓN DE Gnathostoma binucleatum n. sp.
EN EL CAMPO
PECESComo se observa en la tabla 1, el tercer estadio larvario de G. binucleatum es de baja especificidad hospedatoria; coloniza a peces: alóctonos y autóctonos; de ambientes dulceacuícolas y oligohalinos; litorales y pelágico bentónicos, así como micrófagos y macrófagos. Sin embargo, con base en las prevalencias, se pueden separar con bastante claridad dos grupos de especies. Mientras que de 300 mojarras tilapia revisadas sólo cinco (1.67% del total) se encontraron infestadas, de 1,021 cíclidos autóctonos y góbidos examinados, 291 (29.5 %) contenían larvas. En general, los valores obtenidos son muy semejantes a los mostrados por Lamothe-Argumedo et al. (1989), relativos a la mayoría de las especies de la misma localidad. Esta variación en los parámetros y la baja especificidad penden, entre otros, de dos factores profundamente ligados entre sí: su posición espacial dentro del ecosistema (Holloway y Leno, 1983), y sus hábitos alimentarios; es decir, de la categoría ictiotrófica que ocupan en la trama de sustento. La tenguayaca, debido a su alto grado de creofagia (carnivoría) (Reséndez-Medina y Salvadores, 1983), en contraposición a la planctofagia preferencial de las tilapias (Arredondo-Figueroa y Tejeda-Salinas, 1989), acumula larvas III, principalmente en su etapa juvenil, en la que es más voraz, ya que en estado adulto consume en mayor grado restos vegetales. El hallazgo de larvas en ejemplares de 40 mm y el hecho de haberse registrado una intensidad máxima de, seis larvas en peces adultos apoyan esta suposición. 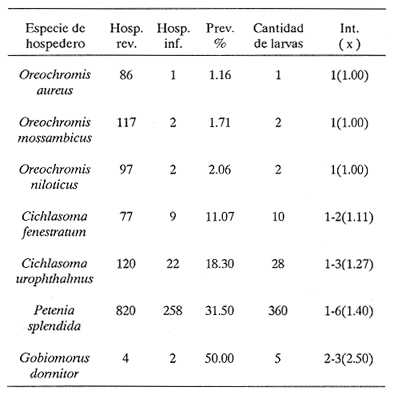 TABLA 1 Parámetros de la infección por la larva III de Gnathostoma binucleatum n. sp. en seis peces cíclidos dulceacuícolas y un góbido oligohalino, en la parte baja de la cuenca del Río Papaloapan Dentro del ecosistema particular de este embalse se considera a la tenguayaca un consumidor de tercer orden y a las tilapias de primero, en los extremos de la trama ictiotrófica. Con base en las prevalencias, a la castarrica se le podría ubicar como de segundo y a la mojarra de morro colorado de primero; sus hábitos alimentarios (carnívoros y omnívoros, respectivamente) confirman dicha suposición. En cuanto al guavino, la baja cantidad de ejemplares revisados no permite elaborar conjeturas sólidas. Sin embargo, mientras que según Zaret y Paine (1973) esta especie se desarrolla como de segundo orden en un ambiente dulceacuícola de Panamá, De la Cruz-Agüero y Franco-López (1981) la consideran de tercero en la Laguna de Sontecomapan, Veracruz. Así, los valores que se obtendrían del análisis de mayor cantidad de individuos podrían definir mejor la categoría ictiotrófica que guarda dentro de la cuenca hidrológica del Río Papaloapan. Otros dos factores que podrían explicar las diferencias menciónadas en lo general y los valores tan bajos y constantes en el caso de las tilapias en lo particular, se refieren: a) al fenómeno de la transfaunación (Hoffman, 1970), proceso paulatino del gnatostómido hacia las especies alóctonas por medio de los peces autóctonos, cuyas consecuencias se deben evaluar a largo plazo, y b) al período tan corto que tiene de establecido el ciclo de vida de G. binucleatum en el embalse -menos de 40 años. En la tabla 2 se observan los valores determinados para la tenguayaca, estación por estación; a primera vista resaltan: a) la prevalencia promedio, muy superior a la menciónada por Lamothe-Argumedo et al. (1989) (21.9%), quizás debido a la cantidad menor de peces revisados (73); b) su homogeneidad a lo largo de los 28 meses estudiados, y c) la máxima -46.7%- entre enero y marzo de 1990. Las larvas se alojan en la musculatura de sus hospederos, por lo general enroscadas y sin enquistarse, salvo en escasas ocasiónes. Las de G. spinigerum, por el contrario, una vez enrolladas, casi siempre lo hacen en una membrana fibrosa cuyo diámetro no excede a 2 mm. Esto se observa no sólo en peces, sino en todos los segundos hospederos intermediarios y paraténicos que intervienen en su ciclo vital (Prominas y Daengsvang, 1937; Miyazaki y Umetani, 1951; Miyazaki, 1954,1960 y 1966; Daengsvang, 1981). De las 360 larvas extraídas de 820 tenguayacas (Tabla 2), el 81.4% se encontraba en los músculos epiaxiales, principalmente de los dos tercios anteriores (63.6%). Esta distribución difiere sensiblemente de la exhibida por la larva del mismo estadio de G. spitugerum en Ophiocephalus argus (Miyazaki, 1966): mientras que el 23% (304) de las larvas se aisló de los dos tercios anteriores epiaxiales, el 56% (734) se extrajo del primer tercio y el 20% (265) del segundo tercio anterior de los paquetes hipoaxiales, de un total de 1,315 peces japoneses muestreados. MAMÍFEROSDe los 49 mamíferos examinados, sólo dos de los nueve gatos ferales (22.2 %) y uno de los cuatro cachorros de ocelote (25%) resultaron infestados con la fase adulta de Gnathostoma binucleatum. La mitad anterior de los gusanos se encontraba emplazada en las capas submucosa y muscularis, en el interior de nódulos únicos crateriformes de paredes gruesas, rojizas, cuyo diámetro no excedía de 30 mm, proyectados estos últimos sobre la pared de la curvatura mayor del estómago. De igual manera ocurre con los ejemplares maduros de G. spinigerum en tumores gástricos característicos, extirpados de gatos domésticos y ferales (Trueman y Ferris, 1977; Beveridge et al., 1978; Ramachandran et al., 1985; Kirkpatrick et al., 1987). En la superficie de los tres hígados se observaron cicatrices y pequeñas áreas necrosadas, probables indicios del paso de la fase migratoria hacia el estómago, como en el caso del bazo de mapaches infestados experimentalmente con G. procyonis (Ash, 1962b). Estos nódulos no estaban perforados externamente por la capa serosa del estómago; internamente, un poro los comunicaba con su lumen, cuyo diámetro era aproximadamente de 3 mm. Al disectarlos, se puso de manifiesto su naturaleza fibrosa; en su interior existían un fluido teñido de sangre, huevos fecundados (en el caso del cachorro de ocelote) y 18 gusanos: tres hembras en uno de los dos gatos ferales, tres machos y dos hembras en el otro, así como seis machos y cuatro hembras en el cachorro de ocelote. POBLACIÓN HUMANACon base en la información recabada en los cuestionarios epidemiológicos, resaltan algunos hechos importantes, dignos de ser mencionados. La mayoría de los casos sospechosos fueron confirmados por el médico de la localidad o de las ciudades de Cosamaloapan y Veracruz, debido a la aparición de varios síntomas, entre los que destacó el edema inflamatorio migratorio fugaz y recídivante característico. Los enfermos confesaron ser aficiónados al cebiche; aunque en su preparación se emplean mayormente tilapias, algunos pobladores de Poza Honda y Tilapa (circunvecinos a Cosamaloapan) señalaron que el guavino así consumido constituye un vector considerable de la larva. Sin embargo, los cerca de 200 casos (con toda seguridad mucho más algunos años después) diagnosticados por Martínez-Cruz et al. (1989) en la cuenca del Papaloapan no concuerdan con las prevalencias tan bajas obtenidas en estos cíclidos (Tabla 1). Es probable que en dicho platillo se mezcle la carne de otras especies, en especial de la tenguayaca (Lamothe-Argumedo et al., 1989) y del guavino, lo que aumentaría la probabilidad de infección (Tablas 1 y 2). INFESTACIÓN EXPERIMENTAL DE GATOS DOMÉSTICOSDe los cuatro gatos examinados, en dos se aislaron gusanos adultos inmaduros; todos los exámenes periódicos de heces resultaron negativos. En el felino no. 1, sacrificado 275 días después de la infestación, se encontró una cicatriz en el estómago, indicio probable de una supuesta estancia prevía de helmintos. El gato no. 2 mostró los síntomas siguientes: anofagia, vómito, diarrea intermitente y dolor abdominal, semejantes a los exhibidos por un gato doméstico australiano infestado con G. spinigerum (Trueman y Ferris, 1977). Sin embargo, la necropsia reveló sólo un tumor, idéntico a los observados en los hospederos naturales, con varias cavernas en su interior. En una zona cercana a la curvatura mayor del estómago del félido no. 3 se halló un nódulo como los ya descritos; en su interior había tres hembras, con la mitad anterior situada en el tejido. Una vez extraídas, se observaron en la zona fibrosa las tres cavernas. Del hígado del gato no. 4 se aisló un espécimen juvenil. Ash (1962b) también mencióna una transición obligatoria para esta etapa de G. spinigerum. 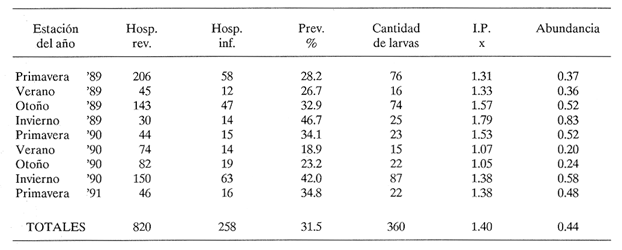 TABLA 2 Parámetros de la infección por la larva III de Gnathostoma binucleatum en Petenia splendida en las 9 estaciones bajo estudio De lo anterior se deduce que, a pesar de existir esta estancia hepática temporal, la permanencia de G. binucleatum en tumores gástricos de gatos domésticos es prematura, no así en felinos silvestres. Prommas y Daengsvang (1937) observaron huevos en heces de gatos domésticos infestados con larvas III de G. spinigerum, 223 y 198 días después de la infección, y gusanos maduros a 39 y 66 días de la primera aparición de huevos, respectivamente. Así mismo, Ollague et al., (1988b) detectaron huevos de la misma especie 8 meses después de la infestación experimental de un gato doméstico. Estos hechos apoyan las suposiciónes anteriores. DESCRIPCIÓN DE Gnathostoma binucleatum n. sp. (Figs. 1 - 4 y Tablas 3 - 6)Está basada en diez especímenes: un macho holotipo, una hembra alotipo y tres hembras y cinco machos paratipos del estómago de un ocelote (Felis p. pardalis). Las tres hembras experimentales extraídas del gato no. 3 presentan caracteres idénticos a los señalados a continuación. GENERALSpirurida, Gnathostomatidae, Gnathostomatinae, Gnathostoma Owen, 1836. Gusanos pequeños; los machos miden de 20.95 a 25.23 (22.78) de longitud y de 1.06 a 1.38 (1.23) de anchura máxima, mientras que la longitud de las hembras varía de 14.95 a 22.38 (19.48) y su anchura máxima de 0.94 a 1.40 (1.20) (Fig. 1). Coloración parda rojiza in vivo, debida a la intensidad del fluido celómico y del intestino. El bulbo cefálico presenta una longitud de 0.31 a 0.43 (0.36) y un ancho de 0.60 a 0.77 (0.70) está armado con ocho a diez (nueve) hileras de ganchos simples, dirigidos hacia la extremidad posterior. Cuerpo separado del bulbo por medio de un cuello angosto. Papila cervical localizada entre las hileras 16 y 19 (17). Esófago corto, dividido en una región anterior muscular y otra posterior glandular. Sacos cervicales muy cortos, que llegan a la región media del esófago. Superficie corporal cubierta en su totalidad con numerosas espinas cuticulares dispuestas en hileras transversales. Forma, tamaño, densidad y arreglo espacial varían de acuerdo con su posición en el cuerpo (Fig. 2). Las espinas de las hileras uno a cinco son anchas y cortas, con base redondeada, en forma de escama, la mayoría armadas con dos dientes de la misma longitud; son raras las de una y tres puntas; miden de 0.0136 a 0.02 de largo. La distancia entre espinas de la misma hilera es ligeramente menor a su longitud (A). En las diez hileras siguientes se aprecian, además, espinas tridentadas; en ocasiónes su diente central es más corto que los laterales; miden alrededor de 0.03 de largo (A). Las espinas de las hileras siguientes, entre las que se encuentran las papilas cervicales, son más largas, miden de 0.037 a 0.039, tienen márgenes lineales y tres dientes; su punta central es más larga (A y B). En la región media del esófago ocurre la transición entre las de tres y dos dientes; uno de los laterales de las primeras es muy pequeño (B). Más adelante, hacia el final del esófago, espinas simples de base redondeada sustituyen a las bidentadas, que alcanzan longitudes máximas de 0.048. A partir del inicio del intestino comienzan a disminuir en tamaño y en densidad (O); de modo gradual se convierten en residuales cerca del extremo posterior (D), en el que están distribuidas de manera muy irregular; miden 0.007 de longitud.  Figura 1. Vista total del macho holotipo (izquierda) y la hembra alotipo de Gnathostoma binucleatum n. sp., extraídos de un tumor gástrico de un ocelote (Felis p. pardalis Linnacus, 1758) de Temascal, Oaxaca; la barra indica 2 mm.  Figura 2. Escamas cuticulares corporales de Gnathostoma binucleatum (macho holotipo); la barra indica 0.050 mm: A) de las primeras hileras posteriores al bulbo cefálico; B) de hileras inmediatas; C) de la región media del esófago; D) del inicio de la mitad posterior del cuerpo. MACHO (Figs. 1 - 3)Longitud: 22.31. Anchura máxima: 1.20 en la región final del esófago. Hileras de ganchos en el bulbo cefálico: nueve; longitud: 0.33; anchura máxima: 0.74. Papila cervical situada en la hilera 19 (Fig. 2A). Longitud del esófago: 3.34. Espinas simples cuticulares muy escasas y casi imperceptibles en la zona inmediatamente anterior a la bursa. Espículas delicadas, desiguales, con ápices romos; la izquierda es mayor, longitud: 1.40; la derecha: 0.31. Cola corta. Extremidad caudal con cuatro pares de grandes papilas laterales pedunculadas, dos pre- y dos post-anales; las dos primeras miden 0. 14 de largo, la tercera 0. 13 y la cuarta 0. 11 (Fig. 3). Cuatro pares de pequeñas papilas ventrales sésiles: un par preanal, otro adanal y dos postanales. Fasmidios presentes. Bursa provista de hileras transversales de pequeñas espinas triangulares dirigidas hacia el extremo anterior, restringidas a su cara ventral (Fig. 3); área en forma de Y alrededor de la abertura cloacal, sin espinas. HEMBRA (Fig. 1).Longitud: 17.1. Anchura máxima: 1.15, en la región ecuatorial. Papila cervical localizada en la hilera 17. Diez hileras de ganchos en el bulbo cefálico, de 0.27 de largueza y 0.70 de anchura. Longitud del esófago: 2.76. Vulva localizada al inicio de la mitad posterior (paratipo). Ano subterminal. La extremidad posterior se adelgaza ligeramente y termina a manera de apéndice digitiforme. Fasmidios presentes. Huevos uterinos fecundados ovales, incoloros, con un óvulo no segmentado grande y central; con un tapón en uno de sus polos; miden de 0.058 a 0.068 (0.064) de largo y de 0.037 a 0.039 (0.038) de ancho (paratipo). La superficie de su delgada cáscara exhibe granulación fina. LARVA DE TERCER ESTADIO AVANZADO (Fig. 4 y Tablas 3, 4 y 6)Se desconocen las fases larvarias de los estadios primero y segundo. Debido a que la larva III ha sido descrita y discutida prolijamente con antelación por Lamothe-Argumedo et al. (1989), aislada de distintas especies de cíclidos de la presa "Presidente Miguel Alemán", se menciónarán sólo ciertos aspectos morfométricos que se consideran sobresalientes. Las larvas estudiadas son ligeramente más largas que las precedentes: miden de 2.6 a 5.9 (4.3). La cantidad de ganchos de las cuatro hileras del bulbo cefálico varía de acuerdo con su posición (Tabla 3). Tanto los promedios de los ganchos por hilera, como la diferencia entre los de la cuarta y la primera son muy cercanos a los enunciados por Lamothe-Argumedo et al. (1989). En pocas ocasiónes se encontró una quinta hilera de ganchos, incompleta. El fluido celómico oscila entre incoloro y rojizo, según la localización de éstas en sus hospederos. 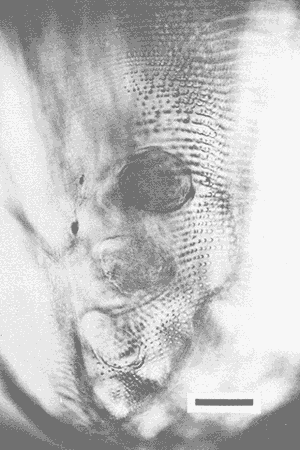 Figura 3. Extremo caudal del macho holotipo de Gnathostoma binucleatum, que muestra la bursa con hileras transversales de espinas triangulares dirigidas hacia el extremo anterior y las cuatro papilas caudales laterales; la barra indica 0.10 mm. Respecto de los cortes transversales practicados, se observa que la pared intestinal de G. binucleatum está compuesta de células por lo general polinucleadas, alargadas y de epitelio columnar simple (Fig. 4). En su región anterior existen entre 17 y 21 (19) por circunferencia, mientras que en el resto de su longitud se hallan entre 22 y 25 (23). La mayoría de éstas (90%) tiene entre uno y cuatro núcleos; nunca contienen más de siete (Tabla 4). Aunque en sus inicios son, en ocasiónes, más abundantes las trinucleadas, en 14 de las 21 circunferencias intestinales examinadas predominan las células binucleadas (Fig. 4A); en promedio, cerca del 33% presenta esta peculiaridad (Tabla 4). Por otro lado, la distribución nuclear exhibida por la larva humana (Fig. 4B) y su morfometría (Tabla 3) son prácticamente idénticas a las de la tenguayaca. En ambas los núcleos miden, en promedio, 0.0035 x 0.0015 mm. Hospedero-tipo: Felis p. pardalis Linnaeus, 1758 (ocelote). Otros hospederos: Felis catus Linnacus, 1758 (natural y experimental) para el adulto; Oreochromis aureus (Steindachrier, 1864), O. mossambicus (Peters, 1852), O. niloticus (Linnaeus, 1757), Cichlasoma fenestratum (Günther, 1860), C. urophthalmus (Günther, 1862), Petenia splendida Günther, 1862 y Gobiomorus dormitor Lacépède,1800 (naturales ), de la larva III. 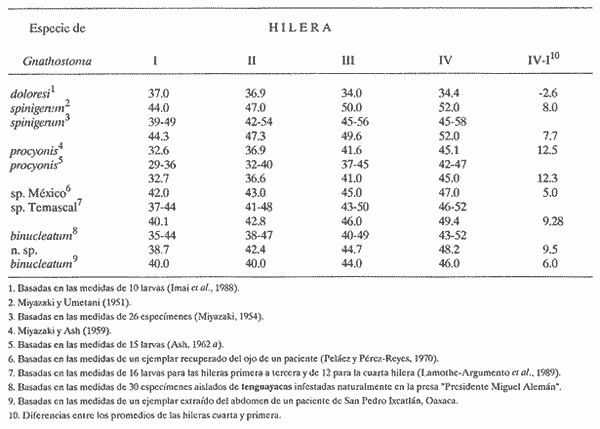 TABLA 3 Cantidad de ganchos en las cuatro hileras del bulbo cefálico y sus promedios en larvas III de cuatro especies de Gnathostoma Localización: En tumores gástricos únicos (adultos), en hígado (juvenil migratorio) y en la musculatura (larvas III). Localidad-tipo: Presa "Presidente Miguel Alemán", Temascal, Oaxaca, México. Otra localidad: Río Papaloapan, Cosamaloapan, Veracruz, México. Especímenes: Depositados en la Colección Helmintológica de la Universidad Autónoma Metropolitana-Xochimilco, con los siguientes números de catálogo. Holotipo (macho): LSAUAMX 010-01; Alotipo (hembra): 010-02; Paratipos (ocho machos y ocho hembras): 010-03. Otros: tres hembras experimentales: 003-I, 01-03; un juvenil experimental del hígado, 003-II-01; larvas III: 004; cortes transversales de la región intestinal de una larva III extraída de un paciente de San Pedro Ixcatlán, Oaxaca: 005,01-02; cortes intestinales de dos larvas III aisladas de la musculatura de Petenia splendida: 006, 01-10 y 007, 01-18. Etimología: El nombre específico se refiere a la dominancia de células binucleadas intestinales de larvas III, carácter que diferencia -junto con otros- a la especie mexicana de uno de los taxa que más se le asemejan (Gnathostoma spinigerum). 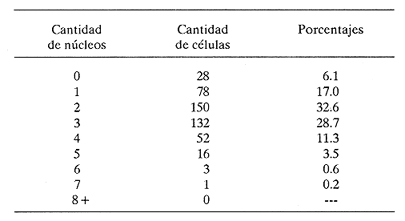 TABLA 4 Distribución de los núcleos en 460 células intestinales en corte transversal, observadas en 21 circunferencias, de una larva III de Gnathostoma binucleatum aislada de la musculatura de una tenguayaca (Petenia splendida) infestada de manera natural DISCUSIÓN TAXONÓMICACon base en la forma, la densidad y el arreglo espacial de las espinas cuticulares corporales, es posible diferenciar fácilmente a Gnathostoma binueleatum n. sp. de cinco de las diez especies válidas del género: G. hispidum Fedchenko, 1872; G. doloresi Tubangui, 1925; G. nipponicum Yamaguti, 1941; G. malaysiae Miyazaki y Dunn, 1965 y G. vietnamicum Le-Van-Hoa, 1965 (Miyazaki, 1960; Scholz y Ditrich, 1990). En la tabla 5 se enuncian los caracteres más importantes, con excepción de la forma y la distribución de las espinas corporales, en las que se han basado otros autores para separar especies (Miyazaki, 1960; Daengsvang, 1981), que permiten distinguir a G. binucleatum de las otras cuatro especies americanas conocidas y de la asiática más importante. La tabla se elaboró a partir de tres descripciónes originales, de la redescripción que de G. turgidum hizo Travassos (1925) y del estudio que, mediante microscopía electrónica de barrido, hicieron Scholz. y Ditrich (1990) de la armadura cuticular de G. spinigerum. Aunque comparten el género del hospedero y el continente, G. binucleatum se distingue con facilidad de G. americanum, ya que en esta última las primeras hileras presentan de cinco a siete dientes; su tamaño aumenta a medida que la cantidad de dientes disminuye gradualmente en sentido antero-posterior y las espinas simples terminan al final del tercer cuarto anterior del cuerpo. En G. spinigerum y G. procyonis las escamas corporales tienen una morfología similar: en las primeras hileras tienen entre tres y cinco dientes; sin embargo, en la segunda especie existen, además, de una a varias denticiónes menores. En filas posteriores, el diente más largo de las escamas tricúspides es el central; en esta región la densidad es máxima en la primera especie y miden 0.040 de longitud; de nueva cuenta, en la segunda especie las escamas están afectadas por una o más denticiónes secundarias, además adoptan forma de hoja de arce. Aunque en ambas especies las espinas continúan hasta el final del cuerpo, en la primera lo hacen a manera de formas no denticuladas, que en sus inicios miden hasta 0.025 de longitud y terminan en diminutas residuales (Daengsvang, 1981; Scholz y Ditrich, 1990) y de endentaduras transversales fusiónadas en la segunda (Chandler, 1942). No obstante las similitudes señaladas en la forma de algunos tipos individuales y su arreglo espacial, tanto la forma general, el tamaño y la densidad de las espinas, principalmente, indican que se trata de especies distintas.  TABLA 5 Características distintivas de la fase adulta de las cinco especies americanas y la asiática más importante, pertenecientes al género Gnathostoma. A pesar de lo anterior, cabe la posibilidad de que los seis gusanos que Waid y Pence (1988) extrajeron de una lesión granulomatosa en el estómago fúndico de un puma (Felis concolor) del suroeste de Texas, identificados como G. procyonis, con base en la descripción de Chandler (1942), pertenezcan a la especie mexicana, la cual parasita igualmente a felinos silvestres (Tabla 5), pues la especificidad hospedatoria de las distintas especies de Gnathostoma en su etapa adulta es muy elevada (Miyazaki, 1960; Daengsvang, 1981). Antes de contar con la descripción de la fase adulta de G. binucleatum, las diagnosis de las larvas III mexicanas, aisladas de dos pacientes con infestación autóctona (Peláez y Pérez-Reyes, 1970) y de peces de Temascal (Lamothe-Argumedo et al., 1989), se asemejaban a tal grado a la de G. spinigerum, que cabía la posibilidad de que se tratara de la misma especie, además de que se creía que era la única capaz de invadir al hombre (Miyazaki, 1960; Lamothe et al., 1989). Sin embargo, los promedios de las cuatro hileras de los ganchos del bulbo cefálico son menores en el taxón mexicano (Tabla 3). Otros caracteres que las distinguen son la ausencia de un quiste verdadero, la preferencia por los paquetes epiaxiales, su estancia prematura en gatos domésticos, la forma y el tamaño de los ganchos del bulbo y el valor obtenido al restarle el promedio de ganchos de la primera hilera al de la cuarta (Tabla 3). Aun prescindiendo de la descripción de la fase adulta de G. binucleatum, la distribución de los núcleos en células intestinales de larvas III en corte transversal constituye un elemento de comparación válido y suficiente para separarla de G. spinigerum. Con base en las Observaciones de Taikechi en 1956 (fide Akahane et al., 1986) del intestino del adulto de G. spinigerum, y de Morita en 1955 (fide Akahane et al., 1986) y de Akahane et al., (1986) para los de la larva III (Tabla 6), es muy probable que la distribución nuclear en el intestino del adulto de G. binucleatum sea idéntica a la mostrada por su tercer estadio larvario (Fig. 4). 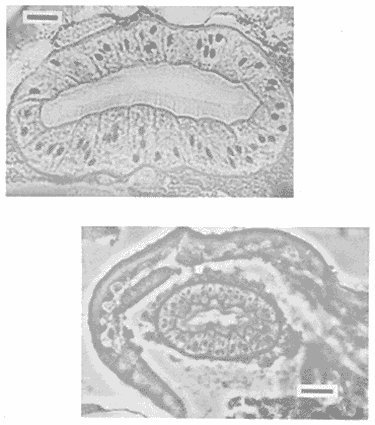 Figura 4. Cortes transversales de la región anterior intestinal de larvas III de Gnathostoma binucleatum, con 19 células por circunferencia: A)Obtenida de la musculatura de una tenguayaca infestada de manera natural; con un núcleo, hay dos células (10.5%); con dos, siete (36.8); con tres, cinco (26.3); con cuatro, cuatro (21.1) y con cinco, uno (5.3); la barra indica 0.010 mm; B) Extraída de un paciente de San Pedro Ixcatlán, Oaxaca: con cero hay una célula (5.3%); con uno, cuatro (21.1); con dos, seis (31.6); con tres, cuatro (21.1); con cuatro, dos (10.5); y con cinco, dos (10.5); la barra indica 0.020 mm. 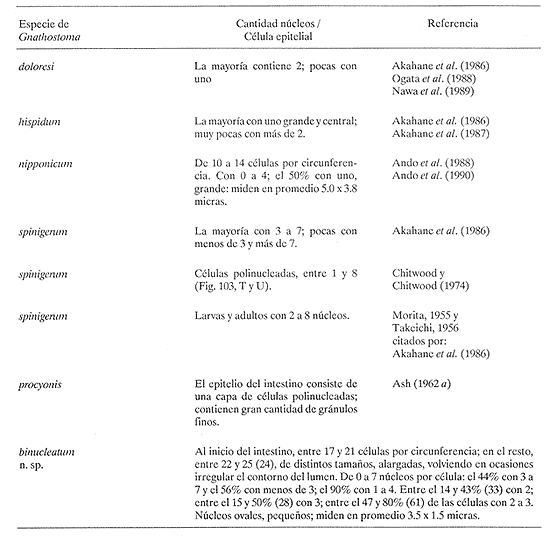 TABLA 6 Comparación de la distribución de núcleos en células intestinales de las seis especies investigadas del género Gnathostoma COMENTARIOSTanto el descubrimiento de la fase adulta de Gnathostoma binucleatum n. sp. como la aseveración de que es el agente causal de la gnatostomiasis humana en la parte baja de la cuenca del Río Papaloapan, partieron del estudio y la manipulación de larvas III, idénticas a las obtenidas por Lamothe-Argumedo et al. (1989) y a las recobradas del guavino. Así, las hembras experimentales aisladas del tumor de un gato doméstico concuerdan en su morfología con la de los gusanos maduros encontrados en los estómagos del ocelote y de los gatos ferales; la distribución de los núcleos de las células intestinales de larvas III obtenidas en tenguayacas, por otro lado, resultó idéntica a la observada en una extraída de un paciente que habita en la ribera del embalse y que consumía cebiche preparado con tilapias provenientes de dicho cuerpo de agua. Debido a que en la actualidad se ha confirmado que otras dos especies, además de G. spinigerum, causan el padecimiento en Asia, no resulta extraño que en América exista por lo menos una responsable. Se considera a G. binucleatum una especie endémica del continente americano, probablemente extendida allende las fronteras de México, con límite septentrional en el sureste de EE.UU. de A., a lo largo del corredor neotropical, por lo menos en la franja atlántica. Es de suponer que aves piscívoras migratorias, como el pelícano (Pelecanus erythrorhynchos), que durante otoño e invierno sobrevuelan la zona, mediante sus desplazamientos contribuyan, de modo significativo, a la propagación de esta especie. La existencia de más de 200 casos de gnatostomiasis humana en habitantes de la cuenca del Papaloapan es un indicio de la aparición de una nueva endemia en México, que pronto puede constituir un problema serio de salud pública. Aunque los estudios se han enfocado a la presa "Presidente Miguel Alemán" y a las inmediaciónes de Temascal, por ser donde se han presentado casos con mayor frecuencia, el padecimiento no se encuentra circunscrito a dicha cuenca, pues el producto pesquero del embalse se distribuye ampliamente en varios estados mexicanos (Chiapas, Distrito Federal, Guanajuato, Guerrero, Hidalgo, Jalisco, Michoacán, Morelos, Nayarit, Oaxaca, Puebla, Sinaloa, Tabasco, Tamaulipas y Veracruz). Además, con el aumento drástico en las posibilidades de infestación, por la mezcla de otras especies de peces en la preparación del cebiche, es probable que los casos se incrementen también en el resto del país. Es innegable que este padecimiento se encuentra en México desde 1965; el hallazgo de los hospederos definitivos hace suponer que la distribución es más amplia de lo que antes se creía. Además, la función futura de los gatos domésticos como nuevos hospederos, una vez que el gnatostómido se adapte totalmente, propiciará la incidencia de más casos en Temascal, pues es frecuente observarlos alimentándose con desechos de pescado del embalse. La presencia de parásitos en dos gatos ferales, su ausencia en nueve gatos domésticos y su estancia prematura en felinos domésticos experimentales confirman que la adaptación parásito-hospedero y la colonización son paulatinas, de felinos silvestres a domésticos, por transición mediante gatos ferales. Para esclarecer el origen del problema, es decir, cómo se instaló la parasitosis en nuestro país, se han postulado varias hipótesis (Martínez-Cruz et al., 1989). Una sostiene que el padecimiento ingresó por la introducción de especies de peces infestadas (autóctonas o alóctonas), provenientes de zonas endémicas. En cuanto al transplante de las primeras a la presa "Presidente Miguel Alemán": en 1963, Micropterus salmoides y Lepomis macrochirus, transportadas de otras regiones del país; en 1968, crías reproducidas en la Estación de Acuicultura Tropical de Temascal de dos mojarras omnívoras (Cichlasoma synspilum y C. pearsei) y de dos carnívoras ( C. urophthalmus y Petenia splendida), para controlar las poblaciones de las tilapias sembradas 3 años antes, procedentes de Emiliano Zapata, Tabasco. De la cuenca del Papaloapan: C. fenestratum, C. meeki, Dorosoma anale y D. petenense, Astyanax fasciatus, Strongylura notata, Ictalurus meridionalis, Rhamdia guatemalensis, Ictiobus meridionalis y Cathorops aguadulce, entre otras. En cuanto a reptiles se refiere, tres especies de tortugas: Trachemys s. scripta, Demiatemys mawii y Staurotypus triporcatus (Morales-Díaz, com. pers.). En relación a las alóctonas, en 1964 se importaron crías de tres especies de mojarras tilapia procedentes de la Universidad de Auburn, Alabama, EE.UU. de A.; se reprodujeron en la actual estación acuícola de Temascal y se transfirieron al embalse en 1965. Estas fueron: Tilapia rendalli, Oreochromis aureus y O. mossambicus. En 1978 se introdujeron a México los primeros ejemplares de O. niloticus, procedentes de Panamá; se reclutaron en la Estación Ciprinícola de Tezontepec de Aldama, Hidalgo; después de permanecer algún tiempo ahí, se trasladaron a la estación de Temascal. A principios de 1981, SEPESCA, por conducto de la Dirección General de Acuicultura, importó de Palmeto, Florida, EE.UU. de A., dos especies de tilapia para la producción intensiva de híbridos 100% machos: O. urolepis hornorum y O. mossambicus línea roja, que se depositaron en la Estación de Reproducción Piscícola de El Rodeo, Morelos. Similarmente a sus congéneres, transcurridos algunos meses, fueron dispersadas, con profusión, en todo el territorio nacional (Arredondo-Figueroa y Tejeda-Salinas, 1989). Otra hipótesis sostiene que la modificación que sufrió la cuenca del Papaloapan a causa de la construcción de la presa produjo cambios no sólo en la ecología local, pues atrajo especies de aves acuáticas y mamíferos no existentes en la zona que probablemente fuesen hospederos intermediarios y definitivos de Gnathostoma, sino también en el modo de vida de sus pobladores. El parásito habría encontrado las condiciones ideales para establecer su ciclo biológico de manera permanente en la zona. El hecho de que, conforme a los habitantes locales, la enfermedad no existía antes de que se construyera el embalse (Martínez-Cruz et al., 1989) apoya esta suposición. Con base en los hallazgos presentados en este trabajo, el autor considera que las tilapias no fueron las responsables ni de la introducción ni de la propagación del gnatostómido, a diferencia de Martínez-Cruz et al. (1989). Considerando la transfaunación, se apoya más bien la existencia de una especie endémica que paulatinamente ha pasado a especies alóctonas, con prevalencia e intensidad promedio iniciales abrumadoramente bajas. Es más probable que su comercialización en aproximadamente 15 estados de México sea la causa de nuevos casos y, por lo mismo, aislados en su mayoría. Así mismo, cabe la posibilidad de que la ictiofauna endémica del sistema fluvial Grijalva-Usumacinta estuviese parasitada. Sin embargo, Reséndez-Medina y Salvadores (1983) sólo encontraron larvas III de Contracaecum sp. (Nematoda: Anisakidae) en la musculatura de 112 tenguayacas recolectadas en dos lagunas del estado de Tabasco. El hecho de que algunas especies habitantes del Río Papaloapan estén infestadas en la actualidad, como el caso de los guavinos nativos, podría deberse a la fuga de especies de peces y/o de copépodos que, habiendo adquirido la infección en el embalse, hayan pasado al Río Tonto a través de las compuertas, y de ahí al Río Papaloapan, sitios donde las habrían devorado especies ícticas dulceacuícolas y estuarinas euri- o estenohalinas en su trayecto cuesta arriba, al remontar grandes distancias desde la Laguna de Alvarado. Otra explicación sería que la introducción de las larvas en la cuenca haya sucedido vía felinos silvestres infestados por ingestión de peces parasitados de la presa y que, de manera paulatina, con sus heces dispersaran los huevos hacia el noreste. Por lo anterior, el autor se inclina más por la segunda hipótesis. A continuación se presenta la versión enriquecida de la propuesta de Martínez-Cruz et al. (1989): originalmente el ciclo se mantuvo de manera silvestre y la infestación circulaba en la naturaleza entre entes muy bajos, sin afectar al hombre. Debido a la construcción de la presa, la retención de los limos arrastrados por los ríos produjo mayor concentración de nutrientes y, en consecuencia, pululación de copépodos; las heces infestadas de ocelotes ribereños que llegaban al agua a beber y a comer permanecieron más tiempo en el mismo lugar, junto con crustáceos y peces, lo cual aumentó las probabilidades de que se parasitaran. De esta manera, otros felinos (gatos ferales) contrajeron la infestación por consumo de peces infestados. Al irrumpir la especie humana en dicho ciclo silvestre, adquirió la larva migrans de G. binucleatum, también por la ingestión de peces, preparados en cebiche. Esto provocó casos esporádicos, por lo que pasaron inadvertidos, pues hasta entonces la mayoría de los residentes acostumbraba comer bien cocido el pescado de los ríos. El auge de la región produjo la inmigración de personas de otras zonas que solían comerlo en cebiche, lo que originó cambios en la preparación del pescado, por parte de la población autóctona. A medida que se habituó a consumirlo, de manera paulatina y preparado con mojarras extraídas del embalse o con especies nativas del Río Papaloapan y sus afluentes y no más con especies marinas (como la sierra, Scomberomorus maculatus) y relegar a un lugar secundario las antiguas preparaciónes culinarias, la cantidad de casos del padecimiento en la región aumentó rápida y alarmantemente. Su rareza hizo que permaneciera fuera de control médico, ya que al principio el diagnóstico fue erróneo. En la actualidad, sin embargo, debido a que la mayoría de los médicos de la cuenca ya pueden reconocerlo y a las campañas profilácticas emprendidas por distintos sectores gubernamentales e instituciones educativas de nivel superior, el número de casos ha disminuido de modo gradual. Debido a que la importancia que implica la introducción de peces alóctonos al país es el de las consecuencias en especies autóctonas por la transmisión de parásitos que podrían causarles serios problemas de salud (tanto como al hombre) ya que en la actualidad en México se carece de: a) alguna ley que controle y regule su importación y dispersión; b) un sistema nacional de profilaxis, y c) un código ictiosanitario de importancia vital ahondar en el fenómeno de la transfaunación. La introducción reciente de varias especies de Oreochromis, con fines de producción intensiva de proteínas, dio como resultado su convivencia, en espacio y tiempo, con algunos peces de su misma familia taxonómica (Cichlasoma fenestratum, C. urophthalmus y Petenia splendida) en el embalse y de familias afines ecológicamente hablando (con Gobiomorus domitor de la Gobiidae, entre otras) en el Río Papaloapan y sus afluentes, en las que la larva III de G. binucleatum se encontraba originalmente presente. Así, el nemátodo pudo entonces utilizar a las especies de Oreochromis como segundos hospederos intermediarios en su ciclo de vida. Cabe señalar que es el primer registro de la larva III de G. binucleatum en el guavino y también el primero, para cualquiera de sus fases, fuera de la localidad-tipo. Los valores medianamente altos y constantes de las prevalencias en las 9 estaciones, determinados en la larva III de G. binucleatum alojada en la tenguayaca, condujeron a concretar, a manera de proposición, dos implicaciónes significativas de estas peculiaridades: 1) Se podría considerar a esta especie como una fuente importante para investigación futura, como en: a) infestación experimental de hospederos intermediarios, paraténicos y definitivas potenciales, y b) diagnóstico indirecto serológico de gnatostomiasis, utilizando a las larvas como antígeno crudo en las pruebas de intradermorreacción, ELISA, inmunodifusión en capa fina o de precipitinas (Miyazaki, 1960; Peláez y Pérez Reyes, 1970). Lamentablemente en México, debido a la aparente ausencia de esta parasitosis, no se cuenta con técnica inmunológica alguna. Esta posible fuente ideal de antígeno larvario podría acelerar la instauración de una o varias de estas actividades en los laboratorios de las instituciones gubernalmentales de Salud; 2) se le podría escoger como especie indicadora de existencia o de ausencia de gnatostomiasis animal en una región determinada y su cuerpo de agua (natural o artificial) implicado, dentro o fuera de la cuenca del Papaloapan, con base en sus hábitos carnívoros y, por ende, en su capacidad de acumular larvas en el transcurso de su vida. En su defecto, podría emplearse otro consumidor íctico de segundo o tercer orden. Se considera importante que continúe la difusión de conocimientos actualizados a los médicos y de profilaxis a la población en general. En relación con la segunda, las acciónes preventivas puestas en práctica con éxito en zonas de alto riesgo (Japón y Tailandia) son: a) enfriamiento a punto de congelación, por cualquier medio, durante períodos largos; b) cocción, al punto de ebullición, durante más de 15 minutos; c) empleo de guantes de látex, quienes por tiempo prolongado manejan carne de pescado crudo (en pescaderías o en el hogar), por ser vulnerables a la penetración cutánea de larvas, y d) evitar, no sólo en zonas endémicas, el consumo de carne cruda o insuficientemente cocida (en cebiche, escabeche o salmuera) de cualquier vertebrado (no sólo de peces de agua dulce, estuarinos o marinos), pues el limón, el vinagre y la sal no constituyen remedios suficientes para matar a las larvas III presentes en la musculatura de sus hospederos (Miyazaki, 1960; Daengsvang, 1981). Por último, se juzga necesario que lo contenido en todos los incisos mencionados y lo que de alguna manera conduzca al control de este padecimiento se desarrollen sin afectar la economía de los sitios de producción y el ya deficiente estado nutriciónal de la población del país, al satanizar el consumo de pescado. AgradecimientosEl autor desea expresar su agradecimiento a los Bióls. Manuel Pérez-Galicia y Armando Morales-Díaz, Jefes de la Estación de Acuicultura Tropical, de SEPESCA, y a las autoridades del campamento de la C.F.E. en Temascal, Oaxaca, por las facilidades otorgadas durante el trabajo de campo; a los Sres. Eugenio Tomás Feliciano, Arturo Conde-Montiel y Mario Sarmiento; al Dr. Dionisio Peláez, a la Biól. Virginia León, a los Pas. Biól. Martha E. Hernández-Viciconti, Miguel Ángel Mosqueda-Cabrera, Griselda Saldaña-Martínez y Edmundo Sánchez-Núñez y al Tec. Hist. Saúl Cortés-Suárez, por la invaluable ayuda prestada para la realización de esta investigación y sus acertadas sugerencias; al personal del Laboratorio de Microcine de la Facultad de Ciencias de la UNAM -M. en C. Alejandro Martínez-Mena y Bióls. Pablo Robles-Barajas y José Antonio Hernández-Gómez-, por el préstamo de un cuarto oscuro y por la toma de las fotomicrografías. LITERATURAACEVEDO-HERNÁNDEZ, A., M. T. QUINTERO y L. PÉREZ XICOTENCATL Hallazgo de huevos de Gnathostoma sp. (Owen, 1836) en heces de perro y cerdo de Temazcal, Oaxaca, México. Rev. Mex.Parasitol., 1988 35. 1 (1): AKAHANE, H., M. SANO y T. MAKO, Jpn. J. Parasitol., Morphological difference in cross sections of the advanced third-stage larvae of Gnathostoma spinigerum, G. hispidum, and G. doloresl. 1986. 465-467. 35 (5): AKAHANE, H. y T. MAKO, Jpn. J. Parasitol., Morphological features of "large type" larval Gnathostoma in loaches from mainland China. 1987. 424-426. 36 (6): ANDERSON, R. C., Gnathostoma miyazakii n. sp. from the otter (Lutra c. canadensis), with comments on G. sociale (Leidy, 1858) of mink (Mustela vison) Can. J. Zool, 1964. 249-254. 42 (2): ANDO, K., H. TANAKA, Y. TANIGUCHI, M. SHIMIZU y K KONDO, Two human cases of gnathostomiasis and discovery of a second intermediate host of Gnathostoma nipponicum in Japan. J. Parasitol., 1988. 623-627. 74 (4): ANDO, K., H. TOKURA y Y. CHINZEI, Parasitol., Jpn. J. Morphological features in cross section of early and adyanced third-stage larvae of Gnathostoma nipponicum. 1990. 482-487. 39 (5): ARREDONDO-FIGUEROA, J. L. y M. TEJEDA-SALINAS, An. Inst. Cienc. del Mar y Limnol. El hueso faríngeo, una estructura útil para la identificación de especies de la Tribu Tilapiini (Pisces: Cichlidae), introducidas en México. Univ. Nal. Autón México, 1989. 59-68. 16 (1): ASH, L. R., J. Parasitol., Development of Gnathostoma procyonis Chandler, 1942, in the first and second intermediate hosts. 1962a. 298-305. 48 (2): ASH, L. R., J. Parasitol., Migration and development of Gnathostoma procyonis Chandler, 1942, in manimalian hosts. 1962b. 306-313. 48 (2): BABERO, B. B. y J. R. SHEPPERSON, On the occurrence of gnathostomes in Georgia, Proc. Helm. Soc. Wash., U.S.A. 1959. 53-54. 26 (1): BEVERIDGE, I., P. J. A. PRESIDENTE y J.H. ARUNDEL, Gnathostoma spinigerum infection in a feral cat from New South Wales. Aust. Vet. J, 1978. 46 54 (1): CABALLERO Y CABALLERO, E., An. Esc. Nal. Cienc. Biol. México, Estudios helmintológicos de la región oncocercosa de México y de la República de Guatemala. Nematoda: 10ma. parte. 1958. 61-76. 9: CHANDLER, A.C., J. Parasitol., The helminths of raccoons in east Texas. 1942. 255-268. 28 (4): CHITWOOD, B. G.. y M. B. CHITWOOD, Introduction to nematology. University Park Press, Baltimore, U.S.A. 1974. 334 p. DAENGSVANG, S., Gnathostorniasis in Southeast Asia. Southeast Asia. J. Trop. Med. Pub. Hlth., 1981. 319-332. 12 (3): DE LA CRUZ-AGÜERO, G. y J. FRANCO-LÓPEZ, En: VII Simp. Latinoamer. Oceanogr. Biol. Relacionales tróficas de la ictiofauna de la laguna de Sontecomapan, Ver., México. Acapulco, Gro., México. 1981. FLORES-BARROETA, L., E. HIDALGO-ESCALANTE y F. GARCÍA-TORRES, An. Esc. Nal, Cienc. Biol México, Nemátodos de aves y mamíferos. III.Datos adiciónales de Gnathostoma en huéspedes norteamericanos 1961. 107-111. 10: HERNÁNDEZ-ORTIZ, G., J. NESME-KURI, J. FLORESCASTAÑON y P. E. HERNÁNDEZ-CUESTA, An. Soc. Mex. Oftal., Gnathostomiasis humana. Manifestaciones oculares. Presentación de un caso clínico. 1982. 65 -73. 56 (1): HOFFMAN, G. L., A symposium on discases of fishes and shellfishes. Intercontinental and transcontinental dissemination and transfaunation of fish parasites, with emphasis on whirling disease (Myxosorna cerebralis). In:Snieszko, S.F. (Ed.). American Fisheries Society, Washington, D.C., U.S.A. 1970. 526 p. HOLLOWAY, H. L. y G. H. LENO, Infection parameters of Diplostomum spathaceum in ecologically different fish. Trans. Amer. Micr. Soc., 1983. 92. 102 (1): IMAI, J. Y. ASADA Y. HORII y Y. NAWA, Gnathostoma doloresi larvae found in snakes-Agkistrodon halys, captured in the central part of Miyazaki prefecture. Jpn. J.Parásitol, 1988 444-450. 37 (4): KIRKPATRICK, C. E., J. B. LOK, M. H. GOLDSCHMIDT y S. L. MELLMAN, Gastric gnathostomiasis in a cat. J. Am Vet. Med. Assoc., 1987. 1437-1439. 190 (11): LAMOTHE-ARGUMEDO, R., R. L. MEDINA-VENCES, S. LÓPEZ-JIMÉNEZ y L. GARCÍA-PRIETO, An. Inst. Biol. Univ. Nal. Autón. México Hallazgo de la forma infectiva de Gnathostoma sp., en peces de Temascal, Oaxaca, México. Ser. Zool., 1989. 311- 320. 60 (3): MARTÍNEZ-CRUZ, J. M., R. BRAVO-ZAMUDIO, A. ARANDA-PATRACA y R. MARTÍNEZ-MARAÑÓN, Salud Pública de México La gnathostomiasis en México. 1989. 541-549. 31 (4): MIYAZAKI, I., Kyushu Mcm Med Sci., Studies on Gnathostoma occurring in Japan (Nematoda: Gnathostomidae). II.- Life history of Gnathostoma and morphological comparison of its larval forms. 1954. 123-139. 5 (2): MIYAZAKI, I., Exper. Parasitol, On the genus Gnathostoma and human gnathostomiasis, with special reference to Japan. 1960. 338-370. 9: MIYAZAKI, I., Progress in Medical Parasitology in Japan. Meguro Parasitological Museum, Gnathostoma and gnathostomiasis in Japan. In. Morishita, K., Y. Komiya y H. Matsudayashi (Eds.). Tokyo, Japan. 1966. 529-586. Vol. 3: MIYAZAKI, I. y T. UMETANI, Jpn. J. Clin. Exp. Med, Morphological description of the larval gnathostome parasitic in a fish Ophiocephalus argus in Kyushu (en japonés). 1951. 56-59. 28: MIYAZAKI, I. y L. R. ASH, On the gnathostome larvae found from snakes in New Orleans, U. S. A. (en japonés). Jpn. J. Parasitol., 1959. 351-352. 8: NAWA, Y., J. IMAI, K. OGATA y K. OTZUKA, J. Parasitol., The first record of a confirmed human case of Gnathostoma doloresi infection. 1989. 166-169. 75 (1): OLLAGUE, W., E. GÓMEZ y M. BRIONES, Primer reporte en Ecuador y América. Med. Cut. I.L.A., Infección natural de peces de agua dulce con el tercer estado larvario de Gnathostoma spinigerum y su dinámica de transmisión al hombre. 1988a. 291-294. 16 (4): OLLAGUE, W., E. GÓMEZ y M. BRIONES, Infección experimental de un gato doméstico adulto con el tercer estado larvario de Gnathostoma spinigerum procedente de un pez de agua dulce. Med Cut. I.L.A., 1988b. 295-297. 16 (4): OGATA, K., J. IMAI y Y. NAWA, Three confirmed ánd five suspected human cases of Gnadiostoma doloresi infection found in Miyazaki Prefecture, Kyushu. Jpn. J. Parasitol., 1988. 358-364. 37 (5): PELÁEZ, D. y R. PÉREZ-REYES, Rev. Lat-Amer. Microbiol., Gnathostomiasis humana en América. 1970. 83-91. 12: PROMMAS, C. y S. DAENGSVANG, J. Parasitol., Feeding experiments on cats with Gnathostoma spinigerum larvae obtained from the second intermediate host. 1937. 115-116. 23 (1): RAMACHANDRAN, P. V., S. VISWANATHAN, S. A. SHAKIR, S. NAGARAJAN y R. RAMAKRISHNAN, Indian Vet J, Gnathostomiasis in a domestic cat (Felis catus) -- a histopathological study. 1985. 10-12. 62 (1): RESÉNDEZ-MEDINA, A. y M. L. SALVADORES, Biótica, Contribución al conocimiento de la biología del pejelagarto Lepisosteus tropicus (Gill) y la tenguayaca Petenía splendida Günther, del estado de Tabasco. 1983. 413-426. 8 (4): SCHOLZ, T. y O. DITRICH, J. Helminthol., Scanning electron microscopy of the cuticular armature of the nematode Gnathostoma spitzigerum Owen, 1836 from cats; in Laos. 1990. 255-262. 64 (3): TRAVASSOS, L., Contribuicóes para o conhecimento da fauna helmintologica Brasileira. XVIII.- Sobre as especies brasileiras do genero Gnathostoma Owen, 1836. Sci. Med, 1925. 508-517. 3 (8): TRUEMAN, K. F. y P. B. C. FERRIS, Aust. Vet. J, Gnathostomiasis in three cats. 1977. 498-499. 53 (10): WAID, D. D. y D. B PENCE, Helminths of mountain lyon (Felis concolor) from southwestern Texas, with a redescription of Cylicospirura subaequalis (Molin 1860) Vevers, 1922. Can. J. Parasitol., 1988 2110-2117. 66 (10): ZARET, T.M. y R.T. PAINE, Science, Species introduction in a tropical lake. 1973. 449-455. 182 (4111):
|

