|
MOLUSCOS DE LA LAGUNA CAMARONERA, VERACRUZ, MÉXICO:
SISTEMÁTICA Y ECOLOGÍA
Trabajo recibido el 6 de diciembre de
1990 y aceptado para su publicación el 18 de febrero de 1991.
Martha Reguero
Antonio García-Cubas
Instituto de Ciencias del Mar y Limnología,
Universidad Nacional Autónoma de México, Apartado Postal 70-305,
México, D. F. 04510 MÉXICO Contribución No. 702 del
Instituto de Ciencias del Mar y Limnología, UNAM.
Se analiza la comunidad de moluscos bénticos de
la laguna Camaronera, la cual está integrada por 38 especies de las
Clases Gastropoda y Bivalvia, siendo Diastoma varium la
forma dominante. Se describen los hábitos de vida de la malacofauna y se
mencionan algunos aspectos hidrológicos de la región. El
análisis revela que la mayoría de las especies son de origen
marino-salobre. Los gasterópodos son principalmente epifaunales y
colectores de depósitos; mientras que entre los bivalvos abundan las
formas infaunales y suspensívoras. Se proporcionan los intervalos de
similitud entre estaciones de muestreo y los valores del índice de
diversidad a nivel de Clase y Phylum.
The benthic mollusks community analysis of Camaronera
lagoon is presented. This community was integrated for 38 species of Gastropoda
and Bivalvia Classes. The dominant species was Diastoma
varium. Life habits of mollusks fauna are described and some
hydrological aspects of region are mentioned. The analysis reveals that the
most of species are marine-brackish inhabitants. Gastropods are mainly
epifaunal and deposit-feeders; while among bivalves predominate the infaunal
and filterfeeders organisms. Similarity ranges among sample locations and
diversity index values are provided for Class and Phylum levels.
El laboratorio de Malacología, del Instituto de Ciencias del Mar y Limnología de la UNAM, ha puesto especial interés en el estudio de los moluscos bénticos, como parte de un proyecto que incluye su identificación en 22 lagunas del Golfo de México y de cuyo análisis se deriva la necesidad de publicar listas faunísticas parciales, que faciliten la integración posterior de un trabajo sobre los recursos malacológicos presentes en estos cuerpos de agua. No obstante la considerable importancia económica y alimentaria que tienen los moluscos en México, el conocimiento de aspectos biológicos y ecológicos es insuficiente hasta la fecha, para atenuar el impacto sobre la comunidad estable, derivado de la pesquería de especies como Crassostrea virginica, Rangia cuneata, R. flexuosa y Polymesoda caroliniana. Con ésta y otras contribuciones, anteriores y futuras, se pretende sentar las bases sobre la sistemática, abundancia, distribución y diversidad de especies del Phylum Mollusca que habitan en cada uno de los sistemas lagunares, con el propósito de mostrar la variedad de poblaciones alternativas, susceptibles de explotación. ANTECEDENTESLa bibliografía relacionada con esta área se encuentra incluída entre los estudios efectuados para el complejo lagunar de Alvarado en su conjunto, como los de Villalobos et al. (1966), Signoret (1969), Villalobos et al. (1969), Reséndez (1973), Villalobos et al. (1975), Gómez-Aguirre (1977), Flores-Coto y Méndez Vargas (1982), Vargas Maldonado (1986), Rosales-Hoz et al. (1986), Fernández (1989), García-Montes (1989) y Raz-Guzmán et al. (1989), en los cuales se detallan aspectos hidrológicos, geológicos y biológicos del sistema. DESCRIPCIÓN DEL ÁREA DE ESTUDIOLa laguna Camaronera está ubicada en la llanura costera del Golfo de México, al sur del Puerto de Veracruz, entre las coordenadas geográficas 18° 50' a 18° 52' 30" de latitud norte y 95° 54' a 95° 58' 30" de longitud oeste (Contreras, 1985). Se localiza al norte del sistema lagunar de Alvarado, del cual forma parte, abarcando aproximadamente el 30% de la superficie total del mismo (Rosales-Hoz et al., 1986). Para el estudio de los moluscos se fijaron en el área 18 estaciones de muestreo y se efectuaron 2 arrastres, uno de la estación 5 a la 6 y otro de la 9 a la 10. Este último no se encuentra representado gráficamente, debido a la estrechez del canal en el que se ubicó (Fig. 1). 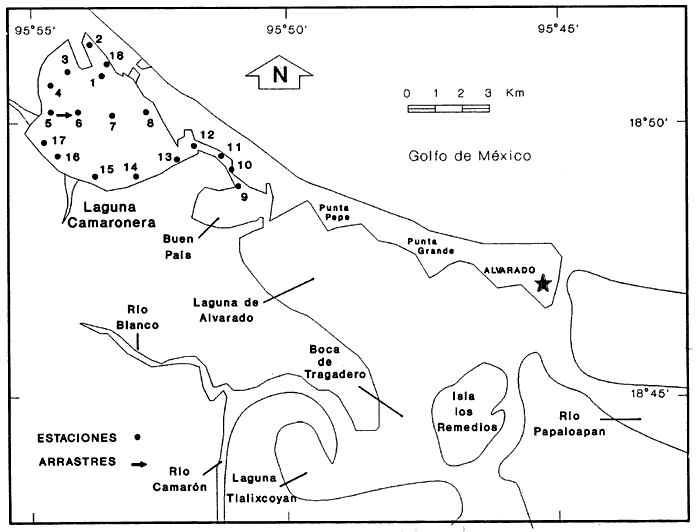 Figura 1. Toponimia y distribución de las estaciones de muestreo. De acuerdo con García (1988), la laguna Camaronera presenta clima cálido subhúmedo -el más húmedo de los subhúmedos-, con lluvias de verano. La temperatura media anual es de 26°C y la media del mes más frío por arriba de 18ºC, con una oscilación anual de las temperaturas medias mensuales entre 5 y 7 °C. La temporada de sequía se presenta entre los meses de enero a mayo, la de lluvias inicia en junio y los "nortes" tienen lugar en noviembre, generalizándose en enero. HIDROGRAFÍAEn esta porción del complejo lagunar no descarga sus aguas ningún río de flujo permanente. HIDROLOGÍALa entrada de aguas marinas se establece a través de un canal artificial constituído por 2 tubos de 3 m de ancho, que comunican a la laguna Camaronera con el mar en su región nororiental (Rosales-Hoz et al., 1986). Los aportes de agua dulce son principalmente de origen pluvial, presentándose algunos escurrimientos temporales en la porción occidental, aparentemente por filtración de aguas de pequeños afluentes del Río Blanco. Vargas-Maldonado (1986) señala que el susbsistema Camaronera es un área de influencia nerítica, con gradientes horizontales, influencia de agua dulce y marina, pero en mayor grado esta última. Sin estratificación. ROSALES-HOZ et al. (1986) caracterizan al canal que comunica a la laguna Camaronera con Buen País como un área lagunar típica; las zonas próximas al canal son transicionales y la región cercana al canal artificial, como un área con influencia marina. BATIMETRÍADe acuerdo con Contreras (1985), la profundidad media en la laguna es de 1 m. TRANSPARENCIACamaronera es un cuerpo de aguas turbias con transparencia promedio de 0.40 m. En el área se han registrado valores de materia orgánica suspendida que van desde 38 hasta 160 mg/l (Rosales-Hoz et al., 1986). Vargas-Maldonado (1986) indica que todo el complejo de Alvarado es un sistema de alta turbiedad, con transparencias aún menores para la época de lluvias. Los porcentajes promedio para las tres épocas son: nortes . . . . . . . . . .36.0% secas . . . . . . . . . . . 38.8% lluvias . . . . . . . . . . 16.5% TEMPERATURA DEL AGUAFlores-Coto y Méndez Vargas (1982) registran para el verano temperaturas superficiales entre 25 y 30 °C en todo el sistema, muy similares a las de fondo que van de 25.1 a 31°C; mientras que Fernández (1989) y García-Montes (1989) señalan variaciones entre 32 y 33°C para la laguna Camaronera, durante el mes de julio. Por otra parte, Rosales-Hoz et al. (1986) indican temperaturas de 20.8 a 22.6 °C para la temporada de lluvias en la laguna Camaronera. SALINIDADLos intervalos de salinidad reportados por Vargas-Maldonado (1986) para todo el complejo lagunar, en cada una de las épocas son: nortes . . . . . . . . . . 5.00 a 22.00 ‰ secas . . . . . . . . . . . 1.65 a 35.58 ‰ lluvias . . . . . . . . . . 0.12 a 5.92 ‰ García-Montes (1989) registra para el mes de julio, en la laguna Camaronera, salinidades de 14 ‰; mientras que Rosales-Hoz et al. (1986) señalan condiciones halinas altamente homogéneas a nivel superficial, durante la temporada de lluvias, con un valor promedio de 4.9 ‰. SEDIMIENTOSDe acuerdo con Contreras (1985), en el fondo de la laguna predominan la arena y el limo, además de fragmentos de conchas. Raz-Guzmán et al. (1989) reportan altos porcentajes de grava en las áreas cercanas al canal que comunica a Camaronera con Buen País y sustratos predominantemente limo-arcillosos frente al canal artificial. El análisis efectuado por Rosales-Hoz et al. (1986) indica que los sedimentos del área presentan un tamaño medio dentro del rango de arenas de grano fino. MATERIAL Y MÉTODOSLas muestras biológicas fueron recolectadas por personal del Laboratorio de Malacología, del Instituto de Ciencias del Mar y Limnología de la UNAM, durante julio de 1980, en una red de 18 estaciones distribuídas en el área lagunar, eliminando zonas con presencia de bancos de ostión y almeja. En cada estación se registró la temperatura y salinidad con un salinómetro de inducción marca Beckman, así como la profundidad y transparencia del agua, utilizando una sondaleza de mano y un disco de Secchi, respectivamente. Por otra parte, mediante el uso de una draga de tipo Van Veen, con capacidad de 2 litros, se obtuvo un volumen de muestra constante, equivalente a 5 litros de sedimento superficial húmedo, el cual se lavó y tamizó in situ, utilizando una malla de plástico con 1.5 mm de luz y se fijó en formaldehído al 10%, neutralizado con borato de sodio. En el laboratorio se lavaron las muestras con agua corriente y se secaron a temperaturas inferiores a 70°C. Posteriomente se llevó a cabo la separación, identificación y cuantificación de los ejemplares vivos y muertos. Para cuantificar las conchas desarticuladas de los bivalvos depositados en el sedimento, se adoptó el criterio propuesto por García-Cubas (1963), considerando cada valva como un ejemplar. Para fines cualitativos, se efectuaron 2 arrastres en la laguna Camaronera, mediante una red biológica con boca de 300 cm² y malla de 2 cm, durante 5 min, a una velocidad promedio de 2 nudos. Las especies obtenidas fueron incluídas en la lista sistemática, aunque no se consideraron para el análisis cuantitativo de la comunidad, ya que la técnica de captura no es adecuada para ese propósito. Los especímenes de referencia fueron separados y etiquetados para incorporarlos a la colección del laboratorio de Malacología del ICMyL. Los ejemplares recolectados se agruparon sistemáticamente, indicando distribución geográfica y local, así como características del habitat para las distintas especies y se sometieron a análisis cuantitativo para obtener el valor de importancia relativo a cada una de ellas y el índice de similitud entre las estaciones de muestreo (Krebs, 1972). Asimismo, se calcularon los índices de diversidad (H'n), diversidad máxima (Hmax), equitatividad (J) y riqueza de especies (D), tanto para poblaciones de las Clases Gastropoda y Bivalvia, como para el conjunto de moluscos, por estación, por laguna y por ambiente halíno, mediante las expresiones matemáticas propuestas por Shannon-Wiener (1963), Pielou (1966) y Margalef (1958), respectivamente. El análisis incluyó también la estimación de los coeficientes de determinación entre los valores de H'n vs. J y H'n vs. D, para establecer el factor dominante sobre la diversidad en cada taxón, trabajando por separado la comunidad viva y la total. RESULTADOS
HIDROLOGÍALos registros de temperatura en la laguna Camaronera oscilaron entre 28.6 y 30.7 °C, los de salinidad entre 4.4 y 6.5 ‰ y la profundidad varió de 0.80 a 3.20 m. Los datos detallados de estos parámetros para cada una de las estaciones de muestreo, se concentran en la Tabla 1. CONSIDERACIONES A LA SISTEMÁTICAA continuación se presenta la sistemática del total de especies encontradas en la laguna, cuyo arreglo se efectuó de acuerdo con el sistema de clasificación propuesto por Keen (1971). Las indicaciones sobre distribución geográfica, habitat y tipo de nutrición fueron extraídas de Abbott (1974), García-Cubas (1981), Antolí y García-Cubas (1985) y Reguero y García-Cubas (1989). Los organismos quedaron ubicados sistemáticamente en 2 Clases, 10 Ordenes, 22 Familias, 30 Géneros y 38 Especies. SISTEMÁTICA DE MOLUSCOS PRESENTES EN LA LAGUNA CAMARONERA
CLASE GASTROPODASubclase Prosobranchia Orden Archaeogastropoda Superfamilia Neritacea Familia Neritidae Género Neritina Lackmarck, 1816 1. Neritina reclivata (Say, 1822) (Lám. 1, Fig. 1) Distribución local. Estaciones 1, 9, 10, 11. Arrastre 1. Distribución geográfica. Florida (EUA), Golfo de México a las Antillas. Habitat y tipo de nutrición. Es una forma común en aguas salobres a dulces, frecuentemente se le encuentra sobre la vegetación sumergida, debido a sus hábitos nutritivos micrófagos. Subgénero Villa Mörch 2. Neritina (Villa) virginea (Linnaeus, 1758) (Lám. 1, Fig. 2) Distribución local. Estaciones 1, 10. Distribución geográfica. Florida, Golfo de México, las Antillas y de las Bermudas a Brasil. Habitat y tipo de nutrición. Especie epifaunal entre la vegetación. Muy frecuente en zonas de intermareas y aguas salobres; nutrición micrófaga raspando la vegetación. Orden Mesogastropoda Superfamilia Rissoacea Familia Hydrobiidae Género Hydrobia Hartman, 1821 3. Hydrobia totteni Morrison, 1954 (Lám. 1, Fig. 3) Distribución local. Estación 1. Distribución geográfica. Península del Labrador al Golfo de México. Habitat y tipo de nutrición. Especie epifaunal, abundante en aguas someras y estancadas. Nutrición micrófaga, asociada con algas verdes. Género Littoridina Eydoux y Souleyet, 1852 Subgénero Texadina Abbott y Ladd, 1951 4. Littoridina (Texadina) sphintostoma Abbott y Ladd, 1951 (Lám. 1, Fig. 4) Distribución local. Estaciones 1, 10, 12. Distribución geográfica. De Mississippi a Texas (EUA) y Golfo de México. Habitat y tipo de nutrición. Es muy común en aguas someras y salobres hasta casi dulces; viven en fondos arenolimosos, epifaunales, se nutren de materia orgánica depositada en el sustrato. Familia Vitrinellidae Subfamilia Vitrinellinae Género Vitrinella C. B. Adams, 1850 5. Vitrinella helicoidea C. B. Adams, 1850 (Lám. 1, Fig. 5) Distribución local. Estación 1. Distribución geográfica. Carolina del Norte a Florida, Golfo de México, las Antillas y Bermudas. Habitat y tipo de nutrición. Especie epifaunal sobre arena y entre rocas; aguas someras. Nutrición micrófaga de partículas depositadas sobre el sustrato. Género Cyclostremiscus Pilsbry y Olsson, 1945 Subgénero Ponocyclus Pilsbry 1953 6. Cyclostremiscus (Ponocyclus)jaeneae Pilsbry y McGinty, 1946. (Lám. 1, Fig. 6) Distribución local. Estación 1. Distribución local. Estación 1. Distribución geográfica. Ambos lados de Florida, Texas (EUA); Costa Rica, Panamá. Habitat y tipo de nutrición. Epifaunales en fondos arenosos, herbívoros macrófagos. Género Solariorbis Conrad, 1865 Subgénero Solariorbis s. s. Solariorbis (Solariorbis) infracarinala Gabb, 1881 (Lám. 1, Fig. 7) Distribución local. Estación 1. Distribución geográfica. Costas de Florida, Texas (EUA); Campeche (México); Panamá. Habitat y tipo de nutrición. Se le encuentra en ensenadas, bahías y lagunas; epifaunales en arena y conchas; nutrición de materia orgánica depositada. Subfamilia Teinostomatinae Género Teinostoma H. y A. Adams, 1854 8. Teinostoma biscaynense Pilsbry y MeGinty, 1945 (Lám. 1, Fig. 8) Distribución local. Estación 1. Distribución geográfica. Sur de Florida y costas del Golfo de México. Habitat y tipo de nutrición. Se encuentra en bahías y lagunas costeras; en fondos de arena, epifaunales; micrófagos de materia orgánica depositada. 9. Teinostoma lerema Pilsbry y McGinty, 1945 (Lám. 1, Fig. 9) Distribución local. Estación 1. Distribución geográfica. Desde la Florida (EUA) al Golfo de México e Islas Vírgenes. Habitat y tipo de nutrición. Areas cercanas a la costa, bahías y lagunas. Nutrición micrófaga de materia orgánica depositada. Superfamilia Cerithiacea Familia Cerithiidae Subfamilia Cerithiopsinae Género Cerithiopsis Forbes y Hanley, 1849 10. Cerithiopsis greeni (C. B. Adams, 1839) (Lám. 1, Fig. 10) Distribución local. Estación 1. Distribución geográfica. De Cabo Cod a la Florida, Bermudas, Golfo de México hasta Brasil. Habitat y tipo de nutrición. Especie epifaunal de aguas costeras y lagunares. Nutrición carnívora. Subfamilia Diastominae Género Diastoma Deshayes 1850 11. Diastoma varium (Pfeiffer, 1840) (Lám. 1, Fig. 11) Distribución local. Estaciones 1, 12, 13, 17. Distribución geográfica. Comprende desde Maryland (EUA), costas del Golfo de México hasta Brasil. Habitat y tipo de nutrición. Epifaunal entre la vegetación sumergida en bahías y lagunas costeras. Herbívoros. Subfamilia Triphorinae Género Triphora Blainville, 1828 12. Triphora nigrocincta (C. B. Adams, 1839) (Lám. 1, Fig. 12) Distribución local. Estación 1. Distribución geográfica. Carolina del Norte, Bermudas, Golfo de México, las Antillas hasta Brasil. Habitat y tipo de nutrición. Forma epifaunal sobre lodos y arenas en aguas marinas someras y salobres. Nutrición carnívora y detritívora. Familia Potamididae Género Cerithidea Swainson, 1840 Subgénero Cerithideopsis Thiele, 1929 13. Cerithidea (Cerithideopsis) plículosa (Menke, 1829) (Lám. 1, Fig. 13) Distribución local. Estaciones 1, 9, 11. Distribución geográfica. Desde Louisiana (EUA), Golfo de México a Centro América. Habitat y tipo de nutrición. Se encuentran en bahías y lagunas costeras donde predominan los pastos marinos, seminfaunales en fondos fangosos; se nutren de materia orgánica depositada en el fondo. Superfamilia Epitoniacea Familia Epitoniidae Género Epitonium Röding, 1798 Subgénero Asperiscala De Boury, 1909 14. Epitonium (Asperiscala) multistriatum (Say, 1826) (Lám. 2, Fig. 14) Distribución local. Estación 1. Distribución geográfica. Sur de Massachusetts a Cabo Cañaveral, Florida, oeste de Texas (EUA), hasta Brasil. Habitat y tipo de nutrición. Zonas costeras y lagunas en áreas de fuerte influencia marina; epifaunales en sustratos predominantemente arenosos. Nutrición carnívora. Superfamilia Calyptraeacea Familia Calyptraeidae Subfamilia Crepidulinae Género Crepidula Lamarck, 1799 Subgénero Ianacus Mörch, 1852 15. Crepidula (Ianacus) plana Say, 1822 (Lám. 2, Fig. 15) Distribución local. Estación 1. Distribución geográfica. Desde Canadá, costas del Golfo de México, las Antillas hasta Brasil. Habitat y tipo de nutrición. Especie epifaunal sobre objetos duros, en aguas marinas someras y salobres. Nutrición por filtración de partículas orgánicas en suspensión Subclase Opisthobranchia Orden Entomotaeniata Superfamilia Pyramidellacea Familia Pyramidellidae Subfamilia Odostomiinae Género Odostomia Fleming, 1813 Subgénero Odostomia s. s. 17. Odostomia (Odostomia) laevigata (d'Orbigny, 1842) (Lám. 2, Fig. 17) Distribución local. Estación 17. Distribución geográfica. Carolina del Norte a Florida, Golfo de México, las Antillas hasta Brasil. Habitat y tipo de nutrición. Especie epifaunal, en aguas marinas y salobres someras. Ectoparásita. Subgénero Menestho Möller 1842 18. Odostomia Menestho impressa (Say, 1822) (Lám. 2, Fig. 18) Distribución local. Estación 1. Distribución geográfica. Massachusetts a Florida y Golfo de México. Habitat y tipo de nutrición. Epifaunal, de aguas salobres, especialmente en bancos ostrícolas, como ectoparásito. Subfamilia Turbonillinae Género Turbonilla Risso,1826 Subgénero Pyrgiscus Philippi, 1841 19. Turbonilla (Pyrgiscus) interrupta (Totten, 1835) (Lám. 2, Fig. 19) Distribución local. Estación 1. Distribución geográfica. Desde Maine al Golfo de México, las Antillas hasta Brasil. Habitat y tipo de nutrición. Especie epifaunal, frecuente en aguas someras marinas y salobres. Ectoparásita. Orden Cephalaspidea Superfamilia Acteonacea Familia Acteocinidae Género Acteocina Gray, 1847 20. Acteocina canaliculata (Say, 1822) (Lám. 2, Fig. 20) Distribución local. Estación 1. Distribución geográfica. Nueva Escocia a Florida, Golfo de México, las Antillas hasta Brasil. Habitat y tipo de nutrición. Especie epifaunal en bahías y lagunas costeras. Alimentación carnívora. Orden Neogastropoda Superfamilia Conacea (=Toxoglossa) Familia Turriidae Subfamilia Mangeliinae Género Pyrgocythara Woodring, 1928 16. Pyrgocythara plicosa (C. B. Adams, 1850) (Lám. 2, Fig. 16) Distribución local. Estación 1. Distribución geográfica. Cabo Cod a Florida y Golfo de México. Habitat y tipo de nutrición. Especie epifaunal sobre lodos y entre la vegetación en lagunas costeras. Nutrición carnívora. CLASE BIVALVIASubclase Pteriomorphia Orden Arcoida Superfamilia Arcacea Familia Arcidae Subfamilia Anadarinae Género Anadara Gray, 1847 Subgénero Larkinia Reinhart, 1935 21. Anadara (Larkinia) transversa (Say, 1822) (Lám. 2, Fig. 21) Distribución local. Estación 1. Distribución geográfica. Desde el sur de Cabo Cod (EUA), Golfo de México a la laguna de Términos, Camp. (México) hasta las Antillas. Habitat y tipo de nutrición. De la zona litoral hasta 11 m de profundidad; formando parte de la infauna; hábitos alimenticios filtrantes de partículas en suspensión. Orden Mytiloida Superfamilia Mytilacea Familia Mytilidae Subfamilia Mytilinae Género Ischadium Jukes-Brown, 1905 22. Ischadium recurvum (Rafinesque, 1820) (Lám. 2, Fig. 22) Distribución local. Estaciones 10, 11. Distribución geográfica. Cabo Cod (EUA), Golfo de México y las Antillas. Habitat y tipo de nutrición. En aguas salobres y someras formando parte de la epifauna, viven adheridas mediante un biso fibroso a rocas y bancos de ostras; su nutrición es filtrante. Orden Pteroidea Suborden Pteriina Superfamilia Ostreacea Familia Ostreidae Género Crassostrea Sacco, 1897 23. Crassostrea virginica (Gmelin, 1791) (Lám. 2, Fig. 23) Distribución local. Estación 1. Distribución geográfica. Desde el Golfo de San Lorenzo (Canadá) al Golfo de México y las Antillas. Habitat y tipo de nutrición. Especie característica de aguas salobres, se le encuentra en lagunas y esteros formando parte de la epifauna cementante; sus hábitos alimenticios son filtrantes de partículas orgánicas en suspensión. Superfamilia Anomiacea Familia Anomiidae Género Anomia Linnacus, 1758 24. Anomia simplex d'Orbigny, 1845 (Lám. 2, Fig. 24) Distribución local. Estación 1. Distribución geográfica. Cabo Cod a Florida, Bermudas, Golfo de México hasta Brasil. Habitat y tipo de nutrición. Especie epifaunal de sustratos duros. Nutrición de partículas orgánicas en suspensión. Subclase Heterodonta Orden Veneroida Superfamilia Dreisseniacea Familia Dreissenidae Género Mytilopsis Conrad, 1858 25. Mytilopsis leucophaeata (Conrad, 1831) (Lám. 2, Fig. 25) Distribución local. Estación 1. Distribución geográfica. Nueva York hasta Florida, Texas (EUA) y costas del Golfo de México. Habitat y tipo de nutrición. Especie epifaunal fija sobre rocas; de aguas dulces a salobres. Nutrición de partículas en suspensión. Superfamilia Lucinacea Familia Lucinidae Género Lucina Bruguière, 1797 Subgénero Parvilucina Dall, 1901 26. Lucina (Parvilucina) multilineata Tuomey y Holmes, 1857 (Lám. 3, Fig. 26) Distribución local. Estación 1. Distribución geográfica. Carolina del Norte, Florida, Texas (EUA), costas del Golfo de México hasta Brasil. Habitat y tipo de nutrición. Infaunal, en aguas someras, esteros y lagunas, en fondos limosos y arenosos, nutrición suspensívora micrófaga. Subgénero Phacoides Blainville, 1825 27. Lucina (Phacoides) pectinata (Gmelin, 1791) (Lám. 3, Fig. 27) Distribución local. Estación 1. Distribución geográfica. Carolina del Norte a Florida, Golfo de México, las Antillas hasta Brasil. Habitat y tipo de nutrición. Forma parte de la infauna superficial en aguas someras de lagunas y estuarios. Nutrición de partículas orgánicas en suspensión. Familia Ungulinidae Género Diplodonta Bronn, 1831 28. Diplodonta punctata (Say, 1822) (Lám. 3, Fig. 28) Distribución local. Estaciones 10, 11. Distribución geográfica. Carolina del Norte a Florida, Bermudas, Golfo de México hasta Brasil. Habitat y tipo de nutrición. Especie infaunal superficial, en aguas someras a profundas. Nutrición suspensívora. Superfamilia Veneracea Familia Veneridae Subfamilia Chioninae Género Anomalocardia Schumacher, 1817 29. Anomalocardia auberiana (d'Orbigny, 1842) (Lám. 3, Fig. 29) Distribución local. Estación 1. Distribución geográfica. Sur de Florida, Texas (EUA); costas del Golfo de México; Centroamérica, las Antillas, Brasil hasta Uruguay. Habitat y tipo de nutrición. Es una forma común en aguas salobres; forma parte de la infauna en fondos de arena y fango. Se localiza en bahías abiertas, típicamente marinas, así como en lagunas y esteros tolerando amplios rangos de salinidad. Su nutrición es suspensívora. Superfamilia Mactracea Familia Mactridae Subfamilia Mactrinae Género Mulinia Gray, 1837 30. Mulinia lateralis (Say, 1822) (Lám. 3, Fig. 30) Distribución local. Estaciones 1, 9, 10, 11, 12, 13. Distribución geográfica. Desde Maine hasta el Golfo de México. Habitat y tipo de nutrición. Especie infaunal de sustratos arenosos y fangosos, en aguas someras templadas y cálidas. Nutrición suspensívora. Género Rangia Desmoulins, 1832 31. Rangia cuneata (Gray, 1831) (Lám. 3, Fig. 31) Distribución local. Estaciones 2, 3, 4, 5, 6, 7, 8, 15, 17. Arrastre 1. Distribución geográfica. De Virginia al sur del Golfo de México. Habitat y tipo de nutrición. Especie típicamente estuarina, en fondos limo-arcillosos; forma parte de la infauna superficial. Nutrición filtrante, saprófaga. Subgénero Rangianella Conrad, 1863 32. Rangia (Rangianella) flexuosa (Conrad, 1839) (Lám. 4, Fig. 32) Distribución local. Estaciones 1, 2, 9, 10, 11, 13. Distribución geográfica. De Louisiana (EUA) hasta el sur del Golfo de México. Habitat y tipo de nutrición. Especie infaunal en sustratos blandos, en aguas salobres influidas por ríos. Nutrición de partículas orgánicas en suspensión. Superfamilia Tellinacea Familia Tellinidae Subfamilia Macominae Género Macoma Leach, 1819 33. Macoma tenta (Say, 1834) (Lám. 4, Fig. 33) Distribución local. Estación 10. Distribución geográfica. Cabo Cod a Florida, Bermudas, Golfo de México hasta Brasil. Habitat y tipo de nutrición. Especie infaunal de aguas someras. Nutrición de partículas depositadas en el sustrato. Subgénero Austromacoma Olsson, 1961 34. Macoma (Austromacoma) constricta (Bruguiére, 1799) (Lám. 4, Fig. 34) Distribución local. Estación 1. Distribución geográfica. Carolina del Norte, Golfo de México, las Antillas hasta Brasil. Habitat y tipo de nutrición. En bahías y lagunas costeras tolerando amplios rangos de salinidad, forma parte de la infauna. Nutrición de partículas orgánicas depositadas en el sustrato. Subgénero Psammacoma Dall, 1900 35. Macoma (Psammacoma) brevifrons (Say, 1834) (Lám. 4, Fig. 35) Distribución local. Estación 11. Distribución geográfica. Carolina del Sur, Golfo de México, las Antillas hasta Brasil. Habitat y tipo de nutrición. Especie infaunal de aguas someras. Nutrición de partículas orgánicas depositadas en el sustrato. Familia Semelidae Subfamilia Scrobiculariinae Género Semele Schumacher, 1817 36. Semele proficua (Pulteney, 1799) (Lám. 4, Fig. 36) Distribución local. Estación 1. Distribución geográfica. Carolina del Norte, Bermudas, Golfo de México hasta Brasil. Habitat y tipo de nutrición. Especie infaunal de aguas someras. Nutrición de partículas orgánicas depositadas. Orden Myoida Superfamilia Myacea Familia Corbulidae Género Corbula Bruguière, 1792 Subgénero Caryocorbula Gardner, 1926 37. Corbula (Caryocorbula) contracta Say, 1822 (Lám. 4, Fig. 37) Distribución local. Estación 1. Distribución geográfica. Cabo Cod a Florida, Golfo de México, las Antillas hasta Brasil. Habitat y tipo de nutrición. Especie infaunal de sustratos arenosos, aguas someras. Nutrición suspensívora. 38. Corbula (Caryocorbula) dietziana C. B. Adams, 1852 (Lám. 4, Fig. 38) Distribución local Estación 1. Distribución geográfica. De Carolina del Norte hasta Florida, Texas (EUA); Golfo de México, las Antillas hasta Brasil. Habitat y tipo de nutrición. Formas marinas, infaunales en arenas calcáreas, nutrición suspensívora. ANÁLISIS CUANTITATIVO Y PORCENTUALEn un total de 18 estaciones de muestreo se extrajeron 46,579 individuos, entre los que se cuantificaron 16,109 (34.6%) organismos vivos y 30,470 (65.4%) exoesqueletos. Para esta laguna se identificaron 20 especies de la Clase Gastropoda y 18 de la Clase Bivalvia. Entre ellas sólo Neritina reclivata y Rangia cuneata (con 1 ejemplar cada una) fueron capturadas con red de arrastre, excluyéndose los 2 individuos del análisis cuantitativo, mas no las especies, debido a que también se extrajeron con draga Van Veen. Los valores de abundancia porcentual y numérica, fueron del orden de 96.5% (44,953 ejemplares) para la Clase Gastropoda y 3.5% (1,626 individuos) para la Clase Bivalvia (Tabla 2). Las estaciones con la cantidad más elevada de organismos fueron la 13 y 1, con 44,800 y 1473 individuos, respectivamente; mientras que las estaciones 14, 16 y 18 carecieron de ejemplares y en la 2 y 4 sólo se registraron 5 individuos en cada una. En lo que respecta a localidades con el mayor número de especies, en la estación 1 se registraron 32 de las 38 encontradas en el área; mientras que en la 14, 16 y 18 no se identificó ninguna y en las estaciones 3 a 8 así como en la 35 se reconoció una especie por estación. En esta laguna, 7 (18.4%) de las 38 especies capturadas con draga Van Veen presentaron formas vivas: 3 de la Clase Gastropoda, con 15,970 individuos y un valor porcentual de 99.1 respecto al total de ejemplares vivos y 4 especies de la Clase Bivalvia, con 139 organismos, que representaron el 0.9%. la estación en la que se registró un mayor número de individuos vivos fué la 13 (Tabla 3). 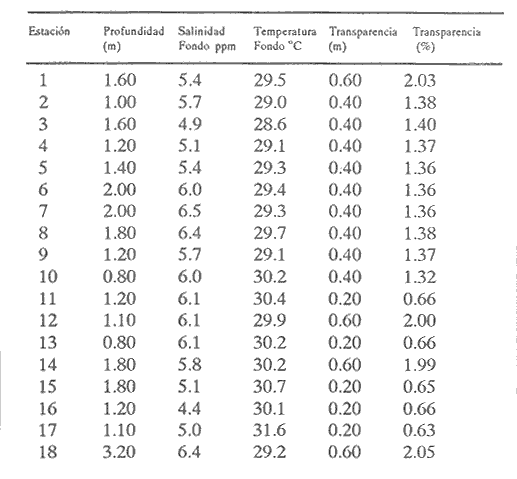 TABLA 1 PARAMETROS HIDROLÓGICOS EN LAS ESTACIONES DE MUESTREO ESPECIES CARACTERÍSTICAS DEL ÁREA DE ESTUDIOAl excluir los agregados de ostión y almeja, que se encuentran constituyendo bancos, el análisis de resultados muestra que el área de estudio está caracterizada por las especies que se enlistan a continuación. COMUNIDAD MALACOLÓGICA TOTAL:Diastoma varium Rangia cuneata Rangia flexuosa Mulinia lateralis Neritina reclivata las cuales, en conjunto, representaron el 98.8% respecto al total de organismos capturados y en donde predomina Diastoma varium por concentrar al 95.6% de la comunidad. COMUNIDAD MALACOLÓGICA VIVA:Diastoma varium Mulinia lateralis Estas dos especies concentraron al 99.9% de los moluscos vivos, registrándose un porcentaje mayor de ejemplares dentro de la especie Diastoma varium (99.1%). Los valores de abundancia, frecuencia, densidad e importancia relativa de las especies, que conforman la comunidad malacológica característica del área, se encuentran detallados en las Tablas 4 y 5, conforme a su arreglo sistemático. ÍNDICES DE SIMILITUDCon el fin de analizar la distribución de las especies que integran la comunidad de moluscos, a partir de sus asociaciones a nivel local, se aplicó porcentualmente el índice de similitud de Krebs (1972), el cual permite calcular la afinidad faunística entre pares de estaciones de un sistema. De manera que si las localidades que ocupa una comunidad son similares, las especies que presentan alguna asociación tendrán una distribución parecida a nivel local y sus límites geográficos coincidirán con los límites de la asociación. Con los valores obtenidos de comparar la presencia-ausencia de especies en las estaciones de muestreo, se elaboraron diagramas de enrejado para las comunidades malacológicas total y viva, confrontando la afinidad para las Clases Gastropoda y Bivalvia, así como para el Phylum en conjunto, estableciendo intervalos de similitud que agrupan y caracterizan estaciones con índices de afinidad semejantes. 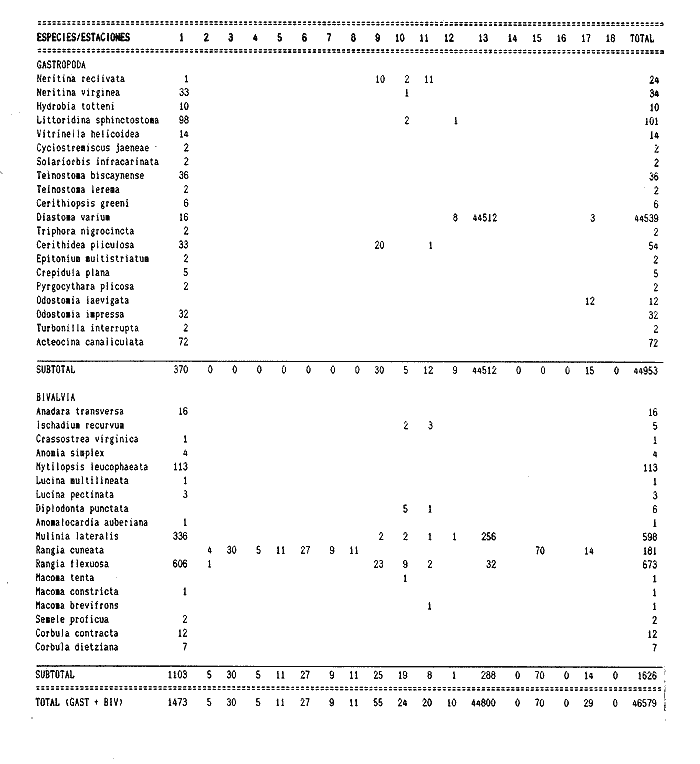 TABLA 2 ABUNDANCIA DE LA COMUNIDAD MALACOLÓGICA TOTAL Las Figuras 2 y 3 muestran gráficamente grupos de estaciones con porcentajes de similitud comprendidos en los intervalos de 0 a 24, 25 a 49, 50 a 74 y 75 a 100, así como el porcentaje que representan con respecto al número total de combinaciones posibles. COMUNIDAD MALACOLÓGICA TOTAL:Con base en las especies de gasterópodos recolectados, la afinidad calculada para las estaciones de muestreo (Fig. 2A) indica que el 61.9% ocupa el intervalo 0-24 con 13 combinaciones de un total de 21; el 19% con 4 combinaciones se encuentra en el rango de 25-49; el 14.3% en el intervalo de 50-74 con 3 combinaciones y por último el 4.8%, con 1 combinación, dentro del rango 75-100. El valor medio de similitud para estaciones en las que se presentaron miembros de esta Clase es de 23.3% Para los bivalvos, los valores porcentuales de semejanza entre pares de estaciones, obtenidos a partir de 105 combinaciones posibles (Fig. 2B), muestran que el 52.4% se ubica dentro del rango 0-24 con 55 combinaciones; el 28.6% en el intervalo de 75-100 con 30 combinaciones; el 13.3% en el rango de 50-74 con 14 combinaciones y finalmente el 5.7% dentro del intervalo 25-49 con 6 combinaciones. El porcentaje promedio de similitud en este caso es de 39% Considerando al total de moluscos (Fig. 2C), la afinidad resultante indica que de las 105 combinaciones posibles, dadas por el número total de estaciones, el 52.4% se ubica dentro del rango 0-24 con 55 combinaciones; el 20% corresponde al intervalo 75-100 con 21, quedando los rangos de 50-74 y 25-49 con porcentajes de 18.1% y 9.5%, con 19 y 10 combinaciones respectivamente. El valor medio de similitud para todo el conjunto de estaciones es de 35.5 % 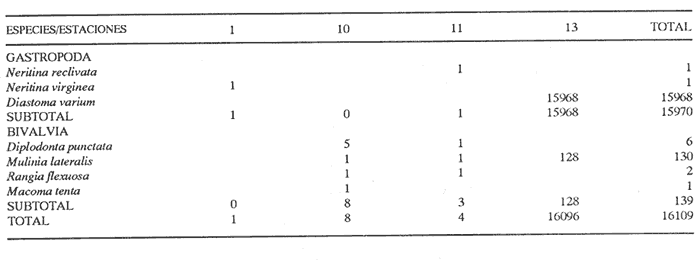 TABLA 3 ABUNDANCIA DE LA COMUNIDAD MALACOLÓGICA VIVA COMUNIDAD MALACOLÓGICA VIVA:Los porcentajes de afinidad en este caso, sólo se calcularon para formas vivas de la Clase Bivalvia, debido a que los gasterópodos de tres especies diferentes fueron capturados en distintas estaciones, por lo que el índice de similitud da un valor de cero. En la comunidad viva de la Clase Bivalvia (Fig. 3), la afinidad resultante indica que las 3 combinaciones posibles vierten porcentajes de similitud equivalentes a 33.3%, con una combinación en cada caso. La semejanza media de este grupo es de 58.6% 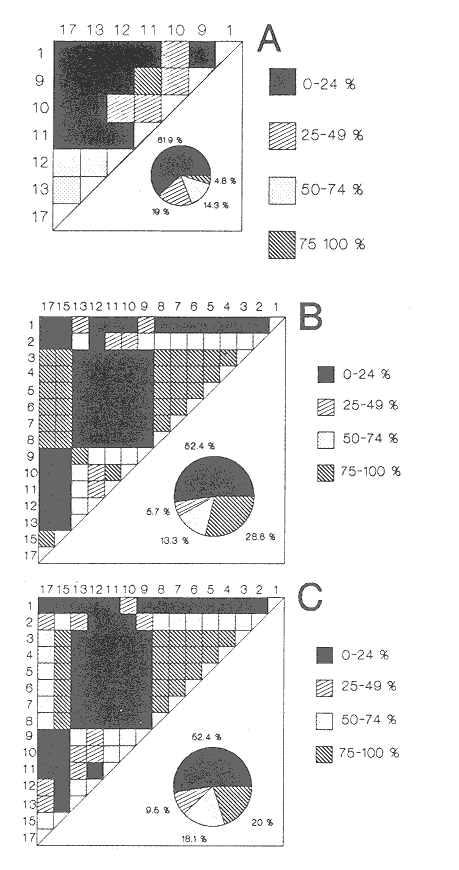 Figura 2. Diagramas de enrejado de similitud entre estaciones de muestreo para la comunidad metacológica. A) Clase Gastropoda, B) Clase Bivalvia, C) Phylum Mollusca. NUTRICIÓN Y HABITATEn la Tabla 6 se enlistan las Familias de moluscos presentes en la laguna, relacionándolas con su origen halino, posición respecto al sustrato y tipo de nutrición, de acuerdo con la literatura especializada (Purchon, 1968; Andrews, 1971; Abbott, 1974; García-Cubas, 1981; Antolí y García-Cubas, 1985; Reguero y García-Cubas, 1989). Asimismo, en la Tabla 7 se refieren estos hábitos de vida, en número y porcentajes parciales que representan, tanto a nivel de Familia como de especie, observándose que los tres conjuntos analizados en esta zona son predominantemente de origen marino-salobre. Por lo que se refiere a su posición respecto al sustrato, tanto los gasterópodos como el total de moluscos son principalmente epifaunales; mientras que la mayor parte de los bivalvos son infaunales. Entre los miembros del Phylum y de la Clase Bivalvía, abundan las formas que se alimentan por filtración de partículas suspendidas y, entre los de la Clase Gastropoda, hay un mayor porcentaje de especies colectoras de depósitos. DIVERSIDADEn esta laguna, los estimadores de la diversidad, equitatividad y riqueza de especies vierten resultados más altos para la Clase Gastropoda, tanto en el análisis general como en el de formas vivas, con excepción de la riqueza de especies que es más elevada a nivel de Phylum (Tabla 8; Fig. 4 A-B). 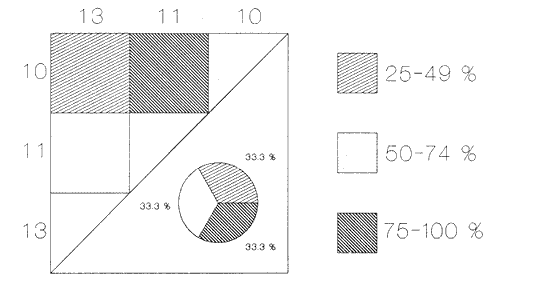 Figura 3. Diagrama de enrejado de similitud entre estaciones de muestreo para la comunidad viva de la Clase Bivalvia El cálculo de estos parámetros para comunidades totales, presenta fluctuaciones en las estaciones de colecta. Así, el índice de diversidad se determinó en intervalos de 0 a 3.23 bits/individuo para gasterópodos, de 0 a 2.16 para bivalvos y de 0 a 2.86 para la suma de estos dos grupos, con promedios de 0.49, 0.49 y 0.82, respectivamente. El de equitatividad varió de 0 a 0.96 en la Clase Gastropoda, de 0 a 0.97 en Bivalvia y de 0.31 a 0.9 en el Phylum Mollusca. El índice de riqueza de especies se registró entre límites de 0.2 a 1.49, de 0 a 1.2 y de 0.51 a 1.98, según el taxón (Tabla 9; Fig. 5 A-C). 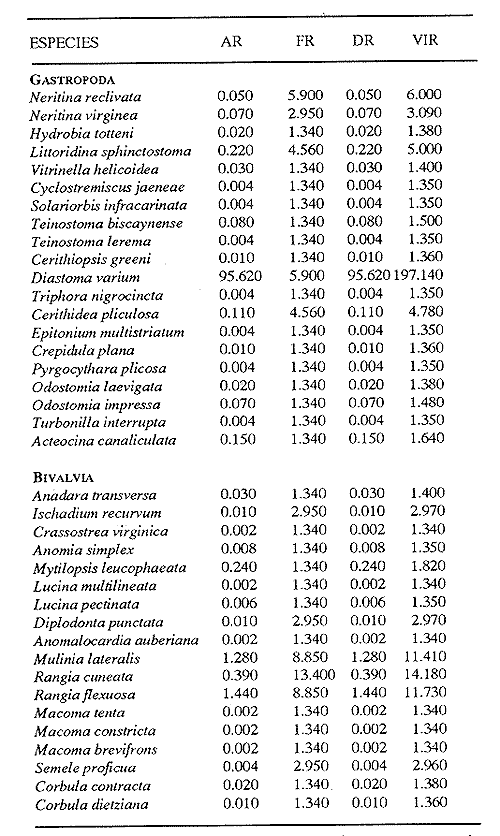 TABLA 4 ABUNDANCIA RELATIVA (AR) FRECUENCIA RELATIVA (FR) DENCIDAD RELATIVA (DR) Y VALOR DE IMPORTANCIA RELATIVA (VIR), PARA LA COMUNIDAD MALACOLÓGICA TOTAL. 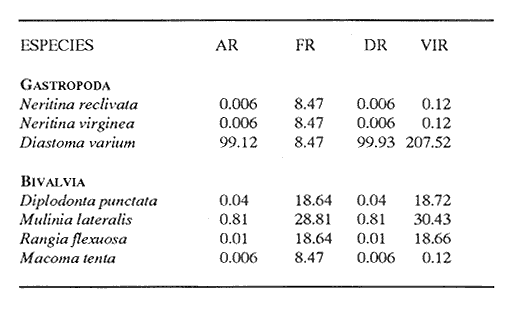 TABLA 5 ABUNDANCIA RELATIVA (AR), FRECUENCIA RELATIVA (FR), DENCIDAD RELATIVA (DR) Y VALOR DE IMPORTANCIA RELATIVA (VIR), PARA LA COMUNIDAD RELATIVA VIVA. 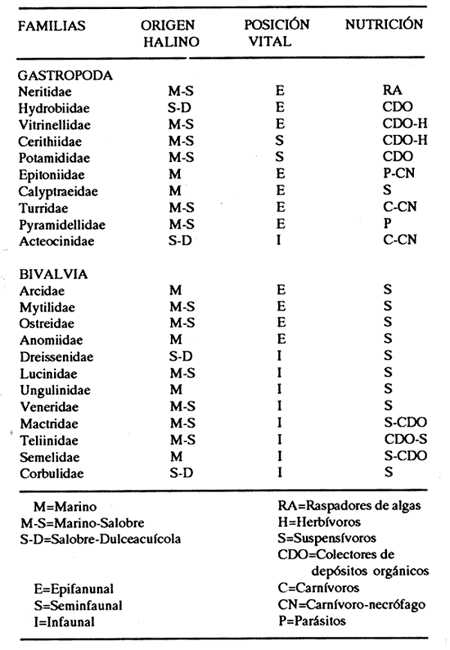 TABLA 6 ORIGEN HALINO, RELACIÓN CON EL SUSTRATO Y TIPO DE NUTRICIÓN DE LAS FAMILIAS Y ESPECIES DE MOLUSCOS 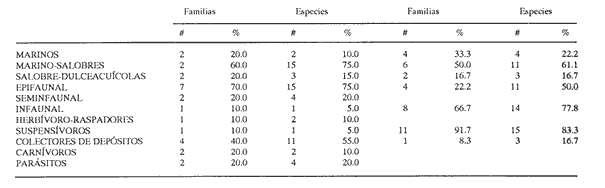 TABLA 7 ORIGEN ALINO, RELACIÓN CON EL SUSTRATO Y TIPO DE NUTRICIÓN DE LAS FAMILIAS Y ESPECIEAS DE LAS TRES CATEGORIAS TAXONOMICAS  TABLA 8 INDICES DE DIVERCIDAD MAXÍMA (Hmáx) DIVERCIDAD (H´N), EQUITATIVIDAD (J) Y RIQUEZA DE ESPECIES (D), POR TAXÓN. 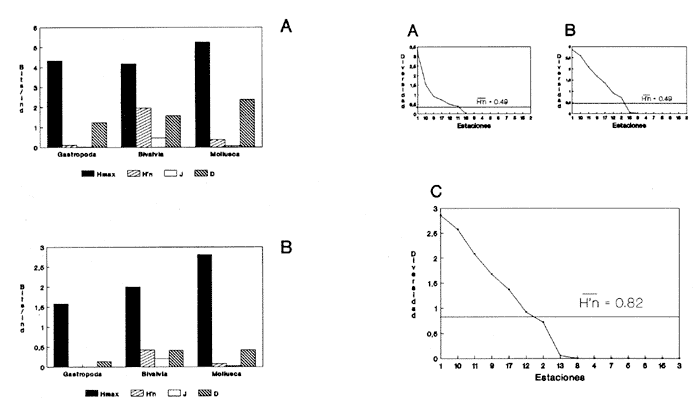 Figura 4. Indices de diversidad máxima (Hmáx), diversidad (H'n), equitatividad (J) y riqueza de especies (D) para la comunidad malacológica: A) Total y B) Viva. 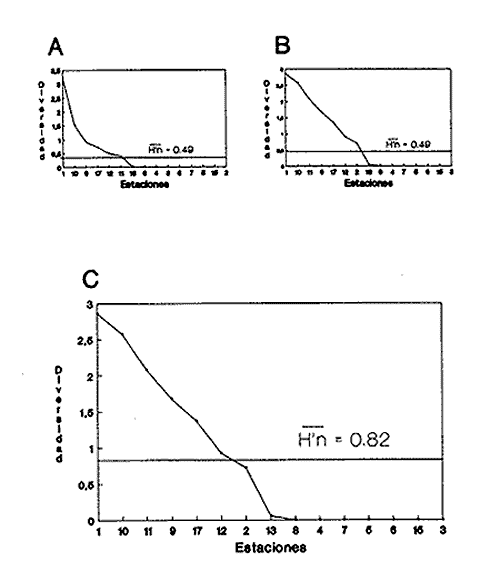 Figura 5. Curvas de valores de la diversidad en cada estación de muestreo, para comunidades totales. A) Clase Gastropoda, B) Clase Bivalvia, C) Phylum Mollusca. 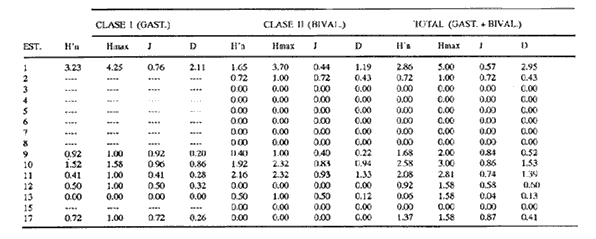 TABLA 9 INDICES DE DIVERCIDAD Y SUS COMPONENTES, POR ESTACIÓN PARA LA COMUNIDAD MALACOLÓGICA TOTAL 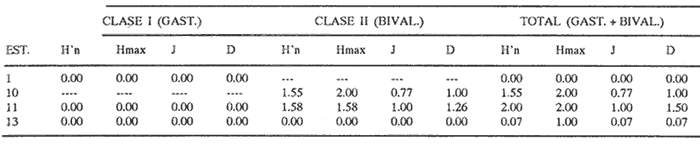 TABLA 10 INDICES DE DIVERCIDAD Y SUS COMPONENTES, POR ESTACIÓN, PARA LA COMUNIDAD MALACOLÓGICA VIVA 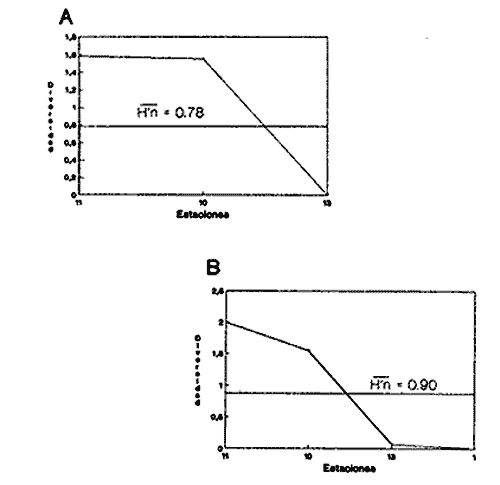 Figura 6. Curvas de valores de la diversidad en cada estación de muestreo, para comunidades vivas. A) Clase Bivalvia, B) Phylum Mollusca. En cambio, en las estaciones en que se capturaron ejemplares vivos de la Clase Gastropoda, el valor de todos los índices fué de cero; mientras que para la Clase Bivalvia la variación de la diversidad fué de 0 a 1.58, la equitatividad fluctuó de 0 a 1.58 y la riqueza de especies de 0 a 1.26 bits/individuo. La diversidad de la comunidad viva de moluscos se presentó en un intervalo de 0 a 2, la equitatividad de 0 a 1 y la riqueza de especies entre 0 y 1.50. Los valores promedio de diversidad para los tres conjuntos fué de 0, 0.78 y 0.90 bits/individuo, respectivamente (Tabla 10; Fig. 6 A-B). Los coeficientes de determinación indican que los cambios en la diversidad de las poblaciones totales de los tres taxa analizados se explican en mayor medida por la riqueza de especies; mientras que en la comunidad viva tiene una influencia similar a la de la equitatividad, siendo más importante esta última a nivel de Phylum (Figs. 7 y 8). La diversidad de los conjuntos analizados por ambiente halino, muestra el mismo comportamiento señalado anteriormente, debido a que en todo el cuerpo de agua el régimen de salinidad registrado en la época de muestreo fué de tipo mesohalino "A". 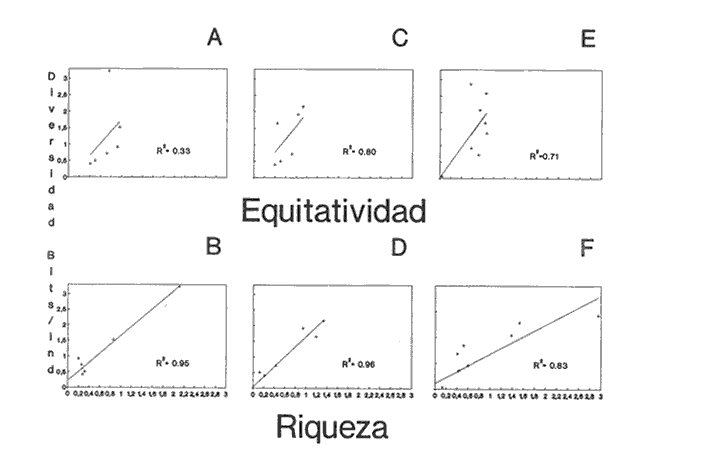 Figura 7. Coeficientes de determinación (R2) entre la diversidad y los componentes de equitatividad y riqueza de especies, para comunidades totales. A-B) Clase Gastropoda, C-D) Clase Bivalvia, E-F) Phylum Mollusca. 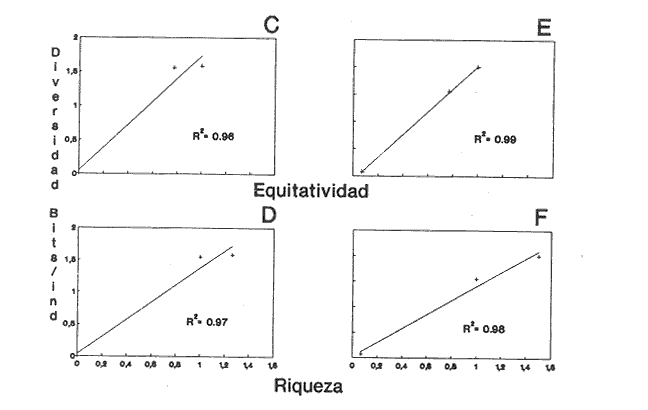 Figura 8. Coeficientes de determinación (R2) entre la diversidad y los componentes de equitatividad y riqueza de especies, para comunidades vivas. C-D) Clase Bivalvia, E-F) Phylum Mollusca. DISCUSIÓN Y CONCLUSIONESLos resultados de temperatura, con valores entre 28.6 y 31.6°C, se ubican cerca de los límites señalados tanto por Flores-Coto y Méndez Vargas (1982) para todo el sistema en verano (25300C), como por García-Montes (1989) para la laguna Camaronera en el mes de julio de 1986 (32-33°C) y difieren de los obtenidos por Rosales-Hoz et al. (1986) pues, aún cuando estos últimos fueron registrados durante la temporada de lluvias de 1980, la oscilación térmica entre los meses de julio y diciembre produjo variaciones hasta de 9ºC en el ambiente acuático. En lo que respecta a distribución horizontal de la salinidad, se observaron condiciones relativamente homogéneas en el área (4.4 a 63 ‰), con diferencias máximas de 2 ‰ y un régimen mesohalino de tipo "A", similar al que citan Rosales-Hoz et al. (1986) y distinto al registrado por García-Montes (1989), quien reporta para julio de 1986 un incremento drástico en la salinidad de la laguna Camaronera (14 ‰), que puede ser atribuído a cambios hidrológicos ocasionados por la apertura del canal artificial. La profundidad media del área (1.5 m) es similar a la señalada por Contreras (1985), con valores hasta de 3.20 m en las estaciones ubicadas frente a la comunicación con el mar. La transparencia en la laguna presenta un promedio numérico y porcentual de 0.40 m y 1.3% respectivamente, indicando una elevada turbiedad que, de acuerdo con el análisis efectuado por Rosales-Hoz et al. (1986), debe verse influída por la cantidad de materia orgánica en suspensión (38 a 160 mg/l), la cual es sabido que aumenta durante la temporada de lluvias. Por lo que se refiere al análisis de la comunidad de moluscos, es evidente la dominancia del gasterópodo Diastoma varium, tanto en la comunidad malacológica total como en la viva, con una abundancia máxima en la estación 13, ubicada en las proximidades del canal que une a la laguna Camaronera con Buen País. Esta zona ha sido caracterizada por Raz-Guzmán et al. (1989), mediante el análisis de los isótopos estables del carbono, dando valores medios de d13C=-16.7, derivados de la vegetación acuática. De manera que el establecimiento de praderas de Ruppia maritima se correlaciona con la presencia de Diastoma varium que, por ser una especie epifaunal sobre vegetación sumergida y de nutrición herbívora, encuentra ahí el sustrato y alimento adecuados. Es importante mencionar que esta dominancia se reflejó en valores bajos de equitatividad, con un coeficiente de determinación que explica los cambios en la diversidad de la Clase Gastropoda sólo en un 33%. Por otra parte, en la estación 1 se encontró la mayor diversidad, con 32 de las 38 especies identificadas en el área. Esta localidad presenta sedimentos de tipo limo-arcilloso, los cuales constituyen verdaderas trampas de detritus ricos en carbono orgánico (Raz-Guzmán et al. 1989), que permiten soportar poblaciones que se nutren de ellos (55% de las especies de gasterópodos). Asimismo, los sustratos blandos favorecen la presencia de formas infaunales (77.8% de las especies de bivalvos). El análisis espacial revela una distribución restringida de la mayoría de las especies, que influyó en valores bajos de similitud entre las estaciones de muestreo. Sólo Rangia cuneata se encontró ampliamente distribuída en la laguna, sin asociación aparente con otras especies, lo cual produjo una semejanza media entre 50 y 55% en las estaciones 3 a 8, 15 y 17. AgradecimientosLos autores agradecen la participación de Vicente Antolí Figuerola y Francisco Escobar de la Llata en la recolección de materiales. Asimismo, manifiestan su reconocimiento a Gerardo Barrientos Mac Gregor, por su asesoría en el manejo de programas de cómputo y por el tiempo dedicado a la elaboración de material, gráfico. LITERATURAABBOTT, R. T., American seashells. The marine Mollusca of the Atlantic and Pacific coast of North America. 2a. ed. Van Nostrand Reinhold Co., New York, 1974. 666 p. ANDREWS, J., Sea shells of the Texas coast. University of Texas Press, Austin 1971. 298 p. ANTOLÍ, V. y A. GARCÍA-CUBAS, An. Inst. Cienc. del Mar y Limnol. Sistemática y ecología de los moluscos en las lagunas cosieras Carmen y Machona, Tabasco, México. Univ. Nal. Autón. México, 1985. 145-198. 12 (1) CONTRERAS, F. Las lagunas costeras mexicanas. Centro de Ecodesarrollo, Secretaría de Pesca, D. F. 1985. 253 p. FERNÁNDEZ BUCES, N., Tesis Profesional. Variación poblacional de Discapseudes holthuisi (TANAIDACEA) (Bacescu y Gutu, 1975) en la laguna de Alvarado, Veracruz. Facultad de Ciencias, UNAM, 1989. 97 p. FLORES-COTO, C. y L. MÉNDEZ VARGAS, An. Inst. Cienc. del Mar y Limnol. Contribución al conocimiento del ictioplancton de la laguna de Alvarado, Veracruz. Univ. Nal. Autón. México, 1982. 141-160. 9 (1): GARCIA, E., Modificaciones al sistema de clasificación climática de Köppen (Para adaptarlo a las condiciones de la República Mexicana). , Ed. Enriqueta García de Miranda, 4a. ed. México, D. F., 1981. 220p. GARCÍA-CUBAS, A., Sistemática y distribución de los micromoluscos recientes de la laguna de Términos, Campeche, México. Bol. Inst. Geol. Univ. Nal. Autón. México, 1963. 1-55,24 figs., 4 láms. 67 (4): GARCÍA-CUBAS, A., An. Inst. Cienc. del Mar y Limnol. Moluscos de un sistema lagunar tropical en el sur del Golfo de México (Laguna de Términos, Campeche). Univ. Nal. Autón. México, Publ. Esp. 1981. 1-182. 5: GARCÍA-MONTES, J. F., Tesis de Maestría. Composición, distribución y estructura de las comunidades de macroinvertebrados epibénticos del sistema lagunar Alvarado, Veracruz. UACPYP-CCH-UNAM, 1989. 124 p. GÓMEZ-AGUIRRE, S., In: Mem. II Simp. Lat-Amer. Oceanogr. Biol. Univ. de Oriente, 24-28 nov. Observaciones comparativas de resultados de estudios del plancton de lagunas costeras del Golfo de México. 1975. Cumaná, Venezuela, 1977. 19-33. 1: KEEN, M. A., Sea shells of tropical west America. Marine mollusks from Baja California to Peru. Stanford University Press, 2a. ed. Stanford 1971. 1065 p., 22 láms. KREBS, J. C., Ecology: The experimental analysis of distribution and abundance. Harper International Edition, New York, 1972. 694 p. MARGALEF, D. R., Transl. from Mem Real Acad Cienc. Arts. Information theory in ecology. General systems. Barcelona, 1958. 373-449. 32: PIELOU, E. C., Ecological diversity. Ed. Wiley, New York, 1975. 165 p. PURCHON, P, D., The Biology of the Mollusca. Pergamon Press, New York, 1968. 560 p. RAZ-GUZMÁN, A., G. DE LA LANZA y L.A. SOTO, Reporte Técnico Interno. Fuentes, distribución y ó13C de la materia orgánica sedimentaria y detrito, y d13C de la vegetación de la laguna de Alvarado, Veracruz. Instituto de Ciencias del Mar y Limnología, UNAM, México, D. F., 1989. 120 p. REGUERO, M. y A. GARCÍA-CUBAS, An. Inst. Cienc. del Mar y Limnol. Moluscos, de la laguna de Alvarado, Veracruz: sistemática y ecología. Univ. Mal. Autón. México, 1989. 279-306. 16 (2): RESÉNDEZ, M. k, Rev. Soc. Mex. Hist. Nal., Estudio de los peces de la laguna de Alvarado, Veracruz, México. 1973. 183-281. 34: ROSALES-HOZ, L, A. CARRANZA-EDWARDS y U. ÁLVAREZ-RIVERA, An. Inst. Cienc. del Mar y Limnol. Sedimentological and chemical studies in sediments from Alvarado lagoon system, Veracruz, Mexico. Univ. Nal. Autón. México, 1986. 19-28. 13 (3): SHANNON, E. C. y N. WIENER, The mathematical theory of comunication. University of Illinois Press, Urbana 1963. 117 p. SIGNORET, P. M., Tesis Profesional. Contribución al conocimiento de las medusas de las lagunas de Tamiahua y Alvarado, Ver., México. Fac. de Ciencias, UNAM, 1969. 91 p. VARGAS MALDONADO, I., Informe Técnico. Estudios ecológicos básicos de las lagunas costeras del Golfo de México. Estudio ecológico de la ictiofauna de la laguna de Alvarado, Veracruz. Estructura de ha comunidades de peces para las épocas de nortes y secas. PCECBNA/UAM IZTAPAlAPA/CONACYT. 1986. VILLALOBOS, A., J. A. SUÁREZ, S. GÓMEZ, G. DE LA LANZA, M. ACEVES, F. MANRIQUE y J.CABRERA, Proc. Gulf Carib. Fish. Inst. Nineteenth Sess.: Considerations on the hidrography and productivity of Alvarado lagoon, Veracruz, México. 1966. 75-85. VILLALOBOS, A., J. CABRERA, F. MANRIQUE, GÓMEZ, V. ARENAS y G. DE LA LANZA, Lagunas Costeras un Simposio. Mem. Simp. Intern. Lagunas Costeras, Relaciones entre postlarvas planctónicas de Penaeus sp. y caracteres ambientales en la laguna de Alvarado, Veracruz, México. In: Ayala-Castañares, A. y F.G. Phleger (Eds.) UNAM-UNESCO, México, Nov. 28-30,1967: 1969. 601-620. VILLALOBOS, A., S. GÓMEZ, V. ARENAS, A. RESÉNDEZ y G. DE LA LANZA, An. Inst. Biol. Estudios hidrobiológicos en la laguna de Alvarado (Febrero-Agosto, 1966). Univ. Nal. Autón. México, Ser. Zool. 1975. 1-34. 1: LÁMINAS  Lámina 1. Fig. 1 Neritina reclivata, Fig. 2 Neritina (Vitta) virginea, Fig. 3 Hidrobia totteni Fig. 4 littoridina (Texadina) sphinctostoma, Fig. 5 Vitrinella helicoidea, Fig. 6 Cyclostremiscom (Ponocyclus) jaeneae, Fig. 7 Solariorbis (Solariorbis) infracarinata, Fig. 8 Teinostoma biscaynense, Fig. 9 Teinostoma lerema, Fig. 10 Cerithiopsis greeni, Fig. 11 Diastoma varium, Fig. 12 Triphora nigrocinta, Fig. 13 Cerithridea (Cerithideopsis) pliculosa.  Lámina 2. Fig. 14 Epitonium (Asperiscala) multistriatum, Fig. 15 Crepidula (lanacus) plana; Fig. 16 Pyrgocythara plicosa; Fig. 17 Odostomia (Odostomia) laevigata, Fig. 18 Odostomia (Menestho) impressa, Fig. 19 Turbonilla (Pyrgiscus) interrupta, Fía. 20 Acteocina canaliculata, Fig. 21 Anadara (Larkinia) transversa, Fig. 22 Ischadium recurvum, Fig. 23 Crassostrea virginica, Fig. 24 Anomia simplex, Fig. 25 Mytilopsisleucophaeata 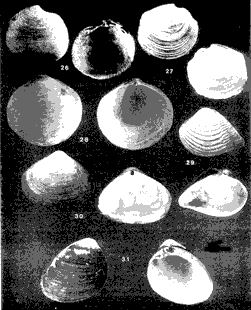 Lámina 3.Fig. 26 Lucina (Parvilucina) multilineata, Fig.27 Lucina (Phacoides) pectinata,Fig.28 Diaplodonta punctata, Fig.29 Anomalocardia auberiana, Fig. 30 Mulinia lateralis, Fig. 31 Rangia cuneata.  Lámina 4. Fig. 32 Rangia (Rangianella) flexuosa, Fig. 33 Macoma tente, Fig. 34 Macoma (Austramacoma) constricta, Fig. 35 Macoma (Psammacoma) brevifrons, Fig. 36 Semele proficua, Fig. 37 Corbula (Caryocorbula) contracta, Fig. 38 Corbula (caryocorbula) dietziana.
|

