|
ANÁLISIS DE
LA DIVERSIDAD, AMPLITUD Y TRASLAPE DEL NICHO EN LA COMUNIDAD DE PECES DEL
SISTEMA TEACAPAN-AGUA BRAVA, NAYARIT, MÉXICO
Trabajo recibido el
15 de marzo de 1990 y aceptado para su publicación el 27 de julio de
1990.
B. Alvares Rubio
F. Amezcua Linares
M. Alverez-Rubio.
Instituto de Ciencias del Mar y
Limnología, Universidad Nacional Autónoma de México,
04510, D.F. Contribución No. 684 del Instituto de Ciencias del Mar y
Limnología, UNAM.
La importancia de determinar la
estructura y función de la comunidad de peces en lagunas costeras y
estuarios, es un aspecto que incide directamente en el conocimiento del
equilibrio ecológico, y por lo tanto proporciona las bases necesarias
para un mejor y correcto aprovechamiento. La información analizada
procede de 4 colectas efectuadas con red de arrastre, chinchorro playero y
agallera, entre el verano de 1979 y la primavera de 1980. Se analiza la
diversidad (H'n) y la equitatividad (J') de la comunidad con su respectiva
varianza, así como la dominancia (1-J'). Se determina por medio de la
prueba de Kolmogorov-Smirnov, que la zona norte del sistema presenta mayor
diversidad. La amplitud y traslape del nicho de la comunidad y de las especies
tipo o dominantes, se calcula por el método de Pielou. (1975). Existen 2
periodos climáticos bien marcados por el régimen pluvial, y 2 de
transición, que en su conjunto corresponden a los 4 periodos anuales. En
verano se detecta una distribución homogénea de la diversidad,
así como un alto valor (33.0) de traslape del nicho en el canal del
estero, por la mayor interacción competitiva, dando como resultado una
comunidad de peces con tendencia a especializarse. En otoño la
diversidad es mayor (2.5) en la zona norte, y por lo tanto existe más
competencia, con altos valores de traslape en el nicho. En invierno la
diversidad es heterogenea en casi todo el sistema, principalmente en la zona
norte, donde se observa alta diversidad (1.3) y mayor competencia (17.0). En
primavera el traslape de nicho es más alto (4.0) en el norte, donde
existe alta diversidad (1.9), tal y como sucede en sistemas donde el recurso no
es una limitante. La equitatividad (J') tiende a presentar valores altos en las
4 épocas climáticas con un máximo de 0.9 en la laguna. Se
relaciona directamente con la diversidad (H'n), excepto en otoño donde
es inversa, lo que indica una relación equitativa entre los individuos y
las especies. Cuando J' se relaciona inversamente con la dominancia (1-J') es
indicativo de una fuerte competencia dentro de la comunidad. En general, la
zona norte se caracteriza por estaciones con una alta diversidad durante todo
el año y mayor traslape de nichos, mientras que en la zona sur la
diversidad y el traslape son menores y mayor la amplitud del nicho.
The
importance of determining the structure and function of the fish community in
coastal lagoons and esturies is an aspect that takes us directly into the
knowledgment of ecological balance and, therefore, suplies the essential basis
to get a propert and better utilization of them. The analyzed data were
obtained from four corrects that were performed with trawl, seine and gill net,
between the summer of 1979 and spring of 1980. The community diversity (H'n)
and abundance (J') are analyzed with their own variance, as well as the
dominance (1-J') The Kolmogorov-Smirnov test determines, that the system north
zone presents a bigger diversity. The amplitude and overlap, of the niche of
the community and dominant species, are calculated by the Pielou method (1975)
There are two climatic periodo which are very well marked by the pluvial
regulations, and two transition ones. All for them, in a whole, belong to the
four annual periods. During the summer season, an homogeneous distribution of
the diversity is detected, as well as a high value (33.0) of the overlap of the
niche in the estuary canal, due to a greater competitive interaction that
brings, a community with a specialistic trend. In the autumn the diversity is
bigger (2.5) in the north zone and therefore, there is a greater competence
with high values of overlap of the niche. In the winter, the diversity is
heterogeneus in most of the system, mainly in the north zone, with a high
diversity (1.3) and a bigger competence (17.0). In the spring, the overlap of
the niche is higher (4.0) in the north, where there is a high diversity (1.9)
such as it appens in others sistems where the research (nutrients) not reduce
the species The abundance J' tendens to present high values during the four
climatic seasons, with a maximun of 0.9 in the lagoon. It is directly related
to the diversity (H'n), exept in the autumn, were it is inversed. This shows an
equitable relationship between the individuals and species. When J' is
inversely related to the dominance (1-J'), indicates a strong competence inside
the community. In general, the north zone is caracterized by high diversity all
along the year, and the stations with a bigger overlap present in the high
diversity and a reductions of the niches, while in the south zone, the
diversity and overlap are maller and the amplitude of the niche is
bigger.
Los sistemas de lagunas costeras y estuarios son ambientes de gran importancia desde el punto de vista ecológico, biológico, pesquero y turístico. Estos ecosistemas presentan diversas características ambientales que influyen en el comportamiento de la comunidad. Muchas especies marinas utilizan las lagunas costeras como áreas de crianza, alimentación y reproducción, por lo que tales sistemas constituyen una importante dinámica en el flujo energético con el océano. Los estudios en lagunas costeras y estuarios en México tienen un especial interés debido a la producción pesquera que se obtiene de estos sistemas, de su accesibilidad y de la poca infraestructura requerida para la explotación de estos recursos (Amezcua Linares, 1972 y Yañez-Arancibia, 1980), ambos sistemas son distintos en cuanto a su formación, dinamica y ambiente (Barnes, 1981 y Mc Lusky, 1981), sin embargo recientemente se menciona que comparten características en común (Day y Yañez-Arancibia, 1982). La diversidad de la comunidad de peces en el sistema lagunar Teacapan-Agua Brava, se encuentra en estrecha relación con la época climática, y un análisis de la diversidad a diferentes niveles del ecosistema, es fundamental para estudios que implican la composición jerárquica y dominancia, ambas relacionadas estrechamente con la teoría del nicho. Grinell (1917 y 1924) fue el primero que consideró al nicho como una subdivisión del habitat, mientras que Elton (1927) lo refiere como una función de la especie. El estudio del nicho en las comunidades esta vinculado con factores como la diversidad, exclusión competitiva y distribución (Pianka, 1982). El modelo del hipervolumen del nicho de "N" dimenciones propuesto por Hutchinson (1957), es demasiado abstracto para su utilización, (Mac Arthur, 1969 y Pianka, 1982). Este último indica que las dimensiones principales para delimitar al nicho ecológico son: el habitat, el recurso (alimento) y el tiempo. Según Colwell y Douglas (1971), el recurso esta formado por: alimento y parámetros fisico-químicos. Vandermeer (1972), incluye en el habitat la temperatura, salinidad, sustrato y alimento. Debido a que los organismos habitan en comunidades en la naturaleza, y que co-existen con numerosas especies, y la escases del recurso (alimento, espacio), influye en las interacciones más frecuentes, es evidente que la teoría del nicho ecológico esta ligado al fenómeno de competencia interespecífica (Mac Arthur (1972), Ebersole (1985) y Gladfelter y Williams (1983). Dos especies no pueden ocupar el mismo nicho, sino solo parte de este, lo que da lugar a dos tipos de especies, las especialistas que explotan solo un tipo de recurso, y las generalistas que tienen la capacidad de explotar más de un recurso. Los habitat de las especies especialistas son raros, mientras que los de las generalistas son más abundantes, además de que las especialistas tienen una amplitud del nicho menor en comparación con las generalistas. Cuando dos grupos de especies interaccionan extrechamente, existe una exclusión competitiva de uno de los grupos, (Vandermer, 1972 y Pianka, 1982). Pielou (1972), menciona que las especies de una comunidad pueden co-existir, dependiendo de su capacidad y de la amplitud y el traslape del nicho de cada una de ellas. En una comunidad la amplitud y traslape del nicho esta en función de la diversidad, y se ha señalado que si no hay traslape entre las especies, la diversidad de la comunidad disminuye conforme aumenta la amplitud del nicho. Aunque también se puede presentar otro tipo de fenómeno, cuando la amplitud del nicho es constante y tiende a disminuir la diversidad. En los trópicos, la diversidad es mayor cuando la amplitud del nicho es menor (Krebs, 1978 y Colinvaux, 1982). Objetivos1. Determinar la diversidad espacio-temporal de la comunidad de peces del sistema lagunar Teacapan Agua Brava, Nayarit. 2. Determinar la amplitud y traslape del nicho de la comunidad, de las especies dominantes y su relación con la diversidad. HipótesisEn la parte norte del sistema existe un ambiente poco variable, con alta diversidad y baja dominancia, por lo que se puede esperar que la comunidad presente mayor traslape de nicho y menor amplitud, mientras que en la parte sur, existe menor diversidad, alta dominancia y ambiente variable, y por lo tanto menor traslape, con tendencia a incrementar la amplitud del nicho. ÁREA DE ESTUDIOEl complejo lagunar Teacapan Agua Brava, esta localizado al noroeste de México, entre los paralelos 220 04' y 220 35' latitud norte, y los meridianos 1050 20' y 1050 50' de latitud oeste. El sistema se encuentra entre los límites de los estados de Nayarit y Sinaloa donde son abundantes lagunetas, esteros y marismas (Curray et al, 1969), al norte esta limitado con el estero del Mezcal y el de Agua Grande, Sinaloa, al sur con las marismas de Canoas y la laguna de Pericos, Nayarit, (Amezcua Linares, 1972). El clima de la región es subtropical a tropical de tipo Aw o (w) (e) según el sistema de Köepen modificado por García (1973). La temperatura promedio anual es de 250C, con precipitaciones de 800 mm en el norte de Mazatlán, de 1200 mm en Tepic y de 1660 mm en la costa sur, cerca de San Blas (Curray et al, 1969). En la Boca de Teacapan, Parte Baja del Estero y Canal del Estero, se observan los valores más bajos de temperatura, evaporación y precipitación mientras que en la Laguna se presentan los más altos durante la época de secas (primavera y parte de verano). En otoño, época de lluvias, disminuye la temperatura y la evaporación, al aumentar las precipitaciones. El invierno se caracteriza por los rangos más bajos de temperatura y evaporación. En el bosque de manglar predomina, Rizophora mangle, principalmente en la región sur, y es uno de los principales productores primarios, lo que representa una fuente importante de alimento para la comunidad (Rollet, 1974 y Flores Verdugo et al 1987). Según Alvarez-Rubio, et al (1986), el complejo lagunar esta geográfica y ambientalmente dividido en cinco regiones (Fig.1): 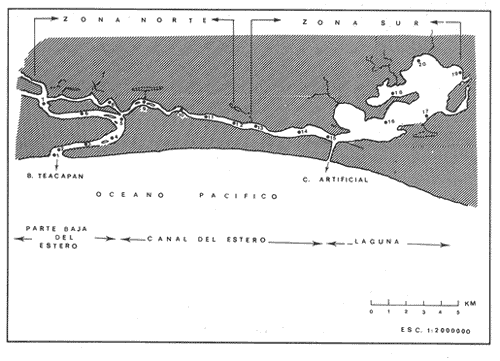 Figura 1. Mapa del Sistema lagunar con las estaciones de muestreo y las Zonas Geográficas. Boca de Teacapan ( estaciones 1 y 2). Parte Baja del Estero (estaciones 3 - 6). Canal del Estero (estaciones 7 - 14). Boca de Cuautla (estación 15). Laguna (estaciones 16 - 20). ANTECEDENTESEn el sistema Teacapan Agua Brava, se han efectuado diversos estudios generales y de comunidades de peces, entre los que destacan Gómez-Aguirre (1971), Nuñez (1973), Rollet (1974), Cepeda (1977) y Carranza y Amezcua Linares (1971), Amezcua Linares (1972), Alvarez Rubioet al (1986) y Amezcua Linares et al (1987). No existen antecedentes específicos sobre el análisis del bicho en sistemas costeros tropicales mexicanos, a excepción de algunos que abordan generalidades como el de Warburton (1978). En relación a ecosistemas acuáticos y comunidades de peces en otras latitudes, se puede mencionar a Headrich y Headrich (1974), Houston (1979), Gladfelter y Williams (1983), Washington (1984) y Ebersole (1985). Otros abordan aspectos teóricos: Lawlor (1980), Petraitis (1981), Feinsinger et al (1981) y Smith y Zaret (1982); y de comunidades terrestres como Pielou (1972) y Miller (1980). MATERIAL Y MÉTODOSSe efectuaron colectas diurnas en 20 estaciones repartidas en las 5 regiones del sistema: Boca de Teacapan, Parte Baja del Estero, Canal del Estero, Boca de Cuautla y Laguna. Para lo cual se utilizó una lancha de 5 m de eslora con motor fuera de borda de 40 hp. y tres artes de pesca: red de arrastre con 13 m de longitud, 5 m de amplitud de boca, 2.5 m de abertura de trabajo y malla de 6.2 cm; chinchorro playero con bolsa de 42.5 m de largo, 3.6 m de alto y malla de 2.5 cm; y red agallera de 60 m de largo, 2.5 de alto y luz de malla de 5 cm. En algunas estaciones no fue posible utilizar las tres artes de pesca, y en cada una de ellas se midió la temperatura, salinidad y oxígeno, en la superficie y fondo. La diversidad de especie H'n, el sesgo E (H'n), la varianza var(H'n); la equitatividad (J'), la varianza var(J) y los intervalos de confianza al 95% se calcularon en base a Miller (1980). Para el cálculo de la amplitud HA(B) y traslape HB(A) de nicho, se utilizó el índice de Brillouin, según Pielou (1975 y 1977), el cual es apropiado para comunidades censadas, ya que que las capturas efectuadas con las artes de pesca se consideraron como poblaciones censadas con el propósito de evitar utilizar la medición del nicho estandarizado por medio del índice de Shannon, mientras que el índice utilizado tiene la propiedad de quedar libre de errores de muestreo (Pielou op cit) provenientes de la selectividad de las artes de pesca. La dimensión del nicho, se definió en base a un análisis de conglomerado con el fin de clasificar el habitat, donde se consideraron variables fisicoquímicas como salinidad, temperatura, oxígeno, transparencia, profundidad y sedimentos, así como variables biológicas. RESULTADOS
VERANOLa equitatividad o abundancia relativa J', tiene una correlación positiva con la diversidad de especie H'n, y es mayor en la zona sur, en el Canal del Estero, Laguna y en algunos sitios de la Parte Baja del Estero. Esto indica una tendencia de los individuos a repartirse equitativamente en las especies, cuando la diversidad es menor (Fig. 2). Tramer (1969) confirma esta idea, sin embargo a veces es posible encontrar una correlación negativa como en las estaciones 11, 13 y 14, lo que se debe a una mayor cantidad de individuos en alguna(s) especie(s). La dominancia es un parámetro que está estrechamente relacionado con la diversidad (Mc Arthur, 1969 y Douglas, 1981). El valor más bajo se presenta en la Parte Baja del Estero y Parte del Canal, (Fig. 2). Esta variabilidad tan marcada entre la zona sur y norte es debida a una barrera hidrológica causada por la salinidad que fluctua de acuerdo al régimen climático, ocasionando una redistribución de las especies. 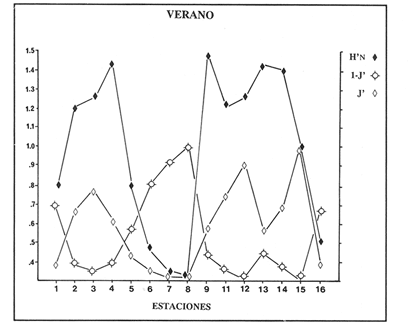 Figura 2. Gráfica de la diversidad de especies H'n, abundancia (J) y dominancia (I- J') en verano. La varianza del índice de diversidad var(H'n), se incrementa en el sur del sistema, es decir hacia los sitios con menor diversidad, mientras que en el norte decrece la varianza y aumenta la diversidad (Fig. 2). La equitatividad var(J'), presenta fluctuaciones irregulares y sigue un patrón similar al de var(H'n), en general los valores altos se tienen en la Boca de Teacapán y cerca de la Laguna, con un intervalo del 95% de confianza para cada estación (Tabla 1). También se observa que las fluctuaciones en la varianza de H'n y de J' pueden deberse a la selectividad en las artes de pesca durante el muestreo, y a la mayor o menor diversidad en cada estación. Los factores abióticos también influyen en la varianza de H'n y J' de acuerdo a la amplitud del nicho de las especies, lo que se manifiesta en una alta o baja competencia. La prueba de comparación para dos muestras de Kolmogorov-Smirnov, (Conover, 1980 y Steel y Torrie, 1985), estableció que existe una diferencia significativa, (P < 0.05), bajo la hipótesis (Ho), de que la diversidad H'n es mayor en la zona norte que en la sur, por lo que esta zona tiene menor diversidad (Tabla 2). Esta diferencia se puede atribuir a la variación salina y a que la macrofauna tiende a dispersarse en favor de este gradiente. Esto es esencial para la dinámica de muchas especies carnívoras, que utilizan a otras especies como parte de su dieta. También puede influir el tipo de sustrato, donde viven una gran variedad de organismos (Reid y Wood, 1976; Barnes, 1981 y Mc Luscky, 1981). Amplitud y Traslape del NichoEl traslape del nicho HB(A) presenta valores altos en el Canal del estero, zona norte e inicio de la zona sur (Fig. 1), donde empiezan a disminuir a partir de las estaciones 11, 12 y 14. En la zona norte, Boca de Teacapán y Parte Baja del Estero, este se mantiene homogeneo hasta la estación 6. En cuanto al número de especies (diversidad alfa), se observa una correlación positiva con el traslape del nicho HB(A) en las estaciones 11, 12, 13 y 14 y negativas en las estaciones 6, 7, 8, 9, 15 y 16. Este tipo de correlación se debe a la disminución o el incremento del número de especies. En la figura 3 se presentan los valores de amplitud HA(B) y traslape HB(A), que son la sumatoria de los valores de todas las especies en un habitat, además se suman los individuas de las especies estandarizando todas las estaciones, como es el caso de la estación 8, con una especie y la estación 9 con 13 especies, donde se presentan valores no esperados, pero a nivel de habitat son valores reales. 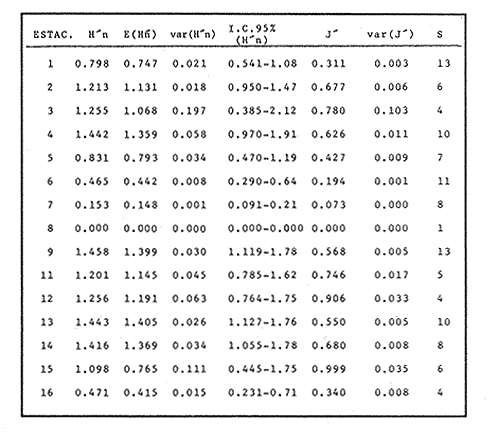 TABLA 1 DIVERSIDAD (H´N). RIQUEZA DE ESPECIES (S) E IGUALDAD DE ESPECIES (J´) EN VERANO 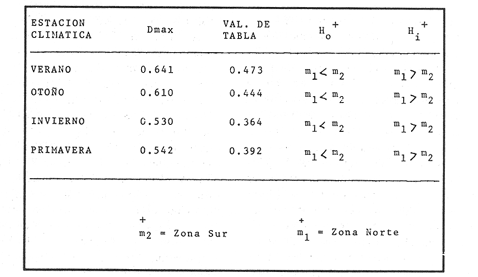 TABLA 2 ANÁLISIS COMPARATIVO DE LA DIVERSIDAD DE ESPECIE DE LA ZONA NORTE Y SUR, PARA DOS MUESTRAS DE KOLMOGOROV-SMIRNOV, DE LA COMUNIDAD DE PECES, DEL SISTEMA TEACAPAN AGUA-BRAVA, NAYARIT Entre la amplitud HA(B) y el traslape del nicho existe una correlación negativa en las estaciones 7, 8, 9 y 15 (Fig. 3), así cuando hay una tendencia a valores altos en el traslape del nicho, existe una mayor competencia, lo que hace que la amplitud HA(B) se reduzca, determinando un máximo grado de explotación del recurso, es decir que se tiende a la especialización (Kloper y Mac Arthur, 1960). En caso de existir correlaciones positivas, se observa que a menor traslape del nicho HB(A), menor es la amplitud HA(B), estaciones 11, 12 y 14 (Fig. 3). Según Guiller (1984), la disminución del traslape en forma positiva junto con la amplitud, se debe a la abundancia de alimento, y por lo tanto existe menor competencia interespecífica. En general, en las estaciones con mayor traslape, se presenta una mayor competencia, por lo que tienden a la reducción del nicho. Esto sucede en la zona norte: parte media del canal, parte baja y canal del estero, donde existe menor variabilidad salina en el año. Amplitud y Traslape del Nicho en Especies DominantesLa distribución y abundancia de las especies dominantes en el sistema, se debe principalmente a su capacidad adaptativa en cada uno de los habitat que conforman los dos tipos de ambientes (Fig. 1). Esta distribución se encuentra relacionada con el nicho trófico y la co-existencia de las especies, que determina el grado de interacción entre ellas (Pielou, 1971 y 1975, Miller, 1980). Para la mayoría de las especies que tienen poca capacidad de adaptación, la salinidad funciona como barrera hidrológica y evita su dispersión. Por esto, especies eurialinas son frecuentes en comunidades de litorales costeros y llegan a ser dominantes. 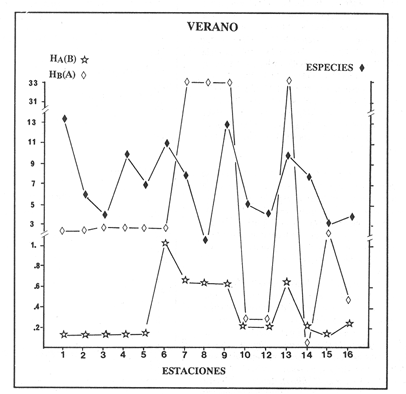 Figura 3. Gráfica del número de especies (SP.), amplitud HA(B) y traslape del nicho HB(A) en verano. Las siguientes especies son las más importantes en el sistema por su frecuencia y abundancia durante el ciclo anual: Verano: Achirus mazatlanus, Citharichthys gilberti y Mugil curema Otoño: Mugil curema, Eugerres axillaris y Arius liropus Invierno: Citharichthys gilberti, Achirus mazatlanus Mugil curema y Diapterus peruvianus. Primavera: Centropomus robalito, Arius liropus, Mugil curema y Diapterus peruvianus. En verano, la salinidad, tiene un rango de 30 a 36% en todo el sistema y se observa que A. mazatlanus, C. gilberti y M. curema tienen una distribución regular en todo el sistema, con excepción de algunas estaciones, en que no aparecen (Fig, 4 a-c). A. mazatlanus tiene una amplia distribución en el sistema a favor del gradiente salino, sus hábitos alimenticios son preferentemente carnívoros (Amezcua Linares, 1972 y Yáñez-Arancibia, 1978). En la figura 4 se observan variaciones del traslape del nicho HB(A), la zona sur con bajos valores (0.004). En la parte media del canal del estero, estaciones 11 y 12, se presentan valores máximos (1.0) donde la especie tiene más interacciones con el resto de la comunidad, con una mayor intensidad de competencia debido a que dos o más especies no pueden ocupar el mismo nicho (Odum, 1972, Pielou, 1975 y Pianka, 1982). La amplitud del nicho HA(B) de A. mazatlanus se mantiene constante en todo el sistema, y tiende a explotar al máximo su recurso (espacio y alimento), por lo que tiende a ser especialista con valores de traslape HB(A), menores que la amplitud HB(B), estaciones 11 y 12, por lo que independientemente de que el recurso sea menor o mayor, siempre tiene a explotar la misma cantidad (Fig. 4a). Citharichthys gilberti, utiliza las lagunas costeras para completar su ciclo de vida y se alimenta de peces pequeños. Esta especie presenta un traslape de nicho HB(A) muy similar a A. mazatlanus (Fig. 4a), utilizando solo una parte del nicho por lo que existe una competencia. En el caso de la amplitud del nicho HA(B), que mide el grado de especialización de la especie, se observa que presenta una correlación negativa HB(A), así cuando existe una mayor competencia por el recurso, C. gilberti tiende a explotarlo al máximo y cuando el traslape es menor la competencia baja, por lo que la amplitud del nicho HA(B) aumenta y la competencia disminuye (Fig. 4a). 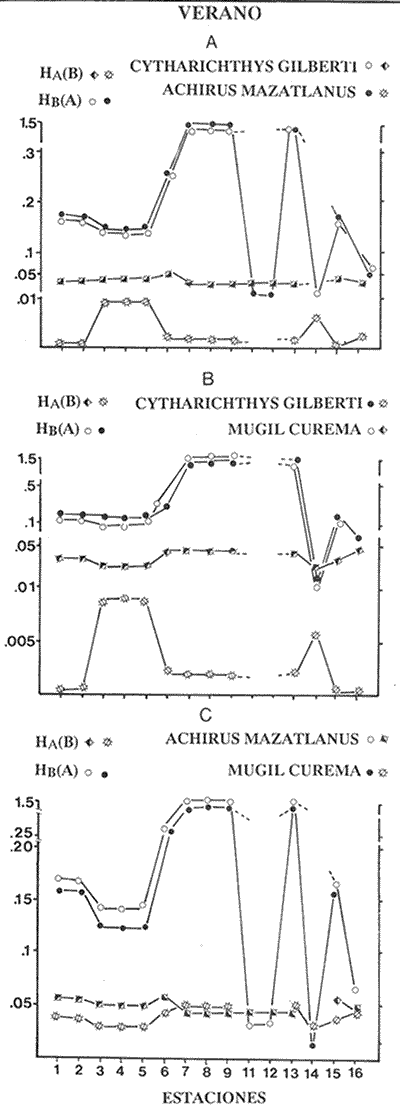 Figura 4. Gráfica de la amplitud HA(B) y traslape del nicho HB(A) de algunas especies dominantes en verano. Mugil curema se distribuye en todo el sistema y su alimento consiste en detritus y algas. El traslape del nicho HB(A) es similar a C. gilberti (Fig. 4b) y en menor grado a A. mazatlanus. En la parte baja del estero y en el resto del sistema M. curema compite más por el espacio que por alimento (Fig. 4c). La amplitud del nicho HA(B) de M. curema tiende a comportarse en forma positiva con el traslape HB(A), así cuando aumenta el traslape del nicho, se incrementa la amplitud y vicerversa (Figura 4c). Este parámetro HA(B) tiende a ser similar conA. mazatlanus, cuyos valores son mayores en la Parte Baja del Estero y menores a partir de la estación 7. OTOÑOEn la equitatividad (J), se observa una correlación negativa con respecto al de diversidad de especies H'n, excepto en verano que tiende a una correlación positiva. Esta correlación negativa puede deberse a que existe una desigualdad en la repartición de los individuos de las especies (Tramer, 1969). En la zona norte se observan con mayor intensidad las correlaciones negativas (Fig. 5), esta relación entre H'n y J', ha sido descrita por Alvarez-Rubio et al (1986). Douglas (1981) indica que para estos dos parámetros pueden influir factores como la competencia y predación. La dominancia (1-J'), presenta una correlación negativa con respecto a la equitatividad (J') en todo el sistema y positiva con el índice de diversidad en la Boca de Teacapán y Parte Baja del Estero, salvo algunas estaciones (Fig. 5). Conforme aumenta la diversidad en esta zona, también se incrementa la dominancia y viceversa, es decir que a mayor diversidad menor dominancia. Esto no siempre sucede, como lo ha demostrado Mac Arthur (1969), para sistemas terrestres. Los sistemas acuáticos son más inestables que los terrestres y la amplitud depende del nicho de cada especie. Por lo que se refiere a la zona sur (Canal del Estero y Laguna), se tiene una correlación negativa entre los parámetros 1-J' y H'n, así a mayor diversidad menor dominancia y viceversa (Mac Arthur, 1969 y Douglas, 1981). En el análisis de la tabla 3, se observa que la varianza del índice de diversidad var(H'n), es alto en la mayoría del sistema, a excepción de las estaciones que presentan alta diversidad. En la varianza de la equitatividad var(J') el comportamiento es similar a var(H'n), y se observa que a mayor equitatividad menor varianza. En el cálculo de intervalos de confianza de la diversidad existe el 95% de confianza de que en muestreos sucesivos se obtenga una diversidad dentro de ese intervalo (Tabla 3). Estas fluctuaciones de var(H') y var(J'), se puede deber a la selectividad de las redes y la diversidad ambiental, ya que esta depende de factores tanto bióticos, como abióticos, provocando interacciones como la competencia y co-existencia de las especies, de acuerdo al régimen climático. La diversidad en la zona norte y la sur muestra una diferencia significativa (P < 0.05), por lo que la diversidad en la zona norte es mayor en relación a la sur. Esta diferencia se atribuye al gradiente salino que existe en esta época, donde en la zona sur predominan condiciones principalmente dulceacuícolas. Esto indirectamente afecta a otros organismos como la fauna bentónica, que le sirve de alimento a los peces, desplazándose en función de la dinámica de estos organismos (Reid y Wood, 1976, Barnes, 1981 y Mc Luscky, 1981). 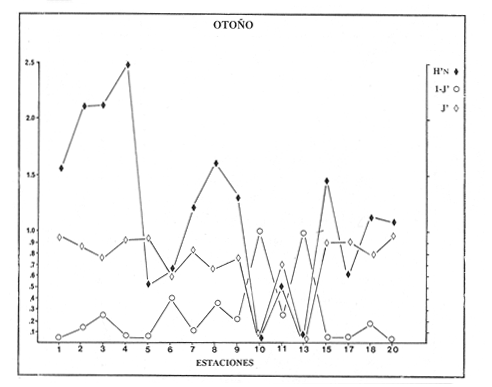 Figura 5. Gráfica de diversidad de especies H'n. abundancia (J') y dominancia (I-J) en otoño. Amplitud y Traslape del NichoEn esta época la salinidad es un factor importante en la dispersión de las especies, de acuerdo a su capacidad de adaptación. La presencia de agua dulce en la zona sur del sistema, ocasiona que el traslape del nicho HB(A) descienda hasta 0.04. Los cambios por el efecto del agua dulce son mayores en esta zona del sistema, por lo que las relaciones interespecíficas son menores, y por lo tanto el traslape del nicho HB(A) desciende hasta 0.04, dando lugar a un menor número de especies, por el contrario en la zona norte se incrementan, como en la estación 3, con 19 especies y en la estación 4 con 14 (Fig. 6), De este modo se incrementan las interacciones entre las especies, y se establece una correlación positiva entre el número de especies y la competencia interespecífica (Cowell y Futuyama, 1971 y Colinvaux, 1982); es decir que entre más especies, existe un mayor número de nichos, incrementándose la competencia por espacio y/o alimento. En el caso del Canal de Estero y Laguna el valor de la diversidad alfa es menor, mientras que el traslape desciende rápidamente con algunas fluctuaciones, y se puede establecer que a menor número de especies, menor es la competencia, con mayor co-existencia entre estas, y por lo tanto un traslape alto, aunque existen estaciones en las que no se registran especies (Fig. 6). 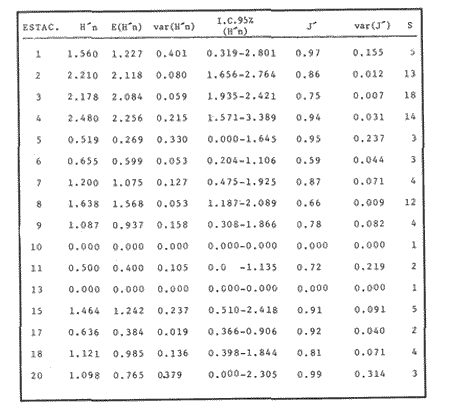 TABLA 3 DIVERSIDAD (H'n), RIQUEZA DE ESPECIES (S) E IGUALDAD DE ESPECIES (J') EN OTOÑO 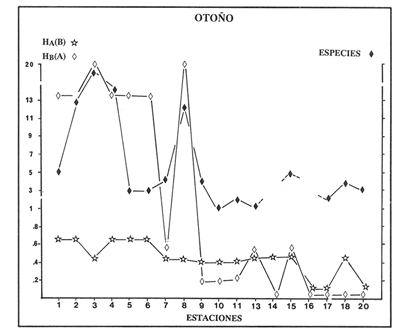 Figura 6. Gráfica del número de especies (SP), amplitud HA(B) y traslape del nicho HB(A) en otoño. En la amplitud del nicho HA(B), que es un evaluador del grado de especialización o generalización de las especies (Pielou, 1972 y 1975 y Miller, 1980), el comportamiento esta relacionado con el traslape HB(A), con una correlación negativa en todo el sistema. En la Parte Baja y Parte del Canal del Estero, especialmente hasta la estación 9, (Fig. 6), es posible observar una relación directa entre el traslape y la competencia, ya que cuando ambos se incrementan, se reducen los nichos. De esto se deduce que las especies tienden a ser especialistas, o sea que explotan más de un recurso (Miller, 1980, Pianka, 1981 y Ebersole, 1985). En el área entre el Canal del Estero y Laguna, la amplitud del nicho HA(B) es mayor que el traslape HB(A), y se observa una menor competencia entre las especies, por lo que se puede determinar un comportamiento generalista donde se explota más de un nicho (Ebersole, 1985 y Vandermeer, 1972). Amplitud y Traslape del Nicho en Especies DominantesEn otoño, la barrera hidrológica limita la dispersión de las especies, solo algunas se distribuyen ampliamente en el sistema evitando la competencia y depredación. Las especies dominantes en esta época, tienen una amplia dispersión, con excepción de algunas estaciones, esto obedece a cuestiones aleatorias más que a ausencia de ejemplares (Fig. 7a, b, c). De acuerdo a su distribución y hábitos alimenticios en verano, Mugil curema presenta su mayor traslape de nicho HB(A) en la Boca de Teacapan y Parte Baja del Estero, mientras que en otoño se encuentra principalmente en la parte media del Canal del Estero, donde alcanza valores altos de traslape, estación 1 a la 16, con excepción de la estación 7, 9 y 15 (Fig. 7a, b y e), donde existe menor competencia. El traslape de nicho HB(A) deM. curema no es tan alto como en verano (1.0), el máximo valor es de 0.8 y el mínimo de 0.5 (Fig. 7 a), por lo cual la competencia por espacio y alimento es menor. Algo similar ha sido establecido en otras investigaciones (Ebersole, 1985). La amplitud del nicho HA(B), que en cierta manera calcula el grado de especialización de la especie, tiende a una correlación negativa entre HB(A) y HA(B) (Fig. 7a), observándose que cuando hay más competencia la amplitud tiende a descender. Esto es más notable en la mitad del canal del estero donde es mayor la amplitud del nicho HA(B), que el traslape HB(A), determinándose que en esta zona, M. curema tiende a ser menos especialista, describiendo un comportamiento similar al de verano (Fig. 4b y c). 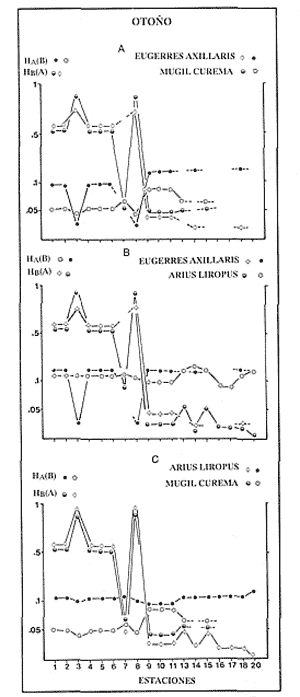 Figura 7. Gráfica de ala amplitud HA(B) y traslape del nicho HB(A) de algunas especies dominantes en otoño. Eugerres axillaris se dispersa en todo el sistema, es una especie omnívora y su comportamiento es similar a M. curema en lugares como en la Boca de Teacapán y Parte Baja y Canal del Estero hasta la estación 11, donde se observa que el traslape y la competencia disminuyen. En la amplitud HA(B) y traslape HB(A), se observa una correlación positiva, así cuando es mayor el traslape, aumenta el valor de la amplitud del nicho (Fig.4a). En general el comportamiento de esta especie tiende a la especialización. Arius liropus permanece en todo el sistema, se alimenta de pequeños peces, macroinvertebrados y restos de vegetales, (Amezcua Linares, 1972). Se comporta en forma similar a E. axillaris y M. curema aunque el menor traslape de nicho HB (A) se presenta en la Boca de Teacapan y Parte Baja del Estero, disminuyendo en el Canal cerca de la Laguna. Entre A. liropus y M. curema existe mayor competencia interespecífica por espacio y alimento. La amplitud del nicho se mantiene constante en todo el sistema, solo con pequeñas fluctuaciones en la el sur (Fig. 7b y c). Esta época es crítica para las especies marinas por los bajos valores de salinidad que constituyen una barrera hidrológica que limita su distribución y evidencia dos zonas, la norte integrada por la Parte Baja del Estero y el Canal, donde existe fuerte competencia por el recurso y la zona sur que comprende la Laguna con menor competencia. En ambas zonas existe reducción de nichos y tendencia a explotar el recurso al máximo. Según Giller (1984), cuando el alimento decrece, la amplitud del nicho disminuye, y solo especies con capacidad adaptativa para ocupar ambos ambientes tienen amplio desplazamiento, evitando la competencia. Esto constituye una tendencia evolutiva y separación de nichos (Pianka, 1982 y Guiller, 1984). INVIERNOEsta época se caracteriza por presentar ambiente típicamente marino al disminuir el aporte fluvial. Los parámetros de H'n y J' presentan correlaciones positiva y negativa (Fig. 1). En la zona norte existe una correlación positiva que presenta una repartición de individuos equitativamente con las especies, y una diversidad baja (H'n). La correlación negativa se encuentra principalmente en la zona sur, donde las individuos tienden a repartirse desigualmente en las especies, y por lo tanto existe una tendencia a elevar la diversidad (Tramer, 1969) (Fig. 8). En los parámetros de abundancia, J y dominancia 1-J', la correlación es negativa, presentando mayor abundancia en la Parte Baja y Parte del Canal del Estero, donde existe una mayor depredación y competencia (Douglas, 1981 y Miller, 1980), con excepción de algunas estaciones que presentan una mayor dominancia 1J' (10 y 16), donde se observa una estrecha relación con la diversidad (Fig. 8). Así, a mayor dominancia, existe una menor diversidad (Mac Arthur, 1969 y Douglas, 1981). En la tabla 4, se observa que la varianza del índice de diversidad var(H'n), tiene valores desde 0.011 a 0.164 en la parte sur del sistema, donde los valores de la diversidad y el número de especies son menores (Fig. 9), en comparación con la Parte Baja y Canal del Estero, donde existe menor varianza, de 0.003 a 0.089. En general, los valores bajos se presentan en la Parte Baja del Estero y los más altos en la Laguna. Los intervalos de confianza de H'n fueron calculados con una confianza del 95% (Tabla 4). La irregularidad en la var (H') y var (J'), puede ser explicada en base a factores como la selectividad en el arte de pesca y la variabilidad de los parámetros ambientales, que pueden afectar la diversidad, e influyen en una alta o baja competencia. La prueba de Kolrnogorov-Smirnov (Steel y Torrie, 1985 y Conover, 1980) demuestra en la zona norte y sur (Tabla 2), que existe una diferencia significativa en la diversidad (P < 0.05), y concluyendo que la zona norte tiene mayor diversidad. Esto se puede atribuir a los efectos dulceacuícolas que persisten desde otoño, al sustrato, la cantidad y distribución de organismos (Reid y Wood, 1976, Barnes, 1981 y McLusky, 1981). Amplitud y Traslape del NichoEn esta época el traslape HB(A) es mayor en la Boca de Teacapán y Parte Baja del Estero, con un valor 16.1 a partir del Canal del Estero hasta la laguna, donde decrece (Fig. 9). La diversidad alfa, número de especies por estación, tiende a mantenerse constante desde la Boca de Teacapán y la Parte Baja del Estero, con pequeñas fluctuaciones, un mínimo de siete especies y máximo de ocho. Estas especies interaccionan ocasionando una mayor competencia interespecífica tanto en alimento, como en espacio (Fig. 9). En la zona sur, Canal del estero y Laguna, se tienen valores menores de traslape HB(A), existiendo un mayor número de especies (3 a 16) (Fig. 9), y se observan correlaciones positivas y negativas, entre mayor es el número de especies, es posible esperar una mayor competencia (Whittaker, 1972, Ebersole, 1985). 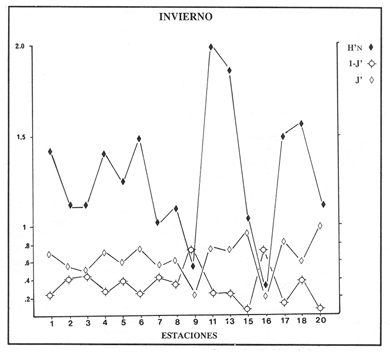 Figura 8. Gráfica de diversidad de especies H'n, abundancia (J') y domina (I-J') en invierno. 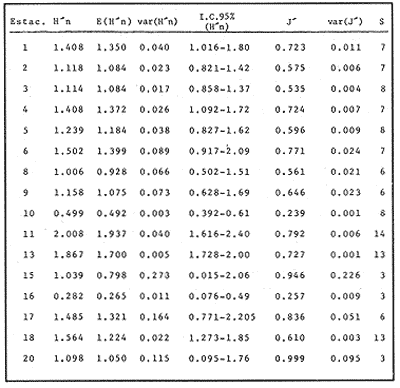 TABLA 4 DIVERSIDAD (H'n), RIQUEZA DE ESPECIES (S) E IGUALDAD DE ESPECIES (J') EN INVIERNO La amplitud del nicho HA(B), tiene un comportamiento similar al traslape HB(A), con correlaciones principalmente positivas, ya que a valores altos de traslape, mayor es la amplitud (Fig. 9). Esto no concuerda con lo esperado, sin embargo no siempre es posible encontrar una relación inversa. Gorman (1979), en un análisis del nicho en mamíferos, hace mención sobre la relación positiva, indicando que se debe principalmente a la abundancia del alimento. Amplitud y Traslape del Nicho de Especies DominantesEl invierno se caracteriza por un incremento de la salinidad en todo el sistema, con rangos de 25.3 a 36.6 %. Cyiharichihys gilberti. Es un consumidor de tercer orden con amplia distribución en el sistema. En la figura 10a, se observa que el traslape del nicho HB(A) es mayor hacia la Boca de Teacapán y Parte Baja del Estero, a diferencia de verano que corresponde a la parte media del Canal del Estero (Fig. 4a). En la parte sur del sistema tiende a disminuir HB(A) con pequeñas fluctuaciones, y existe una tendencia a incrementar la competencia en todo el sistema y con un mayor gasto de energía en la zona norte, que corresponde a las estaciones 1 a la 10. El parámetro que mide el grado de especialización es la amplitud del nicho HA(B), por lo que este se mantiene uniforme en todo el sistema y la especie tiende a explotar al máximo el recurso, ya que en los valores cercanos a cero indican una tendencia a ser especialista (Pielou, 1972, Hurlbert, 1978 y Miller, 1980) (Fig. 10a). Es posible visualizar una diferencia entre verano que presenta correlación negativa en el traslape (Fig. 4a), y el invierno que tiende a ser constante en todo el sistema con pequeñas correlaciones positivas, ocasionadas por la abundancia del alimento (Gorman, 1979). Achirus mazatlanus es una especie carnívora, aunque algunas veces consume detritus. Su traslape, de nicho HB(A), es similar a la de C. gilberti con valores máximos en la Boca de Teacapán y Parte Baja del Estero, donde se observa una mayor competencia. 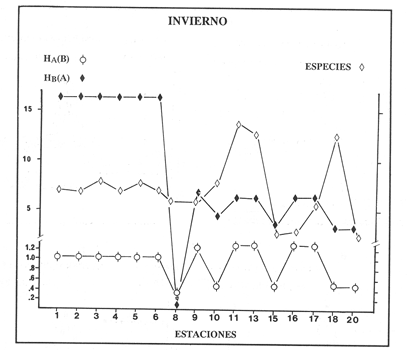 Figura 9. Gráfica del número de especies (SP), amplitud HA(B) y traslape del nicho HB(A) en invierno. El menor traslape de nicho es en la zona sur, donde aparentemente existe una mayor co-existencia entre los nichos de las especies. Ebersole (1985) en su análisis de la separación del nicho, menciona que cuando no hay co-existencia, existe una mayor competencia por el recurso y que ésta es responsable de la evolución y separación de los nichos ecológicos. La amplitud del nicho HA(B), paraA. mazatlanus es mayor que para C. gilberti (Fig. 10a), con pequeñas fluctuaciones en la laguna. En la primera, aunque su amplitud es mayor, tiende a un comportamiento especial. En la laguna se observa mejor esta tendencia, explotando al máximo el recurso. Este comportamiento es similar en el verano (Fig. 4a). Mugil curema se encuentra en todo el sistema, existe una mayor competencia en la zona norte que corresponde a la Parte Baja del Estero, con valor de traslape de 0.5, que a partir de la estación 8 se reduce (Fig. 10b), a diferencia del verano en que los valores altos de traslape del nicho HB(A) se presentan en la Parte baja del Estero (Fig. 4b). En otoño existe mayor traslape en esta área (Fig. 7a), mientras que en invierno la competencia de M. curema es afectada porA. mazatlanus, que tiene un mayor traslape HB(A) en la Boca de Teacapán y Parte Baja del estero, en tanto que en la zona sur desciende (Fig. 10b). C. gilberti tiene un traslape mayor que M. curema en la Parte Baja del estero, mientras que en la Parte media del Canal es similar. La amplitud del nicho HA(B), en esta especie tiende a presentar correlación negativa con respecto al traslape HB(A). En la Parte media del Canal del estero y Laguna se observa que existen valores más altos de amplitud del nicho HA(B), que de traslape HB(A) (Fig. 10d), existiendo un menor grado de competencia y por tanto una mayor amplitud del nicho. M. curema tiene mayor amplitud del nicho que A. mazatlanus, debido a que esta última aprovecha mejor el recurso, por lo que aquella tiende a aumentar su amplitud en la zona sur del sistema con algunas variaciones (Fig. 10b). En C. gilberti, la amplitud del nicho es mayor queM. curema (Fig. 10d), ambas explotan el recurso al máximo. 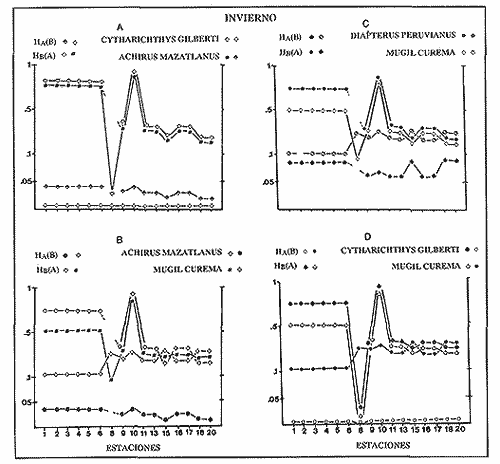 Figura 10. Gráfica de la amplitud HA(B) y traslape del nicho HB(A) de algunas especies dominantes en invierno. En general M. curema, tiene un traslape del nicho HB(A), menor que C. gilberti y A. mazatlanus, existiendo menor competencia entre estas últimas especies por alimento, de acuerdo a sus hábitos alimenticios. Por esto, la amplitud del nicho HA(B) deM. curema es más amplio, ya que lo comparte con el resto de las especies de la comunidad. Diapterus peruvianus presenta un traslape de nicho HB(A) de 0.7, sin llegar a una alta competencia en las Bocas, Parte Baja y Canal del Estero. En la Laguna este valor desciende a 0.2 con fluctuaciones irregulares, por lo que la competencia es menor en relación al resto de la comunidad. El traslape HB(A) de M. curema es mayor en la Parte Baja del Canal del Estero, mientras que en la Laguna tiende a ser similar. La amplitud del nicho en D. peruvianus HA(B) presenta una correlación negativa entre HB(A) y HA(B). En la Parte Baja del Estero, el valor se mantiene uniforme entre esta especie y M. curema, mientras que en la zona sur se presentan pequeñas variaciones, entre 0.2 y 03, en ambas especies (Fig. 10c). En general, esta época se caracteriza por la máxima interacción de especies en la Boca de Teacapán y Parte Baja del estero y mínima en la parte media del Canal del Estero y Laguna, semejante a otoño (Fig. 7), pero diferente a verano, donde el traslape es mayor en la parte media del Canal del Estero (Fig. 4). PRIMAVERALa época de secas se caracteriza por un ambiente marino al disminuir el aporte fluvial al mínimo, los valores salinos son altos y en áreas someras como la Laguna donde suelen ser hipersalinos (Alvarez-Rubio et al,1986). En este ambiente la dinámica del ecosistema cambia radicalmente con respecto a las otras épocas del año. En este periodo no existe barrera hidrológica que impida la dispersión de las especies de origen marino, lo que ocasiona una tendencia a la uniformidad de la diversidad. En la diversidad de especie H'n y de equitatividad J', se observan tanto correlaciones positivas como negativas, en la Parte Baja del Estero se presentan principalmente correlaciones positivas, porque los individuos tienden a repartirse en forma equitativa dentro de las especies. A partir de la parte media del Canal del Estero se observan correlaciones negativas, debido a los altos valores de diversidad (Fig. 11) y porque los individuos no se reparten en forma equitativa entre las especies (Tramer, 1969). En esta época se presenta la menor dominancia de todo el sistema, con excepción de la estación 2, donde se observan altos valores de diversidad (Fig. 11), lo que indica una tendencia de aumento de la competencia, la que depende a su vez del traslape del nicho de las especies. Analizando la tabla 4, se observa en todo el sistema una var(H'n) heterogenea, principalmente por las fluctuaciones de la diversidad que se presentan en una estación con respecto a otra, teniendo valores desde 0.025 a 0.433. En el caso de var (J') las fluctuaciones son irregulares y siguen un patrón semejante a var(H'n). Los cálculos del intervalo de confianza fueron de 95% (Tabla 4). Las fluctuaciones pueden deberse a la selectividad del arte de pesca, factores ambientales y la amplitud del nicho en las especies. La comparación de la diversidad entre la zona norte y sur (Tabla 2), por medio de la prueba de Kolmogorov-Smirnov (Steel y Torrie, 1985 y Conover, 1980), establece que existe una diferencia significativa (P < 0.05), y se concluye que la zona norte tiene más diversidad que la zona sur. Esta diferencia se puede atribuir a factores ambientales. Amplitud y Traslape del NichoEn esta época existe un solo ambiente. El traslape del nicho HB(A), solo presenta pequeñas fluctuaciones que indican un aumento en la competencia en algunas estaciones como en las Bocas, estaciones 1 y 15 y áreas vecinas a la laguna (Fig. 12). Los valores del traslape son menores y constantes. En relación con el número de especies o diversidad alfa, se observa una tendencia uniforme en todo el sistema, los valores menores se registran en la estación 9, con dos especies y el máximo con 10 en las estaciones 10 y 11, así como estaciones en donde no aparece ninguna especie como la 6 y 13. La relación entre la amplitud HA(B) del nicho y el traslape HB(A) puede ser positiva o negativa, en las estaciones 4, 8, 10, 11, 13 y 18 es negativa y existe una menor competencia entre las especies de la comunidad. Amplitud y Traslape del Nicho de las Especies DominantesCentropomus robalito se encuentra desde la Parte Baja del Estero hasta la Laguna. Los valores máximos de traslape del nicho HB(A), se localizan en la Parte Baja del Estero, en el resto del sistema existen fluctuaciones desde 0.08 a 0.34, con una similaridad de traslape parecida a la de A. liropus. En general el grado de competencia de C. robalito no es muy marcado, ya que su valor esta cercano a cero (Fig. 13a). En M. curema se detecta una semejanza en el traslape del nicho HB(A), desde la estación 4 y en todo el sistema, donde ambas tienen fluctuaciones marcadas. En esta especie, los valores son más bajos en relación con C. robalito, ya que su amplitud de nicho HA(B) tiene valores cercanos a cero, lo que indica que tiende a explotar al máximo el recurso. La amplitud de A. liropus, tiene valores más altos queC. robalito, entre 0.08 y 0.28, observándose que la especie tiende a ser menos especialista pero que explota al máximo su nicho trófico (Fig. 13a). M. curema, tiende a presentar valores constantes con pequeñas fluctuaciones en todo el sistema y a ser menos especialista, considerandose como especie dominante cíclica del sistema, esta última especie tiene un traslape de nicho similar al de D. peruivianus, con un valor mínimo de 0.02 y un máximo de 0.7, lo que establece que ambas especies tienen un grado de competencia uniforme en todo el sistema (Fig. 13b y c). La amplitud del nicho HA(B) de M. curema se mantiene uniforme en el sistema, y se observa una correlación positiva entre estos parámetros. En D. peruvianus la amplitud del nicho HA(B) es menor que en M. curema, con fluctuaciones marcadas. A. liropus tiene un valor más alto de amplitud del nicho que M. curema en todo el sistema (Fig. 13c y d). 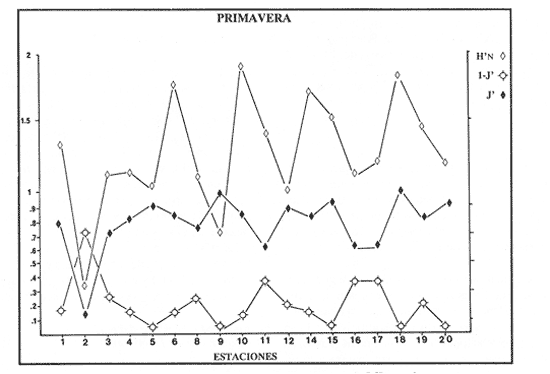 Figura 11. Gráfica de diversidad de especies H', abundancia (J) y dominancia (i-J) en primavera. 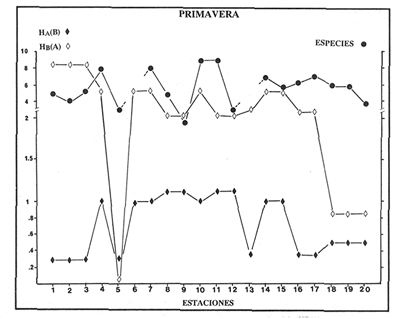 Figura 12. Gráfica del número de especies (SP), amplitud HA(B) y traslape del nicho HB(A) en primavera. 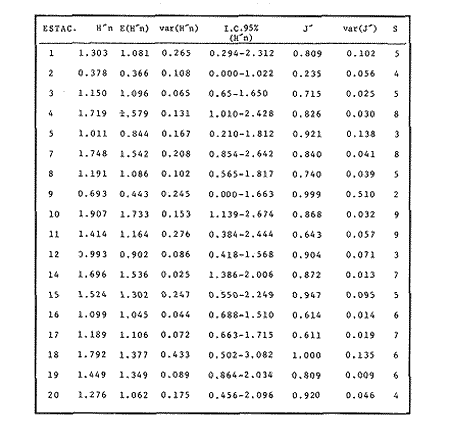 TABLA 5 DIVERSIDAD (H'n) RIQUEZA DE ESPECIES (S) E IGUALDAD DE ESPECIES (J') EN PRIMAVERA CICLO ANUALEn la Fig. 14 se observa una correlación positiva entre HB(A) y H'n, los valores altos se presentan en otoño y los menores en verano, debido a que el sistema mantiene características marinas, mientras que en otoño son dulceacuícolas, por lo que existe una mayor diversidad de especies H'n y un incremento del traslape del nicho HB(A), dando lugar a una mayor competencia interespecífica (Guiller, 1984) y a la reducción del nicho por el aumento de la diversidad, reduciéndose la amplitud HA(B) y resultando una mayor competencia, tal como ha sido observado en otras comunidades (Pielou, 1971). En la amplitud del nicho HA(B) se observa cierta uniformidad en verano, otoño e invierno, con un incremento en primavera, justamente cuando la diversidad es menor. Esta homogeneidad posiblemente se deba al habitat que existe en cada una de las épocas mencionadas, donde la mayoría de las especies tienden a explotar al máximo el recurso, En primavera, cuando se presenta un ambiente marino casi homogéneo, las especies compiten más por el recurso (alimento-espacio), y tienden a la especialización, tal y como lo menciona Giller (1984), para muchas especies de peces tropicales que cambian de alimento cuando es escaso, por lo que el traslape del nicho es mayor, ocasionado una mayor competencia entre otras especies. 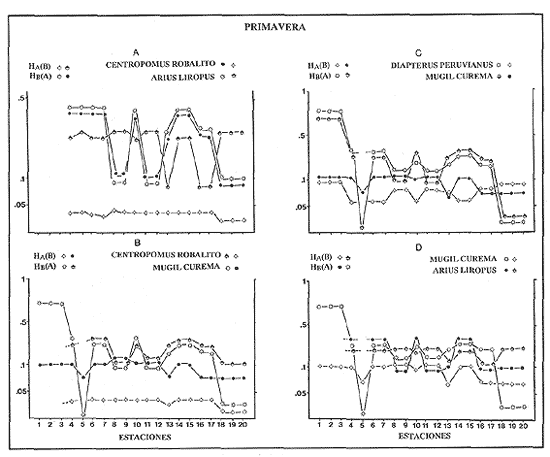 Figura 13. Gráfica de la amplitud HA(B) y traslape del nicho HB(A) de algunas especies dominantes en primavera. 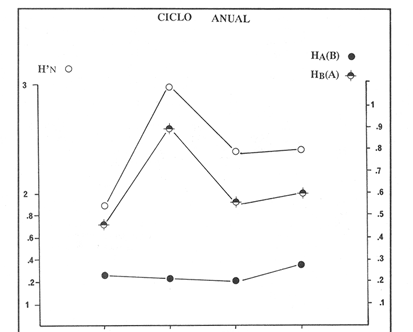 Figura 14. Gráfica de la diversidad de especies (H'n) traslape HB(A) y amplitud del nicho HA(B) del ciclo anual (1979-1980). DISCUSIÓN
AmbienteEl concepto de ambiente y habitat es controvertido, sin embargo su definición es básica en el estudio del nicho y la diversidad de especie. Este ambiente esta compuesto por un conjunto de habitat operacionales (Vandermeer, 1972). Pianka (1982) define al ambiente como "la suma de todos los factores físicos y biológicos que actúan sobre una unidad orgánica definida esta unidad puede ser un individuo, especie población, comunidad, grupo o taxón. Este autor tambien define al habitat como "unidad operacional que es ocupada o consumida por una o más OTU's (Unidad Taxonómica Operacional) que pueden o no estar relacionadas entre si. En este trabajo se utiliza la clasificación del habitat propuesto por Alvarez Rubio et al (1986) y Amezcua Linares et al (1987) para el sistema. Ellos definen 2 ambientes para cada época climática, la zona norte (Boca de Teacapan y región del estuario) y la zona sur (canal del estero y laguna), a excepción de primavera donde se presenta uno solo. Estos ambientes presentan cambios de acuerdo a la época y sus limites son variables, por lo que es difícil precisarlos. En general el sistema tiene dos ambientes que se relacionan entre si de acuerdo a las características del habitat. Diversidad de EspeciesEl análisis de la diversidad en la comunidad de peces es importante porque permite conocer la organización y la abundancia de cada elemento dentro del ecosistema. En el análisis espacio temporal efectuado sobre la diversidad de especie, se observa que los taxa tienden a agruparse hacia las zona con salinidad típicamente marina. Este parámetro constituye un tipo de barrera hidrológica que limita el desplazamiento de las especies en el sistema Paul (1981) menciona en su estudio sobre Callinectes, que la diferente tolerancia de salinidades es importante para la distribución de las especies. Yañez-Arancibia (1978) también indica la importancia de las condiciones hidrológicas para la fauna en las lagunas costeras de Guerrero. A veces existe una relación negativa entre la diversidad y la equitatividad, debido a la abundancia de individuos de algunas especies, lo que se manifiesta en la dominancia (1-J') que a su vez presenta una relación negativa con la abundancia (J), así cuando esta es mayor, la dominancia es menor (Mac Artur, 1969 y Douglas, 1981). En el sistema se observó un patrón de menor dominancia en la parte norte, mientras que en la parte sur sucede lo contrario (Alvarez-Rubio et al, 1986). La dinámica ambiental durante el ciclo anual, produce cambios en la diversidad, distribución, abundancia y dominancia, por lo que las especies con mayor capacidad adaptativa tienen mayor abundancia y dispersión en el sistema. Skud (1982) en un análisis de peces dominantes, menciona que la abundancia de algunas especies esta en relación a los cambios ambientales, los que pueden ser benéficos para unas y drásticos para otras. Horn y Allen (1976), presentan resultados similares en bahías y estuarios, donde encontraron que la diversidad y abundancia disminuye en lugares con menor salinidad. En general los valores altos se presentan en la parte baja del estero, principalmente en otoño donde el habitat marino se ha reducido por el aporte fluvial. El ambiente es determinante en la distribución de las especies, algunas tienen la capacidad de soportar cambios ambientales como sucede con Centropomus robalito frecuente en la laguna, la que es hipersalina en época de secas y dulceacuicola en lluvias. Otras como Hyporhamphus unifasciatus y Lile stolífera se restringen en la parte norte del sistema donde predominan aguas marinas. El Bagre Arius liropus se localiza en la zona sur durante el verano, aunque en otoño durante las lluvias, suele ocupar también la zona norte. Algunas especies no tienen una marcada preferencia por un habitat en particular como Achirus mazatlanus y Mugil curema. Comportamientos parecidos se reportan en peces de estuarios en el norte de Florida por Subrahmanyan (1985) y Hoff y Richard (1977). La macrofauna béntica también se dispersa de acuerdo al gradiente salino, estableciendo una dinámica entre el predador y la presa. En estaciones con mayor var(H'n) existe menor diversidad, por lo que se incrementa la dominancia (1-J'). Esta varianza también depende del número de individuos que tiene cada estación (Tablas 1, 3, 4, 5), observandose de esta forma que la mayor varianza de H'n y J' ocurre en la zona sur del sistema, y la menor en el norte. De hecho la varianza de la diversidad, var (H'n) y de la abundancia relativa var(J'), esta en función de las especies y los individuos (Pielou, 1977 y Miller 1980). Estadísticamente, la mayor variación de la diversidad y equitatividad se presenta en el sur del sistema, que es donde se presenta un mayor sesgo de los datos E(H'n), aunque este puede ser interpretado ecológicamente como consecuencia de una respuesta del ecosistema a las severas fluctuaciones del ambiente que se presentan durante el año, lo que provoca un "stress" en las especies. Conceptos similares se han señalado por Hoff y Richard (1977) y Mc Lusky (1981). La boca artificial de Cuatla contribuye al "stress" de esa región. Houston (1979), Klopper y Mc Artur (1969) y Grey (1981) afirman que en ambientes someros ciertos parámetros ecológicos como H'n, declinan debido a que pocas especies toleran cambios bruscos del ambiente. Los notables cambios que se presentan en la laguna, pueden ser debidos a la apertura de la boca artificial que no permite una estabilidad porque las corrientes marinas son mayores a las que puede soportar el canal (Cepeda, 1977), lo que provoca una erosión continua. Amplitud y Traslape del NichoMedir la amplitud y el traslape del nicho es una tarea difícil, ya que por lo general se toma como base el recurso alimentario para su evaluación, olvidando otros aspectos que interactúan con las especies como la temperatura, salinidad y otros parámetros ambientales (Colwell y Futuyama, 1971; Pielou, 1975 y Hurlbert; 1978). Muchas especies de la comunidad tienen un nicho fundamental, pero las interacciones con otras especies lo reducen, y cuando las interaciones son más frecuentes se consideran como competencia y depredación. El nicho de una comunidad, aparentente es discreto, donde las especies tienden a utilizar parte del nicho fundamental de otras, resultando una mayor demanda del recurso para dos o más poblaciones y existiendo una mayor interacción entre las especies de la comunidad (Colinvaux, 1982 y Giller, 1984). El parámetro que mide el grado de competencia es el traslape del nicho (Witaker, 1972), por lo que ambos son directamente proporcionales, y si la competencia es intensa una de las especies es excluida, o bien cambia su estrategia alimentaria. Por lo que corresponde al traslape del nicho, existe poca información a nivel de ecosistemas acuáticos, principalmente en comunidades de peces, por lo que para medirlo se buscó un modelo donde se pudieran incluir tanto parámetros bióticos como abióticos. Los valores más altos del traslape de nicho HB(A) de la comunidad, se presentan en la zona norte, donde existe alta diversidad de especies, una relación positiva entre la diversidad y traslape, alta competencia por el recurso y reducción del nicho de las especies que componen la comunidad (Krebs, 1978 y Miller, 1980). Se considera que el recurso limitante que puede ser relevante para las especies es el espacio mas que el alimento o los factores ambientales. Colinvaux, (1982) menciona que a mayor diversidad, existen más nichos, y por lo tanto mayor interacción, lo que ocasiona una exclusión competitiva. El mayor traslape de nicho en la zona norte se atribuye principalmente a que en el canal del estero existe salinidad típicamente marina y sustrato arena-fango, donde habitan gran variedad de organismos bénticos como moluscos, crustáceos, anélidos, etc. Por el contrario la amplitud del nicho HA(B), es menor en esta área, estableciendo una relación inversa entre el traslape y la amplitud, que origina reducción de los nichos y una tendencia hacia la especialización de los individuos y por lo tanto de la comunidad a la que pertenecen. En la zona sur, el número de especies tiende a disminuir, al igual que el traslape HB(A), incluso llega a ser menos que la amplitud HA(B), con correlaciones positivas entre estos parámetros principalmente durante el verano, otoño e invierno (Figs. 3, 6 y 9). Porter y Duster (1982) y Giller (1984), mencionan que cuando existe esta relación, se presenta una abundancia en el alimento, y aunque se presenta poca competencia, las especies no amplían su nicho. Según Alvarez-Rubio et al (1986), en la laguna existe abundancia de recurso alimentario, aunque es poco diverso. Esta relación ha sido obtenida en estudios sobre mamíferos pequeños por Gorman (1979). En general, la comunidad de peces tiene mayor competencia durante otoño en la parte baja del estero (norte), justo donde la diversidad es mayor, por lo que se observa una relación directa entre la diversidad y el traslape, e inversa con la amplitud del nicho. En forma global, se puede establecer que la comunidad involucra especies con tendencia especialista en todo el sistema, por lo que especies con capacidad de desplazamiento pueden evitar la competencia y tener mejor adaptavilidad. De esta forma, las especies de la comunidad tienden a compartir el mismo nicho, ya sea por alimento o por espacio, solo variando su intensidad en cuanto al aprovechamiento, lo que da lugar a una mayor coexistencia y evita la exclusión competitiva de una de las especies. Por otra parte, aquellas especies con mayor capacidad adaptativa pueden ocupar más de un habitat y evitar la competencia y depredación, por lo que dejarán mayor descendencia y podrán mantener constante la reserva genética de la población (Dobzhansky, 1951). Según Weatherley (1972), cuando 2 especies de peces compiten por el mismo recurso (alimento-espacio), y una de ellas no es abundante, se pueden extinguir sus poblaciones locales por la fuerte competencia inter o intraespecífica, al reducirse la tasa de crecimiento de los individuos. Cuando el alimento es escaso, una población especifica puede emigrar, mientras que cuando falta espacio se evita el desove, lo que no permite dejar desendencia, se reduce el reclutamiento y finalmente se presenta un disminución drástica de una población en particular. En la zona sur, las especies dominantes presentan bajos valores de traslape, y se reduce la competencia, por lo que existe una correlación positiva entre estos parámetros (Figs. 4, 7, 10 y 13). Giller (1984) menciona que cuando hay abundancia en el alimento, se presenta una relación positiva por la mayor competencia intraespecífica. Según Miller (1980), cuanto mayor es el traslape, mayor es la diversidad de las especies, por lo que existe una relación positiva. Este fenómeno también se visualiza al analizar el nicho por época climática en toda la comunidad. La medición del nicho por el método de Levins y Lloyd (Hurlbert, 1978), limita la información al considerar solo 2 especies sin tomar en cuenta al resto de la comunidad, por lo que los resultados que se obtienen son diferentes, por lo cual se considera más apropiado el modelo de Pielou (1975 y 1977), ya que el concepto de nicho se aplica mejor a la comunidad, debido a que las especies que la componen interaccionan entre si y con los factores ambientales. Además, este método se adecua mejor a comunidades de peces costeros. Conclusiones1. El sistema Teacapan-Agua Brava esta integrado por dos ambientes, la zona norte I, que comprende la Boca de Teacapan, Parte Baja del Estero y la porción norte del Canal (estaciones 1-12), la que presenta valores máximos de salinidad y temperatura durante la época de secas (primavera y verano) y mínimos en lluvias (otoño); y la zona sur II, que comprende la porción sur del Canal y la Laguna (estaciones. 13-20) que se caracteriza por valores desde hipersalinos (primavera), hasta dulceacuícolas (otoño). 2. Se determina que la zona norte (ambiente I, presenta mayor diversidad de habitat y especies en comparación a la zona sur (ambiente II), por lo que al aumentar la diversidad se presenta mayor competencia, reducción de habitat y en consecuencia mayor traslape y menor amplitud del nicho. 3. La equitatividad (J') tiende a ser mayor en el Canal que en algunas estaciones del la Parte Baja del Estero, y la dominancia (I-J') menor, debido a la alta diversidad. La dominancia se relaciona negativamente con la diversidad, la equitatividad y la abundancia durante todas las épocas del año. 4. La época de lluvias (otoño), rompe la continuidad de la influencia marina, se observa un incremento en la diversidad y mayor competencia, así como la reducción de habitat marinos, dando lugar a un mayor traslape y menor amplitud del nicho. 5. La varianza de la diversidad var (H'n) y de la equitatividad var(J'), es menor en las estaciones con mayor número de especies e individuos, como sucede en la zona norte. 6. Existe una relación positiva entre la diversidad y el traslape del nicho, y negativa con la amplitud, de manera que, cuando es mayor la diversidad, aumenta el traslape y se reduce la amplitud. Esta relación entre el traslape y la amplitud es frecuente en la Laguna, donde hay abundancia de alimento y la diversidad tiende a reducirse, por lo que las interacciones de las especies son menores. 7. En la zona norte, se presenta mayor traslape y menor amplitud de nicho porque se registra alta diversidad y baja dominancia, dando lugar a una mayor competitividad. En el sur el comportamiento es totalmente inverso. 8. Por lo anterior, en la zona norte se detectan especies con tendencia especialista debido a la reducción de nichos, en tanto que en el sur se presentan menor cantidad de nichos y menor competencia. AgradecimientosLos autores agradecen a la Maestra Zoila G. Castillo Rodríguez por su valiosa colaboración en los trabajos de campo y registro de la información, al maestro Rafael Madrid del Proyecto Académico de Estadística por sus sugerencias en el uso de la metodología, al Biol. David Delgado H. por su asesoría en el uso de paquetes estadísticos, a los Ings. Adolfo Quintana y Eduardo Estrada de la D.G.C.A. Al Dr. Jorge Carranza Fraser Director del Instituto de Ciencias del Mar y Limnología por su valioso apoyo. LITERATURAAMEZCUA LINARES F. Tesis profesionalAportación al conocimiento de los peces del sistema de Agua Brava Nayarit. Fac. Ciencias Univ. Nal. Autón. México1972. 209 p. 13 lam. AMEZCUA LINARES, F. y A. YÁÑEZ-ARANCIBIA An. Centro Cienc. del Mar y Limnol., Univ. Nal. Auton. México Ecología de los sistemas fluvio-lagunares asociados a la Laguna de Terminos. El habitad y estructura de la comunidades de peces.1980. 69-117. 7(1) AMEZCUA LINARES, F., M. ALVAREZ-RUBIO y A. YÁÑEZ-ARANCIBIA An. Inst. Cienc. del Mar y Limnol. Univ. Nal. Autón. México Dinamica y estructura de la comunidad de peces en un sistema ecológico de manglares de la costa del Pacífico de México, Nayarit 1987. 221-248.14 (2): ALVAREZ-RUBIO, M., F. AMEZCUA LINARES y A. YÁÑEZ-ARANCIBIA An. Centro Cienc. del Mar y Limnol. Univ. Nal. Autón. MéxicoEcología y estructura de las comunidades de peces en el Sistema Lagunar Teacapan-Agua Brava, Nayarit, México. 1986. 185-242.13 (1): BARNES, R.S.K. Coastal Lagoons. The natural history of a neglected habitat Cambridge University PressInglaterra.1981. 106 p. BLACKWELDER, R.E.Taxonomy. John Wiley and Sons Inc. Nueva York.1967. 298 p. CARDENAS, F.M. Lagunas Costeras un Simposio. Mem. Simp. Inter. Lagunas Costeras.Pesquerías en las Lagunas Litorales de México: 645-652. In: Ayala-Castañares, A. y F. B. Phleger (Eds.) UNAM, UNESCO 1969. 686 nov. 28-30, 1967 CARRANZA, F. J. y F. AMEZCUA LINARES 2a Parte del Informe Final del Contrato de Estudios N NAY. Est.-7. Inst. Biol. Plan Nayarit. S.R.H. Resultados finales de la fauna ictiológica en el Sistema de Teacapan Agua Brava (octubre de 1970- junio 1971). Dpto. Cienc. del Mar y Limnol. Univ. Nal. Autón. México y S.R.H. 1971.88-115. CEPEDA, G.H. An. Inst. Geof. Características Mareográficas en Machona, Tabasco y Agua Brava Nayarit1977.105-115.5 (22-23) CONOVER, W.J. Practical Nonparametric Statistics Jhon Wiley Nueva York. 1980. 491 p. COLINVAUX, P. Introducción a la Ecología. Limusa Ed. México.1982. 679 p. COLWELL R.K. and D.J. FUTUYAMAEcology On the Measurement of Niche Breadth and Overlap. 1971.567-576. 52 (4): CURRAY, J.R., F.J. EMMEL, y PJ. CRAMPTON Lagunas Costeras un Simposio. Mem. Simp. Intern. Lagunas Costeras. Holocene History of a Strand Plain, Lagoonal Coast, Nayarit, Mexico: 63-100. In: Ayala-Castallares, A y F.B. Phleger (Eds.) UNAM-UNESCO1969. 686. Nov.28-30,1967 DAY, JR.,J. W. and A. YÁÑEZ-ARANCIBIA Ciencia Interamericana Coastal lagoons and estuaries, ecosystem approach. OEA Washington1982.11-20. 22: DOBZHANSKY, T. Genetics and the Origen of Species. Columbia University Press Nueva York. 1951. 580 p. DOUGLASS, W.B. Dominance in Marine Ecosystem. Am. Nat. 1981.262-274. (118): EBERSOLE, J.P. Ecology Niche separation of two Damselfish apecies by agression and diferential microhabitat utilization 1985.14-20.66 (1) ELTON, C.S. Animal Ecology Sidgwich and Jackson. Londres.1927.209p. FEINSINGER, P., E. E. SPEARS and R. W. POOLE. Ecology A simple measure of niche breadth. 1981.27-32. 62 (1): FLORES-VERDUGO, F., F. AMEZCUA LINARES, A. YÁÑEZ-ARANCIBIA y M. ALVAREZ-RUBIO Estuaries. En prensa.Mangrove ecology, acuatic primary productivity and fish community dynamics in the Teacapan Agua Brava Lagoon, estuarine system, Mexican Pacific. 1990. GARCIA, E. Modificaciones al sistema de clasificación climatica de Köppen. Inst. Geogr Univ. Nal. Autón. México.1973. 246 p. GILLER, P. S. Community structure and the niche. Chapman and Hall Ed. London.1984. 176 p. GLADFELTER, W.B.,y S.J. WILLIAMSEcology Feeding niche Separation in a Guild of Tropical Reef Fishes (Holocentridae).1983.552-563.64 (3): GOMEZ-AGUIRRE, S. Informe Final del Contrato de Estudios Nº NAY. Est.-7. Plan Nayarit. S.R.H. Resultados finales de hidrología y plancton en el Sistema de Teacapan Agua Brava (octubre de 1970junio 1971). Inst. Biol. Dpto. Cienc. del Mar y Limnol. Univ. Nal. Autón. México y S.R.H. 1971. 1-87. GORMAN, M. Island Ecology Chapman and Hall Ed. Londres. 1979. GRINELL, J. The niche relationships of the California Thresher Auk.1917.364-382. (21): GRINELL, J. Ecology Geography and evolution. 1924.225-229. 5 HEADRICH R.L and S.O. HEADRICH Estuarine and Coastal Marine Science A seasonal survey of the fishes in the Mystic River, a polluted estuary in downtown Boston, Massachussetts. 1974.59-73. 2 HOFF J. and M. RICHARDEstuarine and Coastal Marine Science Factors affecting the seasonal abundance, composition and diversity of fishes in a southeastem New England Estuary. 1977. 665-678.5 HORN, M.H., and L.G. ALLENBull. South. Cal. Acad. Sci. Numbers of apecies of marine fishes in California bays and estuaries1976. 159-170.75 (2): HOUSTON, M. A general hypotesis of species diversity. Am. Nat.1979. 81-101. 113: HURLBERT, S.H. Ecology The measurament of niche overlap and some relatives. 1978.67-77. 59: HUTCHINSON, G.E. Evant. Biol. Concluding remarks, cold apring Harver Symp. 1957.415-427. (22) KLOPFER P.H. and R.H. Mc ARTHUR Niche size and Faunal Diversity. Amer. Natur. 1960. 293-300.94 KREBS, CJ. Ecology the mental analysis of distribution and abundance. Harper Interamericana Ed. Nueva York.1978. 678 p. LAWLOR, L.Ecology Overlap similarity, and competition coefficients. 1980.245-251. 61 (2) LLOYD, M., R.D. JUGER and F.W. KING On the diversity of reptile and amphibian apecies in a Bomean Rain Forest Amer. Natur. 1968.497-515.102 Mc ARTHUR, R.H. Biol. Jour. Linn. Soc. Patterns of Communities in the Tropics. 1969.19-30. 1 Mc ARTHUR, R.H Geographical ecology: patterns in the distribution of species. Harper and Row New York.1972. 269 p. Mc LUSKY, D.B. The Estuarine Ecosistem. Blackie and Son. Londres 1981. 145 p. MEE, LD. Chemical Oceanography Coastal lagoons. In: Riley, J.P. y R. Chester (Eds). Academic PressLondres.1979. Cap.7: 441-489. MILLER, J.C.,Ecology Niche Relationships among parasitic insects occurring in a temporary hábitad.1980.270-275.61 (2) NUÑEZ-PASTEN, A. Tesis profesionalHidrología del Sistema Teacapan-Agua Brava en la planicie costera de los estados de Sinaloa y Nayarit, Mexico.Escuela de Biología, Univ. Autón. Mor. 1973. 38p. ODUM, E.P.Science The strategy of ecosystem development. 1969.262-270. (164) ODUM, E.P. Jour. Mar. Res. Species Diversity in Net Phytoplancton of Raritan Bay. 1972. 57-75.(20) PAUL., R.K. The develoment of a fishery for portunid crabs of the genus Callinects (Decapoda, Brachyura) in Sinaloa, México. Oversan Development AdministrationLondon.1981. 78 p. PORTER, J.H. and R.D. DUESEROikos Niche overlap and competition in an insular small mammal fauna: a test of the niche overlap hypothesis.1982.228-36. 39 PETRAITIS, P.S.Ecology Algebraic and graphical relationships among niche, breadth measures.1981.545-548.62 (3) PIANKA, R.E. Ecología Evolutiva. Omega Ed. Barcelona 1982. 365 p. PIELOU, E.C. Ecology Niche Width and Niche Overlap: a method for measuring them.1972.687-692. 53 (4) PIELOU, E.C. Ecology diversity. Wiley Ed. Nueva York.1975. 165 p. PIELOU, E.C.Mathematical Ecology. Wiley Ed. Nueva York.1977. 385p REID, K.G. and D.R. WOODEcology of island water and estuarios.Van Nostrand Co.Nueva York.1976. 485 p. ROLLET, B. Informe Técnico Ecología y reforestación de los manglares en México Programa de investigación y fomento pesquero. FAOMéxico.1974.1-126. 6: SANDERS, H.L Marine benthic diversity: a comparative study. Am. Nat. 1968.243-282. 102 (925) SUBRAHMANYAM, C.B. Fish Community Ecology in Estuaries and Coastal Lagoons: Towards an Ecosystem Integration. Fish comunity of a hay esturine marsh system in north Florida In: A. Yañez-Arancibia (Ed). UNAM Press.México.1985. Chap. 9:191-206. 654 p. SKUD, B.E.Sciens Dominance in fishes: the relation between enviroment and abundance.1982.144-149. 216: SMITH, E.P. and T.M. ZARET Ecology Bias in estimating niche overlap.1982.1248-253. 63 (5): STEEL, R.G. y J.H. TORRIE Biostedística Principios y Procedmientos. McGraw Hill. México. 1985. 622 p. TRAMER E.J.Ecology Bird species diversity: componentes of Shannon's formula.1969.927-929.50 VALENTINE, J.W. Jour. Paleontology Niche diversity and niche size patterns in marine fossils. 1969.905-915. 43 (4): VANDERMEER, J.H. Ann. Rev. Ecol. Syst. Niche theory. 1972. 107-132.(3): WARBURTON, K. Community structure abundance and diversity of fish in a Mexican Coastal Lagoon system Estuar. Cost. Mar. Sci. 1976 497-519. 7: WASHINGTON, H.G. Diversity, biotic and similarity indices. A review with espacial relevance to aquatic ecosystems.Water Res., 1984. 653-694. 18 (6): WEATHERLEY, A.H. Growth and Ecology of Fish Populations. Academic Press Nueva York.1972. 293 p. WHITTAKER, H.Taxon. Evolution and measurement of species diversity. 1972.213-351. 21 YÁÑEZ-ARANCIBIA, A. An. Centro Cien. del Mar y Limnol. Univ. Nal. Autón. México, Pub. Esp.Taxonomía ecología y estructura de las comunidades de peces en Lagunas Costera con bocas efímeras del Pacífico de México. 1978.1-306. 2 YÁÑEZ-ARANCIBIA, A. Ecología de la zona costera análisis de siete tópicos AGT. Ed. México.1986. 189 p.
|

