|
TREMATODOS DE PECES MARINOS DEL GOLFO DE MÉXICO Y DEL MAR CARIBE. II. FAMILIAS HAPLOSPLANCHNIDAE Y OPECOELIDAE Trabajo recibido el 14 de julio de 1989 y aceptado para su publicación el 20 de septiembre de 1990.
Guillermina Caballero y R.
Laboratorio de Helmintología "Dr. Eduardo Caballero y C". Departamento de Zoología del Instituto de Biología. Universidad Nacional Autónoma de México. Dirección particular: Apartado Postal 692, Código Postal 06000, México 1. D. F. México. Taxonomía, Zoogeografía, Trematoda, Haplosplanchnidae, Opecoelidae, Peces marinos, Mar Caribe, México. Taxonomy, Zoogeography, Trematoda, Haplosplanchnidae, Opecoelidae, Marine fishes, Caribbean Sea, Mexico.
RESUMENSe registra una especie nueva de Haplosplanchnidae y dos especies de Opecoelidae. La primera pertenece al género Schikhobalotrema y es parásita del pezSparisoma sp de la familia Scaridae. Las otras dos especies parásitas son Hamacreadium mutabile Linton, 1910 yHelicometrina nimia Linton, 1910. Su presencia se registra por primera, vez en el Mar Caribe, en las costas del Estado de Quintana Roo, México, en peces de las familias Lutjanidae y Serranidae, respectivamente. ABSTRACTHere in, a new species of Haplosplanchnidae and two Opecoelidae are reported. The first one belongs to the genus Shikhobalotrema and it is a parasite of the fishSparisoma sp family Scaridae. The other two parasites areHamacreadium mutabile Linton 1910 andHelicometrina nimia Linton, 1910. Their presence constitute a new record in the fishes of the families Lutjanidae and Serranidae respectively, from the Caribbean Sea in the State of Quintana Roo, Mexico.
INTRODUCCIÓNCon esta segunda contribución se prosiguen los estudios de tremátodos de peces del Golfo de México y del Mar Caribe. Las tres especies que se determinan en esta ocasión, provienen de peces de aguas caribeñas del Estado de Quintana Roo, México y pertenecen a dos familias diferentes: Haplosplanchnidae y Opecoelidae. Algunas especies de los tres géneros que se estudian aquí, son frecuentes, tanto en peces tropicales del Golfo de México como en los del Mar Caribe, Atlántico Occidental y eventualmente del Océano Pacífico, en las Islas Galápagos. De esta manera se describe una especie nueva y las otras dos se discuten únicamente, pues constituyen nuevos registros en el sureste de México y eran ya conocidas en los mismos géneros de hospederos. MATERIAL Y MÉTODOSEl primer material helmintológico que se estudia consta de trece ejemplares maduros, que fueron colectados por el personal del Laboratorio de Helmintología, en el pez marino Sparisoma sp "lora" en aguas de Puerto Morelos, Quintana Roo, el 29 de agosto de 1984 y fueron determinados el 17 de noviembre de 1988. Los tremátodos fueron fijados en Bouin, se tiñeron con Hematoxilina, se aclararon en salicilato de metilo y se montaron en Bálsamo del Canadá. Se dan las medidas en milímetros del mejor de los ejemplares, ya que los demás no son claros de medir, por estar contraidos, poco teñidos o porque las vitelógenas no permiten distinguir los demás órganos. Familia Haplosplanchnidae Poche, 1926
Subfamilia Schikhobalotrematinae
Skrjabin y Guschanskaja, 1955
Genus Schikhobalotrema Skrjabin y Guschanskaja, 1955
Schikhobalotrema leonilavazquezae sp nov. (Figs. 1-3).Descripción. El cuerpo de estos parásitos es muy pequeño, de forma oval o un poco alargado, con los extremos redondeados, mide 0.848 mm de longitud por 0.393 mm de anchura. La cutícula es desnuda de 0.003 mm de espesor. En el borde anterior, cerca de la ventosa oral, se observan pequeñas protuberancias cuticulares de tipo sensorial. La ventosa oral ocupa todo el extremo anterior del cuerpo, es grande, esférica, musculoso y subterminal, mide 0.132 mm de diámetro longitudinal por 0.140 mm de diámetro transversal. El acetábulo es grande, mayor que la ventosa oral, esférico, musculoso, sin proyecciones en sus bordes y postecuatorial, aunque en algunos ejemplares se presenta ecuatorial, mide 0.188 mm de diámetro longitudinal por 0.220 mm de diámetro transversal, dista del borde anterior del cuerpo 0.471 mm y del posterior 0.377 mm. La relación que existe entre el diámetro longitudinal y el transversal de estas dos ventosas es de 1:1.4 x 1:1.5. La boca es subterminal, amplia, en forma de ojal abierto, mide 0.060 mm de diámetro longitudinal por 0.060 mm de diámetro transversal; la prefaringe no se observó con toda claridad debido a que los ejemplares están, en esa región, contraídos, la faringe es también grande, de forma esférica a cuasi esférica, musculosa y mide 0.080 mm de largo por 0.080 mm de ancho; el esófago es corto y se continúa con un ciego intestinal, sacular corto y ancho, que se extiende hasta cerca del borde posterior del acetábulo, o lo rebasa un poco, mide 0.300 mm de largo por 0.060 mm de ancho. Las paredes del esófago y del ciego están tapizadas por un epitelio de células cuboidales. El poro reproductor pequeño y fino es preacetabular, se localiza a nivel de los primeros folículos vitelinos, dista del borde anterior del cuerpo 0.320 mm, es de difícil localización en la mayoría de los ejemplares. Existe un solo testículo, grande, cuya forma varía de cuadrangular a cuasi esférica con bordes enteros, lisos o con lóbulos amplios, está situado muy cerca del borde posterior del acetábulo, ocupa casi toda el área comprendida entre el acetábulo y el borde posterior del cuerpo, rodeado por vitelógenas, sobre todo en el área postesticular, que es reducida, mide 0.200 mm de largo por 0.200 mm de ancho; en su interior se distinguen conjuntos aislados de espermatozoides, dispuestos entre las espermatogonias; el conducto eferente no se localizó; la vesícula seminal es preovárica, tubular casi recta, se angosta hacia el extremo proximal; cargada de espermatozoides, asciende dorsalmente hacia el poro reproductor desde el borde anterior del ovario y bordes lateral-derecho y anterior del acetábulo y antecede al útero; va acompañado en su trayecto de escasas células prostáticas difusas, sobre todo en las proximidades del poro reproductor; no hay bolsa del cirro. El ovario es trilobado, mide 0.080 mm de largo por 0.112 mm de ancho, se localiza cerca del borde posterolateral derecho del acetábulo y la parte basal del ciego. El receptáculo seminal tiene forma esférica, se encuentra en un espacio pequeño entre el borde posterior del ovario, las vitelógenas y el borde latero-anterior derecho del testículo. La glándula del Mehlis es difusa, con escasas células; el útero presenta pocas asas, su trayecto se realiza pasando entre el ciego y el acetábulo, entre los folículos vitelinos preacetabulares hasta el poro reproductor. Contiene pocos huevos, de uno a cinco, o se encuentra vacío, estos huevos son grandes, redondeados, de cáscara lisa, amarillenta y operculada con dos picos laterales en el polo posterior, miden de 0.080 a 0.088 mm de largo por 0.052 a 0.072 mm de ancho. Las glándulas vitelógenas son preacetabulares, forman un conjunto de foliculos grandes y pequeños, de forma irregular, no son abundantes ni apretados; llenan holgadamente los espacios libres entre los órganos, sobre todo el pequeño espacio postesticular en el extremo posterior, algunos de estos folículos miden 0.072 mm de largo por 0.032 mm de ancho. Se observa que en ciertos ejemplares, las vitelógenas se presentan en forma de una especie de cordón y en otros los folículos alcanzan el nivel del borde posterior de la ventosa oral, según la contracción del cuerpo en esa región, o bien algunos folículos se sitúan cerca del esófago. El poro excretor se encuentra en la línea media del extremo posterior y se abre dorsalmente. Hospedero: Sparisoma sp (Pisces: Scaridae) Habitat: Estómago Localidad geográfica: Puerto Morelos, Quintana Roo, México. Ejemplares depositados en la Colección Helmintológica del Instituto de Biología, UNAM. Tipo No. 244-6, Paratipo No. 244-7. 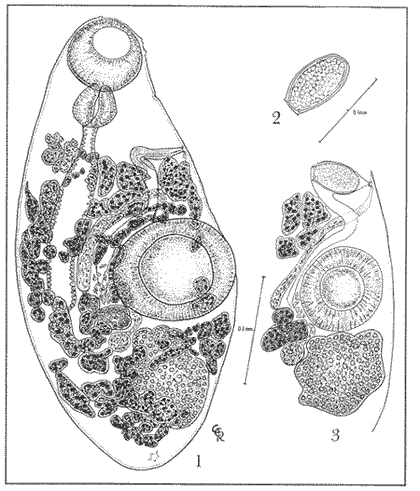 Lámina 1. Schikhoblotrema leonilavazquezae ap. nov. Figura 1. Preparación in toto, Vista ventral. Figura 2. Huevo. Figura 3. Detalle del aparato reproductor. Discusión. La especie de tremátodo que se describe, ha sido determinado como un miembro más del género Schikhobalotrema Skrjabin y Guschanskaja, 1955. Para distinguir Schikhobalotrema leonilavazquezae n. sp de las 18 especies hasta ahora descritas, se ha elegido como carácter diferencial la posición que presenta la ventosa ventral en relación al ecuador del cuerpo del parásito, que en este caso es sensiblemente postecuatorial y en ocasiones es casi ecuatorial, dependiendo posiblemente del grado de contracción del cuerpo en esa región. Asimismo se ha tomado en consideración la forma del cuerpo, ovalado, no alargado, el tamaño, forma y posición del poro reproductor, que en la especie nueva que se describe es pequeño, no saliente, de bordes finos, sin atrio genital y situado en apariencia lateral entre la faringe y el acetábulo, por encima de las primeras vitelógenas; el testículo es grande, de forma cuadrangular con bordes lobulados; el ovario es pequeño trilobulado; los huevos son grandes, anchos, ovalados casi redondeados (0.088 x 0.072 mm), en número de 1 a 5 o bien el útero se encuentra vacío; los folículos vitelinos son de forma irregular, no dendríticos, a pesar de que en un ejemplar las vitelógenas pequeñas se unen una detrás de la otra constituyendo una especie de cadena; los folículos se presentan en general grandes, sin ser numerosos en exceso; por último, la posición del ciego intestinal, que en algunos ejemplares no rebasa el borde posterior el acetábulo, no constituye un carácter constante, ya que en alguno que otro individuo, el ciego sobrepasa ligeramente al acetábulo. La especie se compara con cuatro especies que como ella presentan el acetábulo en la mitad posterior del cuerpo, es decir, postecuatorialmente: S. adbrachyuraSiddiqi y Cable, 1960; S. brachyura (Manter, 1937);S. glomerosum Pritchard y Manter, 1961 y S. pomacentri (Manter, 1937). La especie más parecida a la ahora descrita es S. adbrachyura, pues la forma del cuerpo y de los huevos son similares pero difiere en la distribución casi uniforme y el tamaño reducido de las vitelógenas, ovario con 5 a 6 lóbulos, posición y tamaño de las gónadas y la longitud del ciego intestinal que al ser mayor llega hasta el área ovárica y testicular. De S. brachyura difiere en que el ciego se extiende más allá del acetábulo, hasta nivel del testículo, por la forma del ovario y por su situación cercana al borde posterior del aceetábulo. S. glomerosum difiere por la forma cuasi esférica del cuerpo, con el extremo anterior cónico y el posterior truncado, por el ciego que llega hasta el nivel del borde anterior del acetábulo, por la forma ovoide del testículo, por la vesícula seminal sinuosa y el poro reproductor mediano a nivel del esófago, algo protuberante, además por el ovario ovalado, preacetabular y pretesticular así como por las vitelógenas difusas dispuestas desde el nivel de la faringe hasta el extremo posterior del cuerpo. De S. pomacentri difiere fundamentalmente en la forma, tamaño y distribución de las gónadas así como por la extensión de las vitelógenas en la región anterior del acetábulo y por la posición del poro reproductor cerca de la región faringo-esofágica. Existe otra especie S. hawaiensis Pritchard y Manter, 1961, que cuando fue descrita, se le comparó también con las especies anteriores por tener el acetábulo en el ecuador del cuerpo, pero este carácter variaba de manera que los ejemplares lo presentaban desviado hacia la mitad anterior, por lo que esa parte es más corta que la mitad posterior. Además, el ciego intestinal se extiende hasta el nivel de la región testicular. El testículo es ovalado-alargado con el borde anterior muy cerca o por debajo del acetábulo. El ovario es alargado y los huevos son más grandes (70 a 104 micras de largo por 32 a 58 micras de ancho) y en número de 30 como máximo. Todas estas características también la hacen diferente de S. leonilavazquezae n. sp a pesar de que se le parece por la forma independiente de abrirse la vesícula seminal y el metratermo en el poro reproductor. Respecto a la distribución en los hospederos S. adbrachyura, S. brachyura y S. leonilavazquezae ,parasitan a géneros y a especies de peces de la familia Scaridae de Puerto Rico, Florida y Quintana Roo, respectivamente, yS. pomacentri a especies diversas del género Pomacentrús de la familia Pomacentridae, logrando una distribución más amplia en peces del Golfo de México de Florida, Océano Atlántico de Panamá y del Océano Pacífico en las Islas Galápagos. S. hawaiensisy S. glomerosum solamente se han identificado en peces de la famil la Acanthuridae en el Pacífico, en Hawaii. Por lo que la especie más exitosa e importante tanto por el número de especies que parasita como por la distribución geográfica que ha alcanzado es S. pomacentri. La nueva forma de Schikhobalotrema se dedica con todo respeto y estimación a la doctora Leonila Vázquez García por su gran dedicación a la enseñanza e investigación en la ciencia entomológica, a través de más de 50 años de trabajo continuo en el Instituto de Biología de la UNAM. Familia Opecoelidae Ozaki, 1925
Subfamilia Plagioporinae Manter, 1947
Hamacreadium mutabile Linton, 1910
(Syns. Hamacreadium morgani Baz, 1946
H. krusadaiensis Gupta, 1956
H. leiperi Gupta, 1956
H. confusum Overstreet, 1969) (Figs. 4-5 y 9)
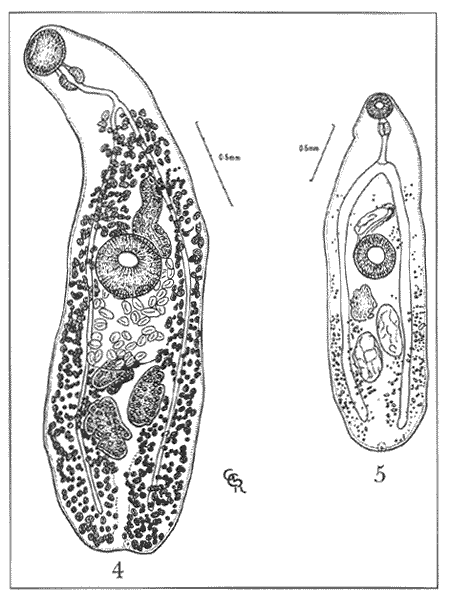 Lamina 2. Hamacreadium mutabile Linton, 1910. Figura 4. Preparación in toso. Vista ventral. Figura 5. Preparación in toto de una forma inmadura. Hospedero: Ocyurus chrysurus (Pisces: Lutjanidae) Habitat: Intestino y ciegos intestinales Localidad: Banco Chinchorro, Quintana Roo, México. Ejemplares en la Colección Helmintológica del Instituto de Biología, UNAM. No. 242-11. Discusión. Este material de estudio, compuesto por 16 individuos maduros y uno inmaduro, se ha identificado con la especie Hamacreadium mutabile por presentar los caracteres morfológicos de la especie descrita por primera vez por Linton en 1910, y que fue motivo de la creación de este género. Durante las décadas siguientes fueron descritas varias especies más que se incorporaron a este género, pero en 1940, los autores Durio y Manter, separaron algunas de ellas, basándose en la posición mediana del poro reproductor y las transfirieron al género Cainocreadium Nicoll, 1909. Estas especies son las siguientes: H. epinepheli Yamaguti, 1934; H. gulella Linton, 1910; H. lintoni Siddiqi y Cable, 1960;H. longisaccum Siddiqi y Cable, 1960 yH. pteroisi Nagaty y Abdel Aal, 1962. Igualmente sucede conH. consuetum Linton, 1910 y H. serraniNagaty y Abdel Aal, 1962. Asimismo esos autores consideraron aCainocreadoides Nagaty, 1956 como sinónimo deCainocreadium. H. kamalai (Gupta, 1958) Yamaguti, 1971 fue transferida al género Allocreadium Looss, 1900. Hamacreadium mutabile ha sido identificada y redescrita en varias ocasiones y los autores coinciden en que se trata de un singular tremátodo, con morfología inestable tanto externa como internamente. Manter (1940) hace algunas consideraciones respecto a las modificaciones más sobresalientes, encontradas por él al examinar los ejemplares obtenidos de lutjánidos y serránidos de las Islas Galápagos y que son fundamentalmente: 1)posición del poro genital; 2) lobulaciones de los testículos y ovario; 3) extensión posterior de la bolsa del cirro; 4) disposición o extensión de los folículos vitelinos; 5) forma del extremo posterior del cuerpo, redondeado o terminando en punta, este último carácter se presenta en el material estudiado por Lamothe (1971). Nagaty (1941) señala estas mismas modificaciones en los ejemplares procedentes de acanturidos, letrínidos, lutjánidos y serránidos del Mar Rojo. Además, indica claramente que la posición del poro genital varía desde encontrarse a la izquierda en gran número de ejemplares, en medio en un número menor y a la derecha en unos pocos ejemplares. Sogandares y Sogandares (1961) y Haffezullah (1971) en sus trabajos hacen referencia y esquematizan diferentes individuos, en los que se hace resaltar las diferentes posiciones y límites que presenta la bolsa del cirro en relación con el acetábulo, desde estar un poco alejada del borde anterior del mismo, ponerse en contacto con él o sobrepasándolo hasta su ecuador o más allá, como sucede en un menor número de individuos. Durio y Manter (1968) la registran en lutjánidos y letrinidos de Nueva Caledonia y de Australia. Con el estudio de numerosos especímenes procedentes de peces del Mar Caribe, ellos concluyeron que el poro genital nunca es mediano en esta especie o en este género, como en Cainocreadium. En el material procedente de un lutjánido del Mar Caribe de Quintana Roo, se observa lo siguiente: los 17 ejemplares muestran el borde posterior del cuerpo redondeado y más ancho que el anterior; el poro reproductor a la izquierda, cerca del ciego del mismo lado; la bolsa del cirro, en la mayoría de los individuos, cruza de derecha a izquierda el cuerpo del parásito, pasando cerca del borde anterior del acetábulo y curvando ligeramente su parte posterior hacia el borde lateral derecho de la ventosa ventral; en un solo ejemplar, se distingue la modificación poco usual que se refiere a la posición de la bolsa del cirro la cual se sitúa entre el borde lateral izquierdo del acetábulo y el ciego del mismo lado, posición que ya ha sido señalada por Sogandareset al. (1961) este órgano se extiende, en un individuo, más allá del borde posterior del acetábulo. Respecto a la posición de la vesícula excretora, sólo en un ejemplar se ha podido distinguir cerca del borde posterior del acetábulo. Por otra parte, se puede constatar que existe una cierta regularidad en lo que se refiere al aparato digestivo; distribución y forma de las glándulas vitelógenas, cuyos folículos son pequeños y de forma irregular; posición de los testículos y ovario, sin haberse podido distinguir bien sus lóbulos; receptáculo seminal sacular, cuando se le localizó; estructura interna de la bolsa del cirro y posición izquierda del poro reproductor, entre la bifurcación intestinal y el acetábulo. Con esta contribución se confirma una vez más el carácter cosmopolita de H. mutabile. Su presencia es muy importante y se pone de manifiesto en primer lugar en peces de la familia Lutjanidae con distribución geográfica en el Golfo de México, Mar Caribe y Atlántico Occidental; en segundo lugar parasita a peces de la familia Serranidae y en tercero a Lethrinidae. Su presencia en Pomadasyidae y Acanthuridae ya ha sido considerada por Sogandares y Sogandares como accidental, a pesar de que los pomadásidos están relacionados con los lutjánidos, serránidos y letrínidos. H. mutabile ha sido identificada también en peces de estas mismas familias en el Mar Rojo, Océano Pacífico (Oaxaca y Baja California Sur en la República Mexicana), en las Islas Galápagos, en Fiji, en Nueva Caledonia y en Queensland, Australia e India (Cuadro l). 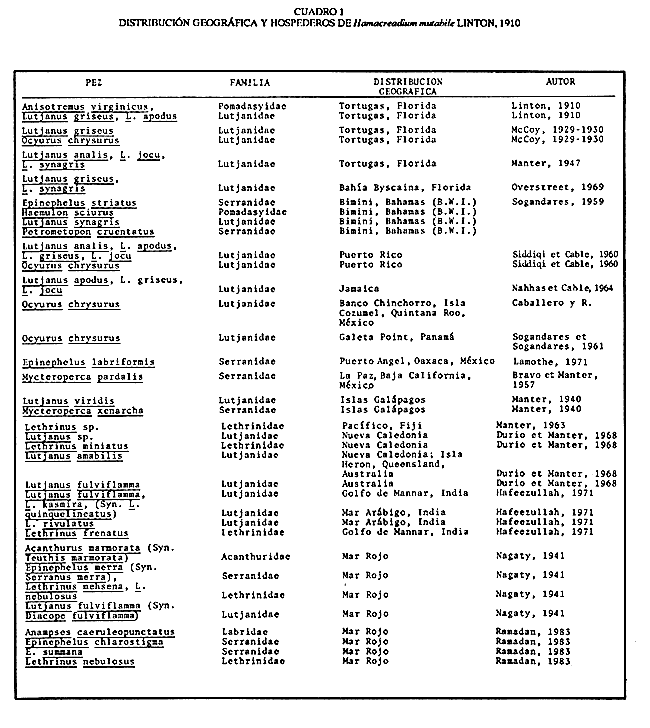 CUADRO 1 DISTRIBUCIÓN GEOGRÁFICA Y HOSPEDEROS DE Hamacreadium mutabile LINTON, 1910 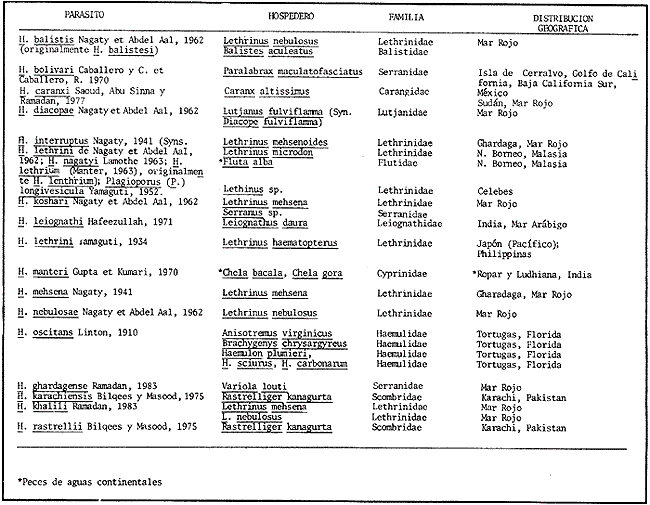 CUADRO 2 DISTRIBUCIÓN GEOGRÁFICA Y HOSPEDEROS DE LAS ESPECIES DEL GÉNERO Hamacreadium LINTON, 1910 Además de esta interesante especie, el género Hamacreadium contiene veinte especies más, restringidas tanto a las mismas familias de hospederos como a las zonas geográficas antes mencionadas (Cuadro 2), sobre todo en peces del Mar Rojo, por ejemplo; y se distribuyen en la zona comprendida entre el Trópico de Cáncer, el Ecuador y Trópico de Capricornio, aisladamente a la zona Austral (Fig. 9). De acuerdo con las consideraciones hechas por Manter (1963) Hamacreadium lariosis (Caballero, 1946) Yamaguti, 1953, queda suprimida de este género ya que el géneroEmmettrema Caballero, 1946, tiene plena validez, al haberse restablecido la importancia que tiene la extensión y posición del útero, mismo que en este último género está bien desarrollado, pues se extiende desde el testículo posterior hacia adelante hasta el borde posterior del acetábulo, luego asciende paralelo a la bolsa del cirro, forma el metratermo y se abre en el poro sexual femenino anterior al masculino; además de que estos poros sexuales se encuentran por encima de la bifurcación intestinal, por lo consiguiente son medianos o ligeramente desviados a la derecha y no como enHamacreadium, que el poro genital es sinistro, postbifurcal, cercano al ciego de ese lado, nunca mediano como lo declaran Durio y Manter (1968), con lo que se está en plena concordancia. En consecuencia, el registro de H. lariosi hecho por Lamothe (1963) con ejemplares de Lutjanus guttatus de Manzanillo, Colima se transfiere y es válido para Emmettrema lariosi Caballero, 1946. Respecto a la sinonimia de las especies de Hamacreadium, queda como sigue: H. mutabile (Syns. H. krusadaiensis Gupta, 1956;H. leiperi Gupta, 1956 de peces del Golfo de Mannar, India y H. confusum Overstreet, 1969 de Florida y Puerto Rico);H. interruptus Nagaty, 1941, de letrínidos del Mar Rojo, Norte de Borneo y Malasia, tiene cuatro sinónimos: H. lethrini Nagaty y Abdel Aal, 1962 de letrínidos del Mar Rojo;H. nagatyi (Nagaty y Abdel Aal, 1962) Lamothe, 1963;H. lenthrium (Nagaty y Abdel Aal, 1962) Manter, 1963;H. lethrium (Manter, 1963); Yamaguti, 1971 yPlagioporus (P.) longivesicula Yamaguti, 1952. Respecto a las sinonimias se alude al hecho de que Nagaty y Abdel Aal, al denominar su especie, desconocian que el nombre estaba previamente ocupado por la especieH. lethrini Yamaguti, 1934 razón por la cual Lamothe (1963) y Manter (1963) proponen una nueva combinación; Yamaguti (1971) transcribe en su obra Synopsis of Digenetic Trematodes of Vertebrates: H. lethrium (Manter, 1963), por lo que también se enlista como sinónimo. Fischtal y Kuntz (1965) redescribieron a la especie H. interruptus colectada en el pez de agua dulce Fluta alba y en el pez marinoLethrinus microdon de Malasia. Ellos encontraron las variaciones que separaron originalmente ambas especies en sus especímenes y declaran que H. nagatyi H. lenthrium yPlagioporus (P.) longivesicula son sinónimos deHamacreadium interruptus. Asimismo sugieren que, debido a esas variaciones, H. interruptus, sea otro sinónimo de H. mutabile, pero esta situación requiere más estudios acerca del ciclo de vida de esa especie. Por último, si se toma en consideración el número de familias, géneros y especies de peces de aguas tropicales de todo el mundo que albergan a Hamacreadium mutabile se puede concluir que es uno de los parásitos más exitosos que se conocen, ya que ha aprovechado muy bien las condiciones óptimas para su desarrollo que ha encontrado, tanto en su medio ambiente, probablemente poco contaminado, como por los hospederos intermediarios necesarios, y por su adaptación a diversas especies de peces, hospederos definitivos, en donde se le ha descubierto. Helicometrina nimia Linton, 1910
(Syns. Helicometrina orientalis Srivastava, 1936
Helicometrina elongata Noble y Park, 1937) (Figs. 6-8)Hospedero: Cephalopholis fulvus (Pisces: Serranidae) Habitat: Intestino Localidad: Cancún, Quintana Roo, México. Ejemplares en la Colección Helmintológica del Instituto de Biología, UNAM. No. 244-8 Discusión. A pesar de que los 5 individuos que se colectaron de este tremátodo son más pequeños, se les ha identificado con la especie Helicometrina nimia Linton, 1910, por presentar los caracteres siguientes: cuerpo foliácelo lanceolado con bordes lisos, en ocasiones festonados, extremos redondeados y cutícula desnuda; poseedor de una anatomía interna estable que se distingue por la presencia de nueve testículos, situados en la mitad posterior del cuerpo, alineados uno detrás del otro, en dos bandas laterales, derecha e izquierda, una bolsa del cirro preacetabular, tubular con vesícula seminal interna, con voluta en la parte basal de la bolsa, conducto eyaculador, cirro inorme globoso con estrías laterales con aspecto de cordones y poro reproductor posbifurcal; ovario intertesticular anterior, con cuatro lóbulos profundos, receptáculo seminal presente, útero bien desarrollado, postacetabular, preovárico y pretesticular, que contiene numerosos huevos pequeños, de cáscara amarillenta y con filamento largo monopolar, los folículos vitelinos pequeños y numerosos, conservan la disposición de la especie. 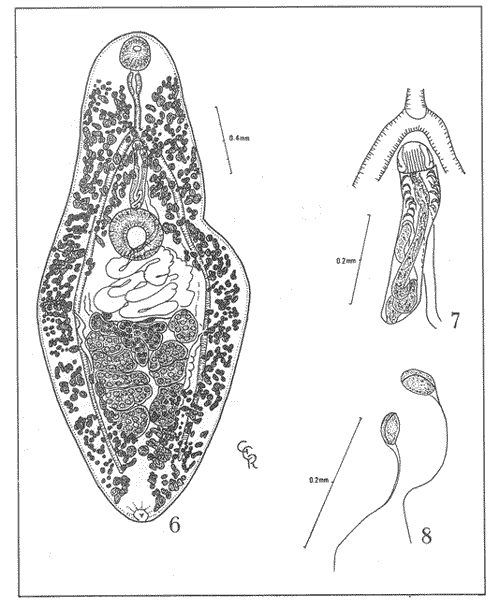 Lámina 3. Helicometrina minia Linton, 1910. Figura 6. Preparación in toto. Vista ventral. Figura 7. Estructura general de la bolsa del cirro y cirro evertido. Vista ventral. Figura 8. Huevos. 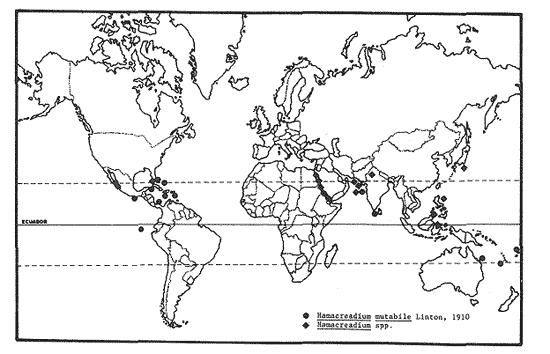 Figura 9. Distribución mundial de las especies del género Hamacreadium Linton 1910. Se ha comparado el material con el redescrito por Bravo-Hollis (1954), colectado en un Lutjanus guttatus (Syn. Neomaenis guttatus ) del Estado de Guerrero, México en la Costa del Pacífico, encontrando como diferencia notable las dimensiones de esos parásitos, que son más grandes. Los ejemplares procedentes del Caribe son más pequeños (1.749 a 2.880 mm de largo), están algo contraídos, por esta causa los testículos se adhieren unos a otros, pero conservan la disposición característica entre ellos y el ovario. Los huevos (0.041 a 0.073 mm) son semejantes en forma y tamaño a los de los ejemplares descritos en 1954, procedentes de lutjánidos del Pacífico. Helicometrina nimia tiene amplia distribución, tanto en el norte del Golfo de México como en el Mar Caribe, dispersándose ocasionalmente hacia el Océano Pacífico Mexicano. Esta especie ha sido identificada en varias ocasiones en peces de las familias Batrachoididae y Lutjanidae de Florida (Overstreet, 1969), Scorpaenidae de Florida y Puerto Rico (Overstreet, 1969; Siddiqi y Cable, 1960). Lutjanidae de las costas del Estado de Guerrero, México, y Cottidae de Los Angeles County, California, EEUU, en esta ocasión se le cita en la familia Serranidae del Mar Caribe en las costas de Quintana Roo, México, lo que constituye un nuevo registro en nuestro país. Esta especie se ha identificado también, en peces de las Islas Británicas Occidentales, Jamaica, y en el Pacífico de Panamá. En general, se le encuentra en veinte familias de peces de las costas del Atlántico y Pacífico del Continente Americano y es común en Scorpaenidae de ambos océanos. AgradecimientosSe agradece al personal de Ictiología: señor Héctor Espinoza, maestras en ciencias Patricia Fuentes y Ma. Teresa Gaspar, por su colaboración en la revisión taxonómica de los peces que se mencionan en la presente contribución. De la misma manera al dibujante Felipe Villegas por su ilustración, a la doctora Edna Naranjo García y a la maestra en ciencias Margarita Bravo Hollis por las revisiones del resumen en inglés y del manuscrito, respectivamente. LITERATURABILQUEES, M.F. Digenetic Trematodes fishes of Karachi Coast. Kifayat Academy. Karachi 1981. 207 pp. BILQUEES, M. F. y S. MASOOD Two new trematode species of the genus Hamacreadium Linton, 1910 (Opecoelidae: Plagioporinae) from the Indian mackerel Rastrelliger kanagurt (Cuv.) off the Karachi Coast.Norw. Jour. Zool. 1975.135-139.23 BRAVO-HOLLIS, M. VII. An. Inst. Biol. Univ. Nal. Autón. MéxicoTremátodos de peces marinos de aguas mexicanas. 1954.219-252. 25: CABALLERO y. C., E. An. Inst. Biol. Univ. Nal. Autón. México Un nuevo género de tremátodo de los peces marinos del Puerto de Salina Cruz, Oaxaca, México. 1946.167-174.17 CABALLERO y C., E y G. CABALLERO R. An. Esc. Nal. Cienc. Biol. IPN Estudios de la Colección de tremátodos colectados por Howard A. Winter en peces marinos del Océano Pacífico de México y de los Estados Unidos de Norteamérica. III. 1970. 265-275. 18: DURIO, W.O. y H.W. MANTERJour. Parasit. Some digenetic trematodes of marine fishes of New Caledonia. Part II. Opecoelidae and Lepocreadiidae. 1968.747-756.54 (4): FISCHTAL, J.H. y R.E. KUNTZ Digenetic Trematodes of Fishes from North Borneo (Malaysia) Proc. Helm Soc.Washington1965.63-71.32 (1) GUPTA, N. K. Res. Bull. Panjab. Univ. Studies en the digenetic trematodes of marine fishes from the Gulf of Mannar (India). 1956.61-83.89: GUPTA, N.K. y A. KUMARIJour. Parasit. Proc. Second Int. Con. Parasit. On Hamacreadium manteri sp n. (Trematoda: Allocreadiidae) from fresh-water fisch, Chela bacala and Chela gora at Ropar and Ludhiana. 1970. 127-128. 56(4) Sec. II. Part I: HAFEEZULLAH, M.Parasit. Opecoelid Trematodes of marine fishes of India. 1971. 321-329. 62 (2): LAMOTHE, A.R. An. Inst. Biol. Univ. Nal. Autón. México Redescripción de dos tremátodos digéneos de peces del Pacífico, Mexicano. 1963.97-111.33 (1 y 2): LAMOTHE, A.R. An. Inst. Biol. Univ. Nal. Autón. México Ser. Zool. Tremátodos de peces. IV. Registro de cuatro especies de tremátodos de peces marinos de la costa del Pacífico Mexicano.1971.179-194.40 (2): LINTON, E. Helminth fauna of Dry Tortugas. U. Trematodes, Pap. Tortugas Lab. Carn. Inst. Wash. 1910.11-98.4 (133) MANTER, H.W. Some digenetic trematodes from deep-water fish of Tortugas Florida. Pap. Tortugas Lab. Carn. Inst. Wash, 28 1934.257-346. Publ. No. 4 35: MANTER, H.W. Pap. Helm. Publ. in Comm. of the 30 year jubileum, K.I. Skrjabin The status of Trematode genus Deradena Linton with a description of six species of Haplosplanchnus Loos. (Trematoda)1937. pp. 181. MANTER, H.W. Digenetic Trematodes of Fishes from the Galapagos Islands and the Neighboring Pacific. Allan Hancock Pacific Exped 1940.325-498.2 (14)(1932-1938) MANTER, H.W. Me Digenetic Trematodes of Marine Fishes of Tortugas, Florida. The Amer. Midl. Nat. 1947257-416. 38 (2): MANTER, H.W. Exper. Parasit. The zoogeography of Trematodes of marine fishes. 1955.62-86. 4: MANTER, H.W. Jour. Parasit Studies on digenetic trematodes of fish of Fiji. II. Families Lepocreadiidae, Opistholebetidae and Opecoelidae. 1963.99-113.49 (1): McCOY, O.R. Jour. Parasit. Experimental studies on two Fish Trematodes of the genus Hamacreadium (Family Allocreadiidae) 1930. 1-13. 17 (1): NAGATY, H.F. Jour. Egypt. Med Ass. Trematodes of fishes from the Red Sea. II. The genus Hamacreadium Linton, 1910 (Fam. Allocreadiidae) with a description of two new species. 1941.300-310.24 (7): NAGATY, H.F. y ABDEL AAL T.M. Jour. ParasitTrematodes of fishes from the Red Sea Part. 15. Four new species of Hamacreadium, Family Allocreadiiidae.1962.48 NAGATY, H.F. y T.M. ABDEL AALJour. Arab. Vet. Med Ass. Trematodes of Fishes from the Red Sea. Part. 16. On three new species of Hamacreadium (Family: Allocreadiidae). 1962.301-305.22 (4): OVERSTREET, R.M. Digenetic Trematodes of marine teleost fishes from Biscayne Bay, Florida. Tulane Stud. Zool. and Bot 1969.119-176. 15 (4): PRITCHARD, H.M.L. y H.W. MANTER Studies of Digenetic Trematodes of Hawaiian Fishes: Family Haplosplanchnidae. Proc. Helm. Soc.Washington1961.191-197.28 (2): RAMADAN, M.M. Jap. Jour. Parasit. A review of the trematode genus Hamacreadium Linton, 1910 (Opecoelidae) with description of two new species from the Red Sea fishes, 1983.531-539. 32 (6): SAOUD, M.F.A., ABU SINNA, H. y RAMADAN, M.M. Jour. Egypt. Soc. Parasite. On Hamacreadium caranxi n. sp (Trematoda: Allocreadiidae): an intestinal parasite of a perciform fish from the Red Sea. 1977.181-186. 7: SIDDIQI, A.H. y R.M. CABLE Digenetic Trematodes of marine fishes of Puerto Rico. Sci. Surv. Porto Rico and the Virgin Islands.The New York Acad. of Sci. 1960.255-369.17 (3) SKRJABIN, K.I. y L.K. GUSCHANSKAJA In: Skrjabin K.I. trematodes of animals and man. Moskva. Family Haplosplanchnidae Poche1955.579-616.10 1925. SOGANDARES-BERNAL, F. Tulane Studies in Zoology. Digenetic trematodes of marine fishes from the Gulf of Panama and Bimini, British West Indies. 1959. 69-117.7 (3): SOGANDARES-BERNAL, F. y L. McALISTER SOGANDARES Tul. Stud. Zool. Nine digenetic trematodes of marine fishes from the Atlantic coast of Panama.1961.141-153. 8 (5) WINTER, H.A. An. Inst. Biol. Univ. Nal. Autón México Algunos tremátodos digéneos de peces marinos de aguas del Océano Pacífico del sur de California, USA y del litoral mexicano.1960.183-208. 30 (1-2): YAMAGUTI, S. Japan. Jour. Zool. Studies on the Helminth Fauna of Japan. Part 2. Trematodes of Fishes. I.1934.249-542.5 (3): YAMAGUTI, S. Digenetic Trematodes of Hawaiian fishes. Keigaku Publ.1970. pags. 1-436. YAMAGUTI, S. Synopsis of Digenetic Trematodes of Vertebrates. Keigaku Publ. Co. 1971. 1074 pp. 349 pp. Vol. I y II.
|

