|
MOLUSCOS DE LA LAGUNA MECOACÁN,
TABASCO, MÉXICO: SISTEMÁTICA Y ECOLOGÍA
Trabajo
recibido el 17 de noviembre 1989 y aceptado para su publicación el 11 de
enero 1990.
Antonio García-Cubas
Francisco Escobar de la Llata
Luis Vicente González Ania
Martha Reguero
Instituto de Ciencias del Mar y
Limnología, Universidad Nacional Autónoma de México.
Contribución No. 671 del Instituto de Ciencias del Mar y
Limnología, UNAM.
Se presentan los resultados del
estudio concerniente a la taxonomía, distribución, origen halino
y tipos de nutrición de los moluscos en la laguna Mecoacán y se
mencionan algunos aspectos hidrológicos de la región. Se describe
la distribución local y geográfica, así como el habitat de
42 especies, 20 de ellas correspondientes a la Clase Gastropoda y 22. a la
Clase Bivalvia. El análisis de la distribución y abundancia
relativa muestra que la comunidad de moluscos en el área está
caracterizada por 3 especies de gasterópodos y un número igual de
bivalvos: Littoridina sphinctostoma, Acteocina canaliculata, Odostomia
impressa, Mytilopsis leucophaeata, Rangia flexuosa yMulinia
lateralis. Entre los gasterópodos predominan los organismos
salobres, epifaunales, carnívoros y detritívoros; mientras que
entre los bivalvos destacan las formas salobres, infaunales y filtradoras de
partículas orgánicas. Se discuten los intervalos de afinidad
entre estaciones de muestreo y los índices de similaridad calculados por
análisis de grupos (cluster). Se proporcionan los valores del
índice de diversidad, estimado tanto para la comunidad total de moluscos
como para las Clases Gastropoda y Bivalvia.
Taxonomy, distribution, haline origin and feeding modes of mollusks of Mecoacan
Lagoon are presented, and some hydrological aspects of the region are
mentioned. The local and geographical distribution as well as habitat of 42
species are described, 20 of them corresponded to Class Gastropoda and 22 to
Class Bivalvia. The distribution and relative abundance's analysis pointed out
that mollusks community in this area is characterized by 3 species of
gastropods and an equal number of bivalves: Littoridina sphinctostoma,
Acteocina canaliculata, Odostomia impressa, Mytilopsis leucophaeata, Rangia
flexuosa and Mulinia lateralis. Brackish,
epifaunal, carnivorous and detritus feeders organisms predominated between
gastropods; whereas brackish, infaunal, and filler feeders specimens detached
among bivalves. Affinity ranges between sampling locations and similarity
indexes calculated by cluster analysis are discussed. Diversity indexes values
-estimated for total mollusks community as well as Classes Gastropoda and
Bivalvia- are provided.
El trabajo forma parte de un proyecto de investigación para el estudio de la fauna malacológica que habita en los distintos ecosistemas lagunares del litoral del Golfo de México; el cual comprende el reconocimiento taxonómico general de las diversas especies que habitan en cada una de ellas, asi como la determinación del papel ecológico de las distintas comunidades, sus hábitos de vida y formas de nutrición, su variablidad y abundancia relativa a través de la medida de su diversidad y cálculo de afinidad faunística, lo que permitirá obtener un panorama general de la malacofauna y de esta manera aprovechar mejor los recursos presentes en estos importantes ecosistemas con bases científicas más sólidas. ÁREA DE ESTUDIO
UBICACIÓNLa laguna Mecoacán está situada en el extremo oeste de la costa de Tabasco, cerca del poblado Puerto Ceiba, comprendiendo la porción noroeste de la llanura deltaica del Río Mezcalapa. Se localiza entre las coordenadas 18°16'a 18°26' de latitud norte y 93° 04'y 93°14'de longitud oeste. Su forma es irregular alargada, paralela a la línea de costa, con el eje mayor orientado de este a oeste; con una longitud aproximada de 12 Km, un ancho máximo de 5.5 Km y cubre un área aproximada de 62 Km², está rodeada de pantanos y vegetación de manglar. Se encuentra separada del Golfo de México por una barrera litoral de origen marino, de aproximadamente 12 Km de largo por 3 km de ancho y alrededor de 4 m de altura máxima, formada por antiguos cordones de playa. La comunicación con el Golfo de México es constante y se realiza a través de una boca natural de aproximadamente 300 m de ancho llamada Barra de dos Bocas. En su parte norte, próxima a la desembocadura del Río Seco y la Barra de dos Bocas, se localiza la Isla Morelos; al sur de ella el cuerpo lagunar sufre un estrechamiento llamado Boca Grande, formado por la barra de Bellote y un grupo de pequeños islotes que forman parte del sistema lagunar y asociados a la laguna principal se localizan dos cuerpos de agua pequeños denominados lagunas Tilapa y la Negrita, los cuales comunican a la laguna Mecoacán a través de canales (Fig. 1). HidrografíaEl aporte de agua dulce a la laguna se establece mediante los ríos Seco, Cuscuchapa y Escarbado que vierten su caudal al noroeste, al sureste y al este, respectivamente. El Río Escarbado, cuyo cauce es artificial, se comunica a través de la laguna Tilapa con el Río González, el cual desemboca al Golfo de México a través de la Boca de Chiltepec ubicada al noroeste de la laguna. BatimetríaEn lo que se refiere a la batimetría, ésta corresponde a una laguna somera, con profundidades medias entre 0.90 y 1.20 m y de 3 a 5 m en los canales de acceso. Con lluvias extraordinarias, el nivel medio de la laguna puede elevarse hasta un metro debido a los fuertes aportes fluviales, lo cual puede presentarse desde el mes de septiembre que corresponde al mes más lluvioso, hasta el mes de febrero, de acuerdo con la época de "Nortes" (Gómez Angulo, 1977). CorrientesEl movimiento del agua en el interior de la laguna se efectúa de manera circular, con dirección oeste a este, las velocidades de corriente varían desde 2 hasta 90cm/seg. MareasLas mareas son de tipo diurno, con un rango máximo de 0.90 m en el mes de diciembre y sufren un retardo de 6 hr desde la boca hasta el extremo sur de la laguna (Galaviz-Solíset al., 1987). SedimentosLa textura de los sedimentos y su distribución han sido estudiados en detalle por Galaviz-Solíset al. (1987), quienes determinan que la mayor parte de la laguna presenta sedimentos areno limosos y areno arcillosos. En el área central una franja limo arenosa y en los bordes noreste y sur aparecen sustratos limo arcillosos (Fig. 2). Los aportes de materia orgánica provienen principalmente del manglar que rodea a la laguna asi como del acarreo de los ríos. ClimaEl clima es cálido húmedo (García, 1973) con temperatura media anual de alrededor de 26°C. La precipitación es del orden de 1500 a 1800 mm; la época de mayores lluvias comprende los meses de junio a septiembre, en este último la precipitación promedio es de alrededor de 350 mm; de octubre a enero se presenta la temporada de "nortes"; los meses relativamente secos abarcan de enero a abril. SalinidadA lo largo del año diversos autores señalan amplias variaciones que difieren en las porciones oriental y occidental de la cuenca lagunar principal, relacionadas principalmente con los aportes pluviales y con el movimiento circular de las corrientes. Galaviz-Solís et al. (1987) señalan salinidades de 8 a 16 % en el invierno; para el verano la parte oriental muestra valores bajos que varían de 9 a 15 % y contrastan con los de la porción occidental de la laguna los cuales varían desde 19 hasta 28 %; para el otoño, señalan valores de 6 a 15 %. Los parámetros aportados por CECODES (1981) difieren notablemente: para la estación invernal (enero), entre 1 y 3 % para la parte oriental y entre 4 y 7 % para la occidental; durante la primavera (marzo), entre 5 y 11 % en la parte oriental y de 11 a 16 % en la occidental; para el verano, de 9 a 10 % en la oriental y de 10 a 22 % en la occidental; para el otoño señalan valores entre 1 y 2% para toda la laguna. 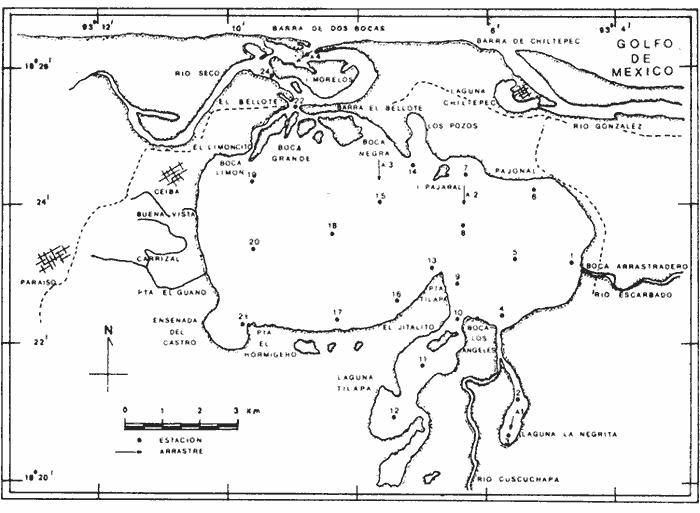 Figura 1. Área de estudio y ubicación de estaciones de muestreo (las flechas indican arrastres). TemperaturaEn la laguna se mantienen aguas cálidas con un promedio de 28°C y una variación anual alrededor de 7°C durante la mayor parte del año. Las temperaturas mínimas se registran en el invierno, coincidiendo con la época de "Nortes" (24-25°C) y las máximas a principios del otoño (28.5 a 32°C). De acuerdo con la información disponible (CECODES 1981), la temperatura durante un ciclo anual, es determinada de la siguiente manera: para el mes de marzo las temperaturas varían en el interior de la laguna entre 28 y 28.5°C; entre 29 y 30°C para el mes de junio; entre 28.5 y 32°C en octubre y las más bajas se registran en el mes de enero, con variaciones de 23.9 a 24°C. ANTECEDENTESLa bibliografía relacionada con el presente trabajo, comprende diversos tópicos: Lara (1972), Iracheta (1972), Garrido y Espinoza (1878) y Gómez Angulo (1978) se refieren a aspectos biológicos y pesqueros de ostión; González Ania (1981), sobre moluscos; Gómez Angulo (1977) y CECODES (1981) a aspectos relacionados con hidrología y productividad; Vázquez Botello (1978, 1979), Vázquez Botello y Mandelli (1980), Castro Gessner (1981), estudian algunos efectos de la contaminación por hidrocarburos en sedimentos y ostiones; Contreras (1985) recopila información general; Galavíz-Solís, Gutiérrez-Estrada y Castro del Río (1987), sobre morfología, sedimentos e hidrodinámica. 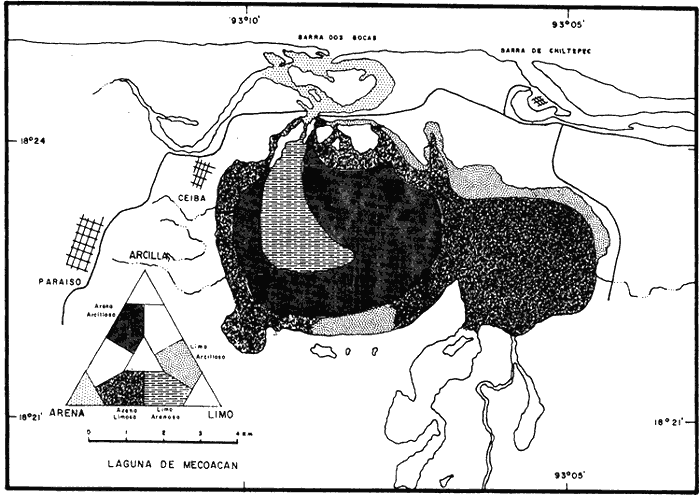 Figura 2. Distribución textural de los sedimentos (tomada de Galaviz, Gutiérrez y Castro, 1987). MATERIAL Y MÉTODOSLas muestras biológicas se colectaron en el otoño de 1979, por medio de una Draga biológica tipo Van Veen con capacidad de dos litros, estableciendo una red de 24 estaciones (ver Fig. 1) distribuidas en la laguna y sistemas lagunares anexos, que incluyen las desembocaduras de los ríos Cuscuchapa, Escarbado y Seco, las lagunas de Dos Bocas, Tilapa y La Negrita. En cada estación se obtuvo un volumen de muestra constante de 5 litros de sedimento superficial húmedo, el cual fué lavado y tamizadoin situ usando una malla de plástico de 2 mm de luz y fijado en formaldehído al 10% neutralizado con borato de sodio para su posterior estudio en el laboratorio. El total de las muestras fué lavado con agua corriente y secado al horno a temperatura constante de 70°C. Posteriormente se procedió a la separación, identificación y cuantificación de los ejemplares vivos y muertos. Para cuantificar las conchas de bivalvos depositados en los sedimentos se adoptó el criterio propuesto por García-Cubas, (1963), considerando a cada valva como un ejemplar. Los especímenes de referencia fueron separados y etiquetados para incorporarlos a la colección del Laboratorio de Malacología del ICMyL. Los ejemplares recolectados fueron sometidos a análisis cualitativo y cuantitativo y referidos a porcentajes parciales y totales, utilizando estos resultados para la obtención de los siguientes índices: DIVERSIDADCon el propósito de obtener una imagen descriptiva de la diversidad de moluscos en la laguna, se efectuaron estimaciones de los valores de diversidad promedio para poblaciones de las Clases Gastropoda, Bivalvia y moluscos en conjunto. La expresión que se empleó como estimador de máxima verosimilitud del índice de Shannon y Wiener fué la propuesta por Pielou (1966). 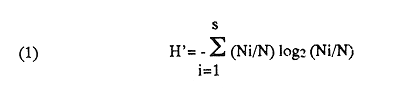 donde S representa el número total de especies en la muestra, Ni es la cantidad de ejemplares pertenecientes a la i-ésima especie y N es el número total de individuos. La ecuación de Shannon-Wiener (1963) está definida solamente para una secuencia infinita de variables aleatorias mutuamente independientes y se expresa: 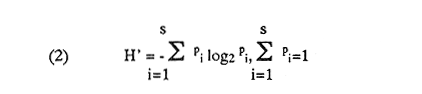 Para poder obtener una estimación estadística de la cantidad de entropía de esta secuencia a partir de una muestra dada, generalmente se sustituye la probabilidad pi desconocida de la fórmula (2) por una estimación pi=Ni/N, resultando así la expresión (1). AFINIDADEl índice de afinidad se obtuvo mediante la aplicación del método de Renkonen (1938) modificado por Amezcua y Yáñez-Arancibia (1980), expresado como: 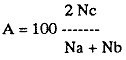 En donde A = Indice de afinidad Na= Número de especies presentes en una estación Nb= Número de especies presentes en otra estación Nc= Número de especies comunes en dos estaciones Los grados de similaridad entre estaciones y entre especies fueron obtenidos mediante el análisis "Cluster", de acuerdo con el programa 46 de encadenamiento simple propuesto por Davies (1971) y su representación gráfica corresponde a los dendrogramas utilizados en el mismo método. RESULTADOS
SISTEMÁTICASe identificó un total de 4284 ejemplares, que incluyen tanto los colectados con draga Van Veen como con una pequeña draga de arrastre de tipo biológico. De éstos, 1868 corresponden a la Clase Bivalvia, con 22 especies agrupadas en 13 Familias y 2416 a la Clase Gastropoda, con 20 especies distribuídas en 11 Familias. A continuación se presenta el arreglo sistemático, así como la referencia blibliográfica de la descripción original, distribución local y geográfica y algunas características ecológicas. El criterio seguido para el arreglo sistemático de los Gasterópodos corresponde al desarrollado por Thiel (1935) y adoptado por Moore et al. (1969), Keen (1971) y García-Cubas (1981) y para los Bivalvos el de Newell (1965) In: Mooreet al. (1969), adoptado por Keen (1971) y García-Cubas (1981). Clase GASTROPODA Cuvier, 1797Subclase Prosobranchia Milne-Edwards, 1848 Orden Archaeogastropoda thiele, 1925 Superfamilia Neritacea Rafinesque, 1815 Familia Neritidae Rafinesque, 1815 Género Neritina Linnaeus, 1758 1) Neritina reclivata (Say) (Lám. 1, Fig. 1) Theodoxus reclivata Say, 1822.J. Ac. Nat. Sci. Phila., 2:257. Distribución local. Estaciones LM-1, LM-7, LM-8, LM-9, LM-14, LM-17 y frente a la estación LM-3 sobre el mangle. Distribución geográfica. Florida (EUA), Golfo de México a las Antillas. Habitat. Es una forma común en aguas salobres a dulces, frecuentemente se le encuentra sobre la vegetación sumergida, debido a sus hábitos nutritivos micrófagos. Subgénero Vitta Mörch, 1852 2) Neritina (Vitta) virginea(Linnaeus) (Lám. 1, Fig. 2) Nerita virginea Linnaeus, 1758. Syst. Nat., 10 Ed., 778. Distribución local. Estaciones LM-3, LM-5, LM-7, LM-8, LM-9, LM-13, LM-14, LM-15, LM-17, LM-18, LM-20. Distribución geográfica. Desde la Florida (EUA), Golfo de México, (Laguna de Términos, Camp., México). Habitat. Aguas someras; epifaunal entre rocas, nutrición micrófaga de materia orgánica depositada. Orden Mesogastropoda Thiele, 1925 Superfamilia Rissoacea Gray, 1847 Familia Vitrinellidae Bush, 1897 Subfamilia Vitrinellinae Bush, 1897 Género Vitrinella C. B. Adams, 1850 Subgénero VitrinellaC. B. Adams, 1850 3) Vitrinella (Vitrinella) floridana Pilsbry y McGinty (Lám. 1, Fig. 3) Vitrinella (Vitrinella) floridana Pilsbry y McGinty, 1946. Nautilus, 60 (1): 16, lám. 2, figs. 4, 4a. Distribución local. Estaciones LM-4, LM-5, LM-6, LM-7, LM-8, LM-10, LM-13, LM-15, LM-18, LM-20. Distribución geográfica. Desde la Florida (EUA) hasta el sur del Golfo de México (Laguna de Términos, Camp., México). Habitat. Aguas someras; epifaunal entre rocas, nutrición micrófaga de materia orgánica depositada. Subfamilia Teinostomatinae Cossman, 1917 Género Teinostoma H. y A. Adams, 1854 4) Teinostoma lerema Pilsbry y McGinty (Lám. 1, Fig. 4) Teinostoma lerema Pilsbry y McGinty, 1945. Nautilus, 59 (1):4. Distribución local. Estaciones LM-2, LM-3, LM-4, LM-7. Distribución geográfica. Desde la Florida (EUA) al Golfo de México e Islas Vírgenes. Habitat. Areas cercanas a la costa, bahías y lagunas costeras; nutrición micrófaga de materia orgánica depositada. Familia Hydrobiidae Stimpson, 1865 Género Potamopyrgus Stimpson, 1887 5) Potamopyrgus coronatus (Pfeiffer) (Lám. 1, Fig. 5) Paludina coronata Pfeiffer, 1840. Arch. F. Natur., 6 (139): 253. Distribución local. Estaciones LM-1 y LM-6. Distribución geográfica Campeche (México), América Central y las Antillas. Habitat. De aguas dulces a salobres de muy baja salinidad; nutrición herbívora. Género HydrobiaHartman, 1821 6) Hydrobia totteniMorrison (Lám. 1, Fig. 6) Hydrobia totteni Morrison, 1954. J. Wash Ac. Sci., 441 (1): 26. Distribución local. Estaciones LM-1, LM-4, LM-5, LM-6, LM-7, LM-8, LM-14. Distribución geográfica. Desde la Península del Labrador hasta el Golfo de México. Habitat. Abundante en aguas someras, es una especie asociada con algas verdes; nutrición micrófaga de materia orgánica depositada. Género LittoridinaEydoux y Souleyet, 1852 SubgéneroTexadina Abbott y Ladd, 1951 7)Littoridina (Texadina) sphinctostoma Abbott y Ladd (Lám. 1, Fig. 7) Littoridina (Texadina) sphinctostoma Abbott y Ladd, 1951. J. Wash. Ac. Sci., 41 (10): 335, fig. 12. Distribución local. Estaciones LM-1, LM-2, LM-3, LM-4, LM-5, LM-6, LM-7, LM-8, LM-10, LM-11, LM-12, LM13, LM-14, LM- 15, LM-17, LM-18, LM-22, LM-23. Distribución geográfica. Desde el Mississippi (EUA), Golfo de México hasta Quintana Roo (México). Habitat. Especie muy frecuente en aguas salobres de zonas lagunares y estuarinas; epifaunales en fondos limoarenosos; se alimenta de partículas orgánicas depositadas en el sustrato. Superfamilia Cerithiacea Fleming, 1822 Familia Cerithidae Fleming, 1822 Subfamilia Diastominae Cossman, 1895 GéneroDiastoma Deshayes, 1850 SubgéneroBittium Say, 1847 8) Diastoma (Bittium) varium (Pfeiffer) (Lám. 1, Fig. 8) Cerithium varium Pfeiffer, 1840. Arch. f. Natur., 6 (1): 256-57. Distribución local. Estaciones LM-4, LM-5, LM-6, LM-7, LM-8, LM-10, LM-15. Distribución geográfica. Comprende desde Maryland (EUA), costas del Golfo de México hasta Brasil. Habitat. Epifaunal entre la vegetación sumergida, en bahías y lagunas costeras; su nutrición es fitófaga. Familia Potamididae H. y A. Adams, 1854 Subfamilia Potamidinae H. y A. Adams, 1854 Género CerithideaSwainson, 1840 SubgéneroCerithideopsis Thiele, 1929 9)Cerithidea (Cerithideopsis) pliculosa (Menke) (Lám. 1, Fig. 9) Cerithium pliculosum Menke, 1829. Verz. Conchy. Samm. Pyremont, 2 Ed.: 27. Distribución local. Estaciones LM-4, LM-5, LM-7, LM-10, LM-14, M-15, LM-20. Distribución geográfica. Desde Louisiana (EUA), Golfo de México a Centro América. Habitat. Frecuentes en aguas someras marinas y salobres; alimentación de materia orgánica depositada. Superfamilia Epitoniacea Berry, 1910 Familia Epitoniidae Berry, 1910 Género EpitoniumRöding, 1798 SubgéneroGyroscala de Boury, 1887 10)Epitonium (Gyroscala) rupicola (Kurtz) (Lám. 1, Fig. 10) Scalaria rupicola Kurtz, 1860.Cat. Rec. Mar. Moll. Portland Mus. : 7. Distribución local. Estación LM-15. Distribución geográfica. Desde Cabo Cod, Massachusetts (EUA), hasta el sur del Golfo de México. Habitat. Presentes generalmente en aguas someras a moderadamente profundas, tanto salobres como marinas, forman parte de la infauna; su nutrición es carnívora. Superfamilia Calyptraeacea Blainville, 1824 Familia Calyptraeidae Blainville, 1824 Subfamilia Crepidulinae Fleming, 1822 GéneroCrepidula Lamarck, 1799 SubgéneroIanacus Mörch, 1852 11)Crepidula (Ianacus) plana Say (Lám. 1, Fig. 11) Crepidula plana Say, 1822.J. Ac. Nat. Sci. Phila., 2 (1): 226. Distribución local. Estaciones LM-7, LM-13, LM-18, LM-20. Distribución geográfica. Desde Canadá, costas del Golfo de México, las Antillas hasta Brasil. Habitat. Se le encuentra comúnmente adherida a objetos sumergidos, tanto en aguas salobres como marinas. Orden Neogastropoda Wenz, 1938 Superfamilia Buccinidae Rafinesque, 1815 Familia Columbellidae Swainson, 1840 Género Anachis H. y A. Adams, 1853 Subgénero Costanachis Sacco, 1890 12) Anachis (Costanachis) semiplicata (Stearns) (Lám. 1, Fig. 12) Columbella semiplicata Stearns, 1873.Proc. Ac. Nat. Sci. Phila 25: 344. Distribución local. Estación LM-15. Distribución geográfica. Comprende desde la Florida (EUA), costas deL Golfo de México, Bermudas hasta Uruguay. Habitat. Epifaunal, frecuentemente se localiza sobre la vegetación sumergida en lagunas costeras y bahías; es una especie carnívora. Familia Nassaridae Iredale, 1916 Género NassariusDuméril, 1806 SubgéneroNassarius Duméril, 1806 13)Nassarius (Nassarius) acutus (Say) (Lám. 1, Fig. 13) Nassa acutus Say, 1822. J. Ac. Nat. Sci. Phila 2 (1): 234. Distribución local. Estaciones LM-5 y LM-15. Distribución geográfica. Comprende desde la Florida (EUA), hasta el sur deL Golfo de México. Habitat. Es una especie seminfaunal en lagunas costeras y bahías; su nutrición es carnívora y en ocasiones carroñera. Subclase Opisthobranchia Milne Edwards, 1848 Orden Pyramidelloida Gray, 1840 Superfamilia Pyramidellacea Gray, 1840 Familia Pyramidellidae Gray, 1840 Género Pyramidella Lamarck, 1799 14) Pyramidella fusca (C. B. Adams) (Lám. 1, Fig. 14) Pyramis fusca C. B. Adams, 1839. Bost. J. Natur. Hist., 2 (2): 282, lám. 4, fig. 9. Distribución local. Estaciones LM-1, LM-6, LM-8, LM-11, LM-17. Distribución geográfica. Comprende desde Carolina deL Sur (EUA), Golfo de México y las Antillas. Habitat. En aguas someras, de salobres a marinas, es epifaunal y ectoparásita. Subfamilia Odostomiinae Pelseneer, 1928 Género OdostomiaFleming, 1817 15) Odostomia weberiMorrison (Lám. 2, Fig. 15) Odostomia weberi Morrison, 1965. Proc. Biol. Soc. Wash., 78: 221, fig. 3. Distribución local. Estaciones LM-1, LM-4, LM-5, LM-6, LM-7, LM-10, LM-11, LM-18. Distribución geográfica. Desde Louisiana (EUA), hasta el sur del Golfo de México. Habitat. Es una especie característica de aguas salobres, epifaunal y ectoparásita especialmente de bivalvos. Subgénero MenesthoMüller, 1842 16) Odostomia (Menestho) impressa (Say) (Lám. 2, Fig. 16) Turritella impressa Say, 1822. J. Ac. Nat. Sci. Phila., 2 (1): 244. Distribución local. Estaciones LM-1, LM-4, LM-6, LM-7, LM-8, LM-13, LM-14, LM-15, LM-18. Distribución geográfica. Abarca desde Massachusetts (EUA), hasta el sur del Golfo de México. Habitat. Es una especie epifaunal, ectoparásita, muy frecuente en bancos de ostión. Subfamilia Turbonillinae Simroth, 1907 Género Turbonilla Risso, 1826 17) Turbonilla interrupta (Totten) (Lám. 2, Fig. 17) Turritella interrupta Totten, 1835. Amer. J. Sci., 28 (2):352, fig. 7. Distribución local. Estación LM-15. Distribución geográfica. Comprende desde el Estado de Maine (EUA) al Golfo de México, las Antillas hasta Brasil. Habitat. Frecuente en áreas protegidas a lo largo de la costa y corresponde a una forma epifaunal y ectoparásita. Orden Cephalaspidea Fischer, 1883 Superfamilia Acteonacea d'Orbigny, 1842 Familia Atyidae Thiele, 1926 GéneroHaminoea Turton y Kingston, 1830 18)Haminoea antillarum d'Orbigny (Lám. 2, Fig. 18) Haminoea antillarum d'Orbigny, 1842. In: de la Sagra (Ed.) Hist. Fis. Pol. Nat de la Isla de Cuba: 124, lám. 4, figs. 9-12. Distribución local. Estación LM-8. Distribución geográfica. Golfo de México a las costas de Yucatán (México), las Antillas y noreste de Brasil. Habitat. Común en aguas someras y áreas protegidas a lo largo de la costa, seminfaunal; carnívora. Familia Acteocinidae Pilsbry, 1921 Género Acteocina Gray, 1847 19) Acteocina canaliculata (Say) (Lám. 2, Fig. 19) Volvaria canaliculata Say, 1826. J. Ac. Nat. Sci. Phila 5 (1): 211. Distribución local. Estaciones LM-1, LM-2, LM-3, LM-4,, LM-5, LM-6, LM-7, LM-8, LM-10, LM-11, LM-12, LM-13, LM-14, LM- 15, LM-17, LM-18, LM-20, LM-22, LM-23. Distribución geográfica. Comprende desde Nueva Escocia (EUA), Golfo de México a las Antillas. Habitat. En bahías de moderada salinidad, infaunales; tipo de alimentación carnívora. Subclase Pulmonata Cuvier, 1797 Orden Basommatophora A. Schmidt, 1855 Superfamilia Melampacea Stimpson, 1851 Familia Melampidae Stimpson, 1851 Género Melampus Montfort, 1810 20) Melampus coffeus (Linnaeus) (Lám. 2, Fig. 20) Bulla coffeus Linnaeus, 1758.Syst. Nat., 10 Ed.: 729. Distribución local. Frente a la estación LM-3 en el margen de la laguna sobre mangle. Distribución geográfica. Desde la Florida (EUA), las Antillas hasta Brasil. Habitat. Epifaunales sobre la vegetación de manglar y tipo de nutrición micrófaga. Clase BIVALVIA Linnaeus, 1758Subclase Pteriomorphia Beurlen, 1944 Orden Arcoida Stoliczka, 1871 Superfamilia Arcacea Lamarck, 1809 Familia Arcidae Lamarck, 1809 Subfamilia Anadarinae Reinhart, 1935 Género AnadaraGray, 1847 Subgénero CunearcaDall, 1898 21) Anadara (Cunearca) brasiliana (Lamarck) (Lám. 2, Fig. 21) Arca brasiliana Lamarck, 1819. Hist. Nat. Anm. sans Vert., 6:44. Distribución local. En el arrastre A-4 en la barra de Dos Bocas. Distribución geográfica. Comprende desde Carolina del Norte (EUA), Golfo de México hasta Brasil. Habitat. En aguas someras de fondos arenosos formando parte de la infauna superficial; hábitos alimenticios filtrantes de partículas en suspensión. SubgéneroLarkinia Reinhart, 1935 22)Anadara (Larkinia) transversa (Say) (Lám. 2, Fig. 22) Arca transversa Say, 1822.J. Ac. Nat. Sci. Phila 2: 269. Distribución local. En el arrastre A-4 que comprende la Barra de Dos Bocas. Distribución geográfica. Desde el sur de Cabo Cod (EUA), Golfo de México a la Laguna de Términos, Camp. (México) hasta las Antillas. Habitat. De la zona litoral hasta 11 m de profundidad; formando parte de la infauna; hábitos alimenticios filtrantes de partículas en suspensión. Subgénero Lunarca Gray, 1857 23)Anadara (Lunarca) ovalis (Bruguière) (Lám. 2, Fig. 23) Arca ovalis Bruguière, 1789. Hist. Nat. Anm. sans Vert., In: Ency. Meth., 1 (1): 110. Distribución local. En el arrastre A-4 en la Barra de Dos Bocas. Distribución geográfica. Desde Cabo Cod (EUA), Golfo de México, las Antillas hasta Brasil. Habitat. En fondos arenosos y duros, próximos a la costa en aguas salobres; formando parte de la infauna superficial; hábitos alimenticios filtrantes de partículas en suspensión. Orden Mytiloidea Férrusac, 1822 Superfamilia Mytilacea Rafinesque, 1815 Familia Mytilidae Rafinesque, 1815 Subfamilia Mytilinae Rafinesque, 1815 GéneroBrachidontes Swainson, 1840 Subgénero Hormomya Mörch, 1853 24) Brachidontes (Hormomya) exustus(Linnaeus) (Lám. 2, Fig. 24) Mytilus exustus Linnaeus, 1758. Syst. Nat., 10 Ed.: 705. Distribución local. Estaciones LM-4, LM-5, LM-7, LM-8, LM-14 y LM-20. Distribución geográfica. Desde Carolina del Norte (EUA), Golfo de México, las Antillas hasta Uruguay. Habitat. Formas epifaunales sobre rocas y bancos ostrícolas fijados mediante un biso fibroso; abundantes en aguas salobres someras; hábitos alimenticios filtrantes de partículas en suspensión. GéneroIschadium Jukes-Brown, 1905 25)Ischadium recurvum (Rafinesque) (Lám. 2, Fig. 25) Mytilus recurvus Rafinesque, 1820.Ann. Gen. Sci. Phys. Bruxelles, 5: 320. Distribución local. Estaciones LM-7, LM-9, LM-14, LM-18 y arrastre A-2. Distribución geográfica. Cabo Cod (EUA), Golfo de México y las Antillas. Habitat. En aguas salobres y someras formando parte de la epifauna, viven adheridas mediante un biso fibroso a rocas y bancos de ostras; su nutrición es filtrante. Orden Pteroidea Newell, 1965 Suborden Ostreina Newell, 1965 Superfamilia Ostreacea Rafinesque, 1815 Familia Ostreidae Rafinesque, 1815 Género Crassostrea Sacco, 1791 26) Crassostrea Virginica (Gmelin) (Lám. 2, Fig. 26) Ostrea virginicaGmelin, 1791. Syst. Nat. 13 Ed., 1 (6): 3336. Distribución local. Estaciones LM-7, LM-8, LM-9, LM-13, LM- 14, LM-18, LM-22 y arrastres A-3 y A-4. Distribución geográfica. Desde el Golfo de San Lorenzo (Canadá), O. Atlántico, Golfo de México a las Antillas. Habitat. Es una especie característica de aguas salobres, se le encuentra en lagunas y esteros formando parte de la epifauna cementante; sus hábitos alimenticios son filtrantes de partículas orgánicas en suspensión. Subclase Heterodonta Neumayr, 1884 Orden Veneroida H. y A. Adams, 1858 Suborden Lucinina Dall, 1889 Superfamilia Lucinacea Fleming, 1828 Familia Lucinidae Fleming 1828 GéneroLucina Bruguière, 1797 Subgénero Phacoides Blainville, 1825 27) Lucina (Phacoides) pectinata(Gmelin) (Lám 2, Fig. 27) Tellina pectinata Gmelin, 1791. Syst. Nat., 13 Ed.,1 (6): 3236. Distribución local. Estaciones LM-4, LM-5, LM-7, LM-8, LM-10, LM-14, LM-18, LM-20 y arrastres A-3 y A-4. Distribución geográfica. Desde Carolina del Norte (EUA), Golfo de México, las Antillas a Brasil. Habitat. En aguas someras de bahías y lagunas formando parte de la infauna superficial; son formas cavadoras con nutrición filtrante. Superfamilia Cyrenoidacea Olsson, 1961 Familia Cyrenoididae H. y A. Adams, 1857 Género Cyrenoida Joannis, 1835 28) Cyrenoida floridana Dall (Lám. 3, Fig. 28) Cyrenoida floridana Dall, 1889.U.S. Nat. Mus., 37: 50. Distribución local. En las estaciones LM-1, LM-2, LM-3, LM-6, LM-14 y en el arrastre A-1. Distribución geográfica. De las costas de Georgia (EUA) al Golfo de México. Habitat. Comunes en aguas salobres a dulces; forman parte de la infauna superficial y son filtradores suspensívoros. Superfamilia Cardiacea Goldfuss, 1820 Familia Cardiidae Goldfuss, 1820 Gubfamilia Laevicardiinae Keen, 1936 GéneroLaevicardium Swainson, 1840 29)Laevicardium mortoni (Conrad) (Lám. 3, Fig. 29) Cardium mortoni Conrad, 1831.J. Ac. Nat. Sci. Phila., 6:259, lám. 11, figs. 5-7. Distribución local. En el arrastre A-4. Distribución geográfica. Comprende desde el Cabo Cod, Massachusetts (EUA), al Golfo de México y las Antillas. Habitat. Frecuente en aguas someras de la costa y en lagunas litorales formando parte de la infauna superficial, predominan en fondos fangosos con vegetación; su nutrición es filtrante. Género DinocardiumDall, 1900 30) Dinocardium robustum(Solander) (Lám. 3, Fig. 30) Cardium robustum Solander, 1786. Portland Mus. Cat.: 58. Distribución local. En el arrastre A-4. Distribución geográfica. Costas de Virginia (EUA), al Golfo de México. Habitat. En áreas costeras, bahías y esteros con influencia marina. Es común encontrar formas juveniles sobre fondos de fango o arena formando parte de la infauna superficial; su nutrición es filtrante. Superfamilia Mactracea Gray, 1832 Familia Mactridae Gray, 1832 Subfamilia Mactrinae Lamarck, 1809 GéneroMulinia Gray, 1837 31) Mulinia lateralis (Say) (Lám. 3, Fig. 31) Mactra lateralis Say, 1882. J. Ac. Nat. Sci. Phila., 2 (2): 309. Distribución local. En las estaciones LM-1, LM-2, LM-3, LM-4, LM-6, LM-7, LM-8, LM-10, LM-12, LM-14, LM-20 y arrastre A- 2. Distribución geográfica. Desde Maine (EUA), hasta el sur del Golfo de México. Habitat. Es una forma común en lagunas costeras, se adapta fácilmente a diversos rangos de salinidad y a distintos sustratos preferentemente en sedimentos arcillosos, forman parte de la infauna superficial; su nutrición es filtrante. Género Rangía Desmoulins, 1832 Subgénero Rangia s. s. 32) Rangia (Rangia) cuneata (Gray) (Lám. 3, Fig. 32) Gnathodon cuneata Gray, 1831. In: Sowerby, Gen. Shells, lám. 36, figs. 1-4. Distribución local. Estación LM-2 Distribución geográfica. Desde Chesapeake (EUA), hasta el sur del Golfo de México. Habitat. Lagunas costeras y esteros de baja salinidad, es una capecie típicamente estuarina (0-15 %) en áreas influídas por ríos, preferentemente en fondos limo-arcillosos, forman parte de la infauna superficial; su nutrición es filtrante. Subgénero Ragianella Conrad, 1868 33) Rangia (Rangianella) flexuosa (Conrad) (Lám. 3, Fig. 33) Gnatodon flexuosa Conrad, 1839. Amer. J. Sci., 38 (1): 92, fig. 1. Distribución local. Estaciones LM-1, LM-2, LM-4, LM-5, LM-7, LM-8, LM-9, LM-10, LM-12, LM-14, LM-15, LM17, LM-18, LM-20 y arrastres A-1, A-2, A-3 y A-4. Distribución geográfica. Desde Louisiana (EUA), hasta el sur del Golfo de México. Habitat. Presentes en aguas salobres con fuerte influencia de agua dulce, forman parte de la infauna superficial en fondos blandos; su nutrición es filtrante. Superfamilia Tellinacea Latreille, 1825 Familia Tellinidae Blainville, 1814 Subfamilia Macominae Olsson, 1961 Género Macoma Leach, 1819 Subgénero Psammacoma Dall, 1900 34) Macoma (Psammacoma) brevifrons (Say) (Lám. 4, Fig. 34) Tellina brevifrons Say, 1834. N. Amer. Conch., 7. 227, lám. 64, fig. 1. Distribución local. Estación LM-2. Distribución geográfica. Desde Carolina del Sur (EUA), Golfo de México, las Antillas hasta Brasil. Habitat. En áreas marginales de bahías y lagunas influídas por agua marina; tomando parte de la infauna. Subgénero AustromacomaOlsson, 1961 35) Macoma (Austromacoma) constricta (Bruguière) (Lám. 4, Fig. 35) Solen constricta Bruguière, 1792.Hist. Nat. Vers., 1 (3): 126. Distribución local. Estaciones LM-5, LM-17, LM-20 y arrastres A-2 y A-4. Distribución geográfica. De Carolina del Norte (EUA), Golfo de México, las Antillas hasta Brasil. Habitat. En bahías y lagunas costeras tolerando amplios rangos de salinidad; vive enterrada formando parte de la infauna; se nutre de materia orgánica depositada en el fondo. Subgénero Rexithaerus Tryon, 1869 36) Macoma (Rexithaerus) mitchelli Dall (Lám. 4, Fig. 36) Macoma mitchelli Dall, 1895. Nautilus, 9: 33. Distribución local. Estación LM-8 y arrastre A-1. Distribución geográfica. De Carolina del Sur (EUA) hasta el sur del Golfo de México. Habitat. Frecuente en lagunas y esteros con influencia de ríos formando parte de la infauna; su nutrición es de materia orgánica depositada en el fondo. Familia Donacidae Fleming, 1828 Género Donax Linnaeus, 1758 37) Donax variabilis texasiana Philippi (Lám. 4, Fig. 37) Donax texasiana Philippi, 1847.Zeit. f Malakozool., 4: 77. Distribución local. Estaciones LM-4, LM-23 y arrastre A-4. Distribución geográfica. Desde el Norte de Texas (EUA), hasta el sur del Golfo de México. Habitat. Aguas someras; forman parte de la infauna en sustratos arenosos; tipo de nutrición filtrante. Familia Solecurtidae d'Orbigny, 1846 GéneroTagelus Gray, 1847 38) Tagelus plebeius (Lightfoot) (Lám. 4, Fig. 38) Solen plebeius Lightfoot, 1786. Portland Mus. Cat.: 42, 101, 156. Distribución local. Estaciones LM-4, LM-5, M-10 y arrastre A-2. Distribución geográfica. De Cabo Cod (EUA), Golfo de México, las Antillas hasta Brasil. Habitat. De aguas profundas a moderadamente someras; forman parte de la infauna, tipo de nutrición micrófaga a base de partículas orgánicas así como de pequeños animales y plantas depositadas en el sustrato en el que ellos habitan. Suborden Articina Newell, 1965 Superfamilia Dreissenacea Gray, 1840 Familia Dreissenidae Gray,1840 GéneroMytilopsis Conrad, 1858 39)Mytilopsis leucophaeata (Conrad) (Lám. 4, Fig. 39) Mytilopsis leucophaeata Conrad, 1831. J. Ac. Nat. Sci. Phila., 6: 263, lám. 11, fig. 13. Distribución local. Estaciones LM-1, LM-3, LM-4, LM-6, LM-7, LM-8, LM-9, LM-12, LM-13, LM-14, LM-15, LM-17, LM-18 y arrastres A-1, A-2 y A-3. Distribución geográfica. De Nueva York (EUA), hasta el sur del Golfo de México. Habitat. En aguas dulces a salobres; fijos sobre rocas, formando parte de la infauna; tipo de nutrición suspensívora micrófaga. Superfamilia Veneracea Rafinesque, 1815 Familia Veneridae Rafinesque, 1815 Subfamilia Chioninae Frizzell, 1936 GéneroChione Mühlfeld, 1811 Subgénero Chione Mühlfeld, 1815 40) Chione (Chione) cancellata(Linnaeus) (Lám. 4, Fig. 40) Venus cancellata Linnaeus, 1767. Syst. Nat., 13 Ed.: 1130. Distribución local. Estaciones LM-9, LM-13 y arrastre A-4. Distribución geográfica. De Carolina del Norte (EUA), Golfo de México, las Antillas hasta Brasil. Habitat. Común en aguas someras marinas con fondos arenosos; constituye parte de la infauna; tipo de nutrición filtrante. Subfamilia Cyclinae Frizzell, 1936 GéneroCyclinella Dall, 1902 41) Cyclinella tenuis (Récluz) (Lám. 4, Fig. 41) Dosinia tenuis Récluz, 1852. J. Conchil., 3: 250, lám.. 10, fig. 1. Distribución local. Estación LM-9. Distribución geográfica. Costas de Virginia (EUA), Golfo de México hasta Brasil. Habitat. Moderadamente común en aguas someras, forma parte de la infauna; tipo de nutrición filtrante. Familia Petricolidae Deshayes, 1831 Subfamilia Petricolinae Deshayes, 1831 Género PetricolaLamarck, 1801 SubgéneroPetricolaria Stoliczka, 1870 42)Petricola (Petricolaria) pholadiformis (Lamarck) (Lám. 4, Fig. 42) Petricolaria pholadiformis Lamarck, 1818. Hist. Nat. Anm. sans Vert.: 505. Distribución local. Estación LM-13. Distribución geográfica. Del Golfo de San Lorenzo (Canadá), al sur del Golfo de México. Habitat. Areas marginales de bahías y lagunas costeras influídas por agua marina, sobre conchas de almejas y ostiones, formando parte de la epifauna; tipo de nutrición filtrante. ANALISIS CUANTITATIVOS Y PORCENTUALESEl resultado de los análisis efectuados sobre 4284 ejemplares, tanto de macromoluscos como de micromoluscos presentes en muestras de volumen constante, de 5 litros de sedimento superficial obtenidas en cada estación mediante draga del tipo Van Veen, se exponen en la Tabla 1, que concentra las poblaciones totales de moluscos, el valor porcentual de cada especie por estación, asi como sus porcentajes globales. Dentro de la población total de moluscos predominan los de la Clase Gastropoda con 2416 ejemplares, los cuales representan el 56.4%, mientras que en la Clase Bivalvia se cuantificaron 1868 ejemplares que equivalen a un 43.6%. 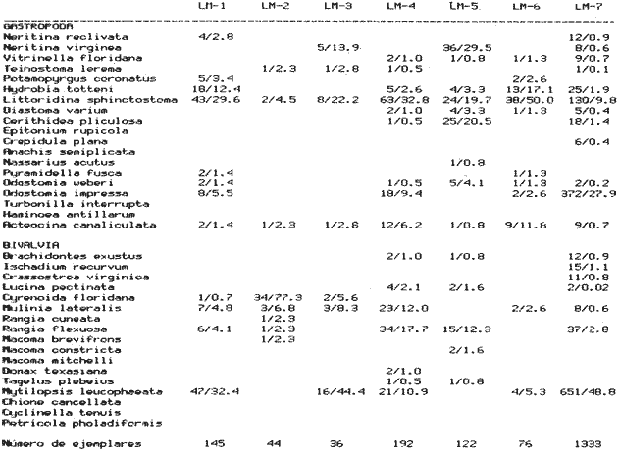 TABLA 1 NÚMERO DE EJEMPLARES Y PORCENTJES DE CADA ESPECIE POR ESTACIÓN Y SUS TOTALES 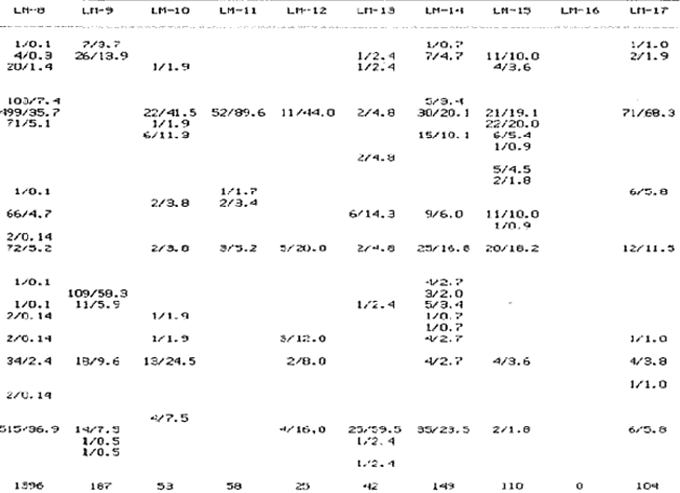 CONTINUACIÓN... 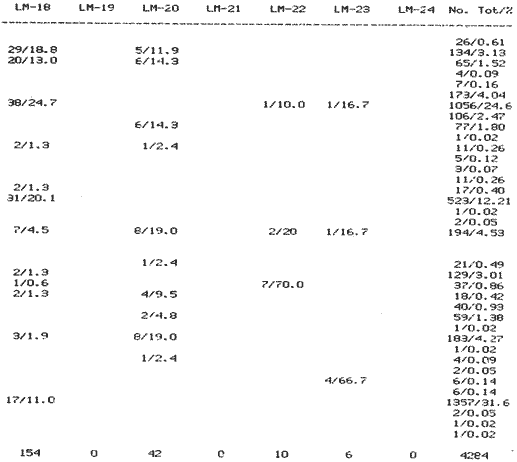 CONTUNUACIÓN... Las especies de gasterópodos con más amplia distribución y mayor abundancia son: Littoridina (Texadina) sphinctostomapresente en 18 de las 24 estaciones de muestreo establecidas, con 1056 ejemplares; Acteocina canaliculata en 19 estaciones con 194 ejemplares y Odostomia (Menestho) impressa en 9 estaciones con 523 ejemplares. Estas tres especies representan por su abundancia el 73.4% de gasterópodos presentes en la laguna. Las especies de bivalvos más abundantes y con mayor distribución son:Rangia (Rangianella) flexuoso presente en 14 estaciones de muestreo con 183 ejemplares; Mytilopsis leucophaeata, en 13 estaciones con 1357 ejemplares y Mulinia lateralis en 13 estaciones con 183 ejemplares, representando en conjunto el 85.6% de los bivalvos. Las mayores poblaciones se localizaron al norte de la laguna en las estaciones LM-7 y 8; contrastando fuertemente con la zona occidental, despoblada de moluscos, en donde se ubican las estaciones LM-16,19,20 y 24. Con respecto a las formas colectadas vivas (sin tomar en cuenta los bancos de ostión), se cuantificaron en total 138 individuos que representan el 3.22% de la población total de moluscos. La Clase Gastropoda alcanzó un valor porcentual de 1.26% con 54 ejemplares, predominando Littoridina (Texadina) sphinctostoma con 47 individuos registrados en 4 estaciones de la parte oriental de la laguna. La Clase Bivalvia estuvo representada por 84 ejemplares que corresponden al 1.96% de la población total. La especieIschadium recurvum resultó la más abundante, aunque restringida a una sola estación frente a la Punta Tilapa, con 80 ejemplares (Tabla 2). Los resultados de los muestreos mediante draga biológica de arrastre hechos, como ya se señaló, con fines puramente cualitativos a fin de no omitir alguna especie de la comunidad malacológica, se muestran en la Tabla 3, observándose que Mytilopsis leucophaeata y Rangia (Rangianella) flexuosa destacan tanto por su abundancia como por su distribución en la laguna. 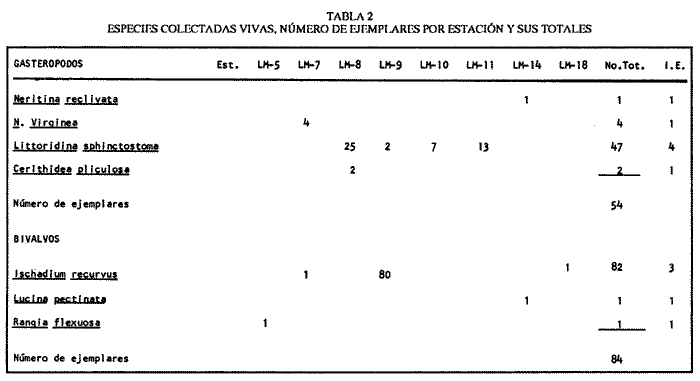 TABLA 2 ESPECIES COLECTADAS VIVAS, NÚMERO DE EJEMPLARES POR ESTACIÓN Y SUS TOTALES HÁBITOS DE VIDA Y NUTRICIÓNLa Tabla 4 resume los hábitos de vida de los moluscos presentes en el complejo lagunar, en lo que se refiere a sus relaciones con el sustrato, tipos de nutrición y ambiente halino en que habitan, así como el número y porcentajes parciales y totales que representan, tanto a nivel Familia como de especie. En lo que respecta a las poblaciones de gasterópodos se observa un marcado predominio de formas epifaunales, las formas seminfaunales e infaunales se hallan pobremente representadas, en cambio entre los bivalvos estas últimas ocupan un lugar preponderante en la comunidad. 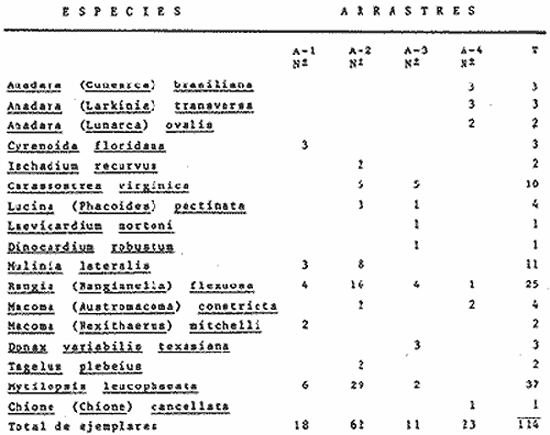 TABLA 3 ESPECIES COLECTADAS MEDIANTE DRAGA BIOLÓGICA DE ARRASTRE, NÚMERO DE EJEMPLARES POR ESTACIÓN Y TOTALES De acuerdo con los hábitos nutritivos, se observa una notable incidencia de formas carnívoro-necrófagas entre los de la Clase Gastropoda y filtradores-suspensívoros para la Clase Bivalvia. En relación al origen halino de las especies identificadas predominan las salobres en ambas Clases. Las figuras 3, 4, 5 y 6 relacionan a nivel de Familia hábitos de vida con respecto al sustrato, tipos de nutrición y ambientes halinos, para ambas Clases. DIVERSIDADLos valores obtenidos para H'en bits/individuo fueron de] orden de 2.572 para la Clase Gastropoda, de 1.572 para Bivalvia y 3.124 para el Phylum. Basharin (1959) ha demostrado que el valor medio y la varianza de la distribución de la variable aleatoria H tienen las formas: 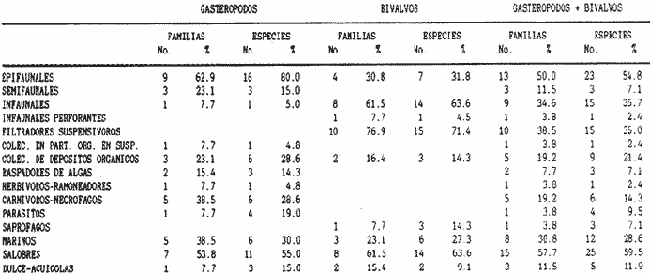 TABLA 4 NÚMERO Y PORCENTAJE DE FAMILIAS Y ESPECIES DE I.AS CLASES GASTROPODA Y BIVALVIA EN RELACIÓN AL SUSTRATO, FORMAS DE NUTRICIÓN Y ORIGEN HALINO El valor del sesgo es insignificante, pues la estimación (H') difiere del valor esperado en 0.2% a 0.4% tanto para las dos Clases de moluscos como para su conjunto. 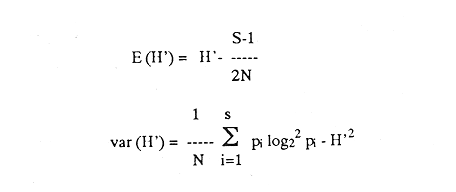 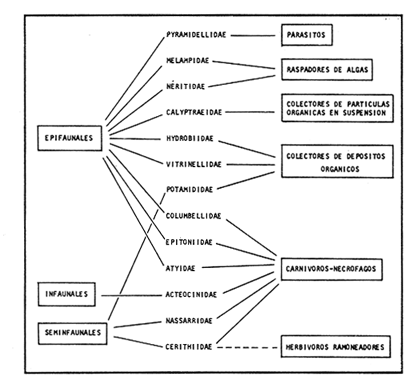 Figura 3. Posición respecto al sustrato y tipos de nutrición de las Familias de la Clase Gastropoda. 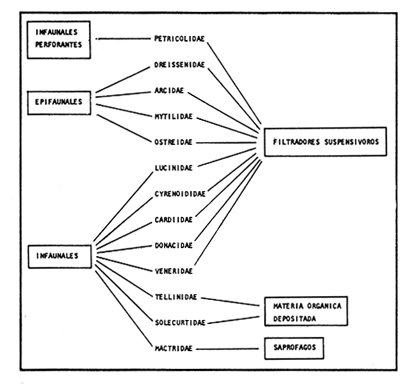 Figura 4. Origen halino de las Familias de la Clase Gastropoda. 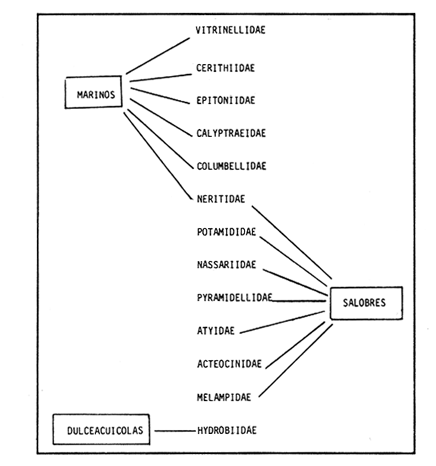 Figura 5. Posición respecto al sustrato y tipos de nutrición de las Familias de la Clase Bivalvia. 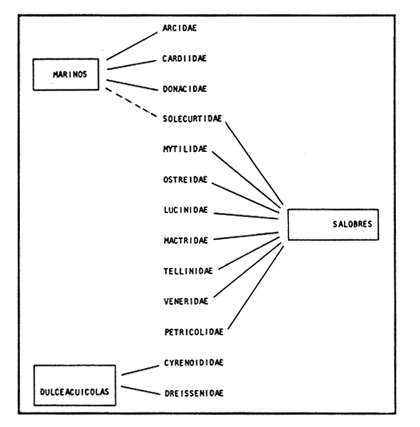 Figura 6. Origen halino de las Familias de la Clase Bivalvia. Para la varianza de H' se obtuvieron los siguientes resultados: Clase Gastropoda 1.1 x 10-³ Clase Bivalvia 2.1 x 10-³ Total de moluscos 0.8 x 10-³ Por lo tanto, los límites de confianza del 95% para las diversas poblaciones fueron: Clase Gastropoda 2.5 < H'< 2.64 Clase Bivalvia 1.48< H' < 1.66 Total de moluscos 3.07 < H'< 3.18 Con base en el número total de especies (S) colectadas en los muestreos cuantitativos y cualitativos se calcularon los valores de diversidad máxima (en bits/ejemplar) para las tres poblaciones de moluscos, mediante la fórmula: Hmáx = log2 S resultando 4.284 para los gasterópodos, 4.459 para los bivalvos y 5.358 en la población total de moluscos. Al comparar estas cantidades con las respectivas estimaciones de la diversidad por medio de la relación J' = H'/Hmáx se obtuvieron los valores de equitatividad (J') de 0.60, 0.35 y 0.58 para las tres poblaciones correspondientes. AFINIDADLa presencia o ausencia de especies en las estaciones de muestreo permite calcular la afinidad faunística entre pares de estaciones y establecer intervalos de similitud que agrupen y caractericen estaciones con índices de afinidad semejantes. Las Figuras 7 a 9 muestran gráficamente grupos de estaciones con porcentajes de afinidad comprendidos en los intervalos de 0 a 24, 25 a 49, 50 a 74 y 75 a 100, así como el porcentaje que representan con respecto al número total de combinaciones posibles. Con el fin de agrupar las estaciones afines y facilitar su apreciación visual, se modificó en estos diagramas el acomodo progresivo de las mismas, de acuerdo a Sanders (1960). Considerando a la población total de moluscos (Fig. 7), la afinidad resultante indica que de las 190 combinaciones posibles, dadas por el número total de estaciones, el 44.7% se ubica dentro del rango 50-74 con 85 combinaciones, el 42.1% corresponde al intervalo 25-49 con 80, quedando los rangos de 75-100 y 0-24 con porcentajes de 5.2% y 7.9%, con solo 10 y 15 combinaciones respectivamente. El valor medio de afinidad para todo el conjunto de estaciones es de 48.9%. Con base en las especies de gasterópodos colectados, la afinidad calculada para las estaciones de muestreo (Fig. 8) indica que el 59.5% ocupa el intervalo de 50-74 con 113 combinaciones; el 22.6% con 43 combinaciones se encuentra en el rango de 25-49; el 13.7% en el intervalo de 75-100 con 26 combinaciones y por último el 4.2% con 8 combinaciones dentro del rango 0-24. El valor medio de afinidad para este conjunto es de 55.5%. Para los bivalvos, los valores porcentuales de afinidad entre pares de estaciones, obtenidos a partir de 171 combinaciones posibles (Fig. 9), muestran que el 34.5% se ubica dentro del rango 50-74 con 59 combinaciones; el 30.4% en el intervalo de 25-49 con 52 combinaciones; el 25.7% en el rango 0-24 con 44 combinaciones y finalmente el 9.4% dentro del intervalo 75-100 con 16 combinaciones. El valor medio de afinidad en este caso es de 41.1% Para corroborar estos resultados y estar en posibilidad de determinar cualitativamente qué especies y estaciones inciden en un mismo nivel de similaridad, se elaboraron dendrogramas entre estos dos componentes (Figs.10 y 11). Respecto a los gasterópodos, en el diagrama relativo a estaciones (Fig. 10) se observa que la mayor similaridad (1.0) se presenta entre las estaciones LM-12, 22, y 23 debido a la presencia en las tres de las especiesLittoridina (Texadina) sphinctostoma, Acteocina canaliculata y Odostomia (Menestho) impressa. La menor similaridad (0.68) se presenta entre la estación LM-15 y todas las demás; mientras que la estación LM-8 está asociada con las restantes a un nivel de similaridad de 0.73. Entre estos extremos se encuentra una gran agrupación con similaridad ligeramente menor de 0.8 y que contiene varios subgrupos que abarcan a la mayoría de las estaciones, excepto la LM-15 y la LM-8. En el diagrama que se refiere a especies, la mayor similaridad (1.0) en relación a su distribución la tienen entre sí, Anachis semiplicata, Epitonium rupicola y Turbonilla interrupta, ya que las tres fueron colectadas únicamente en la estación LM-15. En cambio, entreNeritina virginea y el resto de las especies se encuentra el menor índice de similaridad, 0.65. Como punto de comparación entre estos casos extremos, se puede mencionar la situación de L. sphinctostoma y A. canaliculata, cuya presencia en casi la totalidad de las estaciones produce un índice de similaridad de 0.85. A un nivel de similaridad de 0.75 se agrupan la mayor parte de las especies, formando varios subgrupos. Unicamente se excluyen de esta agrupación Hidrobia totteni, Littoridina (Texadina) sphinctostoma, Acteocina canaliculata y Neritina virginea. En bivalvos, el diagrama relativo a estaciones (Fig. 11) muestra que el mayor nivel de similaridad (1.0) corresponde a las estaciones LM-3 y LM-6 con la presencia de las especiesMulinia lateralis, Cyrenoida floridana y Mytilopsis leucophaeata; la menor similaridad (0.82) se presenta entre la estación LM-13 y todas las demás, siendo los valores intermedios de 0.88 y 0.94 que forman tres subgrupos en cada nivel en donde se incluyen las estaciones restantes. Con respecto a la similaridad entre los bivalvos se observa que las especies Rangia cuneata y Macoma brevifrons alcanzan el nivel más alto (1.0) debido a que su distribución en la laguna se restringe a la estación LM-2. El nivel de 0.95 agrupa a Petricola pholadiformis, Cyclinella tenuis y Chione cancellata, especies pobremente distribuidas. En el nivel 0.91 se incluye a Lucina pectinata y Brachidontes exustus en un subgrupo bien definido abarcando las estaciones LM-20, LM-5, LM-18, LM-8,LM-7, LM-14 Y LM-4. 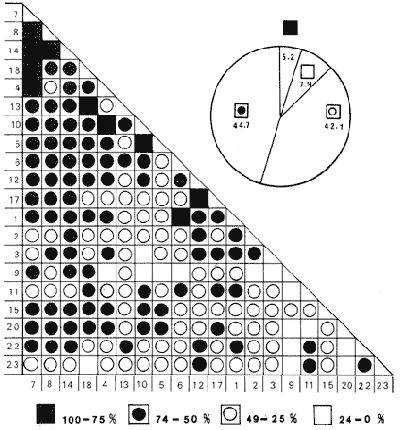 Figura 7. Diagrama de porcentajes y afinidad entre estaciones en relación a Poblaciones totales de moluscos. 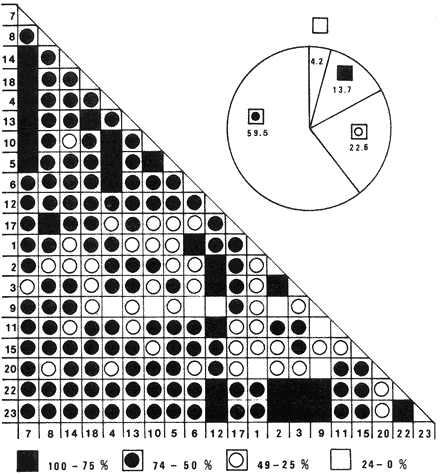 Figura 8. Diagrama de porcentajes de afinidad entre estaciones respecto a las poblaciones de la Clase Gastropoda. 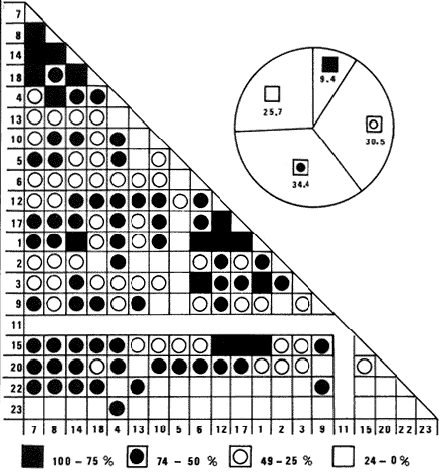 Figura 9. Diagrama de porcentajes de afinidad entre estaciones respecto a las poblaciones de la Clase Bivalvia. 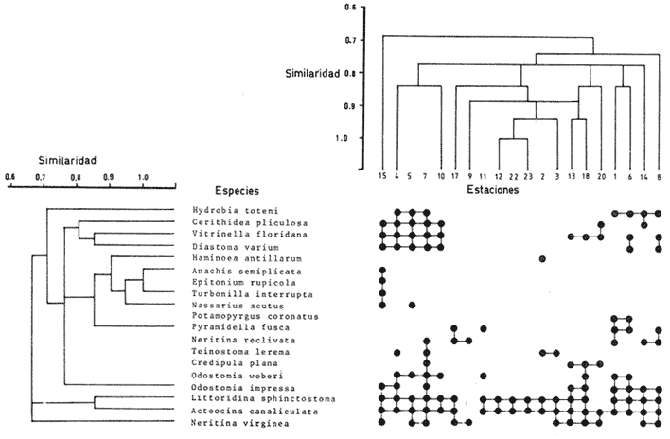 Figura 10. Dendrogramas de similaridad entre estaciones y especies de la Clase Gastropoda. 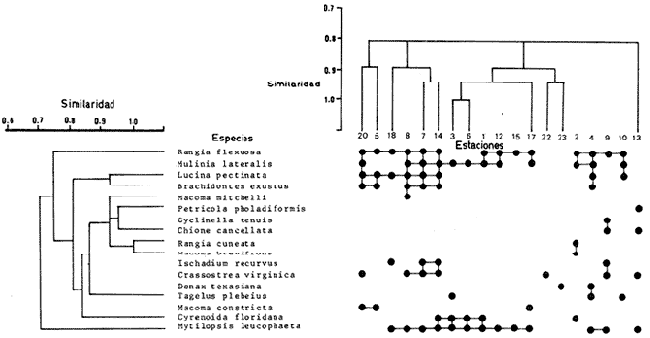 Figura 11. Dendrogramas de similaridad entre estaciones y especies de la Clase Bivalvia. Con valores de 0.86 aparecenIschadium recurvum, Crassostrea virginica, Donax texasiana y Tagelus plebeius que, junto con las especies antes mencionadas, agrupa al 70.5% de los bivalvos. El nivel de 0.82 incorpora a Macoma constricta y Cyrenoida floridana; por último Rangia flexuosa y Mulinia lateralis en 0.73 y Mytilopsis leucophaeata en el nivel de 0.69, estas tres especies con un amplio rango de distribución. De acuerdo con las figuras 10 y 11, los grados de similaridad entre estaciones alcanzan un mayor valor en la Clase Bivalvia que en la Clase Gastropoda, obteniendo valores mínimos de 0.82 y 0.68 respectivamente. En relación a la similaridad entre especies no se observa ninguna diferencia significativa entre ambas Clases, obteniéndose valores mínimos de 0.65 para los gasterópodos y 0.69 para los bivalvos. DISCUSIÓN Y CONCLUSIONESLos datos hidrológicos indican que la temperatura mínima promedio corresponde a los meses invernales, a partir de los cuales se registra un ascenso que coincide con la primavera. Al inicio de la época de lluvias, a partir del mes de junio, la temperatura disminuye como consecuencia de los aportes de agua dulce que recibe la laguna. Posteriormente, al finalizar los meses lluviosos se registra un ligero aumento en los valores promedio, seguido finalmente de un enfriamiento invernal. En lo que se refiere a salinidad, las grandes fluctuaciones señaladas por los diversos autores, se pueden atrubuir a que los valores han sido medidos puntualmente durante años diferentes, ya que no existen mediciones contínuas durante ciclos anuales cuyo régimen pluviométrico varía en intensidad y duración, así como por la presencia de "nortes" que azotan a la región. La distribución y abundancia de los organismos muestra un claro predominio de la Clase Gastropoda que se refleja no solamente en el número de especies e individuos, sino también en la amplia distribución que dentro de la laguna tienen las especies predominantes:Littoridina (Texadina) sphinctostoma, Acteocina canaliculata y Odostomia (Menestho) impressa, siendo todas ellas formas características de aguas salobres, las cuales representan en conjunto el 73.2% de la población total de gasterópodos y el 35.5% respecto a la población total de moluscos. En el caso deLittoridina (Texadina) sphinctostoma, su abundancia relativa y amplio rango de distribución obedecen a que es una forma común en aguas someras, salobres a dulces y en fondos areno-limosos, requerimientos ambientales que concuerdan con las características de la laguna. Por lo que se refiere a Odostomia (Menestho) impressa, este piramidélido parasita a ostiones, lo cual coincide con su presencia en áreas lagunares en donde se ubican los bancos ostrícolas. La presencia dePotamopyrgus coronatus en la zona oriental de la laguna, se puede explicar como debida al transporte fluvial, ya que se trata de una especie típicamente limnética de la que sólo se encontraron 7 ejemplares, ninguno de los cuales estaba vivo en el momento de la colecta. Dentro de los bivalvos, Mytilopsis leucophaeata, Rangia flexuosa y Mulinia lateralis especies ampliamente distribuídas, representan por su abundancia relativa el 84.8% de la población de bivalvos y el 37.3% respecto al total de moluscos, coincidiendo también como las especies más abundantes en los cuatro arrastres de draga realizados. Mytilopsis leucophaeata es una especie epifaunal asociada a bancos ostrícolas; su distribución en la laguna, aun en áreas con sustrato limo-arenoso, parece indicar que estos organismos cuando están vivos se ubican en áreas ostrícolas cercanas a las estaciones de colecta y cuando mueren son desprendidos del sustrato original por la acción erosiva de las corrientes y redepositados en sitios próximos a los bancos de ostión. Una situación similar se presenta en el caso del mejillónIschadium recurvum que, siendo también una especie epifaunal asociada a bancos ostrícolas, fué encontrada en algunas estaciones con sustrato limo-arenoso. Las especies Mulinia lateralis y Rangia (Rangianella) flexuosapresentaron mayor abundancia entre las estaciones LM-4 y LM- 10, que es la zona en donde se localiza la mayor diversidad. La gran influencia fluvial en esta área favorece a estas formas características de aguas salobres de baja salinidad, típicas de la laguna. Además, esta región ofrece el sustrato limoso adecuado para especies infaunales someras. Las estaciones LM-3 y LM-12, separadas del cuerpo lagunar principal, presentan un reducido número de ejemplares y una diversidad relativamente menor que la registrada para el área lagunar. Lo mismo ocurre en las estaciones LM-22 y LM-23 localizadas en la zona de los canales de comunicación con el mar, en los que la profundidad y salinidad son mayores y además se encuentran sometidos a fuertes corrientes de marea. Estos hechos sugieren que esos ambientes tal vez no sean propicios para los moluscos y para la depositación y conservación de sus conchas. Respecto al tipo de nutrición, la mayoría de los gasterópodos son colectores de depósitos orgánicos y carnívoros. Las especies dominantes se ajustan a este mismo patrón. Las especies de bivalvos características de la laguna son filtradoras suspensívoras y colectoras de depósitos orgánicos. Por lo que concierne a su habitat, las especies dominantes de gasterópodos son epifaunales, salobres por su origen o marinos, y las de bivalvos son infaunales y salobres. Los ejemplares vivos fueron recolectados principalmente en la región oriental de la laguna, en estaciones sucesivas (LM-7 a 11) de norte a sur, incluyendo la Laguna Tilapa. Es importante señalar que aunque los bivalvos presentan un mayor número de especies en relación con los gasterópodos, estos últimos los superan en diversidad por más del 60% En consecuencia, la equitatividad en los gasterópodos representa casi el doble de la de los bivalvos. Sin embargo, las valores calculados de diversidad máxima no reflejan necesariamente una situación factible, por lo que las equitatividades observadas en cada una de las tres taxocenosis pueden estar subestimadas. Si se tiene en cuenta además que en los ecosistemas naturales rara vez se observan valores de diversidad superiores a los 5 bits/individuo (Margalef, 1977) se puede considerar que los 3.1 bits /ejemplar de los moluscos de esta laguna corresponden a una diversidad relativamente elevada. Respecto a la gran diferencia existente entre la diversidad de los bivalvos y la de los gasterópodos, se puede interpretar que tal discrepancia se encuentra en el hecho de que una gran proporción de bivalvos pertenece a niveles tróficos inferiores a los de las poblaciones dominantes de gasterópodos y quizá los primeros representan un subsistema más fluctuante que los últimos. Los porcentajes de afinidad entre estaciones alcanzan valores más altos en gasterópodos que en bivalvos, estos valores están determinados básicamente por la presencia en la mayoría de las estaciones de las especiesLittoridina (Texadina) sphinctostoma, Acteocina canaliculata y Neritinea virginea. Correlativamente, en el análisis de similaridad interespecífica, las especies de distribución restringida como Anachis semiplicata, Epitonium rupicola y Turbonilla interrupta alcanzan valores más elevados y las especies más comunes se ubican a niveles bajos de similaridad. Dentro de los bivalvos, al igual que en los gasterópodos, los valores más altos de similaridad entre estaciones están determinados por la presencia de especies ampliamente distribuidas, tales comoMytilopsis leucophaeata, Rangia flexuosa y Mulinia lateralisy en el caso de similaridad entre las especies los valores más elevados corresponden a aquéllas cuya distribución se mostró restringida como es el caso de Rangia cuneata Macoma brevifrons, Cyclinella tenuis, Chione cancellata y Petricola pholadiformis. Los niveles bajos de similaridad correspondieron a las especies más ampliamente distribuidas. Algunos mejillones comoIschadium recurvum y Brachidontes exustuspueden ser considerados con posibilidades futuras de explotación comercial. Su distribución en la laguna está determinada por la presencia de sustratos adecuados para su fijación de tipo bisógeno y permite el establecimiento de grandes agrupamientos que de manera natural forman parte de la epifauna en los bancos de ostión con los cuales compiten por espacio y alimento. Sin embargo, su tolerancia a bajas salinidades permite que poblaciones de mitílidos como B. exustus se desarrollen aún en salinidades menores a 10 % y hasta de 2.5 % en formas juveniles de I. recurvum (Chanley, 1957). Las almejas Rangia cuneata yR. flexuosa están sujetas a explotación comercial en algunas lagunas costeras del Golfo de México. En la laguna Mecoacán, R. flexuosa muestra un amplio rango de distribución y será necesario ubicar los bancos adecuadamente. Por otra parte, R. cuneata fue detectada en la desembocadura del rio González en bancos capaces de soportar, por lo menos, una explotación a nivel artesanal. AgradecimientosLos autores hacen patente su agradecimiento a Felipe Flores Andolais y Vicente Antolí Figuerola por su participación en los muestreos y elaboración de material gráfico. A Xavier Chiappa Carrara y Gerardo Barrientos Mac Gregor por la revisión crítica del manuscrito. LITERATURAABBOTT, R.T., H.S. LADD J. Wash Ac. Sci. A new brackish water gastropods from Texas (Amnicolidae: Littoridina). 1951. 335-338, 12 figs.(10): 41 ADAMS, C.B. Bost. J. Nat. Hist. Observations on some species of the marine shells of Massachusetts, with descriptions on five new species. 1839.262-288, lám. 4.(2): 2 AMEZCUA LINARES, F., A. YÁÑEZ-ARANCIBIA An. Centro Cienc. del Mar y Limnol. Univ. Nal. Autón. México Ecología de los sistemas fluvio-lagunares asociados a la laguna de Términos. El habitat y estructura de las comunidades de peces. 1980.69-118.(1): 7 BASHARIN, G. P. Theory Probab. Applic. On statistical estimate for the entropy of a sequence of independent variables. 1959. 333-336.4: BRUGUIÈRE, J.G.Histoire naturelle des Vers. Encyclopedie Méthodique. 1789-1792. 1-344, 345-757. (1), (2) 1, 1 CASTRO GESSNER, S. A., Tesis Profesional.Determinación de los niveles de hidrocarburos en sedimentos recientes y en el ostión Crassostrea virginica de la Laguna Mecoacán, Tabasco, México. Fac. Ciencias, Univ. Nal. Autón. México 1981. 134 p. CECODES Las lagunas costeras de Tabasco. Un ecosistema en peligro. Centro de Ecodesarrollo, SEPESCAD. F. México 1981. 109 p. CONRAD, T. A. J. Ac. Nat. Sci. Phila. Descriptions of fifteen new species of recent and three of fossil shells, chierfly from the coast of the United States.1831. 256-268, lám. 11, figs. 1-20.(2): 6 CONRAD, T. A. Amer. J. Sci. Art.Observations on the Genus Gnatodon with descriptions of new species. 1839.92, fig. 1.(1): 38 CONTRERAS, F. Las lagunas costeras Mexicanas. Centro de Ecodesarrollo, SEPESCAD. F.México1985. 253 p. CHANLEY, P. E. Proc. Nat. Shelf. Assoc. Survival of some juvenils bivalves in water of low salinity. 1957. 52-65.48: CHÁVEZ, E. A. An. Centro Ciene. del Mar y Lininol. Univ. Nal. Autón. México Análisis de la comunidad de una laguna costera en la Costa sur occidental de México. 1979. 15-44.(2): 6 DALL, W. H. U. S. Nat. Mus. Bull. A preliminary catalogue of shell-bearing marine mollusks and brachiopods of south-eastern coast of United States, with illustrations of many species. 1889. 221, láms. 1-74.37: DALL, W. H.Nautilus Three new species of Macoma from the Gulf of Mexico. 1895.32-34.9: DAVIES, R. G. Computer Programming in Quantitative Biology. Academic PressLondon1971. 420-430. DE LARA, A. R. Tesis Profesional. Evaluación de los recursos ostrícolas de las lagunas Mecoacán, Machona y El Carmen. Fac. Ciencias, Univ. Nal. Autón. México1972. 32 p. GALAVIZ-SOLÍS, A., M. GUTIÉRREZ-ESTRADA, A. CASTRO DEL RÍO An. Inst. Cienc. del Mar y Limnol. Univ. Nal. Autón. MéxicoMorfología, sedimentos e hidrodinámica de las lagunas Dos Bocas y Mecoacán, Tabasco, México.1987.109-124.(2): 14 GARCÍA, E. Modificaciones al sistema de Clasificación Climática de Köppen (Para adaptarlo a las condiciones de la República Mexicana). Inst. Geograf. Univ. Nal. Autón. México. 2a. ed.D.F. México 1973. 246 p. GARCÍA-CUBAS, A. Bol. Inst. Geol. Univ. Nal. Autón. México Sistemática y distribución de los micromoluscos de la Laguna de Términos, Campeche, México. 1963. 1-55,24 figs., 4 láms.67: GARCÍA-CUBAS, A.An. Inst. Ciene. del Mar y Limnol. Univ Mal. Autón. México, Publ. Esp. Moluscos de un sistema lagunar tropical al sur del Golfo de México. (Laguna de Términos, Campeche). 1981.1-182.5: GARRIDO, F., A. ESPINOSAII Simposio de la Asociación Latinoamericana de Acuicultura, México. Fomento de la ostricultura en la Laguna Mecoacán, Mpio. de Paraiso, Tabasco. 1978. GMELIN, J. F. Caroli a Linné Sistema Nature per Regna tria Naturae. Leipzing 13a. ed 1791.3021-3910.(6): 1 GÓMEZ A. H. Ciencias MarinasDeterminación de corrientes en la laguna costera de Mecoacán, Tabasco, México. 1977.67-80.(4): 1 GÓMEZ A. VI Congreso Nacional de Oceanografía. Estudio de la dinámica de fijación post larvas del ostión americano Crassostrea virginica (Gmelin) en la Laguna de Mecoacán, Tabasco, México.1978. GONZÁLEZ ANIA, L. V. Tesis Profesional.Estudio prospectivo de los moluscos de la laguna costera Mecoacán, Tabasco, México. Fac. Ciencias, Univ. Nal Autón. México1981. 90 p. IRACHETA, J. Tesis Profesional. Ostricultura en el Estado de Tabasco. Fac. Ciencias, Univ. Nal. Autón. México 1972. 72 p. KEEN, M. A Sea shells of tropical west America. Marine mollusks from Baja California Mexico to Peru. Standford University Press 2a. ed.California1971. 1064 p., 22 láms. KURTZ, J. D. Catalogue of recent marine shells found on die coast North and South Carolina. Portland1860. 9 p. LAMARCK, J. B. Histoire Naturelle des Animaux sans Vertebres.Paris 1815-1822. 1-711. 1-7: LIGHFOOT, J. A Catalogue of the Portland Museum. London1786.194p. LINNAEUS, C. Systema Naturae per Regna tria Naturae. Editio decima, reformata. Stockholm 1758. 824 p.1 Regnum animale: LINNAEUS, C. Systema Naturae per Regna tria Naturae. Editio duodecima, reformata.Stockholm1766-1767.1-552, 533-1327 1 Regnum animale: (1766), (1767). MARGALEF, D. REcología. Ed. Omega Barcelona1977. 951 p. MENKE, K T.,Verzeichniiss der ansehnlichen Conchylien Sammlung des Freinhernn von der malburg. Pyrmont Heinrich Gelpke: 1829. 1-123. MOORE, R. C. Treatise on Invertebrate Paleontology. Mollusca Geol. Soc. American and University of Kansas Press New York1969. 1-952, 953-1224. 1 y 2:6 MORRISON, J. P. E.Proc. Biol. Soc. Wasch. New Brickish Water Mollusks from Louisiana. 1965. 217-224, figs. 1-9.78: ORBIGNY D', A. D.Histoire Physique, Politique, et Naturelle de l'Ile de CubaMollusques. In: R. de la Sagra (Ed.)1841-1846. 1-264, 1-380. 1 Y 2: PFEIFFER, L. Arch. für Natur. Uebersicht der in Januar Februar and Marz auf Cuba gesammelten Mollusken.1840.250-261.(1): 6 PHILIPPI, R. A. Zeit. Malak.Testaceorum novorum centuria. 1847. 71-77, 84-96, 113-127.4: PIELOU, E. C. J. Theor. Biol. The measurement of diversity in different types of Biological collections. 1966. 131-144. 13: PIELOU, E. C. Ecological diversity. Ed. Wiley New York 1975. 165p. PILSBRY, H. A., T. L. McGINTY NautilusCyclostrematidae and Vitrinellidae of Florida. 1945-1946.1-13, lám. 1, 77-83.(1):, (3): 59 1946 POOLE, R. W. An introduction to quantitative ecology. Me Graw-Hill New York 1974.400 p. RAFINESQUE, C. S. Ann. Gen. Sci. Phys. Bruxelles Monographie des coquilles bivalves et fluviatiles De la riviére Ohio.1820. 287-322. 5: RECLUZ, C. A. J. Conchyl. Description de coquilles nouvelles. 1852. 249-256, lám. 10.3: RENKONEN, O An. Zool. Soc. Vanamo Statistichokologishe untersuchungen uber die terrestrische kaferwelt der finnischer bruchmoore.1938.1-227.(1): 6 SANDERS, H. I. Limnol. Oceanogr. Benthic studies in Buzzards Bay. III. The structure of the soft bottom community. 1960.138-153.5: SAY, T. J. Acad. Nat. Sci. Phila An account of some of Ihe marine shells of the United States. 1822.221-248, 257-276; 302-322.(1):, (2): 2 SAY, T. J. Acad Nat. Sci. Phila. Descriptions of marine shells recently discovered on the coast of the United States. 1826.207-221.(1): 5 SAY, T. American conchology or descriptions of the shells of North America. New Harmony Indiana.1830-1834. 1-258,68 láms.1-7: SHANNON, E.C., N. WIENER The mathematical theory of communication. University of Illinois PressUrbana 1963. 117 p. SHANNON, E. C, N. WIENER Am. Nat. Shannon's formula as a measure of specific diversity. Its use and misuse. 1966.463-465.100 SOLANDER, D. C. A Catalogue of the Portland Museum. London 1786. 194 p. SOWERBY, G. B. The genera of recent and fossil shells. Bernard Quaristch London1821-1834. 1 láms. 1-126., 2, láms. 127-262. STEARNS, R. E. C., Proc. Acad. Nal. Sci Phila Descriptions of new marine shells from the west coast of Florida. 1873.344-347, figs. 1-425: TOTTEN, J. G. Amer. J. Sci. Description of some new shells, belonging to the coast of New England. 1835.347-352, 1 lám., figs. 1-8.(2): 28 VÁZQUEZ-BOTELLO, A. Rev. Biol. Trop.Presencia de hidrocarburos fósiles en ecosistemas estuarinos del Golfo de México. 1978. 135-151.(1): 26 VÁZQUEZ-BOTELLO, A. An. Centro Cienc. del Mar y Limnol. Univ. Nal. Autón. México Niveles actuales de hidrocarburos fósiles en ecosistemas estuarinos del Golfo de México. 1979. 7-14.(1): 6 VÁZQUEZ-BOTELLO, A., E. F.MANDELLI Geochim. Cosmochim. acta Organic carbon isotope rations of recent sediments from coastal lagoons of The Gulf of Mexico. 1980.557-559.44: WARME, J. E. J. Paleont. Live and dead molluscs in a coastal lagoon. 1969. 141-150. 43: WARME, J. E. Univ. California Publ. Geol. Sci. Paleoecological aspecto of modem coastal lagoon.1971. 1-131. 87: WELLS, H. W., M. J. WELLS Nautilus The destruction between Acteocina candei and Retusa canaliculata.1962.87-93.(3): 75 LAMINAS
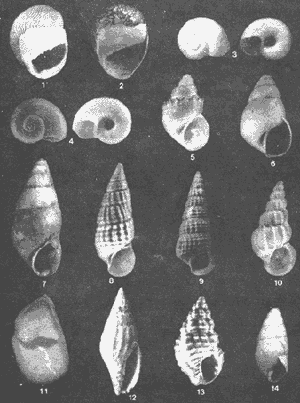 Lámina 1. 1)Neritina reclivata. 2)Neritina virginea. 3)Vitrinella(Vitrinella)floridana.4)Teinostoma lerema. 5) Potamopyrgus coronatus. 6)Hidrobia totteni. 7) Littoridina (Texadina) sphinctostoma. 8) Diastoma (Bittium) varium. 9) Cerithidea (Cerithidiopsis) pliculosa. 10) Epitonium (Gyroscala) rupicola. 11) Crepidula (Ianacus) plana. 12) Anachis (Costanachis) semiplicata. 13) Nassarius (Nassarius) acutus. 14) Pyramidella fusca.  Lámina 2. 15) Odostomia weberi. 16) Odostomia (Menestho) impressa. 17) Turbonilla interrupta. 18)Haminoea antillarum. 19) Acteocina canaliculata. 20) Melampus coffeus. 21) Anadara (Cunearca) brasiliana. 22.) Anadara (Larkinia) transversa. 23) Anadara (Lunarca) ovalis. 24) Brachidontes (Hormomya) exustus 25) Ischadium recurvum.  Lámina 3.26) Cassostrea Virginica. 27)Lucina (Phacoides) pectinata. 28) Cyrenoida floridana. 29) Laevicardum mortoni. 30)Dinocardium robostum. 31) Mulinia lateralis. 32) Rangia (Rangia) cuneata 33) Rangia (Rangianella) flexuosa.  Lámina 4. 34) Macoma (Psammacoma) brevifrons. 35) Macoma (Austromacoma) constricta. 36)Macoma (Rexithaerus)mitchelli. 37)Donax variabilis texasiana. 38)Tagelus plebeius. 39) Mytilopsis leucophaeata. 40) Chione (Chione) cancellata. 41) Cyclinella tenuis. 42) Petricola (Petricolaria) pholadiformis.
|

