|
CLAVE PARA LA
IDENTIFICACIÓN DE LARVAS DE LAS FAMILIAS GONOSTOMATIDAE, STERNOPTYCHIDAE
Y MYCTOPHIDAE DEL SUR DEL GOLFO DE MÉXICO
Trabajo recibido el 2 de
septiembre de 1988 y aceptado para su publicación el 8 de julio de 1989.
Uriel Ordóñez-López
César Flores-Coto
Instituto de Ciencias del
Mar y Limnología, Universidad Nacional Autónoma de México.
Contribución No. 659 del Instituto de Ciencias del Mar y
Limnología, UNAM.
Se presenta una clave de
identificación de larvas de las familias Gonostomatidae, Sternoptychidae
y Myctophidae del Sur del Golfo de México. El material provino de una
serie de campañas realizadas entre 1983 y 1987, y comprende un total de
26 géneros y 31 especies de éstas tres familias de
peces.
A larvae identification key of
Gonostomalidae, Sternoptychidae and Myctophidae families from South Gulf of
Mexico is presented. The key comprise 26 genera and 31 species of this
families, captured during a series of oceanographic crusies between 1983 and
1987.
Los peces luminosos de las familias Gonostomatidae, Sternoptychidae y Myctophidae son abundantes en aguas oceánicas del Golfo de México (Rass, 1971). La particularidad de éstas familias es la presencia de órganos luminosos o fotóforos, que son utilizados como característica merística en la diagnósis de las especies y como base de su clasificación (Fraser- Brunner, 1949; Paxton, 1972; Weitzman, 1974 y Nafpaktitis, 1977, 1978). Cerca de 82 especies de Mictófidos, 35 especies de Gonostomátidos y 6 especies de Esternoptíquidos ocurren en el Atlántico Norte y tan sólo un 40% de éstas especies han sido descritas sus formas larvales (Fahay, 1983). En el Golfo de México, Gartner et al. (1987), refieren la ocurrencia de 17 géneros y 49 especies de Mictófidos y Houde et al. (1979), determinaron la presencia de las etapas larvarias de 25 especies de Mictófidos, 11 de Gonostomátidos y tres géneros de Esternoptíquidos. La abundancia de sus etapas larvarias puede llegar a constituir del 4 al 6% de las pescas planctonicas en las áreas oceánicas del Golfo de México y Mar Caribe (Shiganova, 1977; Romero y Del Castillo, 1984; Hopkins y Lancraft, 1984 y Richards, 1984). Debido a su heterogéneidad morfológica por sus prominentes especializaciones hace difícil su identificación (Grey, 1964; Ahlstrom, 1974; Moser y Ahistrom, 1970, 1972, 1974 y Lasker et al., 1981). Dentro del proyecto "Ictioplancton del Sur del Golfo de México", del laboratorio de Zooplancton del Instituto de Ciencias del Mar Y Limnología, se ha puesto especial interés en algunas familias, entre otras aquellas objeto de éste trabajo; y de cuyo análisis primario (Ordóñez-López, 1987) se deriva la necesidad de publicar claves de indentificación que faciliten la tarea de futuros trabajos. La clave incluye únicamente los géneros y/o las especies cuyas etapas larvarias, ocurrieron durante las campañas oceanográficas de: marzo-abril de 1983, febrero de 1984, abril-mayo de 1984, agosto de 1984 y febrero-marzo de 1987. Es posible que en colectas futuras aparezcan otras especies, sin embargo la clave podrá ser de utilidad ya que comprende a los componentes más frecuentes de éstas tres familias. En la clave se ha incluido una serie de abreviaturas que corresponden a los fotóforos utilizados en la separación de las especies (Fig. 1), así como de términos utilizados y que se señalan a continuación: Ojo pedunculado: Ojos sustentados por tallos móviles. Tejido coroide: Masa de tejido vascular alrededor del ojo. Pliege: Membrana del tegumento que se extiende a lo largo del cuerpo de la larva y del cual se desarrollan las aletas dorsal, adiposa, anal y caudal. Ojo Ovoide: Ojo en forma de huevo con uno de los ejes ligeramente mayor (con un sólo eje de simetría). Ojo elíptico: Ojo plano con dos ejes de simetría que se cortan perpendicularmente. Tracto digestivo voluminoso: Intestino que en su porción anterior es muy ámplio, disminuyendo hacia el ano. 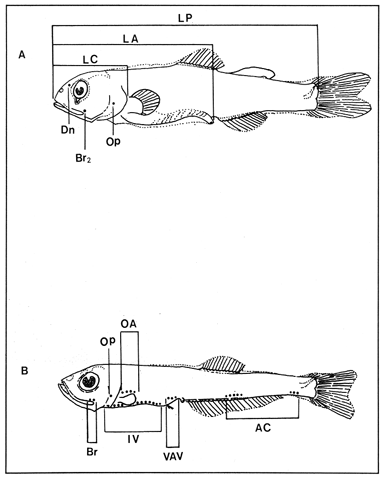 Figura 1. A. Myctophidae; B. Gonostomatidae. CLAVE DE IDENTIFICACIÓN DE LAS FAMILIAS.I (a).- Cuerpo alargado y delgado, tracto digestivo relativamente corto (<45% de la longitud patrón) en organismos menores de 9 mm y voluminosos en tallas mayores; ojos sésiles sin tejido coroide; aleta anal inicia su formación alrededor de los 7.8 mm; amplio espacio entre la terminación del tracto digestivo y el origen de la aleta anal; aleta adiposa presente; cresta occipital y espinas preoperculares presentes o .....STERNOPTYCHIDAE. (b).- Cuerpo corto y grueso, o alargado y delgado, con el intestino largo mayor de 45% de la longitud patrón; ojo sésil o pedunculado, con tejido coroide; aleta anal inicia su formación generalmente antes de los 8.5 mm; con o sin espacio entre la terminación del intestino y origen de la aleta anal, cuando se presenta es un espacio corto; aleta adiposa presente o no; sin cresta occipital ni espinas preopcreulares.....II II (a).- Cuerpo alargado y delgado; ojos sésiles redondos u ovoides, sin tejido coroide; longitud del intestino variable, generalmente no existe un espacio entre el ano y el origen de la aleta anal; con o sin aleta adiposa, cuando se presenta es notoria en organismos mayores de 15 mm; generalmente sin pigmentos y cuando los presenta son sumamente escasos; dientes sobre la maxila y premaxila, los primeros fotóforos en desarrollarse se hacen evidentes a tallas mayores de 7.5 mm ..... GONOSTOMATIDAE. (b).- Cuerpo generalmente corto y grueso, en algunos alargado y delgado; ojos sésiles redondos, ovoides o elípticos, éstos últimos generalmente con tejido coroide y pedunculados, en algunos ligeramente pedunculados o claramente pedunculados (cuando están dentro de sus cuencas esto no es aparente); generalmente presentan un espacio entre el ano y el origen de la aleta anal; con o sin aleta adiposa y cuando presente es evidente desde tamaños menores de 15 mm; los primeros fotóforos en desarrollarse se hacen evidentes a tallas menores de 7.5 mm..... MYCTOPHIDAE. FAMILIA GONOSTOMATIDAE1 (a).- Longitud preanal (PA) menor de 70% de la longitud patrón (LP); la altura de la cabeza mayor que el cuerpo, y disminuye gradualmente hacia el pedúnculo caudal; vejiga natatoria evidente en las formas más largas; ojos grandes, redondos o ligeramente ovoides..... 2 (b).- Longitud preanal más de 70% de la longitud patrón; la altura de la cabeza no difiere de manera notoria del resto del cuerpo, cuya altura es relativamente uniforme; ojos pequeños y ovoides.... 9 2 (a).- Origen de la aleta anal, anterior o a la misma altura del origen de la aleta dorsal; ojos redondos u ovoides; generalmente la aleta adiposa esta ausente..... 3 (b) Origen de la aleta anal, posterior al origen de la aleta dorsal; ojos ovoides; aleta adiposa presente (10>mm) ..... 8 3 (a).- Longitud preanal mayor a 50% de la longitud patrón; origen de la aleta anal a la misma altura o anterior al origen de la aleta dorsal <10mm).-..... 4 (b).- Longitud preanal menor a 50% de la longitud patrón; origen de la aleta anal, anterior al origen de la aleta dorsal.- .....5 4 (a).- Desarrollo de fotóforos en racimo (Br 1-3); sin pigmentación aparente, primordios de las bases y radios de la aleta anal en organismos mayores de 7 mm; ojos ovoides .....Maurolicus muelleri (Lám. 1 A). (b).- Sin desarrollo de fotóforos en racimo; pigmentos en la línea media ventral a la altura de la aleta anal y algunos dispersos en el intestino; inicio de la aleta anal y dorsal en organismos menores de 7 mm; ojo redondo .....Cyclothone spp (Lám. 1B). 5 (a).- Ojo redondo; vejiga natatoria conspicua; pigmentos en la cabeza .....6 (b).- Ojo ovoide; vejiga natatoria no conspicua; sin pigmentos en la cabeza .....7 6 (a).- Pigmentos en la línea media ventral y pedúnculo caudal; sin aleta adiposa.....Gonostoma atlanticum (Lám. 1C). (b).- Sin pigmentos en la línea media ventral y pedúnculo caudal, pigmentos evidentes sobre la cabeza y en el intestino, a nivel de las aletas pélvicas; aleta adiposa presente en organismos mayores a 20 mm ..... Gonostoma elongatum (Lám. 1D). 7 (a).- Pigmentos en el pedúnculo caudal; sin aleta adiposa; sin pigmentación peritoneal evidente; fotóforos de la serie IV separados ..... Bonapartia pedaliota(Lám. - 1E). (b).- Sin pigmentos en el pedúnculo caudal; con aleta adiposa presente; pigmentación peritoneal; fotóforos de la serie IV en racimo (12-20) .....Valenciennellus tripunctulatus (Lám. 1F). 8a).- Doble línea de fotóforos venítrales (IV, VAV y OA); origen de la aleta anal claramente posterior al origen de la aleta dorsal; fotóforos (Br 1-5 y IV 1-4) en racimo; pigmentos en el pedúnculo caudal .....Maurolicus muelleri(Lám. 2A). (b).- Una sola línea de fotóforos (IV y VAV); origen de la aleta anal, muy próximo al origen de la aleta dorsal; fotóforos (Op y Br) separados; pigmentación peritoneal, pigmentación en barras transversales al cuerpo, sin pigmentos en el pedúnculo caudal. Margrethia obtusirostra (Lám. 3A). 9 (a).- Origen de la aleta anal posterior a la base de la aleta dorsal; sin pigmentos en el pedúnculo caudal; longitud preanal mayor a 80% de la longitud patrón. .....10 (b).- Base de las aletas dorsal y anal se traslapan; pigmento en el pedúnculo caudal; longitud preanal menor a 80% de la longitud patrón. .....12 10 (a).- La parte final del intestino es colgante; pigmentación difusa en la parte lateral del cuerpo; radios ventrales de la aleta pectoral largos en organismos mayores de 15 mm. .....Ichthyococcus ovatus (Lám. 2B). (b).- La parte final del intestino no es colgante; sin pigmentación en la parte lateral del cuerpo; aleta pectoral poco desarrollada. ..... 11 11 (a).- Base de la aleta anal corta; aleta adiposa presente en organismos mayores de 12 mm. .....Pollichthys mauli (Lám. 2C). (b).- Base de la aleta anal larga; sin aleta adiposa. .....Diplophos taenia (Lám. 2D). 12 (a).- Pigmento ventral en el pedúnculo caudal, con pigmentos en la base de los radios de las aletas caudal y anal. .....Vinciguerria nimbaria (Lám. 2E). (b).- Pigmento central en el pedúnculo caudal; sin pigmentos en la base de la aleta caudal, ni en la base de los radios de la aleta anal. .....13 13 (a).- Vejiga natatoria presente en organismos mayores de 10 mm; origen de la aleta anal a la mitad de la base de la aleta dorsal; ojo tubular en estado juvenil . .....Vinciguerria attenuata (Lám. 2F). (b).- Vejiga natatoria ausente; origen de la aleta anal posterior a la mitad de la base de la aleta dorsal..... Vinciguerria poweriae. (Lám. 2G).
dorsalVinciguerria poweriae (Lám. 2G). FAMILIA STERNOPTYCHIDAE(a).- Tracto digestivo corto con el ano dirigido hacia abajo; cresta occipital; espinas preoperculares; cristalino dentro del plano del ojo; inicio de la aleta anal a 8 mm; flexión del urostilo después de 8 mm; fotóforos presentes después de los 6 mm; origen de la aleta anal y dorsal a la misma altura; pigmento peritoneal. .....sternoptyx sp (Lám. 3B). (b).- Intestino corto con el ano recto; sin cresta occipital; sin espinas preoperculares; cristalino fuera del plano del ojo; inicio de la aleta anal a 9 mm; flexión del urostilo antes de los 8 mm; fotóforos presentes después de los 9 mm; origen de la aleta anal posterior a la dorsal; sin pigmento peritoneal. .....Argyropelecus spp (Lám. 3C). FAMILIA MYCTOPHIDAEA.- Ojos ovoides o elípticos; tejido coroide presente o no; ojos sésiles o pedunculados. .....Subfamilia Myctophinae. B.- Ojos redondos; tejido coroide ausente; ojos sésiles .....Subfamilia Lampanyctinae. SUBFAMILIA MYCTOPHINAE1 (a).- La altura de la cabeza mayor de 22% de la longitud patrón; intestino corto y grueso..... 2 (b).- La altura de la cabeza menor de 22% de la longitud patrón; intestino casi recto y delgado.....11 2 (a).- Fotóforo branquiostegal dos (Br 2) ausente en tallas menores de 7 mm, a tallas mayores sólo se forma el Br 2 (etapa larvaria); tejido coroide poco desarrollado o ausente; ojo ovoide. .....3 (b).- Fotóforo branquiostegal dos (Br 2) presente, en tallas menores de 7 mm, a tallas mayores hay desarrollo de otros fotóforos; tejido coroide generalmente presente; ojo elíptico..... 4 3(a).-Melanóforo grande sobre el recto, sin pigmento en la mandíbula. ..... Hygophum taaningi (Lám. 3D). (b).- Numerosos melanóforos dispersos en la parte posterior del intestino, pigmento en la mandíbula.....Hygophum macrochir (Lám. 3E). 4(a).- Tejido coroide distribuido homogéneamente alrededor del ojo; ámplio espacio entre el ano y la aleta anal; aleta pectoral poco desarrollada; escasos pígmentos en la membrana branquiostega y gular; pliegue muy desarrollado..... Benthosema suborbitale(Lám. 4A). (b).- Tejido coroide alrededor del ojo, prominente en posición anteroventral o ventral; prácticamente sin espacio entre el ano y la aleta anal; aleta pectoral muy desarrollada; sin pigmentos en la membrana branquiostega y gular; pliegue poco desarrollado. .....5 5 (a).- Pigmentos evidentes en la cabeza, en el cuerpo, y radios de la aleta pectoral. .....6 (b).- Pigmentos evidentes sólo en la cabeza. .....8 6 (a).- Cabeza alta (la altura de la cabeza menor al 30% de la longitud patrón; ojo elíptico claramente pedunculado; pigmentación prominente en la aleta pectoral, línea media ventral, membrana branquiostega y cabeza. .....Myctophum nitidulum(Lám. 4B). (b).- Cabeza muy alta (la altura de la cabeza mayor al 30% de la longitud patrón); ojo ovoide ligeramente pedunculado; pigmentos en la base de los radios caudales. .....7 7 (a).- Grandes cromatóforos distribuídos en el cuerpo, particularmente notorios en la base de la aleta caudal, al inicio de la aleta dorsal y final de la anal. Hocico escasamente pigmentado. .....Myctophum asperum(Lám. 4C). (b).- Sin cromatóforos en el cuerpo, un par de pigmentos en la base de la aleta caudal, pigmentos del margen lobular de la aleta pectoral. Hocico densamente pigmentado. .....Myctophum sp (Lám. 4D). 8 (a).- Tejido coroide ligeramente aguzado, sin pigmento en su parte distal; ojo no pedunculado. .....Myctophum obtusirostre (Lám. 4E). (b).- Tejido coroide largamente aguzado, fuertemente pigmentado en su parte distal; ojo ligeramente pedunculado. .....9 9 (a).- La cabeza termina en forma aguzada; tejido coroide pigmentado; diversos pigmentos en la mandíbula y cabeza; pliege no desarrollado. .....Myctophum selenops (Lám. 5A). (b).- La cabeza termina en forma roma; tejido coroide muy aguzado; pliegue desarrollado; cuerpo comprimido.....10 10 (a).- Tejido coroide no pigmentado, sin pigmentos en la cabeza y mandíbula, pequeño pigmento en el lóbulo de la aleta pectoral. .....Centrobranchus nigroocellatus (Lám. 5B). (b).- Tejido coroide pigmentado, pigmentos en la cabeza, mandíbula, cuerpo (ventrales y dorsales) y pedúnculo caudal, después de los 3 mm; dentición desarrollada. .....Gonichthys cocco(Lám. 5C). 11 (a).- Con un barbillón en la mandíbula a partir de los 5 mm; con pigmentos. en la línea ventral del cuerpo a nivel de la terminación del intestino y el siguiente cuarto del cuerpo. .....Diogenichthys atlanticus(Lám. 5D). (b).- Sin un barbillón en la mandíbula; pigmentación diversa. .....12 12 (a).- Cabeza ligeramente plana; hocico notoriamente agudo, ojos pedunculados y prominentes (con tejido coroide) abarcando la altura de la cabeza; aleta dorsal y anal desarrollándose después de los 10 mm; pigmentación en el itsmo, pedúnculo caudal entre los miómeros y pigmentos pareados en el intestino. .....Hygophum reinhardtii(Lám. 6A). (b).- Cabeza no aplanada; hocico corto; ojos sésiles; escasa pigmentación. .....13 13 (a).- Pigmentos en la punta de la mandíbula y maxila, pigmentos en la base de los radios caudales, pigmento en el tracto digestivo antes de los 5 mm, así como en el pliegue. ..... Hygophum benoiti(Lám. 6B). (b).- Sin pigmento en la punta del hocico, sin pigmento en la base de la aleta caudal, sin pigmentos en el tracto digestivo y en el pliegue ni antes ni después de los 5 mm. .....Hygophum hygomii(Lám. 6C). SUBFAMILIA LAMPANYCTINAE1 (a).- Cabeza grande más de 30% de la longitud patrón; cuerpo alto, más del 25% de la longitud patrón .....2 (b).- Cabeza pequeña menor del 30% de la longitud patrón; altura del cuerpo menor del 25% de la longitud patrón ..... 4 2 (a).- Ojo pequeño (menor a 25% de la longitud de la cabeza en organismos menores de 5 mm); prolongación de los primeros radios dorsales de la aleta pectoral, alcanzando más allá de la aleta pélvica; un par de pigmentos notorios en la base de la aleta caudal y lóbulo de la aleta pectoral.....Lobianchia gemellarii (Lám. 6D). (b).- Ojo grande (mayor a 25% de la longitud de la cabeza en organismos mayores de 5 mm); sin pigmentos en la aleta caudal, ni en el lóbulo de la aleta pectoral. .....3 3 (a).- La aleta pectoral alcanza el nivel de los primeros radios de la aleta, dorsal; sin prolongación del hocico evidente; cabeza termina en forma roma; dentición poco desarrollada; pigmentos notorios en la línea media ventral, lateral y dorsal del cuerpo..... Notoscopelus resplendens (Lám. 6E). (b).- La aleta pectoral no alcanza el nivel de los primeros radios de la aleta dorsal; prolongación del hocico en forma aguzada; dentición muy notoria; escasa pigmentación en el cuerpo, pigmento en la mandíbula.....Lampanyctus spp (Lám. 7A). 4 (a).- Tracto digestivo voluminoso, no es evidente en la línea ventral del cuerpo; en la posflexión del urostilo un pigmento notorio en la parte media de los radios caudales; origen de las aletas anal y dorsal al mísmo, nivel..... Notolychnus valdiviae (Lám. 7B). (b).- Intestino recto y largo, se nota en la parte ventral del cuerpo..... 5 5 (a).- Ultima porción del intestino y recto, sin estriaciones de bandas musculares; vejiga natatoria no evidente..... 6 (b).- Ultima porción del intestino y recto con estriaciones de bandas musculares; vejiga natatoria evidente y pigmentada. .....Ceratoscopelus warmingii (Lám. 7C). 6 (a).- Origen de la aleta anal posterior a la terminación de la aleta dorsal; pigmentos en la línea media dorsal del pedúnculo caudal, sin pigmentos en la cabeza, pigmentos en la base de los radios caudales.....Diaphus spp (Lám. 7D). (b).- Origen de la aleta anal bajo la segunda mitad de la aleta dorsal pigmentos en la línea media dorsal y ventral del pedúnculo caudal, con o sin pigmentos en la cabeza, sin pigmentos en los radios caudales. .....Lepidophanes spp (Lám. 7E). AgradecimientosLos autores desean hacer patente su agradecimiento a las autoridades del ICM y L y al personal del B/O "Justo Sierra", así como a los compañeros del laboratorio que participaron en las campañas y en particular a Faustino Zavala y Rubén Pineda, por su apoyo y desinteresada ayuda. LITERATURAAHLSTROM, E. H. The Early Life History of Fish. The diverse patterns of metamorphosis in gonostomatid fishes - An Aid to Classification. J. H. BlaxterSpringer-VerlagN.Y.1974659-674 FAHAY, M. P. Journal of the Northwest Atlantic Fishery Science Guide to the early stages of marine fishes occurring in the western North Atlantic Ocean, Cape Hatteras to the southern Scotian Shelf.19831-4324 FRASER-BRUNNER, A. A classification of the fishes the family Myctophidae. Proc. Zool. Soc. Lond.19491019-1106118(4) GARTNER, J.V., T.L. HOPKINS, R.C. BAIRD y D.M. MILLIKENFish. Bull. U.S. The lanternfishes:(Pisces: Myctophidae) of the eastern Gulf of México.198781-9885 GREY, M. Fishes of the Western North Atlantic. Mem. Sears Found Mar. Res. Family Gonostomatidae196478-2401(pt.4) HOPKINS, T.L. y T.M. LANCRAFTThe Composition and stock of mesopelagic at 27 N, 86 W in the eastern Gulf of México.Contribution in Marine Science1984143-15827 HOUDE, E.D., J.C. LEAK, C.E. DOWND, S.A. BERKELEY, y W.J. RICHARDSIchthyoplakton abundance and diversity in the eastern Gulf of MéxicoReport to U.S. Bur. Land. Mgt.,546 p.Contract No. AA550-CT7-28, LASKER, R., P.E. SMITH, J.R. HUNTER y H.G. MOSER Marine Fish Larvae. Reuben Lasker University of Washington.1981 131 p. MOSER, H.G. y E.H. AHLSTROMBull. Los Ang. Cty. Mus. Nat. Hist. Sci Development of lanternfishes (family Myctophidae) in the California Current. Part I. Sepecies with narrow-eyed larvae.19701-1457 MOSER, H.G. y F.H. AHLSTROMFish. Bull. U.S.Development of the lanternfish of its phylogenetic position, in the family Myctophidae and its role in a proposed mechanism for the evolution of photophore patterns in lanternfishes.1972541-56470 MOSER, H.G. y E.H. AHLSTOMFish Bull. Role of larval stages in systematic investigations of marine teleostes: The Myctophidae, a case study.1974391-41372(2) NAFPAKTITIS, B.G. FAO Species identification aheets for fishery purposes.Westem Central Atlantic.FAO, Roma1977p. 6. Vol. III (Myctophidae), NAFPAKTITIS, B.G. Bull. Los Ang. Cty. Mus. Nat. Hist, Sci. Sysrematics and distribution of lanternfishes of the genera Lobianchia and Diaphus (Myctophidae) in the Indian Ocean.19781-9230 ORDOÑEZ-LÓPEZ, U.Tesis Profesional. Análisis de la composición específica, distribución y abundancia de las familias Gonostomatidae, Stemoptychidae y Myctophidae (PISCES), en el Sur del Golfo de México. Fac. Ciencias, Univ. Nal. Autón. México.197884 p. PAXTON, J.R. Osteology and relationships of the lanternfishes (Family Myctophidae).Bull. Los Ang. Cty. Mus. Nat. Hist. Sci.197281P.13 RASS, T. S. Coloquio sobre Investigaciones y Recursos del Mar Caribe y Regiones Adyacentes.Deep-Sea fish in the Caribbean Sea and the Gulf of Mexico (The American Meditarranean Region) UNESCO Willemstand, CuracaoAntillas Holandesas1971509-52518-26, Nov. 1968 RICHARDS, W. J. Kinds and abundances of fish larvae in the Caribbean Sea and adjacent areas. Dep. Commer.NOAA Tech. Rep. NMJS SSRF- 776198454 p. ROMERO, M. y J. DEL CASTILLODistribución y abundancia de larvas y juveniles de peces mictófidos en el Mar Caribe.Acad Cien.Cuba19841-1626 SHIGANOVA, T.A. Larvae and juveniles of the lanternfishes (Myctophidae, Pisces) of the Atlantic Ocean.Tr. Inst. OkeanoL Akad Nauk SSSR197742-112109 WEITZMAN, S. H.Osteology and evolutionary relationships of the Sternoptychidae, with a new classification of Stomiatoid families. Bull. Amer. Mus. Nat. Hist.1974327-478153(3)
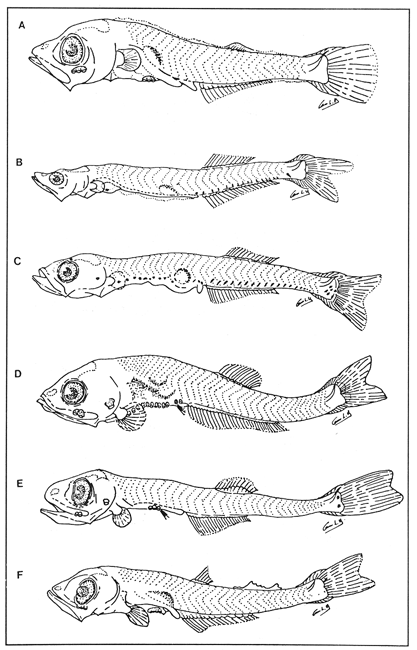 Lámina 1. A. Maurolicus muelleri, 5.6 mm.; B. Cyclothone spp, 7.2 mm., C. Gonostoma atlanticum, 8.9 mm.;D.Gonostoma elongatum, 12.4 mm.; F. Bonapartia pedaliota, 10.8 mm. ;F. Valenciennellus tripunctulatus, 10.2 mm. 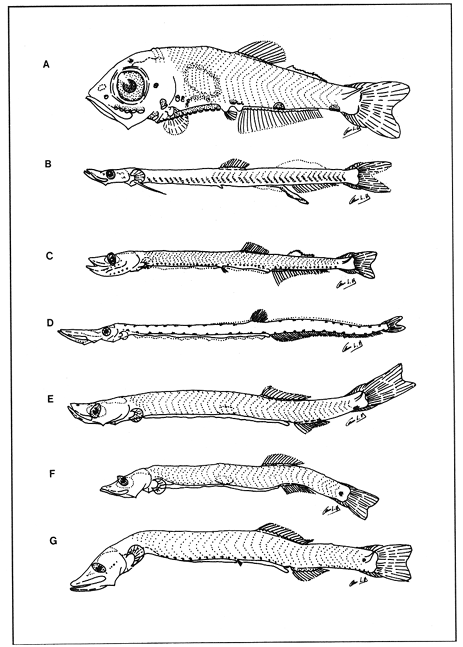 Lámina 2. A Maurolicus muelleri, 10.6 mm.; B. Ichthyococcus ovatus, 18.1 mm.; C. Pollichthys mauli, 15.3 mm.; D. Diplophos taenia, 27.8 mm.; F. Vinciguerria nimbaria, 10.2 mm.; F. Vinciguerria attenuata, 13.9 mm.; G. Vinciguerria poweriae, 16.8 mm. 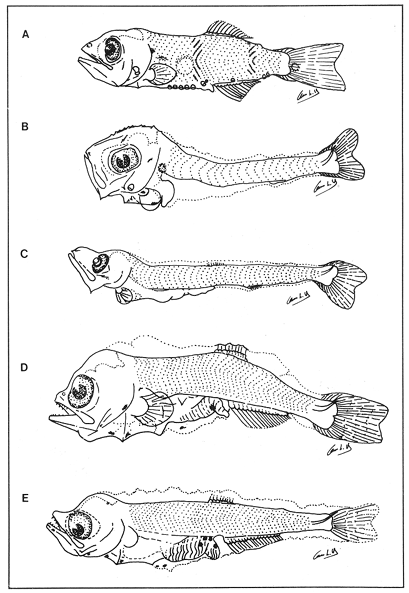 Lámina 3. A Margrethia obtusirostra, 5.4 mm.; B. Sternoptyx sp, 6.6 mm.; C. Argyropelecus spp, 6.7 mm.; D. Hygophum taaningi, 5.2 mm.; E. Hygophum macrochir, 5.2 mm. 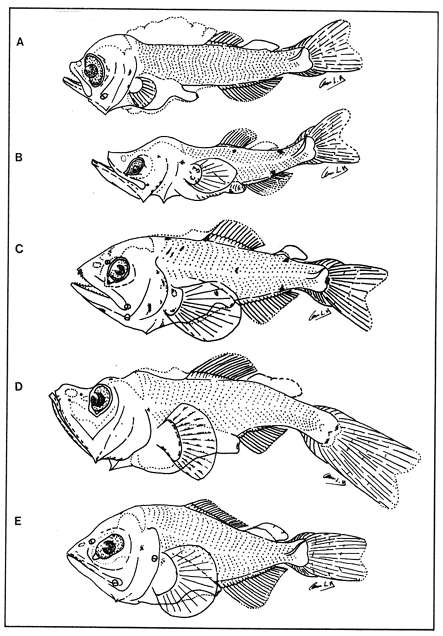 Lámina 4. A Benthosema suborbitale, 6.3 mm.; B. Myctophum nitidulum, 5.5 mm.; C. Myctophum asperum, 6.6 mm.; D. Myctophum sp, 7.2 mm.; E. Myctophum obtusirostre, 6.4 mm. 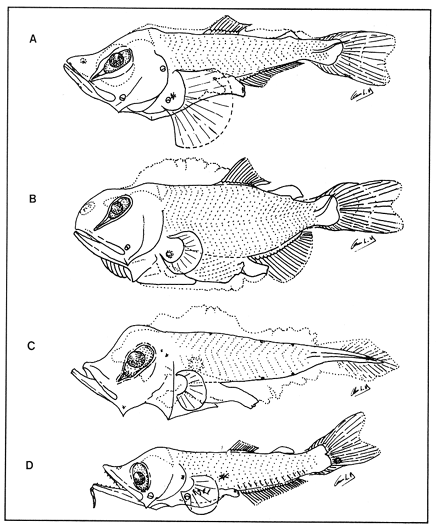 Lámina 5. A Myctophum selenops, 4.9 mm.; B. Centrobranchus nigroocelloatus, 4.5 mm.; C. Gonichthys cocco, 3.3 mm.; D. Diogenichthys atlanticus, 6.1 mm. 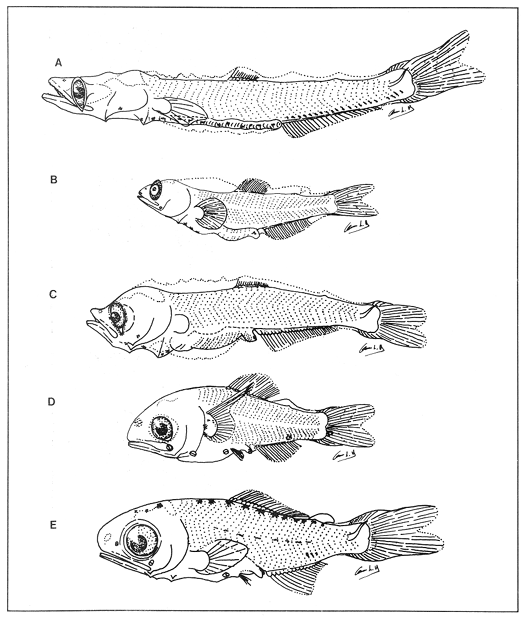 Lámina 6. A Hygophum reinherdtii, 10.1 mm; B. Hygophum benoiti, 8.5 mm; C. Hygophum hygomii, 8.1 mm; D. Lobianchia gemellarii, 6.7 mm.; E. Notoscopelus resplendens, 6.8 mm. 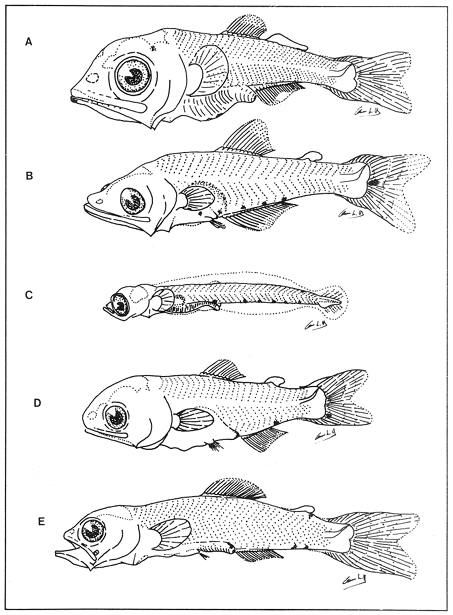 Lámina 7. A Lampanyctus spp, 5.4 mm.; B. Notolychnus valdiviae, 5.2 mm.; C. Ceratoscopelus warmingii, 5.2 mm.; D. Diaphus spp, 6.7 mm.; E. Lepidophanes spp, 7.3 mm.
|

