|
MARCADORES
ELECTROFORÉTICOS ESPECÍFICOS DE Oreochromis mossambicus Y
Oreochromis urolepis hornorum (PISCES: CICHLIDAE)
Trabajo recibido el 2 de
marzo de 1988 y aceptado para su publicación el 14 de marzo de
1988.
Manuel Uribe-Alcocer
Guadalupe Vera-Muñoz
Julio Arreguín-Espinosa
Instituto de Ciencias del Mar y
Limnología, Universidad Nacional Autónoma de México,.
Contribución No. 658 del Instituto de Ciencias del Mar y
Limnología, UNAM.
Las tilapias han
llegado a tener en México considerable importancia económica y
alimentaria. A fin de contribuir a una caracterización mas objetiva y al
mejor manejo de estos recursos acuáticos, se estudiaron mediante
técnicas electroforéticas en gel de poliacrilamida, cinco
sistemas de proteínas (plasma sanguíneo, transferrinas,
hemoglobinas, extracto de músculo y parvalbúminas) con el objeto
de encontrar patrones electroforéticos específicos en las
poblaciones de peces de Oreochromis mossambicus y
O. urolepis hornorum, así como del híbrido F1
O. mossambicus x O. u. hornorum,
provenientes de las piscifactorías del Rodeo y Zacatepec del estado de
Morelos. Se encontraron patrones electroforéticos específicos de
cada especie en las hemoglobinas y en las parvalbúminas. El
patrón del híbrido presentó bandas intermedias originadas
por la interacción genotípica de los dos
progenitores.
The tilapias have become resources of
considerable economic and alimentary value in Mexico. This paper reports the
results of electrophoretic studies of five protein systems (blood serum,
transferrins, hemoglobins, muscle myogen and parvalbumins) carried out on
polyacrilamide gel (PAG), searching for specific electrophoretic patterns of
the speciesOreochromis mossambicus and O. urolepis
hornorum, as well as the F1 hybrids O.
mossambicusx O. u. hornorum, fish cultured in the
fish farms El Rodeo and Zacatepec, in the State of Morelos, Mexico.
Species-specific electrophoretic patterns were found in the hemoglobins and the
parvalbumins. The hybrid pattern showed intermediale bands originated by the
genotipical interactions of the parental species.
La determinación de variantes electroforéticas de proteínas, y de sus respectivas frecuencias en una población, han sido utilizados como marcadores genéticos poblacionales en diferentes grupos de peces (v. gr. Tsuyukiet al., 1962, 1965, 1967; Johnson, 1975; Avise et al., 1975; Starmach, 1977; Kirpichnikov y Muske, 1979) y enOreochromis en particular (Kornfield et al, 1979; Avtalionet al, 1975; Avtalion, 1982; Camacho et al, 1984; Vera Muñoz, 1985). Por ello es necesario conocer tanto los patrones electroforéticos de algunas proteínas estructurales selectas, presentes en las poblaciones de tilapias sujetas a explotación en nuestro país como otros caracteres relevantes en su identificación (Castorena Sánchezet al, 1983; Arredondo Figueroa, 1984 y Arredondo Figueroa y Tejeda Salinas, 1989). Esta información es útil además en el manejo de las poblaciones y es relevante para la conservación de los recursos genéticos constituidos por el géneroOreochromis (FAO Fisheries Technical Paper 217, 1981). Este estudio tuvo como objetivo realizar un análisis prospectivo de cinco sistemas de proteínas (plasma sanguíneo, transferrinas y hemoglobinas, extracto de músculo y parvalbúminas) provenientes de muestras representativas de tres poblaciones: Oreochromis mossambicus, O. u. hornorum y el híbrido F1 O. mossambicus x O. u. hornorum, en peces provenientes de las piscifactorías de la Delegación Federal de la Pesca del Estado de Morelos: El Rodeo y Zacatepec, Mor. en búsqueda de: 1) sistemas proteicos que permitan una identificación clara y consistente a nivel de cada individuo estudiado. 2) sistemas que permitan conservar vivo al espécimen, con el fin de poder utilizar esta metodología en el monitoreo genético de, por ejemplo, organismos reproductores. 3) metodologías que involucren la menor complejidad posible en equipo y reactivos, y el menor costo de operación, a fin de que puedan ser implementados donde sean requeridos, a costos accesibles. MATERIAL Y MÉTODOSLos organismos estudiados pertenecen a las especies O. mossambicus (línea albina con manchas anaranjadas) yO. urolepis hornorum, introducidas a México en 1981 procedentes de Florida y depositadas en la Piscifactoría El Rodeo en el Estado de Morelos. Los híbridos estudiados fueron la F1 del cruzamiento O. mossambicus x O. u. hornorum llevado a cabo para producir progenie monosexual masculina. En cada grupo se procesaron 25 organismos, cuya longitud oscilaba entre 10 y 15 cm. Se analizaron los siguientes sistemas: extracto de músculo, parvalbúminas, plasma sanguíneo, hemoglobinas y transferrinas. La muestra de sangre fue extraída de la vena principal caudal con jeringa de 1 ml y con aguja 25 x 16 conteniendo 0.5 ml de solución heparinizada. Posteriormente fue centrifugada a 1600 rpm durante 10 minutos. El sobrenadante se conservó para estudios posteriores de plasma sanguíneo y transferrinas. Al paquete celular se le añadió NaCl al 2.5 % agitándolo en un vórtex hasta obtener una solución homogénea, repitiéndose la centrifugación tres veces. Se virtió agua fría al paquete celular, a fin de lisar las células, y se añadieron unas gotas de solución antioxidante. Dada la facilidad de oxidación de las hemoglobinas, se procedía a hacer su corrimiento electroforético a la brevedad posible. Las transferrinas se obtenían de la fracción sobrenadante, se solubilizaban en 0.15 g de Rivanol (Sigma) en solución amortiguadora pH 8.9 y se mezclaba con el sobrenadante en una proporción de 3:1. El extracto de músculo fue extraído de un cubo de 1 cm de lado de músculo blanco, limpio de escamas, de la parte media lateral de pedúnculo. Se homogenizó el tejido en un volumen igual de solución amortiguadora Tris-Glicina pH 8.9 y se centrifugó a 1600 rpm durante un minuto. El sobrenadante se dividió en dos porciones: una para correr proteínas del extracto de músculo y otra para parvalbúminas. Los organismos se sexaron y guardaron en el refrigerador a aproximadamente -5 °C para su conservación. Posteriormente las muestras de extracto de músculo fueron dializadas durante 12 horas contra agua destilada. Las muestras de parvalbúminas se sometieron a baño maría durante cinco minutos a 60 °C con el fin de desnaturalizar las otras proteínas. En la separación de las muestras se usaron como medio de soporte geles de poliacrilamida (Merck-Schuchardt y Sigma) al 10 %, según la técnica descrita por Fehrström y Moberg (1977). Se usaron las soluciones amortiguadoras sugeridas por Sullivan (Duke Marine Laboratory, Comunicación personal, 1981): Tris-Glicina pH 8.9 (cátodo) y Tris-HCI pH 8.1 (ánodo). Los corrimientos electroforéticos se llevaron a cabo en una cuba modelo Multiphor horizontal 2117 LKB Normma, conectada a una fuente de poder 2103 y a un Multitemp LKB a una temperatura de 9 °C Se llevó a cabo una preelectroforesis de 30 min a 222 volts, 400 mA y 280 W, a fin de impregnar el gel de la solución amortiguadora y limpiarlo de impurezas. Pasado este tiempo en las concavidades del gel se aplicaron las muestras y azul de bromofenol como indicador del avance frontal de la electroforesis. Junto con las muestras se corrió un patrón de proteína de peso molecular conocido (albúmina bovina PM 10 000). Las muestras se corrieron durante 10 minutos a 222 Volts, 200 mA con el objeto de que se compactaran en la zona. Pasado este tiempo las condiciones eléctricas se cambiaron a 222 V, 450 mA y 280 W. Según el tipo de corrimiento electroforético, varió entre una hora y media y dos horas. Concluida la electroforesis, se sumergió la placa de gel en una solución fijadora durante una hora, tiñéndose posteriormente con Kenacid blue R (Coomassie) (BDH Chemicals). El exceso de colorante fue retirado por difusión de la solución desteñidora, y por último la placa se dejó una hora en solución preservadora. Se colocó posteriormente una placa de plástico para su conservación. Las placas se fotografiaron sobre un negatoscopio con una cámara Reflex y rollo Kodak Technical Pan Film. RESULTADOS
Parvalbúminas:Se presenta una fotografía representativa de los corrimiento de las parvalbúminas en la figura 1 que muestra las bandas presentes en las tres poblaciones estudiadas. Los dos carriles de la izquierda pertenecen aO. u. mossambicus, los de la derecha a O. u. hornorum y los del centro al híbrido. En ella se puede apreciar que una banda central intensa y ancha, común a todos los organismos estudiados. Tres pares de bandas, la de mayor migración, delgada y poco intensa, la que se encuentra inmediatamente después y la que se encuentra inmediatamente antes de la banda central intensa presentan posiciones particulares en cada una de las poblaciones representativas, y ambas en los híbridos. Por ello se pueden considerar como marcadores electroforéticos específicos de estas poblaciones. 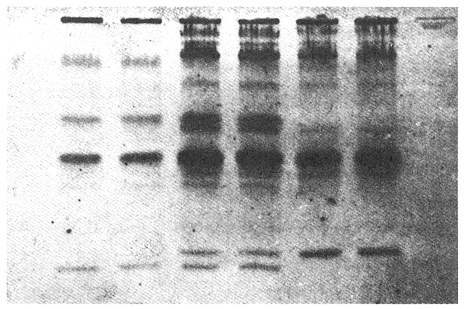 Figura 1. Fotografía de una placa de PAG con separación de parvalbúminas. Los carriles izquierdos muestran corrimientos de O. mossambicus, los derechos de O. u. hornorum y los centrales de los híbridos (40 mA, 9°C). Extracto de Músculo:Los patrones encontrados se ilustran en el diagrama de la figura 2. Se observaron tres bandas comunes, las bandas 2, 3 y 5. No se detectaron diferencias importantes entre las poblaciones, salvo una banda, la banda 1a, que aparece en las especies O. mossambicus y O. u. hornorum, y no está presente en los híbridos. Transferinas:En la figura 3 se ilustra el patrón presentado por las transferrinas. Las bandas 4, 5, 6, 7 y 8 generalmente eran intensas, las demás tenues. La banda 6 se presenta sólo en O. mossambicus y la banda 5 en O. u. hornorum y ambas en el híbrido. Por ello esta banda puede constituir un auxiliar útil en la determinación de las poblaciones. Plasma Sanguíneo:Como se aprecia en la figura 4, los patrones electroforéticos son muy parecidos entre sí, excepto por la banda 6 de O. u. hornorum, ausente en las otras dos poblaciones. Se observa asimismo que los patrones de plasma sanguíneo, principalmente el de O. mossambicus, se asemejan a los de las transferrinas. 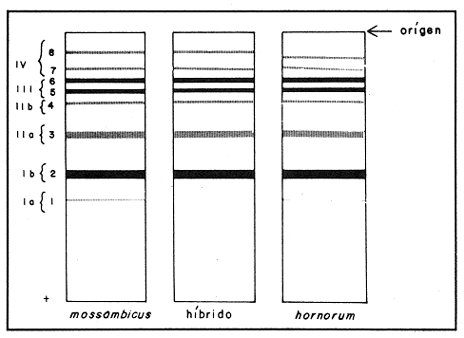 Figura 2. Patrón de separación de extracto de músculo 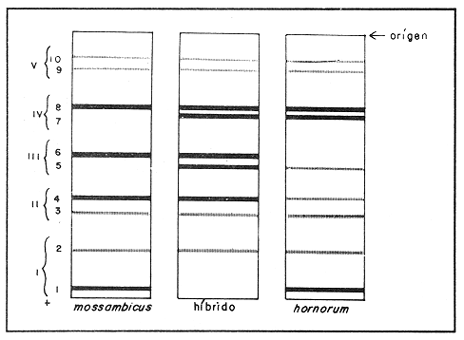 Figura 3 Patrón de separación de Transferrinas. 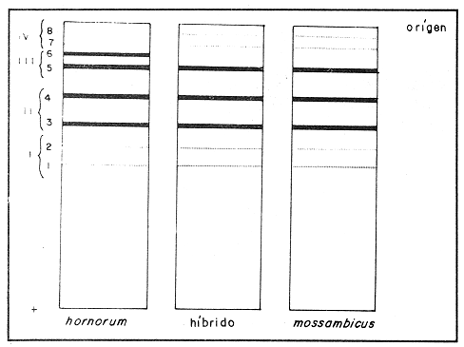 Figura 4. Patrón de separación de plasma sanguíneo. Hemoglobinas:Los corrimientos de hemoglobinas se dividieron en seis zonas, como se ilustra en las figuras 5 y 6. La banda 12 emigró hacia el cátodo en algunos organismos de la especie O. u. hornorum y el híbrido. El patrón de O. mossambicus no presenta las bandas 1, 2, 3, 6, 9 y 12. Estas bandas, exclusivas de O. u. hornorum tienen las siguientes características: bandas 3 y 9, delgadas e intensas; bandas 1, 2 y 6 delgadas y tenues. Este patrón mostrado consistentemente, puede constituir un marcador poblacional útil. Electroenfoque:Se llevó a cabo un estudio preliminar de separación por electroenfoque (Abramset al, 1983). Se sometieron a electroenfoque muestras de hemoglobinas y de plasma sanguíneo en un intervalo amplio de pH que abarcaba de 3.5 a 9.5, y se observó que las bandas de hemoglobina se situaron en el intervalo 7.6 - 5.3, mientras que el plasma sanguíneo en el intervalo 5.8 - 4.2. Las hemoglobinas fueron sometidas nuevamente al electroenfoque en un rango más estrecho 8.5 - 5.5. Las bandas se establecieron en el gradiente de pH 5.5 a 7.7. 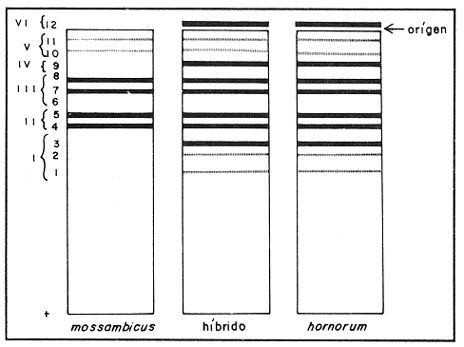 Figura. 5. Patrones de separación de hemoglobinas 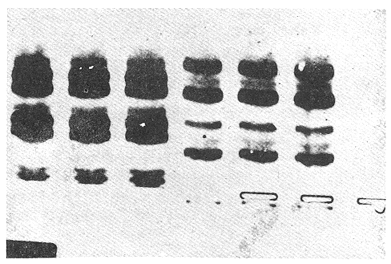 Figura 6. Fotografía de una placa de PAG mostrando los perfiles de separación de las hemoglobinas. Los carriles izquierdos muestran corrimientos de O. mossambicus y los de la derecha, a O. u. hornorum. DISCUSIÓNEl análisis de los electroferogramas de las especiesO. mossambicus, O. u. hornorum y el híbrido, en los cinco sistemas de proteínas estudiados, se hizo de acuerdo a la migración anódica de las bandas, a su presencia o ausencia, y a la intensidad de las mismas, así como en la presencia de bandas comunes. 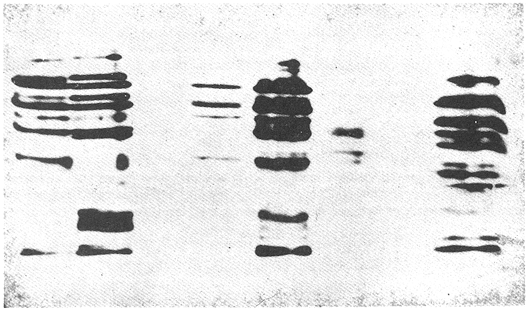 Figura 7. Fotografía de separación de hemoglobinas por electroenfoque. Se pudieron detectar variaciones en las proteínas provenientes de las dos especies y el híbrido, originando patrones electroforéticos diferentes. Del análisis de las bandas de los electroferogramas, destaca que en todos los sistemas estudiados existen tres o más bandas comunes a las distintas poblaciones, testigos de información genética que ha sido conservada a partir, por lo menos, del tronco ancestral común. Por otra parte, se ha encontrado gran variación en los diferentes sistemas, los puntos más relevantes de la cual se mencionan a continuación. Al comparar los electroferogramas de las parvalbúminas (figura 1) provenientes de las especies O. mossambicus, O. hornorum y el híbrido, se encontraron bandas específicas en cada una de las especies y la consiguiente presencia conjunta en el híbrido, por lo que se les puede considerar como marcadores genéticos. En la comparación de los patrones electroforéticos del extracto de músculo (figura 2), se aprecian varias bandas comunes. No se detectó una diferencia consistente entre los tres patrones. Chen y Tsuyuki (1970) demostraron que los patrones de extracto de músculo son específicos de las especies, lo que no fue detectado en este trabajo. Esta discrepancia se puede deber a diferencias técnicas, ya que el medio de soporte y las soluciones amortiguadores utilizadas por ellos difieren de las empleadas en este estudio. Las transferrinas también presentan diferencias. Por ejemplo, la banda 6 es encontrada en O. mossambicus, mientras que las bandas 5 y 7 en O. hornorum, y las tres en el híbrido. Sin embargo, por falta de nitidez en las placas debida tal vez a la variación en las concentraciones de las muestras, no se pudo observar en todos los organismos estudiados, no pudiendo considerárseles como marcadores. Sin embargo, se pudieron detectar tres frecuencias electroforéticas diferentes. Existe el antecedente de que Chen y Tsuyuki (1970) estudiando transferrinas encontraron en O. u. hornorum, dos bandas, y en O. mossambicus, una, mientras que el híbrido mostraba las bandas de cada progenitor. Es por esto que en estudios posteriores se deberá ampliar la muestra, o auxiliarse con técnicas como la autorradiografía para obtener mayor confiabilidad de los resultados. En los patrones de hemoglobinas específicos de cada población, la especificidad resulta de la presencia de bandas exclusivas de los corrimentos de O. u. hornorum y el híbrido, ausentes en O. mossambicus (figuras 5 y 6). Así, esta última presenta tres notorias zonas de bandas, mientras que en los corrimientos de O. u. hornorum y del híbrido, muestran sólo dos zonas de tres bandas cada una, además de una banda de migración catódica. Como el patrón de bandas de las hemoglobinas de los híbridos se inclina al de O. u. hornorum no es posible discriminar entre estas poblaciones, pero sí se puede caracterizar sin ambigüedad a O. mossambicus. Estos patrones son congruentes con los presentados por Camacho y colaboradores en 1984. Existen algunos posibles factores que pudieran enmascarar resultados añadiendo variación artificial. Por ejemplo, la posible utilización de cepas que en alguna etapa hayan sufrido contaminación genética por medio de la incorporación de individuos de otras cepas a las poblaciones reproductivas, hecho que pudiera haberse dado en las piscifactorías. Esta variación se podrá demostrar al estudiar muestras más amplias, provenientes de diferentes lugares, en fases posteriores del estudio. ConclusionesLos estudios electroforéticos de las tilapias han mostrado que existen proteínas (hemoglobinas y parvalbúminas) que se separan electroforéticamente en bandas características y diferentes en las poblaciones estudiadas, y que pueden ser utilizadas como características diagnosticas diferenciales. AgradecimientosEste trabajo fue realizado con fondos del presupuesto interno otorgado por la UNAM al Instituto de Ciencias del Mar y Limnología, así como fondos proporcionados por el CONACYT al Proyecto clave PCCBBNA - 021431 "Estudios genéticos en peces de importancia alimentaria y económica. a) Género Tilapia. b) Género Dormitator". LITERATURAABRAMS, R., R. VERBEKE y J. VAN HOOF Fish species identification by isoelectric focusing. The use of schematic patterns.Fleischwirpsch19831459-146263(9) ARREDONDO FIGUEROA, J.L.Tesis DoctoralSituación Taxonómica actual de las especies de la Tribu Tilapiini (Pisces, Cichlidae) introducidas a México. Facultad de Ciencias. Univ. Nal. Autón. México.1984 ARREDONDO FIGUEROA, J.L. y M. TEJEDA SALINAS An. Inst. Cienc. del Mar y Limnol.El hueso faríngeo, una estructura útil en la identificación de las especies de la tribu Tilapiini (Pisces, Cichlidae) introducidas a MéxicoUniv. Nac. Autón. México198959-6816 (1) AVISE, J.C., SMITH, J.J. y F. J. AYALA EvolutionAdaptive differentiation with little genic change between two native California minnows.1975411-42629 AVTALION, R.R. The Biology and Culture of Tilapias. Genetic markers in Sarotherodon and their use for sex and species identification. Pullin, R.S.V. y Lowe-McConell (Eds.) ICLARM Conference. International Center for Living Aquatic Resources. Manila, Philippines.1982 AVTALION, R.R., Y. PRUGININ y S. ROTHBARD Determination of allogeneic and xenogeneic markers in the genus Tilapia. I. Identification of sex and hybrids in Tilapia by electrophoretic analysis of serum proteins.Bamidgeh19758-1327(7) CAMACHO, A., V. RIVALTA, A. VILLAESCUSA y R. CABALLEROLas isoenzimas en el estudio de Tilapia y géneros afines existentes en Cuba. I. Características electroforéticas de seis sistemas proteínicos. Ciencias Biológicas198411-2212 CASTORENA SÁNCHEZ, I., M. URIBE ALCOCER y J. ARREGUÍN ESPINOSA Estudio cromosómico de poblaciones del género Tilapia (Pisces, Cichlidae), provenientes de tres regiones de México.E Veterinaria Méx.1983137-14414 CHEN, F.Y. y H. TSUYUKIZone electrophoretic studies on proteins, of Tilapia mossambica and T. hornorum and their F1 hybrids, T. zilii and T. melanopleura.Fish. Res. Bd. Can.19702167-217727 FAO/UNEPConservación de los Recursos Genéticos de los Peces Problemas y Recomendaciones. Informe de la Consulta de Expertos sobre Recursos Genéticos de los Peces.Roma, FAO Fish Tech. Pap.1981217 8 a 13 de junio de 1980. FEHNSTROM, H. y U. MOBERGSDS and conventional poliacrilamide gel electrophoresis with LKB 2117 multiphor. Application note 306. LKB produkter AB, BrommaSuecia1977 JOHNSON, M. S.Biochemical Systematics of Atherinid genus Menidia.Copeia1975662-691 KIRPICHNIKOV, V.S. y G. A. MUSKEMaterials XVI Int. Conf. Anim. Blood Gr. Biochem Plym. Functional differences between allozymes in Pacific sockeye salmon (Onchorhyncus merka Walb.)1979VOL. IV. KORNFIELD, I.L., U. RITTE, RICHLER y J. WAHRMANEvolution Biochemical and cytological differentiation among cichlid fishes on the sea of Galilee.19791-1433(1) STARMACH, J.Electrophoretic separation of blood serum protein on polyacrilamide gel in seven carp families. Acta Hydrobiol.1977163-16719(2) TSUYUKI, H., E. ROBERTS y E. A. GADD Muscle protein of Pacific Salmon (Onchorhyncus). Can. Jour Bioch. Physiol1962929-93640 TSUYUKI, H., E. ROBERTS y R. H. KERR Comparative electropherograms of the family Catostomidae. J. Fish. Res. Bd. Canada1967299-30425 TSUYUKI, H., E. ROBERIS y W. E. VANSTONE Comparative zone electropherograms of muscle myogens and blood hemoglobins of marine and freshwater vertebrates and their application to biochemical systematica. J. Fish. Res. Bd. Canada1965203-21322(1) VERA MUÑOZ, M.G.Tesis de Maestría en Ciencias.Caracterización electroforética de los peces sarotherodon mossambicus y S. hornorum (Pisces, Cichlidae).Facultad de Ciencias. Univ. Nal. Autón. México.1985
|

