|
CICLO REPRODUCTIVO DEL
MEJILLÓN Modiolus capax (Conrad, 1837) (BIVALVIA, MYTILIDAE,
ANISOMYARIA) EN LA BAHÍA DE LOS ANGELES, BAJA CALIFORNIA,
MÉXICO
Trabajo recibido el 5 de enero de 1989 y aceptado para su
publicación el 4 de abril de 1989.
Luis Fernando Bückle Ramírez
María del Carmen Garza Aguirre
Centro de Investigación Científica y
de Educación Superior de Ensenada (C. I. C. E. S. E. ). Acuicultura. Av.
Espinoza 843, Ensenada, Baja California,
México.
A partir del análisis
histológico de las gónadas de organismos colectados en una
estación de muestreo en la zona intermareal de la Bahía de Los
Angeles, B.C., desde febrero de 1985 hasta enero de 1986, excluyendo los meses
de marzo y julio, se determinaron las etapas de madurez y el ciclo reproductivo
de Modiolus capax.Aunque se encontraron evidencias de
liberación de gametos durante todo el período de estudio, el
ciclo reproductivo tuvo fases definidas. De febrero a junio la mayoría
de los organismos se encontraron en etapas de crecimiento gonadal, en agosto
fue evidente un período de intensa liberación de gametos el cual
probablemente también sucedió en Julio. En agosto y septiembre la
gametogénesis se reinició rápidamente; la
liberación de gametos con menor intensidad, pero en gran número
de organismos, continuó hasta el final del estudio. Desde agosto hasta
enero de 1986 se encontraron organismos cuyos gametos maduros se reabsorbieron
en los folículos. El período de crecimiento gonádico
más rápido y la liberación de gametos más intensa,
estuvieron relacionados con las temperaturas más altas de la
bahía. Se describen 14 etapas de madurez, cuatro de la cuales fueron
etapas combinadas de crecimiento y de liberación de gametos. Se propone
una nueva escala de madurez gonádica.
The
reproductive cycle of the musselModiolus capax (Conrad 1837)
(Bivalvia, Mytilidae, Anysomyaria) in Bahia de Los Angeles, Baja California,
Mexico. The gonad maturation and reproductive cycle of Bahia de los
AngelesModiolus capax were determined with a hystological
study of the gonads of organisms collected monthly, from february 1985 to
january 1986, along the shores of the bay. Although gamete release was observed
throughout the sampling period, the reproductive cycle of M.capax
has defined peaks: from february throug june, most were in different
stages of gonadic growth. August was a period of intense gamete release
(probably initiated in july). During this and the following month gametogenesis
reinitiated and the liberation of gametes continued, though with lower
intensity, in a high number of individuals. This situation continued until
january; throughout this period resorption of mature gametes was also observed
in the gonadic follicles. Rapid gonadic growth and intense gamete release were
related to high water temperatures. This study also proposes a new gonadic
scale with fourteen maturation stages, four of which are combined stages of
growth and gamete release.
Los cultivos marinos de algunas especies de mejillones de la familia Mytilidae, han llegado a constituir una parte importante en la producción de alimento para el consumo humano en algunos países como España, Francia, Holanda, Italia y otros (Korringa, 1976; Bardach et al.1972) En México las condiciones para el desarrollo de la acuicultura son excelentes. Las 28 millones de hectáreas de cuerpos de agua distribuidos en el interior del país y a lo largo de los litorales ofrecen una base muy amplia para la producción directa de proteína de origen animal (Urbina, 1980). A la descripción taxonómica comoModiola capaxhecha por Conrad en 1837 y redescrita por Soot-Ryen en 1955 (Keen, 1971) se agregan observaciones sobre la distribución geográfica y el hábitat (0lsson, 1961; Keen, 1971; Coan y Carlton, 1975; Brusca, 1980). La información científica relacionada directamente con la biología deModiolus capax se inicia con el estudio de la actividad reproductiva (Ochoa-Báez, 1985) en una población en la Bahía de la Paz, Baja California Sur, México; Orduña-Rojas (1986) describe por primera vez el desarrollo embriológico y larval; Aguirre-Hinojosa, (1987) estudió los patrones de fijación de las larvas sobre sustratos artificiales fijados a estructuras flotantes instaladas en la Bahía de Los Angeles; Rico-Mora, (1987) experimenta en el laboratorio el efecto interactivo de la temperatura y la concentración de las microalgas Pavlova (Monochrysis) lutheri (Droop) yTetraselmis suecica (Kylin) en las respuestas fisiológicas de filtración, clarificación, eficiencia de asimilación, consumo de oxígeno y excreción amoniacal y Espinoza-Peralta (en preparación) investiga la forma de prolongar la condición óptima de desove de los progenitores manipulando los factores de temperatura y alimentación. Un requerimiento básico para aplicar normas de conservación y/o explotación de especies marinas comerciales es el conocimiento detallado del proceso de maduración gonádica, el cual puede deducirse sólo en base a una amplia experiencia. Este trabajo redescribe y define en profundidad el devenir de la maduración gonádica deM. capaxy compara los resultados con la escala de madurez, propuesta por Ochoa Báez (1985). MATERIALES Y MÉTODOSBahía de los Angeles está situada en la parte Oeste de Golfo de California, en la intersección de los 29º de Latitud Norte y los 113º 13' de Longitud Oeste. Comprende un área aproximada de 63 km². Sus entradas están protegidas por varias islas, entre ellas la isla Angel de la Guarda, la segunda más grande del Golfo (Brusca, 1980). La estación de muestreo quedó situada en la zona noroeste frente al campamento del Programa de estudio de la tortuga marina de la Secretaria de Pesca. (Fig. 1). En la zona intermareal de esta localidad donde se midió la temperatura y la salinidad superficial, existe una zonación del sustrato primario y de la epibiosis. La franja inferior de la estratificación se compone de un sustrato mixto de fragmentos de piedra y arena densamente colonizada por Modiolus capax y es la zona del intermareal cuyo tiempo de inmersión es mayor al tiempo de exposición. Para hacer el análisis histológico de las gónadas deM. capax se colectaron mensualmente desde febrero de 1985 a enero de 1986, diez organismos de cada uno de los siguientes intervalos de longitud anteroposterior: 43-69;9 mm, 70-89;9 mm y mayores de 90 mm. Según la frecuencia de distribución de tallas el intervalo intermedio constituye la reagrupación de las tallas más numerosas de la estación y los intervalos inicial y último contienen las tallas menos abundantes. Aunque inicialmente se colectaron organismos menores de 43 mm, éstos no fueron utilizados para el análisis histológico debido a que la mayoría de ellos eran indiferenciados sexualmente, además del agravante de ser muy escasos en la población. Las gónadas de los organismos se fijaron en formol al cuatro porciento neutralizado con bórax. Por causas de fuerza mayor, los organismos colectados en marzo de 1985 no pudieron analizarse y en julio no se sacaron muestras. La gónada de cada organismo se describió macroscópicamente y para las preparaciones histológicas se utilizaron porciones de la parte más prominente, el lóbulo, situado ventralmente entre el músculo aductor posterior y la glándula del biso. Todas las muestras de la gónada se embebieron en parafina y se prepararon secciones de cinco micras de espesor que se tiñeron con la técnica de hematoxilina y eosina. Los cortes histológicos se analizaron al microscopio y se estableció una escala arbitraria de madurez, adaptada según los criterios de clasificación de Seed (1975), Kennedy (1977) y Kelley et al., (1982), basada principalmente en el tipo y proporción de las células germinales de los folículos de las gónadas. Todos los meses se calculó el índice promedio de madurez (Chipperfield, 1953) como : I.P.M. = Σ (A x B)/N, donde A = número de organismos en la misma etapa de madurez B =rango numérico arbitrario de la etapa de madurez y N = número de organismos en la muestra analizada. Los incrementos de este índice denotan un aumento del crecimiento gonadal y los decrementos un avance en la liberación de gametos. 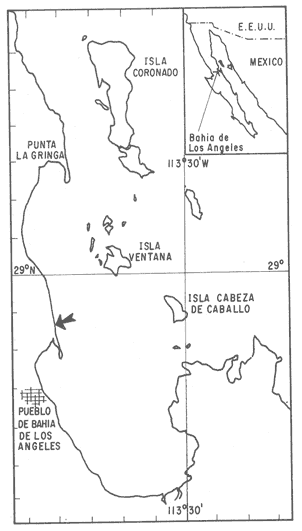 Figura 1. Ubicación geográfica de la Bahía de Los Angeles. Las flechas indican las estaciones de muestreo. (Mapa tomado de Barnard y Grady, 1968). El Indice Gonádico (Sastry, 1978) de cada animal se computó como I.G. =(peso húmedo de la gónada/peso húmedo de la carne) x 100 y el valor promedio para el total de los organismos se calculó mensualmente. Para detectar diferencias del número de organismos en las diferentes etapas de madurez entre los tres intervalos de tamaño de la población se aplicaron mensualmente análisis de varianza no paramétricos de Kruskall Wallis y también pruebas U' de Mann Wittney (Siegel, 1980) para establecer esas diferencias entre los sexos de los organismos. RESULTADOS
DESCRIPCIÓN DE LA GÓNADAModiolus capax es un organismo dioico. El reconocimiento del sexo por la coloración de la gónada sólo es posible en los animales con un alto grado de madurez porque los sexos se confunden fácilmente en las etapas tempranas de la gametogénesis y al final de la liberación de los gametos. La mayor parte de la gónada llena el espacio entre el músculo aductor posterior, los músculos retractores del pie y del biso y la glándula del biso. En la región ventral forma entre el músculo aductor posterior y la glándula del biso, un lóbulo, que puede llegar a ser muy voluminoso y prominente en los organismos completamente maduros, ó muy delgado y fláccido en los individuos con un escaso desarrollo gonadal ó que han liberado gran parte de sus gametos. Hacia la región anterior de animal, la gónada se extiende cubriendo dorsal y ventralmente a la glándula digestiva y al intestino, variando su volumen con el grado de madurez. Por la región posterior dorsal se localiza alrededor del recto llegando en ocasiones a rodearlo por completo. El color de la gónada es variable. Durante las primeras etapas de la gametogénesis adquiere un color crema, en ocasiones con tonalidades anaranjadas. En los organismos con una madurez gonadal avanzada ó que comienzan a liberar sus gametos torna a un color anaranjado en las hembras y crema brillante en los machos. En las etapas avanzadas de liberación de gametos la gónada vuelve a adquirir una coloración crema pero opaca o parduzca. El tamaño de los folículos ó alvéolos con paredes de fibras musculares que contienen las células germinales varía con el grado de madurez, pero no necesariamente todos los organismos maduros tienen folículos más grandes que los inmaduros. El estroma de la gónada tiene paquetes de células con granulaciones en cantidades variables que son sostenidas por numerosas fibras. Los fagocitos libres son frecuentes en el tejido conectivo ó dentro de los senos venosos bien definidos. DESCRIPCIÓN DE LAS ETAPAS DE MADUREZEn el examen de este proceso se reconocieron 14 etapas de madurez de las cuales cuatro son etapas combinadas de crecimiento y de liberación de gametos. La descripción microscópica y macroscópica de las etapas es la siguiente: Etapa 0 ó de reposo.- Incluye animales que no tienen indicios de sexualidad. Comprende organismos vírgenes ó aquellos que han liberado completamente sus gametos y que no han reiniciado la gametogénesis. En los animales vírgenes el material reproductivo es escaso sin folículos conspicuos ó estos apenas comienzan a formarse. Macroscópicamente, el material reproductivo se concentra casi por completo en el lóbulo ventral pequeño, delgado y de color crema, casi transparente. En los organismos sexualmente activos (Fig. 2A) que ya han liberado totalmente los gametos, los folículos (f) generalmente se encuentran contraídos, las paredes son gruesas (p.f.) y no tiene células germinales en el lumen. La gónada varía de color crema a anaranjado opaco tenue. El lóbulo es delgado, de poca altura, fláccido con los bordes transparentes y a veces colapsado y extendido hacia los lados. En el resto del cuerpo del animal, donde también se distribuye la gónada, suele encontrarse en la región dorsal formando una capa delgada. ETAPAS DE CRECIMIENTO (C)Etapa C1.- Iniciación de las gametogénesis. Al comienzo de esta etapa sólo se encuentran gonias en los folículos y es difícil reconocer el sexo, mientras que en estados más avanzados el lumen de los folículos lo ocupan estadíos tempranos de la gametogénesis. En los machos existe una predominancia de las espermatogonias (eg) y de los espermatocitos (es) (Fig. 2 B) y en las hembras de oogonias (og) y ovocitos primarios (o.p.) (Fig. 2 C) pero en ningún caso existen gametos morfológicamente maduros. Los folículos en general son alargados y angostos. El aspecto macroscópico de la gónada es similar al de la etapa de reposo, aunque el color de la gónada no siempre es opaco. Etapa C2.- También es una etapa temprana de la gametogénesis. En los machos abundan los espermatocitos (es), y se distinguen los primeros espermios (e) morfológicamente maduros (Fig. 2D). En las hembras los ovocitos primarios (o.p.) y secundarios (o.s.) son los más abundantes, los últimos (o.s.) devienen óvulos maduros (ov) libres en el lumen folicular (Fig. 2 E). Como resultado de las continuas divisiones celulares los folículos se distienden, aumentan el volumen disponible y en consecuencia se observan más redondeados. El lóbulo comienza a engrosarse y a ser más firme (aunque a veces permanece delgado); el color es crema ó anaranjado tenue. La masa gonadal en la región anteroventral es delgada y en la región dorsal oculta casi por completo a la glándula digestiva y al recto. Etapa C3.- En esta etapa la mayoría de los folículos están ocupados por una proporción aproximadamente igual de gametos maduros e inmaduros. Las gonias son escasas. Los folículos son redondos y sus lúmenes generalmente pequeños debido a la profusión de gametos. En los folículos de los machos, los espermios (e) se disponen radialmente (Fig 2 F). En las hembras los ovocitos primarios (o.p.) son pequeños y adheridos totalmente a la pared del folículo. Los ovocitos secundarios (o.s.) (mayoritarios) son piriformes y están sujetos a la pared folicular por un delgado pedúnculo citoplasmático (Fig.3A). La aparencia de la gónada es similar a la etapa anterior pero siempre con el lobulo engrosado. 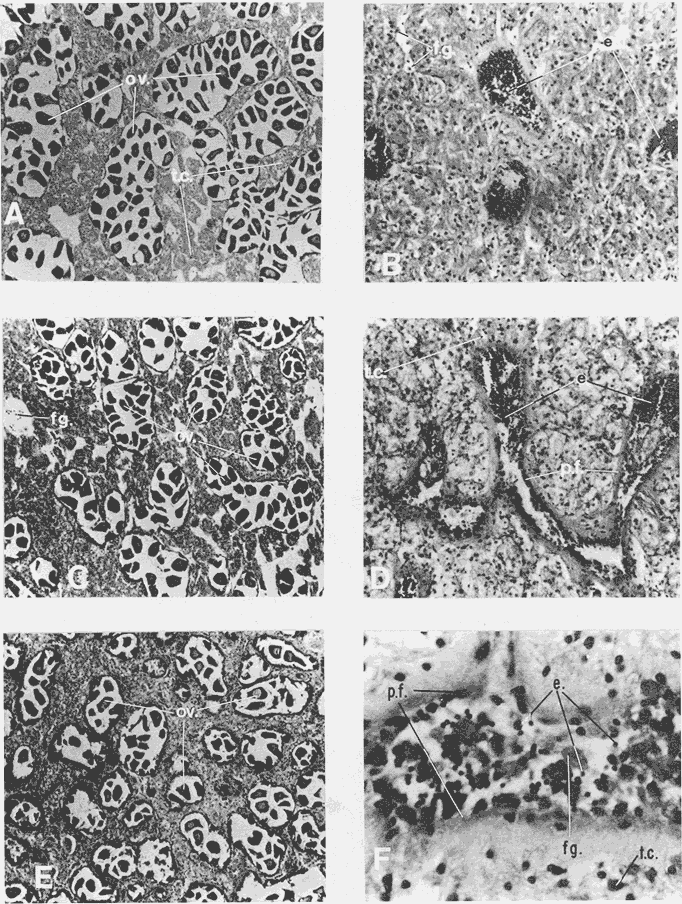 Figura 2. Ciclo de madurez de M. capax A-Etapa 0 o de reposo. B-Etapa Cl, macho, C-Etapa Cl, hembra. D-Etapa C2,macho.E-Etapa C2, hembra F-Etapa C3, macho. e espermios; eg espermatogenia; es espermatocito;f folículo;n núcleo:og ogonias. o.p. ovocito primario; o.s. ovocito secundario ov óvulo maduro; p.f. pared folicular; t.e. tejido concetivo. Etapa C4.- En esta etapa la mayoría de los folículos están ocupados principalmente por óvulos y espermios morfológicamente maduros. En los machos los gametos inmaduros ocupan una franja periférica bien delimitada (Fig. 3B b.es.). Los espacios vacíos que forman estrías en el lumen folicular son muy pequeños. En las hembras, los óvulos maduros (ov), ya libres de la pared del folículo ocupan casi todo el lumen (Fig 3C). Hay pocos ovocitos primarios (o.p.) y secundarios (e.s.). El lóbulo es por lo general voluminoso. En los machos el color de la gónada varía de crema a crema anaranjado y en las hembras de anaranjado tenue o intenso con pequeños puntos anaranjados más teñidos. Anatómicamente la gónada de los machos y de las hembras cubre exteriormente por completo la glándula digestiva y el recto. Etapa C5 ó de completa madurez.- Los folículos se han dilatado mucho y contienen óvulos ó espermios morfológicamente maduros. En los machos, los espermios (e), dispuestos radialmente, llenan por completo los folículos prácticamente sin dejar espacios vacíos entre ellos. Los gametos inmaduros son muy escasos ó están ausentes (Fig. 3D). En las hembras los óvulos morfológicamente maduros (ov) adquieren formas poligonales como resultado de su compactación en el folículo, comprimiendo también a los exiguos gametos inmaduros (Fig 3E). El lóbulo alcanza en esta etapa el volumen máximo y adquiere un color crema brillante en los machos y anaranjado intenso en las hembras. El material reproductivo en la región anterior ventral, es decir, alrededor de la glándula digestiva es generalmente abundante, pero forma capas más voluminosas en la región anterior dorsal del organismo. ETAPAS DE LIBERACIÓN DE GAMETOS (D)Etapa D4.- Aparecen los primeros signos de liberación de gametos. En los folículos de los machos se produce una reducción general de la densidad de los espermios (e); en la región central se pierde el arreglo radial y se forman pequeños espacios vacíos estriados (Fig. 3F e.v.). En la gónada de las hembras se observan algunos óvulos (ov) redondos a causa de la disminución de la presión de compactación entre ellos (Fig. 4A). El aspecto macroscópico de la gónada es similar a la etapa anterior. Etapa D3.- La liberación de los gametos progresa. Los organismos de ambos sexos conservan aproximadamente la mitad de los gametos maduros y los espacios vacíos entre ellos aumentan (Fig. B y C). El lóbulo, ahora más delgado, es de color crema anaranjado en los machos, y anaranjado tenue ó intenso en las hembras y en algunos casos es opaco. En el resto del cuerpo la gónada se distribuye en capas delgadas. Etapa D2.- La mayoría de los folículos en los machos y en las hembras, conservan aproximadamente una cuarta parte de los gametos maduros (Figs. 4D y E). Los folículos con paredes engrosadas comienzan a colapsarse probablemente como resultado de la disminución de la densidad de los gametos. El lóbulo en ambos sexos es delgado y a veces fláccido, el color es crema amarillento ó anaranjado claro, con los bordes más teñidos ú opacos con manchas café en la región anterior. En las demás regiones del cuerpo donde se distribuye la gónada hay poco material reproductivo. Etapa D1.- En los folículos de los machos(Fig. 4F) y de las hembras solo permanecen espermios (e) y óvulos residuales (Fig. 5A). Los fagocitos (fg) que en esta etapa son comunes en el tejido conectivo y dentro de los folículos, inician el proceso citolítico de los gametos formando matrices de color amarillo ó café. El lóbulo es turgente, delgado, teñido de color café en la región anterior y el resto de la estructura es amarillento ó anaranjado claro, pero muy opaco. Existe poco material reproductivo en la región dorsal y anterior ventral de los organismos. ETAPAS COMBINADAS (C/D)Etapa de crecimiento-liberación de gametos C4/D.- La morfología de los folículos es muy parecida a la descrita en la etapa C4, pero la mayoría tienen evidencias de haber comenzado a liberar gametos. En los machos los espacios libres en el lumen de los folículos son concomitantes con una disminución de la densidad de los espermios que ya no conservan la disposición radial en el centro. Se forma una separación entre la banda periférica de gametos inmaduros y los espermios. En las hembras estos folículos todavía contienen ovocitos secundarios en la pared y espacios vacíos que quedan entre los óvulos maduros. A diferencia de la etapa de crecimiento hay menos cantidad de óvulos, ovocitos primarios y gonias. La descripción macroscópica de la gónada es similar a la de los organismos en la etapa C4. Etapa de crecimiento-liberación de gametos C3/D.Esta se caracteriza porque la mayoría de los folículos de la gónada tienen signos de liberación de gametos y aproximadamente la mitad del radio folicular ocupada por gametos inmaduros. La apariencia macroscópica es similar a la descrita en la etapa C3. 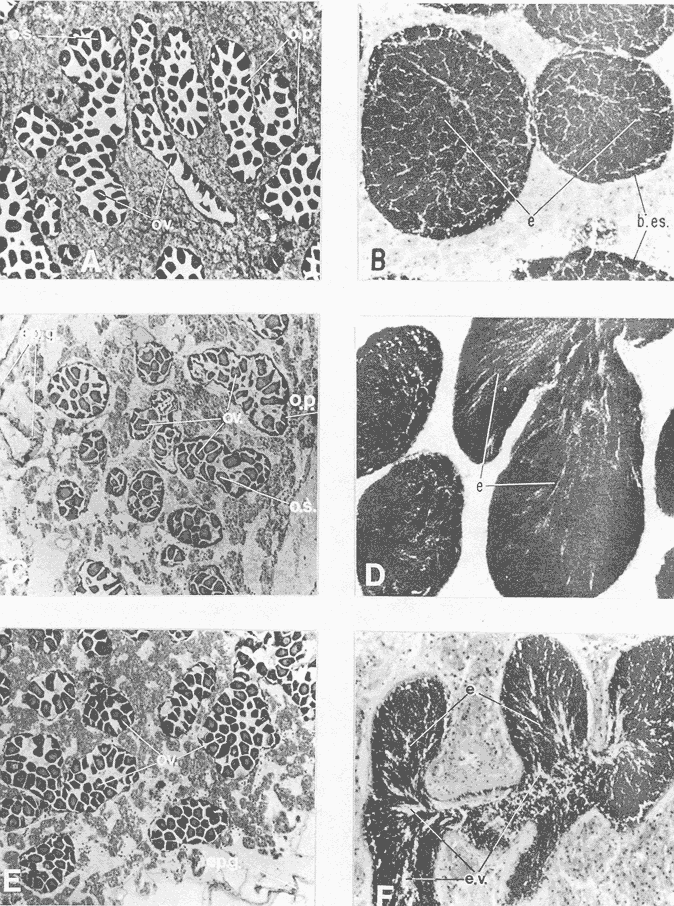 Figura 3. Ciclo de madurez de M. capax (continuación) A-Etapa C3, hembra. B-Etapa C4, macho. C-Etapa C4, hembra. D-Etapa C5, macho. E-Etapa C5,hembra. F-Etapa D4, macho. b. es banda Periféria de espermatocitos, e. espermios maduros; e.v. espacios vacíos en el lumen folicular, ep.g. epitelio de la gonada; o.p. ovocito primario ,).s. ovocito secundario; ov. Óvulo 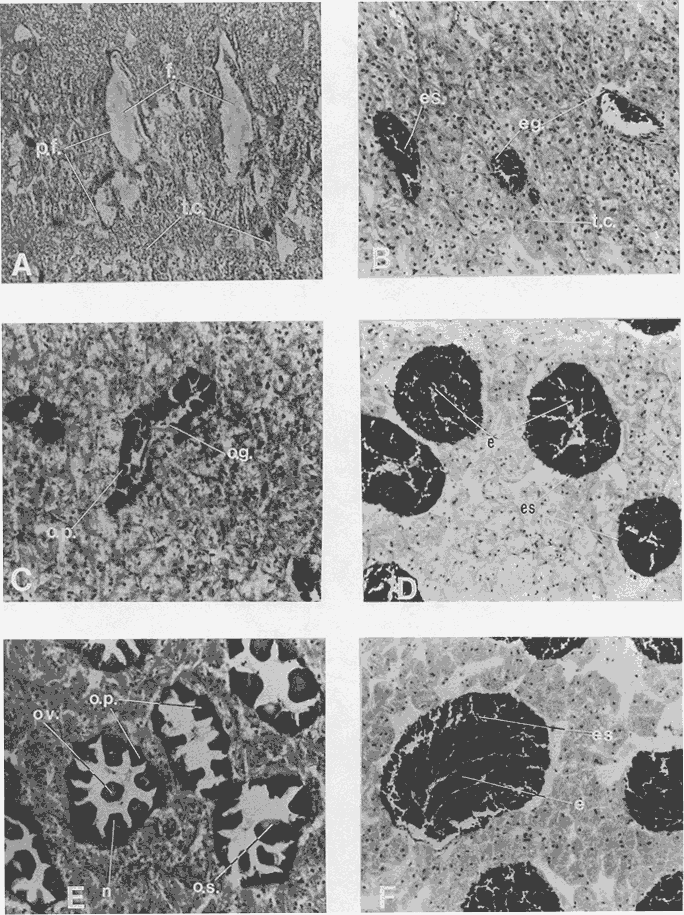 Figura 4. Ciclo de madurez de M. capax (continuación)A-Etapa D4, hembra. B-Etapa D3, macho. C-Etapa D3, hembra. D-Etapa D2, macho.E-Etapa D2,hembra. F-Etapa DI, macho. e espermios; fg. fagocitos. ov. óvulos morfológicamcnte maduro; p.f. pared folicular; t.c. tejido conectivo. 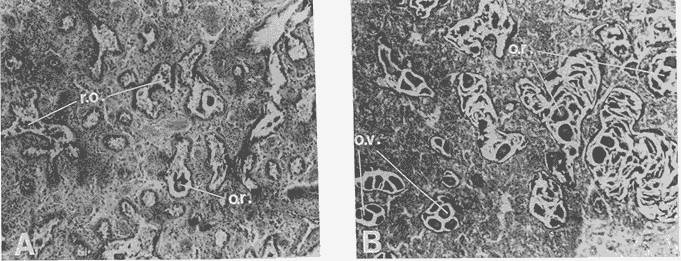 Figura 5. Cielo de madurez de M. capax(continuación)A-Etapa DI, hembra. B-Folículos con gametos en reabsorción o.r. óvulo en reabsorción; o.v. óvulo maduro; r.o. restos de óvulos. Etapa de regeneración D2/C.- El lumen de los folículos que todavía albergan espermios u óvulos maduros (aproximadamente una cuarta parte del folículo) tienen en sus paredes una gametogénesis activa. En los machos se observan espermios desarreglados en el centro de los fóliculos y en la pared paquetes de gametos inmaduros que en algunos casos se intercalan entre grupos de espermios que también hacen contacto con la pared. En las hembras, las concentraciones de oogonias y algunos ovocitos primarios se distinguen fácilmente en las paredes foliculares. Etapa de regeneración D1/C.- Folículos con óvulos ó espermios residuales que también contienen paquetes de gonias en sus paredes. Esta etapa difiere de la C1 en que aún se observan gametos residuales y procesos citolíticos, y en menor grado de colapsamiento de los folículos. En consecuencia la nueva escala de madurez de M. capax con algunas etapas sintetizadas del desarrollo gonadal es la siguiente: 0 reposo; C1-C2 crecimiento temprano; C3-C4 crecimiento avanzado; C5 maduro; D4-D3 liberación temprana de gametos; D2-D1 liberación avanzada de gametos; C4/D- C3/D crecimiento avanzado con liberación de gametos y D2/C-D1/C regeneración gonádica. Ochoa-Báez (1985) propone una escala compuesta de siete estadíos a saber: indiferenciados; gametogénesis inicial; gametogénesis intermedia; gametogénesis avanzada; desove; desovado y postdesove. Esta clasificación no registra los estadios C4/D, C3/D y D2/C. La secuencia general de las distintas etapas de madurez establecidas se indica en la figura 6. 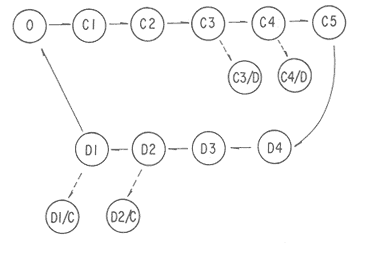 Figura 6. Etapas sucesivas que definen el ciclo reproductivo de Modiolus capax Etapa(s): 0, reposo; C1 a C5, crecimiento; D1 a D4, liberación de gametos; C/D o D/C, etapas combinadas. Las flechas interrumpidas señalan la secuencia probable de las etapas combinadas. CICLO DE REPRODUCCIÓNDurante todo el período de estudio la población se encontró reproductivamente activa. La gametogénesis progresó gradualmente en la mayoría de los organismos desde febrero hasta junio de 1985 cuando se observó una alta proporción de animales en estados avanzados de madurez o completamente maduros (Fig. 7A). La liberación de gametos, que en abril y mayo fue denotada principalmente por las etapas combinadas de crecimiento y liberación de gametos C4/D y C3/D, adquirió una mayor intensidad en agosto, dada la alta incidencia de organismos con evidencias de emisiones avanzadas de gametos. Algunos estaban en estado de reposo. La libración más intensa de gametos en agosto estuvo acompañada por un período de regeneración gonadal (D2/C - D1/C) que predominó también en septiembre. El resto de los meses la mayoría de los individuos estuvieron completamente maduros y en etapas de liberación temprana de gametos (D4 - D3). Las tendencias de la actividad reproductiva de Modiolus capax se reflejaron claramente en el índice promedio de madurez (I.PM.) (Fig. 7B), el cual tuvo dos incrementos, uno de febrero a junio que marcó el período progresivo de la gametogénesis, y otro a partir de agosto que señaló la regeneración gonadal. La declinación de este índice de junio a agosto indicó la liberación de gametos de mayor intensidad en ese período. El índice promedio de madurez fue siempre más alto en los machos (Fig. 7C). Sin embargo, sólo en junio y agosto existió una diferencia significativa (p < 0.05) en el número de organismos en las diferentes etapas de madurez y entre los sexos, la cual fue más notable según el índice en agosto porque la mayoría de los machos se encontraban en un estado de regeneración y avanzada liberación de gametos, mientras que todas las hembras estaban en la etapa D1 de emisión de gametos. 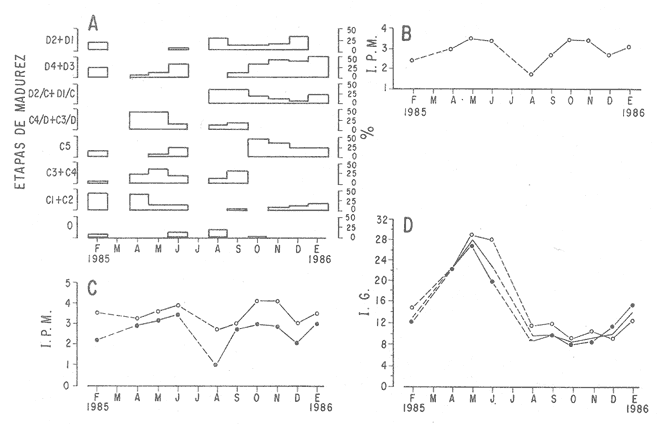 Figura 7. A- Porcentaje mensual de mejillones (M. capax) en las diferentes etapas de madurez. B- Indice promedio de maduración de la población de M. capax. C- Variación mensual del índice promedio de madurez (I.P.M.) de los machos (o) y de las hembras (o). D- Fluctuación mensual del valor promedio del índice gonádico (I. G.) del total de los individuos (-); de los machos (o) y de las hembras (o). N= 294. Al comparar las tallas establecidas, en febrero, abril, mayo y noviembre se detectaron diferencias significativas (p < 0.05) en el número de organismos en las distintas etapas de madurez entre los intervalos de tamaño. Esas diferencias fueron generadas por los individuos de las tallas menores (43.0 a 69.9 mm) los cuales estaban un poco retardados en su madurez respecto a los demás en esos meses. El incremento del índice gonádico (I.G.) (Fig. 7D) desde febrero hasta mayo de 1985 correspondió al crecimiento gonadal observado histológicamente, y su decrecimiento durante junio y agosto a la liberación más intensa de gametos, definiendo hasta aquí satisfactoriamente el curso del ciclo reproductivo en ese período. Sin embargo, en los meses siguientes los valores de este índice fueron muy bajos, lo cual probablemente se debió a la gran proporción de organismos, 20 al 30 %, en su mayoría hembras con atrofia parcial de las gónadas (Fig. 5B). Las tendencias de este índice fueron muy similares entre los mejillones de los tres intervalos de tamaño y entre las hembras y los machos. Durante todo el período de estudio la salinidad fluctuó entre 35 y 36 %, y la variación de la temperatura fue de 14.8 a 29.30C (Fig. 8). 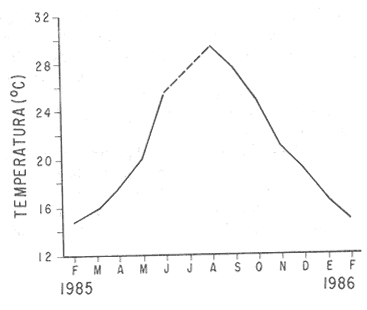 Figura 8. Variación de la temperatura en la Bahía de Los Angeles. DISCUSIÓNEl estadío IV (Desove) descrito por Ochoa-Báez, (1985) abarca las características de las etapas D4, D3 y D2 lo cual encubre una información importante sobre la intensidad de la emisión de los gametos de la población deModiolus capax. Las características de la etapa de liberación de gametos D1 pueden corresponderse a los estadíos V (Desovado) y VI (Postdesove) donde el primero fue definido por Ochoa-Báez (1985) como aquel en el que los folículos de la gónada tienen menos del 10 % de gametos maduros, que en este trabajo son considerados como gametos residuales por estar fuertemente vinculados con los procesos citolíticos en los folículos; además en el estadío V existe una gametogénesis inicial e intermedia, proceso que distingue a la etapa de regeneración (D1/C) que se caracteriza por tener óvulos y espermios residuales y paquetes de gonias en sus paredes. El estadío VI según Ochoa-Báez (1985) se distingue por tener algunos gametos residuales, lo cual también corresponde al estadio D1. En consecuencia una escala de madurez más acotada a la realidad de los procesos fisiológicos de esta especie es la que propone esta investigación. El hecho que los organismos en las etapas de liberación de gametos (incluyendo las etapas combinadas) constituyeron del 41 al 52 % de febrero a junio y del 57 al 73 % del total de agosto a enero de 1986, sugiere una liberación contínua de gametos (Fig. 7A), con una más intensa probablemente a partir de julio (mes sin muestreo) reflejada en el reclutamiento de Modiolus capax detectado por Aguirre-Hinojosa (1987) en agosto de 1985 en sustratos artificiales sujetos a una balsa experimental en la Bahía de Los Angeles y también por los resultados satisfactorios de la inducción al desove ejecutados en julio del mismo año por Orduña-Rojas (1986). La alta frecuencia de organismos en etapas de regeneración durante agosto y septiembre sugiere que la gametogénesis se reinició rápidamente y que la mayoría de los organismos no declinaron a una etapa de reposo, ó que ésta sucedió en un período de tiempo muy corto, como se ha observado en otras especies de mejillones (Kennedy, 1977; Kelleyet al., 1982; López y Gómez, 1982). Esta puede ser la causa de que en los meses siguientes se observara una baja proporción de organismos en etapas de crecimiento y una alta proporción de organismos maduros y en etapas de liberación de gametos. El índice promedio de madurez (I.P.M.), sustenta estas tendencias. Aunque se ha comprobado en algunos bivalvos que las condiciones de tensión causadas por la temperatura y el alimento pueden provocar la regresión y reabsorción de los gametos recién formados (Sastry, 1978; Bayne, 1978), la causa de la atrofia parcial de las gónadas de una gran cantidad de organismos, observado a partir de agosto, no puede dilucidarse de este estudio. La fluctuación de la temperatura (de 15 a 29ºC) durante el período en que observó este fenómeno, fue muy amplia. En este estudio se observó una relación de la temperatura con la actividad reproductiva. El período de gametogénesis más lento correspondió al incremento de 14.8ºC en febrero a 25.5ºC en junio, en contraste con la rápida regeneración de la gónada que sucedió cuando la temperatura alcanzó sus valores máximos en agosto (29.3ºC) y septiembre (26.5ºC), Asimismo se observaron esas relaciones en la intensidad de la liberación de gametos, ya que ésta fue más profusa cuando la temperatura aumentó más rápido y alcanzó los valores más altos (Junio a agosto) y disminuyó cuando la temperatura declinó de 24ºC en octubre a 14.8ºC en enero de 1986. Puede ser entonces, como indica Chipperfield (1953) en relación aMytilus edulis de las costas de Gran Bretaña, que las tasas de incremento de la temperatura no sólo determinan directa ó indirectamente la liberación de gametos, sino que también pueden tener influencia sobre su intensidad. El patrón del ciclo reproductivo de Modiolus capax en la Bahía de Los Angeles parece ajustarse al de la mayoría de las especies de origen meridional las cuales, al expanderse hacia el norte, tienden a reproducirse en los meses de verano (Margalef, 1972). AgradecimientosAGRADECIMIENTOS Este trabajo fue financiado parcialmente por el Consejo Nacional de Ciencia y Tecnología (Clave: PCECCNA 050018). LITERATURAAGUIRRE-HINOJOSA, E.,Tesis de Maestría. Centro de Investigación Científica y de Educación Superior de Ensenada. Análisis de la fijación crecimiento y sobrevivencia, del mejillón Modiolus capax (Conrad) (BIVALVIA-MYTILIDAE), durante el desarrollo de una comunidad sobre sustratos artificiales en la Bahía de Los Angeles, B.C..(C.I. C.E.S.E).México1987.106 p. BARNARD,J.L.,y J.R. Grady, General account. San Diego Soc. Nat. Hist. Trans.Abiological survey on Bahía de Los Angeles. Gulf of California. México. I:1968.51-66.15 (6): BARDACH, J.E., H.J. RYTHERy W. McLARNEY, Aquaculture.The farming and husbandry of freshwater and mame organum Wiley-interscience, a divicion of John Wiley and Sons, Inc. New York,London,Toronto1972. 868 p. BAYNE, B.L, Physiological ecology of estuarine organisms. South Carolina Press. Reproduction in bivalve mollusks under evironmental stress. In: J.F. Vernberg (Ed). 1978.p. 259-277 BRUSCA, R.C., Second edition. The University of Arizona Press. Common intertidal invertebrate of the Gulf of California.1980.513P. CHIPPERFIELD, P.N.J., J.Mar. biol.Ass. U.K.Observations on the breeding and settlement of Mytilus edilus (L.) in british waters.1953.449- 476. 32: COAN, E.U., y J.T. CARLTON, Intertidal Invertebrates of the Central California Coast. Univ. of Cal. Press. Berkeley, Ca. p. 543-579. Phyllum Mollusca: Bivalvia. In: Light's Manual: 1975.716 p. ESPINOZA-PERALTA, A.M. Tesis de Licenciatura.En preparación. Dilación del desove de Modiolus capax Conrad (Bivalvia: Mytilidae). Escuela de Biología.Universidad Autónoma de Baja California. Ensenada, Baja California,México. KEEN, M.A., Standfórd University Press.Sea shell of tropical west America Marinemollwks from Baja California to Peru. Second ed. Standford Ca.1971.1064 p. KELLEY, R.N., M.J. ASHODD-SMITH, y D.V. ELLIS, J.Mar. biol. Ass U.K. Duration and timing of spermatogenesis in a stock of the mussel Mytilus californianus 1982.509-519.62: KENNEDY, V.S., Reproduction in Mytilus edulis aoetanus and Aulacomya maoriana (Mollusca: Bivalvia) from Taylors Mistake, N.Z. Jour. Mar Fres. Res.New Zealand.1977.255-267.11: KORRINGA, P., Elservier Scientific Publisherd Company. Farming marine organisms low in the food chain. A multidisciplinary aproach to edible seaweed, mussell, and clam production. 1976.264 p. LÓPEZ, D.G.M. y E.D. GÓMEZ, Reproductive cycle of the brown mussel Modiolus metcalfei in Calatagan, Batangas. Kalikasan, Philipp. J.Biol.1982.74-82.11 (1): MARGALEF, R., Fundación La Salle de Ciencias Naturales.100-129.Luz y temperatura In: Ecología Marina.Caracas, Editorial Dossal S.A.,1972. 705 p.Cap.4: OCHOA-BAEZ, R.I., Antecedentes sobre el ciclo de reproducción de Modiolus capax (Conrad, 1837) (BIVALVIA-MYTILIDAE), en la Bahía de La Pez Baja California Sur, México. Inv. Mar.CICIMAR1985.86-103.2(2): OLSSON, A.A., Paleontological Research Institution,Mollusks of the tropical Pacific, particularly from the southern half of the Panamic Pacific faunal Province (Panama to Peru). Panamic Pacific Pelecypoda. Ithaca, N.Y. 1961.574 p. 86pls. ORDUÑA-ROJAS, J., Tesis de Licenciatura. Facultad de Ciencias Marinas. Universidad Autónoma de Baja California Desoye y desarrollo embriológico y larval del mejillón Modiolus capax CONRAD (BIVALVIA:MYTILIDAE) en condiciones controladas.(U.A. B. C). Ensenada Baja California.México.1986.52P. RICO-MORA, R., Tesis de Maestría en Ciencias.Centro de Investigación Cientifica y de Educación Superior de Ensenada. Efecto interactivo del la temperatura y de la concentración de microalgas en la fisiología alimenticia y la energía potencial para el crecimiento de Modiolus capax Conrad. (C.I.C.E.S.E).Ensenada Baja California.México.1987. 91 p. SASTRY, A.N., Physiolocal ecology of estuarine organisms. South Carolina Press. Physiology and ecology of reproduction in marine invertebrates. In: J.F. Vernberg. (Ed). 1978.p. 279-299 SEED, R., Reproduction in Mytilus (Mollusca: Bilvalvia) in european waters. Pubbl. Staz. Zool. Napoli. [39] Suppl:1975.317-334. SIEGEL, S., Non parametric statistics for the behavioral sciences. International student edition. McGraw-Hill Kogakusha, LTD. 1980.312p. URBINA, P.R., In: Memorias 2do Simposio Latinoamericano de Acuicultura Acuacultura en México.Depto. de Pesca.1980.95-102.Tomo 1:
|

