|
PROTEINAS,
CARBOHIDRATOS Y CLOROFILA a DE LA MATERIA ORGÁNICA PARTICULADA, EN TRES
DIFERENTES AMBIENTES OCEÁNICOS: MAR DE PORTUGAL, GOLFO DE CALIFORNIA Y
NW DE BAJA CALIFORNIA SUR.
Trabajo recibido el 14 de octubre de 1988 y
aceptado para su publicación el 4 de abril de
1989.
Carlos H. Lechuga Devéze
Bernardo Ayala Rocha
Ismaél Gárate Lizárraga.
Centro de Investigaciones
Biológicas de Baja California Sur, Apartado Postal 128, 23000 La Paz,
Baja California Sur, México.
Las
concentraciones de Proteína (PROT) y Carbohidrato (CHO) de la Materia
Orgánica Particulada (MOP) menor de 333 micras, fueron estimadas en la
costa oeste de Portugal en el Océano Atlántico (1981), en el
Golfo de California (1984) y en la costa noroeste de la Península de
Baja California, en el Océano Pacífico Mexicano (1985). Por medio
de análisis de regresión lineal con la clorofila
a se estimaron las concentraciones de PROT y CHO
pertenecientes a la Materia Orgánica Particulada
Detríticobacteriana (MOPD). La concentración de PROT de MOPD fue
constante para las tres zonas estudiadas (31.9±4.2 mg PROT/m³ :
la concentración de CHO fluctuó entre 5.4 y 117 mg CHO/m³
. A partir de las ecuaciones de regresión se estimó el porcentaje
de PROT y CHO asociados a la Materia Orgánica Particulada
Fotosintética (MOPF). El porcentaje de PROT varió de 37% al 69%.
Se presume que PROT y CHO particulados de origen detríticobacteriano,
puede representar una fuente importante de energía para los organismos
heterótrofos planctónicos, y que esta energía que se
incorpora en la piramide alimenticia, está siendo principalmente
modificada por las variaciones en la fuente y concentración del
carbohidrato.
Protein, carbohydrate, and chlorophyll a
of Particulate Organic Matter in three different oceanic waters: Sea of
Portugal, Gulf of California and NW of South Baja California. During three
cruises carried out in the Atlantic ocean off Portugal (1981), Gulf of
California (1984) and Pacific ocean off South Baja California (1985), was
estimated the concentration of protein (PROT), carbohydrate (CHO) and
chlorophylla(CHLa) of the Particulate
Organic Matter (POM). Linear regressions analysis with CHL,
a were performed to estimate the PROT and CHO concentrations of
Detritical Partículate Matter (DPM). The PROT concentration of DPM was
quite constant for the three sampled arcas (31.9±4.2 mg PROT/m³):
the CHO concentrations ranged between 5.4 and 117 mg CHO/m³. The
regression analysis of biochemical parameters on CHL a, were
used to estimate the proportion of PROT and CHO associated to Photosynthetic
Particulate Matter (PPM). The CHO proportions of PPM ranged between 28% to 95%:
the Prot proportions between 37% to 69%. It is presumed that PROT and CHO of
bacteria/detritus fraction might be an important energy source for others
members of the marine food chain, and this energy input is being modified by
variations in the source and concentration of particulate
CHO.
Estudios sobre la composición bioquímica del fitoplancton, expresada en términos de proteínas y carbohidratos, han sido llevados a cabo tanto en condiciones experimentales (Parsons, et al., 1961: Myklestad y Haug, 1972: Haug et al., 1973: Ganf, et al., 1986: Lechuga-Devéze y Gostan, 1986) como en ambientes naturales (Antia, et al., 1963: Barlow, 1980, 1982, Ganf,et al., 1986; Veldhuis, et al.,1986). En ambos casos, por ejemplo, se ha reportado que una deficiencia en la fuente de nitrogeno provoca una disminución del cociente proteína/carbohidrato, por lo que este cociente se considera adecuado como un índice del estado fisiológico del fitoplancton (Barlow, 1980). En cultivos monoespecíficos, la variabilidad de las proteínas y carbohidratos celulares responde a los cambios metabólicos de la microalga inducidos por un diseño experimental controlado. En el medio ambiente natural, la variabilidad de las proteínas y carbohidratos además de estar asociada al efecto de las variables ambientales sobre los organismos fitoplanctónicos, se ve afectada por la presencia de partículas no fotosintéticas como bacterias, detritus y zooplancton, cuya biomasa y proporción representa importantes variaciones espacio-temporales, haciendo mas difícil la interpretación de las variaciones bioquimicas observadas. La asignación de los diferentes parámetros de biomasa a cada grupo de partículas, vivas o detriticas, en suspensión, es uno de los problemas metodológicos de mayor dificultad. Los métodos utilizados involucran: 1) Separación mecánica (tamices) y 2) el uso de parámetros libres dé influencia detritica y/o específicos de ciertos grupos de organismos del plancton (Sakshaug, 1980), como los pigmentos fotosintéticos. El propósito de este trabajo es el estimar las variaciones espacio-temporales de las concentraciones de proteínas y carbohidratos de las partículas fotosintéticas y no fotosintéticas; considerar la posible interferencia del material no fotosintético sobre la utilización del índice PROT/CHO, como índice del estado fisiológico del fitoplancton, y finalmente, estimar la posible contribución de este material detritico como potencial fuente de alimento para los organismos heterótrofos. MATERIAL Y MÉTODOSMuestras de Materia Orgánica Particulada (MOP) en suspensión fueron obtenidas durante el desarrollo de tres campañas oceanográficas: Campaña RCA (Résurgence Cotière Atlantique) realizada durante Agosto-Septiembre de 1981 con el objetivo de estudiar el ecosistema pelágico de la zona de surgencias de la costa de Portugal (Fig.1); campaña GOLCA 8411 realizada durante el mes de Noviembre de 1984 con el objetivo del estudio biológico de la zona de desove de sardina y anchoveta, y campaña PAC 8505 realizada durante Agosto de 1985 con objetivos similares a la campaña Golca (Fig.2). Durante la campaña RCA, las muestras fueron tomadas de cuatro niveles ópticos: 100%, 40%, 20% y 1% de la irradiación incidente en superficie. En las restantes dos campañas las muestras provienen sólo de superficie. Los muestreos fueron efectuados con botellas tipo Niskin de 20 (RCA) y 10 (GOLCA, PAC) litros de capacidad. Las muestras fueron tamizadas con una red de plancton para eliminar partículas mayores de 333 micras. La MOP restante fue retenida sobre filtros de fibra de vidrio de 47 mm de diámetro, tipo GF/C (Whatman), filtrando volúmenes adecuados para el análisis de proteínas totales (PROT). carbohidratos totales (CHO) y clorofila a (CLOR a). Los filtros fueron congelados a -20ºC hasta su análisis en laboratorio. Todos los filtrados fueron efectuados por duplicado. Para el análisis de CLOR ase utilizó el método de extracto acetónico y las ecuaciones tricromaticas descritas por Jeffrey y Humphrey (1975): las proteínas totales fueron analizadas por el método de Duboiset al. (1956). Los resultados se expresan en equivalentes de albumina y glucosa respectivamente. Para determinar la relación existente entre PROT o CHO con la Materia Orgánica Particulada Fotosintética (MOPF), se realizaron análisis de regresión lineal con la CLOR a. Asumiendo que el pigmento se considera libre de influencia detrítica y animal el resultado de tal análisis muestra, por medio de la pendiente "b", la relación entre PROT o CHO por unidad de CLOR a,mientras que la intercepción con el eje "Y" (constante "a") nos indica la concentración de PROT o CHO asociada al componente Detrítico-bacteriano o Materia Orgánica Particulada Detrítico-bacteriana (MOPD) (Sakshaug, 1978; Herbland y Le Bouteiller. 1983). RESULTADOSEl mayor intervalo de temperatura y la temperatura más elevada, se observó durante la campaña PAC coincidente con el valor medio de CLOR a más bajo (tabla1). Las campañas GOLCA y RCA presentaron amplitudes semejantes en temperatura. El valor medio de CLOR a más elevado se observó durante la campaña GOLCA así como un balance entre PROT y CHO más equilibrado. Las campañas PAC y RCA mostraron una alta proporción en CHO (Tabla 1). 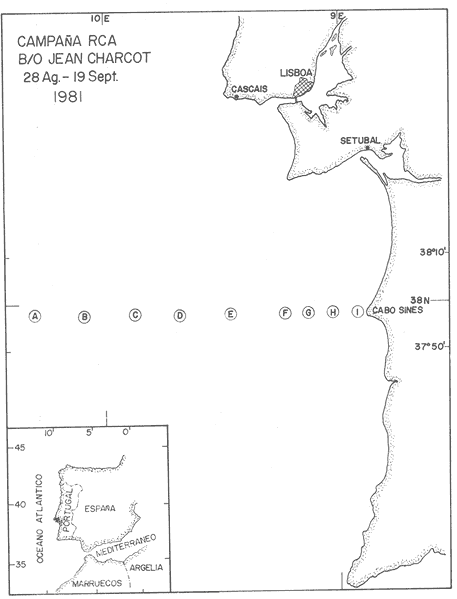 Figura 1. Localización y estaciones de muestreo para la campaña oceanográfica RCA (Agosto-Septiembre de 1981, costa de Portugal). El análisis de regresión CHO-CLOR a (Fig. 3) muestra claramente tres pendientes significativamente diferentes (p = 95%) para cada región estudiada. En la campaña RCA las pendientes obtenidas a cada nivel óptico se confunden, exceptuando aquella obtenida en el nivel 1% pero que sin embargo no es significativamente diferente (p = 95%) de los niveles restantes. En esta misma figura se observa la alta variabilidad de la intercepción en Y, con valores desde 5.4 mg CHO.m-3 (PAC) hasta 117 mg CHO.m-3 (RCA 20%). 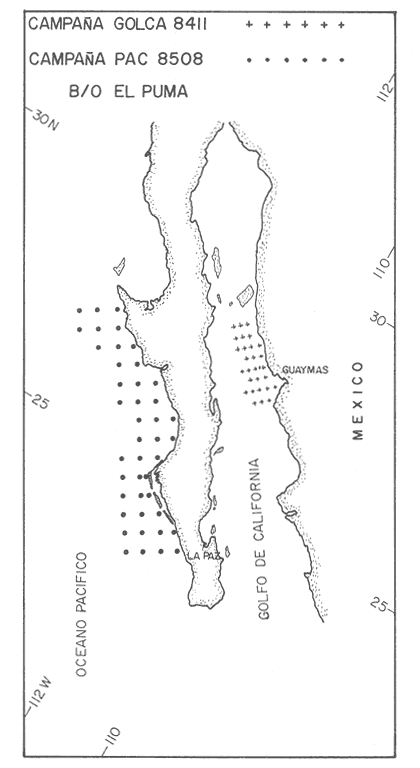 Figura 2. Localización y estaciones de muestreo para las campañas oceanográficas GOLCA 8411 (Noviembre de 1984 al Golfo de California) y PAC8508 (Agosto de 1985 a la costa occidental de Baja California Sur), México. En la regresión PROT-CLOR a (Fig. 4) la intercepción en Y es notablemente constante (31.9±4.2 mg PROT.m-3). Las pendientes son más parecidas entre sí no habiendo diferencias significativas (p = 95%) entre las campañas RCA y PAC. Sólo la pendiente de la campaña GOLCA es significativamente diferente (p = 95%) de las dos anteriores. Todos los coeficientes de regresión de las ecuaciones de regresión obtenidas (tabla 2) son significativos (p = 95%), a excepción de la regresión CHO-CLOR a en la campaña GOLCA donde p =.90%. 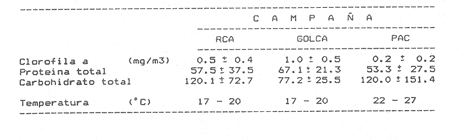 TABLA 1 MEDIAS (DESVIACIÓN ESTÁNDAR) Y RANGOS DE DESCRIPTORES BIOLÓGICOS Y FÍSICOS ENCONTRADOS DURANTE EL DESARROLLO DE LAS CAMPAÑAS OCEANOGRÁFICAS RCA, GOLCA Y PAC 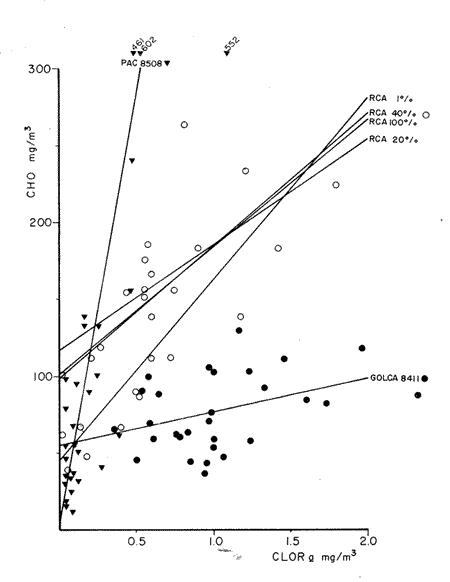 Figura 3. Relación entre Carbohidratos totales y Clorofila a durante las campañas RCA (diferentes niveles ópticos), GOLCA 8411 y PAC 8508 (superficie). Estas ecuaciones de regresión fueron utilizadas para obtener el porcentaje de PROT o CHO pertenecientes a MOPF: por ejemplo, el porcentaje de PROT del fitoplancton en la campaña GOLCA fue calculado multiplicando el valor medio de clorofilaa (1.0 mg/m³ , Tabla 1) por la pendiente "b" resultante de la regresión (32.61, Tabla 2). El resultado expresa la concentración de proteína (mg/m³ ) adjudicable a MOPF puesto que la constante "a" (33.37), presumiblemente proteína detritica, no es tomada en cuenta. 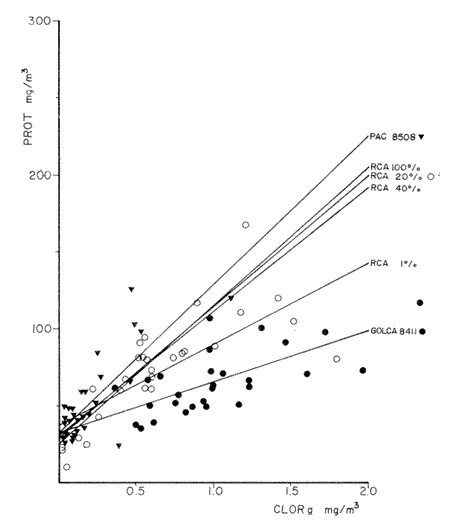 Figura 4. Relación entre Proteinas totales y Clorofila a durante las campañas RCA. (diferentes niveles ópticos), GOLCA 8411 y PAC 8508 (superficie). 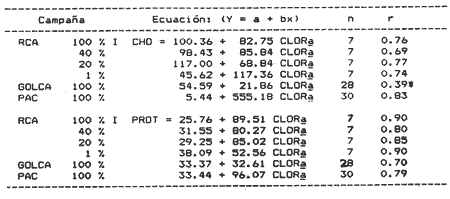 TABLA 2 ECUACIONES DE REGRESIÓN RESULTANTES DEL ANÁLISIS EFECTUADO ENTRE PROT Y CHO CON CLORa. TODOS LOS COEFICIENTES DE REGRESIÓN SON SIGNIFICATIVOS AL 95% LÍMITE DE CONFIANZA.SIGNIFICATIVO AL 90% LÍMITE DE CONFIANZA Finalmente, PROT de MOPF se expresa como el porcentaje que representa del valor medio de PROT obtenido para esta misma campaña (32,61/67.1, Tabla 1). El porcentaje de PROT o CHO para MOPD se obtuvo calculando el cociente entre el valor de la intercepción en Y y el valor medio de la variable en cuestión. Los resultados de esta serie de operaciones aritméticas (Tabla 3), muestran que el mayor porcentaje de PROT se encuentra en el fitoplancton, a excepción del crucero PAC, mientras que son los carbohidratos el componente mayoritario de la fracción detrítica. Por otro lado es notorio que CHO de MOPF y MOPD muestran una variabilidad mayor que la observada para PROT. Las pendientes de las ecuaciones de regresión fueron utilizadas finalmente, para obtener un índice del estado fisiológico de MOPF por medio del cociente PROT/CHO (Tabla 4), observando que RCA 1% y PAC presentan cocientes muy por debajo de la unidad, indicando esto una limitación en el crecimiento del fitoplancton. 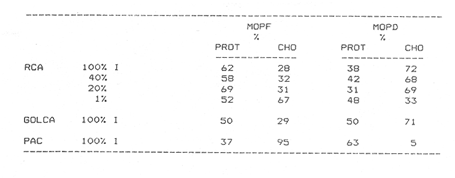 TABLA 3 PORCENTAJES ESTIMADOS DE PROTEINAS Y CARBOHIDRATOS TOTALES DE ORIGEN FITOPLANCTÓNICO (MOPF) Y DETRTICO-BACTERIANO (MOPD) 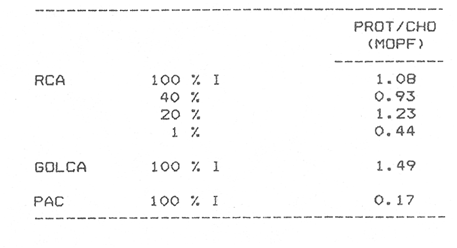 TABLA 4 COCIENTE PROTEINA/CARBOHIDRATO FITOPLANCTÓNICO. ESTE COCIENTE DADO QUE FUÉ CALCULADO A PARTIR DE LAS PENDIENTES DEL ANÁLISIS DE REGRESIÓN, SE CONSIDERA LIBRE DE INFLUENCIA DETRÍTICA DISCUSIÓNEl artificio para la evaluación de la proteína o carbohidrato asociada al fitoplancton y al detritus, supone que la intercepción con el eje Y en la regresión con CLORa nos indica la concentración de PROT o CHO al nivel "cero" de clorofilaa, es decir, en ausencia de fitoplancton, por lo tanto se asocia a otras partículas que en este trabajo se interpretan como detritus mas las bacterias asociadas a éste. Así, este artificio puede ser una herramienta útil para describir algunas propiedades de MOP de diferentes cuerpos de agua (McAllister et al., 1960: Banse. 1977: Sakshaug, 1978: Lancelot-van Beveren. 1980; Herbland y Le Bouteiller, 1983: Verlencar y Qasim, 1985: Veldhuis et al.,1986). Las regresiones significativas obtenidas entre las variables bioquímicas y la clorofilaa, indican que PROT y CHO están presentes en porcentajes apreciables en MOPF y MOPD. Tres aspectos son de especial interés: a) la respuesta significativa de las pendientes CHOCLORa hacia tres ambientes oceánicos diferentes. b) La gran variabilidad en las intercepciones en Y de las regresiones CHO-CLORa: y, c) la extraordinaria coincidencia de las intercepciones en Y de las regresiones PROT-CLORa. En el interés de encontrar un descriptor del estado fisiológico de una comunidad fitoplanctónica, se ha utilizado como indicador la proporción existente entre PROT y CHO del fitoplancton (Myklestad y Haug, 1972: Barlow, 1980,1982; Ganf, 1986; Lechuga Devéze, 1986). La variación de esta proporción es controlada principalmente por la variabilidad del carbohidrato (Handa, 1969: Myklestad. 1974: Kenneth et al,.1983). Si coincidimos en afirmar que el fitoplancton tiene como actividad principal el construir moléculas proteícas (Myers, 1962. 1980; Morris, 1981), y que ésta síntesis proteíca debe llevarse a cabo aún a expensas del carbohidrato que la célula tenga como reserva (Kowallik y Schaltze, 1980; Kulandaivelu y Sarojini, 1980); Lechuga Devéze, 1982; Kennethet al, 1983; Varum y Myklestad. 1984). Podemos entonces suponer que, por unidad de clorofilaa, los niveles de proteína permanecerán con una variabilidad menor que los niveles de carbohidrato. Bajo estas condiciones la menor variabilidad en la concentración de PROT que la observada para CHO de MOPF, puede presumiblemente ser atribuible a este mecanismo metabólico. Las diferencias entre las campañas PAC-RCA y GOLCA pueden ser explicadas en base a diferentes estadios de limitación nutritiva las cuales se explican con la evolución de las pendientes CHO-CLORa. Podemos entonces considerar que la campaña GOLCA presenta una suficiencia nutritiva avalada por un cociente CHO/CLOR a bajo (21.9) y el mayor cociente PROT/CHO (1.5). La campaña RCA se encuentra en una etapa transnacional con un cociente CHO/CLORa en aumento (88.7) y un cociente PROT/CHO en descenso (0.9), y para la campaña PAC una fase de limitación nutritiva mas avanzada con un cociente CHO/CLORa muy elevado (555) y el más bajo cociente PROT/CHO (0.17). Existe alguna información sobre la utilización del análisis de regresión para estimar el contenido de PROT y CHO en MOPD. Sakshaug (1978) estima esta concentración en 11 mgN detrítico/ 1;Verlencar y Qasim (1985) la estiman dentro de una variación del 46 al 76% de la correlación CLORa-Carbón total; de los resultados de Veldhuis et al. (1986) en una regresión PROTCLORa se calcula una concentración de 117 mg PROT/1 al nivel "cero" de clorofilaa, resultado muy elevado comparado al encontrado en este trabajo (32 mg/1) y que posiblemente sea específico para Phaeocystis pouchetti organismo altamente dominante en el citado artículo. Convenientemente, en un trabajo realizado por Herbland y Le Bouteiller (1983) en la zona fótica del Atlántico Ecuatorial, se presenta una regresión entre Nitrógeno Orgánico Particulado (NOP) y CLORa.La intercepción en Y promedia un valor de 4.1 mgN/1. Utilizando la clásica constante 6.25 para transformar NOP a PROT, resulta en un valor de 25.6 mg PROT/1 al nivel "cero" de CLORavalor muy cercano al obtenido en este trabajo. Handa y Tominaga (1969) y Handa y Yanagi (1969), señalan un decremento mas acentuado de los carbohidratos de MOP con la profundidad que los aminoácidos proteícos. Las partículas detriticas forman un sustrato para la instalación de bacterias las cuales degradan dicha partícula. Aparentemente, las bacterias instaladas contribuyen a la gran inestabilidad de los carbohidratos observada en la intercepción en Y de las regresiones CHO-CLORa. Por otro lado, Handa y Tominaga (1969), señalan un incremento del cociente proteína particulada/carbón particulado con la profundidad, debido a la rápida degración del carbohidrato y permitiendo una mayor permanencia de esta proteína particulada en la capa fótica del océano. La prácticamente constante concentración de PROT en MOPD de las tres zonas estudiadas, pudiera ser explicada entonces en función de la limitada acción de bacterias proteolíticas en el estrato superficial. Algunas de ellas tendrían una acción específica hacia un número posiblemente reducido de compuestos nitrogenados de forma tal que la partícula detrítica tendría una composición en aminoácidos semejante, únicamente degradables por bacterias localizadas bajo la zona fótica. Los resultados de la Tabla 3 muestran que MOPD contiene una proporción significativa de carbohidratos y proteínas. La utilización de esta MOPD como fuente de alimento alterna para organismos del zooplancton ha sido señalada por varios autores (Paffenhofer y Strickland, 1970; Sekiet al., 1968; Wiebe y Hendricks, 1974; Barlow, 1982). Para los efectos de sobrevivencia de, por ejemplo, algunas larvas de peces, la sola presencia de la partícula alimenticia no es la única condición: es necesario que sea del tamaño adecuado y de una conveniente calidad nutritiva y digestibilidad (Lasker y Zweifel, 1978; Leiby; 1984). No existe una idea definida sobre los hábitos alimenticios, por ejemplo, de la sardina, ya que se ha citado tanto fitófaga como zooplanctófaga e inclusive como filtradores indiscriminados (Kawasaki y Kumagi. 1984). Resulta interesante considerar que siendo la sardina uno de los pocos organismos capaces de asimilar- el carbohidrato particulado (Kawasaki, com. pers.) las fluctuaciones en su abundancia de los últimos 40 años (Lluch- Belda et al., 1986) pudiera estar directa o indirectamente relacionada con la variabilidad del carbohidrato disponible tanto en la materia orgánica particulada fotosintética como detrítica. AgradecimientosParte de este trabajo fue realizado con la ayuda económica de Consejo Nacional de Ciencia y Tecnología (México) y del Centre National de la Recherche Scientifique (Francia). La participación en las campañas oceanográficas de los colegas L. Lazzara (RCA), G. López (GOLCA) y D. López (PAC), es ampliamente apreciada. La tripulación de los buques oceanográficos "Jean Charcot" (Francia) y "El Puma (México), tiene nuestro particular reconocimiento. Las observaciones críticas a este trabajo fueron hechas por D. López, J. Bustillos, D. Lluch y J.L. Castro, hacia quienes hacemos patente nuestro agradecimiento. LITERATURAANTIA. N. J., C. D. MCALLISTER. T. R. PARSONS. Y, STEPHENS, y J. D. H. STRICKLAND, Limnol. Oceanogr. Further measurements of primary production using a large- volume plastic sphere.1963.166-183.8: BANSE, K, A review. J.Phycol. Rates of growth, repiration and photosynthesis of unicellular algae as related to cell size.1977.135-140.12: BARLOW, R. G., J.Exp. Mar. Biol. Ecol., The biochemical composition of phytoplankton in an upwelling region off South Africa. 1980.83-93.45: BARLOW, R. G., J. Exp. Mar. Biol, Ecol,Phytoplankton ecology in the southern Benguela current. I. Biochemical composition.1982.209-227.63: DUBOIS, M.K., A GILLES, J.K. HAMILTON, P.A. REBERS, y F. SMITH, Anal. Chem., Colorimetric method for determination of sugars and related substances.1956.350-356.28: GANF, G.C., S.J.L. STONE, R.L OLIVER, Aust. J. Mar. Freshiw. Res., Use of protein to carbohydrate ratios to analyse for nutrient deficiency in phytoplankton. 1986.183-197.37: HANDA. N., Carbohydrate metabolism in the marine diatom Skeletonema costatum. Mar. Biol.,1969.208-214. 4: HANDA. N. y H. TOMINAGA.A detailed analysis of cabohydrates in marine particulate matter. Mar. Biol., 1969.228-235. 2: HANDA, N. y K. YANAGI,Studies on water-extractable carbohydrates of the particulate matter from the northwest Pacific Ocean. Mar. Biol.,1969. 197-207.4: HAUGH, A., S. MYKLESTAD y E. SAKSHAUGH, J. Exp. Mar Biol. Ecol.,Studies on the phytoplankton ecology of the Trondheimsfjord. I. the chemical composition of phytopalnkton populations.1973. 15-26. 11: HERBLAND, A. y A. LE BOUTEILLER, Dynamique du phytoplancton et matiere organique particularire dans la zone euphotique de 1' Atantique Equatorial. Mar. Biol.1983.265-278.72: JEFFREY, S. W., y G. F. HUMPHREY, New spectrophotometric equations for determining chlorophylis a, b, cl and c2 in algal, phytoplankton and higher plants. Biochem Physiol. Pfanz, B. P.P., 1975.191-194.1967. KAWASAKI,T.,y A. KUMAGI, Bull. Jap. Soc. Fish., Foods habits of the far eastern sardine and their implication in the fluctuation pattern of the sardine stocks.1984.1657-1663.50: KENNETH, L.T., J. HIRATA, y E.A. LAWS, . J. Exp. Mar. Biol. Ecol. Light-limited growth of two strains of the marine diatom Phaeodactylum Tricornotum Bohlin: Chemical composition, carbon partitioning and the diel periodicity of physiological process.1983.209-22768: K0WALLIK W., y S. SCHALTZE,The Blue Light Syndrome Sprigher- Verlag.Enhancement of carbohydrate degradation by blue light, In: Horst Sengher (ed.).1980 344-360p. KULAINDAIVELU, G. y G. SAROJINI, The Blue Light Syndrome. Springer-Verlag.Blue Light-induced enhancement in activity of certain enzymes in heterotrophically grown cultures.of Scenedesmus obliquus. In: Horts Senger (ed.). 1980.372-380 p. LANCELOT-VAN BEVEREN, C., A statistical method to estimate the biochemical composition of phytoplankton in the soutern bight of the North Sea. Est. Coast. Mar Sci., 1980.467-478.10: LASKER,R., y J.R.SWEIFEL, Spatial Pattern in Plankton Communities Plenum Press,Growth and survival of first-feeding northem anchovy larvae (Engraulis mordax) in patches containing differents proportions of large and small prey In: J.H.Steele (ed.) 1978. 470 p. LECHUGA-DEVÉZE, C.H., Universitë Pierre et Marie Curie. Station Zoologique. Influence de l`eclairement (energie et composition spectrale) sur les compartiments proteines et glucidess d'une diatomee pelagique et du phytoplackton marin. These du Troisieme Cycle.1982.147 p. LECHUGA-DEVÉZE, C.H. y J. GOSTAN, An. Inst. Cienc. Mar y Limnol.,Essai de la methode de dilution semi-continueu pour des etudes sur la croissance du phytoplancton en culture.1986.159-166.13: LEIBY, M.M., Marine Plankton Life Cycle Strategies. CRC Press. Life history and ecology of pelagic fish eggs and larvac. In: K.A. Steindiger y L.M. Walker (eds.). 1984.121-140 pp. LLUCH-BELDA, D., F.J. MAGALLON y R.A. SCHWARTZLOSE, Large fluctuations in the sardine fishery in the Gulf of California. Possible causes. CalCOFIrep.,1986.136-143.27. LOWRY, 0.H., N.J. ROSEBROUGH, A.L FARR, y R.J. RANDAL,. Protein measurement with folin phenol reagent. J.Biol. Chem.1951265-275.193: MCALLISTER, C.D., T.r. PARSONS, y J.D.H. STRICKLAND,J.Cons. Internat. Explor. Mer.Primary productivity and fertility at station "P" in the Northeast Pacific Ocean.1960.240-259.25: MORRIS. I., Can Bull. Fish. Aquat. Sci, Photosyntetic products, physiological state and phytoplankton growth.Physological Bases of Phytoplankton Ecology. In: T. Platt (ed.) 1981.83-102210: MYERS, J., Variability of metabolism in algae. Dtsch. Bot. Ges. Nene Folge Nr.,1962.13-19.1: MYERS, J., Primary Productivity in the Sea. Plenum Press.On the algae:Thoughs about physiology and measurements of efficiency. In: P.G. Falkowsky (ed.).1980. 1-16 p. MYKLESTAD, S., J.Exp. Mar. Biol. Ecol.,Production of carbohydrates by marine planktonic diatoms. I. Comparison of nine different species in culture.1974.261-274.15: MYKLESTAD, S.,y A.HAUG,J.Exp. Mar. Biol. Ecol.,Production of carbohydrates by marine diatom Chaetoceros affinis var. wileii (Gran) Hustedt. I. Effect of the concentration of nutrients in the culture medium. 1972. 125 -136.9: PAFFENHOFER, G. A., y J. D. H. STRICKLAND, A note on the feeding of Calanus helgolandicus on detritus. Mar. Biol.,1970.97-99.5: PARSONS, T. R., K STEPHENS, y J. D. H. STRICKLAND, J. Fish. Res Bd. Can., On the chemical composition of eleven species of marine Phytoplankters.1961.1001-1016.18: SAKSHAUG, E., University of Trondheim. Trondheim Biological Station,The influence of environmetal factors on the chemical composition of cultivated and natural populations of marine phytoplankton.Norway.1978.82 p. SAKSHAUG, E., The Physiological Ecology of Phytoplankton. Problems in the methodology of studying phytoplankton. In: I.Morris (ed.). Univ. California Press.1980. 57-91 p. SEKI, H., J. SKELDING, y T.R. PARSONS, Observations on the decomposition of a marine sediment. Limnol. Oceanogr.,1968.440-447.13: VARUM, K, M., y S. MYKLESTAD, J.Exp. Mar. Biol. Ecol.,Effects of light, salinity and nutrient limitation on the production of -1,3-D-Glucan and Exo-D-Glucanase activity in Skeletonema costatum (Grev.) Cleve.1984.13-25. 83 VELDHUIS,M. J. W., W. ADMIRAAL, y F. COLIJN, Chemical and physiological changes of phytoplankton during the spring bloom, dominated by Phaeocystis poucheti (Haptophyceae): Observations in Dutch coastal waters of the North Sea. Neth J.Sea Res., 1986.49-60.20: VERLENCAR, X. N., y S. Z. QASIM, Particulate organic matter in the coastal and estuarine waters of Goa and its relationship with phytoplankton production. Est.Coast Mar.Sci,1985.235-243.21: WIEBE,W. J., y C. W. HENDRICKS, Effect of the Ocean Environment on Microbial Activities. Univ. Park. Press. Distribution of heterotrophic bacteria in a transect of the Antartic Ocean. In: R. R. Colwell y R.Y. Morita (eds.). 1974. 524-535 p.
|

