|
ESTUDIO AL MICROSCOPIO ELECTRÓNICO
DE BARRIDO DE LA ESTRUCTURA ESQUELÉTICA DE LA ESPONJA Placospongia
melobesioides GRAY
Trabajo recibido el 17 de marzo de 1988 y aceptado
para su publicación el 25 de mayo de 1988.
Femando González-Farías
Instituto de Ciencias del Mar y Limnología,
Estación "Mazatlán", Apdo. Postal 811. Mazatlán Sinaloa,
México. Contribución No. 647 del Instituto de Ciencias del Mar y
Limnología, UNAM.
Se estudió por medio de
microscopía electrónica de barrido la disposición de los
constituyentes esqueléticos en especímenes Íntegros de la
esponjaPlacospongia melobesioides Gray. Se observó
que las megascleras presentes en la esponja conforman la base estructural del
esqueleto, siendo las microscleras las que recubren los canales internos y
forman compactas placas corticales. Las únicas megascleras presentes son
tilostiles (526 x 12µm) que se proyectan en paquetes de 300µm de
diámetro del endodermo hasta la superficie. De las microscleras se
presentan tres tipos: selenásteres, esterrásteres y a las que
aquí se sugiere se llamen "microesferásteres" . Las
selenásteres (65 x 58µm) son muy abundantes y forman un ectodermo
compacto, las esterrásteres (66 x 58µm) se presentan en el
endodermo y las microesferásteres (3µm) se presentan de una
manera ordenada recubriendo canales en el endodermo. Se discute la importancia
de los estudios de microscopía electrónica de barrido, en
especímenes íntegros, para la taxonomía de
esponjas.
Palabras clave: esponjas, Porifera,
taxonomía, microscopía electrónica de barrido,
espículas, megascleras, microscleras, Placospongia
melobesioides.
The skeletal
configuration ofPlacospongia melobesioides Gray specimens
was studied with scanning electron microscopy. Disposition of spicules,
megascleres and microscleres, on integer specimens was observed. The
megascleres are tylostiles (526 x 12µm) which form tracts with a
300µm diameter oriented perpendicular to the ectoderm. The microscleres
are of three different types: the selenasters (65 x 58µm) which conform
cortical plates in the ectoderm, the sterrasters (66 x 58µm) which pack
the endoderm and the microscopic siliceous spheres named "microspherasters" by
us (3µm), which cover the internal channels of the sponge. The
importance of scanning electron microscopy studies on integer specimens for
taxonomic studies of sponges is discussed.
Keywords: sponges,
Porifera, taxonomy, scanning electron microscopy, spicules, megascleres,
microscleres, Placospongia melobesioides.
Actualmente no existe para el Phylum Porifera una clasificación taxonómica completamente establecida, esto se ha debido en parte a la falta de características morfológicas constantes utilizables para su clasificación, así como por la gran plasticidad que presentan dichos organismos en respuesta a cambios en las condiciones ambientales (Bergquist, 1978; Guido, 1985). La identificación de las esponjas se ha basado en estudios de su esqueleto, principalmente la morfología de las fibras de espongina y las espículas, así como sobre su disposición dentro del organismo (Reid, 1968). La mayoría de estos estudios se han realizado con microscopios ópticos, sobre preparaciones de espículas y fibras aisladas o bien sobre cortes histológicos. Los resultados obtenidos se ven limitados por la profundidad de campo y el poder de resolución de tales microscopios, por lo que es factible que algunas características microscópicas (p. ej. ornamentación de espículas) no se hayan observado y por tanto utilizado para la identificación y clasificación de las esponjas. Si bien actualmente se tienen algunos estudios de esponjas al microscopio electrónico de barrido (MEB), la mayoría de ellos se han efectuado sobre preparaciones de espículas y fibras aisladas (Bergquist, 1978, 1980; Núñez, 1978; Gómez, 1982; Gilbert y Hadzisce, 1984; Green y Gómez, 1986) y no sobre la estructura integra del organismo (De Vos, 1977,1978). El desarrollo de técnicas de laboratorio que permiten la observación al MEB de estructuras externas e internas (p. ej. criofractura) dé los especímenes conservando su integridad, facilita las investigaciones tendientes a la búsqueda de características microscópicas presentes en las esponjas que implementen su clasificación taxonómica. En este trabajo se realiza un análisis de la estructura esquelética de la esponjaPlacospongia melobesioidesGray observada al MEB, presentando la disposición de los diferentes constituyentes esqueléticos en especímenes íntegros. MATERIAL Y MÉTODOSLos especímenes estudiados fueron obtenidos de la Colección de Esponjas del Laboratorio de Farmacología Marina del Instituto de Ciencias del Mar y Limnologia de la UNAM, teniéndose registrados como Placospongia carinata(Bowerbank) Carter (Núñez, 1978). Los especímenes de la Colección se mantienen en alcohol etílico al 70% de éstos se disectaron pequeños fragmentos (1cm³) que se deshidrataron en serie de alcoholes de concentración creciente hasta etanol al 96% y un baño final de acetona. Los fragmentos así tratados fueron secados al punto crítico utilizando C02 como líquido de transición, y posteriormente adheridos con pintura de plata coloidal a portamuestras de aluminio. Las muestras fueron recubiertas con una capa de oro de 30 nm en una cubridora fina (JEOL mod. JFC-1100). Las observaciones se realizaron en un MEB (JEOL mod. JSM-35) a 20 KV. A modo de comparación se realizaron preparaciones de espículas aisladas, para ser observadas en un microscopio óptico. Las espículas se obtuvieron colocando por separado, en tubos de ensaye, fragmentos del endosoma y del ectosoma de la esponja. La materia orgánica de los fragmentos se digirió con una solución concentrada de hipoclorito de sodio. Las espículas que sedimentaron en los tubos fueron lavadas exhaustivamente con agua destilada. Las espículas así obtenidas se colocaron sobre portaobjetos para su observación. RESULTADOSLas esponjas estudiadas son masivas y presentan ramificaciones de 3.1 a 6.5 cm de altura con un grosor de 0.7 a 1.0 cm. La coloración de los especímenes fijados es café claro. Su consistencia es dura, no compresible ni flexible. La superficie es relativamente tersa y presenta un armazón de placas corticales que se encuentran separadas entre sí por una red de acanaladuras. Las placas corticales son de forma poligonal irregular con tamaños entre 1 y 20 mm en su parte más ancha. Las acanaladuras tienen un ancho aproximado de 1 mm y en ellas se presentan poros y ósculos (Fig. 1). El ectosoma consiste en una densa amalgama de selenásteres unidas firmemente entre sí por material orgánico (Figs. 2, 6). El endosoma es microcavernoso y contiene paquetes de tilostiles que se proyectan tangencialmente desde el endosoma hasta la superficie (Fig. 2). Dichos paquetes pueden medir varios milímetros de largo, con un grosor aproximado de 300 um en su parte más ancha. Los ápices de los tilostiles, dentro de los paquetes, están orientados hacia la periferia. En el endosoma se presentan gran cantidad de selenásteres (Fig. 3) y esterrásteres (probablemente son selenásteres juveniles) de diversos tamaños (Fig. 4). Se presentan también en el endosoma lo que se ha reportado como microscópicas esferas de sílice (De Laubenfels, 1954; Bergquist, 1965), que recubren los canales internos de la esponja (Figs. 6-9). Estas esferas microscópicas se han denominado en este trabajo como microesferásteres, debido a que son euásteres con rayos cortos y un centro grueso cuyo diámetro excede el largo de los rayos. El esqueleto está compuesto básicamente por espículas, unidas firmemente entre sí por material orgánico. Las únicas megascleras presentes son tilostiles, teniéndose varios tipos de microscleras: selenásteres, esterrásteres y microesferásteres. Las dimensiones promedio de las espículas son las siguientes: tilostiles de 526 x 12 um (Figs. 2, 11), selenásteres de 65 x 58 nm (Figs. 2, 3, 6, 11), esterrásteres de 66 x 58 um (Fig. 4) y microesferásteres de 3 um (Figs. 6-9.) 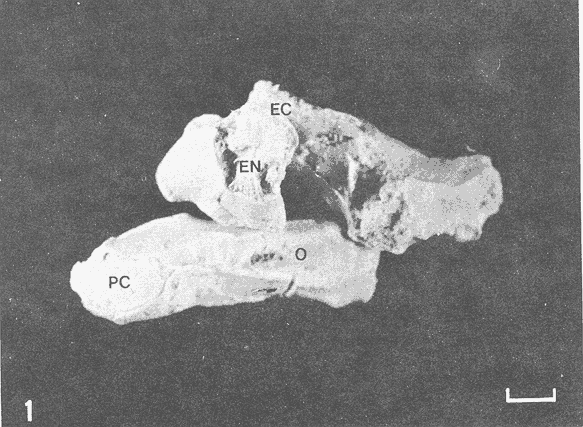 Figura 1. Ejemplares de Placospongia melobesioides. PC = placas corticales, EC = ectodermo, o, EN endodermo, 0 = ósculos. Escala 1 cm. 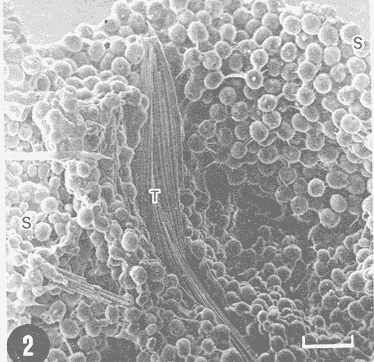 Figura 2. Observación al MEB del ectosoma de Placospongia melobesioides, nótense las uniones de materia orgánica entre las selenásteres. T = tilostiles, S = selenásteres. Escala 250 ,µm. 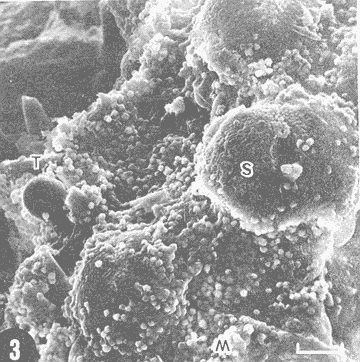 Figura 3. Observación al MEB del endosoma de Placospongia melobesioides, T = tilostiles, S = selenásteres, M = microesferásteres. Escala 20µm. Se observó que las microscleras consideradas como esterrásteres (probablemente selenásteres juveniles) son la base para la formación de las selenásteres, éstas últimas aparentemente se generan cuando sobre las espinas de las esterrásteres se forman trabéculas de materia orgánica (Figs. 4,5) sobre las cuales se deposita el sílice siguiendo un patrón pentarradiado. Este patrón pentarradiado es característico de las selenásteres maduras (Fig. 12), el cual se mantiene a pesar de que las espículas se encuentren en estados avanzados de erosión (Fig.. 13). Las microesferásteres son esféricas, ornamentadas con aproximadamente 120 espinas cónicas de 0.4 um de altura promedio (Fig. 9). Se presentaron en preparaciones de espículas aisladas algunas microscleras de forma similar a espirásteres pero de tamaño mucho menor (7 um), que aparentemente son dos microesferásteres unidas (Fig. 10).  Figura 4. Esterrásteres (selenásteres juveniles) de Placospongia melobesoides T = tilostiles, E = esterrásteres. Escala 20 µm. 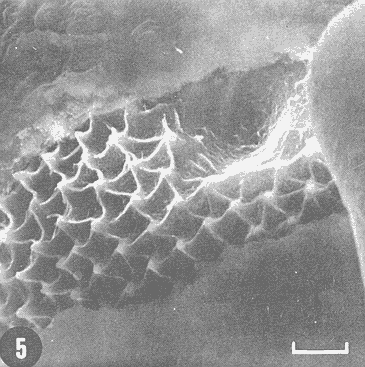 Figura 5. Ampliación de la parte central de la figura 4, obsérvese la formación, en un patrón pentarradiado, de trabéculas de materia orgánica sobre las espinas de las esterrásteres. Escala 5 p m. 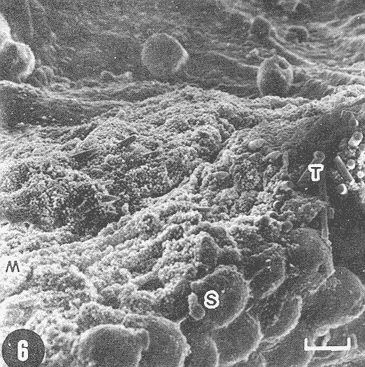 Figura 6. Observación al MEB del endosoma de Placospongia Melobesioides. Se presentan selenásteres (S) y tilostiles (T) que soportan a un canal interno de la esponja, al que recubren de una manera ordenada las microesferásteres (M). Escala 50µm. 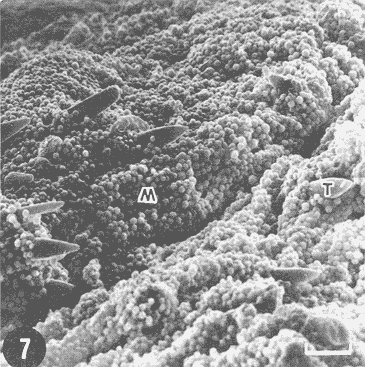 Figura 7. Ampliación de la parte central de la figura 6. Escala 20 µm. 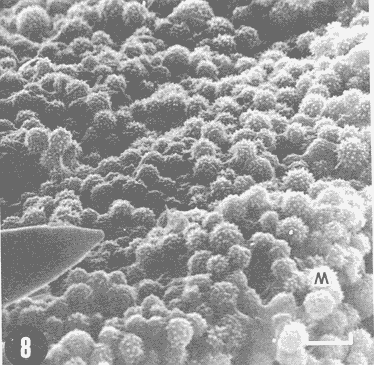 Figura 8. Ampliación de la parte central de la figura 7, nótese que las microesferásteres se encuentran unidas entre si por medio de filamentos orgánicos. Escala 5 µm. 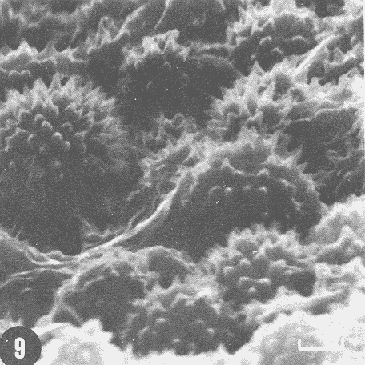 Figura 9. Ampliación de la esquina superior izquierda de la figura 8, obsérvese la homogeneidad de las espinas de las microesferásteres, tanto en su disposición como en su tamaño. Escala 1 µm. 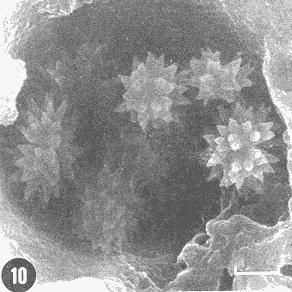 Figura 10. Observación al MEB de una preparación de espículas aisladas de Placospongia melobesioides, se presentan unas microseleras con forma similar a espirásteres. Escala 1 µm. 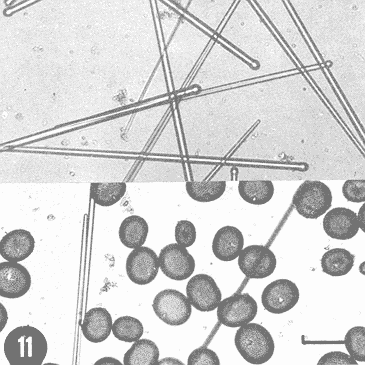 Figura 11. Observación al microscopio óptico de una preparación de espículas aisladas de Placospongia melobesioides, se presentan tilostiles y selenásteres, las microesferásteres se observan como pequeños puntos en donde se difracta la luz. Escala 75µm.  Figura 12. Observación al MEB de la ornamentación que poseen las selenásteres de Placospongia melobesioides, nótese el patrón pentarradiado de las trabéculas. Escala 1 µm. 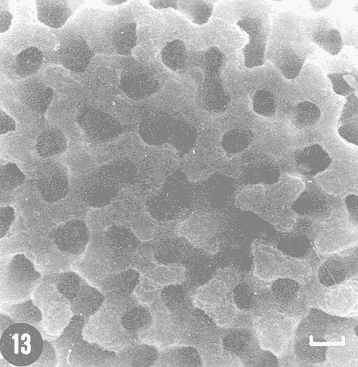 Figura 13. Observación al MEB de la superficie erosionada de una selenáster de Placospongia melobesioides, nótese que a pesar de la erosión se mantiene el patrón pentarradiado de los restos de trabéculas. Escala 1 µm. DISCUSIÓNEn general se puede decir que las espículas han sido la base para la clasificación de las esponjas, algunos autores han normado sus criterios de clasificación en función de las megascleras y otros únicamente considerando a las microscleras (véase Reid, 1968). Las meglascleras son de gran ayuda para una preclasificación indicando en algunos casos el orden o la familia, por su parte las microscleras pueden caracterizar géneros y en algunos casos especies (Bergquist, 1978). Lo anterior se confirma para los especímenes analizados en este trabajo, pues la presencia de selenásteres (Figs. 2,3,6) es indicativa de la familia Placospongiidae (Rotzler y Macintyre, 1978), y la presencia de pequeñas esferas síliceas aquí denominadas microesferásteres (Figs. 8, 9) es característica deP. melobesioides (De Laubenfels, 1954). El hecho de que Núñez (1978) haya considerado a los especímenes estudiados en este trabajo como P. carinata y no como P. melobesioides se debió por una parte a la similitud de los componentes esqueléticos entre ambas especies (Tabla I), y por la otra a que no logró observar con el microscopio óptico las microesferásteres (Figs. 6-9) que son características deP. melobesioides. Cabe mencionar que Núñez analizó los componentes esqueléticos de las esponjas por medio de preparaciones de espículas aisladas, y es posible que las microesferásteres debido a su tamaño hayan permanecido en suspensión, eliminándolas a través de la serie de lavados. 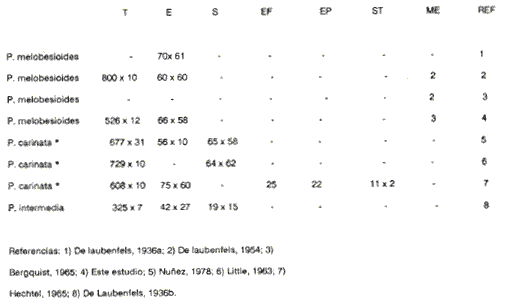 TABLA 1 COMPARACIÓN ENTRE LOS TAMAÑOS PROMEDIO (µm) DE LAS ESPÍCULAS DE DIVERSAS ESPECIES DE Placospongia. T = TILOSTILES, E = ESTERRÁSTERES, S = SELENÁSTERES ,EF = ESFERÁSTERES, EP = ESPIRÁSTERES , ST=MICROESTRONGILES, Y ME = MICROESFERÁSTERES. * = VALOR PROMEDIO CALCULADOS APARTIR DE LA REFERENCIA (REF) Al hacer las preparaciones de espículas aisladas con la técnica convencional se observó que si las muestras se lavan exhaustivamente se pierde una gran cantidad de microesferásteres, y si se lavan unas cuantas veces para no perderlas quedan remanentes de materia orgánica de las esponjas que dificultan su observación en el microscopio óptico. Es evidente que una de las grandes ventajas de los estudios de esponjas integras al MEB, a diferencia de los análisis esqueléticos sobre preparaciones de espículas aisladas, es que con éstos se permite constatar la presencia, la morfología y la posición de las espículas en los organismos (Figs. 2, 6-9), además con los estudios al MEB se elimina la posibilidad de tomar en cuenta para la identificación espículas contaminantes. Existen casos en los que se han utilizado espículas foráneas para la identificación de esponjas, e incluso se ha confundido a espículas de esponjas con organismos (Inoue e Iwasaki, 1975). En las observaciones hechas al microscopio óptico de las espículas aisladas (Fig. 11), las microesferásteres se presentan como puntos de difracción del haz luminoso confundiéndose con restos de la materia orgánica de la esponja. El fenómeno de difracción se presenta de igual forma para las selenásteres y los tilostiles (Fig. 11) dificultando su medición. Para algunos géneros de esponjas (p. ej. Haliclona) la diferencia en tamaño de un mismo tipo de espículas representa especies distintas, y considerando que la difracción de la luz en los bordes de las espículas origina error en su medición, es de gran valor taxonómico la exactitud de las mediciones de espículas que se tienen con el MEB. A excepción de las microesferásteres las observaciones realizadas sobre la presencia y disposición de las espículas tanto en el ectosoma como en el endosoma concuerdan en general con las reportadas por Núñez (1978) para los mismos ejemplares. Para P. carinata se ha reportado la presencia de espirásteres, esferásteres y microestrongiles (Little, 1963; Hechtel, 1965), que no fueron observadas en los especímenes analizados, lo que confirma que la especie estudiada es P. melobesioides. Se ha reportado que las megascleras constituyen el soporte esquelético principal y que su disposición es la responsable de la forma de la esponja. De las microscleras se ha dicho que no poseen una organización definida ni una función específica, encontrándose desordenadas en el mesohilo o entre las megascleras (Bergquist, 1978), lo anterior no concuerda totalmente con las observaciones realizadas paraP. melobesioides, pues si bien las megascleras dan soporte a la esponja y se presentan en una forma organizada, como paquetes de tilostiles (Fig. 2), también las microscleras confieren soporte a la estructura esquelética dada su alta compactación. Además en este caso las microscleras presentan una organización definida siendo las selenásteres responsables de la estructuración del ectodermo y las microesferásteres de los canales internos de la esponja (Figs. 6,7). En trabajos anteriores se ha reportado que las selenásteres se origínan a partir de una microsclera monoaxial, cuyo crecimiento es por deposición de capas concéntricas de sílice (Rützler y Macintyre, 1978). En este trabajo si bien no se observaron los pasos intermedios en el crecimiento de las selenásteres, si se observó que el paso final en la generación de la mismas, es la formación de trabéculas de materia orgánica entre las espinas de las esterrásteres (que realmente son selenásteres juveniles), sobre las que posteriormente se deposita el sílice siguiendo un inconfundible patrón pentarradiado (Figs. 4, 5, 12). Este patrón pentarradiado de los selenásteres se mantiene a pesar de la erosión de las mismas (Fig. 13), que puede ser causada por defectos fisiológicos de la esponja o por ciertas condiciones ambientales (Hartman y Goreau, 1970; Rützler y Macintyre, 1978). Con las observaciones anteriores sobre la formación de las selenásteres se considera necesario el continuar este tipo de estudios con diversas especies de Placospongia, pues probablemente lo que se ha reportado como estarrásteres (Tabla I) son selenásteres juveniles. Algunas descripciones de especies dePlacospongia enlistan a las espirásteres como parte de su espiculación, pero se discute que las microscleras así designadas sean posiblemente selenásteres en sus estadíos iniciales ( De Laubenfels, 1954; Hechtel, 1965). En este estudio no se observaron espirásteres, aunque sí se presentaron pequeñas microscleras cuya forma tiende más hacia las espirásteres que hacia las microesferásteres (Fig. 10). Es posible que estas "espirásteres" sean variaciones de las microesferásteres, pues se sabe que un mismo tipo de espicula puede presentar variaciones en el tamaño y la forma en función de cambios en las condiciones ambientales (Pe, 1973; Rützler y Macintyre, 1978). Expuesto lo anterior se comprende que los estudios al MEB de especímenes íntegros son de gran importancia tanto para la taxonomía y sistemática de esponjas, como para entender procesos tales como el origen y crecimiento de las espículas. ConclusionesLos estudios al MEB proporcionan información confiable respecto a la presencia, forma, tamaño distribución de las espículas en las esponjas. Las pequeñas esferas silíceas reportadas por De Laubenfels (1954) como característica distintiva deP. melobesioides son microscleras del tipo euaster, nombrándolas en este trabajo como microesferásteres. Las microscleras se presentan en forma organizada dentro de la esponja, teniendo gran importancia en la estructura esquelética. Las microesferásteres tienen una función relevante al recubrir los canales interiores de la esponja. Las selenásteres provienen de las esterrásteres (selenásteres juveniles), sobre las cuales se forman trabéculas de espina a espina, en un patrón pentarradiado, en las que posteriormente se deposita el sílice. Existe erosión y disolución de las espículas dentro de las esponjas vivas, fenómeno que reviste gran importancia para el ciclo del silicio. AgradecimientosSe agradece la colaboración de M. Hernández-Garza y de P. Gómez-López para la realización de este trabajo. LITERATURABERGQUIST, P.R.,Sponges of the Palau Islands. Pac. Sci.,1965.186.19: BERGQUIST, P.R., Sponges. Hutchinson and Company Publishers.Gran Bretaña.1978. 268 p. BERGQUIST, P.R., A revision of the supraspecific classification of the orders Dictyoceratida, Dendroceratida, and Verongida (class Demospongiae).New Zealand Jour. Zool., Z.:1980.443-503. DE LAUBENFELS, M. W., ., Papers from Tortugas LabA discussion of the sponge fauna of the Dry Tortugas in particular and the West Indies in general, with material for a revision of the families and orders of the Porifera.1936a.30. 225 p. DE LAUBENFELS, M. W. de, ,A comparison of the shallow water sponges near the Pacific end of the Panama Canal, with those at the Caribbean end. Proc U.S. Nat. Mus.1936b.454-455. 83(2993): DE LAUBENFELS, M. W., Oregon State Monogr. Zool, No. 7-1.The sponges of the West-Central Pacific.1954. DE VOS, L, Arch. Biol. (Bruxelles), Etude au microscope électronique a balayage des cellules de l'éponge Ephydatia fluviatillis. 1977.1-4.88: DE VOS, L . Colloques Internat. C.N.R.S., No. 291:Structure tridimensionnelle de l' eponge d' eau douce Ephydatia fluviatillis.1978.159-164. GILBERT, J.J. y S. HADZISCE, Arch. Hydrobiol.,Taxonomic notes on the shallow-water endemic sponges of Lake Ohrid, Yugoslavia, with a description of two new species and a redescription of Spongilla stankovici. 1984.331-339.99: GÓMEZ, P., Tesis Profesional, facultad de Ciencias, UNAM. Estudio sistemático de las esponjas marinas de Puerto morelos, Quintana Roo. México.1982.111p. GREEN, G y P. GÓMEZ, An. Inst. Cien del Mar. y Limnol.Estudio taxonómico de las esponjas de la Bahía de Mazatlán, Sínaloa, México.Univ. Nal Autón. México,1986.273-300.13 (3): GUIDO,S.C., Tesis Profesional, Escuela de Biologia, Aspectos ecológicos de la comunidad de esponjas de la Bahía de Mazatlán, Sinaloa.Universidad Autónoma de Guadalajara.1985. 103 p. HARTMAN, W. D. y T. F. GOREAU, The bioloy of The Porifera Jamaican coraline sponges: their morphology, ecology and fossil relatives. In: Fry, W.G. (Ed. ) Academic Press. Londres:1970.205-243 HECHTEL G.J., Bull. Peabody Museum Nat. Hist., A systematic study of the demospongia of Port Royal, Jamaica.1965.62-64. 20: INOUE, M. y Y. IWASAKI, A problematic micro-organism similar to the sterraster of sponges. Proc. Japan Acad, 1975.273-278.51: LITTLE, F.J., Tulane Studies in Zoology, The sponge fauna of the St. Georges Sound, Apalachee Bay and Panama City regions of the Florida Gulf coast.1963.56-57. 11 (2): NUÑEZ, E., Tesis profesional, Facultad de Ciencias, UNAM. Estudio taxonómico de las esponjas de la Laguna de Términos, Campeche, México.1978. 96 p. PÉ, J., Arch Biol. (Bruxelles),Etude quantitative de la régulation du squelette chez une éponge d'eau douce.1973. 147- 173.84: REID, R.E.H., Microscleres in demosponge classification, The University of Kansas Paleontological Contributions Paper 35. 1968. 37 p. RÜTZLER, K. y I.G. MACINTYRE, Siliceous sponge spicules in coral reef sediments. Mar. Biol, 49: 1978.147-159.
|

