|
CONTRIBUCIONES AL ESTUDIO
LIMNOBOTÁNICO DE LA ZONA LITORAL DE SEIS LAGOS CRÁTER DEL ESTADO
DE PUEBLA
Trabajo recibido el 15 de enero de 1988 y aceptado para su
publicación el 14 de abril de 1988.
Pedro Ramírez-García
Instituto de
Biología, Universidad Nacional Autónoma de
México.
Felipe Vázquez-Gutiérrez
Instituto de Ciencias del
Mar y Limnología, Universidad Nacional Autónoma de México.
Contribución No. 640 del Instituto de Ciencias del Mar y
Limnología, UNAM.
En seis lagos
cráter del estado de Puebla, México, se hace un estudio de las
variables físico-químicas del agua y del sedimento y se analizan
las relaciones que tienen estas variables con la composición floristica
de hidrófitas y con la producción de biomasa de las especies
más abundantes (Limnología-botánica). Los datos de
concentración de los iones más abundantes se usaron para calcular
la densidad del agua en estos lagos a partir del volumen equivalente aparente.
El estado de los iones más abundantes en los lagos ha sido analizado
usando el modelo del par iónico para las interacciones iónicas.
Se ha comparado la composición iónica del agua de los lagos
cráter, con la del agua de mar y con la de los lagos Zempoala
(México) y Tangañica (Africa). Los iones más abundantes se
analizaron mediante la comparación de la especiación de los
solutos iónicos, obteniéndose que el carbonato de magnesio es el
más abundante en todos los lagos. Se uso el análisis de
clasificación para conocer la interrelación que guardan estos
lagos entre si, utilizando las variables físico-químicas del agua
y del sedimento, y la producción de biomasa, así como la
composición floristica de hidrófitas de cada lago. Los
análisis forman tres grupos de dos lagos cada uno: 1) Alchichica y
Atexca, 2) La Preciosa y Quechulac y 3) Aljojuca y Tecuitlapa. A través
del análisis de correlación de Pearson se buscó establecer
los patrones de interrelación entre las variables
físico-químicas y la producción de biomasa. Se
encontró, en la mayoría de los lagos, que son los carbonatos el
eje de las mayores correlaciones con las demás variables, y que la
producción de biomasa se ve afectada, principalmente, por las variables
de sedimento como la textura.
A
study of six volcanic lakes in Puebla, México involving analysis of the
physico-chemical variables and their effects on the hydrophytes compositions
and biomass production in each lakes was carried out. Information on the
concentration of the most numeros ions was used to calculate the water density.
Using the model of the ionic pairs, the states of the most numerous ions were
analysed for ionic interaction. The ionic composition of the water of this
lakes were compared with sea water and lake Zempoala (México) and the
Tanganyika (Africa). The most abundant ions were analyzed by way of the ionic
solute speciation, it was determined that magnesium carbonate is the more
abundant ions in each of the lakes. Cluster analysis was used to understand the
relationships within the lakes, using the physico-chemical variables of the
water and sediments and biomass production as well as compositions of the
hydrophytes of each lake. Three groups consisting of the two lakes each formed
the analysis: 1) alchichica and atexcac, 2) La Preciosa and Quechulac and 3)
aljojuca and Tecuitlapa. Using Pearson correlations an attempt was made to
establish the relationships between the physico-chemical variables and the
biomass productions. It was found that in the maiority of the lakes the hinging
point of the maior correlations with other variables was the carbonates, and
the variables the sediments texture afected the biomass
productions.
La existencia y formación de los lagos depende de una gran variedad de procesos que pueden ser divididos de acuerdo a: la naturaleza general del cuerpo de agua y al proceso responsable de su formación. De acuerdo a esto último algunos autores como Welch (1952), Wetzel (1975), Hutchison (1975a) y Reid y Wood (1976), propusieron una clasificación conforme a la génesis de los mismos. Los lagos donde se realizó este trabajo pertenecen al grupo de los formados por actividad volcánica, con base en la clasificación de Hutchinson (1975a). A nivel mundial se han reportado escasamente en la literatura varias clases de lagos asociados con actividad volcánica, como son los lagos de Nemi y averno en Italia; Pulvermaar en alemania; Viti, Graenavatn y Geststdvatn en Islandia; Tikitapu en Nueva Zelanda (Hutchinson, 1975a); El lago Bishoftu en africa (Baxter y Wood, 1965); Bunyonyi en Uganda (Denny, 1972a); Debunidsha en el oeste de Cameroon (Green et al., 1974); los lagos cráter de la isla Miyaki en Islandia (Yoshimura, 1938) y los lagos cráter en el oeste de Victoria (Timms, 1975); algunos en América Central (Juday, 1915; Deevey, 1957 y armitage, 1958); Butte en California y el lago Cráter en Oregon (Hutchinson, 1975a). Los estudios limnológicos en el país, a la fecha, han sido principalmente enfocados desde un punto de vista geológico, y es escaso el conocimiento biológico y fisico-químico, que se tiene de los cuerpos de agua continentales. En los ecosistemas acuáticos el estudio de las hidrófitas o macrófitas, es importante por que en la zona litoral de los lagos o lagunas, esta vegetación funciona como trampa o cedazo para compuestos orgánicos disueltos, así como para nutrimentos inorgánicos (Wetzel y Allen, 1970; Wetzel y Hough, 1973). Las hidrófitas contribuyen en gran medida al equilibrio del ambiente acuático, puesto que con su enraizamiento fijan el sedimento de los litorales evitando así la erosión y el asolvamiento del lago. Además actúan como una bomba para el flujo de nutrimentos en un cuerpo de agua, tomándolos del sedimento para su aprovechamiento y liberándolos con la muerte y descomposición de los tejidos vegetales, formándose con ello materia orgánica (Wetzel, -1975). Harman (1974), en un estudio sobre la fisiología y fisonomía de hidrófitas, menciona como el zoobentos y el zoomeroplancton sufren drásticas fluctuaciones asociadas con los cambios en la estructura de las comunidades de hidrófitas, ya que ofrecen una gran diversidad de nichos ecológicos para ser ocupados como protección, anidación y alimentación por otros organismos. OBJETIVOSEn el presente estudio se analiza la relación de la flora y la vegetación acuática con los parámetros físico-químicos del agua y del sedimento de los lagos cráter alchichica, Quechulac, La Preciosa, atexcac, aljojuca y Tecuitlapa en el Estado de Puebla, a través de los siguientes objetivos: 1) Establecer las variaciones de las características físicoquímicas de la línea de margen, mediante la aplicación de modelos. 2) Determinar las semejanzas que existen entre los lagos, con base en la composición físico-química del agua y del sedimento y con base en la composición floristica y producción de biomasa de la zona litoral, así como determinar las relaciones que existen entre las diferentes variables estudiadas. ANTECEDENTESAlgunos trabajos reportados hasta la fecha en lagos cráter son: de tipo limnológico, como los de Juday (1915), Yoshimura (1938), Utterbak (1942), Williams (1942), armitage (1959), Deevey (1957) y Baxter y Wood (1965); de tipo geológico como el de Melac (1978) y de tipo biológico como los de Hasler (1938), Denny (1972b), Green et al.(1974) y armitage y Fassett (1971). Existen pocos estudios reportados para los lagos cráter de Puebla, como el trabajo geológico de Ordóñez (1906), donde describe el origen y constitución de cada uno de ellos; el de Taylor (1943), que describe una especie nueva de Salamandra; el de De Buen (1945), en el que describe una nueva especie de Aterinido y el de Alvarez (1950), sobre la ictiofauna de los seis lagos. Recientemente están los trabajos de Fuentes (1972), en el que describe las diferentes regiones del estado de Puebla; el de Gasca (1982), sobre la génesis de los lagos; el de Arredondo et al. (1983), sobre la batimetría morfometría de los seis lagos, el de Arredondo et al.(1984), sobre el fitoplancton del lago Alchichica y por último el de Ramírez-García y Novelo (1984), sobre la vegetación acuática de los seis lagos. ZONA DE ESTUDIOLos lagos donde se realizó este trabajo se encuentran localizados en la Cuenca Oriental, situada entre los Estados de Puebla, Tlaxcala y Veracruz en las coordenadas 97º 09’ y 98º 03’ de longitud oeste y a los 18º 48’ y 19º 43’ de latitud norte (Gasca, 1982). Los dos grandes llanos que forman parte de esta cuenca son de origen lacustre, llamados Llanos de San Andrés y Llanos de San Juan, que se encuentran al noroeste de la meseta poblana entre los poblados de San Salvador el Seco y Perote (Fig. 1). En los Llanos de San Andrés se encuentran los lagos Aljojuca y Tecuitlapa y en los Llanos de San Juan los lagos Atexcac, La Preciosa, Quechulac y Alchichica. El clima característico de estos Llanos va de templado seco, registrado en la estación meteorológica de alchichica, con temperatura promedio anual de 12.8 grados y precipitación anual de 425 mm, clima tipo B S1 W"k’(i’)g, a templado húmedo en la estación de Tlalchichuca con un temperatura promedio anual de 14.4 grados y precipitación anual de 656 mm, clima tipo C (w)big (Ramírez-García y Novelo, 1984). Los lagos se encuentran entre los 2345 y los 2510 m de altitud. Su profundidad varia de los 2.5 m en el lago Tecuitlapa hasta los 64 m en el lago alchichica, con áreas superficiales que van del los 260 m² a los 1810 m² respectivamente (Tabla 1). Estos lagos tipo Maars, se originaron de explosiones volcánicas que probablemente ocurrieron entre el terciario medio y el cuaternario superior. Las explosiones ocasionaron fallas y rupturas en el manto freático de la región que con el tiempo llenaron los cráteres de agua (Fuentes, 1972; Gasca, 1982; Arredondo et al., 1983). 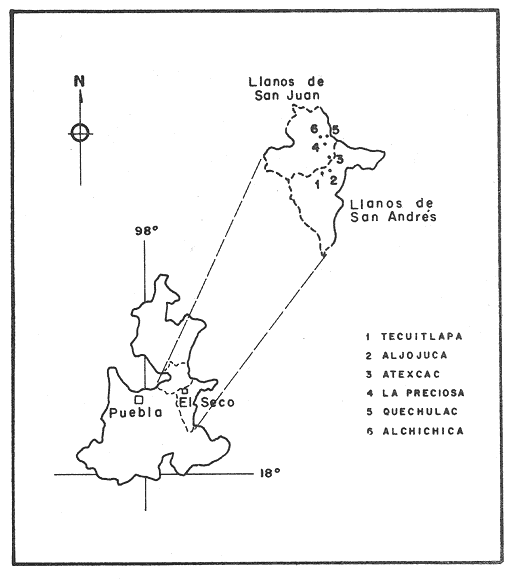 Figura. 1. Localización de los lagos Cráter del Estado de Puebla - ( tomado de Ramírez-García y Novelo, 1984 ).  TABLA I CARACTERÍSTICAS MORFOMÉTRICAS GENERALES DE LOS LAGOS CRATER DE PUEBLA METODOLOGÍASe hicieron doce visitas con duración de seis días cada una, durante doce meses, donde se colectó material botánico. Además se seleccionaron sitios de muestreo que reunieran ciertas condiciones como mayor representación de la vegetación acuática y poca perturbación de la misma. Evitando así los lugares de pesca, pastoreo, cultivo y recreación que se realizan en algunas playas de los lagos. En estos lugares se cosechó la biomasa bimestralmente, utilizando un cuadro de 25 cm por lado. En el caso de hidrófitas emergentes la cosecha se hizo a nivel de la zona de mareas del lago y para las hidrófitas sumergidas la cosecha se efectuó entre 4 y 5 m de profundidad utilizando para esto equipo de buceo SCUBA (Ramírez-García y Novelo, 1984). Con una barra de aluminio marcada se tomaron registros de la variación del nivel del agua, y con el disco de Seccki se midió la transparencia. A nivel de la zona litoral de los lagos, se tomaron muestras de agua cada dos meses y en el laboratorio se determinó la concentración de los siguientes iones: cloruros (Cl-), carbonatos (CO²-3), sulfatos (S0²-4) , bicarbonatos (HCO-3), sodio (Na+), calcio (Ca²+), magnesio (Mg²+), potasio (K+) y pH. También se tomaron muestras de sedimento en cada una de las estaciones del año y para cada una de las poblaciones de hidrófitas. A las muestras de sedimentos se les aplicaron los siguientes análisis: textura (arena y limo), pH, materia orgánica (M.0), nitrógeno total (Nt), fósforo asimilable (P) y potasio intercambiable (K). Los métodos físico-químicos aplicados a las muestras de agua y de sedimento fueron los siguientes: el pH in situ, se midió utilizando un potenciómetro marca Corning mod. 10, los carbonatos y bícarbonatos por titulación con ácido sulfúrico método de Reitemeir (1943); los cloruros por titulación con nitrato de plata y con cromato de potasio al 5% como indicador, método de Reitemeir (1943); el calcio y el magnesio por titulación con la sal disódica del ácido etilen-diamino-tetracético (Dihel, 1950); los sulfatos por determinación turbidimétrica, método de Sheen (1935); y el sodio y potasio por flamometría, método de Barnes (1945) y Wander (1942), respectivamente. Textura por el método del hidrómetro de Bouyoucos (1963); el pH del sedimento se determinó a través de la suspensión con agua destilada en relación 1:5 y utilizando un potenciómetro marca Corning mod. 10; el porciento de materia orgánica, por combustión húmeda según el método de Walkley (1947); el fósforo asimilable por el método de Bray y Kurtz (1945); el nitrógeno total por el método de Kjeldhal (Chapman y Pratt, 1973) y finalmente el potasio intercambiable por el método de lavado y centrifugado con acetato de amonio y la determinación en el extracto por flamometría (Jackson, 1964). RESULTADOSLos resultados fueron analizados utilizando tres técnicas; haciendo uso de modelos físico-químicos, mediante el análisis de clasificación y mediante el análisis de correlación de Pearson. En la tabla 2, se enlistan los valores promedio y las desviaciones estandar de las variables físico-químicas estudiadas, tanto del agua como del sedimento, en esta tabla se ha hecho una modificación por balance de equivalentes al ión sodio, lo cual modifica un poco los valores de salinidad, calculada por la suma de aniones y cationes. Los lagos Alchichica y atexcac en general son los que presentan los valores más altos de Cl-, HCO-3, Na+ y Mg²+, y de salinidad total 14.033 y 13.590 g/Kg respectivamente. En contraposición los más bajos de salinidad se encontraron en los lagos Quechulac (1.252 g/Kg) y Tecuitlapa (1.452 g/Kg), con esto se aprecia una clara diferenciación de los lagos. En la figura 2 se presenta una comparación de los porcentajes de concentración de los iones del agua de mar (36 g/Kg) y del agua de los lagos estudiados. En general todos los lagos presentan una alta concentración de cloruros y de sodio, las más altas en Alchichica con 36.23% y 39.47% respectivamente, y en Atexcac con 42.08% y 39.66% respectivamente. Las concentraciones más bajas, de estos iones, se dieron en el lago Tecuitlapa con 8.63% y 29.95% respectivamente. Se puede observar como la composición iónica del agua de los lagos Atexcac y Alchichica se asemeja a la del agua de mar, principalmente debido a la concentración de cloruros y de sodio. En contraposición, los porcentajes de concentración de bicarbonatos y de magnesio fueron bajos en los lagos Atexcac y Alchichica, pero altos en los demás lagos, como en Quechulac con 21.64% y 19.88%, respectivamente y en Tecuitlapa con 30.71% y 11.42% respectivamente. (Fig.2). Las concentraciónes del ión sulfato sólo fueron altas en los lagos La Preciosa, con 12.99%, y en Aljojuca con 10.76%. En los demás lagos la concentración, más baja, se encuentra en el intervalo de 0.51% a 4.97% en Tecuitlapa y Quechulac respectivamente. Los porcentajes de concentración del potasio fueron homogéneos en todos los lagos y van de 6.85%, el más alto para el lago Tecuitlapa, a 1.4% en el lago Atexcac. Como una comparación de la composición química del agua de estos lagos, se analizaron algunas características físicoquímicas del agua de los lagos Zempoala (México) y Tangañica (Africa). Estos lagos no son de origen volcánico, lo cual proporciona una composición química diferente respecto a los lagos cráter. Sin embargo esta diferencia permite apreciar más las particularidades de los lagos estudiados.  Figura 2. Comparación en porciento de los valores de concentración promedio de aniones y cationes de los seis lagos y del agua de mar a 36 g/kg. Cloruro, carbonato, sulfato, bicarbonato, sodio, magnesio, potasio y calcio. La textura de los sedimentos en estos lagos cráter se puede clasificar como arenosa, con el valor promedio más alto en Tecuitlapa (89.7%) y el más bajo en La Preciosa (64.9%) (Tabla 2). Los valores promedio de pH del sedimento muestran diferencias en los lagos, pH neutro en La Preciosa y Quechulac con 6.9, ligeramente alcalino en Alchichica y Atexcac con 7.3 y alcalino en Aljojuca y Tecuitlapa con 8.2 (Tabla 2). El porciento de materia orgánica del sedimento de los lagos, en general se considera bajo, con el valor mayor de 5.6% en La Preciosa y el menor de 1.5% en Tecuitlapa. Como consecuencia de un bajo porciento de materia orgánica, el porciento de nitrógeno total también lo fue, el valor más alto de estos corresponde al mismo lago con el valor más alto en materia orgánica, y el valor más bajo corresponde al lago con el valor más bajo en materia orgánica, esto se observo en La Preciosa con 0.4% y en Tecuitlapa con 0.14% de nitrógeno total (Tabla 2). La concentración de fósforo asimilable en los sedimentos de los lagos varía desde valores bajos de 0.23 ppm (partes por mil) en Alchichica, hasta altos de 17.3 ppm en Tecuitlapa (Tabla 2). La concentración de potasio intercambiable en el sedimento- de todos los lagos se considera alta, de un valor de 1.1 meq/100gr (miliequivalentes por 100 gramos de suelo), en La Preciosa y Aljojuca a uno más alto de 1.5 en Tecuitlapa (Tabla 2). La producción de biomasa de hidrófitas de los lagos se considera baja como en Alchichica con 0.303 kg/m² y en Aljojuca con 2.767 kg/m², y alta en La Preciosa con 10.04 k g/m². 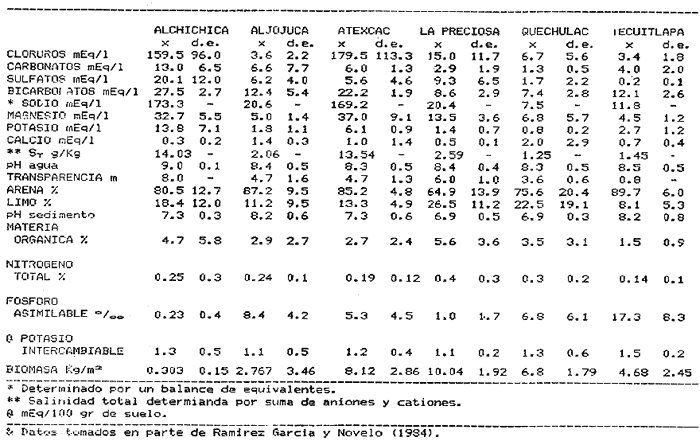 TABLA 2 PROMEDIO (X) Y DESVIACIÓN ESTANDAR (d. e.) DE LAS VARIABLES ANALIZADAS PARA LOS LAGOS CRATER DE PUEBLA La biomasa de estos lagos esta en función de su diversidad, de la abundancia de las poblaciones y de la permanencia de las mismas ya que muchas de ellas son ramoneadas por el ganado. En la tabla 3 se da la lista floristica de las especies de hidrófitas de estos lagos y se marca con un asterisco las especies en las que se estimó la producción de biomasa. En la figura 3 se esquematizan los valores de cosecha de biomasa durante los meses de trabajo. Se puede observar en esta figura que los meses de mayor cosecha para todos los lagos fueron en forma general, octubre y febrero, con dos grandes picos en los lagos Tecuitlapa y Aljojuca. MODELO DEL PAR IÓNICOLa fracción equivalente del agua de los lagos cráter se compara con la de los lagos Zempoala y Tangañica en la tabla 4. La concentración de los cationes, en los lagos cráter, sigue el orden de: Na + > Mg²+ > Ca²+y con respecto a los aniones, para los lagos Alchichica, Atexcac y La Preciosa, por lo general siguen el orden de : Cl-> HCO-3 > CO²-3>SO²-4y para los lagos Quechulac, Aljojuca Tecuitlapa el orden es : HCO-3 > Cl->CO²-3>SO²-4.  TLABLA 3 COMPOCICIÓN FLORÍSTICA D HIDRÓFITAS DE LOS LAGOS CRÁTER DE PUEBLA 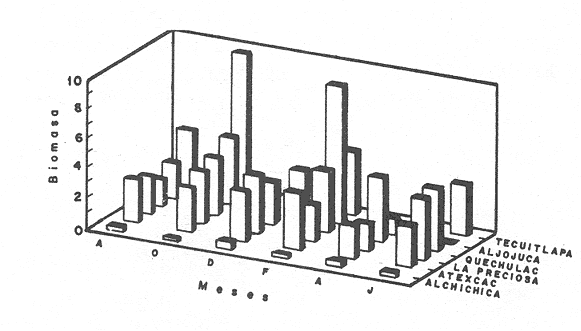 Figura 3. Comparación mensual de la cosecha de biomasa en kg/m² para cada uno de los lagos. Las comparaciones demuestran que los iones más abundantes de los lagos cráter son Na+Mg²+Cl- y HCO-3, y esta composición química se asemeja a la del agua de mar, donde los iones más abundantes son Na+Mg²+,Cl-y SO²-4 (Millero, 1975a). De esta comparación se puede esperar que las propiedades físicas de estos lagos cráter, también sean semejantes a las del agua de mar. Una de estas propiedades físicas es la densidad de la solución, la cual se puede calcular por la ecuación: d = d° + 10³ (Mt -d° ø v) et (1) donde d° es la densidad del agua pura (Kell, 1975), Mt=ΣEiMies el peso equivalente promedio, øv = ΣEiøv (i) es el volumen equivalente aparente del lago y et es la normalidad total (eq/1). La dependencia de øv respecto a la concentración para un electrolito puede ser representada por: øv= øºv + SvIv¹/2+ bv Iv (2) donde øv = ΣEi0v (i) es el volumen equivalente aparente a dilución infinita, Sv = ΣEi Sv (i) es la pendiente de la ley limitante de Debye- Hiickel, y bv = ΣEibv (i) es un parámetro relacionado a la desviación de ley limitante. Al combinar la ecuación 1 y 2, se tiene la ecuación: d = d° +10-³ (Mt-dºøºv)et- 10-³ Svd° etIv1/2-10-³bvdºetIv(3) 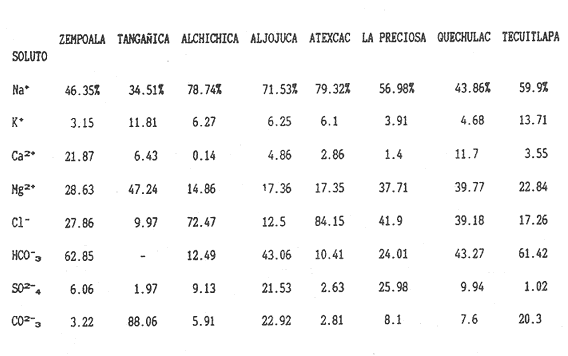 TABLA 4 FRACCIÓN EQUIVAlENTE DE LOS SOLUTOS MAS ABUNDANTES En la tabla 5, se presenta una comparación de øºv, Sv y bv calculados para estos lagos y los lagos Zempoala y Tangañica. Evidentemente los valores de ø°v, Sv y bv de los lagos Zempoala y Tangañica son diferentes a los de los lagos estudiados. Alchichica y Atexcac presentan datos similares, así como Aljojuca, La Preciosa y Quechulac; los valores de Iºv, Sv y bv para el lago Tecuitlapa son diferentes a los de los otros lagos, pero se asemejan más o menos a los del lago de Zempoala, debido tal vez a su semejanza en la composición química del agua. Las densidades relativas (d-dº; 25ºC), calculadas de la fracción equivalente de la tabla 4, se presentan en la tabla o; en estas se comparan con la densidad obtenida mediante la ecuación (Milleroet al., 1976). (d -d°) = AS %o + BS3/2 + CS²%o (4) donde A, B y C son constantes en función de la temperatura y tienen los valores de 761.88042 x 10-6 -5.3456 x 10-6 y 604.61 x 10-9respectivamente. Estos valores de densidad se aproximan bien entre si, una desviación de 0.215 x 10-6 g/cm³ es obtenida; con esto se demuestra que las densidades de estos lagos se pueden obtener a partir de los mismos métodos aplicados al agua de mar; las diferencias grandes son debidas a la composición química, la cual afecta los valores de øºv, Sv y bv. 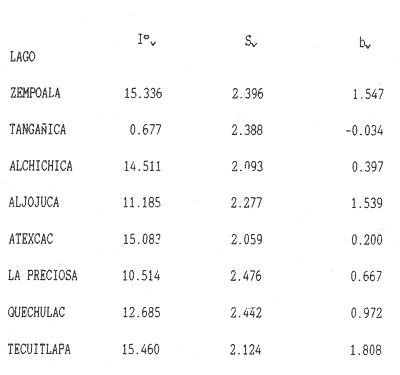 TABLA 5 COMPARACIÓN DE 95 v, Sv y Bv, a 25ºC La composición química de los iones más abundantes también fue usada para entender las reacciones químicas que se suceden en estos lagos, las cuales se analizaron mediante la comparación de la especiación de los solutos iónicos. Como la fuerza iónica para los lagos de Alchichica y Atexcac es diferente (0.253 y 0.238 mol/kg, respectivamente), a la de los otros lagos (0.023 a 0.049 mol/kg), se prefirió usar un modelo para la fuerza iónica alta en el cálculo de la especiación, dicho modelo es el del par iónico (Millero, 1975 a y b). Para los lagos cráter una comparación de la especiación de los cationes indica en general que estos forman pares iónicos en el siguiente orden: Ca²+> Mg²+ > H+Na+ > K+, siendo este último el que menos se acompleja . Respecto a los aniones se sigue el orden CO²-3SO²-4HCO-3Cl-. El porcentaje de iones libres varia más drásticamente en los aniones, principalmente con el ión carbonato y sulfato. 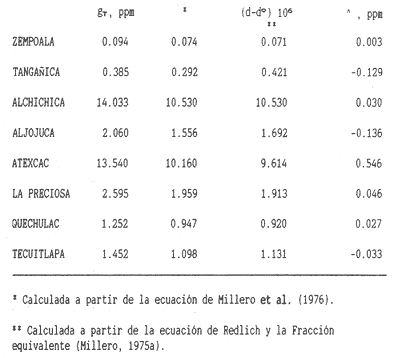 TABLA6 DENSIDAD RELATIVA A 25ºC En la figura 4, se muestra una comparación de la especiación del ión CO²-3 ; el porcentaje de este ión libre para los lagos cráter es menor comparado con los de los lagos Zempoala y Tangañica (Fig. 4), el lago Atexcac presenta el menor porcentaje (35.28 %. Fig. 4) 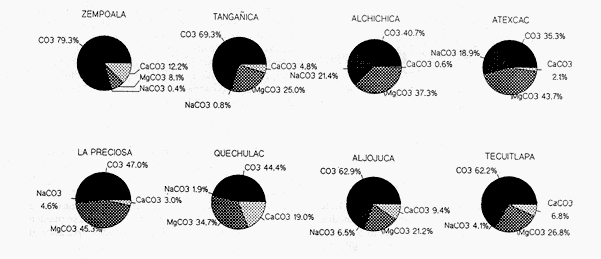 Figura 4. Comparación de la especiación del ión carbonato (C03), para los lagos Zempoala y Tangañica de origen no volcánico y para los lagos cráter de Puebla. Carbonato de calcio (CaC03), carbonato de magnesio (MgCa3) Y Carbonato de sodio (NaC03). del ión libre seguido por el lago Alchichica (40.71%, Fig.4), valores que se deben a la mayor concentración de otros solutos iónicos presentes en estos lagos. El lago Aljojuca presenta el mayor porcentaje del ión CO²-3libre (62.91%,Fig. 4), lo cual se debe a la proporción en que se encuentran presentes los cationes más abundantes (Na +, Mg²+ y Ca²+), esta característica también se observa para el lago Tecuitlapa (Fig. 4). En suma se puede indicar que el ión CO²-3 en estos lagos forma pares iónicos en el siguiente orden: MgCOº3 > NaCO-3> CaCO-3. El ión sulfato presenta una variación semejante a la descrita para el ión carbonato, este ión para los lagos cráter congrega pares iónicos en la siguiente disposición: NaSOº4 > MgSOº4 > CaSOº4y KSO-4. ANÁLISIS DE CLASIFICACIÓNOtro procedimiento para analizar los parámetros físicoquímicos de los lagos cráter fue mediante el análisis multivariado de clasificación (Conglomerados) (Espinoza y López, 1977; Reyes et al., 1978). En forma conjunta fueron analizados los valores de las variables físico-químicas del agua y del sedimento y de la producción de biomasa. Para los análisis de datos no fue necesario introducir las mediciones del nivel del agua, ya que esta característica no varió durante el año. La transparencia del agua, tampoco fue considerada en el análisis por falta de datos en los lagos Alchichica y Tecuitlapa. En la figura 5, se muestra el dendrograma de clasificación de los seis lagos con base en 18 variables. En este dendrograma se forman 3 grupos, el primero con los lagos Aljojuca y Tecuitlapa, con un coeficiente de similaridad de 0.709, el segundo grupo lo forman los lagos La Preciosa y Quechulac con un coeficiente de 0.708 y el tercer grupo lo forman los dos restantes lagos, Achichica y Atexcac con un coeficiente de 0.588. Ahora bien, la similaridad entre el primero y el segundo grupo es de 0.497 y la de estos con el tercero es de 0.326. Esto significa que a un coeficiente de similaridad más alto la relación entre lagos o entre grupos es más alta. Analizando los histogramas de clasificación, se encuentra que en el primer grupo, formado por los lagos Aljojuca, y Tecuitlapa, las concentraciones de los iones HCO-3, Cl-, Mg²+ y pH del sedimento son las más semejantes. En el segundo grupo, formado por los lagos La Preciosa y Quechulac, los iones HCO-3, Cl-, K + y pH de sedimentos son similares en su concentración por lo que también se agrupan. Finalmente los iones que más influyen para la formación del tercer grupo, Alchichica y Atexcac, son el Mg²+ Cl- y el Na+. Las variables que maximizan las diferencias entre el primero y el segundo grupo de lagos son principalmente las que corresponden al sedimento como arenas, limos, materia orgánica, nitrógeno total y fósforo asimilable y de estos grupos con el tercero son algunas del agua como HCO-3, Cl-, Mg ²+ y Na+. El análisis de clasificación de la composición floristica de los seis lagos formó tres grupos, los mismos que se formaron con el análisis de las variables físico-químicas y la biomasa. En este caso el orden jerárquico de clasificación se invirtió formándose en primer lugar un grupo con los lagos Alchichica y Atexcac, esto es los que tiene el coeficiente de similaridad más alto (0.8). El segundo grupo forman los lagos La Preciosa y Quechulac con un coeficiente de 0.75. El tercer grupo lo forman AljoJuca y Tecuitlapa con un coeficiente de 0.66. La similitud entre el primer grupo y los dos restantes es de 0.0 y entre el segundo y tercer grupo es de 0.25 (Fig. 6). 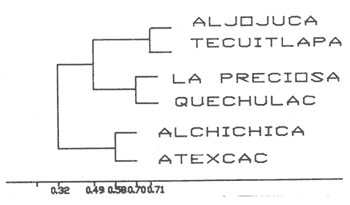 Figura 5. Dendrograma de clasificación de los seis lagos con base en las variables fisico-químicas del agua y del sedimento y de la biomasa de las hidrófitas. Clasificación jerarquica con el coeficiente de Gower por el método de conexión larga. 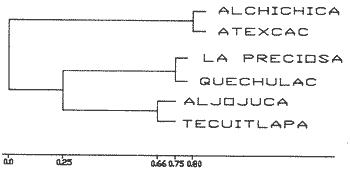 Figura 6. Dendrograma de clasificación de los seis lagos con base en la composición florística de las hidrófitas. Clasificación jerarquica con el coeficiente de Dice por el método de conexión larga. El primer grupo de lagos comparte la presencia de dos especies Cyperus laevigatus L. y Ruppia marítima L. El segundo grupo comparte la presencia de tres especies de hidrófitas Scirpus californicus (mey) Steud., Potamogeton pectinatus L. y Ranunculus cymbalaria Pursh. El tercer grupo también presenta tres especies en común Eleocharis montevidendsis Kunth, P. pectinatus e Hydrocotyle verticillata Thub. (Tabla 3). ANÁLISIS DE CORRELACIÓNOtra forma de analizar los datos fue con el grado de asociación lineal entre las variables. En figuras 7 y 8 se esquematizan estas relaciones a través de los coeficientes de correlación de Pearson (Sokal y Rohlf, 1969). A través de éste coeficiente se trató de encontrar algún patrón de asociación entre las variables físico-químicas del agua y del sedimento con la biomasa (Tablas 7 y 8). 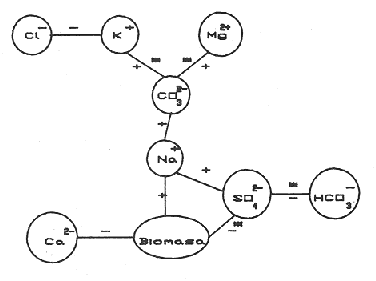 Figura 7. Diagrama de las correlaciones de Pearson de las variables fisico-químicas del agua y la biomasa para los seis lagos.(*)Correlaciones significativas. Para la identificación de un patrón de asociación de variables, primero se considero a aquellas que guardan entre si una correlación alta y significativa a un 95% de confianza. En segundo lugar se tomó en cuenta a aquellas variables con una correlación mayor al 60% de varianza explicada, pero que se presentan al menos en un par de lagos, de tal manera que justifique su asociación. 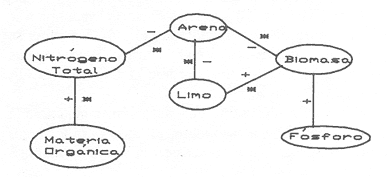 Figura 8. Diagrama de las correlaciones de Pearson de las variables fisico-quimicas del sedimento y la biomasa para los seis lagos.(*) Correlaciones significativas. De una forma general se establece que en casi todos los lagos el eje de las mayores correlaciones lineales directas es en primer lugar el carbonato, ya que establece relaciones con el magnesio, potasio y sodio. En segundo lugar está el sulfato que establece algunas correlaciones significativas e inversas (negativas) con el bicarbonato, el sodio y la biomasa (Fig. 7). En cuanto a los sedimentos el eje de las mayores correlaciones lo tienen las arenas, que guardan relaciones lineales inversas con el limo, el nitrógeno total y la producción de biomasa (Fig.8). Por otro lado la biomasa guarda correlación positiva y significativa con el limo y positiva pero no significativa con el fósforo asimilable. Por último la materia orgánica y el nitrógeno total tienen entre si una correlación positiva y significativa. DISCUSIÓNLos resultados obtenidos a través de los diferentes tratamientos de los datos fueron más o menos semejantes entre si, por ejemplo, el análisis de las interacciones iónicas de los iones más abundantes estuvo en concordancia con los de clasificación, debido a que los dos conjuntan de alguna manera a los mismos grupos de lagos, como el compuesto por Alchichica y Atexcac, similitud que puede ser debida a los procesos geoquímicos que se suceden en la interface agua-sedimento y a la composición química del agua. En cuanto a los otros dos grupos de lagos formados por el análisis de clasificación, existe una diferencia del grupo formado por el análisis de las interacciones que agrupa a los lagos La Preciosa, Quechulac y Aljojuca. Esta diferencia se debe probablemente a que en el método de clasificación se usó en forma conjunta las variables del agua, de los sedimentos y de la biomasa, mientras que en el análisis de interacciones solo se usan las variables químicas del agua. Como la profundidad de la cuenca es más similar en los lagos La Preciosa, Quechulac y Aljojuca es también muy posible que sus procesos geoquímicos y fisicos sean más similares, mientras que con el lago Tecuitlapa habrá una gran diferencia por la poca profundidad de su cuenca. El análisis de correlación mostró que el ión carbonato (C0²-3) se encuentra fuertemente asociado con los cationes magnesio (Mg²+) y sodio (Na+) hecho que fue similar en el análisis de la especiación iónica del mismo ión, donde los principales pares iónicos que forma son: MgCO3º >NaCO-3 > CaCOº3. 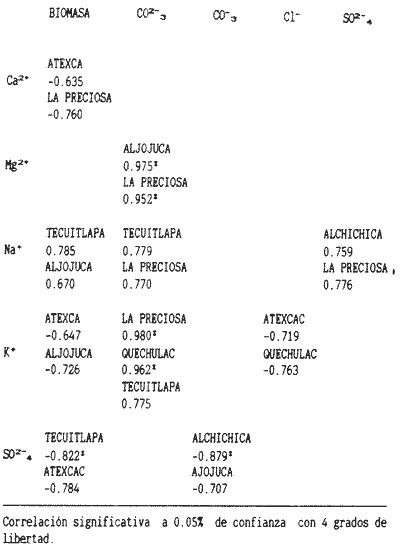 TABLA 7 COEFICIENTE CORRELACIÓN DE PEARSON PARA LAS VARIABLES DEL AGUA Y LA BIOMASA DE LOS SEIS LAGOS CRATER DE PUEBLA  TABLA 8 COEFICIENTE CORRELACIÓN DE PEARSON PARA LAS VARIABLES DEL SEDIMENTO Y La BIOMASA DE LOS SEIS LAGOS CRATER DE PUEBLA El agua de los seis lagos cráter estudiados se puede clasificar como de tipo alcalina (alcalinidad total), con una alta concentración del ión bicarbonato, favorecida por el pH alcalino en el rango de 8.3 a 9.0. En aguas moderadamente duras o alcalinas todas las bases están presentes en forma de bicarbonatos, se establece en el caso de estos lagos, un equilibrio en la solución con los cationes que más fácilmente seden electrones, como el calcio y el magnesio. En los lagos estudiados la reacción de equilibrio debe ser: H20 + MgCO3------------------->Mg(HCO-3)²<-->Mg²+2(HCO-3) que indica el proceso por el cual incrementa o desciende la concentración de bicarbonato y magnesio en la solución (Wetzel, 1975; Valentyne, 1978). Por lo general en aguas, continentales la alcalinidad es debida al calcio, catión que fija carbonato o bicarbonato, pero en lagos salinos con alta concentración de sodio, el calcio es rápidamente precipitado y entonces la alcalinidad es debida al sodio (Margalef, 1983). La rápida precipitación del calcio en forma de carbonato de calcio (CaCO3) o sulfato de calcio (CaSO4.2H20), se observó en forma de concreciones sobre las rocas o las plantas de los lagos. Margalef (1983), comenta que cuando entra agua rica en bicarbonato de calcio en un lago salino, ocurre una precipitación en forma de concreciones calcáreas de márgenes agudos, que al irse depositando capa tras capa forman torres o columnas que engloban arena. Este fenómeno se puede observar en el lago Alchichica, en donde a escasos metros de la costa se han formado pequeñas islas de estas precipitaciones. Otra forma de clasificar el agua de los lagos es a través de la concentración de cloro (Margalef, 1983), cuando es mayor que la de carbonatos y la de sulfatos se llaman aguas Athalassohalinas, como ocurre en los lagos Alchichica, Atexcac y La Preciosa. En aguas Athalassohalinas hay una menor importancia relativa de bicarbonato y calcio (Margalef, 1983). Esto es debido a que el bicarbonato esta favorecido en la solución por el pH y el calcio se encuentra precipitado. En este trabajo se encuentra que es el ión carbonato establece los principales pares iónicos con el magnesio, con el sodio y con el calcio. Algunos autores como Sculthorpe (1967), Margalef (1977), Hutchinson (1975b) y Wetzel (1975), mencionan que las hidrófitas sumergidas, generalmente toman el carbono a través del CO², pero en lagos donde la concentración de éste es muy baja sólo hidrófitas facultativas se desarrollan, ya que pueden tomar carbono tanto del C0² como del HCO-3, como ocurre con la especies potamogeton pectinatus y Ruppia marítima, que se distribuyen ampliamente en los seis lagos estudiados. No sólo el pH del agua influye en la distribución y crecimiento de las hidrófitas, como sugieren Moyle (1945) y Pip (1979), sino también por la disponibilidad del carbono a través del HCO-3 que a su vez está favorecido en la solución por el pH alcalino. Walker y Wehrhahn (1970) y Pip (1979) sugieren que el ión cloro tiene un efecto selectivo sobre el crecimiento y desarrollo de algunas especies de hidrófitas, favoreciendo el crecimiento de especies como Potamogeton pectinatus y Ruppia marítima. Por su alta concentración se considera que el ión cloro es uno de los factores más importante que afecta el desarrollo de las hidrófitas, ya que en los lagos Alchichica, y Atexcac donde la concentración del cloro es alta, la diversidad de especies es baja en comparación con los lagos Quechulac y Tecuitlapa. La mayoría de las especies de hidrófitas encontradas en estos lagos tienen una amplia tolerancia tanto a condiciones climáticas como físico-químicas del agua y del sedimento, ya que un buen número de ellas se distribuyen ampliamente en el mundo (Ramírez-García y Novelo, 1984). La principal influencia del substrato sobre la distribución de la vegetación acuática enralzada fue la textura. Se ha visto en algunos casos que las plantas acuáticas siguen patrones de sedimentación más que de profundidad. Algunos autores como Sculthorpe (1967), Singhal y Singh (1978), sugieren que es mayor la colonización en sedimentos finos que en sedimentos arenosos y caracterizan algunas especies como colonizadoras de ciertos tipos de sedimento, como Typha, Phragmites y Potamogeton para lugares fangosos. Aunque estas especies se pueden encontrar en sedimentos arenosos, se observo que su desarrollo es mucho menor que en otros. La Preciosa y Quechulac que tienen los porcentajes más bajos de arena y los más altos en limo, son los lagos donde se obtuvieron los valores más altos en biomasa, al menos para La Preciosa, además también se encuentran las poblaciones más extensas y mejor desarrolladas de todos los lagos, como son las Scirpus californicus, Juncus andicola y Potamogeton pectinatus. En contraposición, los lagos restantes con sedimentos francamente arenosos, presentan poblaciones muy reducidas y bajos valores de biomasa, que dando de manifiesto una interacción negativa entre biomasa y arena a través de la correlación de Pearson. Existe una relación entre la textura y la composición química del sedimento que influye sobre la vegetación acuática (Hutchinson, 1975b). Esta relación se considera a través de los coeficientes de correlación negativos entre arena y biomasa, arena y limo, y arena y nitrógeno total, y positivos entre limo y biomasa. Por lo general en sedimentos de textura gruesa existe una baja retención de materia orgánica, y al ser pequeña la fracción de ésta las substancias como carbohidratos, proteínas, péptidos y aminoácidos de los cuales derivan los principales nutrientes también serán escasos. De los macronumentos esenciales para el crecimiento de las hidrófitas, el nitrógeno, es el que se encuentra en medianas cantidades y puede ser un limitante especifico para el desarrollo de las hidrófitas. Aunque no se puede justificar una correlación significativa entre el crecimiento y la producción de biomasa con la proporción de nitrógeno, ésta es más o menos evidente en los lagos La Preciosa con la mayor producción de biomasa y Quechulac con las poblaciones más extensas de Scirpus californicus y Potamogeton pectinatus, lagos donde también se dan los más altos porcentajes de nitrógeno total. Junto con el nitrógeno, el fósforo es el otro nutriente limitante en el crecimiento de las hidrófitas, se encuentra en bajas concentraciones en el sedimento de casi todos los lagos, excepto en Tecuitlapa. Margalef (1983), afirma que el fósforo forma con facilidad minerales insolubles, al precipitarse en forma de fosfato cálcico o de magnesio en lagos salinos de pH del agua alcalino y sedimentos ricos en calcio con pH también alcalino. Es posible que no exista una disponibilidad de este elemento al encontrarse en forma de un coloide poco soluble. El potasio intercambiable se encuentra en equilibrio solución-coloide-roca o mineral y por lo mismo es muy difícil su intervención en la distribución vegetal. Mickle y Wetzel (1978) y Barko y Smart (1981), sugieren que las hidrófitas toman el potasio del agua más que del sedimento, por lo que es posible que este no tenga variaciones en su concentración dentro del sedimento debido al equilibrio previamente mencionado. La flora litoral tiene un papel muy importante en la dinámica del nitrógeno y del fósforo, ya que las hidrófitas actúan como una bomba para reciclarlos en el sistema del lago, pero aunque son rápidamente movilizados del sedimento (Boyd, 1970; Redd, 1976; Barko y Smart, 1981), las altas concentraciones iónicas en el agua producen una fuerte retención de los mismos al precipitarlos, en el caso del nitrógeno en forma de compuestos solubles, lo que produce que este sea más fácilmente reciclable en comparación con el fósforo, que forma compuestos insolubles. En determinaciones de biomasa la curva típica de crecimiento es de forma sigmoide, hasta un máximo de tiempo en donde esta empieza a decaer. Aunque existe un rápido crecimiento en primavera y un máximo en verano esto no es una regla para las regiones subtropicales y tropicales (Westlake, 1965). En estos lagos observamos dos máximos de producción de biomasa, en los meses de octubre y febrero, que coinciden con una disminución en la concentración de sulfatos en casi todos ellos y con una disminución en las proporciones de arena en el sedimento. A través de los resultados obtenidos en este trabajo, se puede decir que aunque los lagos se encuentran ubicados a escasa distancia unos de otros, existen algunas diferencias entre ellos. Estas diferencias tienen su origen en la profundidad, superficie y forma de la cuenca que actúan sobre los procesos de mezcla y geoquímica de cada lago. Por ejemplo, en el lago Tecuitlapa con una profundidad promedio de 2.5 m, la transparencia del agua, aunque no se registró sistemáticamente, nunca fue mayor de 40 cm, por su poca profundidad este lago se ve más afectado por la erosión debida a los vientos y al oleaje. En el otro extremo de las diferencias se encuentra el lago Alchichica, con una profundidad máxima de 64.6 m, y una área superficial de poco menos de 2 km2. En este lago el proceso de erosión de la costa esta más atenuado por su profundidad, reflejándose en una alta transparencia mayor a 8 m. Las diferencias en la batimetría y morfometría de los lagos marcan toda una gradación de diferencias en la composición química del agua, en la produccion de biomasa, en la composición floristica de las hidrófitas y en menor escala en las características físico-químicas del sedimento. AgradecimientosLos autores desean agradecer a la Dra. Guadalupe de La Lanza, M. en C. Alejandro Novelo y M. en C. Agustín Quiroz del Instituto de Biología de la Universidad Nacional Autónoma de México la revisión critica de este trabajo y al CONACyT por la beca otorgada y el apoyo parcial a través del Proyecto PECNAL 790236. LITERATURAAlVAREZ J. An. Esc. Nac. Ci. Biol México Contribución al conocimiento de los peces de la Región de los Llanos, estado de Puebla (México).1950. 81-107.69(2) ARMITAGE, K.B. , . Lagos volcánicos de El Salvador. Común.Inst. Trop. Cient.195839-517(1-2): ARMITAGE, K.B. And N.C. FASSETT. Arch. Hydrobiol. Aquatic plantes of Salvador.1971.243-255.69 (2): ARREDONDO, F.J., L.BORREGO, R., CASTILLO y M. VALLADOLID.BióticaBatimetría y morfometría de los lagos "maars" de la Cuenca de Oriental, Puebla, México. 1983.:31-47.8 (1) ARREDONDO, FJ., 0. VERA y 0. ORTIZ. Biótica Análisis de componentes principales y cúmulos, de datos limnológicos, en el lago de alchichica, Puebla1984.23-39..9(1): BARKO, IJ.W. And R.M. SMART. Aquat. Bot. Sediment-based nutrition of submersed macrophytes.1981.339-352.10(4): BARNES, R.B. Ind. Eng. Chem. Anal. Flame photometry: a rapid analytical method. 1945.605.Ed.17: BAXTER, R.M. And R.B. WOOD.J. Appl. Ecol. Studies on stratification in the Bishoftu crater lakes.1965.416.2: BOUYOUCOS GJ. Method. Directions for making mechanical analisis of soil by hydrometer. Soil Sci.1963. 25-30.42: BOYD C.E. Arch. Hydrobiol. Losses of mineral nutients during descompositions of Typha latifolia.1970.511-517.66: BRAY H.R. And T.L KURTZDetermination of total organic and avallable formas of phosphorous in soils. Soil Sci.1945.439-4-45.59: CHAPMAN, H.D. y P.F. PRATT.Métodos de análisis para suelos, plantas y aguas. Trillas, México.1973.195 p. DE BUEN F. An. Inst. Biol. Investigaciones sobre la ictiología mexicana. I. atherinidae de aguas continentales de México.Univ. Nac. Autón. México1945.475-532.16(2): DEEVEY E.S. . Trans. Comn. Acad. Limnologic studies in Middle America Arts. Sci.1957.213-328.39: DENNY P. Freshwater Biol. Lakes of South Western Uganda. I. Physical and chemical studies on lake Bunyonyi.1972a.143-158.2: DENNY P. Freshwater Biol. Lakes of South Western Uganda o lake Bunyonyi.1972b.123-135.3: DIHEL H. C.A. GOETZ and C.C. HACH. . The versenate tritaion for total hardness Amer. Water Works Assoc. Jour.1950.40-48.42: ESPINOZA, G. y A. LÓPEZ Comunicaciones técnicas. Introducción a los métodos jerárquicos de análisis de cúmulos.Serie verde: Notas. Univ. Nac. Autón. México.1977.77pp.No.9. Vol 11. IIMAS, FUENTES A.L. Direc. de Publ. Regiones naturales de estado de Puebla.Univ. Nal. Autón. México.1972. 143 pp. GASCA D.A.Génesis de los lagos.cráter de la Cuenca de Oriental. Colec. Cient. Inst. Nal. Antropol. Hist. 98 México.1982. 45 pp. GOOD E.R. F.D. WHIGHAM and L.R., SIMPSON. . Feshwater wetlands.Academic Press NY.1978. 378 pp GREEN J. S.A. CORBER and E. BETNEY. Ecological studies on crater lakes in West Cameroon. J. Zool. Lond.1974199-223.173: HARMAN, W.N. Phenology and physiognomy of the Hydrophyte community in Ostego Lake,N.Y. Rhordora1974.497-508.76 (808): HASLER A.D. . Fishbiology and limnology of crater lake Oregon. J Wildl.. Manage.1938.94-103.2: HUTCHINSON G. H. Geography, physics and chemistry. A treatise on limnology. I.Jhon Wiley & Sons Inc. N.Y.1975a.1015 pp. HUTCHINSON G. H. A treatise on limnology. III.Aquatic macrophytes and attached algae.Jhon Wiley & Sons Inc. N.Y.1975b. 660 PP JACKSON M. L Análisis químicos de suelos.Ed. Omega. Barcelona.1964. 662 pp. JUDAY C. Limnology studies on some lakes in Central america. Trans. Wis. Acad. Litt.1915.214-243.18(1): KELL, G. S. Density, thermal expansibility and compressibility of liquid water from Oo to.150oC: corrections and tables for atmospheric pressure and saturation reviewed and expressed on 1968 temperature scale, J. Chem. Eng. Data.,1975.97-105.20: MARGALEF, R. Ecología. Omega 2a. ed.Barcelona.1977. 951 pp. MARGALEF, R. Limnología. Omega,Barcelona.1983. 1010 pp. MELAcM.J. Arch. Hydrobiol.Morphometric physical and chemical features of the volcanic crater lakes of Western Uganda.1978.430-453.84(4): MIKLE, A.M. And R.G. Wetzel. Inorganic nutrients. Aquat. Bot.Effectiveness of submersed angiosperm epiphyte complex on excange of nutrients and organic carbon in littoral system. I.1978.303-316.4(4): MILLERO, F.J. The sea Vpl. 5, Seawater as milticomponent electrolyte solution. Ch.1, Em: E.D. Golberg (ed.), Jhon Wiley and Sons,New York.1975a.3-80. MILLERO, F.J. Marin chemestry in the coastal environment. The physical chemestry of estuaries. Ch2 En: ACS Symp. Ser. 18, T.M. Church (ed.) Washington, D.C. 1975b. 25-55 pp. MILLERO, F.J. A. GONZÁLEZ and G.K. WARD. The density of seawater solutions al one atmosphere as a function of temperature and salinity.J. Mar. Res.1976.61-93.34: MOYLE B.J. Some chemical factors influencing the distritution of aquatic plants in Minesota. Amer. Midl. Nat.1945.402420.34: ORDOÑES E. Los Xalapascos de estado de Puebla. Paregones Inst. Geol. México.1906.348-405. 1(8): PIP F. Aquat. Bot. Survey on the ecology of submerged aquatic macrohytes in central Canada.1979.339-357.7: RAMÍREZ-GARCÍA, P. y A. NOVELO. La vegetación acuática vascular de seis lagos cráter del estado de Puebla, México. Bol. Soc. Bot. Méx.1984.75- 88. 46: REID K, and D. WOOD. Ecology of inland waters and estuaries. 2a. ed. D. Van Nostrand. NY.1976,485 pp. REYES, L, A. LÓPEZ y G. ESPINOZA. Comunicaciones técnicas.Análisis /Cúmulos: un programa para análisis de cúmulos. Serie amarilla: Desarrollo.Univ. Nac. Autón. México.1978. 27 pp.No.6. Vol 1.IIMAS, REITEMEIR R. F. Smimicroanalysis of saline soil solution. Ind. Eng. Chem. Anal. Ed. 1943.393-402.15: SCULTHORPE C.D. The biology of aquatic vascular plants. Edward amold London.1967. 619 pp. SHEEN R.T. H.L KAHLER and E.M. ROSS. Turbidimatric determination of sulfate in water. Ind. Eng. Chem. Anal. Ed.1935262.7: SINGHAL P.K. And J.S. SINGH. Ecology of Nainital lakes: Morphometry and macrophytic vcgetation. Trop. Ecoll.1978.178-188.19(2): .SOKAL, R. And F.J. ROHLF.Biometry. W.H. Freeman and Co. San Francisco.1069. TAYLOR E.H. A new amblystimid salamander adapted to brackish water. Copeia1943.151-156.3: TIMMS B.V. Basic limnology of two crater lakes in Western Victoria.Proc. R. Soc. Victoria.1975. 159-166. 87: UTTERBAK C.L. Some chemical physical and optical characteristic of crater lake. Ecol. 1942.97-103.23: VALLENTYN J. Introducción a la Limnología Omega Barcelona.1978.169 pp. WALKER B.H. And C.F. WEHRHAHN. Relationships between derived vegetation gradients and measure environmental variables in Saskatchewan wetlands. Ecol. 1970.85-94.52 (1): WALKLEY A. A critical examination of a rapid method for determining organica carbon in soils effects of variations in digestion conditions and of organid soil constituents. Soil Sci.1947.251-264.63: WANDER I.W. Photometric determination of potassium. Ind. Eng. Chem. Anal. Ed. 1942.471.14: WELCH P.S. .Limnology 2a. ed. McGraw-Hill NY. 1952.538 pp WESTLACKE, Some basic data afor investigations; of the productivity of aquatic macrophytes.Mem. Inst. Ital. Idrogiol.(Suppl.)1965.229-248.18 WETZEL R.G. Limnology. Saunders, Philadelphia.1975.743 pp. WETZEL R.G. And H.L ALLEN. Function and interaction of dissolvel organic matter and the littoral zone in lake metagolism and eutrophication En: Kajak Z, and a. Hillbricht A. (Eds.) Productivity problems of freshwater warsaw PWN. Polish Sci. Publs.1970.pp.333-347. WETZEL R.G. And R.A. HOUGH. Productivity and role of aquatic macrophytes in lake. An assessment. Pol. Arch. Hydrobiol.1973.9-19.20: WILLIAMS H. Bull. Carnage. Inst. Wash. The geology of crater lake National Park Oregon.1942.162.32 p.540 YOSHIMURA S. Limnology observations of two crater lakes of Miyaki Island. J. Jap. Geor.1938.339-352.13: VÁZQUEZ G. F. y M. ORDOÑEZ. Estudio físicoquímico del lago de Zempoala (en preparación)
|

