|
CULTIVO SEMICONTINUO DE LA MICROALGA
Tetraselmis suecica K
Trabajo recibido el 17 de marzo de 1987 y aceptado
para su publicacíón el 5 de abril de
1988.
Carlos Cáceres Martínez
Alonzo Aguirre Muñoz
Luis McAnally Salas
Griselda Pares Sierra
Gustavo Leyva
Ciencias del Mar, Universidad Autónoma de
Baja California Sur, Apdo. Postal 219, La Paz, B.C.S., 23000, México.
Se muestra la técnica de cultivo semicontinuo para
la microalga Tetraselmis suecicaK. bajo condiciones
rudimentarias. Se calculo la dilución optima para el sistema de acuerdo
con la ecuación de Monod: Dm = 0.46. Se discuten las oscilaciones de los
valores de la densidad (células/ml) obtenidos en relación al
régimen de diluciones.Esta técnica de cultivo semicontínuo
de fitopiáneton tiene aplicación directa en la
acuacultura.
A semicontinuos culture teclinique
under rudimentary conditions for Tetraselinis suecica K. is
illustrated. The optimal dilution rate was calculated according to Monod
equation: Dm = 0.46 vol/day. The oscilations of densityvalues (cell/ml)
obtained in the system are discussed in reference to environmental parameters.
This semicontinuous culture teclinique can be used for aquacultural purposes in
phytoplank-ton production.
Uno de los problemas más graves en la acuacultura de moluscos, es el aprovisionamiento de microalgas. En la medida que se desarrollen técnicas simples para su cultivo masivo, los problemas de producción de larvas de moluscos se verán disminuidos grandemente. Actualmente en los centros de productores de semilla de moluscos, las microalgas son cultivadas en forma discontínua. Su producción se realiza en forma calendarizada, en donde la vida del cultivo es generalmente corta (Droop, 1.969; I-Jkelcs, 1973; Guillard, 1972). El mantenimiento de esta serie de cultivos, que comprenden múltiples unidades intermedias, trae consigo toda una serie de problemas técnicos que los convierten en una parte muy vulnerable del centro de producción de semilla. Los progresos realizados en los últimos años, en las técnicas de cultivo de fitoplancton, están en el sentido de la automatización, por el uso de los cultivos continuos (dilución constante con medio nutritivo) y semicontinuos (dilución a intervalos de tiempos definidos) (Dustan y Menzel, 1971; Ukeles, 1973; Canzonier y Brunetti, 1975; Droop, 1975; Trota, 1981; Laing y Helm, 1981). El desarrollo de sistemas de cultivo para microalgas de este tipo, bajo condiciones rudimentarias, tales que puedan reproducirse a bajo costo, son alternativas apropiadas para el desarrollo de unidades de cultivo a nivel masivo. Este trabajo presenta un sistema de cultivo semicontinuo para la mieroalgaTetraselmis suecica Kylin usada en la alimentación de moluscos, bivalvos y larvas de crustáceos. MATERIALES Y MÉTODOSEl quemostato para el cultivo deTetraselmis suecicaK. consta de dos recipientes: El distribuidor y el de cultivo. Su diseño se basa en los trabajos de Droop (1966); Persoone y Sorgeloos (1975) y Ukeles (1973). El recipiente distribuidor consiste en un garrafón de 20 litros Pyrex en el cual se prepara y se esteriliza el medio cultivo. Este tiene un tapón de goma por el que ingresan tres tubos de vidrio de 0.5 cm de diámetro al interior. Una entrada es para el aire, la segunda para el escape de éste y la última para permitir el paso del medio de cultivo al recipiente de crecimiento. Cada tubo de vidrio se conecta con una manguera de, vinilo esterilizable que cuenta con una pinza para abrir o cerrar el paso. Cerrando la línea de escape de aire con su pinza, se crea una sobrepresión que forza el paso del líquido a través del tubo distribuidor y así al recipiente de cultivo. El segundo recipiente o de cultivo representado en la figura 1 con capacidad de 8 litros, es un tubo de polietileno, de acuerdo con Persoone y Sorgeloos (1975), de una longitud de 80 cm y un diámetro de 16 cm sellado en su parte basal para crear un fondo en forma de "V". Su parte superior se sujeta a una tapadera de acrilico que descansa sobre un anillo de PVC de 16 cm de diámetro. El recipiente de cultivo cuenta con cuatro tubos: uno para la entrada de aire, que termina en un difusor, proveniente del compresor de aire general del laboratorio, y que pasa a traves de un filtro similar al descrito por Elsworth (1969); la segunda es la salida del sifón de cosecha que puede ser cerrado con una pinza; la tercera la del escape de aire que se conecta con un tubo de vidrio que contiene algodón para evitar la contaminación del sistema; y la cuarta es el acceso para el medio de cultivo, conectada con el recipiente distribuidor. 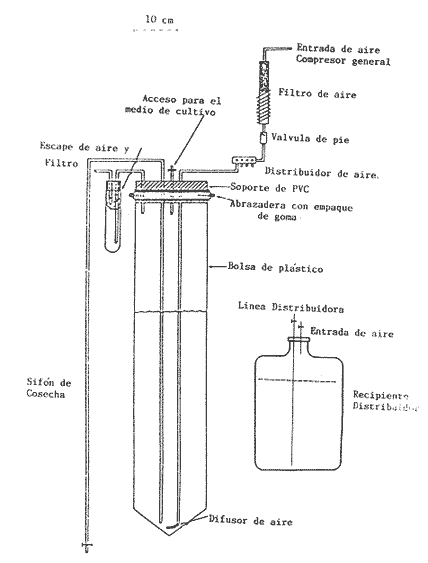 Figura 1. Recipiente de cultivo semicontinuo (Quemostato) El recipiente de cultivo se encuentra iluminado por una lámpara fluorescente (Sylvania "Cool White" de 75 W) situada a 30 cm de distancia. Siendo la intensidad de iluminación 1 - 14 W/cm² . Como medio de cultivo se usó el f/2 de Guíllard (1972) y su esterilización fue realizada de acuerdo con la metodología descrita por Hamilton (1973). La esterilización de las vitaminas se realizó después de acidificarlas y fueron almacenadas a -20°C. Dos recipientes de vidrio Pyrex, de 125 ml fueron usados para mantener la capa del microflagelado Tetraselinis suecica K que fue donada por el Dr. Thomas, del National Marine Fisheries Service, La Jolla, Calif. Una de las cepas estuvo en la obscuridad y fue transferida de recipiente cada quince días. La segunda cepa se mantuvo iluminada y fue transferida cada semana, ambos frascos permanecieron en un cuarto con temperatura controlada 20±3°C, y su condición fue agnotobiótica. El inóculo del quemostato consistió en dos litros de cultivo con una densidad promedio de 140 x 10³ cel/ml. Las mediciones de densidad de los cultivos (X) en millones de células por ml, se determinaron por conteos en un hematocitómetro de 0.1 mm de profundidad, para ocho cámaras de 0.1 mm² . Tres quemostatos de 8 litros cada uno funcionaron simultáneamente, para evaluar el efecto de diluciones de 10, 25, 30, 35, 40, 43, 50, 60 y 75% del volumen total del recipiente por día. La producción óptima del sistema se determinó haciendo uso de la ecuación de Monod (1950). 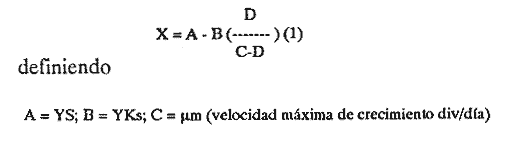 IMAGEN PAG 274b de donde: S es la concentración del sustrato limitante; Ks la concentración del sustrato correspondiente a Aµ = 1/2 µm; Y la constante de proporcionalidad del crecimiento de la células y la velocidad de flujo del sustrato (Herbert et al., 1956). La ecuación 1 fue resuelta usando los datos experimantales de densidad (céluls/ml) correspondientes a diferentes diluciones. Minimizando sus cuadrados y resolviendo las ecuaciones resultantes se obtuvieron los estimadores de A y B cuando N es el número de datos como:  IMAGEN PAG 275a donde 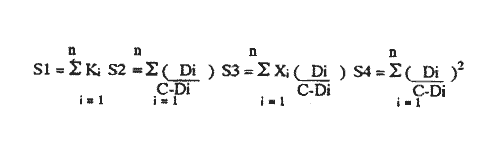 IMAGEN PAG 275b La estimación de las oscilaciones del sistema se determinaron haciendo uso del coeficiente de variación secuencial:  IMAGEN PAG 275c X = Medida del valor de densidad El azar de las oscilaciones se determinó con el método descrito por Willianis (1971) de acuerdo con: 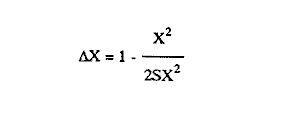 IMAGEN PAG 275d Si σx² = Diferencias sucesivas de la media cuadrática, al usar el estadístico de Young (1941) C¹, donde las desviaciones de ΔX respecto de cero indican oscilaciones no al azar, ya que ΔX tiene una distribución alrededor de cero (Willianis, 1971). RESULTADOS Y DISCUSIÓNNueve valores de dilución y sus correspondientes valores de densidad de células en el estadío de equilibrio (condición alcanzada cuando la velocidad de crecimiento es igual a la dilución, Herbert, 1964), fueron obtenidos de los tres quemostatos que funcionaron durante un periodo de tres meses (Fig. 2). La velocidad de crecimiento máxima, se estimó cuando los quemostatos fueron inoculados manteniendo el cultivo sin diluir por un periodo promedio de cinco días, siendopin = 1.16 Div/día. Los valores anteriores fueron usados para resolver la ecuación de Monod (1950), obteniendo los coeficientes A = 15.25 y B = 8.44 quedando la ecuación (1) como: X = 15.25 - 8.44 (D/1.15 - D) La producción del sistema se obtiene al multiplicar esta ecuación por la dilución. Relación que tiene su máximo cuando es derivada e igualada a cero (Cáceres Martínez, 1979). Resolviendo, obtenemos la estimación de la dilución que corresponde al máximo rendimiento (dilución óptima) Dm = 0.46 Vol/día (equivalente al 46% del volumen total del cultivo). Las condiciones de cultivo rudimentarias en lo refe rente al control de los parámetros físicos, repercuten sobre los resultados al producir oscilaciones que van de 9% para D = 0.25 Vol/día hasta un caso extremo de 70% para D = 50 Vol/dia. Sin embargo, los valores intermedios de dilución muestran un valor alrededor de 15% (Cuadro 1), a excepción de tres casos, las oscilaciones de la densidad durante el estadío de equilibrio son de naturaleza fortuita como lo muestran los resultados de Δx. Esto último también está ligado a las fluctuaciones de la temperatura (19.6 a 24.2C a lo largo del experimento) que es uno de los agentes moduladores más importantes, Williams (1971). 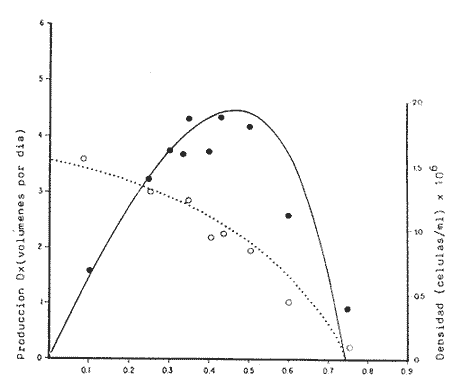 Figura 2. Relación de la Densidad (celulas x l0"/ml) y la Producción (volumenes por dia = % del volumen total del cultivo) con la Dilución del cultivo semicontinuo de Tetraselmis suecica K., el punto de inflección corresponde a la máxima peoducción La producción del sistema a largo plazo, fue evaluada usando el cultivo correspondiente a D = 0.43 Vol/día, durante un periodo de 48 días. Los resultados obtenidos muestran un valor de densidad para la cosecha diaria de 3.88 litros con 1.0±0.024 x 106 células/ml (Fig. 3) y un valor de sus oscilaciones en el estado de equilibrio del 13%, valor aceptable para una producción programada de fitoplancton. La estimación de la dilución óptima permite, la planificación de un trabajo de producción masiva de la microalgaTetrasebnis suecica K. Ejemplificando con el uso de un recipiente de 10 litros se producen 4.40±0.04 x 109 células/día, cantidad suficiente para cubrir las necesidades de un modesto laboratorio de mantenimiento de moluscos. 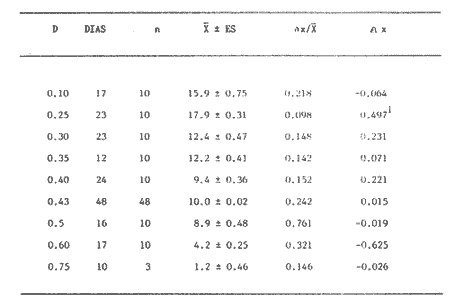 Cuadro 1. Valores promedio de densidad en células x 15 ± error estandard (ES), correspondientes a las diluciones (D) y sus índices de variación; coeficientes de variación secuencial ( delta x/X); azar de las oscilaciones Delta x); y el número de muestras. 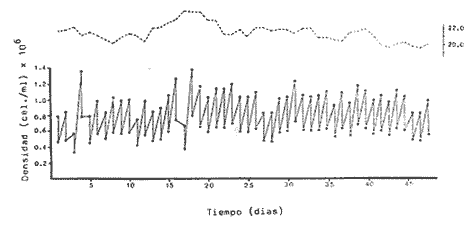 Figura 3. Densidad (células x 106/ml) de Tetraselmis suecica K obtenida en un Quemostato mantenido con una Dilución del 43 % de su volúmen total. LITERATURACÁCERES MARTÍNEZ, C. Tesis Cultivo continuo de la microalga Monochrysis lutheri bajo condiciones rudimentarias. Ensenada, B.C., U.A.B.C. 1979. 51 p. CANZONIER, W.J. y R. BRUNETHMar. Biol. Belgica Low-cost continuous alga culture system. In. 10th European Symp.1975.27-31. 1: DROOP, M.R. J Mar. BioL Ass. U. Vitamin B12 and marine ecology. III. An experiment with a chemostat. 1966. 659-671. 46: DROOP, M.R. Algae. Methods in microbiology.Academic Press, p. London: 1969.269-313. Vol. 3B. DROOP, M.R. Mar. Biol. Belgíca The chernostat in mariculture. In: 10th European Symp. 1: 1975. 17-21. DUNSTAN, W.M. y D.W. MENZELContinous culture of natural populations of phytoplankton in dilute trated seawage effluent. LimnoL Oceanogr1971.623-632. 16: ELSWORTH, R. Treatment of process air for deep culture. Methods in Microbiology Academic PressLondon: 1969. p. 123-136. Vol. I GUILLARD, R.R-L Culture of phytoplankton for feeding marine invertebrates. In: Culture of marine invertebrates animals. New York: Plenum 1972. p. 29-60. HAMILTON, R.D. Sterilization. In: Handbook of phycological methods. Cambridge U. Press. London:1973. P. 181-194. HERBERT, D., R. ELSWORTH y R.G. TELLING The continuous culture of bacteria: a theoretical and experimental study. J Gen Microbiol1956601-622.14: LAING, 1. y M.M. HELMFactors affecting the semi-continuous production of Tefraselmis suecica (Kylin) batch in 200 1. Vessels. Aquaculture.1981.137-148.2 (1,2): MONOD, J. Annels Inst. Pasteur. La technique de culture continue. Theorie et applications. Paris1950.390-410.79 PERSONE, G. y P. SORGELOOSI. Devices and Methods.Aquacubure. Thechnologícal improvement for the cultivations of invertebrates as food for fishes and crustaceans. 1975. 275-289. 6: TROTA, P. A simple and inexpensive system for continuous monoxenic mass culture of marine microalgae. Aquaculture1981. 383-388.22 (4): UKELES, R. Continuous culture. A method for the production of unicellular algal food. Handbook of phycological methods. Cambridge U. Press London: 1973 p. 233-254. WILLIAMS, F.M. Ecology Dynamics of microbial populations. In: Systenis analysis and simulation in . Academic Press,New York: 1971. 197-265. YOUNG, L.C. Test of nonrandomness. Ann Math. Statist. 1941. 293. 12:
|

