|
SISTEMÁTICA Y ALGUNOS ASPECTOS
ECOLÓGICOS DE LOS MOLUSCOS DE LA LAGUNA DE LA MANCHA, VERACRUZ,
MÉXICO.
Trabajo recibido el 28 de agosto de 1987 y aceptado para
su publicación el 17 de mayo de 1988.
F. Flores-Andolais
A. Garcia-Cubas
A. Toledano-Granados
Instituto de Ciencias del Mar y
Limnologia, Universidad Nacional Autónoma de México, D. F.,
04510, México. Contribución No. 637 del Instituto de Ciencias del
Mar y limnología, UNAM.
Se estudia la fauna
malacológica de la laguna de la Mancha, Veracruz. La recolecta de
materiales se realizó durante los meses de septiembre octubre de 1978,
estableciendo un total de 56 estaciones y efectuando en cada una de ellas las
mediciones de parámetros hidrológícos. Se encontraron 3927
ejemplares distribuidos en dos clases, 29 familias, 37 géneros y 40
especies, resultando predominante la Clase Gastropoda. Por lo que respecta al
análisis a nivel de las familias de los gasterópodos, el 56.2%
son salobres, el 62.5% epifaunales y el 43.7% carnívoros. Entre las
familias de bivalvos, el 69% son salobres, el 61.5% infaunales y el 84.6%
suspensívoros filtradores. Las especies de gasterópodos y
bivalvos más abundantes
fueron:Neritina(Vitta) virginea,
Cerithidea pliculosa; Acteocina canaliculata, Mytilopsis leucophaeata Ischadium
recurvum y Lucina pectinata Del análisis del índice de
diversidad general se obtuvieron los siguientes resultados: H' = 3.10 y J' =
0.58. El índice de afinidad aplicado indica que los gasterópodos
son los que presentan el valor porectual más alto. El análisis
"cluster" efectuado para las dos clases de moluscos se encuentra integrado en
los dendrogramas de similaridad correspondientes.
The
malacological fauna from Mancha lagoon in Veracruz state coast is studied. The
colect of materials was realized during september and october of 1978,
establishing a total of 56 stations, making in cach of them the hidrological
parameters measurements. 3927 molluscs were found distributed in 2 classes, 29
families, 37 genus and 40 species. Class Gastropoda was the main group in the
samples. Refering to gastropods families the 56.2% were in brackish water,
62.5% were epifaunal and 43.7% carnivorous. The families of bivalves, 69% were
in brakish water, 61.5% were infaunal and 84.6% were
suspensive-filter.Neritina (Vitta) virginea, Certhidea pliculosa,
Acteocina canaliculata, Mytilopsis leucophacata, Ischadium recurvum and Lucina
pectinata were the main species of gastropods and bivalves. The
general diversity index analysis give the following resuits: H' = 3.10 and J' =
0.58. The afinity index used indicates that gastropods has the highest
porcentage. The "cluster" analysis used for the two classes of molluscus is
integrated in the correspondent dendrograms of
similarity.
En el litoral del Golfo de México se encuentran alrededor de 22 lagunas costeras y numerosos estuarios, de los cuales se desconocen diversos aspectos biológicos e hidrológicos fundamentales, sin embargo se les atribuye una riqueza pesquera actual o potencial debido a las caracterísiticas particulares de cada una de ellas. En estas áreas uno de los grupos componentes de la fauna bentóníca es el de los moluscos, dentro del cual destacan particularmente los gasterópodos, bivalvos y algunas especies de importancia económica como el ostión, almeja y caracol. Por tal motivo, el ICMyL de la UNAM, a través del Laboratorio de Malacología, desarrolla un programa de investigación taxonómica y ecológica de las comunidades de moluscos que forman parte de los ecosistemas lagunares costeros del Golfo de México. El conocimiento de la fauna malacológica presente en estas áreas, requiere efectuar estudios tanto de sistemática y distribución, así como de establecer las relaciones de los organismos con los diversos parámetros ambientales, por lo que el objetivo del presente trabajo es contribuir a la sistemática y analizar la distribución, abundancia relativa y algunos aspectos ecológicos relevantes de la fauna malacológica perteneciente a la laguna de la Mancha. ANTECEDENTESLa información existente es escasa y se refiere a diversos tópicos; entre ellos se puede citar a Vázquez y Márquez (1972) sobre aves acuáticas; Aburto (1974) fauna bentónica y sus variaciones estacionales; Mora (1977) variación estacional de la fauna ictiológica; Young (1978) identificación y distribución de invertebrados macroscópicos del litoral rocoso; Novelo (1978) la vegetación del "morro de la Mancha"; Díaz (1980) estudio cromosómico de una población de bivalvos de la especieIsognomon alatus (Gmelin). Dentro de las investigaciones realizadas en diversos grupos zoológicos acuáticos a los que se han aplicado los diferentes índices de diversidad, destacan las de Simpson (1949), Brillouin (1962), Shannon Wicner (1963), Mac Arthur (1965), Pielou, (1966a) y Margalef (1957, 1974). Sin embargo no figuran trabajos sobre la diversidad de la fauna malacológica de las lagunas costeras del Golfo de México. Por lo que para estar en posibilidades de determinarla se tomaron en cuenta algunas consideraciones basadas en estudios efectuados principalmente por Antolí y García-Cubas (1985). ÁREA DE ESTUDIOLa laguna de la Mancha está situada al norte del puerto de Veracruz, Municipio de Actopan, en el kilómetro 25 de la carretera Cardel-Nautla. Se ubica entre los 19º34' y 19º36' de latitud norte y 96º22` y 96º24' de longitud oeste. La laguna es pequeña, de forma irregular y cubre una superficie de aproximadamente 25 km², con cerca de 3 km de longitud, está integrada por dos cuerpos de agua unidos por un canal estrecho y separada del Golfo de México por una gran barra arenosa, denominada "barra de la Mancha", en cuya porción noreste comunica al Golfo mediante una boca de flujo intermitente. Los aportes de agua dulce provienen de escurrimientos continentales estacionales (Young, 1975; Aburto, 1974), a los que contribuye el flujo semipermanente de un pequeño río conocido como "Caño Grande", ubicado en la porción suroeste de la laguna (Fig. l). La vegetación circundante está integrada principalmente por:Rhizophora mangle (mangle rojo), Avicennia germinans (mangle negros), Laguncularia racemosa(mangle blanco) y Conocarpus erectus(mangle botoncillo), (Novelo, 1978). CLIMADe acuerdo con el sistema climático de Köppen, modificado por García (1964), el clima es cálido, subhúmedo; con lluvias de verano que corresponde al tipo Aw (w) (i), con temperatura promedio anual de 25.7ºC, máxima de 29ºC y mínima de 22ºC. El promedio de precipitación es de 1100 a 1200 mm. Los meses lluviosos comprenden de junio a septiembre. MATERIAL Y MÉTODOSLos muestreos se llevaron a cabo en dos ocasiones durante el otoño, en los meses de septiembre y octubre de 1978, estableciéndose un total de 56 estaciones para muestreos biológicos e hidrológicos (Fig. 2). Para las mediciones de los parámetros ambientales, como salinidad, temperatura, profundidad y tipo de sedimentos se emplearon los métodos convencionales como son: refractómetro marca American Optical, termómetro de cubeta, sondaleza manual y draga Van Veen de 2 litros de capacidad. Las muestras de sedimentos conteniendo el material biológico, fueron tamizadasin situ a través de una malla con abertura de 1 mm y preservadas en formol al 10%, neutralizado con barato de sodio. 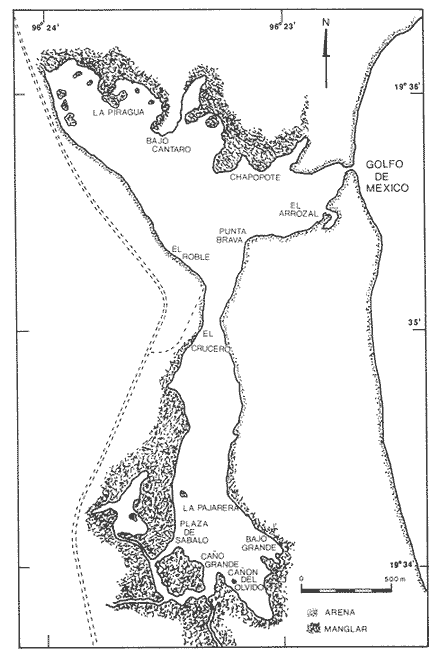 Figura 1. Área de estudio. Para la sistemática de la Clase Gastropoda se utilizaron los criterios de Thiele (1935), Moore (1969), Keen (1971) y García-Cubas (1981). Para la Clase Bivalvia, los de Newell (1965), Moore (1969), Keen (1971) y García-Cubas (1981). DiversidadDe acuerdo con Pielou (1966a y 1966b), el cálculo de la diversidad (H') se hizo mediante la fórmula de Shannon y Wiener (1963): 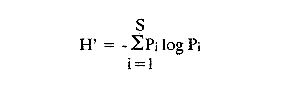 en donde, s = número de especies y Pi es el número total de individuos de lasi especies. La diversidad de una comunidad depende del número de especies y de la equitatividad o abundancia relativa de éstas, denotada por J'. Para este cálculo Figura2.Estacionesdemuestreo. es necesario conocer el valor de la diversidad máxima (H' máx = log 2 S) y la diversidad calculada (H') (Pielou, 1966a). 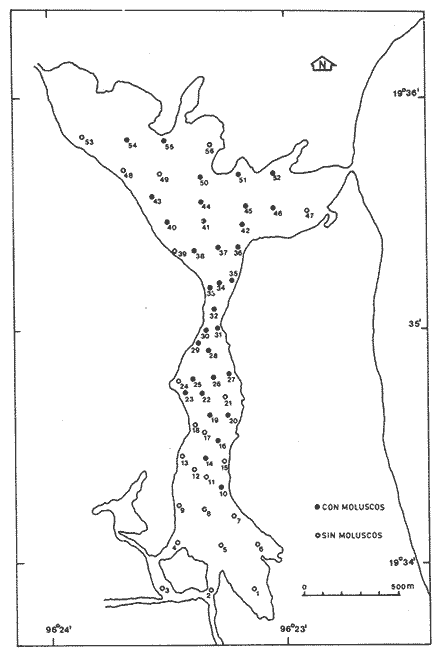 Figura 2. Estaciones de muestreo. 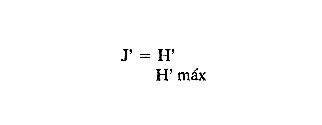 AfinidadPara calcular el índice de afinidad entre pares de estaciones, usando datos binarios presencia-ausencia, se empleó la fórmula propuesta por Czechanowski (1913). 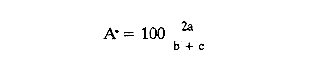 Donde a es el número de especies comunes, b es el número de especies presentes en la primera estación y c es el número de especies presentes en la segunda estación. Expresada en una matriz cuadrada y simétrica, llamada diagrama de enrejado. Análisis de "cluster"En este caso, se aplicó el programa de computación para analizar la similitud entre colectaslestaciones, utilizado por Yáñez-Arancibia (1978) y Sánchez-Gil et al. (1981): (Programa 46: Single Linkage Cluster Analysis, In : Davies, 1971). El programa consiste en el proceso de reunir en dos o más grupos las unidades, con base en sus atributos. Las características compartidas entre dos o más unidades (estaciones de colecta) proporcionan el grado de afinidad existente. El intervalo de similaridad va de 0 a 1 (Sánchez-Gilet al. 1981). En relación al análisis sobre el tipo de habitat y nutrición, tanto de gasterópodos como bivalvos, la información proviene de la recopilación bibliográfica correspondiente a los autores Brook (1975), Darnell (1961), Khon (1983), Purchon (1977) y García-Cubas (1981). RESULTADOS
ARREGLO SISTEMATICO
 Clase GASTROPODA Cuvier, 1791  continuación...  continuación...  continuación...  continuación... HIDROLOGÍA
SalinidadLos valores se incrementan desde condiciones limnéticas (0.0 a 0.5%.) hasta polihalinas (18 a 30%.) a medida que se aproximan hacia la zona más estrecha de ambas cuencas. La salinidad de la laguna muestra condiciones limnéticas en el extremo sur y en la zona más estrecha o canal de comunicación fue en donde se registraron los valores más altos de 20 ‰ (Tabla 1, Fig. 3). 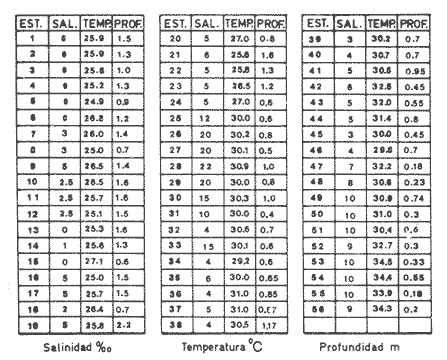 TABLA 1 VALORES DE SALINIDAD, TEMPERATURA Y PROFUNDIDAD La zona norte, que es la más extensa, presenta un comportamiento diferente por el escurrimiento continental de diversos arroyos que drenan en la porción media de la misma y por el escaso movimiento del agua, lo que determina condiciones mesohalinas de 5 a 10 ‰. La laguna tiene un promedio de 80 cm a un metro de profundidad, salvo en los canales. Sin embargo presenta salinidades bajas, a pesar de que en esta área se ubica la boca de comunicación con el mar, debido a que ésta se encontraba obturada en la época de muestreo; posteriormente se abrió por el intenso aporte de agua dulce provocado por las fuertes lluvias de verano. 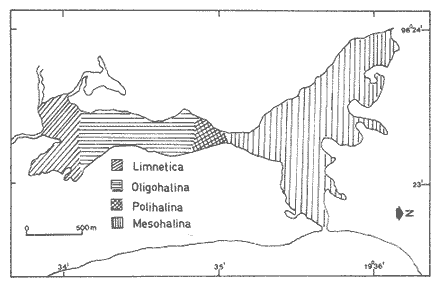 Figura 3. Distribución de salinidades. TemperaturaLos valores registrados varían de 24.9 ºC a 34.5 ºC, con un promedio de 28.8 ºC. La mínima de 24.9 ºC se obtuvo en la zona sur y la máxima de 34.5 ºC en la norte (Tabla 1). SedimentosEn la mayor parte del sistema lagunar predominan los sedimentos limo-arcillosos, a excepción del área cercana a la boca, en donde son limo-arenosos y la boca está constituida por arenas finas (Tabla 1, Fig. 4). 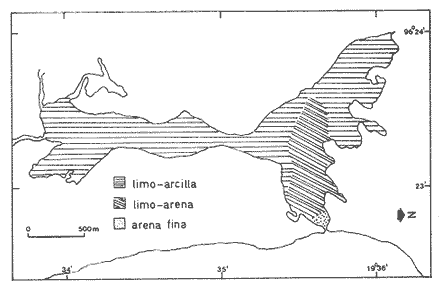 Figura 4. Distribución de los grupos de sedimentos. ASPECTOS ECOLÓGICOS
Abundancia y disutribuciónLa fauna contenida en los sedimentos fué estudiada cuantitativamente, identificando de cada muestra el número y porcentaje de individuos por estación. En la Tabla 2 se observa que la comunidad está compuesta por las Clases Gastropoda y Bivalvia, identificando 3927 ejemplares distribuídos en 29 familias, 37 géneros y 40 especies. La Clase Gastropoda predomina con 2293 individuos, en la que se incluyen 16 familias, 20 géneros y 20 especies. A la Clase Bivalvia correspondieron un total de 1634 ejemplares contenidos en 13 familias, 17 géneros y 20 especies. Las especies de gasterópodos con mayor número de organismos y amplia distribución fueronNeritina (Vitta) virginea con 1295 ejemplares, provenientes de 27 estaciones, representando el 56.4% respecto a la Clase;Cerithidea pliculosa con 419 ejemplares presentes en 24 estaciones, con un 18.2%; Acteocina canaliculata con 139 ejemplares procedentes de 21 estaciones y con un valor porcentual de 6.0%. Los bivalvos con mayor número de organismos y amplia distribución fueron los siguientes: Mytilopsis leucophaeata con 746 ejemplares, procedentes de 26 estaciones, representando el 45.3%; Ischadium recurvum con 528 individuos provenientes de 20 estaciones, con un 32.3%; Lucina pectinata con 86 ejemplares derivados de 22 estaciones y con un valor porcentual de 5.3% (Tabla 3). Del resultado del análisis sobre la distribución y abundancia a nivel familia y concentración de especies, se establecieron tres áreas (Tabla 4) caracterizadas por las familias de gasterópodos Neritidae 84%, Potamididae 72%, Pyramidellidae 66% y Acteocinidae 63%. Entre las familias de bivalvos sobresalieron Dreissenidae 75%, Lucinidae 66%, Ostreidae 63% y Mytilídae 60%. Los mayores porcentajes se localizan en el área norte, le sigue la sur y, finalmente, la central o canal de comunicación entre ambas. Es importante resaltar también la presencia de especies de importancia comercial que forman bancos y que están sujetas a explotación, como Isognomon alatus, Crassostrea virginica, Ischadium recurvum y Melongena melongena. HABITAT Y TIPO DE NUTRICIÓNLa fauna malacológica de la laguna está representada por organismos de ambientes salobres y marinos, que se colectaron únicamente en 33 de las 56 estaciones muestreadas. En la Tabla 5 se concentra el origen halino, posición respecto al sustrato y tipo de nutrición para cada una de las familias de moluscos identificadas. Con base en las salinidades registradas en el área de estudio, del total de familias de gasterópodos encontradas, el 56.2% corresponden a ambientes salobres y el 43.7% a marinos. Las especies presentes en ambiente oligohalino (0.5 - 5 %) son Neritina reclivata, Caecum pulchellum, Cerithiopsis greeni, Diastoma varium, Antillophos candei, Pyrgocytara plicosa y Turbonilla sp., correspondiéndoles un 33%, respecto a la Clase. En salinidades mesohalinas (6 - 16 %):Neritina virginea, Truncatella caribaeensis, Vitrinella helicoidea, Teinostoma biscaynense, Littoridina sphinctostoma, Cerithium lutosum, Cerithidea pliculosa Crepidula plana Melongena melongena, Nassarius vibex, Marginella lavalleeana, Odostomia impressa y Acteocina canaliculata, las cuales representan el 61%. En salinidades polihalinas (18 - 20 ‰) sólo se encuentra Cingula floridana, con un 4%. En relación al habitat, el 62.5% son epifaunales, el 25% seminfaunales y el 12.5% infaunales. Respecto al tipo de nutrición, el 43.7% son carnívoros, el 25% colectores de partículas orgánicas depositadas, el 18.7% herbívoros, el 6.2% colectores de partículas orgánicas en suspensión y el 6.2% son parásitas (Fig. 5). 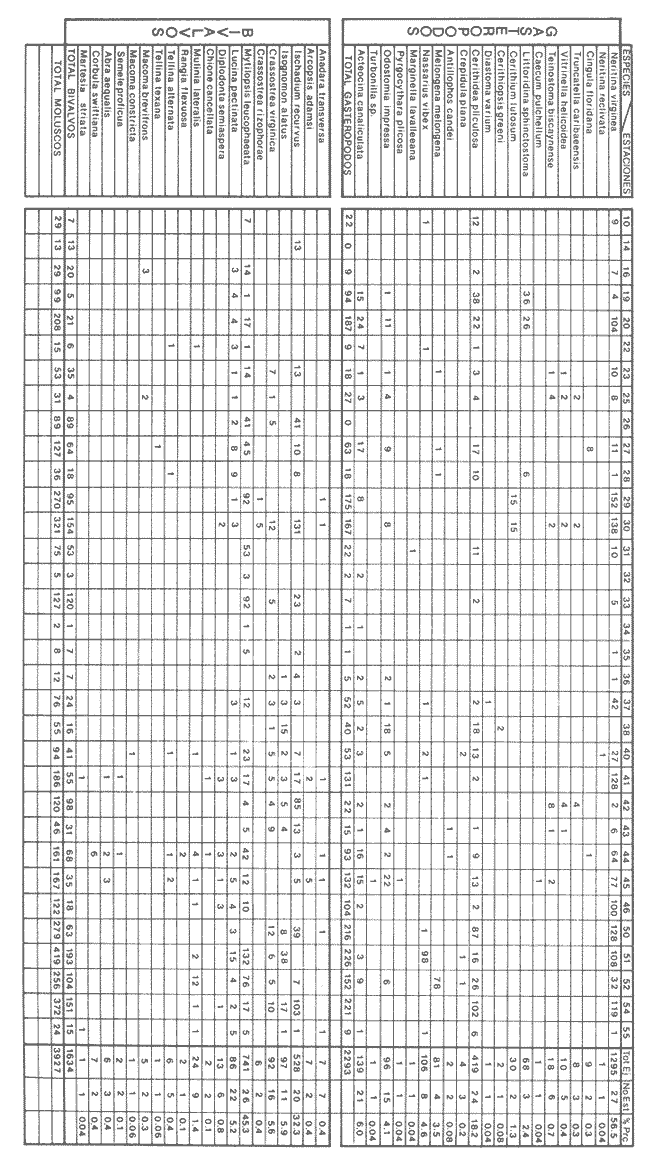 TABLA 2 CONCENTRACIÓN DE NÚMERO PARCIAL Y TOTAL DE EJEMPLARES POR ESTACIÓN DE GASTERÓPODOS Y BIVALVOS 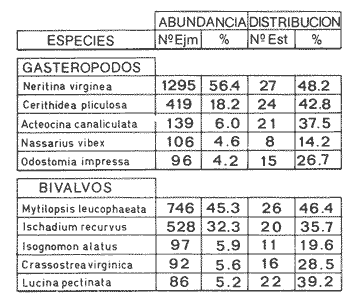 TABLA 3 ESPECIES DE GASTERÓPODOS Y BIVALVOS 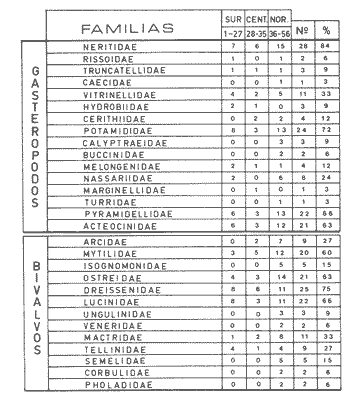 TABLA 4 DISTRIBUCIÓN DE FAMILIAS POR ÁREAS De acuerdo a las salinidades obtenidas en el área, del total de familias de bivalvos, el 69% son salobres y el 30% marinos. Dentro de éstas, ocurren tres especies en salinidades oligohalinas (0.5 - 5 %o): Arcopsis adamsi, Chione cancellata y Rangia flexuosa, las cuales representan el 15%. En salinidades mesohalinas (5 - 10 %o) 16 especies: Anadara transversa, Ischadium recurvum, Isognomon alatus, Crassostrea virginica, C. rhizophorae, Mytilopsis leucophaeata, Lucina pectinata, Diplodonta semiaspera, Mulinia lateralis, Tellina alternata, Macoma brevifrons, M. constricta, Semele proficua, Abra aequalis, Corbula swiftiana y Martesia striata, correspondiéndoles un 80%. En salinidades polihalinas (18 -25 %o) una:Tellina texana, con un 5%. 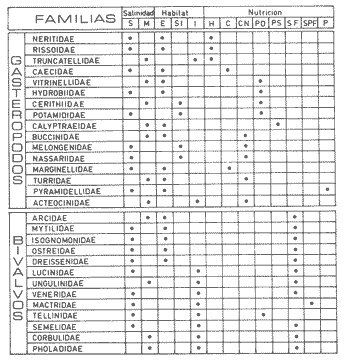 TABLA 5 CARACTERÍSTICAS DEL TIPO DE HABITAT NUTRICIÓN Y SALINIDAD DE FAMILIAS DE GASTERÓPODOS Y BIVALVOS. S=SALOBRES, E=EPIFAUNALES, H=HERVÍVOROS, PS=COLECT. PART. ORG. ENSUSPENSIÓN, M=MARINOS, SI=SEMIFAUNALES, C=CARNÍVOROS, SF=SUSPENSÍVOROS-FILTRADOS,I=INFAUNALES, CN=CARNIV.-S, PD=COLECT. PART. ORG. DEPOSITADAS, SPF=SAPRÓFAGOSFILTRADOS, P=PARÁSITOS En relación al habitat, el 61.5% corresponden a formas infaunales y el 38.4% epifaunales. Según el tipo de nutrición, el 84.6% resultaron suspensivoros filtradores, el 7.6% saprófagos filtradores y el 7.6% se alimentan de materia orgánica depositada (Fig. 6). DiversidadSe sabe que dos componentes están combinados en la fórmula del índice de diversidad (H') de Shannon-Wiener: el número de especies y la equitatividad. Para obtener información global de la comunidad que se está estudiando y adoptar estos procedimientos como marco de referencia, previo al análisis de la diversidad, se analiza primeramente cómo se distribuyen el número de especies y ejemplares de ambas clases en las distintas estaciones o muestras. El número de ejemplares varía de 2 (estación 34) a 419 (estación 51) (Fig. 7). 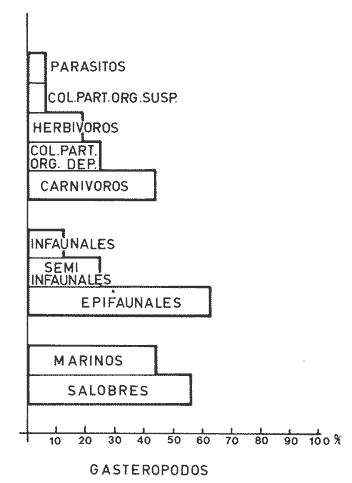 Figura 5. Habitat, salinidad y nutrición de familias de gasterópodos. Para determinar la validez del muestreo se elaboró una gráfica correspondiente al área mínima considerando el número de estaciones en donde se colectaron moluscos. Aproximadamente en la estación 44 aparece el 90% del total de las especies, posteriormente el incremento de nuevas especies es poco significativo, manteniendo el mismo número hasta la estación 55 (Fig. 8). Brower y Zar (1977) proponen una serie de gráficas en las que se encuentran varios tipos de curvas, llamadas de abundancia relativa o dominancia y diversidad, cuya finalidad es la de agrupar a especies dominantes y comunes. Utilizando los valores de la comunidad en estudio y con base en lo propuesto por los autores anteriormente mencionados, se encontró que los datos permiten reconocer que la presencia de especies dominantes es baja para la comunidad en estudio (Fig. 9). 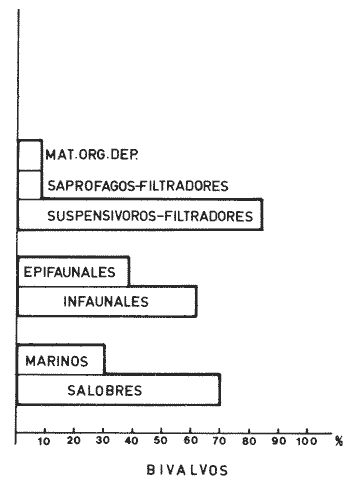 Figura 6. Habitat, salinidad y nutrición de familias de bivalvos. 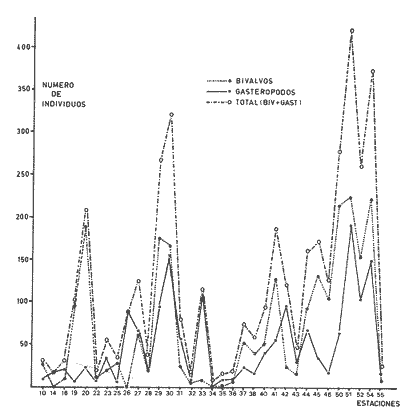 Figura 7. Número total de ejemplares de gasterópodos y bivalvos por estación. Existen varias formas de estimar el valor de la diversidad de una comunidad, sin embargo es conveniente que la medición de esta característica, por cualquier método que se estime, dé un valor directamente proporcional al número de especies ponderado, por el número de ejemplares presentes en la muestra (Chávez, 1979). Tomando en cuenta cada estación, se obtuvieron los valores de índice de diversidad (H'), diversidad máxima (H' máx) y equitatividad (J'), los cuales se analizan para cada una de las clases de moluscos y para la comunidad en conjunto (Tabla 6). 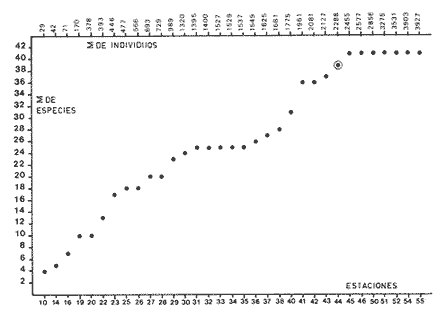 Figura 8. Curva del área mínima. 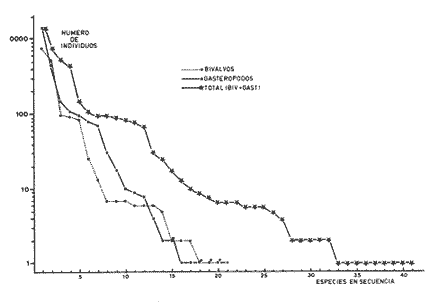 Figura 9. Curva de abundancia relativa o dominancia diversidad de especies de gasterópodos y bivalvos.  TABLA 6 VALORES DEL ÍNDICE DE DIVERSIDAD (H'max) Y DIVERSIDAD MÁXIMA (H'max) Y EQUITABILIDAD (J') DE GASTERÓPODOS, BIVALVOS Y POBLACIÓN TOTAL Para la Clase Gastropoda: Indice de diversidad (H') = 2.1 Diversidad máxima (H'máx) = 4.3 Equitatividad (J') = 0.49 El índice de diversidad fluctúa entre 0 (estaciones 32, 34, 35) y 2.6 (estación 25) como mínimo y máximo respectivamente. Para la Clase Bivalvia: Indice de diversidad (H') = 2.1 Diversidad máxima (H'máx) = 4.3 Equitatividad (J') = 0.49 El índice de diversidad presenta un valor mínimo de 0 (estaciones 10, 14, 31, 32, 34) y un máximo de 2.7 (estaciones 41 y 45). La diversidad general presenta los siguientes valores: H' = 3.1 H' máx = 5.3 J' = 0.58 El índice de diversidad mínimo fue de 0.97 (estación 32), el máximo de 3.0 (estación 25); la J' el mínimo fue de 0.38 (estación 46) y el máximo de 1.0 (estación .34) (Fig. 10). 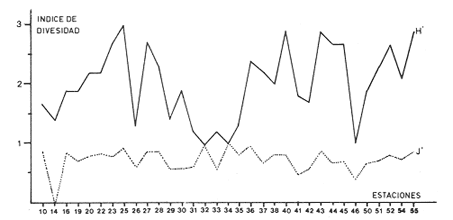 Figura 10. Curva de valores del índice de diversidad general. El análisis numérico de la diversidad por clases resultó similar, ya que el número total de especies es semejante. Debido a esta circunstancia y por considerar que los valores de diversidad por sí solos tienen poco significado, se trató de establecer alguna posible relación con los parámetros hidrológicos como la salinidad y temperatura del agua. El resultado con respecto a los parámetros anteriormente mencionados es poco claro y denota que la temperatura no presenta cambios drásticos, manteniéndose una diferencia de 8ºC entre la mínima y la máxima. La salinidad registra cambios que van desde condiciones limnéticas hasta polihalinas. El análisis independiente de cada uno de los factores antes señalados (S ‰ y TºC) refleja cierta influencia de éstos sobre la comunidad, mientras que en conjunto su acción resulta más evidente (Fig. 11). 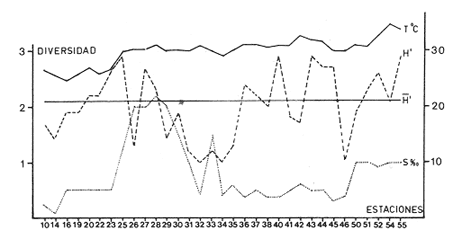 Figura 11. Curva de valores del índice de diversidad general con relación a los valores de Tº y S %o. AfinidadEste análisis consiste en comparar sucesivamente unas estaciones con otras, con base en el número de especies comunes presentes en cada una de ellas. Posteriormente se determina el porcentaje de afinidad entre las estaciones, concentrando los resultados en un diagrama de enrejado. Para ubicar las estaciones que resulten con el menor o mayor grado de afinidad para las dos clases de moluscos, se establecieron rangos de afinidad que van de 0-24, 25-49, 50-74, 75-100. La afinidad faunística resultante de asociar una estación con otra estará dada por el mayor o menor índice. Así, algunas estaciones que se encuentran en los intervalos menores a 50 presentan pocas especies comunes y aquéllas en las cuales el rango es superior a 50 tienen una mayor afinidad. Para los gasterópodos, el intervalo de 50-74 ocupa el porcentaje mayor (37.8%), el de 25-49 un 32.7%, el de 0-24 un 18.7% y el de 75-100 un 10.6% (Fig. 12). Para los bivalvos el rango de 25-49 fue el mayor con 39.3%, el de 50-74 representó un 34.6%, el de 0-24 un 16.8% y el de 75-100 un 9.0% (Fig. 12). En general se observan diferentes valores porcentuales, los cuales reflejan que la mayor afinidad se presenta en los gasterópodos. Similitud del habitatEl ánalisis "cluster" se realizó para las dos clases de moluscos, con el objeto de identificar estaciones ecológicamente similares. Los dendrogramas describen el comportamiento de grupos de estaciones, para la época en la cual se efectuó el muestreo (otoño). Los valores de similitud cercanos o iguales a 1.0 se presentan en estaciones con características comunes. Así, en las figuras 14 y 15 se concentran los resultados de este análisis para las Clases Gastropoda y Bivalvia, respectivamente. Similitud de especiesEl ánalisis "cluster" para las especies de las dos clases de moluscos se basó en la composición, distribución y abundancia numérica de las mismas. En el dendrograma por presencia-ausencia de especies de gasterópodos, el valor en donde se reunieron todas las especies fue de 0.88 de similitud, formando varios grupos: uno con un valor de 0.95 en donde aparecen 18 especies, de las cuales 3 son las más abundantes y ampliamente distribuidas; otro en el nivel de 0.97 con 2 y el nivel de 1.0 con tres especies (Fig. 16). 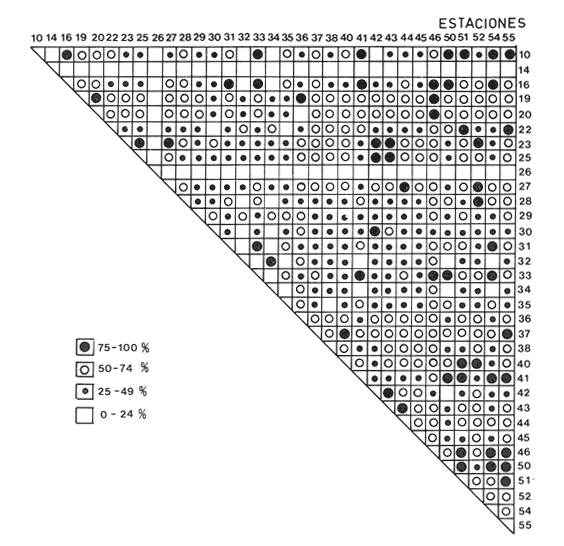 Figura 12. Diagrama de enrejado a la afinidad de gasterópodos. Por lo que respecta a los bivalvos, el nivel en donde se acumularon todas las especies fue de 0.63 de similitud (Fig. 17). En este gráfico no aparecen grandes grupos, sino conjuntos pequeños, en donde se repartieron tanto las especies dominantes por su abundancia y distribución como las no dominantes. Conclusiones1. La comunidad presenta un grupo de especies que por su abundancia y distribución caracteriza a la laguna: Neritina virginea Cérithidea pliculosa, Acteocina canaliculata, Mytilopsis leucophaeata, Ischadium recurvum y Lucina pectinata. 2. La salinidad y temperatura del agua de la laguna son factores que influyen en la distribución de la fauna malacológica. 3. La mayor concentración de especies se obtuvo a partir del canal de comunicación de las cuencas hacia la zona norte, en donde el sustrato dominante es limo-arcilla, disminuyendo ésta en el de limo-arena y arena fina. 4. La mayoría de las especies de gasterópodos son epifaunales y carnívoros, los bivalvos epifaunales y suspensívoros filtradores, concentrándose en salinidades mesohalinas. 5. La diversidad calculada para las dos clases de moluscos presentó valores semejantes, debido a que el número total de especies y ejemplares es similar y la presencia de especies dominantes es baja. 6. Del análisis de la afinidad faunística en las dos clases de moluscos, los intervalos más frecuentes fueron de 50-74 con porcentaje de 37.8% para los gasterópodos, y de 25-49 con 39.3% para los bivalvos. 7. El análisis de similitud del habitat para gasterópodos y bivalvos presenta grupos de estaciones bien definidos, variando los valores dependiendo del área en donde se asocien. 8. En el análisis "cluster" para las especies de gasterópodos se distinguen cuatro conjuntos, destacando el que reunió a tres especies en el nivel de 1.0 y otro en el nivel de 0.95 con 8 especies. Dentro de los bivalvos se clasificaron 7 grupos con pocas especies, concentrándose los valores de similitud en los niveles de 0.88 y 1.0. 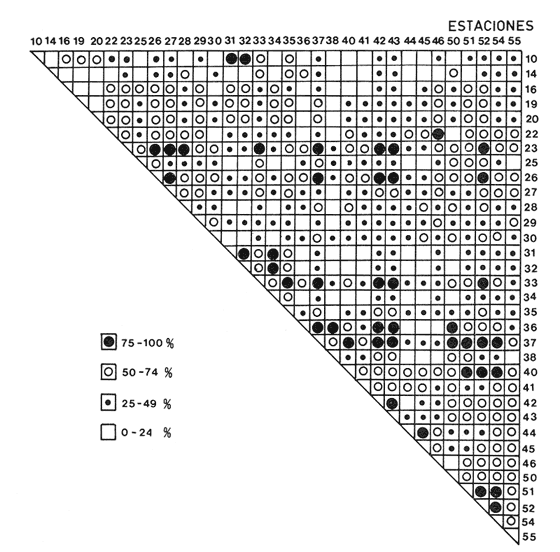 Figura 13. Diagrama de enrejado a la afinidad de bivalvos. 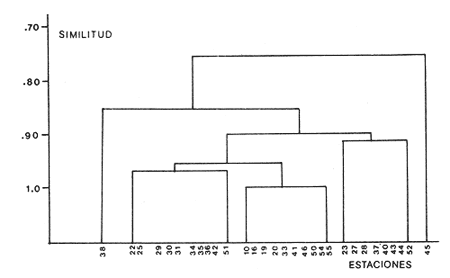 Figura 14. Dendrograma de agrupamiento de estaciones de gasterópodos 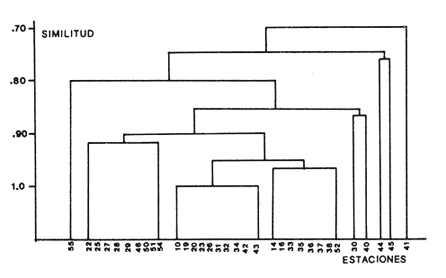 Figura 15. Dendrograma de agrupamiento de estaciones de bivalvos. 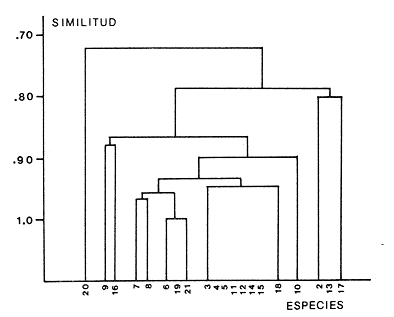 Figura 16. Dendrograma de presencia-ausencia de especie de gasterópodos. 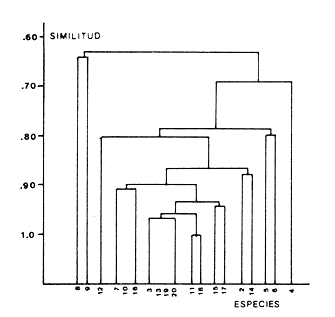 Figura 17. Dendrograma de presencia-ausencia de especie de bivalvos. AgradecimientosLos autores desean expresar su agradecimiento a Vicente Antolí Figuerola y Francisco Escobar de la Llata por la participación en los muestreos, preparación de material y valiosos comentarios. A Martha Reguero Reza por contribuir en la redacción y revisión crítica del manuscrito. A Margarito Alvarez Rubio por un asesoramiento estadístico y a los estudiantes de Biología de Campo de la Facultad de Ciencias de la UNAM, por su entusiasta colaboración. LITERATURAABBOTT, R.T. y H.S. LADD, A new brackish water gastropod from texas (Amnicolidae: Litioridina). J Wash. Ac. Sci. 1951335-338, 12 figs.41 10 ABURTO, A.M., Tesis profesional, Contribución al estudio de la fauna bentónica y sus variaciones estacionales en la laguna de la Mancha, Municipio de Actopan, Veracruz. Fac. de Biología, Universidad Veracruzana197420 ADAMS, C.B., Bost. J. Nat. Hist., Observations on some species of the marine shells; of Massachusetts, with descriptions of five species.1839 262-288, lám. 4 22 ADAMS, C.B., Descriptions of supposed new species of marine shells wich inhabit Jamaica. Contr. Conch. N. Y 1850a.50-55, 56-68,69-75,76-108,109-122.1, 1, 1, 1, 1. 3, 4, 5, 6, 7. ADAMS, C.B. Amherst Mass. Monograph of Vitrinella, a new genus of new species of Turbinidae.1850b1-10 ADAMS, C.B., Descriptions of new species of Corbula from Jamaica. Contr.. Conch,1852233-241 12 ANDREWS, J. Sells and Shores of Texas. University of Texas Press. Austin y London,1977365 ANTOLI y A. GARCIA-CUBAS, An. Inst. Cien. del Mar y Limnol. Univ. Nal. Autón. México, Sistemática y Ecología de moluscos en las lagunas costeras Carmen y Machona, Tabasco, México.1985145-19812 1 BRILLOUIN, L., Science and Information Theory Academic Press, New York, 1962325 BROOK, J.M., Ph. D. Disseilation, Some aspects of the trophic relative ships among the higher consumers in seagrass comunity (Thalassia testudinum) in Cord Saund, Florida. University of Miami, 1975133 BROWER, J.E. y H. ZAR, Field and Laboratory methods for general Ecology. W.M.L. Brown. Co. Publishers1977133-142 BRUGUIERE, J. G., In: En Enciclopedia opédie Méthodique., Historie Naturelle des Vers, 1789-92 1-1344, 345-757 1, 1.1, 2. CONRAD, T.A.,Descripfions of fifteen new species of recent and three of fossil shells, chiefly from the coast of the United States. J Ac. Nat. Sci Phila.,1831 256-268, lám 11, figs. 1-206 2 CONRAD, T.A., Observations on the genus Gnathodón, with descriptions of the new species. Amer. Jour. Sci. 183992, 1 fig.38 1 CHÁVEZ, E.A., An. Centro. Cienc. del Mary Limnol, Análisis de la comunidad de una laguna costera en la costa sur occidental de México.Univ. Nal. Autón. México,197915-446 2 CZECHANOWSKI, J., Zarys metod stalystycwyck. Wendego Warsow, 191375 DALI, W.H., Bull. Mus. Comp. Zool, Reports on the resuits of dredging ... in the Gulf of Mexico (1877-78) and the Caribbean Sea (1879-1889) by the...Steamer Blake, 29. Report on the mollusca, part 1, Brachiopoda and Pelecypoda. 1886171-318, láms.1-9 DALL, W.H., Synopsis of the familyTellinidae and of the North American species. Proc. U.S. Nat. Mus., 1900285-326, láms. 2-423 1210 DAVIES, R-G., Computer Programing in Cuantitative Biology. Academie Press Inc., London1971420-430 DARNELL, R.M., Ecology. Trophic spectrum of on estuarine community, based on studies of lake Portehartrain, Louisiana.1961553-56842 3 DÍAZ E.L, Tesis profesional, Estudios cromosómicos en una población de moluscos bivalyos de la especie Isognomon alatus. Fac. Ciencias, Universidad Nacional Autónoma de México,198045 GARCíA, E., Modificaciones al Sistema de Clasificación Climática de Kóppen. D.F.,México, 1964 71, 9 gráf. 2 map. GARCíA-CUBAS, A., Moluscos de un sistema lagunar tropical en el sur del Golfo de México (Laguna de Términos, Campeche). Inst. Cíenc. del Mar y Limnol. Univ. Nal. Autór; México,Públ. Esp.,19811-182 5 GMELIN, J.F., Leipzing, Caroli a Linné Sistema Naturae per Regna tria Naturae, 13 Ed., 17913021-39101 6 GUILDING, L, Observations on the zoology of the Caribbean Islands. J Zool., 1828527-5443 12 KEEN, M.A., Sea Shells of Tropical West America Marine Mollusks from Baja California lo Perú. Standford University Press, 2 ed.,California,1971 1065, 22 láms. KHON, AJ., Feeding bilogy of Gastropods. In: The Mollusca, Academic Press Inc, 19835355 2 LINNAEUS, C., Systema naturae per regna tria naturae. Edito Decima reformata.Stockholm,17581-824 1 LINNAEUS, C., Systema naturae per regna tria naturea. Regnum animale Editio Duodecima, reformata. Stockholm, 1766-67 1-532, 533-1327 11766, 1767 MAC ARTHUIR, R., Patterns of species Diversity. Biol. Ref, 1865510-533 40 MARGALEF, R., La teoría de la información en ecología. Mem. R Acad Cienc ArtesBarcelona19577932 13 MARGALEF, Ecoloy. Ed. Omega, Barcelona,19577932 13 MENKE,K.T., Verzeichniss der anschnlicehen Conchylien Sammlung des Freiherrn von Malburg .. Pyrmonti, H. Gelpke: 18291-123 MENKE, K.T., Synopsis methodica molluscorum generum omnium et specierumn earum, quae in Museo menkeano, adservatur; cum synonymia critica et novarum specierum diagnosibus: Pyrmonti: H. Gelpke 18301-168 MORA, C.P., Tesis profesional. Contribución al conocimiento de la variación estaciones de la fauna astrológica y su posible relación con los factores ambientales en la laguna de la Mancha, Municipio de Actopan, Veracruz. Fac. de Biología Universidad Veracruzana. 197783 MOORE, R-G., Geol. Soc. Treatise on Invertebrados Paleontology Mollusca 6. American and University of Kansas Press, NewYork, 19691-952, 3-95, 3-1224 1 y 2 NEWELI, N.D. Classification of the Bivalvia. Amer. Mus. Nov.,1965 1-24, figs. 1-3 2206 NOVELO, A.R., Biótica La vegetación de la estación biológica "El Morro" de la Mancha, Veracruz. 19789-233 1 ORBIGNY, A.d'. Mollusques Histoire Persigue, Volquete et Naturelle de l´Ile de Cuba, In: R. de la Sagra Ed, 1841-46 1-264, 1-380 1, 2. PFIEIFFER, L, Uebersicht der in Januer, februar und Marz auf Cuba gesammelten Molluske. Arch. für Naturgeschichte, 1840250-2616 1 PHIILIPPI, R.A., In: Arch für. Naturgeschichte 1836-412-7 PIELOU, E.C., The measurement of diversity in different types of biological collections.J Theoret. Biol.1966a141-144 13 PIELOU, E.C., Species-Diversity and Pattern-Diversity in the study of Ecological Succession. J. Empeores Biol. 1966b.370-383 10 PILSBRY, H.A. y T.L. McGINTY, NautilusCyclostrematidae and Vitrincilidae of Florida. pt I, 1945 1-13, láms. 1-259 1 PULTENEY, R., Catalogues of die Birds, Shells, and e oí talle more rara Praxis oí Dorseishire. From Hutchins, Historia oí chal country. 2 Ed.,London,1977560 PURCHON, R-D., The Biology of the Mollusca. By Biddles, Ltd., Guilford, Surbay, 1977560 RAFINESQUE, C.S., Monographie des coquilles bivalves et fluviatiles de la rivifte Ohio. Ann. Gen. Sei. Phys.Bruxelles1820305-322 5 REHDEP, H.A., New marina mollusks from the lean Region. Proc. U.S. Has. Marqués., 1943 187-203, láms. 19-2093 3161 REEVE, LA., Conchologia Systematica or complete system of Conchology. London,1841-42 1-195, láms. 1-129, 1-337, láms. 130-300 1, 2. SÁNCHEZ-GIL., P., A. YÁÑEZ-ARANCIBIA y F. AMEZCUA LINARES An. Ins.Cienc. del Mar y Limnol. Diversidad, distribución y abundancia de las especies y poblaciones de peces demersales de la sonda de Campeche. (verano 1978). Univ. Nal. Autón. México,1981209-2408 SAY, T., PhilaAn Account of some of the marine shells of the United States. J. Ac. Nat. Sci.1822 221-248, 257-276, 302-322 2, 2. 1, 2. SAY, T., Phila., Descriptions of marine Shells recently discovered on coast of the United States. J. Ac. Nat. Sci.1826207-2215 1 SAY, T., American Conchology, or Descriptions of the Shells of North America New Harmony, Indiana.1830-34 1-258, 68 láms. 1-7 SHANNON, C.E. y N. AMBIENTES, The mathematical theory oí comuncation University of Illinois Press, Urbana,1963117 SIMPSON, E.H., Naturae, Measurement of diversity. 1949163-688 STIMPSON, W., Monograph of the genus Caecum in the United States. Proc. Boston Soc. Has. Pass., 1851112-113 4 THIELE, J., Jena. Handbuch der systernatischen Weichtierkunde. 1934-35779-1154, figs.784-8792 VÁZQUEZ, T.M. y C. MARQUEN, An. Inst. Biol. Univ. Nal. Autón. México. Algunos aspectos ecológicosy la alimentación de la "garza garrapatera"Bulbucus ibis ibis (Lance) en la región de "" Mancha", Ser. Zoología Actopan, Veracruz.1972 89-116, 10 figs. 2 maps, 6 tabs.43 1 YÁÑEZ-ARANCIBIA, A., Centro Cienc. del Mar y Limnol. Taxonomía, analogía y estructura de las comunidades de peces en lagunas costeras con bocas efímeras del Pacífico de México.Univ. Nal. Autón. México, Publ. Esp. 19781-306 2 YOUNG, E.M., Tesis profesional,Identificación y distribución de los invertebrados macroscópicos del litoral rocoso en la playa Paraíso, Municipio de Actopan, Veracruz. Fac. de Biología, Universidad Veracruzana, 197840
 Lámina 1. Fig. 1. Neritina (Vitta) virginea (Linnaeus, 1758) Fig. 2. Neritina (Vitta) reclivata (Say, 1822) Fig. 3. Cinngula (Microdochus) floridana (Redher, 1943) Fig. 4. Truncatella caribaeensis Reeve, 1842 Fig. 5. Caecum (Caecum) pulchellum Stimpson, 1851 Fig. 6. Vitrinella helicoidea C. B. Adams, 1850 Fig. 7. Teinostoma biscaynense Pilsbry y Mc Ginty, 1945 Fig. 8. Littoridina (Texadina) Sphinctostoma Abbot y Ladd, 1951 Fig. 9. Cerithium lutosum Menke, 1828 Fig. 10. Cerithiopsis greeni (C. B. Adams, 1939) Fig. 11. Diastoma (Bittium) varium (Pfeifer, 1840) 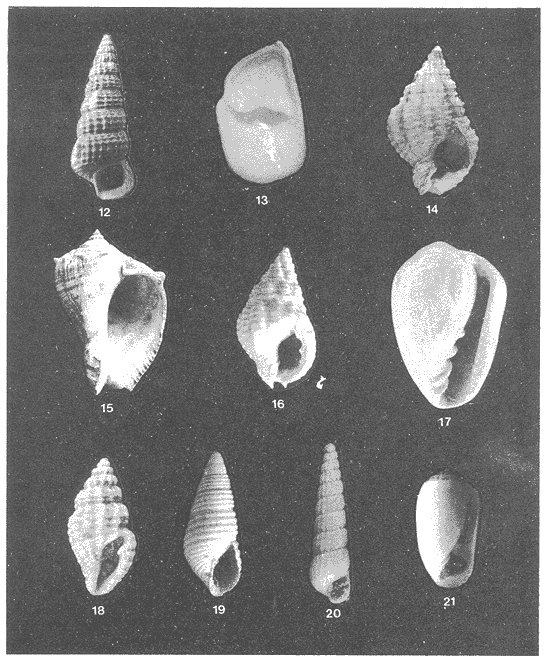 Lámina 2. Fig. 12. Cerithidea (Cerithideopsis) plículosa (Meenke, 1829) Fig. 13. Crepidula (Tanacus) plana Say, 1822 Fig. 14. Antillophos candei (d'Orbigny, 1842) Fig. 15. Melongena (Melongena) melongena (Linnaeus, 1758) Fig. 16. Nassarius (Nassarius) vibex (Say, 1822) Fig. 17. Marginella (Gibberuda) lavalleeana d'Orbigny, 1842 Fig. 18. Pyrgocythara plicosa (C. B. Adams, 1850) Fig. 19. Odostomia (Menestho) impressa (Say, 1822) Fig. 20. Turbollina sp Fig. 21. Acteocina canaliculata (Say, 1826) 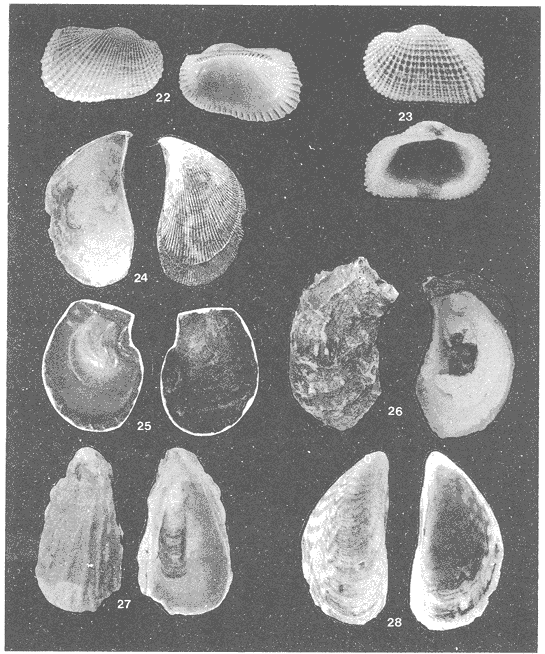 Lámina 3. Fig. 22. Anadara (Larkinia) transversa (Say, 1822) Fig. 23. Arcopsis adamsi (Dall, 1886) Fig. 24. Ischadium recurvus (Rafinesque, 1820) Fig. 25. Isognomon alatus (Gmelin, 1791) Fig. 26. Crassostrea virginica (Gelin, 1791) Fig. 27. Crassostrea rhizophorae (Guilding, 1828)Fig. 28. Mytilopsis leucophaeata (Conrad, 1831)  Lámina 4. Fig. 29. Lucina (Phacoides)pectinata (Gmelin, 1791) Fig. 30. Diplodonta (Phlyctiderma) semiaspera Philippi, 1836 Fig. 31 Chione (Chione) Cancellana Linnaeus. 1767 Fig. 32. Mulinia lateralis Say, 1822 Fig. 33. Rangia (Rangianella) flexuosa Conrad, 1839 Fig. 34. Tellina (Eurytellina) alternata Say, 1882  Lámina 5. Fig. 35. Tellina (Angulus) texana Dall, 1900 Fig. 36. Macoma (Psammacoma) brevifrons Say, 1834 Fig. 37. Macoma (Austromacoma) constricta Bruguiere, 1799 Fig. 38. Semele proficus Pulteney, 1799 Fig. 39. Abra aequalis Say, 1822 Fig. 40. Corbula (Caryocorbula) swiftiana C.B. Adams, 1852 Fig. 41. Martesia striata Linnacus, 1767
|

