|
DISTRIBUCIÓN DE BACTERIAS EN LOS SEDIMENTOS DE LA
REGIÓN SUR DEL GOLFO DE CALIFORNIA, MÉXICO
Trabajo recibido
el 19 de junio de 1986 y aceptado para su publicación el 16 de marzo de
1987.
M.J Ferrara Guerrero
J.M. Romero Jarero
S. Saitz Ceballos
M.T. Nuñez Cardona
F.J. Villena Irive
Universidad Nacional Autónoma de
México, Instituto de Ciencias del Mar y Limnología,.
Contribución 615 del nstituto de Ciencias del Mar y Limnología,
UNAM.
La distribución vertical de las poblaciones de
bacterias heterótrofas aeróbicas y sulfo-reductoras en los
sedimentos del Golfo de California, fueron estudiados durante la
realización del Crucero Oceanográfico PALEO-2 (01-13 agosto
1983). El área estudiada está comprendida entre los 26° 13'
latitud norte y 111° 13' longitud oeste hasta los 21° 40' latitud norte
y 110° 04' longitud oeste. Los conteos fueron realizados por métodos
indirectos del sembrado en placa y métodos directos de tinción
con naranja de acridina para la obtención de la biomasa bacteriana. Las
poblaciones bacterianas heterótofas presentaron una fluctuación
de entre 105 a 106
bacterias por gramo de sedimento húmedo en la capa más
superficial de la columna sedimentaria sin mostrar ningún cambio
significativo a causa de la presión hidrostática causada por la
profundidad a la que fueron obtenidos los núcleos (640 a 3,400 m). La
biomasa bacteriana presentó una relación inversa con la
granulometría del sedimento de las diferentes zonas. La población
de bacterias sulfo-reductoras apareció en todos los núcleos
estudiados, haciendo evidente el carácter reductor de la zona de
estudio, por la presencia de sulfatos.
La distribution verticale des populations
bactériennes héterotrophes aérobies et
sulforécutrices dans les sediments du Golfé de Califonie a
été estudiée est de la Campagne Océanographique
PALEO-2 (01-13 aout 1983). La zone éstudiée est située
entre 26° 13' de latitude nord et 111° 13' de longitude ouest et
21° 40' de latitude nord et 110°04'de longitude ouest. Les comptages
ont eté réalisés par méthodes indirectes sur plaque
et par méthodes directes de coloration par orange acrydyne pour l
obtention de la biomasse bactérienne. Les populations
bactériennes hétérotrophes présentent une
fluctuation entre 105 et
106 bacteries para gramine de sédiment humide
dans les permiers centimetres de la colonne sédimentaire, sans faire
apparaitre aucun changement significatif a la pression hydrostatique
provoquée para la profondeur du prelevernent des carottes (640 a 3,400
m). La biomasse bactérienne presente une relation inverse avec la
granulimétrie du sediment dans les différentes zones. La
polulation de bacteries sulfo-reductrices a eté trouvee dans tous les
carottes etudiés, montrant a l'evidence le caractere reducteur de la
zone estudiée, du fait de la présence de sulfates.
El sistema marino profundo se caracteriza por sus bajas temperaturas (4 °C), sus diferentes presiones hidrostáticas (por arriba de las 1000 at.) y su bajo contenido de materia orgánica. Debido a este último factor, se considera al océano abierto como una región ultra-oligotrófica (Morita, 1980). La ocurrencia y densidad poblacional de las bacterias marinas son afectadas por asociaciones con otros organismos, agregaciones y adherencias a partículas, así como por la temperatura y salinidad (Hobbie, 1977). La distribución de la materia orgánica, particulada y disuelta, a profundidades de 200 m a 300 m es muy homogénea si es comparada con el medio ambiente de la plataforma continental. Los rangos son de 2 a 10 gm c/l y entre 0.35 t 70 mg c/l, respectivamente (Morita, 1980). A pesar de las características que se encuentran presentes en el océano abierto, existen microorganismos capaces de reproducirse y metabolizar en condiciones de altas presiones hidrostáticas, bajas temperaturas y las condiciones de salinidad existentes (35‰). La materia orgánica particulada hidrolizada se considera un buen sustrato para las bacterias, ya que ésta presenta proteínas refractarias que son convertidas lentamente en biomasa bacteriana. Esta capacidad de las bacterias para colonizar los dentritus produce una fuente de alimento rico en nitrógeno para los organismos detritívoros. En el proceso evolutivo de las primeras formas de vida, las bacterias han servido como alimento, ya sea ingeridas en forma individual, en agregados, en detritus o como bacterias asociadas con las partículas fecales. Al ser ingeridas las células bacterianas proveen los factores nutricionales necesarios a la macrofauna que habita en los mares profundos, especialmente cuando se reconoce que las células bacterianas son ricas en proteínas, en factores de crecimiento, en ácidos nucléicos y en ácidos grasos. Según Maeda y Taga (1974) la hidrólisis del ADN en el mar puede aportar cantidades considerables de fosfato, así como bases púricas y pirinidicas (en Lizárraga-Partida, 1979). ZoBell y Morita, 1957; Mitskevitch y Kriss, 1966; Jannasch et al., 1971; han encontrado que las bacterias marinas profundas, en condiciones de laboratorio y bajo las presiones que tenían in situ proliferan; sin embargo, presentan un crecimiento bajo en condiciones de presión atmosférica. Todos los aspectos de la actividad microbiana, incluyendo el crecimiento, respiración y procesos bioquímicos específicos, se ven afectados por las altas presiones; la presión y las bajas temperaturas, que reducen los rangos metabólicos, ayudan a la inmigración y a la especiación dentro de este ecosistema (Jannasch y Wirsen, 1973, 1977; Carlucci y Williams, 1978). Además de que el incremento de presión afecta negativamente el metabolismo de las bacterias y a su actividad enzimática, el grado de barotolerancia varía mucho de un cultivo a otro. El mayor problema que existe en el estudio de los efectos de la presión sobre el crecimiento, respiración y funciones metabólicas de las poblaciones bacterianas naturales de las profundidades marinas es el de la descompresión, la cual ocurre cuando las muestras son obtenidas con muestreadores convencionales (Tabor, 1981). El océano con sus gradientes de temperatura, presión hidrostática, salinidad y potencial redox, presenta varios tipos fisiológicos de bacterias marinas en un ambiente aparentemente adverso, y por ello es necesario la demanda de mecanismos evolutivos para su adaptación a este medio ambiente. Esta viabilidad de las especies puede expresarse en términos de crecimiento y actividad metabólica al encontrar un ambiente adecuado, sin embargo las bacterias son capaces de sobrevivir en ambientes desfavorables adquiriendo un estado de "sobrevivencia", mientras retienen al mismo tiempo, su capacidad para reconocer y utilizar un ambiente favorable. En el ambiente de las profundidades marinas, la temperatura mantiene a las células en estado latente, permitiéndoles sobrevivir (Baross et al., 1975). Liston, 1976 y Hobbie, 1977 reportaron un promedio de bacterias heterótrofas viables, en sedimentos profundos, de 1,000 bacterias por gramo de sedimento húmedo y para la columna de agua, en mares profundos, de 2 a 3 ordenes de magnitud menor; en ambos casos la población bacteriana es baja comparada con la existente en aguas costeras donde se han reportado 1ds bacterias por ml de agua y d bacterias por gramo de sedimento húmedo (Saitz, et al., 1986 en prensa). Jannasch y Jones, 1959; Watson, 1976; Williams y Carlucci, 1976; Hobbie et al., 1977 Bwden, 1977; Carlucii y Williams, 1978; Daley, 1979 y Pedrós, 1982 entre otros, han comparado métodos de estimación directa por microscopio de fluorescencia y de, cultivo en placa, demostrando que aproximadamente de un 1/3 a 1/10,000 de las células presentes, no son detectadas por los métodos de cultivo. El uso del microscopio de fluorescencia y de tinción fluorescente con naranja de acridina, permite el conteo de pequeñas bacterias; en general, esta forma de conteo puede ser utilizada como una estimación real del número total de microorganismos (Atlas, 1982). Sin embargo, la distribución de bacterias viables y no viables dentro de la población total analizada por epifluoresencia aún no se conoce. Todas las evidencias indican que el conteo directo con naranja de acridina de una medida específicamente cuantitativa del número total de bacterias, además de ser un método rápido y preciso. Se puede pensar que esta técnica mide el número de bacterias viables ya que el naranja de acridina muestra una inherente especificidad por las bacterias vivas. Bianchi et al. (1975) ha reportado entre 104 a 106 bacterias/gramo de sedimento húmedo en la película sedimentaria superficial de las grandes profundidades. Estudios de taxonomía numérica, hechos en condiciones de laboratorio, de muestras colectadas en mares profundos en una gran diversidad de localidades geográficas, han establecido que las bacterias profundas se clasifican dentro de tres grupos taxonómicamente distintos: bacterias de vida libre en la columna de agua, en la columna de sedimento y las bacterias que han sido aisladas del tracto digestivo de la macrofauna béntica. Hobbie (1977) y Tabor (1981) han reportado que el papel más importante de las bacterias que habitan las profundidades marinas, es el de flora comensal del trato digestivo de los organismos bentónicos, ya que la cantidad de materia orgánica disponible a esas profundidades es muy pequeña y los microorganismos encontrados dentro de estas condiciones no presentan una rápida utilización de los nutrientes. En la zona del Pacífico Suroriental en las troneras de Galápagos, a profundidades de 2,700 m, las bacterias obtienen la energía necesaria para sus procesos vitales del metabolismo de sustancias inorgánicas y no de la materia orgánica. Es posible que la producción primaria por quimiosíntesis, contribuya a una significativa relación de los elementos disponibles en las grandes profundidades marinas, como son los sulfuros polimetálicos y el fierro (Tait 1991) DESCRIPCIÓN DEL ÁREAEl Golfo de California es una cuenca alargada de 1,200 km. de longitud, cerrada en tres lados y abierta en su parte sur con comunicación al Oceano Pacífico; en la región central existen una cadena de islas aproximadamente de 29 latitud norte. La porción central y meridional del Golfo consiste de una serie de cuencas que incrementan su profundidad hacia el sur de 100 hasta cerca de 3000 m (Donegan y Schrader, 1982). Se encuentra localizado entre los 23 y 32° latitud norte y 115 longitud oeste. Presenta un clima continental ya que está situado entre dos zonas áridas: la península de Baja California al occidente y la porción continental mexicana al oriente (Fig. 1). Al final del invierno y principios de la primavera el clima es seco con transporte del agua superficial al sur y generando surgencias a lo largo de la costa oriental. En esta época la temperatura se acerca más a la temperatura de un mar templado. Durante el verano y principios del otoño, los vientos provenientes del sureste, cargados de humedad, provocan precipitación en la costa suroriental del golfo, el transporte de las aguas superficiales hacia el interior del golfo, generando surgencias sobre la costa occidental (Molina-Cruz, 1986; Carvacho, 1982). El Golfo en esta época alcanza, en su extremo norte, temperaturas mayores de 30 °C. 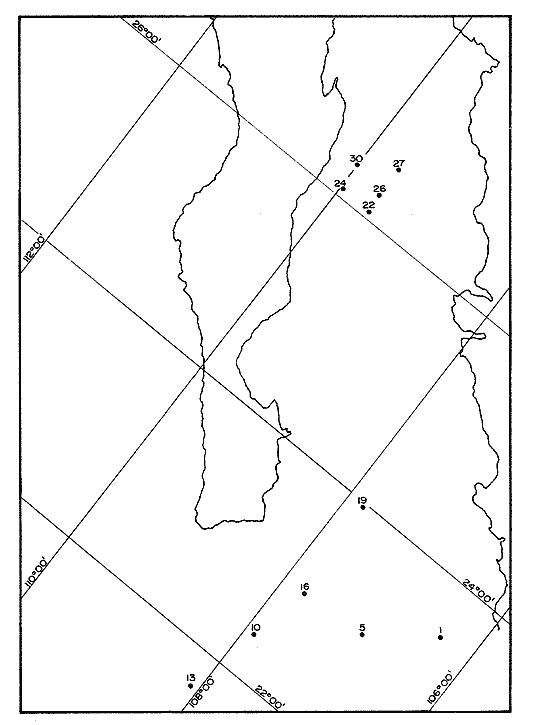 Figura 1. Localización de las estaciones de muestreo. En la región oriental de la Cuenca de Guaymas, en invierno en la región occidental de la Cuenca del Carmen, en verano, ocurren frecuentemente fenómenos se surgencias. Las surgencias de la Cuenca del Carmen son alimentadas en parte por aguas provenientes de la Corriente de California (Molina-Cruz, 1986). La mezcla de agua que ocurre en el Golfo de California, provocada por fenómenos de surgencia y por la presencia de fronteras de masas de agua que actúan en forma simila a un frente oceánico, induce la regeneración de nutrientes en la superficie y con ello el florecimiento del plancton. Esta condición produce que el talud continental del golfo y la parte norte de la Cuenca de Guaymas, principalmente alrededor de las Islas Tiburón y Angel de la Guarda, sean regiones donde hay una gran concentración de materia orgánica en los sedimentos (Molina-Cruz, 1979). En la parte sur del golfo en régimen fluvial impone un carácter terrígeno-detrital al fondo de las cuencas. La región central y meridional del golfo, presenta una banda hemipelágica laminada de sedimentos diatomaceos en una zona de mínimo oxígeno en la interfase agua-sedirnento, entre aproximadamente 450 y 800 m de profundidad (Donegan y Sclirader, 1982). Los niveles de oxígeno disuelto son bajos (0,2 ml O2/l) impidiendo el desarrollo de la infauna béntica, la bioturbación es mínima y los sedimentos no son prácticamente bioturbados. En general, el margen oeste se caracteriza por sedimentos más gruesos que el margen este (Van Andel, 1964). Debido a que existen pocos trabajos sobre las poblaciones bacterianas existen en los sedimentos del Golfo de California y, siendo ésta una zona donde los estudios de distribución y sistemática de las comunidades animales de importancia comercial, es particularmente interesante se han comenzado a realizar estudios de la distribución y caracterización de las poblaciones bacterianas en la columna de agua y sedimento en dicha zona. El objeto del presente trabajo es el de iniciar estudios sobre la distribución de grupos fisiológicos bacterianos en la columna sedimentaria con el fin de establecer las actividades microbiológicas que se llevan a efecto para la remineralización de la materia orgánica. MATERIAL Y MÉTODOSLas muestras de sedimento fueron colectados en el Golfo de California, durante la campaña oceanográfica PALEO-2 (Paleoceanograffa), que se efectuó del 1 al 13 de agosto de 1983, a bordo del buque oceanográfico EL PUMA de la Universidad Nacional Autónoma de México, entre los 26° 13' N y 111° 13' O, hasta los 21° 40' N y 110° 04' O. Bacteriológicamente, se muestrearon 11 estaciones de las 33 en que consistió el derrotero (Fig. 1). Las columnas de sedimento fueron obtenidas por medio de un nucleador de gravedad de gran diámetro (13 cm) submuestreados a bordo con ayuda de una jeringa estéril de 10 cc; las submuestras fueron obtenidas a diferentes niveles: 10, 25, 50 y 90 cm. Inmediatamente después de haber sido tomada la muestra, se hicieron diluciones 1:10, 1:100 y 1:1000 en medio mineral estéril tipo Lyman y Fleming (1940). De cada una de las diluciones se tomó una alicuota de 0.1 ml, los cuales fueron sembradas por duplicado, en cajas de petri conteniendo medio Oppenheimer 2216E y ZoBell para el caso de bacterias heterótrofas aerobicas, (el medio de cultivo para bacterias almilolóticas y una alicuota de 1 nil fue sembrada en tubos de vainille conteniendo medio de Post Gate (1966) modificado por Jacq, para bacterias sulfo-reductoras). Las cajas de petri fueron incubadas a bordo, durante 48 horas a 20 °C y los tubos para bacterias sulfo-reductoras 24 horas a 20 °C. Después del tiempo de incubación se hizo el conteo total viable. Se tomaron muestras de sedimento para determinar la biomasa bacteriana utilizando la técnica de conteo directo por microscopio de epifluorescencia y con tinción de naranja de acridina (Hobbie, Daley y Jasper, 1977); las muestras de sedimento fueron almacenadas, hasta el momento de ser utilizadas a 4 °C en frascos de vidrio de 20 cc conteniendo formol a una concentración final de 2%. Se determinó el porcentaje de carbono orgánico en los sedimentos por la técnica de Gaudette y Flight (1971). RESULTADOS Y DISCUSIÓNEn la época en que se realizaron los muestreos, la población de bacterias heterótrofas aeróbicas de los sedimentos presentó una fluctuación entre 10 5 y 10 7 bacterias por gramo de sedimento húmedo (Tabla 1) en todas las estaciones muestreadas, independientemente de la profundidad a la que el núcleo de sedimento fue tomado; con un promedio de 105 bact. g. sed. h-1. En las figuras 2, 3 y 4 se puede observar que las numeraciones más altas 106 bact. g. sed. h-1) se encuentran en la capa más superficial de la columna sedimentaria, presentando una pequeña disminución en el subsuelo, entre los 15 y 50 cm (105 bact. g sed. h-1), con excepción de las estaciones 5, 26 y 27 en las que las poblaciones bacterianas permanecen constantes a lo largo de los 90 cm que fueron submuestreados en la columna sedimentaria y las estaciones 13 y 24 donde el proceso es inverso y la población aumenta con la profundidad. Los resultados obtenidos coinciden con lo reportado por Bordovsky (1965) y Bianchi et al. (1971,1973 y 1975) para sedimentos profundos y sedimentos litorales quienes, también observaron que en los primeros 50 cm de sedimento las bacterias aeróbicas son de aproximadamente 104 bact. g. sed. h-1. En este estudio se puede observar que la diferencia de profundidades a las que fueron tomados los medios (entre 640 y 3,400 m) no afectan de una manera considerable a la población bacteriana heterótrofa aeróbica de los sedimentos, debido a que son bacterias que presentan baro y termotolerantes, además de una gran adaptación a las condiciones existentes a estas profundidades (Jannasch y Wirsen, 1977) y a que el Golfo de California es una zona que en su parte sur presenta un régimen pluvial que da carácter terrígenodetrital al fondo de las cuencas y a que la región occidental de la Cuenca del Carmen, durante el verano, es una zona de surgencias. También se observó que el número de bacterias heterótrofas aeróbicas no varía significativamente en los estratos más profundos de la columna sedimentaria (50 y 90 cm). Estas diferencias en variaciones de la población podría deberse a que la textura del sedimento no presenta un perfil homogéneo (Figs. 2, 3 y 4). Consecuentemente en acuerdo con las observaciones de Rodina, (1960); Volkmann y Oppenheimer, (1962); y Hendrich y Farrington, (1984). En los sedimentos de grano fino, las bacterias se encuentran absorbidas, mientras que en las arenas gruesas se encuentran en estado libre. Es posible, por ello, que en las estaciones 13, 19 y 24 se observe un aumento en el número de bacterias después de los 50 cm de profundidad, indicándonos, que tal vez, en estas capas sedimentarias la granulometría del sedimento presenta una phi mayor que en las capas superficiales. (Tabla 1, Figs. 1, 2). En cuanto a la distribución de la materia orgánica y su relación con la biomasa bacteriana se puede observar en la Tabla 1, que el porcentaje de carbón orgánico en los sedimentos es muy alto debido al aporte planctónico que existe en esta zona, a causa de las surgencias que aparecen en esta época del año. Todo esto, aunado a que el tipo de sedimento en esta zona es de arenas muy finas y limos (Van Andel, 1964) y al aporte de una gran cantidad de terrígenos-detritales al fondo de las cuencas en la parte sur del Golfo por los ríos Presidio y Piaxtla, explica los altos valores obtenidos, los que van desde 14.47% hasta 3.48% de carbón orgánico y una biomasa bacteriana que varía de 19.21 hasta 0.226 mg C/cm3 (Tabla 1, Figs. 2, 3). En la estación 13, a pesar de que el contenido de carbón orgánico es alto (8.94%), la biomasa bacteriana es muy baja, tal vez debido a que en esta zona el sedimento este compuesto de arenas gruesas que permitan el libre movimiento de las bacterias hacia las cepas más profundas. En el resto de las estaciones de la zona sur, la biomasa bacteriana es alta, debido a que los sedimentos son de tipo arcillo-limoso, lo que permite absorción, tanto de la materia orgánica como de las bacterias y de las enzimas necesarias para los procesos de descomposición de la materia orgánica. Estas últimas, pueden ser inactivadas por asociación con los minerales de las arcillas. (Volkman y Oppenheimer 1962). Dicha absorción consecuentemente puede ser una barrera física que limite el movimiento de las bacterias. (Tabla 1. Fig. 2). En la zona cercana a la Isla del Carmen (margen occidental del Golfo de California), entre las estaciones 22 y 30, el tipo de sedimento es de arena mediana y gruesa con depósitos de foraminíferos calcáreos (Van Andel, 1969); es por ello que el contenido de carbón orgánico es menor que en la zona sur, y al igual que en la estación 1,3 la biomasa bacteriana es baja, ya que las bacterias se encuentran libres para llevar a cabo los procesos de remineralización de la materia orgánica con una mayor velocidad que en los sedimentos limo-arcillosos. 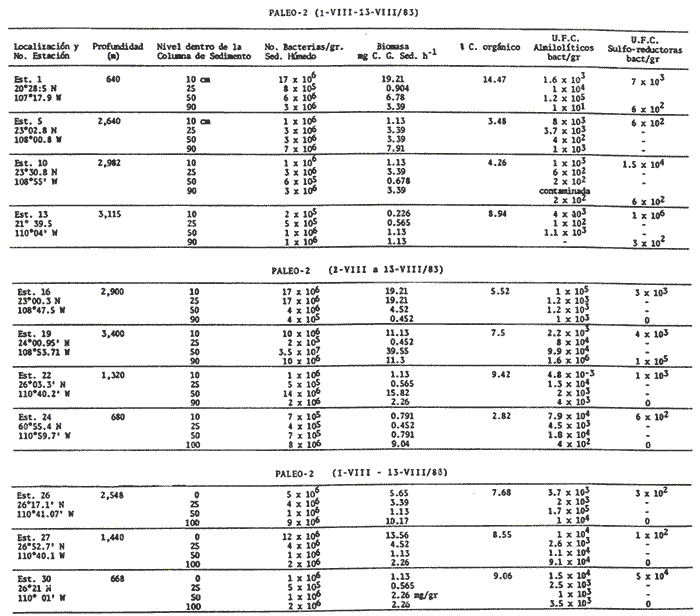 TABLA 1 Estos resultados coinciden con lo reportado por Bordooskiy (1965) quien ha establecido que hay una relación directa entre la cantidad de bacterias y el contenido de materia orgánica de los sedimentos, además de que la biomasa bacteriana es verdaderamente significativa en algunos mares interiores. La concentración de materia orgánica se eleva cuando la película sedimentaria decrece y es por ello que las arcillas contienen, aproximadamente, cuatro veces más materia orgánica que las arenas. Así se puede decir que la cantidad de carbón orgánico de los sedimentos está inversamente relacionado con la medida de la partícula. En los sedimentos marinos profundos, la función almilolítica se realiza con mucha frecuencia, sobre todo en la capa más superficial de los sedimentos, ya que esta está compuesta por materia orgánica fácilmente degradable por la mayoría de las bacterias. En los resultados obtenidos se observa que la población de bacterias almilolíticas presenta una variación que tiene un rango de 102 a 106 bacterias por gramo de sedimento húmedo, teniendo un promedio de 103 bact. g sed. h-1. También, se puede observar que aproximadamente un 50% de la población bacteriana heterótrofa es almilolítica. (Tabla 1 y Figs. 2, 3 y 4). 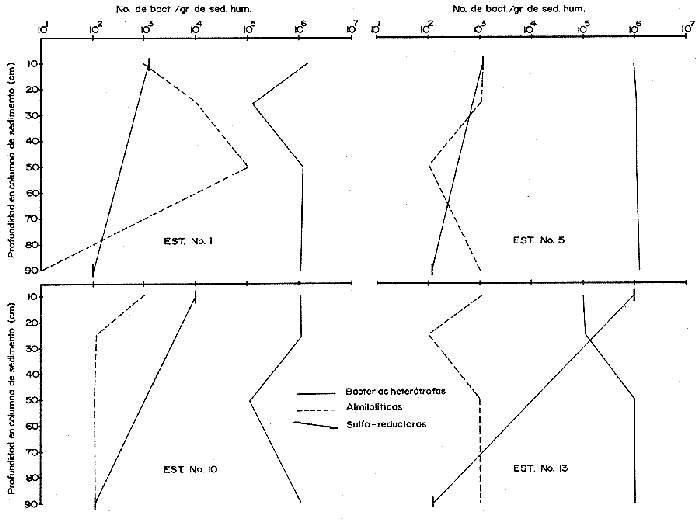 Figura 3. Estaciones 1, 5, 10 y 13. 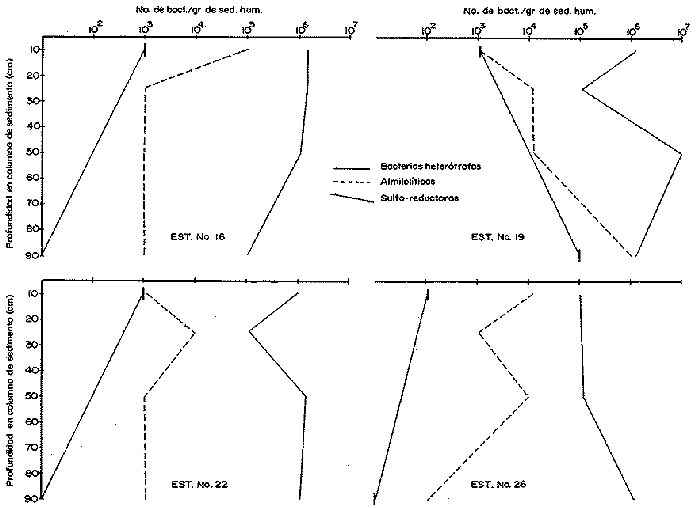 Figura 3. Estaciones 16, 19, 22 y 26. El número de bacterias almilolíticas disminuyen con la profundidad dentro de la columna sedimentaria, con excepción de las estaciones 1, 22 y 26 que entre los 25 y 50 cm de profundidad sufren un aumento (105 bact. g sed.h-1) para disminuir de nuevo a niveles más profundos. En la estación 19, la población almilolítica presenta un comportamiento particular, ya que aumenta con la profundidad; esto indica que existe una discontinuidad en el perfil sedimentario y que en las capas inferiores la cantidad de materia orgánica es mayor que en los superiores, la cual soporta una biomasa bacteriana mayor que en la superficie (Tabla 1, Figs. 2, 3 y 4). 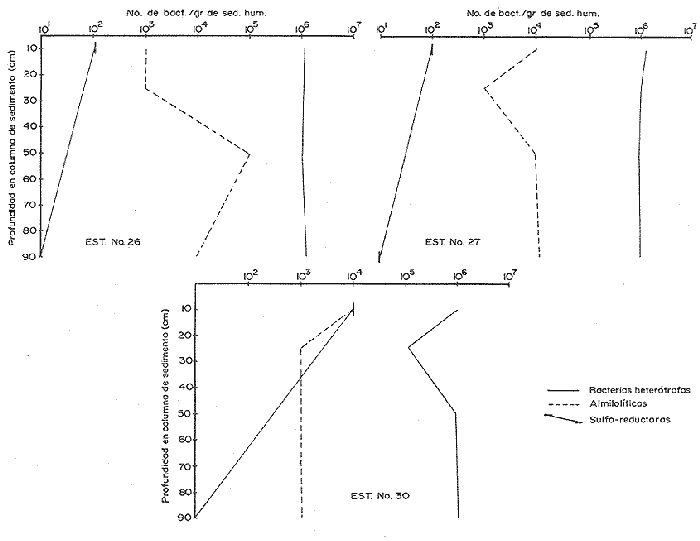 Figura 4. Estaciones 26, 27, y 30. Bianchi (1971, 1973, 1975) ha reportado que en la capa superficial de los sedimentos profundos, la celulosa es poco sensible al ataque bacteriano y puede alcanzar los niveles más profundos sin degradarse, tal vez debido a que los microorganismos que habitan en las grandes profundidades ha perdido la capacidad de degradar la celulosa. Esto coincide con los resultados obtenidos ya que después de un mes de incubación no se registró ningún crecimiento en las cajas de petri que contenían medio de cultivo para crecimiento de bacterias celulolíticas. En el caso de las bacterias sulforeductoras se tomaron muestras de sedimento de los 10 primeros cms y a 90 cms de la columna sedimentaria. Como se puede observar en los sedimentos obtenidos, las mayores concentraciones bacterianas se encuentran en la capa más superficial del sedimento con un promedio de 10 3 bact. g. sed. h-1, a excepción de la estación 19 donde la población aumenta con la profundidad; por lo que se puede pensar que en esta región se encuentran sedimentos muy reducidos, producidos por fenómenos volcánicos. (Tabla 1, Figs. 2, 3 y 4). Winfrey et al. (1981), Henrich y Ferrington (1984) observaron que los rangos de sulfato reducción en los sedimentos bioturbados (primeros 10 cm de la columna sedimentaria) son mucho mayores que en las grandes profundidades, debido a la descomposición de la materia orgánica que existe en esta zona. En el caso de la zona de estudio se puede decir que es una región bioturbada, ya que se encuentra bajo una zona de surgencia, las cuales provocan un flujo de materia orgánica que es depositada en la superficie de los sedimentos. El número de bacterias heterótrofas decrece con la profundidad de la muestra, lo cual se puede relacionar con una incrementada capacidad de la materia orgánica para producir acetato sólo en la capa superficial de la columna sedimentaria y a que mayores profundidades disminuye la cantidad de materia orgánica degradable. El estudio sedimentológico de los medios estudiados podría ayudar a refinar el análisis distributario de las bacterias, ya que esto y la cantidad de materia orgánica existente son un factor primario en el comportamiento de la actividad microbiana. AgradecimientosA A. Molina Cruz Investigador del Instituto de Ciencias del Mar y Limnología, y Jefe de la Campaña Oceanográfica PALEO-II, por la revisión del presente trabajo y por sus comentarios. LITERATURAATLAS, R.M., Experimental Microbiol Ecology, Scientific Publications: Enumeration and Estimation of Microbial Biomass. Richard G. Burns y J. Joward Stater (Eds.) 1982. 84-112. BAROSS, J.A., FJ. HANUS y R.Y. MORITA, Appl. Microbiol, The survival of human enteric and other sewage microorganisms under simulated deep-sea conditons. 1975. 309-318. 21: BIANCHI, A.J.M., Intemational Journal on life in Oceans and Coastals Waters, Distribution de cetaines bactéries hétérotrophes aérobies dans le sédiments profonds de Méditerranée Orientale. 1971. 106-107. 2 (2): BIANCHI, A.J.M., Marine Biologie, Variation de la concentration bactérienne dans les eaux et les sédimento littoreaux. 1973. 23-29. 22: BIANCHI, A., V. JACQ. y H. GENSOUSSON, La geochime organique des sédiments marins profotids mission Ogon 1, 1974. (mer de Norvege), Distribution des populations bactériennes hétérotrophes dans les sédiments it dans les eaux proches du fond en mer de Noriege. In: Revie de Plnstitur Francais du Pétrole (Eds.) 1975. 204-211. 29 (1): BORDOVSKIY, OK, Marine Geol., Accumulation and transformation of organic substances in marine sediments. 1965. 5-31. 3: BOWEN, W.B., Apple. Environ. Microbiol., Comparison of two direct count techniques for enumeration aquatic bacteria. 1977. 1229-1232. 33 (3): CORLUCCI, A.F. y P.M. WILLIAMS, Maturcavúsenchaften, Simulated in situ growth rates of pelagic marine bacteria. 1978. 541-542. 65: CARVACHO, A. y k RIOS, An. Inst. Cienc. del Mary Limnol. Los camarones carideos del Golfo de California. II Catálogos, Claves de Identificación y Discusión Biogeográfica. Univ. Nal Autón. México, 1982. 279-294. 9 (1): DALEY, R.J., American Society for testing and materials: Direct epifluorescence aumentation of nature aquatic bacteria. Uses, limitations and comparative accuraey. In J.W. Costero y R.R. Colwett (Eds.) Native aguatic bacteria activity and ecology ASTPM Stp. 1979. 29-41. DONEGAN, D. y H. SCHRADER, Marine Geol., Biogenic and abiogrenic components of laminated sediments in the Central Gulf of California. 1982. 214-237. 48: GAUDETTE, H.E. y W.R. FLIGHT, J. Sed. Petrol., An inexpensive titration for determination of organic carbon in recent sediments. 1974. 249-253. 44 (1): HENRICH, M.S. y J.W. FARRINGTON, Limnol. Oceanogr., Peru upwelling region sediments near 15 S.I. Remineralization and accumulation of organic matter. 1984. 29 1-19. (1): HOBBIE, J.E., R.J. DOBEY y S. JASPER, Appl. Environ. Microbiol., Use of muclopore filters for countina bacteria by fluorescence microscope 1977. 1225-1228. 33 (5): JANNASCH, H.W. y G.E. JONES, Limnol. Oceanogr., Bacterial populations in sea waters as determined by different methods of enumeration. 1959. 128- 139. 4 (2): JANNASCH, K. EIMKJELLEN, C.O. WIRSEN y A. FARMANFARMAIAN, Science, Microbial degradation of organic matter in the deep sea 1971. 672-675. 171: JANNASCH, y C.O. WIRSEN, Science, Deep sea microorganisms: insitu response to nitrient enrichement. 1973. 641-643. 180: JANNASCH, y C.O. WIRSEN, Investigación y Ciencia, Vida microbiana en las profundidades marinas. 1977. 44-56. 11: LISTON, J., Marine Microbiology Benckmark papers in Microbiology. (Dowden, Hutehirson and Ross Stroundoburg Peun). Distribution, taxonomy and function of heterotrophic bacteria on the sea floor. In: C.D. Litchfield (Ed.) 1976. Vol. 11. LIZARRAGA-PARTIDA, M.L., Pseudomonades du nilieu marin. Taxonomie polyphasique et ecologie. These pour obtenir le grade de docteur en-sciences naturelles. (Aix-Marseille 1). 1979. 117P. LYMAN, J. y R.H. FLEMING, J. mar. Res., Composition of sea water. 1940. 134-146. 3: MITSKEVITCH, I.N. y A.E. KRISS, Doklady Akademii nauk SSSR, Biological Science Section, High pressure tolerance of Pseudomonas sp strain 8113, isolated from the bottom of a deep water basin of the Black sea. 1966. 822-824. 171: MOLINA-CRUZ, A., Memorias de Symposium "El Golfo de California": Origen, evolución, aguas, vida marina y recursos. Registro micropaleontológico de las masas de agua en la región central del Golfo de California. Mazatlán, Sin. México. noviembre 1979. 1979. MOLINA-CRUZ, A. An. Inst. Cienc. Del Mar y Limnol. Evolución oceanográfica de la Boca del Golfo de California. Univ. Nal. Autón. México 95-128 13 (2): MORITA, R.Y., Can. Microbiol, Microbial life in the deep sea. 1980. 1375-1385. 26 (12): PEDROS, C. y T.D. BROCK, Appl. Environ. Microgiol. Assessing biomass and production of bacteria in eutrophic lake Mendota, Wisconsin. 1982. 203-218. 44 (1): RODINA, G.A., Methods in Aguatic Microbiolo University Part. Press. USA. 1960. 461. SAITZ C.S., M.J. FERRARA y J.M. ROMERO. An. Inst. Cienc. del Mar y Limnol. Distribución cuantitativa de bacterias y levaduras heterótrofas en las costas de Sinaloa y Nayrit, México. Univ. Nal. Autón. México., 1986. 87-106. 13 (3): TABOR; S.P., J.W. DEMING, V.OHWADA, H. DORIS, M. WAXMANN y R.R. COLWELL, Microb. Ecol., A pressureretaining deep ocean sampier and transfer system for measurement of microbial activity in deep sea. 1981. 51-65. 7: TAIT, R.V. Elemnts of Marine Ecolgy 3er. Organic production in the sea. In: Butterworth (Eds.) EUA: 1981. 147-183. VAN-ANDEI, T.1I., Marine Geoloy of dw Gulf of California. Recent marina sediments of Gulf of California. In: T.H. Van Andel y G.G. Shar, Jr. (Eds.) The American Association of Petroleum Giologists. Tuba, Oklahoma USA. 1969. 407 p. VOLKMANN, C.N. y C.H. OPPENHEIMER, Institute of Marine Sci., Tle Microbial descomposition of organic carbon in surface sedíments of Marine Bays of the Central Texas Gulf Coast. 1962. 80-96. 8: WATSON, S.W., TJ. NOVITSKY, H.L QUINBY y F.W. VOLOIS, Appl. Environ. Microbiol., Determination of bacteria¡ number and biomass in the marine environment. 1976. 940-954. 33: WILLIAMS, P.M. y A.F. CARLUCCI, Nature., Bacterial utilization of organie matter in the deep sea. 1976. 810-811. 262: WINDREY, H.R., D.G. MARTY, A. BIANCHI y D.M. WORD. Geomicrobiol J., Vertical distribution of sulfate reduction, methane production and bacteria in maríne sediments. 1981. 341-362. 2 (4): ZOBELI, C.E. y R.Y. MORITA., J. Bacteriol., Borophillic bacteria in some deep sea sediments. 1957. 563-568 73:
|

