|
DINÁMICA Y ESTRUCTURA DE LA COMUNIDAD DE
PECES EN UN SISTEMA ECOLÓGICO DE MANGLARES DE LA COSTA DEL
PACÍFICO DE MÉXICO, NAYARIT
Trabajo recibido el 7 de agosto
de 1986 y aceptado para su publicación el 5 de marzo de
1987
F. Amezcua Linares,
M. Álvarez Rubio A.
Yáñez-Arancibia
Instituto
de Ciencias del Mar y Limnología, Universidad Nacional Autónoma
de México. Contribución 527 del Instituto de Ciencias del Mar y
Limnología,
UNAM
El
sistema lagunar costero de Agua Brava es un área característica
por sus notables manglares y otras vegetación litoral asociada, lo que
confiere una alta productividad que es aprovechada por gran cantidad de
especies. El cuadro ambiental está determinado principalmente por el
regimen pluvial, la influencia de los bocas y la descarga de los ríos.
El análisis "cluster" clasificó dos grandes grupos de habitat en
3 estaciones del año; uno poco variable en la porción norte
característico por su influencia marina y; otro muy variable en el sur
donde existe predominancia fluvial. Estos habitat caracterizan a dos grupos de
especies cuya dinámica en el sistema se encuentra influenciada
directamente por factores climáticos ambientales. La comunidad de peces,
integrada por 32 especies fue evaluada por medio de una red de arrastre de
prueba camaronera durante el ciclo anual 1979-1980, bajo los siguientes
aspectos: estructura y dinámica de la comunidad en el espacio, tiempoy
patrones de diversidad poblacional, distribución y abundancia. La
diversidad de evaluó en base a los índices de Shanon y Weaver
(H'n), Wilhm (H'w), Margalef (D') y Lloyd y Gheraldi (J'), además de la
densidad poblacional, distribución y abundancia de las especies,
componentes comunitarios y categorías ictiotróficas. Los valores
señalados presentan fluctuaciones anuales de acuerdo a la
dinámica ambiental, la localidad y la selectividad del arte de pesca,
así como otros factores bióticos como la disponibilidad de
alimento.
The
coastal lagoon system of Agua Brava is a typical arca because of its remarkable
mangroves and other associated litoral vegetation which conferes a high
productivity that is used by a great amount of species. The environmental frame
is mainly determined by the pluvial regimen, the influence of the inlets and
the discharges of the rivers. The cluster analisys classified two great habitat
groups in three of the four seasons of the year. The groups in the north
portion presents few variation and is distinguished by its marine influence,
meanwhile the one in the south portion is quite variable with a great fluvial
predominance. These habitat typify two groups of species which dynamic in the
system is directly influenced by environmental climatic factors. The fish
community, integrated by 32 species, was evaluated using a traw1 net during the
annual cycle 19791980 under the following aspects: structure and dynamic of the
community in the space, time, and patterns of diversity, distribution and
abundance. The diversitywas evaluated taking as a base Shannon and Weaver
(H'n), Whilm (H'w), Margalef (D) and Lloyd and Gheraldi (J') indexes, as well
as the population ensity,distribution and abundance of the species, community
components and ichthyotrophic categories. The indicated values present annual
fluctuations according to the environmental dynamic, the locality and the
selection of fishing art and to other biotic factors as food
availabity.
La tracendencia ecológica de los ecosistemas de manglares ha sido tradicionalmente destacada por Rutzler (1969), Kuenzler (1974) y Lugo y Snedaker (1974). Recientemente, los avances de investigación cuantitativa en hábitats de manglares dejan pocas dudas de la importancia ecológica crítica para los peces costeros tropicales (Thayeret al., 1987; Robertson y Duke, 1987; Yáñez Arancibia y Lara-Domínguez, 1983; Yáñez-Arancibiaet al., 1988). Su importancia como fuente de energía directa a acroconsumidores es notable; además se ha detectado a dichas zonas como áreas de alimentación, crianza, reproducción y protección temporal para peces y crustáceos. Otro aspecto importante de los manglares, es que son grandes productores de detritus, fuente potencial de energía y uno de los principales puntos de partida en la transferencia energética de las estructuras tróficas involucradas (Odum y Heald, 1972,1975; Odumet al., 1973, Healdet al., 1974). El estudio más detallado sobre ecología de las comunidades de manglares, que actualmente se conoce, se efectuó en la región indopacífica y abarca comunidades asociadas, incluyendo zonaciones y adaptaciones de los organismos (Macnae, 1968). Recientemente, la UNESCO ha editado un volumen referido a la bibliografía de los manglares (Rollet, 1981). En México existen trabajos importantes de manglares. Entre ellos sobresale un plan de investigaciones, en relación con su diagnóstico actual como ecosistema y su importancia en la producción pesquera (Rollet, 1974). Sobre comunidades animales cabe referir los trabajos de Chávez (1979), Yáñez-Arancibia (1978 y et al., 1980), Vargas Maldonado et al. (1981). El inventario de Rollet (1974) destaca que las costas de Campeche en el sur del Golfo de México y de Nayarit en el área central del Pacífico de México son áreas críticas desde el punto de vista de la ecología de los sistemas de manglares. El estado de Nayarit tiene una extensa planicie costera con lagunas que se interponen entre los ríos y bordeado por un complejo de bermas antiguas formadas por sucesivos cambios de la línea de costa. El sistema de Teacapan-Agua Brava es la configuración estuarina más notable en la porción costera de Nayarit y da lugar a extensas áreas de manglar donde domina la especie Rhizophora mangle, aunque también existe Laguncularia racemosa yAvicenia germinans. Este trabajo tienen por objeto entregar resultados sobre la ecología de sus comunidades, destacando aspectos de diversidad, distribución, frecuencia, abundancia, y la estructura de las poblaciones que habitan esta región de manglares. ÁREA DE ESTUDIOEl sistema Teacapan-Agua Brava se localiza al norte de la planicie costera del estado de Nayarit, entre los 22°04-22°35'latitud N y 105°20'-105°50' longitud O (Fig. 1). El sistema lagunar destaca por cuatro zonas preliminarmente definidas, que son: la Boca de Teacapan, el Estuario de Teacapan o parte baja del Estero, el Estero de Agua Brava y, finalmente, la laguna de Agua Brava hacia el interior (Alvarez Rubioet al., 1986). La planicie costera presenta bordes y barras subparalelas que se han formado por sucesivos cambios de la línea de costa (Currayet al., 1969). La línea de costa es relativamente homogénea con varios ríos que influyen en la geología costera por su caudal de sedimentación (i. e., rios Acaponeta, Cañas y Bejuco, principalmente). 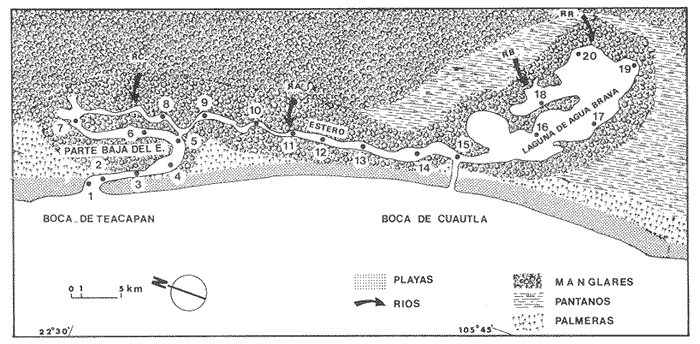 Figura 1. Mapa Topográfico y de estaciones de colecta, donde se destacan los manglares y los afluentes. El clima de la región es subtropical-tropical con una temperatura media anual de 25°C, precipitación anual de alrededor de 1660 mm y la época de lluvias se presenta a fines del verano (García, 1973). Las mareas son mixtas, diurnas y semidiurnas, con un rango medio anual de 0.70m La figura 2, muestra las relaciones pluvio-climáticas del área con datos de dos estaciones meteorológicas (Rosa Morada y Tecuala) que cireunscriben los fenómenos señalados en la zona de estudio. Se destaca una marcada época de lluvias desde julio hasta septiembre coincidiendo con las temperaturas más elevadas. La evaporación máxima que va desde abril hasta agosto inicia su ascenso antes de las lluvias probablemente por efecto de los vientos predominantes en esa época. De noviembre a junio es la época de secas. 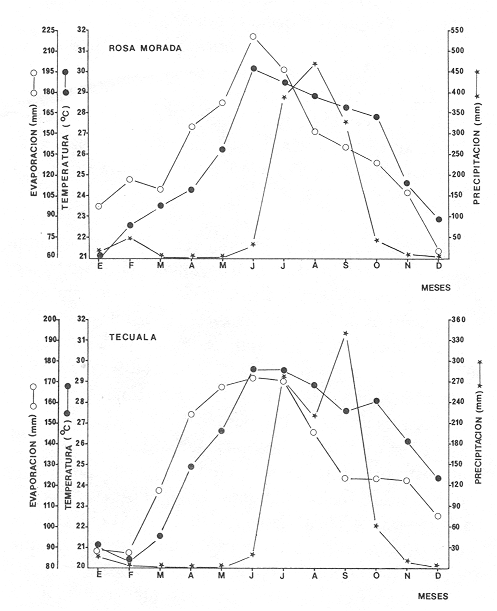 Figura 2. Parámetros meteorológicos en dos estaciones de observación: Tecuala y Rosa Morada. La figura 2, muestra el efecto climático-meteorológico resultante de la acción del clima. Cuatro ríos principales drenan en el sistema lagunar (i.e., Río Cañas, Acaponeta, Bejuco y Rosa Morada) cuyo comportamiento es marcadamente estacional, con los máximos volúmenes de descarga entre julio y diciembre con un máximo mensual en septiembre. La descarga de los ríos es: Cañas 99,846.5 miles de m³ (promedio) y Rosa Morada 81,636 miles m³ (promedio) lo que determina que el sistema Teacapan-Agua Brava recibe al año una descarga total de 1,469,664 miles de m3 (Fig. 3). Más del 90% de este aporte fluvial ocurre entre julio y diciembre. 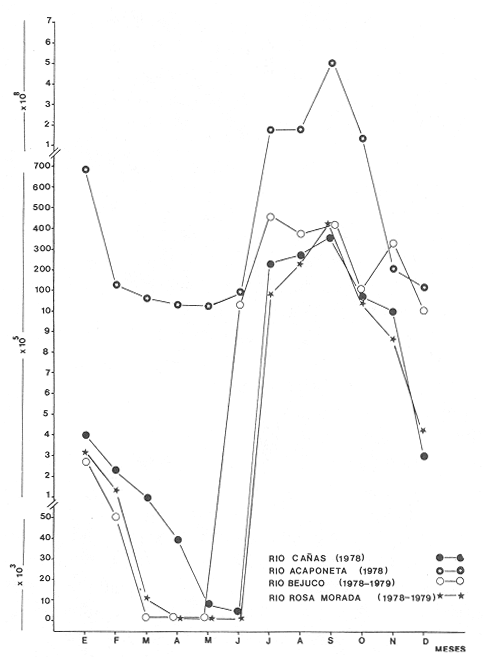 Figura 3. Descarga fluvial (1978-1979) en promedios mensuales. Geomorfológicamente pueden caracterizarse las cuatro zonas del sistema de la siguiente manera: 1) la Boca de Teacapan, es la desembocadura natural del sistema con una anchura de ± 1000 m, y una profundidad variable entre 3 y 5 m,correspondiendo esta última al canal de marea, la playa y el fondo son normalmente arenosos, 2) el Estuario o Parte Baja del Estero, orientado en forma inclinada a la costa, con profundidades medias máximas de 12 m, y fondo arenoso, 3) el Estero, orientado paralelo a la costa en dirección norte-sur, separado originalmente del mar por una barrera con bermas arenosas, profundidades medias de 4 m; el fondo es de arena, limo y arcilla en la parte inicial, más al interior predominan sedimentos terrígenos. Actualmente existe una boca artificial, la Boca de Cuautla, que ha modificado las condiciones naturales haciendo más salino el estero y la laguna, 4) la Laguna de Agua Brava que se encuentra separada del litoral por un corto terreno, presenta profundidades medias de 2.5 m, los sedimentos son terrígenos. Tanto en el estero como en la Laguna existe vegetación de Rhizophora mangle pero también se presenta Conocarpus erectus, Avicenia genninans y Laguncularia racemosa. Existe una estratificación térmica que se incrementa desde la Boca de Teacapán hacia la laguna de Agua Brava. A principios del verano se registran las temperaturas y salinidades más altas por irradiación solar y evaporación del agua. En invierno se registra la temperatura más baja. Las salinidades permanecen estables en la laguna y varían significativamente hacia la boca. En invierno las mareas también penetran hasta el estero y la laguna aumentando la oxigenación del agua; así como a fines del verano la oxigenación es mínima por el intenso aporte fluvial. Es evidente una variación del oxígeno hacia el interior del sistema aumentando en la laguna. El flujo de las corrientes de marea sólo influyen con relativo efecto en la boca, el estuario y la parte baja del estero. Un complemento ecológico a esta descripción se puede encontrar en Curray et al.(1969), Amezcua Linares (1972), Rollet (1974) y Alvarez Rubioet al.(1986). MÉTODOSDurante el ciclo anual 1979-1980, entre junio y mayo se efectuaron colectas diurnas de ictiofauna en 20 estaciones localidazadas a lo largo del sistema. Se utilizó una lancha de 3 m de eslora y motor fuera de borda de 40 H.P. desde donde se operó una red de prueba camaronera de 13 m de largo, malla de 11/4 de pulgada y 2.5 m de abertura de trabajo, en lances de 15 min de duración. Conjuntamente con las muestras de peces y fauna béntica, se registraron parámetros ambientales como: salinidad, temperatura y oxígeno en superficie y fondo, transparencia, nivel de marea y sedimentos. Los ejemplares capturados se fijaron en formalina al 10% neutralizado con bórax, y fueron trasladados al laboratorio para su identificación y proceso, que consistió en cuantificar el número de individuos y biomasa por especie. Los componentes ícticos de la comunidad están de acuerdo con Yáñez-Arancibia et al. (1980), donde se consideran visitantes ocasionales, visitantes cíclicos y residentes permanentes, de acuerdo a la frecuencia, abundancia, distribución y procedencia que tengan las especies dentro del sistema. La posición trófica de los peces, se hizo en base al contenido estomacal, el espectro trófico y la morfología del aparato digestivo, siguiendo la clasificación complementada por Yáñez-Arancibia (1978) que considera 3 niveles: primer orden, consumen preferentemente detritus y restos vegetales; segundo orden, son predominantemente carnívoros, consumen básicamente pequeños invertebrados y, de tercer orden, que son aquellos exclusivamente carnívoros, la mayoría predadores. Para la evaluación de la comunidad, se tomaron en consideración los siguientes parámetros ecológicos: a) El índice de diversidad de Shannon y Weaver (1963) H'n; b) El índice de equitatividad de Lloyd y Gheraldi (1964) J'; c) El índice de riqueza de especies de Margalef (1958) D; d) El índice de biomasa de Whilm (1968) H'w. El estudio de las clasificaciones ecológicas y de comunidades por medio de dendrogramas que muestran el grado de similaridad o disimilaridad que existen entre las estaciones de acuerdo a sus especies, ha sido utilizado recientemente en comunidades de peces como lo muestran Horn y Allen (1976), Daniels (1979) y Yáñez Arancibia et al.(1980) entre otros. Este análisis "cluster" permite relacionar grupos dentro de unidades similares, basándose en los propios caracteres de cada muestra. Para este proposito se seleccionó el "Simple Matching Coeficient" (Sokal y Michener, 1958) el que fue computarizado por el "cluster análisis" de Davis (1979). Los resultados de este proceso se expresan en dendrogramas que analizan la presencia-ausencia de especies para cada una de las muestras en las diferentes estaciones de colecta. Para mayores detalles del método puede consultarse Alvarez Rubio et al.(1986). RESULTADOS
CARACTERIZACIÓN AMBIENTAL DEL HÁBITATLos parámetros climáticos influyen ampliamente en el sistema de Agua Brava, principalmente por su estrecha relación con el ambiente lagunar. Estas características climáticas dan como resultado variedad de hábitat en los que se encuentran diferentes comunidades de seres vivos en estrecha relación con los caracteres ambientales del sistema. Por lo tanto, la comunidad íctica se comporta de acuerdo y en función a estos parámetros meteorológicos y fisicoquímicos que actúan directamente en el comportamiento de las poblaciones. VERANOEste periodo corresponde a finales de la época de secas e inicios de las primeras lluvias, con temperaturas altas. En la parte norte del sistema (estación metereológica de Tecuala), se registra un rango de 28.9 a 29.6ºC, en tanto que en la región sur del sistema (estación Rosa Morada), existe un rango promedio mensual de 28.8 a 30.2°C. La evaporación tiene un patrón similar a la temperatura con un rango de promedio mensual de 146.1472.7 mm para Tecuala, y 151.3 a 222.4 mm para Rosa Morada. Por lo que respecta a la precipitación, en la región de Tecuala el rango de promedio mensual es de 18.9 a 226.3 mm y de 42.3 a 473.1 mm para Rosa Morada. En cuanto a los parámetros fisicoquímicos del agua, el gradiente salino observado en la figura 4, muestra salinidades relativamente mayores en la zona del canal del estero (36%). Las profundidades en este lugar son someras causando altas temperaturas que provocan evaporación y, en consecuencia aumento de la salinidad en la columna de agua. En zonas como las bocas, parte baja del Estero y laguna se registran salinidades relativamente bajas (32%). Las temperaturas del agua en esta área son relativamente menores, pero la profundidad y transparencia son las mayores del sistema. El aporte fluvial de los ríos es nulo con excepción del río Acaponeta, que a través de todo el año registra descargas sobre la región del estero (Fig. 3). El análisis "cluster" efectuado para el hábitat muestra a dos grandes grupos de estaciones (Fig. 5). Las bocas y áreas circunvecinas de influencia directa tienen una alta afinidad en cuanto a sus parámetros físico- químicos, lo cual refleja un grupo homogéneo de estaciones (grupo II de estaciones, Fig. 5), que incluye áreas definidas como: parte baja del Estero y las bocas de Teacapán y Cuautla, estaciones 12 y 15 (Fig. 5). Este grupo tiene características muy afines, determinadas por la influencia marina, así como también, menores temperaturas, mayor transparencia, sustrato arenoso y fauna macrobéntica escasa. El segundo grupo (grupo I de estaciones, Fig. 5) presentan características contrastantes que involucran al canal del estero y laguna. Este grupo presenta salinidades y temperaturas altas, profundidades someras, transparencias mínimas, sustrato esencialmente de arena-fango, fauna macrobéntica abundante y vegetación sumergida numerosa. Ambos grupos Particularizan a sus hábitat respectivos. Las aguas someras y tranquilas de las estaciones en este grupo, tienen mayor impacto de evaporación y consecuentemente las salinidades y temperaturas son más elevadas, de esta manera se predisponen condiciones de transición y vegetación circundante que propicia una mayor diversidad macrofaunística. 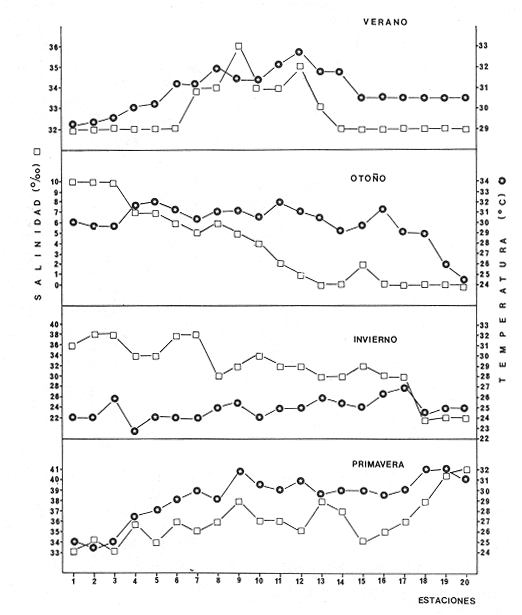 Figura 4. Parámetros ambientales, salinidad y temperatura durante el ciclo anual en las 20 estaciones de colecta. Estructura de la Comunidad
Diversidad Se examinaron 356 ejemplares de 18 especies. Estas pueden variar, según el arte de pesca utilizado, tal como lo señala (Alvarez Rubio et al,. 1986). El análisis de los distintos índices de diversidad calculados para cada estación del año fluctuan en función de variables tales como: época del año, localidad, selectividad del arte de pesca y de las características intrínsecas de las especies. El índice de diversidad de Shannon y Weaver (H'n), es una formulación matemática independiente del tamaño de la muestra, efectua la proporción de individuos por especie y con mayor frecuencia, refleja la tendencia real (estimada), en un conjunto de muestras. Así se observa una relación directa con el número de especies e individuos que al compararse con el resto se obtiene el índice de equitatividad (J'), que por lo general tiene un comportamiento inverso en esta época del año (Fig. 6). Esta misma situación se presenta con el índice de Margalef (D), es decir que se observa una correlación negativa, aunque esto no siempre sucede con la utilización de otras artes de pesca donde es más probable encontrar una correlación positiva en ambientes marinos (Douglass, 1981). 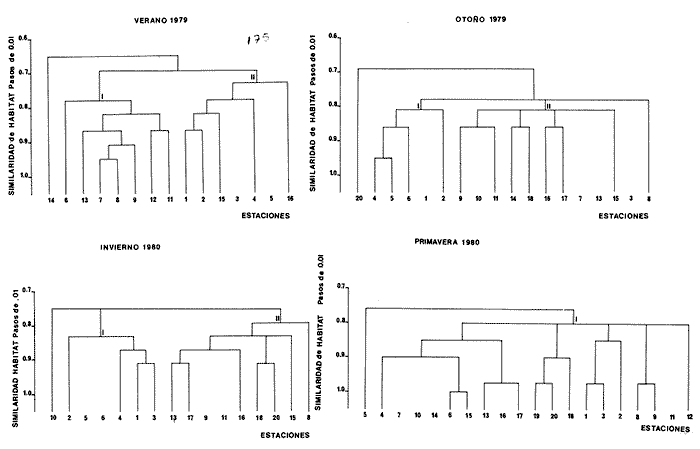 Figura 5. Diagrama "cluster" de similaridad entre las estaciones según el ambiente durante el ciclo anual. El índice de biomasa (H'w) presenta mayores valores en lugares donde la diversidad es baja, existiendo aparentemente una correlación inversa (Fig. 6), lo cual indica la abundancia en peso de algunas especies que son dominantes (Whilm, 1968). La máxima diversidad observada dentro del sistema en esta época del año es hacia la parte norte del sistema: Boca de Teacapán, Parte Baja del Estero y Canal del Estero, donde las salinidades son típicamente marinas o cercanas a ella, en tanto que la menor se registra al sur del sistema en la laguna de Agua-Brava, precisamente en la zona más variable en cuanto a la salinidad, que varía de 0 a 43% según la época climática. 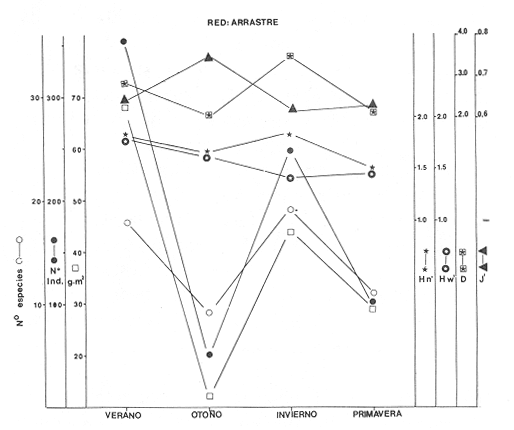 Figura 6. Parámetros ecológicos de la comunidad: índices de diversidad (H'n y H'w) riqueza (D') y equitatividad (J'); así como abundancia numérica, densidad de biomasa y número de especies. Distribución y Abundancia de las Especies Las 18 especies encontradas se comportan de acuerdo al ambiente según la época del año, algunas se distribuyen en áreas restringidas. Esto depende fundamentalmente de la época y lugar de muestreos así como la selectividad de las redes. Muchas de las especies con amplia distribución se han considerado como dominantes en lo que se refiere al número de individuos y a la alta frecuencia de aparición a través de todo el sistema. Así. la especieAchirus mazatlanus,está practicamente en toda el área con una frecuencia de aparición de 69% del total (Fig. 7). Figura 7 Otra especie comoArius liropus tiene una frecuencia de aparición del 38%, que a pesar de ser abundante en número y peso, su distribución se restringe a la época de verano, a partir del Canal del Estero hacia la laguna de Agua-Brava (Fig. 7); su frecuencia de aparición en la parte baja del Estero y Boca de Teacapán llega a ser escasa o inclusive nula, aún utilizando otro tipo de artes de pesca, pero su dominancia numérica se incrementa conforme se interna hacia la laguna siendo una especie muy común en el sur del sistema. Otra de las especies dominantes que es recurso local con potencial pesquero esPomadasys macracanthus, que tiende a distribuirse hacia la Boca de Teacapán, Parte Baja del Estero y Canal del Estero. Su captura depende en gran parte del arte de pesca y parece ser que se logra mayor eficiencia de pesca con redes de arrastre y agallera (Alvarez Rubio et al., 1986). Esta es una especie rara o escasa en la laguna y su aparición en el sur del sistema varía de acuerdo a la época del año, su frecuencia de aparición en el sistema representa en esta época el 31% del total de colectas (Fig. 7). El resto de las especies de la comunidad muestreada varía su frecuencia de aparición de 8 a 23%, con una distribución preferencial hacia la parte norte del sistema y en cl canal del Estero. En su mayoría son especies que en esta época del año no pueden ser consideradas como dominantes, aunque es probable que en otra época lo sean. Hay especies con abundancia numérica como es el caso de Latjanus argentiventrisque es una especie muy apreciada por los pescadores. Tiene una distribución restringida a la zona del Canal del Estero, y llega a ser abundante en alguna estación de colecta, pero su frecuencia de aparición es baja (15%), como para ser considerada como una especie dominante. Otra especie similar en comportamiento esCentropoinus robalito, cuya distribución se acentúa en el canal del Estero, con una frecuencia de aparición del 23%, aunque en general se distribuye principalmente hacia el sur de la laguna. Esta especie puede ser considerada como dominante cuando menos en esta época del año. Componentes Comunitarios Los visitantes ocasionales representan el mayor porcentaje con un 44%, en segundo lugar los cíclicos con 7% y especies residentes con tan sólo el 3%. La alta frecuencia de componentes ocasionales, puede deberse al hecho de que el sistema es prácticamente marino y permite el flujo de organismos desde el mar. Sin embargo, otro factor importante es la selectividad que tiene la red de arrastre, puesto que si se compara con otras artes de pesca, como la agallera y chinchorro, podría resultar que los componentes principales de la comunidad son los cíclicos y en segundo lugar serían los ocasionales. Pero en términos generales se puede apreciar que en verano, la inmigración de especies ocasionales es mayor probablemente por la homogeneidad ambiental que existe en el sistema. Algunas especies que son un recurso pesquero, como Centropomus robalito, se considera como un residente permanente, por su presencia a través de todo ciclo anual. Dentro de los llamados componentes cíclicos, las especiesPomadasys macracanthus, Diapterus peruvianusyLutjanus argentiventris, son de interés comercial y se pescan localmente. Otros componentes comunitarios residentes como elArius liropus no tiene interés comercial, pero ecológicamente representan un importante eslabón en la cadena trófica del sistema, de ahí su interés dentro de la comunidad. Circunstancias similares tiene la especie Achirus mazatlanus que es un componente residente sin interés comercial y su importancia es exclusivamente ecológica. Categorías Ictiotróficas Los consumidores de segundo orden representan un 67% del total en verano, 28% los de tercer orden y 17% los de primer orden. La aparente dominancia del segundo orden es debido a que muchas especies tienen un espectro trófico amplio, por lo que tienen distintas alternativas de alimentación ante situaciones diversas, esto obedece a una respuesta adaptativa, por lo que muchas especies en tanto tienen la capacidad de cambiar su nivel trófico de acuerdo a las condiciones ambientales y la disponibilidad de alimento, otros niveles tróficos están representados por especies que son más restringidas en su espectro alimenticio y su variación en cada época está en función de sus hábitos tróficos y comportamiento social (Keenleyside, 1979). La abundancia para cualquier nivel trófico también depende de otros factores como: selectividad de la red, disponibilidad de alimento, tipo de sustrato y otros elementos o variables no identificados (Fig. 8). Afinidad de Especies y de Hábitat El análisis "cluster" de especies, presenta una dinámica comunitaria muy estrecha en relación con el ambiente descrito, encontrándose que algunas especies tienen una distribución restringida a un hábitat en particular y otras por el contrario presentan una amplia distribución sin importar el tipo de hábitat. Así en verano se presentan varios sub-grupos de poblaciones en el dendrograma de especies, aunque se pueden considerar sólo a dos grandes grupos representativos, A y B. El primer grupo (A) tiende a dispersarse hacia la parte baja del Canal del Estero, esto es en la parte norte del sistema (Fig. 7), en un hábitat definido como grupo II (Fig. 5).En tanto que el segundo grupo B, tiene una amplia distribución en el sistema, con cierta tendencia hacia el canal del estero, en un hábitat definido como el grupo I (Fig. 5). Algunas especies como Achirus mazadanus, Citharichthys gilbertiyPomadasys macracanthus con niveles de similitud de 0.8, no quedan como parte integrante del grupo, dando como resultado una heterogeneidad entre ellos. La explicación es que no se tiende a la similitud, porque su distribución es amplia así como por su frecuencia de aparición. Podría decirse que no hay sitios de preferencia, ni siquiera en sus hábitos porque los individuos sobre los cuales preda también están ampliamente distribuidos. En términos generales se puede observar que la ictiofauna presenta una inclinación a distribuirse en casi todo el sistema en un hábitat prácticamente uniforme, con una ligera tendencia relativa hacia el canal del estero, prácticamente en un hábitat con traslape de los dos grupos I y II del hábitat (Fig. 5). 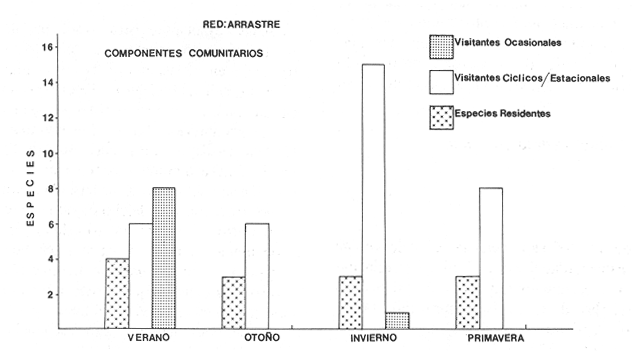 Figura 8. Componentes comunitarios con sus variaciones estacionales a través del ciclo anual. OTOÑOEsta época del año es la de mayor precipitación, donde las temperaturas bajan gradualmente (Fig.2). La región de Tecuala tiene un rango promedio mensual de 26.2 a 27.6 °C, en tanto que en Rosa Morada es de 24.6 a 28.3°C. La evaporación tiene un descenso igualmente gradual, de 123.9 a 124.4 mm de promedio mensual en Tecuala y de 107.5 a 141.6 mm en Rosa Morada. La precipitación en Tecuala registra un rango de 123.9 a 124.4 mm de promedio mensual y Rosa Morada de 716 a 333.9 mm. La afluencia de los principales ríos es la máxima en esta época del año; esto hace que el sistema se convierta en dulce-acuícola, contrastando notablemente con el verano (Fig. 3). Es tan determinante la influencia fluvial, que la mayor parte del sistema tiene valores de 0 0/00, en tanto que la Boca de Teacapán y Parte Baja del Estero oscila entre 7 y 10% y 10 y 275 para superficie y fondo respectivamente disminuyendo gradualmente hacia dentro del sistema (Fig. 4). Las temperaturas también muestran un cambio, en un sentido espacial-longitudinal, observándose un proceso inverso al verano, con valores relativamente mayores en la Boca de Teacapán y Parte Baja del Estero que oscilan entre los 29.8 a 31.3°C y 29.9 a 30.8°C de superficie y fondo respectivamente. Las temperaturas menores existen en la región sur, en la laguna, con fluctuaciones de 24.3 a 31.6°C y de 24.4 a 32.4°C de superficie y fondo respectivamente. Las profundidades y transparencias son mayores en la Boca de Teacapán y Parte Baja del Estero con 12 m y 1.4 m respectivamente; la parte sur del sistema tiene 2.2 m de profundidad y 0.40 m de transparencia, ésta se debe al acarreo de materia orgánica y detritus por parte de los ríos y distributarios. El tipo de sustrato cambia gradualmente de verano a otoño, conforme se acerca la época de lluvias, así es común encontrar en la laguna, sustrato básicamente fangoso y arena-fango en lugares de influencia marina, como las bocas y parte Baja del Estero. En el análisis "cluster" efectuado para otoño se clasificaron dos grupos de estaciones (Fig. 5). El primero de ellos (grupo I), es muy pequeño y presenta atributos bien definidos como son altas salinidades, temperaturas relativamente bajas, transparencias altas, sustrato de arena-fango y fauna macrobéntica escasa; este grupo describe a un hábitat marino y contine como principal característica la estabilidad, en función al gradiente safino y los pocos cambios que sufre por la influencia fluvial. El segundo (grupo II) es mucho más grande e incluye a la mayor parte del sistema, es un hábitat homogéneo característico principalmente por bajas salinidades, así como temperaturas mayores, abundancia de fauna macrobéntica y algas rodoficeas. Este grupo muestra una homogeneidad que es ocasionada por la estación lluviosa y la gran descarga de aguas dulces, a inicios de otoño, que circulan hacia el mar principalmente por la Boca de Cuautla (Fig. 5). Estos cambios contrastantes de verano a otoño provocan una dinámica también en las comunidades de organismos, propiciando que muchas especies emigren hacia la parte norte del sistema. Estructura de la Comunidad
Diversidad En esta época de otoño aparecieron 9 especies con 49 ejemplares. La diversidad tiende a disminuir en relación a otras temporadas; sin embargo, esto puede deberse a la selectividad de la red de arrastre, ya que estudios efectuados por Alvarez-Rubio et al. (1986) con otras artes de pesca obtiene hasta 2.75 de H'n. Los índices de diversidad como H'n, D' y de biomasa H'w presentan una relación directa con el número de individuos y especies, esta correlación positiva de H'w y H'n, parece indicar la heterogeneidad ambiental. Lo anterior explicaría la existencia de ciertos hábitat de complejidad estructural en los organismos bentónicos o cuando menos que algún elemento de heterogeneidad ambiental está involucrado en una correlación negativa, que pocas veces sucede en el sistema de Teacapán Agua Brava. Esto indicaría que los efectos ambientales sobre la biomasa son nulos o escasos. Por otra parte si se compara el índice de equitatividad (J'), existe una correlación negativa. Este comportamiento se presenta en general para red de arrastre, no sucede así para otras artes de pesca donde la luz de malla es una limitante que incide en la diversidad. En realidad el comportamiento de J', que es un índice de abundancia relativa, en relación a H'n, comprueba lo expresado anteriormente en relación con H'n y H'w (Fig. 6). La diversidad máxima dentro del sistema, se localiza en los lugares donde existe mayor salinidad, en este caso el extremo norte del ecosistema (Boca de Teacapán, Parte Baja del Estero y Canal del Estero). Es notorio que el movimiento de los organismos desde el canal del estero y laguna es hacia las áreas de mayor salinidad. La menor diversidad se presenta en áreas de fuerte influencia dulceacuícola, como lo es la laguna, y generalmente ésta es la zona con dominancia para algunas especies eurihalinas. Distribución y Abundancia de las Especies De las 9 especies registradas sólo tres de ellas se consideran como dominantes y por lo tanto con amplia distribución en el sistema, el resto se mueve hacia un gradiente salino alto (Fig. 6). Estas especies dominantes varían notablemente en su distribución en comparación a la época anterior. Así, Achirus mazatlanus, tiene una tendencia a dispersarse hacia la Boca de Teacapán y Canal del Estero, aunque recientes muestreos indican que también se puede encontrar hasta la laguna, aunque en menor frecuencia. El hecho de que se muevan hacia la parte norte del sistema en favor de un gradiente salino, probablemente se deba a una migración de la macrofauna y por lo tanto su comportamiento esté en función de las especies sobre las que preda; su frecuencia de aparición en el área es de 36% del total. Arius liropus tiene una alta frecuencia de aparición con un 55% del total, siendo la especie más abundante. En verano su tendencia de distribución es desde el canal del estero a la laguna, pero en otoño es posible encontrarla hasta la Boca de Teacapán, su movimiento probablemente se deba a que otros organismos sobre los cuales se alimenta estén emigrando hacia alta salinidad. La otra especie Centropomus robalito, tiene un 27% de aparición y baja abundancia numérica; sin embargo, observaciones hechas por pescadores y muestreos recientes, indican que esta especie es muy abundante en el área de la laguna de Agua Brava y su distribución hacia la parte norte del sistema es pobre o escasa, ya que no se encontró ningún ejemplar en esta época de lluvias. El resto de las especies muestreadas tienen una tendencia a dispersarse en favor de el gradiente de salinidad, es decir hacia la Boca de Teacapán y parte Baja del Estero (Fig. 9). Esta dispersión de los organismos eurihalinos hacia la parte sur del sistema tiene poca relevancia. Componentes Comunitarios Los visitantes cíclicos representa el más alto porcentaje 77%, a diferencia de la época anterior en que existía cierta tendencia a la predominancia de componentes ocasionales, de los cuales en esta épóca del año no se encontró a ninguno, contrastando notablemente con la estación climática anterior (Figs. 2 y 8). Sin embargo, existen reportes de su aparición en otras artes de pesca, como en agallera y chinchorro (Alvarez Rubio et al.1986). La disminución de especies ocasionales puede deberse a que el medio es en gran parte dulceacuícola y por consiguiente difícilmente invadido por especies marinas ya que sólo existe dispersión en el sistema por especies que toleran bajas salinidades. Las especies residentes representan el 22% y en general son especies eurihalinas y prácticamente son las mismas que se encuentran en la época anterior y que tienen amplia distribución en casi todo el sistema, a diferencia de las ocasionales que tienen bajo porcentaje y se restringen a la Boca de Teacapán. La dominancia de especies residentes tales comoAchirus liropus, Centropomus robalito yAchirus mazatlanus, indica que estos componentes comunitarios son los que realmente aportan la mayor información y flujo de energía en el sistema. Aunque puede haber otras especies comoEugerres axillarisque es un visitante cíclico, que frecuentemente aparece. 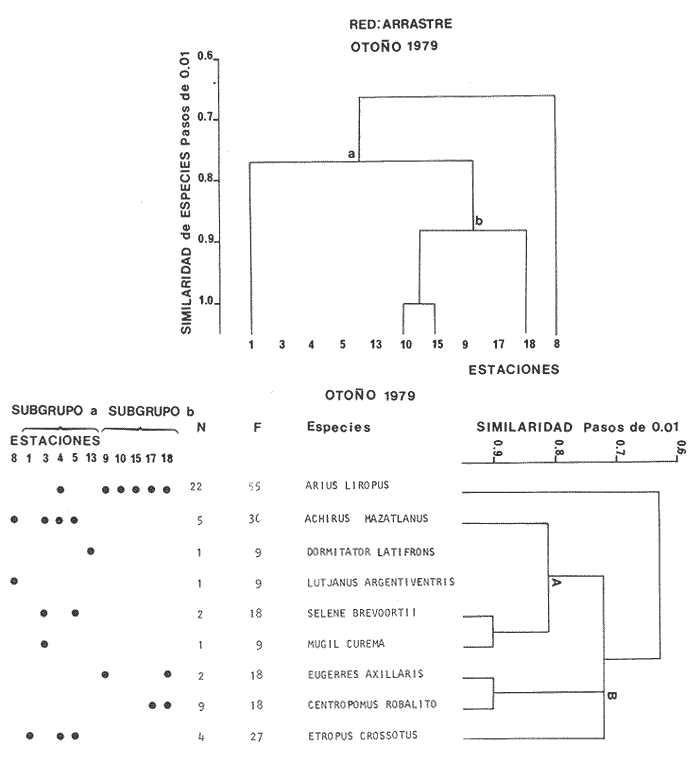 Figura 9. Diagrama "cluster" que re resentan la similaridad de las especies, abundancia numérica (N) y frecuencia de aparición (F) en las estaciones del sistema durante el otoño. Categorías Ictiotróficas Los consumidores de primer y segundo orden ocupan el mismo porcentaje en cuanto a su frecuencia con 33%. Esto es debido a la propia selectividad de la red de arrastre, porque en otras artes de pesca, como agallera y chinchorro, existe un ligero incremento de especies de segundo orden. Parece ser que en esta época del año existe una tendencia al equilibrio en las cadenas alimentarias, lo cual concuerda con la más alta diversidad anual y con una biomasa relativamente baja. Esto puede indicar que la producción de uno o varios componentes comunitarios se distribuyen entre los diversos elementos de los niveles tróficos, y por tanto la abundancia de recursos equilibrados, se distribuyen a su vez en las distintas categorías tróficas. Esta abundancia equilibrada puede deberse a la alta productividad generada por distintas vias, como materia orgánica en descomposición y detritus que son aprovechados por especies mierobianas principalmente algas y bacterias, zooflagelados, ciliados y organismos de la meiofauna. Muchas especies de peces pueden aprovechar a estos organismos para su alimentación como sucede en lagunas similares a Teacapán-Agua Brava (Yáñez-Arancibia, 1978; Edwards, 1978). Afinidad de Especies y Hábitat Los grupos observados en el "cluster" de especies indican una concordancia con la similaridad del hábitat descrito para esta época de lluvias (Figs. 5 y 9). Se observan 2 sub-grupos de especies: A y B, el primero de ellos (A) presenta una tendencia de distribución hacia la Boca de Teacapán y Parte Baja del Estero, precisamente en la parte del sistema con más influencia marina, caracterizada por un hábitat que fue clasificado como grupo I (Fig. 5). Este grupo involucra a la mayoría de especies, en tanto que el segundo sub-grupo (B) tiende a dispersarse hacia el canal del estero y laguna: con excepción de una especie que lo hace en la parte norte en un hábitat con características dulceacuícolas y que es clasificado como un grupo II (Fig. 5). Este sub-grupo de especies (B), es pequeño y con amplia distribución en el sistema y caracteriza a especies que son de alta frecuencia de aparición que guardan cierta similitud debido a la coexistencia que puediesen guardar entre sí. El patrón general, es que existe una tendencia en todos los subgrupos, de especies a desplazarse hacia zonas de mayor salinidad y menor influencia fluvial (Boca de Teacapán y Parte Baja del Estero) en un hábitat que tiene como característica principal las salinidades más altas del sistema (grupo I de estaciones del hábitat, Fig. 5), a diferencia del verano donde las poblaciones de pesca se desplazan hacia el interior del sistema. INVIERNOLa precipitación decrece hasta niveles prácticamente nulos y aunque se observan algunas lluvias, éstas se presentan esporádicamente mientras que las temperaturas son relativamente bajas tomando en consideración que se trata de un clima tropical. La región que corresponde a la parte norte del sistema (estación meteorológica de Tecuala), tiene un rango promedio mensual de 20.3 a 24.4°C, en tanto que en Rosa Morada es de 21.05 a 22.0°C. La evaporación al igual que la temperatura tiene un descenso, observándose en Tecuala valores de 89.2 a 105.2 mm y de 66.7 a 117.4 mm en Rosa Morada. La precipitación tiende a disminuir gradualmente, aunque llegan a registrarse algunos chubascos hacia la parte sur del sistema, en Tecuala se observan valores de 0 a 4.76 mm de promedio mensual y de 0.75 a 48.8 mm (Figs. 2 y 3). Lo que se refleja en las características del sistema, donde las fuertes corrientes de ambas bocas, vuelven a dominar gradualmente proporcionando propiedades muy similares a las observadas en verano, que marcan el intermedio entre lluvias y secas y la salinidad vuelve a ser el elemento preponderante en el sistema (Fig. 4), que muestra valores típicamente marinos en la Boca de Teacapán y Parte Baja del Estero con pequeñas fluctuaciones de 36 a 38%. El canal del estero tiene salinidades más bajas que la Parte Baja del Estero con fluctuaciones que van desde 30 a 40%. mientras que en las partes altas de la laguna, la salinidades disminuyen gradualmente hasta la porción más interna con 22%. Las temperaturas del agua son invertidas en comparación con otras épocas del año, ya que ésta es la estación climática más fría; la Boca de Teacapán y Parte Baja del Estero, tiene valores que van desde 22 a 26°C y de 22.0 a 23.5°C para superficie y fondo respectivamente, en tanto que en la laguna es de 24.0 a 27.0°C de fondo y superficie (Fig. 4). La descarga de los Bejuco y Rosa Morada inlfuyen directamente sobre la laguna y aún en la Boca de Cuautla (Fig. 3). Un análisis "cluster" para el hábitat, muestra a dos grupos de estacionesr: el primero (grupo 1, Fig. 5), que correspoende a la Boca de Teacápan y Parte Baja del Estero, con altas salinidades (típicamente marinas), temperaturas bajas, sustrato principalmente arenoso, transparencias altas y fauna macrobéntica escasa; el segundo grupo (grupo II, Fig. 5), presenta características propias del canal del Estero y laguna, con salinidades menores a las de la Boca de Teacapán, profundidad menor y transparencia baja, debido a los escasos aportes fluviales, especialmente en el área de la laguna, donde la salinidad aún es baja; sustrato y ocasionalmente arena-fango que alberga grandes cantidades de fauna macrobéntonica: moluscos, crustáceos y anélidos, mientras que otros grupos de organismos son escasos. Estos dos grupos tienen una elevada correlación con las características de otoño, sin embargo el descenso de la descarga fluvial le confiere características ambientales propias. En síntesis el panorama del sistema se ve reflejado por dos grupos de estaciones, uno representado por la Boca de Teacapan y Parte Baja del Estero con persistente influencia marina, y otro representado por el canal del Estero y laguna, caracterizado por ser una zona de intensa mezcla entre aguas marinas y pluviales. Estructura de la Comunidad
Diversidad Se analizaron un total de 249 ejemplares de 19 especies. Los índices H'n, H'w, D y Y, tienen un comportamiento casi definido por la selectividad de la red de arrastre, cuando se comparan con otras artes de pesca como agallera y chinchorro, sin embargo los factores bióticos y abióticos también juegan un papel relevante. Cuando se compara H'n y D, se observa un incremento positivo en relación al número de especies, individuos y biomasa y una correlación negativa con la equitatividad (J'). Esto indica que existe una disminución de la diversidad en invierno, así el índice H'n para la red de arrastre tiene un valor de 1.842 para esta época del año, que no supera los registros obtenidos en agallera de 2.518 ni chinchorro con 2.753. Por consiguiente se puede afirmar que existe una tendencia de la diversidad a disminuir en forma generalizada, y el incremento aparente en la red de arrastre, se debe a su propia selectividad. La tendencia hacia un decremento de la diversidad se ve comprobado por el aumento de especies dominantes en esta época invernal. Todo parece indicar que con la disminución del aporte del material orgánico, gran parte de las especies no ingresan al sistema y solo lo hacen los componentes cíclicos, que cumplen alguna función determinada como alimentación, crecimiento y probablemente reproducción (Fig. 6). El sistema presenta una alta diversidad en el canal y en la Parte Baja del Estero los valores más bajos se encuentran en la laguna y Boca de Teacapan, donde predomina la influencia marina y se observa movimiento de las poblaciones de peces hacia el canal del Estero y laguna. Esto sucede conforme el gradiente salino es mayor en su concentración por la disminución de aporte dulceacuícola. Distribución y Abundancia de las Especies Las 19 especies presentes se distribuyen conforme al habitat (Fig. 10). Algunas especies son dominantes en cuanto a número, biomasa y distribución:Arius liropus, Centropomus robalito, Diapterus peruvianus yAchirus mazatlanus. A. liropuspresenta un comportamiento diferente en relación a la época anterior, dispersándose desde la parte media del canal del Estero hacia la laguna (Fig. 10), este patrón de distribución es similar al de verano. Este comportamiento esta en función de parámetros ambientales, principalmente la salinidad y probablemente se deba a que muchas especies de la fauna macrobéntonica se mueven hacia el canal del Estero y parte de la laguna, por lo que su dinámica puede estar asociada a los lugares con mayor disponibilidad de alimento. La aparición de esta especie en el sistema constituye el 46% del total muestreado. C. robalito,presenta un comportamiento o patrón de distribución similar al deA. liropus (Fig. 10), solo que en esta época del año, su distribución se amplia desde el canal del Estero a la laguna, observando una abundancia numérica mayor hacia la parte sur del sistema. Es común observar la coexistencia entre ambas especies, formando grupos con características propias, lo que hace suponer que su alimentación es lo suficientemente diferente como para que pudiese existir competencia interespecífica.Diapterus peruvianus, con una frecuencia del 23% del total, se presenta desde el canal del Estero a la laguna, en menor abundancia se le localiza hasta la parte norte del sistema, Boca de Teacapan y Parte Baja del Estero, (Fig. 10). La última especieAchirus mazatlanus, con 77% de frecuencia, es la especie de más amplia distribución en el sistema, desde la Boca de Teacapan hasta la laguna. El resto de las especies tienden a distribuirse desde el canal del Estero a la laguna y escasamente en la Boca de Teacapan. Componentes Comunitarios Los componentes cíclicos son los más representativos, 84%. Las especies residentes ocupan el segundo lugar en abundancia con 10% y los componentes ocasionales solamente 5%, esto se debe a la baja diversidad de la época. El comportamiento que se observa es muy similar al de primavera, lo cual define gradualmente la influencia marina como el principal factor que afecta a la dinámica comunitaria. Asimismo la disminución del aporte fluvial, ocasiona el incremento de especies con amplio rango de adaptabilidad (eurihalinas y euritérmicas). Los componentes comunitarios dominantes de esta época son Arius liropus con una distribución del canal del Estero a la laguna, de hecho es una especie considerada como residente permanente, otra especie residente esCentropomus robalito que tiene distribución preferencial hacia la laguna. Las anteriores especies son dominantes sólo en la zona sur del sistema, por el contrarioAchirus mazatlanus, que también es residente permanente, presenta una fuerte dominancia en todo el sistema, lo que se debe principalmente a que es una especie asociada con el bentos y por tanto es muy selectiva y presenta cierta tendencia a ser capturada con la red de arrastre; sin embargo, su alta distribución se debe también a la capacidad de adaptación que le permite ocupar todos los hábitat, principalmente por su amplio espectro alimenticio. 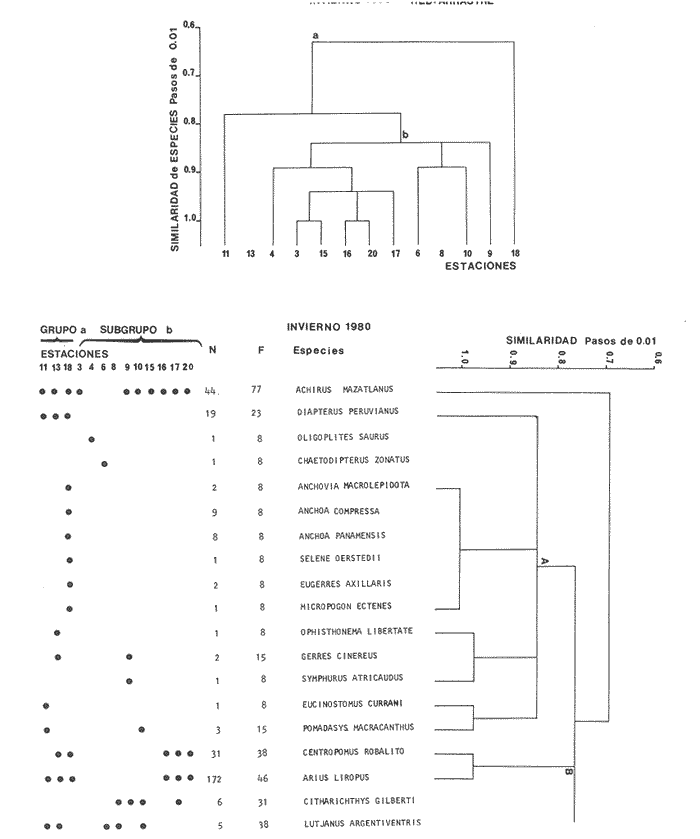 Figura 10. Diagrama "cluster" que representan la similaridad de las especies, abundancia numérica (N) y frecuencia de aparición (F) en las estaciones del sistema durante el invierno. Diversas especies son visitantes cíclicos, de estas, Diapterus peruvianus es la única con fuerte dominancia en el área, principalmente hacia el canal del Estero y laguna. Otro visitante cíclico de interés comercial esPomadasys macracanthus, aunque su abundancia es baja así como su distribución en el sistema, ya que se restringe hacia la parte media del canal del Estero; aunque en biomasa por individuo representa un porcentaje relativamente más elevado. El invierno, época con características ecológicas que sugieren el patrón que se presentará en primavera (Fig. 8), de hecho puede considerarse como una época de transición entre dos importantes periodos climáticos. Categorías Ictiotróficas Los consumidores de primer orden representan el mayor porcentaje con 47%, los del segundo orden 42% y los del tercer orden con 16%. La dominancia del 1er. y 2do. orden se debe probablemente, a que muchas especies presentan un espectro trófico más amplio debido a que el ambiente es más homogéneo en algunas áreas y los organismos responden a un mismo hábitat de diferentes maneras de acuerdo a su distribución, hábitos alimenticios, disponibilidad de alimento, tipo de sustrato. En general la abundancia de cada nivel, depende no sólo de factores ambientales bióticos y abióticos, sino también de la selectividad del arte de pesca. Alvarez Rubio et al. (1986), menciona que la abundancia de consumidores de 1er. orden es menor en la red agallera en tanto que los consumidores de 3er. orden tienden a incrementar. También es probable que existan variaciones en relación a sitios de colecta por ejemplo si es en zonas cercanas a las playas, en áreas protegidas por el mangle, en pastos marinos o en bancos de algas. Aunque estas variaciones en cuanto a la proporción de consumidores se puede atribuir a problemas de selectividad, lo más probable es que se deba a razones propias de la época del año o de variables poco conocidas relacionados al nicho ecológico de las especies, y a las respuestas fisiológicas frente a variables ambientales abióticas. También puede deberse a interacciones de tipo intraespecífico en que los efectos del tamaño poblacional de las especies, y la abundancia del recurso sea compartido otras, disminuyendo la variedad de especies a causa de la limitación del alimento. En Agua Brava, donde el ambiente se hace más uniforme conforme se aproxima la época de secas, ocurre una escases del recurso debido a que las especies saturan el ambiente aunque los competidores pueden coexistir bajo sus capacidades de carga. En conclusión, en ambientes más o menos uniformes como invierno, primavera y verano, se espera la presencia de especies generalistas en comunidades insaturadas con niveles tróficos inferiores saturados (consumidores de 1er. y 2do. orden), en tanto que en comunidades saturadas con mayor diversidad, como otoño y verano, es de esperarse especialmente niveles tróficos superiores (consumidores de 3er. orden) (Fig. 11). Afinidad de Especies y Hábitat Se clasificaron a dos grandes grupos de especies con el análisis de "cluster", A y B, el primero de ellos muestra una tendencia a oncentrarse hacia el canal del Estero en el hábitat determinado como grupo II (Fig. 5), que tiene influencia dulceacuícola. El grupo B reune a especies de amplia distribución en el sistema, alguno de ellos muestran parches de poblaciones hacia la parte norte del sistema y otras hacia el sur. De manera global se observa que el desplazamiento de la ictiofauna se realiza desde la Boca de Teacapán hacia el interior del canal del Estero. Esta dinámica de la comunidad se manifiesta conforme la salinidad aumenta en el sistema. Este parámetro químico predomina debido a la disminución fluvial y por consiguiente al poco aporte de agua dulce. Con este fenómeno, gradualmente se inician las características propias de la época de secas (Fig. 5). PRIMAVERACorresponde a la época de secas donde se presentan las temperaturas más altas del año. La temperatura ambiente en el sistema tiene un rango de 21.5 a 26.7°C en la parte norte, en el sur es de 23.5 a 26.3°C. La evaporación presenta una relación directa con la temperatura, con rango promedio mensual de 87.7 a 168.2, para Tecuala y 117.4 a 173.5 para Rosa Morada. La precipitación es nula en ambas regiones y por consiguiente los ríos Cañas, Rosa Morada y Bejuco, disminuyen casi totalmente su cauce, en tanto que el Río Acaponeta sigue aportando agua dulce (Figs. 2 y 3). El comportamiento de este parámetro es similar al de verano, con valores típicamente marinos, 33 a 36% en las bocas y Parte Baja del Estero, y de 42% para la laguna (Fig. 4). Los valores más bajos se registran en las bocas y parte baja del Estero con rangos de 33 a 36% y de 33 a 34% de superficie y fondo respectivamente (Fig. 4), y se incrementagradualmente, con pequeñas fluctuaciones, en el canal del Estero con rango de 35 a 38% y para la superficie y fondo. Este incremento se debe a la fuerte evaporación en una zona de poca profundidad, donde el calentamiento de la columna es prácticamente uniforme, lo que ocasiona salinidades altas, algunas veces mayores en la superficie que en el fondo. La temperatura presenta fluctuaciones poco notables con un ligero incremento en 4°C. Los registros de transparencia son los mayores del año, estos se presentan en las bocas y parte baja del Estero, desde 1 a 2 m, los menores en el canal del estero con un rango 0.40 a 1.0 m y en la laguna de 10.40 a 0.60 m. Al finalizar la primavera e inicio del verano con las primeras precipitaciones, este cambio climático estacional permite que se reinicie el ciclo ambiental que caracteriza los hábitat. Las variables en la salinidad del sistema de 0% en otoño a 42% en primavera, son debidos en gran proporción a la boca artificial de Cuautla, principalmente porque esta boca es inestable y permite corrientes de alta velocidad hasta de 0.96 m/seg., que es capaz de erosionar el fondo y los márgenes del canal (Cepeda, 1977). Esto puede verse reflejado en la distribución y establecimiento de comunidades de peces, originando que en el sur del sistema se encuentren solo especies con respuestas fisiológicas en adaptación a una zona variable. 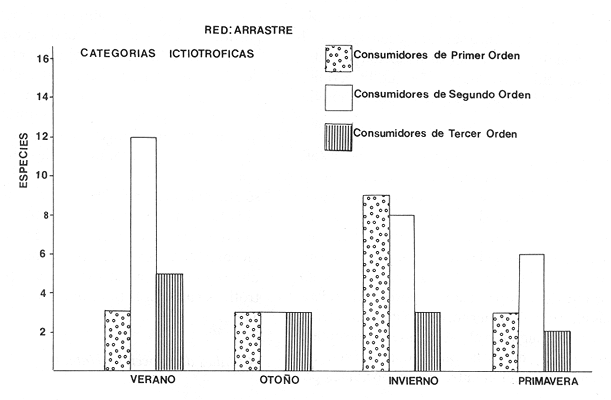 Figura 11. Categorías ictiográficas y las diferentes proporciones en que aparecen durante las cuatro estaciones del año. Estructura de la Comunidad
Diversidad Fueron analizados 98 ejemplares de 11 especies. En la figura 6 se observa el comportamiento de los índices de diversidad así como los parámetros poblacionales de biomasa y densidad. El índice H'n de Shannon y Weaver (1963), presenta el valor más bajo de todo el año. Este mismo patrón es observado con el índice de Margalef, el cual indica la riqueza de especies o el posible número máximo de acciones interespecíficas contra el máximo número posible del logaritmo de todas las poblaciones que interactuan con las especies. Este índice coincide con la disminución en el número de las especies, en tanto que la abundancia relativa o equitatividad (F) tiene un patrón inverso. Sin embargo, como ya se indicó, esta hipótesis no se comprueba para otras artes de pesca donde se puede encontrar una correlación positiva, En cuanto al índice de biomasa (H'w), éste tiende a incrementarse justamente cuando la diversidad disminuye, existiendo una correlación inversa (Fig. 6), lo cual indicaría la abundancia en biomasa de algunas especies que son dominantes. Los valores más altos de diversidad para esta época,se presentan en el canal del Estero y laguna con fluctuaciones de poca consideración, los más bajos se registran en la Boca de Teacapan. Este comportamiento puede estar relacionado con la presencia de algas, fauna macrobentónica y sedimento blando que permite la proliferación de algunos moluscos, especialmente gasterópodos y bivalvos, aunque también existen crustáceos decápodos asociados a los grandes manchones de algas, principalmente clorofíceas. Las estaciones 9 y 10, Tecualilla y Sta. Rita respectivamente, y la 11, Isla del Mogote en menor grado, ejemplifican este comportamiento. Estas localidades representan importantes sitios de pesca, generalmente con alta divesidad de especies. Distribución y Abundancia de las especies. De las 11 especies que aparecen en esta época, existen algunas que son dominantes:Achirus mazatlanus, Centropomus robalito, Diapterus peruviatius yArius liropus. Estas especies tienden a distribuirse hacia la parte sur del canal del Estero y esencialmente en la laguna; esporádicamente se llegan a localizar hacia la parte norte del sistema (Fig. 12). A. mazatlanus, con una frecuencia del 40% del total, se distribuye desde la parte media del canal del Estero hasta la laguna, a diferencia de la época invernal en que presenta una amplia distribución en todo el sistema (Fig. 12). Esta tendencia a situarse en áreas donde existe alta diversidad como el canal del Estero, determina una estrategia en la dinámica de la especie que está en función de los hábitos alimenticios. C. robalito tiene una frecuencia del 40% de aparición, su distribución es similar a la época de invierno, con un gradiente numérico que se incrementa en la laguna. Todos los elementos parecen indicar que su dispersión está en función a la dinámica poblacional de los macroinvertebrados, los cuales se presentan con notable diversidad principalmente en el canal del Estero. Las especiesD. peruvianus y A. liropus con 60 y 70% de frecuencia respectivamente, tienen el mismo patrón de comportamiento que las especies anteriores, ya que tienden a formar un grupo de organismos que existen conjuntamente y no compiten por el mismo alimento, por lo que este grupo tipifica a la comunidad de peces en el sistema de Teacapán-Agua Brava, Sin embargo, es necesario aclarar la importancia de efectuar un análisis trófico a fondo de estas especies para comprobar la hipótesis planteada, ya que la mayoría de las especies tienen baja frecuencia y en su mayoría son ocasionales con distribución restringida en la parte norte del sistema. Componentes Comunitarios Los componentes cíclicos representan la mayor parte de la comunidad con 81%, mientras que las especies residentes sólo tienen el 19%. Las especies visitantes ocasionales están prácticamente ausentes en la época de secas, quizá por las condiciones poco propicias para cstas especies que generalmente, no utilizan la laguna. El uso de otras artes de pesca demuestran la existencia de estos componentes aunque en un porcentaje muy bajo. Es probable que este fenómeno esté relacionado con la época de secas donde la diversidad es baja, tanto en necton como en macrobentos, haciendo al sistema poco atractivo como área de alimentación. Este comportamiento también es probable que se deba a que el potencial productivo del sistema, como fitoplancton, bentos, algas y detritus disminuya. El incremento gradual de la salinidad en invierno, alcanza sus valores máximos en primavera, con 35% en las bocas y áreas someras del canal del Estero y de 38 a 42% en el canal del Estero y laguna, lo cual también provoca un efecto en las poblaciones. Estos cambios permiten que se establezcan, al menos transitoriamente, algunos organismos con adaptaciones a un sistema inestable (Fig. 8). Categorías Ictiotróficas Los consumidores de segundo orden ocupan un 50%, en tanto que los de primer orden el 41% y en menor frecuencia los de tercer orden. En el ambiente uniforme y constante de la primavera, los recursos escasean debido a que las especies saturan estos ambientes, y aunque los competidores son capaces de coexistir bajo su capacidad de carga individual, la población disminuye, aún cuando en realidad pertenezcan a comunidades insaturadas y se espere encontrar especies de niveles tróficos inferiores. Aquí se dan casos de especies capaces de cambiar de nivel trofico, por ejemplo de primer a segundo orden. El hecho de que abunden más especies dentro del primer y segundo orden, sólo indica que los organismos con posibilidades para consumir otro tipo de alimento son capaces de subsistir en esta área en época de secas (Fig. 11). Afinidad de Especies y Hábitat El análisis efectuado a los grupos de especies en el "cluster" clasifican a dos sub-grupos. El primero de ellos (A), es grande e incluye prácticamente a todas las especies, pero su abundancia en número de individuos es bajo; este grupo de especies tiene una amplia distribución en el sistema (Fig. 12), debido a que el hábitat es homogéneo en cuanto a la salinidad. El segundo grupo (B), es más pequeño e incluye aquellas especies que son dominantes en cuanto a número y frecuencia de aparición (Fig. 12); este grupo tiene una tendencia de distribución particularmente hacia el canal del Estero y laguna, donde las principales especies son:Achirus mazatlanus, Centropomus robalito, Diapterus peruvianus y Arius liropus que son especies que coexisten a lo largo del año. En términos generales no se pueden precisar grupos de especies, ya que su distribución es prácticamente en todo el sistema debido a la uniformidad del amiente (Fig. 5). El análisis "cluster" en un ciclo anual (Fig. 13), indica que un sub-grupo de especies (A) tiende a distribuirse hacia el sur del sistema; este sub-grupo de especies está representado por escasos individuos y alta diversidad y similaridad ecológica dada principalmente por su escasa aparición a través del año. El segundo sub-grupo (B) es pequeño y contiene especies dominantes que coexisten a lo largo del año y con una amplia distribución en el sistema (Fig. 13); este conjunto de especies forman un "grupo tipo" o "dominantes ecológicos". 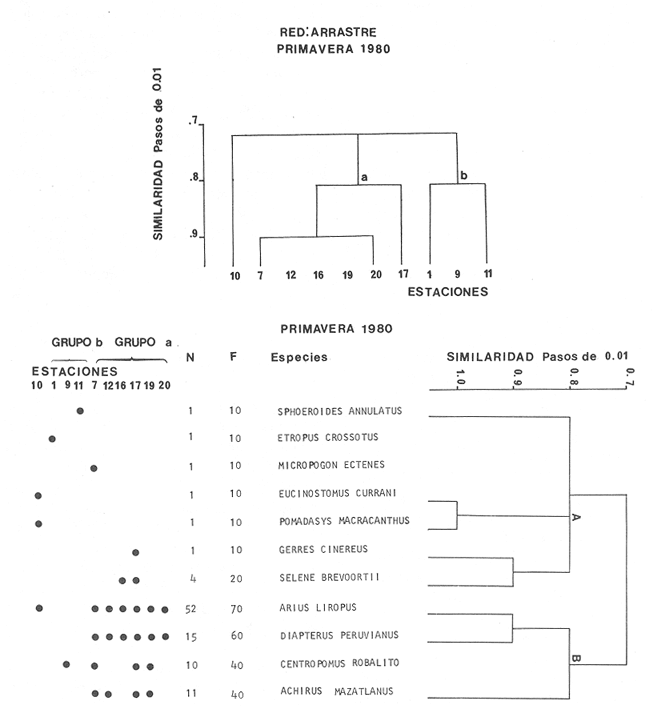 Figura 12. Diagrama "cluster" que representan la similaridad de las especies, abundancia numérica (N) y frecuencia de aparición (F) en las estaciones del sistema durante la primavera. 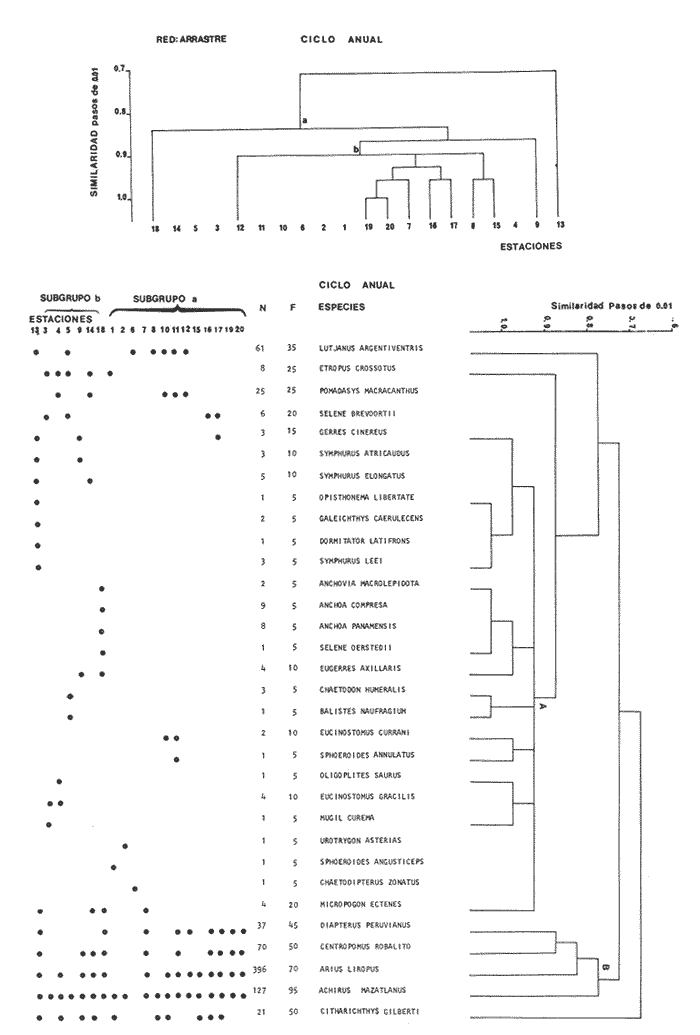 Figura 13. Diagrama "cluster" que representan la similaridad de las especies, abundancia numérica (N) y frecuencia de aparición (F) en las estaciones del sistema durante el ciclo anual. Otras artes de pesca como chinchorro y agallera no manifiestan este tipo de "grupos tipo", lo cual es importante al seleccionar los métodos cuando se estudia una comunidad. Al hacer un análisis de la dinámica comunitaria, se detectó que existe un grupo de especies que se desplaza a través del sistema en función del régimen climático, ocasionado por un gradiente salino, que controla la abundancia y distribución, pero que no limita las especies drásticamente. Si bien este grupo indica un cambio a través del año, no se puede decir que sea una sucesión ecológica de la comunidad, más bien es una sucesión estacional controlada por factores físicos. DISCUSIÓN
CARACTERIZACIÓN DEL HÁBITATEl sistema Teacapán-Agua Brava se encuentra ampliamente influenciado por los parámetros meteorológicos, principalmente por las recipitaciones y en consecuencia por el aporte pluvial. El hábitat se clasificó de acuerdo a las características ambientales propias como temperatura, salinidad y otros factores bióticos para diferentes épocas del año. En verano se clasificaron 2 subgrupos de estaciones (Fig. 5), el primero (subrupo II) que incluye la parte Baja del Estero y las Bocas, presenta los siguientes caracteres: temperatura baja, alta transparencia, sustrato arenoso, considerable profundidad, fauna macrobéntica y vegetación sumergida escasa; el segundo grupo (subgrupo I) que incluye la región sur de sistema; parte del Estero y Laguna, contrasta con el anterior y presenta los siguientes caracteres: temperatura alta, transparencia baja, sustrato arena-fango, profundidad somera, abundante fauna macrobéntica y vegetación sumergida numerosa. Ambos subgrupos tipifican a 2 hábitat diferentes. Durante la época de lluvias en otoño, los hábitat cambian drásticamente con la gran afluencia de descargas fluviales que disminuyen notablemente el gradiente salino. En esta época se clasifican dos grupos de estaciones, el primero (I) es poco notable con características de salinidad alta, cercana a la del mar, temperatura baja, alta transparencia y profundidad, e incluye la Boca de Teacapán y Parte Baja del Estero. Este hábitat es en general muy estable a través del año por la notable influencia marina aún en la época con mayores descargas fluviales, además es notable la ausencia de mangles y por tanto, escaso aporte de materia orgánica. El segundo grupo (II) ocupa la mayor parte del sistema a excepción de los sitios mencionados, se caracteriza por cierta homogeneídad, debido a salinidades muy bajas, temperaturas ligeramente mayores, abundante fauna macrobéntica y vegetación sumergida. Esto se debe al aporte fluvial de los ríos Acaponeta, Bejuco y Rosa Morada principalmente, que además de diluir grandemente la cuenca del sistema, aporta nutrientes. Estos cambios en la dinámica ambiental provocan que las comunidades de peces se concentren en favor del gradiente salino. Durante el invierno, la disminución gradual de las lluvias, provoca características ambientales similares a las de verano a excepción de la temperatura que es más baja en esta época. Así, la influencia marina vuelve a predominar en la mayor parte del sistema. Del análisis "cluster" desprenden 2 grupos importantes de estaciones, el primero, grupo I (Fig. 5), incluye a la Boca de Teacapán y Parte Baja del Estero, con salinidades marinas, temperatura baja, transparencia y profundidad alta, sustrato arenoso y fauna maerobéntica escasa, es decir, mantienen prácticamente las caractéristicas de la época anterior. El segundo grupo (II) está representado por el canal del estero y la laguna donde persiste la salinidad y la temperatura baja, poca transparencia, profundidad somera, sedimento limo-arcilloso principalmente, aunque existen vestigios de arena en algunas localidades, y gran cantidad de fauna macrobéntica, esencialmente moluscos, crustáceos y anélidos. Esta época del año es una fase ambiental intermedia entre la época de secas, primavera y parte del verano y la de lluvias, otoño. En la primavera, el aporte fluvial disminuye casi en su totalidad sólo el río Acaponeta continua aportando escasos volúmenes de aguas consiéntales, esto ocasiona que el sistema se comporte como una cuenca de evaporación y por tanto se torne hipersalino en el área sur, mientras que en el norte el ambiente es típicamente marino, Boca de Teacapán y Parte Baja del Estero (Fig. 4). Al analizar la similaridad en el hábitat se pudo clasificar sólo un grupo (A) que incluye a la mayor parte de las estaciones (Fig. 5). Esto indica el grado de homogeneidad ambiental del hábitat durante esta época. El ambiente se caracteriza por el aporte fluvial casi nulo y un incremento del gradiente salino. Un análisis entre pequeños subgrupos de estaciones con alta similaridad, reflejan la afinidad ambiental que existe entre áreas proximas que comparten características propias. En esta época existe mayor influencia de las dos Bocas, Teacapán y Cuautla en el sistema, ya que la dinámica ambiental esta influenciada en gran parte por la influencia marina. Con las primeras lluvias, durante el verano la homogeneidad ambiental empieza a desaparecer gradualmente hasta completarse el cambio limático estacional que determina el inicio de un nuevo ciclo donde se presentan las mismas características ambientales. Estructura de la Comunidad
Diversidad Como lo indica Mc Lusky (1981), el estuario es un ecosistema complejo que contiene poblaciones muy productivas dependientes del suministro del detritus. Sin embargo, no todas las especies tienen la capacidad de adaptarse a las condiciones tan dinámicas y cambiantes de estos sistemas, por lo que la diversidad se restringe. En el sistema de Agua Brava la presión fisiológica es la salinidad, y los organismos responden a tales cambios de acuerdo a su capacidad y tolerancia. Otros factores como la temperatura, el sedimento y materia orgánica son los más importantes y se encuentran a su vez supeditados a parámetros meteorológicos. Los índices de diversidad pueden ser un artificio, y en muchos casos no representan real y objetivamente la diversidad en un ecosistema (Pielou, 1977), por lo que deben de ser complementados con observaciones directas relacionadas con aspectos ambientales, lugares de muestreo y selectividad de redes como ya ha sido destacado por otros autores. En particular, la red de arrastre de prueba camaronera obtiene muestras representativas de la comunidad en general, aún teniendo en cuenta sus limitaciones relacionadas principalmente con la selectividad y eficiencia de la red, sobre todo en lo referente a tallas, por la tendencia del arte a capturar ejemplares pequeños de escasa movilidad, aunque en esto la luz de malla juega un papel importante. La disminución del índice H'n en otoño, en parte puede deberse a la selectividad señalada, sobre todo por el hecho de que en la misma época con otras artes de pesca los valores del H'n son más altos. Por otro lado, la disminución del índice en invierno y primavera se debe a la baja disponibilidad de alimento, y sólo ingresan al sistema especies que cumplen alguna función determinada (Yáñez-Arancibia, 1978). Sucede lo contrario en otoño, donde el considerable aporte de materia orgánica y nutrientes determina valores altos de diversidad. La máxima diversidad en el sistema se presenta en la porción norte, Boca de Teacapán y Parte Baja del Estero, precisamente en zonas que son consideradas como estables prácticamente durante todo el ciclo anual, mientras que en la porción sur, canal del estero y laguna, donde las condiciones son inestables, la diversidad es menor. Estos lugares son ampliamente colonizados por especies que tienen la capacidad de oportar los cambios ambientales, convirtiéndose en dominantes ecológicos (Odum, 1972); que en el sistema están representados por: Achirus mazatlanus, Centropomus robalito, Diapterus peruvianus y Arius liropus. Otros índices de diversidad como el de riqueza de especies de Margalef (D), y el índice de biomasa (H'w), presentan el mismo comportamiento que el índice H'n, mientras que con el índice de equitatividad (F) existe una correlación negativa. Sin embargo, se ha visto que en ecosistemas marinos, ocasionalmente un incremento en la diversidad se acompaña con una alta dominancia, como es el caso de estuarios y lagunas costeras (Douglas, 1981). Este autor, después de analizar estadísticamente diversos ecosistemas marinos, afirma que aunque lo más común es encontrar correlaciones positivas, la influencia de diversos factores propios de la muestra como puede ser el muestreo de hábitat diferentes, puede llevar a encontrar correlación negativa. Una muestra más homogenea produce correlaciones positivas. Este mismo comportamiento puede presentarse cuando se utilizan diferentes artes de pesca. En Agua Brava, la distribución, abundancia y frecuencia de las especies está determinada principalmente por el gradiente salino y el sustrato. En general existe cierta preferencia de las comunidades por los sustratos limo-arcillosos de color obscuro. Las especies que presentan alta densidad poblacional son considerados como dominantes, es decir que además de su notable número de individuos, presentan una alta biomasa, amplia distribución y alta frecuencia de aparición durante el ciclo anual. Esta dinámica se encuentra influenciada directamente por los cambios climático- ambientales que finalmente caracterizan a las dos principales zonas del sistema, la porción norte estable y la sur variable ambientalmente. En la zona estable es donde se localizan el mayor número de especies, mientras que en la zona sur éstas decrecen, pero aumentan su número. Las notables fluctuaciones ambientales que se suceden en el sistema, especialmente entre la época de lluvias y la de secas, provocan tensiones ambientales que sólo pueden soportar algunas especies, las que por su elevado número, biomasa y persistencia se convierten en especies dominantes. La dinámica está en función de la época y de la zona del sistema. Así, en primavera e inicios del verano cuando existe poca precipitación pluvial, las especies se distribuyen en la mayor parte del sistema donde existen condiciones típicamente marinas, por el contrario al llegar las lluvias las especies migran a favor del gradiente salino hacía la zona norte manifestándose entonces los dos ambientes contrastantes ya señalados. Estos movimientos pueden estar directamente relacionados con un ambiente o bien con el movimiento del macrobentos que les sirva de alimento, ya que especies como Centropomus robalitoy Achirus mazatlanus que son dominantes y no les afectan los cambios ambientales, llegan a moverse bajo este mismo patrón. El resto del ciclo anual se mantiene el esquema de dos ambientes esencialmente diferentes con sus interacciones y límites variables, hasta que nuevamente en primavera, con el drástico descenso del aporte fluvial rompe el esquema y el sistema tiende a ser homogeneo en un solo ambiente. Componentes Comunitarios Es frecuente encontrar dentro de lagunas costeras y estuarios, mayor abundancia de visitantes ocasionales (Yáñez-Arancibia y Lara-Domínguez, 1983 y Alvarez-Guillén et al., 1985), sobre todo cuando existe mayor influencia marina. Sin embargo, la selectividad a las redes de arrastre puede influir en este punto, tal y como lo sugieren Alvarez Rubioet al., (1986), quienes utilizan otras artes de pesca y establecen una relación entre éstas y la mayor o menor capturabilidad de diferentes componentes. La mayor evidencia de variabilidad en los componentes comunitarios se refiere al ciclo climático-ambiental como se muestra en la figura 8, donde se aprecian las variaciones en el ciclo anual.En esta figura resalta la desaparición de visitantes ocasionales en otoño, cuando la influencia fluvial es más notable, mientras que en invierno los visitantes cíclicos alcanzan su máximo, al decrecer el aporte de aguas continentales. Por otro lado, los residentes estuarinos permanecen con pocas variaciones durante todo el año, lo cual es razonable si consideramos qué especies habitan el sistema comúnmente bajo cualquier circunstancia ambiental, y que además por su abundancia y persistencia, tienen que ver en gran medida con el intercambio y transferencia de energía en el sistema. En forma generalizada, la salinidad es el principal factor que influye en la limitación de los componentes en el sistema, ya que ésta, conjuntamente con la temperatura, es la más afectada con la variabilidad estacional de descarga fluvial. Categorías Ictiotróficas La notable predominancia de consumidores de segundo orden en la mayor parte del ciclo anual a excepción de otoño, puede tener una explicación en el hecho de que algunas especies regularmente consumidores de 1er. orden, amplían su espectro de acuerdo a las circunstancias alimentarías, tal como lo indica Warburton (1978) y Alvarez Rubio et al.,(1986). Otros estudios explican este fenómeno simplemente por la mayor disponibilidad de alimento (Vargas Maldonado et al., 1981); sin embargo, esto no es aplicable al sistema de Agua Brava, principalmente por la variación ambiental que está en función directa del comportamiento y hábitos alimenticios de los peces (Keenleysidde, 1970). Durante otoño se observa un equilibrio en la proporción de consumidores (justamente cuando se alcanza la diversidad más alta y la biomasa más baja del año). Esto se explica en la medida de que cuando existen diferentes componentes comunitarios, estos se distribuyen en distintas categorías tróficas (Margalef, 1974), así la abundancia de recursos logra un equilibrio. Este equilibrio se explica porque en esta época, existe gran variedad de aporte orgánico y de productores primarios principalmente manglares que pueden ser aprovechados por los peces (Edwards, 1978). Durante periodos ambientales adversos, es de esperarse que abunden especies generalistas cuyo nicho es amplio, mientras que cuando existe estabilidad ambiental es más probable que se encuentren especies especialistas que tienen nichos reducidos, tal y como sucede en el sistema en el área sur y norte respectivamente. Afinidad de Especies y Hábitat Un análisis entre las especies y el hábitat, permite determinar o clasificar ciertos patrones de comportamiento dentro de la comunidad de peces. Dentro de estos, el análisis numérico permite describir esta comunidad, ya que se establecen asociaciones de similaridad o disimilaridad según los atributos que comparten las diferentes especies en función a las características de las estaciones de colecta, en base al método cualitativo de presencia-ausencia que establece grupos de especies de acuerdo a la frecuencia de aparición y distribución según las características del hábitat. En el verano se determinaron dos grupos (Fig. 7), donde el primer grupo (A) se encuentra en la zona más etable, en un hábitat clasificado como grupo II (Fig. 5); mientras que el segundo (B) tiene una amplia distribución en la mayoría del sistema prácticamente en ambos hábitat, grupo I y II (Fig. 5). Algunas especies como Achirus mazatlanus, Citharichthys gilberti yPomadasys macracanthus no conforman un grupo definido ya que son de amplia distribución y dominantes en número y biomasa, además de que no muestran preferencia por áreas determinadas posiblemente por su versatilidad y amplitud de nicho. En otoño durante las lluvias, se clasifican también dos grupos de especies A y B (Fig. 9), el primero tiende a distribuirse en la Boca de Teacapán y Parte Baja del Estero donde existe mayor influencia marina, en un hábitat denominado como grupo I (Fig. 5). Este grupo incluye a la mayoría de las especies. El grupo B se dispersa principalmente en el estero y laguna en un hábitat con características dulceacuícolas clasificado como grupo II (Fig. 5). A diferencia del anterior que incluye menos especies pero éstas son dominantes y tienen poca competencia. En general existe una tendencia de la mayoría de las especies a despalzarse hacia las áreas más salinas es decir hacia las bocas donde existe notable influencia marina a diferencia del verano cuando los peces se desplazan al interior del sistema a la zona fluvial. El invierno se caracteriza por el notale decremento en las lluvias y el descenso paulatino de la temperatura. Se determinaron 2 grupos de especies A y B (Fig. 10), el primero se tiende a concentrar en el canal del estero en un hábitat dulceacuícola denominado como grupo II (Fig. 5); el grupo B son especies de amplia distribución cuyas poblaciones se concentran en parches en la mayor parte de sistema. El comportamiento global de la comunidad de peces es a desplazarse hacia el interior conforme las aguas marinas penetran en el sistema. La primavera es la época más seca del año, con un aporte fluvial prácticamente nulo. Se manifiesta un solo grupo de especies con dos subgrupos, A y B (Fig. 12), el primero incluye a la mayoría que presenta amplia distribución pero poca abundancia; en el segundo son pocas especies, pero éstas son dominantes por su abundancia, distribución, frecuencia y persistencia. Estas especies sonAchirus mazatlanus, Centropomus robalito, Diapterus peruvianus y Arius liropus. La mayoría del sistema se encuentra con características marinas y en algunos sitios existen condiciones hipersalinas por la baja profundidad y la excesiva insolación. A través de un ciclo anual (Fig. 13), se tienen 2 grupos de especies: A que es muy diverso, con amplia distribución y alta similaridad ecológica, es decir el cielo; y el B que incluye a las especies dominantes que coexisten durante todo el año en todo el sistema, aunque con mayor abundancia en la región sur. Estas 5 especies, Diapterus peruvianus, Centropomus robalito, Arius liropus, Achirus mazatlanus y Citharichthys gilberti, son considerados como "grupo tipo" o dominantes ecológicos. El gradiente salino es el principal factor que influye en la distribución y abundancia de las especies durante el ciclo anual; sin embargo, no se pueden descartar las temperaturas y la profundidad en regiones cercanas al mar (Oviatt y Nixon, 1973). En general se presenta una dispersión de las especies durante el verano cuando se presentan las lluvias, aunque en otoño ingresan especies marinas que se agrupan en la proción norte. Este mismo comportamiento de la comunidad de peces ha sido observado en otras latitudes como el estuario de la Bahía de Boston Massachusetts (Haedrich y Haedrich, 1974). En Agua Brava, la extrema complejidad de sus componentes hacen aún más difícil cualquier especulación sobre su posible comportamiento más allá de la época de muestreo, quizás en la zona norte donde existe mayor estabilidad se pueda precisar algún patrón de comportamiento. En la zona sur, además de gran variedad de factores que intervienen hay que tomar en consideración la influencia del canal artificial de Cuautla que ha repercutido indiscutiblemente en el equilibrio del sistema. La magnitud de estos cambios debe ser evaluada en un futuro próximo por la relevancia que representa para el ecosistema y para su diagnóstico en el aprovechamiento como recurso. Conclusiones1. La laguna de Agua Brava es el más importante sistema de manglar en la costa del Pacífico mexicano, tanto por su magnitud como por su extensión, esto le confiere características especiales como ecosistema de alta productividad. 2. Se identificaron dos ambientes, uno poco variable localizado en la parte norte, Boca de Teacapán y Parte Baja del Estero, con características marinas; y otro muy variable en el sur, estero y laguna con características fluviales. Estos hábitat persisten la mayor parte del año, a excepción de la primavera cuando la falta de aporte dulceacuícola origina en todo el sistema un ambiente homogeneo de notable influencia marina. 3. La diversidad presenta variaciones de acuerdo a los ambientes descritos y a la época climática. Los valores más altos son frecuentes en donde existe mayor estabilidad ambiental, mientras que, por el contrario, la dominancia es mayor en áreas variables. 4. Se determina un grupo tipo o dominante ecológico integrado por:Arius liropus Achirus mazatlanus, Diapterus peruvianusyCentropomus robalito. Estas especies coexisten durante el ciclo anual en todo el sistema y su abundancia depende de aspectos climático-ambientales. 5. La dinámica de la comunidad de peces está en función de los cambios climáticos, así durante las lluvias la ictiofauna tiende a desplazarse a favor del gradiente salino en dirección de las bocas, mientras que en el periodo de secas se dispersa ambientalmente en todo el sistema. AgradecimientosLos autores desean hacer patente su agradecimiento a Zoila G. Castillo Rodríguez, por su valiosa participación durante el desarrollo de este trabajo. A Agustín Ayala-Castañares, Director del Instituto de Ciencias del Mar y Limnología por el apoyo Institucional, a A. L. Lara-Domínguez por la revisión crítica del manuscrito. A los compañeros y estudiantes del Laboratorio de Ictiología y Ecología Estuarinas, en especial al personal que colabora en los proyectos del Pacífico. LITERATURAÁLVAREZ GUILLÉN, A., A. YÁÑEZ-ARANCIBIA y A. L. LARA-DOMÍNGUEZ An. Inst. Cienc. del Mar y Limnol . Ecología de la Boca del Carmen, Laguna de Términos. El habitat y estructura de las comunidades de peces (sur del Golfo de México).Univ. Nal. Autón. México1985.107-144.12(1) ÁLVAREZ-RUBIO, M., F. AMEZCUA LINARES y A. YÁÑEZ-ARANCIBIA An. Inst. Cienc. del Mar y Limnol. Ecología y Estructura de las Comunidades de Peces en el Sistema Lagunar Teacapán-Agua Brava, Nayarit, Pacífico Central de México.Univ. Nal. Autón. México1986.185-242.13(1) AMEZCUA LINARES, F.Tesis profesional.Aportación al conocimiento de los peces del sistema de Agua Brava, Nayarit.Fac. Ciencias, Univ. Nal. Autón. México1972.209 p. AMEZCUA LINARES, F. An. Centro Cienc. del Mar y Limnol. Generalidades ictiológicas del sistema lagunar costero de Huizache-Caimanero, Sinaloa, México.Univ. Nal. Autón. México1977.1-26.4(1) AYALA-CASTAÑARES, A., M. GUTIÉRREZ y V. M. MALPICA Depto. Cienc. del Mar y Limnol. (Informe técnico)Informe preliminar sobre la fisiografía y características de los sedimentos de la región de Yavaros, Son. Inst. Biol. Univ. Nal. Autón. México.1969.1-15. AYALA-CASTAÑARES, A., R . CRUZ, A. GARCÍA-CUBAS y L R . SEGURA Lagunas Costeras un Simposio, Mem. Simp. Inteern., Lagunas costeras.Síntesis de los conocimientos sobre la geología marina de la Laguna de Tamiahua, Veracruz, México. In: Ayala-Castañares, Ay F.E. Phleger (Eds.)UNAM/UNESCO1969.39-48.Nov. 28-30, 1967. CARRANZA, J. Informe final sobre la primera etapa del estudio. Informe técnico.Estudios de la fauna ictiológica y depredadores del camarón en las lagunas y esteros de los planes piloto Escuinapa, Sin., y Yávaros, Son. Inst. Biol. Univ. Nal. Autón. México.197028p. CARRANZA, J. y F. AMEZCUA LINARES Resultados finales de hidrología, plancton y fauna ictiológica en el sistema Teacapán-Agua Brava (octubre 1970 a junio 1971) parte 2., informe final sobre la fauna ictiológica del sistema Teacapán-Agua Brava, Sin., Nay.).Inst. Biol. Univ. Nal. Autón. México1971.27 p. CEPEDA, G. H. An. Inst. Geof.Características mareográficas en Machona, Tabasco y Agua Brava, Nayarit.1977.105-110.5(22-23) CLIFFORD, H. T. y W. STEPHENSON An. Introduction to Numerical Classifcation.Academic Press. Inc. N. Y.1975.229 p. COLINVAUX, P. Introducción a la Ecología.LimusaMéxico1982679 p. CURRAY, J. R. y D. G. MOORE Marine Geology of the Gulf of California, Pliestocene deltaic progradation of continental terrace, Costa de Nayarit, México. In: Van Andel T.H. and Shor, G.B. Jr. (Eds.).American Assoc. Petrol. Geol.Tulsa, Oklahoma1964.193-215. CURRAY, J. R., E. J. E. EMMEL y P. J. S. CRAMTON Lagunas Costeras un Simposio, Mem. Simp. Intem. Lagunas Costeras. Holocene history of a strand plain, lagoonal coast Nayarit, México: 63-100. In; Ayala-Castañares, A. y F.B. Phleger (Eds.)UNAM-UNESCO1969.631p.67Nov. 28-30, 1999 CHAPA-SALDAÑA, H.Serie de trabajos de divulgaciónLa Laguna del Caimanero, su producción camaronera y un proyecto para la realización de obras encaminadas a su incremento.Inst. Nal. Invest. Biol. Pes. Mex.1966.1-37.2(103): CHÁVEZ, E. A. An. Centro Cienc. del Mar y Limnol.Análisis de la comunidad de una laguna costera en la costa suroccidental de México.Univ. Nal. Autón. México19979.15-44.6(2): DANIELS, K. Proc. Third Coastal Marsh and Estuary Management Symposium. Habitat designation based on cluster analisis of inchtyofauna. In: Day J.W., D.D. Culley, R.E. Turner y A.J. Murphrey (Eds.). Louisiana State University Division of Counting EducationBaton Rouge, L179.317-324. DAVIES, R . G. Computer Programing in Cuantitative Biology.Academic Press Inc.Londres1971.429 p. DOUGLASS, W. B.Dominance in marine ecosystem. Amm. Nat.1981.262-274.(118): EDWARDS, R . C . Ecology of a coastal lagoon complex in Mexico.Estuar. Coast. Mar. Sci.1978.75-92.6: GARCÍA A. E.Modificaciones al Sistema de Clasificación Climática de Koppen, para adaptarlo a las condiciones de la República Mexicana. Instituto de Geofísica. Univ. Nal. Autón. México1973.246 p. GÓMEZ-AGUIRRE, S., S. LICEA DURÁN y C. FLORES COTO An. Centro Cienc. del Mar y Limnol. Ciclo anual de plancton en el sistema Huizache-Caimanero (1969-1970). Univ. Nal. Autón. México1974.83-98.1(1) GONZÁLEZ, L I.Tesis profesionalAspectos biológicos y distribución de algunas especies de la familia Ariidae de las lagunas litorales del noroste de México.Universidad Nacional Autónoma de México1972.88p. GREENWOOD, P. H., D. E. ROSEN, S. H. WEITZMAN y G. S. MYERS Bull. Am. Mus. Nat. Hist. Phyletic studies of teleostean fishes, with a provisional classification of living froms.1966.341-455.131(4) GREENWOOD, P. H., G. S. MYERS, D. E. ROSEN y S. H. HEITZMANN Named main divisions of teleostean fishes Proc. Biol. Soc.Washington1967.227-228.80: GUNTER , C . A. revised list of euryhalin fishes of North and Middle American.Am. Midland Nat.1956.345-354.56(2): HAEDRICH, R. L y HAEDRICH, S. O.A seasonal survey of the fishes in the Mystic River, a polluted estuary in downtown Boston, Massachusetts.Estuar. Coast. Mar. Sci.1974.59-73.2 HEALD, E. J., W. E. ODUM y D. C. TABB Environmental of South Florida: Present and Past. Mangroves in the estuarin food chain. In: Gleason, P.J. (Ed.)Miami Geological Society, Mem.1974.182-189.(2) HEDGPETH, J. W. Treatise on Marine Ecology and Paleoecology.Estuaries and lagoons II. Biological aspects In: Hedgpeth, J.W. (Ed.)Geol. Soc. Amer. Mem.1957.673-750.64(1): HILDEBRAND, S. F. Bull. Bingham. Oceanogr. Coll. A review of the American anchones (Family Engraulidae).1943.1-165.8(2): HOFF, J. G. y R. M. IBARRAFactors affecting the seasonal abundance, composition and diversityof fishes in a S.E. New England estuary.Estuar. Coast. Mar. Sci.1977665-678.5: HORN, H. M. y L G. ALLEN Bull. South. Cal. Acad. Sci.Numbers of species and faunal resemblance of marine fishes in California Bays and estuaries1976.159-170.75(2): HUSTON, M. A general hypotesis of species diversity.Am. Nat.1979.81-101.113: JORDAN, D. S. y B. W. EVERMANN Bull. U.S. Nat. Mus.The fishes of North and Middle America1896-1900.1-3313.1-4(47) JORDAN, E., M. ANGOT y P, DE LA TORRE An. Centro Cienc. del Mar y Limnol.Prospección biológica de la Laguna de Nichupté (Cancún), Q. Roo., México. Nota Científica. Univ. Nal. Autón. México1978.179-188.5(1) KEENLEYSIDE M. H. A.Diversityand Adaptation in Fish Behavior.Springer-VerlagBerlin1979.210 p. KHAYRALLA, N. y JONES, A.M. Proc. Royal Soc. A survey of the bentos of the Tay estuary.Edinburgh1975.113-13575B KREBS, C. J. Ecology the Experimental Analysis of Distribution and Abundance Ed. Harper InternationalNeueva York1978678p. KUENZLER, E. J. Coastal Ecological System of the United States. The Coinservations FoundationsMangrove swamps system. In: Odum, H.T., B.J. Copeland y E.A. Mc Mahan (Eds.). Washington D.C.1974.346-371.1: LLOYD, M. y R- J. GHELARDI Jour. Anim. Ecol.A table for calculating the equiality component of species diversity.1964217-225.33: LUGO, A. E. y S. C. SNEDAKER Ann. Rev. Ecol. Sist.The ecology of mangroves1974.39-64.5: MAC ARTHUR , R . H.Geographical Ecology- Patterns in the Distribution of Species. Harper and Row, Pub.N. Y.1972269p. MACNAE, W. Adv. mar. Biol. A general account of the fauna and flora of mangrove swamps and forest in the Indo-west-pacific region.1968.73-270.6 MARGALEF, D. R . Gen. Syst. Information theory in ecology.195737-71.3 MARGALEF, D. R . Transl. From Mem. Real.Information Theory in ecology. Gen. Sist.Acad. Cienc. ArtsBarcelona1958.36-71, 373-449. 3: 32 MC HUGH, G. M. Estuaries. Publ. Amer. Ass. Adv. Sci.Estuarine nekton. In: Lauff, G.H. (Ed.).1967.581-619.83: MCLUSKY, D. S. The Estuarine Ecosystem Glasgow Ed.London1981.150p. MEEK, E. S. y S. P. HILDEBRAND Fiels. Mus. Nat. Hist. Publ. Zool. Ser. The marine fishes of Panamá.1923-29-28.1-1045.15(215, 226 y 249) ODUM, E. P.Ecología Ed. InteramericanaMéxico1972.639p. ODUM, W. E. y E. J. HEALD Bull. Mar. Sci.Trophic analysis of an estuarine mangrove communit.1972671-738.22(3): ODUM, W. E. y E. J. HEALD Est. Res .The detritus based food web of an estuarine mangrove community.In: Cronin, L.E. (Ed.) Academic Press New York1975.265-286.1: ODUM, W. E., J. C. ZIEMAN y E. J. HEALD Proc. Coastal Marsh and Estuary Management Simposium The importance of vascular plant detritus to estuaries In: Chabrek (Ed.) Louisiana State University Baton Rouge, La.197391-114.Jul.1972 OVIATT, A. C. y NIXON, W. S.Estuar. Coast. Mar. Sci. The Demersal Fish of Narragansett Bay: An Analysis of Community Structure, Distribution and Abundance.1973.361-378.1 PAINE, R. T. Am. Nat. Food web complexity and species diversity.1966.65-75.(10): PIELOU, E. C. Ecological diversity Ed. Wiley N. Y.1975.165p. PIELOU, E. C.Mathematical Ecology. Ed. Wiley Nueva York1977.385p. RAMÍREZ, R.Revta. Soc. Mex. Hist. Nat. Estudio ecológico preliminar de las lagunas costeras a Acapulco, Gro.1952.199-218.13 ROLLET, B. Informe TécnicoEcología y reforestación de los manglares en México. Programa de investigaciones y fomento pesquero.FAO.México.1974.1-1266 ROLLET, B. (Compiled) Bibliography on Mangrove ResearchUNESCOLondon1981.480 p.1600-1975. RUTZLER , R . Lagunas Costeras un Simposio. Mem. Simp. Intern. Lagunas CosterasThe mangrove community aspects of ecology. In: Ayala-Castañares, A. y F.B. Phleger (Eds.)UNAM-UNESCOMéxico1969.645-652.Nov. 28-30, 1967 SÁNCHEZ-GIL, P., A. YÁÑEZ-ARANCIBIA, F. AMEZCUA LINARES An. Inst. Cienc. del Mar y Limnol.Diversidad, distribución y abundancia de las especies y poblaciones de peces demersales de la Sonda de Campehe (verano, 1978).Univ. Nal. Autón. México1981.209-240.8(1) SANDERS, H. L Am. Nat Marine Benthic Diversity: A comparative study.1968.243-282.(102) SHANNON, E. C. y N. WIENER The Mathematical Theory of Communication.University of Illinois Press.Urbana1963.117 p. Amer. Fish. Soc. Spec. Publ.A Symposium on Estuarine Fisheries SMITH, R. F., A. H. SWARTS y W. C. MASSAMANN (Eds.)1966.1-154.3 SNEATH, P. A. y R. R. SOKAL Numerical Taxonomy.Freeman and Company (Ed.)San Francisco1973.573 p SOKAL, R. R. y C. D. MICHENER Sci. Bull. A statistical method for evaluatysistematic relationship.Univ. Kansas19581409-1438.38: SOTO, L. A., Tesis Profesional Mecanismo hidrológico del sistema de lagunas litorales Huizache-Caimanero y su influencia sobre la producción camaronera.Univ. Nal. Autón. México1969.75 p TRAMER, E. J. Ecology Bird species diversity: Components of Shannon's formula.1969.927-929.50: VARGAS MALDONADO, I., A. YÁÑEZ-ARANCIBIA y F. AMEZCUA LINARESAn. Inst. Cienc. del Mar y Limnol.Ecología y estructura de las comunidades de peces en áreas de Rhizophora mangle y Thalassia testudinum de Isla del Carmen, Laguna de Términos, Sur del Golfo de México. Univ. Nal. Autón. México1981241-266.8(1) VILLALOBOS, A. J., J. CABRERA, F. MANRIQUE, S. GÓMEZ, V. ARENAS y G. DE LA LANZA Lagunas Costeras un Simposio Mem. Simp. Intern. Lagunas Costeras Relaciones entre postlarvas planctónicas de Penaeus sp y caracteres ambientales en la Laguna de Alvarado, Veracruz, México In: Ayala-Castañares, A. y F.B. Phleger (Eds.).UNAM-UNESCOMéxico1969.601-620Nov. 29-30, 1967 WARBURTON, K Est. Coast. Mar. Sci. Community structure, abundance and diversity of fish in a Mexican Coastal Lagoon System.1978.497-519.7: WIHLM, J. L Ecology Use of biomass unites in Shannon's formula.1968.153-156 p49: WILDISH, D. J.Helgolander wissFactors controlling marine and estuarine sublittoral macrofauna.Meeresunters1977.445-454.30 YÁÑEZ-ARANCIBIA, A. In: Informefinal 2da. Etapa Programa Uso de la Zona Costera de Michoacán y Guerrero.Relaciones tróficas de la fauna ictiológica del sistema lagunar costero de Guerrero y aspectos parciales de dinámica de poblaciones de los peces de importancia comercial, 230 p., 71 figs.Convenio Comisión del Río Balsas, S.R.H. y Centro Cienc. del Mar y Limnol. Univ. Nal. Autón. México. Contrato de estudios No. OC-E-03-741975.750 p. YAÑEZ-ARANCIBIA, A . CICAR-II Symposium Fish. Rep. Fish culture in coastal lagoons: Perspectives México. Progres in Marine Research in the Caribbean and adjacent Regions In: Streart, H.B. (Ed.)FAOCaracasVenezuela1976a.529- 547200: july 12-16, 1976 YÁÑEZ-ARANCIBIA, A.An. Centro Cienc. del Mar y Limnol.Observaciones sobre Mugil curema Cuvier y Valenciennes, en áreas naturales de crianza, México. Alimentación, crecimiento, madurez y relaciones ecológicas. Univ. Nal. Autón. México 1976 b.92-124.3(1): YÁÑEZ-ARANCIBIA, A.An. Centro Cienc. del Mar y Limnol. Publ. Esp.Taxonomía, ecología y estructura de las comunidades de peces en Lagunas Costeras con Bocas Efímeras del Pacífico de México Univ. Nal. Autón. México1978.1-306.2: YÁÑEZ-ARANCIBIA, A.Teach. Pap. Mar. Sci. The occurrence, diversity, and abundance of fishes in two tropical coastal lagoons with ephimeral inlets on the Pacific cost of MexicoUNESCO1981233-26033: YÁÑEZ-ARANCIBIA, A., y R- NUGENT An. Centro Cienc. del Mar y Limnol El papel ecológico de los peces en estuarios y lagunas costeras.Univ. Nal. Autón. México1977.125-140.4(1) YÁÑEZ-ARANCIBIA, A. y G. DÍAZ An. Centro Cienc. del Mar y Limnol.Ecología trofodinámica de Dormitator latifrons (Richardson) en nueve lagunas costeras del Pacífico de México (Pisces:Eleotridae).Univ. Nal. Autón. México1977.125-140.4(1) YÁÑEZ-ARANCIBIA, A., F. AMEZCUA LINARES y J. W. DAY Estuarine PerspectivesFish community structure and function in Terminos Lagoon, a tropical estuary in the Southern Gulf of México. In: Kennedy, V. (Ed.). Academic PressN.Y.1980.465-482. YÁÑEZ-ARANCIBIA, A. y J. W. DAY Coastal Lagoon. Oceanologica Acta.Ecological characterizatin of Terminos Lagoon, a tropical lagoon-estuarine system in the Southern Gulf of Mexico p. 431-440.Vol. Spec., In: Lasserre, P. y H. Postma (Eds.).1982.462 p.(4)5 YÁÑEZ-ARANCIBIA, A. y A. L. LARA-DOMÍNGUEZAn. Inst. Cienc. del Mar y Limnol. Dinámica ambiental de la Boca de Estero Pargo y estructura de sus comunidades de peces en cambios estacionales y ciclos de 24 hrs. (Laguna de Términos, sur del Golfo de México).Univ. Nal. Autón. México198385-116.10(1):
|

