|
ESTRUCTURA DE LAS COMUNIDADES DE PECES EN SISTEMAS
DE PASTOS MARINOS (Thalassia testudinum) DE LA LAGUNA DE TÉRMINOS,
CAMPECHE MÉXICO
Trabajo recibido el 27 de noviembre de 1958 y
aceptado para su publicación el 8 de mayo de
1986
Irma Vargas Maldonado
Alejandro Yáñez-Arancibia
Instituto de ciencias del
Mar y limnología, Universidad Nacional autónoma de México.
Contribución 515 del Instituto de Ciencias del Mar y limnología,
UNAM.
Se
analiza la estructura de una comunidad de peces en pastos marinos. El
área de estudio, es el ecotono entre dos subsistemas: el litoral interno
de la Isla del Carmen con vegetación predominante de Thalassia
testudinum y, la Cuenca Central de la Laguna de Terminos. La zona tiene
variaciones estacionales mínimas en salinidad y temperatura durante el
ciclo anual muestreado (febrero 1980-abril 1981). El número de especies
registrado fue de 56 analizando 4117 individuos. Este número completa un
total de 87 especies reportadas para esta taxocenosis, a través de
diferentes trabajos. El sistema posee una especie altamente
conspicua,Sphoeroides testudineus, que es la más
abundante. Con esta especie, existen asociadas otras 8 que mantienen una
biomasa en equilibrio durante todo el ciclo:Archosargus rhomboidalis,
Arius felis, Arius melanopus, Eucinostomus gula, Bairdiella chrysoura,
Chilomycterus schoepfi, Acanthostracion
quadricornisyOrthopristis chrysoptera en orden de
dominancia. Un hecho diferencial de esta comunidad es que está compuesta
en gran parte por visitantes ocasionales. Se concentran la mayor
producción de peces de este sistema en cl nivel de consumidores de
segundo orden. Por un gran número de migraciones, en este habitat, se
permite la convivencia de especies con variadas estrategias biológicas
tales comoNicholsina usta (típicamente marina)
yCichlasoma urophthalmus (de origen dulceacuícola).
Como el área deThalassia testudinum muestreada, se
aproxima más hacia la Cuenca Central que hacia el litoral
deRhizophora mangle, es evidente una activa
movilización de las poblaciones de peces y un reemplazo estacional de
las
mismas.
The
structure of a fish community in sea grasses was analyzed. The study arca is
the ecotone between two subsystems: the internal littoral of Carmen Island
where the dominant vegetation isThalassia testudinum and the
Central Basin of Terminos Lagoon. The zone has minimal seasonal variations with
regards to salinity and temperature during the annual cycle that was sampled
(February 1980-April 1981). The number of species recorded was 56 based on an
analysis of 4117 individuals. This brings to a total of 87 the species reported
for this taxocenosis inciuding those from other papers. This system has one
highly conspicuos species, Sphoeroides testudineus, which is the most abundant.
Along with this eight others species are found that kecp the biomass in balance
throughout the cycle:Archosargus rhomboidalis, Arius felis, Arius
melanopus, Eucinostomus gula, Bairdiella chrysoura, Chilomycterus scoepfi,
Acanthostracion quadricornis and Orthopristis
chrysoptera in order of dominance. One fact that sets this community
apart is that a large part of it is made up of occasional visitors. The
greatest proportion of fish production in this system centers on the second
order consumer level Due to the large number of migrations in this habitat,
species with varied biological strategies such as Nicholsina
usta(typically marine) andCichlasoma
urophthalmus(freshwater origen) are able to com-habitat there As the
sampled arca ofThalassia testudinum is located near the
Central Basin than theRhizophora mangle littoral, an active
mobilization of the fish populations and their seasonal reptacement is
apparent.
Hace algunos años se planteaban investigaciones para contribuir al estudio de las comunidades de peces en la Laguna de Términos. A medida que se incrementó la información sobre este ecosistema, surgió el interés sobre estudios más específicos (Yáñez-Arancibia y Day,1982). Entre los estudios específicos, se ha enfocado la atención hacia la biocenosis deThalassia testudinumy otros pastos asociados, cerca de manglares de borde (Yáñez-Arancibia et al.,1982; Yáñez-Arancibia y Lara-Domínguez, 1983). Las cualidades de los sistemas de pastos marinos, no necesariamente se limitan a constituir alimento directo para organismos. Thayer y Phillips (1977) puntualizan las siguientes funciones multifacéticas: 1. Proveen hábitat para crecimiento de peces e invertebrados comerciales y no comerciales (pero todos ecológicamente importantes). 2. Debido a que su crecimiento normalmente es denso, los pastos marinos protegen a organismos pequeños de sus depredadores. 3. Las hojas de los pastos tienen una alta tasa de crecimiento. Aunque pocos organismos se alimentan directamente de ellas, las principales cadenas de alimentos están basadas en detritus derivados de las hojas. 4. El detritus derivado de estas praderas, puede sostener cadenas alimenticias en aguas adyacentes. 5. Las hojas sostienen muchos organismos epifíticos que son usados como fuente alimenticia por gran número de invertebrados y peces. 6. Las raíces se enlazan a los sedimentos, protegiendo el fondo de la erosión, mientras que las hojas amortiguan las corrientes e incrementan la tasa de depositación de sedimentos finos y materia orgánica. 7. Las raíces de las plantas remueven nutrientes como nitrógeno y fósforo del sustrato, lo transfieren a las hojas y de ahí al agua circundante, proporcionando nutrientes para otras plantas. Los incisos 1, 2, 3 y 5 arriba mencionados, se relacionan directamente con la importancia de este estudio.Los incisos 1, 2, 3 y 5 arriba mencionados, se relacionan directamente con la importancia de este estudio. Los pastos marinos del litoral interno de la Isla del Carmen mantienen una comunidad de peces que es explotada por los pescadores locales. Permiten además, el desarrollo de diferentes estadios del ciclo de vida de especies que se capturan a escala comercial en la plataforma adyacente (Yáñez-Arancibia, 1984). De aquí que tengan un papel clave en la laguna y plataforma adyacente, por lo cual es prioritario conocerlos en mayor detalle. Para esta investigación, se planteó analizar la comunidad del litoral interno de la Isla del Carmen en el punto de contacto con la Cuenca Central, que a su vez, se comporta como otro hábitat distintivo (Yáñez-Arancibia y Day, 1982, Yáñez-Arancibiaet al.,1983). Como se ha discutido por algunos autores, la fauna asociada a pastos marinos presenta modificaciones en cuanto a su estructura dependiendo de la ubicación con respecto a los límites del sistema (Orth y Heck, 1980) y la interacción con hábitats adyacentes (Zieman, 1982). A su vez esta fauna tiene diversas manifestaciones de respuesta a las presiones ambientales dependiendo de su estructura comunitaria (Livingston, 1985). Es razonable suponer que la composición y estructura de este ecotono, presentará variantes respecto a las comunidades ya caracterizadas para otras áreas de pastos de la Laguna de Términos (Vargas Maldonadoet al., 1981, Yáñez-Arancibiaet al., 1982, Vargas Maldonado, 1982 y Yáñez-Arancibia y Lara-Domínguez, 1983). Para acercarse a esta hipótesis, se plantearon los siguientes objetivos: 1. Realizar un muestreo exhaustivo (mensual, durante 15 meses) en el área limítrofe entre el. subsistema del litoral interno de la Isla del Carmen y la Cuenca Central. 2. Analizar el marco físico ambiental de esta área. 3. Realizar una descrpción detallada de la estructura de la comunidad de peces, en términos de diversidad, abundancia y composición de especies de la misma. ANTECEDENTES Y FUNDAMENTOS ECOLÓGICOSEn México, los estudios de estructura de comunidades de necton en pastos marinos, son escasos. Vargas Maldonadoet al.(1981) analizan la comunidad de peces en áreas de Thalassia testudimun cercanas a manglares(Rhizophora mangle) del litoral interno de la Isla del Carmen. Concluyen que este habitat es un subsistema particular dentro de la Laguna de Términos. Yáñez-Arancibia (1981), discute la composición de la ictiofauna en pastos marinos de la Boca de Puerto Real, analizando la abundancia, la diversidad, categorías y relaciones tróficas. En otra investigación (Bravo Nuñéz y Yáñez-Arancibia, 1979), se presenta una sinopsis ecológica de la fauna de peces en la Boca de Puerto Real, abordando aspectos de la estructura de las comunidades y comparando los valores de diversidad y biomasa con respecto a otras localidades del Golfo de México. Ciclos nictemerales en la Boca de Puerto Real, fueron realizados durante un ciclo anual por Yáñez-Arancibia et al. (1982); los autores destacan la importancia de la orientación geográfica de los arrastres en una boca estuarina; detallan el comportamiento nictemeral, reportando una mayor actividad del necton por las noches, tanto por actividad trófica como por migraciones. En relación a ciclos nictemerales, Yáñez-Arancibia y Lara-Domínguez (1983) analizan la dinámica de la comunidad frente a la Boca de Estero Pargo, enfatizando su papel como área de crianza, reproducción y alimentación de peces, y estableciendo patrones estacionales de diversidad y abundancia en pastos marinos y manglares. A nivel tropical de otras latitudes, la información sobre comunidades de peces en pastos marinos es abundante. Se presentan por lo tanto una gran variedad de puntos de vista. Por ello, se citan algunos trabajos cuya forma de abordar este tópico, es afín con las ideas expuestas en esta investigación. Se ha estimado que las praderas de fanerógamas, proveen un porcentaje muy alto en la producción total de sistemas estuarinos; el hombre explota en forma indirecta esta producción primaria como capturas comerciales de peces y crustáceos (Adams, 1976). Como mencionan Thayer y Phillips (1977), no solo proveen habitat contra depredadores, sino que además son sitios de alimentación y crianza para una gran variedad de organismos tales como camarones comerciales, langostas, cangrejos, bivalvos, peces, tortugas y aves migratorias; de aquí la necesidad de protegerlos, pues son sistemas muy sensibles a las variaciones ambientales. Se ha visto que perturbaciones relativamente pequeñas en la luz submarina y temperatura, modifican la distribución y abundancia relativa de las fanerógamas marinas, alterando como resultado toda la ecología del habitat que proporcionan (Wetzel y Penhale, 1983). Zieman (1982) efectúa un perfil muy completo de las características bio-ecológicas de pastos marinos; lo más relevante de su trabajo, es que expone claramente la interacción de pastos con otros sistemas adyacentes, tales como arrecifes de coral, plataforma continental y manglares. Por lo que a interacciones se refiere, Ogden y Ehrlich (1977) estudian las migraciones de pomadásidos coralinos a praderas de pastos marinos para su alimentación. La influencia que ejercen los parámetros ambientales sobre las comunidades estuarinas, ha llamado la atención de algunos autores. Pauly (1975) investigando una laguna costera semicerrada en Africa Occidental, encuentra que las condiciones ambientales son el principal factor que controla la composición de la comunidad; el rápido incremento de la salinidad después de la estación lluviosa, es seguido por una rápida desaparición de animales dulceacuícolas, y por un incremento de animales marinos, que son representados en su mayoría por estados juveniles. Resultados similares presenta Castro-Aguirre (1982) para una laguna de Oaxaca: la salinidad en primer lugar y la temperatura en segundo lugar, son los factores que más influencían la abundancia relativa de los individuos. Recientemente Yáñez Arancibia et al. (1985) analizan en detalle la ecología que controla a las especies dominantes en sistemas de pastos marinos concluyendo que diversos parámetros ambientales modulan las estrategias biológicas y la producción de los peces. Para el Caribe panameño, parece que la temperatura tiene un papel importante en la abundancia de escasas especies, dado que los gradientes son más restringidos (D'Croz y Averza, 1979). En áreas como Queensland en Australia, existe un gradiente de turbidez y profundidad entre los estuarios y el mar, así como entre áreas claras y turbias del mar; en Asia sudoriental, esos gradientes pueden ayudar a los peces juveniles a localizar áreas de crianza; de ahí que en los lugares como Africa sudoriental y Australia, los estuarios son las únicas áreas turbias y someras y por lo tanto el único ambiente adecuado para los juveniles de muchas especies (Blaber, 1985). En contraste para Florida, se ha observado que la composición y densidad de la fauna, está más relacionada con densidad de vegetación que con la temperatura (Orth y Heck, 1980). Un hecho relativamente común en estuarios, es la progresión estacional y regular de la ictiofauna, Sheridan y Livingston (1983) describen una comunidad de peces en Florida, cuyas especies dominantes tienen un pulso de máxima abundancia de mayo a septiembre; parece que la progresión está relacionada con recursos tróficos disponibles, competencia y depredación. Otra modalidad en estacionalidad, es que los organismos más móviles, se presenten todo el año, pero con máximos en primavera, mientras otros componentes muestran picos en verano y otoño; este esquema regulado por temperatura, se observó en Carolina del Norte (Godfrey, 1980). La segregación de la fauna en cinco grupos, revela diferencias estacionales y de microhábitat en los peces litorales de la Bahía de Newport; los grupos, se forman con la mayor o menor frecuencia con la que se localizan las especies dentro de la Bahía, siendo algunas residentes y otras raras y periódicas; parece que la temperatura y salinidad conjuntas pueden influenciar la abundancia de estas especies litorales (Allen, 1982). Otro caso en el que hay pulsos estacionales por presencia de una o varias especies dominantes de peces es la zona nerítica frente a California; éstos peces realizan migraciones nictemerales entre las praderas de pastos marinos y el habitat pelágico cercano a la costa (Allen y DeMartini, 1983). La estructura permite obtener un conocimiento integral de la comunidad como sistema. Cuando se conocen las proporciones de abundancia relativa y diversidad de las especies, un cambio en ellas puede estar reflejando alteraciones del habitat. Livingston (1984) utiliza este tipo de criterio para establecer diferencias entre dos estuarios, uno de los cuales está contaminado; utiliza además un metodo innovador que consiste en observar los cambios en hábitos alimenticios, como una respuesta a las alteraciones del habitat. En condiciones naturales, es común encontrar para praderas de pastos marinos que algunas especies dominan el conjunto (Turner y Johnson, 1973). Sucede algo similar en manglares: en ellos las especies dominantes suelen ser especies residentes, que parecen tener territorios fijos dentro del manglar (Valdez, 1981). Al analizar la estructura, algunos autores abordan el estudio de otros grupos además de peces. Brook (1977) ha estudiado la interacción trófica entre los peces y la fauna macrobéntonica en pastos de Florida. Kjelson et al . (1973) analizan biomasa y diversidad de poblaciones de peces y macroinvertebrados en Carolina del Norte. Existe un trabajo en el que se discuten estrategias de biología, alimentación y competencia de peces estuarinos (Livingston, 1976). Por otra parte, se plantea que la constancia en producción de estuarios tropicales induce aumento de herbívoros en el sistema, lo cual repercute en la complejidad de la trama trófica (Qasim, 1970). Por último, es conveniente mencionar a Heck (1977) quien investiga las especies de peces que depredan sobre macrofauna de pastos marinos; en un análisis muy práctico, establece como la densidad de las poblaciones de los primeros, depende en gran medida de la disponibilidad de alimento que ofrece la macrofauna. ÁREA DE ESTUDIOUna revisión de la bibliografía existente sobre aspectos hidrológicos, geomorfológicos, físicos y biológicos de las praderas de pastos marinos en Laguna de Términos, fue realizado por Vargas Maldonado et al .(1981) y, Yáñez-Arancibia y Day (1982). El comportamiento ambiental de la Laguna de Términos como un sistema integrado, se encuentra en Yáñez-Arancibia et al. (1983). En este último trabajo, se ha sintetizando información para el litoral interno de la Isla del Carmen, a continuación se presenta la información que los autores detallan en dos aspectos principales: CARACTERIZACIÓN DEL HABITATLa porción norte de la Laguna de Términos, en el litoral interno de la Isla del Carmen, presenta una persistente influencia marina, manteniendo valores elevados de salinidad y transparencia. Es importante mencionar que no existe aporte de agua dulce de la Isla del Carmen; no obstante, durante las estaciones de lluvias y nortes existe influencia de agua dulce proveniente de precipitación y de los sistemas Fluvio-lagunares. Las principales zonas de Pastos marinos de la Laguna se extienden hacia el litoral interno de la Isla del Carmen, Boca de Puerto Real y Bajos de Sabancuy. La vegetación sumergida, está compuesta de pastos marinos, donde dominaThalassia testudinum, existen también macroalgas (PhaeophyceayRhodophycea) y grandes bosques de manglar circundante principalmente Rhizophora mangle). Esta vegetación está asociada con grandes valores de salinidad, transparencia y contenido de carbonato de calcio. A lo largo de la Isla del Carmen, se encuentra una banda de sedimento finos arenosos, que probablemente son depositados por las corrientes que llevan una dirección este-oeste. La parte este del litoral interno de la isla, esta situada en un área de acumulación biogénica, y la zona de Bajos del Cayo parece ser el delta de una boca antigua. Existe un alto contenido orgánico y CaCO3 en proporciones de 40 a 50 %. Los sedimentos varían en zonas más interiores como Estero Pargo, donde el aporte de materia orgánica de manglar modifica los sedimentos, siendo éstos lodo y arena de transición con gran cantidad de detritus orgánico (Yáñez-Correa, 1963, Ayala-Castañares, 1963, Phleger y Ayala-Castañares, 1971). La Tabla 1 muestra las características generales de las estaciones. Como se señala en la figura 1, la localización de éstas se sitúa en el borde extralimital de la distribución de Thalassia hacia la Cuenca Central de la Laguna. HIDROLOGÍAEl comportamiento general de la salinidad a través de todo un ciclo anual, tiene un patrón estacional, que se incrementa de 28.7 % (febrero) a 34.7 % (junio), que son los máximos valores. En noviembre decrece a su valor mínimo (14.9 %) incrementándose una vez más en diciembre y enero. El valor promedio es de 27.7 % con un coeficiente de variación de 24.8 %. Los valores de temperatura oscilan de 21.8 °C en enero a 30.8 °C en junio con un valor medio de 27.8 °C y con un coeficiente de variación de 19.7 %. La transparencia no parece tener un patrón regular a través de todo el año. Mostró valores de 33.2 % en diciembre a 63.4 % en junio, con un promedio de 51.2 % y con un coeficiente de variación de 25.5 %. No obstante, existe una clara tendencia a incrementarse de marzo/abril hasta junio, decreciendo hasta diciembre. Durante septiembre, se registraron los valores más altos (83.4%). Los tres parámetros ambientales muestran un patrón similar, sus fluctuaciones están relacionadas a los cambios climáticos característicos de cada estación. Los máximos valores pueden registrarse durante el final de la época seca, cuando se reduce la precipitación y descarga de los ríos. Consecuentemente, el sistema permanece estable. Durante la estación lluviosa, se produce una gran dilución de aguas marinas así como un incremento de la turbidez debido al aporte de material orgánico y partículas en suspensión que proviene de los ríos, lo cual causa un incremento importante de la salinidad, temperatura y transparencia. Este decremento, alcanza su valor máximo durante la estación de nortes, cuando se intensifica el fenómeno mencionado. Los vientos nortes aumentan su velocidad e influencían el patrón de circulación y el regimen hidrológico de la laguna.  TABLA 1 CARACTERISTICAS DE LAS ESTACIONES 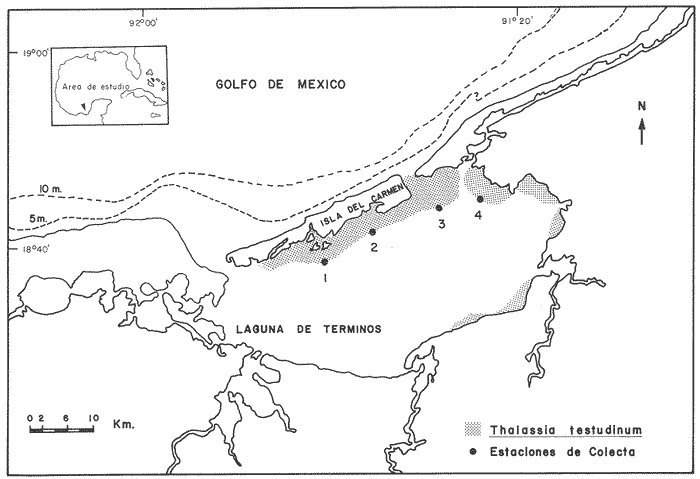 Figura 1. Laguna de Términos, Campeche. Se señala el habitat de Thalassia testudinum en cl litoral interno de la Isla M Carmen. Se indican también las estaciones de muestreo. En ciclos de 24 horas realizados en Esteros Pargo durante un año, la salinidad alcanza sus mínimos valores por la noche, entre las 6 p.m. y las 6 a.m., mientras que los mayores valores pueden registrarse durante las horas de alta insolación, i. e. de mediodía hasta las 4 p.m. Estos valores se midieron durante los meses de febrero, marzo, julio y septiembre. En mayo, la salinidad permanece constante y no presenta un patrón definido en relación a la hora del día. Durante noviembre y enero, se registraron los máximos valores durante horas sin luz y probablemente fueron causados por la marea. La temperatura mostró un patrón similar al descrito antes, los valores mínimos son registrados durante la noche y primeras horas del día (de medianoche a 10 a.m.). Los máximos valores de temperatura se registraron durante las horas de mayor insolación y las primeras horas de la noche (mediodía a 8 p.m.). Los rangos de temperatura para este ciclo nictemeral anual van de 22°C a 31.6°C (febrero a las 4 a.m. y septiembre a las 4 p.m.); los rangos de salinidad van de 10 a 36 % (noviembre a las 6 a.m.; mayo casi todo el día). Los valores de salinidad mensual promedio fluctuaron entre 13.79 % en noviembre y 35.93 % en mayo. Se observó un incremento durante la estación seca de febrero a mayo donde alcanzó su máximo valor. Durante la estación lluviosa la salinidad decrece, alcanzando su valor mínimo en noviembre. Puede observarse un patrón estacional bien marcado para este parámetro. MATERIAL Y MÉTODOS
ACTIVIDADES DE CAMPOSe realizaron muestreos mensuales durante el ciclo anual febrero 1980-abril 1981. Las estaciones de colecta se señalan en la figura 1. Se cubrió un muestreo representativo de praderas de pastos marinos con 60 lances, distribuídos por igual en las estaciones. Se efectuaron arrastres con duración promedio de 12 minutos y una velocidad entre 2 y 3 nudos, cubriéndose un área de 2,000 m² por estación en una lancha de fondo plano y motor fuera de borda de 50 HP. Las capturas se implementaron con una red de prueba camaronera (2.5 m de abertura de trabajo, malla de 3 3/4''), a la cual experimentalmente se le ha calculado una selectividad promedio de 20%. En todos los casos fueron evaluados los parámetros ambientales correspondientes; como temperatura, salinidad, transparencia y oxígeno. Todas las muestras fueron fijadas en formaldehído al 10% neutralizado con borato de sodio. Posteriormente, se empacaron en bolsas de polietileno con una clave para su proceso en el laboratorio. ACTIVIDADES DE LABORATORIOEn el laboratorio, los peces, flora y macroinvertebrados fueron separados, lavados, reetiquetados y envasados, usando como preservador alcohol etilico al 70%. Se utilizaron instrumentos y técnicas diversas para el análisis preliminar de la fauna. Entre los principales están: microscopios estereoscópicos, balanzas granatarias de 0.01 g de presición, báscula con capacidad de 10 kg e ictiómetro convencional. La identificación de los peces se hizo empleando la literatura básica y las claves de identificación que se han elaborado en el Laboratorio de Ictiología y Ecología Estuarina del Instituto de Ciencias del Mar y Limnología (UNAM), también se compararon los ejemplares con material de referencia y las colectas se incorporaron a la colección. Parámetros Ambientales Los parámetros ambientales considerados importantes en la distribución y abundancia de las poblaciones de peces son: la temperatura, la salinidad, la transparencia y el oxígeno. La transparencia del agua se midió con disco Secchi y fué estimada porcentualmente según el método descrito en Amezcua Linares y Yáñez-Arancibia (1980), relacionándola con la profundidad. Los otros parámetros (salinidad, temperatura, oxígeno) fueron estimados convencionalmente. Abundancia, Diversidad y Especies Dominantes La diversidad se consideró como el número de especies y la proporción de los individuos dentro de ellas para cada una de las colectas. Para su estimación se utilizó la expresión de Shannon y Weaver (1963). Aún cuando esta función considera diversidad y abundancia, es recomendable usar otros índices. Para el cálculo de la riqueza de especies como componente de la diversidad se usó la expresión de Margalef (1968). También se consideró el índice de equitabilidad propuesto por Pielou (1966). Se calculó el índice de biomasa según Wilhm. (1968), que efectuó una modificación de la expresión de Shannon y Weaver (1963), en la que se evalúa la diversidad por medio de la biomasa, reemplazando el número de individuos por su peso. La abundancia de la ictiofauna fué determinada por densidad de individuos (ind / m²), biomasa (g peso húmedo / m²) y gramos/individuo. Las dos primeras características junto con el análisis de frecuencia de especies, permitieron determinar aquellas que fueron dominantes. Categorías Ictiotróficas y Componentes Comunitarios La posición trófica de las especies se ubicó revisando detalladamente los trabajos de Aguirre-León y Yáñez-Arancibia (1986); Vargas Maldonadoet al.(1981); Mallard Colmenero et al.(1982); Chavance et al. (1984); Diaz Ruíz (1987); Lara-Domínguez (1986); Randall (1967); Springer y Woodburn (1960); Dayet al.,(1973). Se adoptó el criterio de Yáñez-Arancibia y Nugent (1977) para ubicarlas en varias categorías de alimentación definidas como: a. Consumidores de primer orden, que incluye planctófagos (fito y/o zoo) detritívos y omnívoros (detritus vegetales y fauna de pequeño tamaño). b. Consumidores de segundo orden, son peces predominantemente carnívoros, aunque incorporan en su dieta cantidades pequeñas de vegetales y detritus. c. Consumidores de tercer orden, son peces exclusivamente carnívoros en los cuales los vegetales y detritus son alimentos accidentales. La frecuencia de aparición de las especies, su procedencia, estado de desarrollo gonádico, hábitos alimenticios y rangos de tallas, permitió determinar los tipos de componentes de la comunidad. La frecuencia fue un factor determinante para decidir la ubicación de las especies dentro de los componentes. Las especies con frecuencia de 1 a 30% se consideraron visitantes ocasionales, visitantes cíclicas aquellas con frecuencia de 31 a 70% y finalmente como sedentarias o tipicamente estuarinas las especies con 71 a 100% de frecuencia. Similitud Ecológica Con el objeto de conocer la afinidad de las poblaciones de peces de pastos marinos, en términos de apariciones simultáneas de especies por colecta, se realizó un análisis de agrupamiento de tipo "single linkage" (Davies, 1971). Los principios han sido explicados en Vargas Maldonadoet al .(1981). El agrupamiento se realizó utilizando como características a las especies y como individuos a las estaciones. Se utilizó el criterio de presencia/ausencia de las especies, introduciendo una matriz inicial de 56 x 15 (especies vs estaciones) = 840 elementos. El procesamiento de los datos se efectuó en la computadora Burroughs B7800, de la Universidad Nacional Autónoma de México. RESULTADOS
AMBIENTELa profundidad promedio fué de 2.5 m con valores máximos de 4.5 m y mínimo del m. Con los resultados de transparencia y salinidad (superficial y de fondo), se obtuvo una matriz de 300 elementos. Con esta última se hicieron diferentes análisis estadísticos: Una prueba para comparar las salinidades superficiales y de fondo ("t"). Lo mismo para la temperatura. En ambos casos no hubo diferencias significativas. Ensayos pareados (con la prueba anterior) de todas las estaciones entre sí, con temperatura superficial y transparencia (26 combinaciones), no hubo diferencias significativas. Matriz de correlaciones con los parámetros arriba mencionados (Pearson). Los valores der fueron muy bajos para todos los pares. Observando las gráficas de salinidad y temperatura, se infirió cierta relación entre éstos dos factores (Fig. 2). Por esta razón se intentó el procedimiento anterior desfasando un mes los valores. Los resultados fueron negativos. 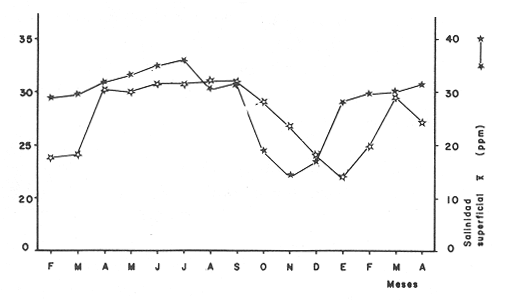 Figura 2. Fluctuaciones en el ciclo anual 1980 - 1981 de la temperatura y salinidad superficiales (se muestran los promedios de las cuatro estaciones muestreadas). Es interesante ver que la temperatura tiene decrementos marcados en enero y febrero, mismos que empiezan a partir de octubre (Fig. 2). Sin embargo, presenta valores muy parecidos el resto del ciclo, de aquí que su desviación estándar sea baja e igual a 3.12 para un promedio anual de 27.2°C. Cabe mencionar que en las cuatro estaciones de colecta se nota la misma tendencia. La salinidad fue homogénea en todas las localidades, con descensos de octubre a diciembre. Se conserva con pequeñas variaciones en todos los meses. Su promedio es de 26.6%, con una desviación de 6.01. Eliminando los descensos en la época de lluvias, su promedio es de 32.3% con una desviación de 1.8. La transparencia mostró fluctuaciones erráticas (Tabla 2). No presenta tendencia en el cielo. El promedio fue de 31, con una desviación de 18.67. Es pertinente mencionar que los resultados presentados en la figura 2 y en la Tabla 2 provienen del análisis exhaustivo de una matriz inicial de 300 elementos y muestran con toda fidelidad las fluctuaciones de los parámetros en praderas de pastos marinos. ESTRUCTURA DE LA COMUNIDADDurante el muestreo anual se obtuvieron 4117 ejemplares de 56 especies, completando con esto un total de 87 especies reportadas para el área. La captura pesó 251,374 gramos. En las Tablas 3 a 6 se muestra con detalle la estructura de las comunidades para cada una de las estaciones. Asimismo se dan los valores obtenidos en cada mes para biomasa, densidad, talla promedio de las poblaciones e índices de diversidad. 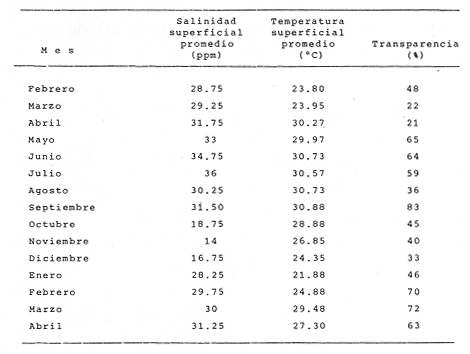 TABLA 2 PARÁMETROS AMBIENTALES EN EL LITORAL INTERNO DE LA ISLA DEL CARMEN. CICLO ANUAL 1980-1981 Abundancia y Diversidad La abundancia se estimó a partir de la densidad y la biomasa. Los valores detallados por colecta y por mes se presentan en las Tablas 3 a 6. No hay cambios significativos para éstos dos índices en el ciclo anual (ANOVA, F = 0.2071, α = 0.05). Se presentan los valores de índices de diversidad para cada uno de los meses, en cada una de las estaciones. Dado que ninguno de los índices mostró variaciones importantes durante el ciclo (ANOVA, F = 0.2071, α = 0.05) , se considera oportuno no entrar en detalles. Es pertinente mencionar que los valores por estación están dentro de los rangos ya reportados para la Laguna de Términos. Se analizó además de las Tablas ya mencionadas una matriz de 56 x 30 = 1680 elementos en la que se concentraron todos los resultados de abundancia. Esta matriz permitió calcular los valores de cada uno de los índices de diversidad considerando todas las colectas del ciclo anual. Los resultados globales obtenidos para heterogeneidad fueron de 2.45 para H'n y 2.19 para H'w. Los valores para los índices de Pielou y Margalef fueron de 0.608 y 6.6 respectivamente.
Tabla 3 Tabla 4 Tabla 5 Tabla 6 Componentes de comunidad El tipo de componentes al que pertenece cada una de las especies, se muestra en la Tabla 7. Del total de 56 especies, sólo una especie quedó clasificada como sedentaria:Sphoeroides testudineus(1.8%). Cuatro especies se consideraron como visitantes cíclicasArius felis, Eucinostoinus gula, Archosargus rhomboidalis yChilomycterus schoepfi (7.1%). El resto de las especies (51) quedaron clasificadas como visitantes ocasionales (91.1%).  TABLA 7 TIPOS DE COMPONENTES Y CATEGORIAS ICTIOTROFICAS PARA EL CICLO ANUAL 1980-1981 Categorías Ictiotróficas La figura 4 muestra la categorización por tipo de alimentación para las especies, 35 especies quedaron incluidas como consumidores de segundo orden (62.5%), 13 (23.2%) como consumidores de tercer orden y 8 (14.3%) como consumidores de tercer orden. En la Tabla 7 se muestra en detalle esta distribución. Así también en las figuras 3 y 4 se muestra gráficamente la distribución de componentes comunitarios y categorías tróficas respectivamente. 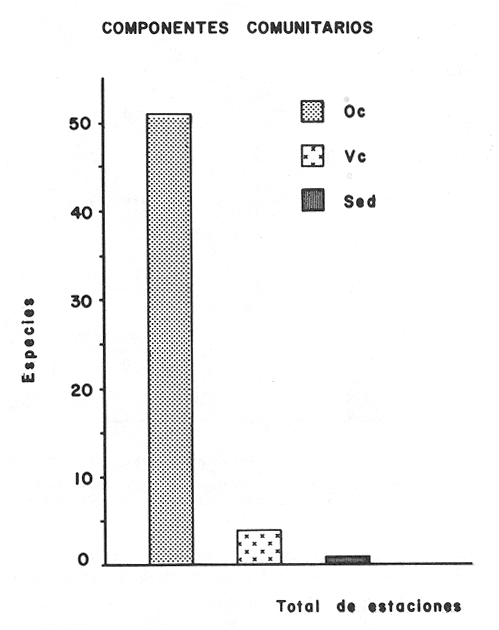 Figura 3. Proporciones de las tres categorias ictiotróficas de la taxocenosis en praderas de pastos marinos. Ciclo anual 19W - 1981. Especies Dominantes y Similitud En su mayoría, la asociación más conspicua tiene ejemplares carnívoros intermedios (66.6%). A continuación se enlistan en orden de dominancia:Sphoeroides testudineus, Archosargus rhoniboidalis, Arius felis, Arius melanopus, Eucinostomus gula, Bairdiella chrysoura, Chilomycterus schoepfi, Acanthostración quadricornis, Orthopristis chrysoptera. Cabe aclarar que la especieArchosargus rhomboidalis es la especie con mayor biomasa, sin embargo se consideró en segundo lugar por ser menor en número y frecuencia. La biomasa de las especies arriba enlistadas, tiene fluctuaciones no significativas (ANOVA, F = 0.2071, α = 0.05), de aquí que no se detectó tendencia en todo el ciclo anual. Igual sucede con la talla promedio de las poblaciones (ANOVA, F = 0.7652, α = 0.05). Existe un hecho sobresaliente y es que los gramos/m² de las especies a las que se hace referencia, es significativamente mayor que la del resto juntas (Fig. 5). Esto quizá explique el alto coeficiente de correlación obtenido entre la biomasa total y la de las especies dominantes (r = 0.97). 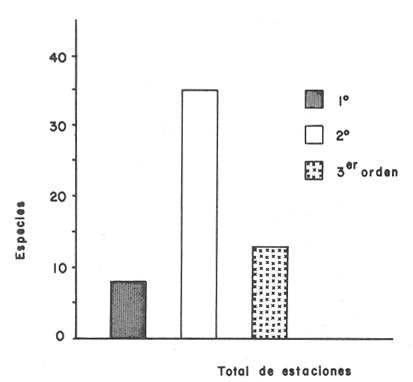 Figura 4. Proporciones de las tres categorias ictiotróficas de la taxocenosis en praderas de pastos marinos. Ciclo anual 1980-1981. Se realizaron diversas correlaciones de biomasa, densidad, g/ind e índices de diversidad con resultados negativos. La figura 6 muestra la agrupación por similitud de especies. Como puede observarse, no existe formación de grupos por época del año, de aquí que se mantiene una homogeneidad en esta zona de pastos marinos, en lo que a apariencias simultáneas de especies se refiere. 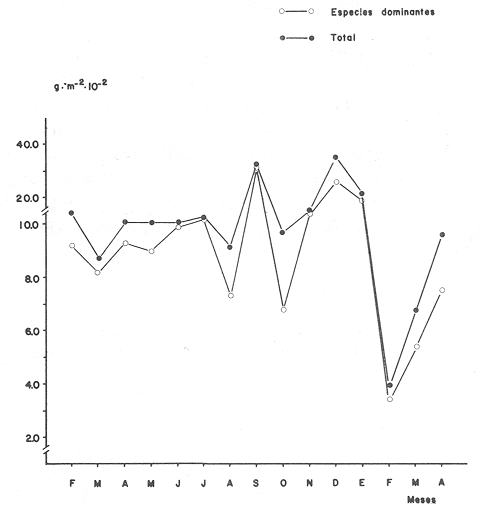 Figura 5. Variación estacional de la biomasa en el litoral interno de la Isla del Carmen (Febrero 1980 - Abril 1981). 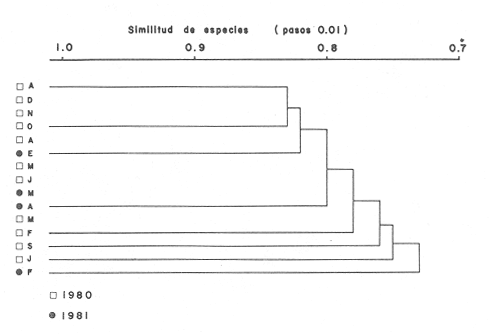 Figura 6. Dendograma que agrupa los diferentes meses de muestreo basado en la presencia/ausencia de las especies. Ciclo anual 1980-1981. DISCUSIONEl habitat deThalassia testudinum en la región cercana a los límites de la Cuenca Central es una zona muy somera, con una profundidad promedio de 2.5 m. La región se comporta como un solo cuerpo de agua, con variaciones mínimas casi todo el año. Los descensos de la temperatura del agua coinciden con los meses más fríos y la disminución de la salinidad con las lluvias torrenciales. La transparencia no presenta un patrón de finido, sus valores están afectados principalmente por la presencia de vientos norte y sureste que remueven sedimentos; podría pensarse que la presencia de pradera deThalassia condiciona una transparencia relativamen te alta todo el año. Según Ginsburg y Lowenstam (1956) los pastos marinos estabilizan los sedimentos; además crean una capa de agua semiquieta que favorece el atrapamiento de sedimentos finos. No obstante que los índices de diversidad no mostraron variaciones importantes en el ciclo, es de gran utilidad obtener registros contínuos de sus valores. Como ha discutido Livingston (1982, 1984), es primordial registrar periodicamente algunas características del sistema, incluyendo desde luego índices de diversidad. Estos datos permiten conocer la variablidad natural y abren la posibilidad de ubicar respuestas específicas a alteraciones del habitat. El hecho de que predominen las especies visitantes ocasionales puede deberse al tamaño de las poblaciones. Una población según sea su estrategia mantiene sus números hasta un límite impuesto por la resistencia ambiental. Este límite es diferente para cada especie y depende de la biología de la misma e interacciones con su entorno. Es lógico suponer que aquellas especies de peces que rara vez se capturan no acuden esporadicamente, por que no pensar que lo hacen ciclicamente. Solo que al presentar bajas densidades o bien si solo arriban en ciertas épocas del año, la probabilidad de capturarlas disminuye. Sería interesante comprobar ésta hipótesis. Heck y Orth (1980) han demostrado que las comunidades de peces en pastos son más abundantes y diversas que las áreas adyacentes sin vegetación. De aquí que en el litoral interno de la Isla del Carmen, se este observando un gradiente en la estructura de la comunidad de peces. podría pensarse que mantienen sus números muy altos en áreas protegidas por pastos marinos y manglares, y disminuyen hacia el ecotono con la Cuenca Central. Otra modalidad del fenómeno mancionado es la gran movilización de especies que existe en el área. Si se concentraran en un tiempo dado (p. ej. un mes) el total de las especies que llegan en un ciclo anual, excedería los números que el sistema deThalassia realmente puede soportar. De ahí que la optimización en el uso de un biotopo altamente productivo, es la utilización secuencial del habitat. Esto permite el mantenimiento de una variedad de grupos de múltiples estrategias. Lo anterior gracias a un gran movimiento de migraciones. Con la modalidad de que las especies que ahí conviven, utilizan en ocasiones otros tipos de habitat totalmente opuestos por ejemplo Cichlasoma urophthalmusyNicholsina usta como ejemplos extremos. Conjuntamente, se permite que especies no adaptadas totalmente en su ciclo de vida a este sistema ejerzan control sobre el resto de la comunidad. Es decir, son especies dominantes, mantienen sus números muy altos, sin ser especies sedentarias. Subrahmanyam y Coultas (1980) han discutido la presencia escalonada de especies estuarinas, sugiriendo que esto favorece la utilización de recursos. Una de las diferencias con el ecotono de manglar es la ausencia de algunas especies y presencia de otras (Tabla 8). Algunas de las que están sólo en las cercanías del manglar son tipicamente asociadas a éste. Una especie que seguramente es sedentaria en manglares de Punta Gorda y que rara vez se captura es Cyprinodon sp, (Vargas Maldonado, 1982). Intuitivamente, debe ser un eslabón muy importante en la red trófica que mantiene a especies explotables por el hombre. Esto sugiere estudios más específicos y uso de censos visuales (Valdéz-Muñóz, 1981) y redes estacionarias (Kjelson et al., 1975) en las inmediaciones del manglar para la captura de estas poblaciones.  TABLA 8 ESPECIES REGISTRADAS EN ÁREAS DE PASTOS MARINOS CERCANAS A MANGLAR NO DETECTADAS PARA EL CICLO ANUAL 1980-1981 Durante el ciclo anual los peces tienden a concentrarse en un nivel trófico principalmente. Este hecho se ha observado en los trabajos ya citados de pastos marinos. En un estudio reciente en la Laguna de Alvarado se reporta el mismo comportamiento (Vargas Maldonado, 1984); esto quizá sea común para sistemas del Golfo de México. La mayor frecuencia de peces consumidores de segundo orden puede deberse a los tamaños de las especies, ya que las hojas no pueden brindar protección a especies e gran tamaño como lo a mencionado Thayer y Phillips (1977). Por consiguiente especies carnívoras de gran tamaño, difícilmente podrán utilizar estos sistemas para sus actividades, al menos su frecuencia dentro de ellos será muy baja y esencialmente por actividad trófica. La especie Sphoeroides testudineus es la más representada y ampliamente distribuída de la familia tetraodontidade en la Laguna de Términos (Mallard Colmeneroet al., 1982). La frecuencia con la cual se presenta en el área de estudio permite suponer que es sedentaria estuarina. Parece que depende en gran parte de su ciclo de vida de estas praderas, se piensa que se reproduce en la línea de costa (Yáñez-Arancibiaet al., 1985) utilizando las áreas de pastos marinos para protección. La presencia de adaptaciones específicas como es la morfología bucal que le permite alimentarse de ostras en los manglares y las toxinas que produce le confiere ventajas adaptativas para colonizar ampliamente este sistema. No obstante las diferencias en la estructura de la comunidad de este ecotono con respecto a habitats de pastos marinos contiguos, se conserva la homogeneidad ambiental, como lo demuestra el "cluster" realizado para describir la similitud de la comunidad (Fig. 6). Como corolario a los aspectos discutidos se propone una hipótesis: la existencia de sólo dos tipos de especies para la comunidad de contacto entre el sistema de pastos marínos y la cuenca central. Se designarán como especies pares e impares. En el primer caso estánSphoeroides testudineus, Archosargus rhoinboidalis, Arius felis y Eucinostomus gula cuyos ejemplares se encuentran siempre. En el segundo caso están el resto de las especies (52) que se movilizan todo el tiempo sin un patrón definido en el año. En ambos casos se refleja la densidad con altos valores para las especies pares y bajos para las impares. La persistencia y gran abundancia de las especies pares se debe a que han desarrollado estrategias adaptativas que les confieren ventajas. De hecho las especies pares mantienen en gran proporción los valores de producción del sistema. Recordar que la abundancia (densidad) en una fase de la distribución, con abundancia igual a cero en los límites de la misma; la estructura de la comunidad se ve modificada a lo largo de un gradiente ambiental, que en este caso va de los pastos adyacentes al manglar hasta los que bordean la Cuenca Central, con densidades altas en las cercanías al manglar para las especies de la Tabla 8 e iguales a cero para las mismas especies en las cercanías a la Cuenca Central. Al acercarse a sus límites de distribución la densidad de una especie empieza a acercarse a cero, esto ocasiona que se capture en bajas frecuencias, lo cual haría pensar que se trata de un visitante ocasional, sin necesariamente serio. Estudios posteriores podrán comprobar si ésta hipótesis se cumple. AgradecimientosAl Instituto de Ciencias del Mar y Limnología y al Laboratorio de Ictiología y Ecología Estuarina el apoyo ínstitucional y financiero para la realización de este trabajo, a través del proyecto de investigación "Ecología, Usos, Recursos y Manejo de los Ecosistemas Costeros del Estado de Campeche" (clave PCECBNA-021924). A los investigadores: A. Ayala-Castañares, V. Solís-Weiss, A. García-Cubas y F. Amezcua Linares la revisión del manuscrito y algunas sugerencias. A todos los integrantes del Laboratorio de Ictiología y Ecología Estuarina, su ayuda en los muestreos y procesamiento del material biológico. A A. Gamietea Domínguez el exámen estadístico de los resultados. Al Departamento de Crédito Educativo del Consejo Nacional de Ciencias y Tecnología la beca de investigación proporcionada y al programa de Superación del Personal Académico de la Universidad Nacional la beca de posgrado otorgada. LITERATURAADAMS, M.S., The ecology of eelgrass Zostera marina (L), Fish comunities. II Structural analisys. J. exp. mar. Biol. Ecol.1976.269-291.22: AGUIRRE LEÓN, A y A. YÁÑEZ-ARANCIBIA,An. Inst. Cienc. del Mar y Limnol. Las mojarras de la Laguna de Términos: Taxonomía, biología, ecología y dinámica trófica (Pisces: Gerridae).Univ. Nal. Autón. México,1986.369-444.13(1): ALLEN, L.G. y E.E. DEMARTINI, California. Fish.Bull.,Temporal and spartial pattems of nearshore distribution and abundance of the pelagic físhes off San Onofre-Ocean side,1983.569-586.81(3): AMEZCUA LINARES, F. y A. YÁÑEZ-ARANCIBIA, An. Centro Cienc. del Mar y Limnol. Ecología de los sistemas fluvio-lagunares asociados a Laguna de Términos, El habitat y estructura de las comunidades de peces. Univ. Nal. Autón. México,1980.69-118.7(1): AYALA-CASTAÑARES, A., Bol. Inst. Geol. Univ. Nal. Autón. México,Sistemática y distribución de los foraminiferos recientes de la Laguna de Términos, Campeche, México.1963.1-130.67(3): BLABER, S. J. M. , Fish Community Ecology in Estuaries and Coastal Lagoons: Towards an Ecosystem Integration. Factors affecting the distribution of estuarine fishes of the Indo-Pacific. In:A. Yáñez-Arancibia (Ed.)Editorial Universitaria, UNAM-PUAL-ICML. México.1985.658 p. BRAVO NÚÑEZ, E. y A. YÁÑEZ-ARANCIBIA, An. Centro Cienc. del Mary Limnol. Ecología de la Boca de Puerto Real, Laguna de Términos. 1. Descripción del área y análisis estructural de las comunidades de peces.Univ. Nal. Autón. México,1979.125-182.6(1): BROOK I. M., Trophic relationships in a seagrass community (Thalassia testudinum), in Card Sound, Florida. Fish diets in relation to macrobenthic and cryptic faunal abundance.Trans. Amer. Fish. Soc.,1977.219-229.106(3): CASTO AGUIRRE, J. L.,An. Esc. Nac. Cienc. Biol. México, Los peces de las lagunas Oriental y Occidental, Oaxaca, México y sus relaciones con la temperatura y la salinidad. II. Análisis multifactorial.1982.85-100.26: CHAVANCE, P., A. YÁÑEZ-ARANCIBIA, D. FLORES HERNANDEZ. A. L. LARA-DOMÍNGUEZ y F. AMEZCUA LINARES, An. Inst. Cienc.. del Mar y Limnol. Ecology, biology and populations dynamics of Archosargus rhomboidalis (Pisces: Sparidae) in a tropical coastal lagoon, Southern Gulf of México. Univ. Nal. Autón. México,1986.11-30.13(2): DAVIES, R. G., . Computer Programming in Quantitative Biology.Academic Press. London..1971420 p DAY. J. W., Jr., W. J. SMMI. P. R. WAGNER y W.C. STOWE, Community structure and carbon budget of a salt marsh and a shallow hay estuarine system in Louisiana. Center of Wetland Resources,Louisiana State University, Baton Rouge, La., Publ. LSU-56-72-04.1973.78 p. D'CROZ, L. y A. A. AVERSA, Rev. Biol. Trop.,Observaciones sobre la abundancia y diversidad de las poblaciones de peces estuarinos en el Caribe de Panamá.1979.189-201.27(2): DÍAZ RUÍZ, S., Tesis M. en C. del Mar (Oceanografía Biológica y Pesquera). Aspectos taxonómicos, evaluación ecológica y estructura trófica de las poblaciones de pomadásidos de la Laguna de Términos, Sur del Golfo de México (Pisces: Pomadasyidae).CCH, Inst, Cienc, del Mar y Limnol. Univ. Nal. Autón. México.1987.240 P. FOX, L. S. y W. L. MOOK, Seasonal ocurrence of fishes in two shore habitats in Barataria Bay, Louisiana. Proc. Louisiana Acad. Sci.,1968.43-53.31: GINSBURG, R- N. y H. A. LOWENSTAM, Jour. Geol., The influence of marine bottom communities on a depositional environment of sediments.1956.310-318.66(3): GODFREY, M. M., Thesis. Seasonal changes in the macrofauna of an eelgrass (Zoostera marina) community near Beaufort, North Carolina. M. A.Duke University.1970.232 p. HECK, K L., Jr., Mar. Biol.,Comparative species richness, composition and abundance of invertebrates in Caribbean seagrass (Thalassia testudinum) meadows (Panama).1977.335-348.4: HECK, K. L. y R. J. ORTH,Estuarine Perspectives.Seagrass habitats: the role of habitat complexity, competition and predation in structuring associated fish and motile macroinvertebrate assemblages. In: V. Kennedy (Ed.) Academc Press Inc. New York:1980.449-464. KJELSON, M. A., W. R. TURNER y G. N. JOHNSON, Description of a stationary dropnet for estimating nekton abundance in shallow waters.Trans. Amer. Fish, Soc.,1975.46-49.(1):104 KJELSON, M. A., G. N. JOHNSON, R. L. GARNER y 3. D. WATSON, Annual Report of the Atomic Energy Commission. Biomass and densities of the fish and macroinvertebrates of the Newport Estuary, North Caroline. U.S. Dept. Commerce, National Marine Fisheries Service Beaufort,1973.169-182. LARA-DOMÍNGUEZ, A. L., Tesis M. en C. del Mar (Oceanografía Biológica y Pesquera). Biología y ecología comparativa de los bagres marinos de la Laguna de Términos, Campeche, sur del Golfo de México (Pisces: Arfidae). CCH, Inst. Cienc. del Mar y Limnol. Univ. Nal. Autón México.1986.274 p. LIVINGSTON, R. L., Diurnal and seasonal fluctuations of organisms in a North Florida estuary. Estuar. Coast. Mar. Sci.,1976.373-400.4: LIVINGSTON, R. L., Ecological Stress and the New York Bight: Science and Managernent. Estuarine Research Federation Columbia, South Caroline:Long-term variability in coastal systems: background noise and environmental stress In: G. F. Mayer (Ed.)1982.605-619. LIVINGSTON, R. L., Ecology, Trophic response of fishes to habitat variability in coastal seagrass system.1984.1258-1275.65(4): LIVINGSTON, R. L., Fish Community Ecology in Estuaries and Coastal Lagoons: Towards an Ecosystem Integration.Organization of fishes in coastal seagrass systems. The response to stress, Chap. 367-383. In: A. Yáñez-Arancibia (Ed.)Editorial Universitaria, UNAM-PUAL-ICML. México.1985.654 p.16: MALLARD COLMENERO, L., A. YÁÑEZ-ARANCIBIA y F. AMEZCUA LINARES, An Inst, Cienc. del Mar y Limnol.Taxonomía, biología y ecología de lo, tetraodóntidos de la Laguna de Términos. sur del Golfo de México (Pisces: Tetraodontidae).Univ. Nal. Autón. México,1982.161-212.9(1): MARGALEF, R., Perspectives in Ecological Theory.The University of Chicago Press.Chicago, Illinois.1968.112 p. OASIM, S. Z., Some problems related to the food chain in a tropical estuary.Proc. Symposium Marine Food Chains. Edimburg, Oliver and Boyd, London: In: J. H. Steele (Ed.)1970.46-51. OGDEN, J. C. y P. R. EHRLICIH,The bahavior of heterotypic resting schools of juvenile grunts (Pomadasyidae). Mar. Biol.1977.273-280.42: OGREN H. L. y H. A. BRUSIHER, The distribution and abundance of fishes caught with a trawl in the St.Andrew Bay system, Florida North Gulf Sci.,1977.83-105.1(2): ORTH, R. J. y K. L. HECK, Jr., Structural components of eelgrass (Zostera marina) meadows in the lower Chesapeake Bay Fishes. Estuaries,1980.278-288.3(4): PAULY. D., On the ecology of a small West-African lagoon. Sonderdruck aus Bd.,1975.46-62.24: PHLEGER, F. B y A. AYALA-CASTAÑARES, Bull. Am. Ass. Petrol. Geol., Processesand history of Terminos Lagoon, México.1971.2130-2140.55(2): PIELOU E. C., J. Theoret. Biol.,The measurement of diversity in different types of biological collections.1960.131-144.13: PRISTAS J. P. y L. TRENT, Bull. Mar. Sci.,Seasonal abundance, size and sez ratio of fishes caught with gill ncts in St. Andrew Bay, Florida.1978.581-589.28(3): RANDALL. J. E. y B. P. BISIHOP, Food habitats of the reef fishes of the West Indies. Stud. Oceanogr. Univ. Miami,1967.665-847.5: ROBERTSON, A. I. y N. C. DUKE, Mangrove as nursery sites: Comparison of the abundance and species composition of fish and crustaceans in mangroves and other nearshore habitats in tropical Australia.Mar. Biol.,1987.193-205.96: SHANNON, C. E. y W. WEAVER, The Mathematical Theory of Communication. University of Illinois Press. Urbana.1963117 p. SHERIDAN, P. S. y R. J. LIVINGSTON, Abundance and seasonality of infauna and epifauna inhabiting a Halodule wrightii meadow in Apalachicola Bay, Florida. Estuaries,1982.407-419.6(4): SPRINGER, V. G. y K. D. WOOBURN, An ecological study of the fishes of the Tampa Bay arca. Fla. St. Bd. Conserv. Mar. Lab., Prof. Pap.,1960.1-104.1: SUBRAHMANYAM, C. B. y C.L.COULTAS, Bull. Mar. Sci.,Studies on the animal communities in two North Florida salt marshes. Part III. Seasonal fluctuations of fish and macroinvertebrates.1980.790-818.30(4): THAYER, W. G. y R. C. PHILLIPS, Importance of eelgrass beds in Puget Sound. Mar. Fish. Rev.,1977.18-22.39(11): THAYER, W. G., D. R. COLBY y W. HETTLER, Jr., Utilization of the red mangrove prop root habitat by fishes in south FloridaMar. Ecol. Progr. Ser.,1987.25-38.35: THAYER, W. G., D. R. COLBY, A. KJELSONy M. P. WEINSTEIN,Estimates of larva fish abundance: diurnal variation and influence of sampling gear and lowing speed. Trans. Amer. Fish. Soc.1983.272-279.(112): TURNER, W. R. y G. N. JOHNSON, Distribution and relative abundance of fishes in New port River, North Caroline, Tech, Rept.,1973.1-23.NMFS-668: VALDÉZ MUÑOZ, E., Cienc. Biol., Estructura y diversidad de la ictiofauna de los manglares de Punta del Este, Isla de la Juventud.1981.111-124.6: VARGAS MALDONADO, I., Problema de Investigación Maestria en Ciencias del Mar. Análisis preliminar de la ecología de comunidades nectónicas en áreas de pastos marinos de Punta Gorda, Laguna de Términos, Campeche, México (Ciclo anual 1976-1977). Inst. Cienc. del Mar y Limnol. Univ. Nal. Autón. México.1982.44 p. VARGAS MALDONADO, I, In: Estudios Ecológicos Básicos de las Lagunas Costeras del Golfo de México. Tercer Informe Proyecto de Investigación PCECBNA/UAM- IZTAPALAPA/CONACyT (TI),Estudios ecológicos de la ictiofauna de la Laguna de Alvarado, Veracruz. Estructura de las comunidades de peces para las épocas de nortes y secas.1984.16 p., 6 Tabl., 8 figs VARGAS MALDONADO, I, A. YÁÑEZ-ARANCIBIA y F. AMEZCUA LINARES, An. Inst. Cienc. del Mar y Limnol.Ecología y estructura de las comunidades de peces en áreas de Rhizophora mangle y Thalassia testudinum de las Isla del Carmen, Laguna de Términos, Sur del Golfo de México.Univ. Nal. Autón. México,1981.20-266.8(1): WETZEL, R. L. y P. A. PENHALE, Production ecology of sea grass communities in the lower Chesapeake Bay. Mar. Tech. Soc. Jour.,1983.22-31.17(2): WILHM, J. L, Ecology, Use of biomass units in Shannon's formula.1968.153-156.49(1): YÁÑEZ-ARANCIBIA, A., Ecological studies in Puerto Real Inlet, Laguna de Términos, México: Discussion on the trophic structure of fish communities on Thalassia testudinum banks. Proc. Sem. Duke Univ. Mar. Lab. Beaufort C. USA.(UNESCO, IABO). UNESCO Tech. Pap. Mar. Sci.,1981.191-232.33:Aug. 1978 YÁÑEZ-ARANCIBIA, A., Ciencia y Desarrollo.Evaluación de la pesca demersal costera. CONACyT. México1984.61-71.(58): YÁÑEZ-ARANCIBIA, A. y R. S. NU`GENT, An. Centro Cienc. del Mar y Limnol.El papel ecológico de los peces en estuarios y lagunas costeras. Univ. Nal. Autón. México,1977.107-114.4(1): YÁÑEZ-ARANCIBIA, A. y J. W. DAY, Jr.,Coastal Lagoons. Oceanologica Acta, Vol. Spec.,Ecological characterization of Terminos Lagoon, a tropical lagoon estuarine system in the southern Gulf of México.In:Lasserre, P. y H. Postma (Eds.)1982.431-440.5(4): YÁÑEZ-ARANCIBIA, A. y A. L. LARA-DOMÍNGUEZ, An. Inst. Cienc. Del Mar y Limnol.Dinámica ambiental de la Boca de Estero Pargo y estructura de sus comunidades de peces en cambios estacionales y cielos de 24 hs. Laguna de Términos sur del Golfo de México.Univ. Nal. Autón. México,1983.85-116.10(1): YÁÑEZ-ARANCIBIA, A., A. L. LARA-DOMÍNGUEZ, P. CHAVANCE y D. FLORES HERNÁNDEZ.,An. Inst. Cienc. del Mar y Limnol.Enviromental behavior of Terminos Lagoon ecological system, Campeche, México.Univ. Nal. Autón. México,1983.137-176.10(1): YÁÑEZ.ARANCIBIA,A., A.L. LARA-DOMÍNGUEZ, A. AGUIRRE LEON, F. AMEZCUA LINARES, D. FLORES HERNÁNDEZ y P. CHAVANCE, Fish Comunity Ecology and Coastal Lagoons: Towards an Ecosystem Integration. Ecology of dominant fish population in tropical estuaries: environmental factors regulating biological strategies and production.In:A. Yáñez-Arancibia (Ed.)Editorial Universitaria, UNAM-PUAL-ICMI,México.1985,654 p. YÁÑEZ-ARANCIBIA, A., A. L. LARA-DOMÍNGUEZ, J. L. ROJAS GALAVIZ, P. SANCHEZ-GIL, J. W. DAY, Jr. y C.J. MADDEN, J. Fish. Biol., 33 (Supplement A):Seasonal biomass and diversity of estuarine fishes coupled with tropical habitat heterogeneity (Southern Gulf of México).1988.191-200. YÁÑEZ-ARANCIBIA, A., A. L. LARA-DOMÍNGUEZ, P. SANCHEZ GIL, I. VARGAS, P. CHAVANCE, F. AMEZCUA LINARES, A. AGUIRRE-LEON y S. DIAZ RUIZ,. Coastal Lagoons. Oceanologica Acta, Vol. Spec., Ecosistem dynamics and nichtemeral and seasonal programming of fish community structure in a tropical estuarine inlet, México. In:Lasserre, P. y II. Postma (Eds.)1982417-429.5(4): YÁÑEZ CORREA, A., Bol. Inst. Geol. Univ. Nal. Autón. México,Batimetría, salinidad, temperatura y distribución de sedimentos recientes de la Laguna de Términos, Campeche, México.1963.1-47.67(1): ZIEMAN, J. C., The ecology of the sea grasses of South Florida: A community profile. US Fish and Wildlife Ser.,Office of Biological Ser. Wash., DC FWS/OBS-82/25.1982.158 p.
|

