|
PROSPECCIÓN ICTIOECOLÓGICA
EN LA ZONA DE PASTOS MARINOS DE LA LAGUNA ARRECIFAL EN PUERTO MORELOS, QUINTANA
ROO, VERANO 1984
Trabajo recibido el 30 de marzo de 1985 y aceptado para
su publicación el 25 de octubre de 1985.
NOTA CIENTIFICA
HERNÁN ÁLVAREZ-GUILLEN, MA. DE LA C. GARCÍA-ABAD, GUILLERMO J. VILLALOBOS ZAPATA y ALEJANDRO YÁÑEZ-ARANCIBIA
Universidad Nacional Autónoma de México,
Instituto de Ciencias dei Mar y Limnología, Laboratorio de
Ictiología y Ecología Estuarina.
MARGARITO TAPIA GARCIA
Universidad Autónoma Metropolitana Iztapalapa, D.C.B.S.,
Depto. de Hidrobiología. Contribución 468 del Instituto de
Ciencias del Mar y Limnología, UNAM.
Se
realizó un estudio preliminar de la ictiofauna en la zona de pastos
marinos (Thalassia testudinum y Halodule
sp) en la laguna arrecifal de Puerto Morelos, Quintana Roo en agosto de 1984
mediante un muestreo nictemeral (24 hr) con chinchorro playero. Los
parámetros ambientales registrados (pH, oxígeno disuelto y
temperatura) presentaron pulsos máximos a las horas de mayor iluminacion
y mínimos a las horas de obscuridad. Se analizaron 1959 peces
distribuidos en 22 familias, 33 generos y 43 especies. Son dominantes por su
abundancia y frecuencia 7 especies (16%): Harengula jaguana, Harengula
humeralis, Caranx crysos, Eucinostomus argenteus, Haemulon aurolineatum
y Polydactylus oligodon. Estas especies fueron
analizadas obteniendose su relación talla-peso, proporción de
sexos, madurez gonádica, espectro trófico y hábitos
alimenticios. Se observó que estas especies utilizan este habitat
particular y definido de los arrecifes de coral como áreas de
alimentación, crianza y protección encontrandose una gran
variedad de ejemplares juveniles. Las variaciones nictemerales en densidad y
biomasa están relacionadas a un comportamiento trófico
(consumidores diurnos y nocturnos).
A preliminary study of the
ichthiofauna in the sea grass (Thalassia testudinum and
Halodule sp) zone of reef lagoon in Puerto Morelos, Quintana
Roo, México by means of a nichtemeral sample (24 hr) using a hand seine
was carried out in August, 1984. The environmental parameters recorded (pH,
dissolved oxygen and temperature) indicate the highest pulses during the hours
of maximum sunlight and the lowest during the hours of darkness. An analysis of
1959 fishes distributed in 22 families, 33 genus and 43 species was made. On
the basis of abundance and frequency, 7 species (16%) are dominant:
Harengula jaguana, Harengula humeralis, Caranx crysos, Eucinostomus
argenteus, Haemolun aurolineatum andPolydactylus
oligodon. These specis were analysed to determine the realtionships
size-weight, sex ratios, gonad maturity, trophic spectrum and feeding habits.
It was found that these species use the particular and well defined coral reef
habitat as feeding, growing and protection areas. A great variety of mostly
juvenile, and some adult individuals were found there. Nichtemeral variations
in density and biomass are related to certain trophic behavior (diurnal and
nocturnal consumers).
Los litorales de México son heterogéneos como consecuencia de latitudes diversas y unidades oceanográficas distintas (¡.e., Golfo de California, Océano Pacífico, Golfo de México y Mar Caribe). La zona costera árida del noroeste del país contrasta con características subtropicales del Pacífico central y sur, las costas tropicales del sur del Golfo de México, y los sistemas arrecifales costeros del Caribe. Aún cuando se presentan arrecifes en el Pacífico, Golfo de México y Caribe, los dos primeros están poco representados, son unidades aisladas, locales y no constituyen complejos arrecifales tipo barrera como la costa del Caribe. Existen escasos trabajos publicados sobre el área del Caribe Mexicano que tratan de caracterizar el sistema arrecifal Entre estos se encuentran las publicaciones de Huerta (1958), Stoddart (1962), Ward (1967), Folk (1967), Ekdale (1972), y Jordan et al. (1978) y Jordan (1979). En cuanto a trabajos sobre peces de arrecifes del Caribe y sistemas de pastos asociados, existen algunos trabajos como los de Bölke y Chaplin (1968), Randall (1967, 1968), Cervigón (1966, 1967), Collete (1974), Heck y Orth (1980), Vargas Maldonado et al. (1981) y Munro (1983), pero en particular sobre peces arrecifales del Caribe Mexicano se conocen pocos estudios publicados, estos son Hildebrand et al. (1964), Chávez (1966) y Jordanet al. (1978) quienes incluyen una lista de peces observados. Rodríguez-Capetillo et al. (1987) hacen una evaluación de la diversidad y abundancia de los peces demersales de la Plataforma Continental de Yucatán, en un estudio prospectivo adyacente al Caribe. Las comunidades de pastos marinos constituyen un hábitat particular y definido en los arrecifes coralinos. Entre estas, las praderas de Thalassia testudinum han sido objeto de numerosos trabajos y entre sus atributos más importantes están el constituir áreas de crianza, alta diversidad y densidad de peso e invertebrados, asimismo funcionan como áreas de alimentación para la macrofauna en general, como estabilizadores de sedimento, en la creación de microhabitats y en general como un hábitat complejo (Hoese y Jones, 1963; Wood et al.,1969; Carr y Adams, 1973; Thayer et al., 1975; Adams, 1976a, 1976b, 1977; Mc Roy y Helfferich, 1977; Thorhaug y Roessler, 1977; Kikuchi y Pérez, 1977; Weinstein y Heck, 1979; Yáñez-Arancibia et al., 1980; Heck y Orth, 1980; Yáñez-Arancibia, 1981; Vargas Maldonado et al.,1981; Yáñez-Arancibia y Lara-Domínguez, 1983; Ogden y Gladfelter, 1983). Existe información ecológica acerca del comportamiento nictemeral y estacional de poblaciones de peces en praderas de Thalassia testudinum, en los cuales se destaca la importancia que tienen los pastos marinos en el ciclo de vida de los peces Yáñez-Arancibia et al.,1982a, 1985a. OBJETIVOSLo anterior fundamenta el planteamiento preliminar de efectuar una prospección sobre la composición de las poblaciones de peces y aspectos de las comunidades en un área representativa de las condiciones que prevalecen en el litoral mexicano del Caribe, esto es, ambientes de pastos marinos asociados a los arrecifes de coral. 1. Determinar la composición taxonómica de la ictiofauna en praderas de Thalassia testudinum y Halodule sp de la Laguna Arrecifal de Puerto Morelos, Quintana Roo, durante un ciclo de 24-hrs. 2. Evaluar la diversidad, abundancia numérica y de biomasa y su variación en un ciclo nictemeral. 3. Efectuar un análisis de la relación talla-peso, proporción de sexos y madurez gonádica de las especies dominantes. 4. Determinar el espectro trófico y hábitos alimenticios de las especies dominantes y discutir su ecología trofodinámica en un ciclo níctemeral. ÁREA DE ESTUDIOLa laguna arrecifal de Puerto Morelos se encuentra localizada en la costa este de la Península de Yucatán frente al mar Caribe y está comprendida entre los 20°48' y 20°52' de latitud norte y 86°51' de longitud oeste y cubre una extensión aproximada de 6 km de longitud (Fig. 1). Geológicamente la península está formada por carbonato autigénico y anhídritas, predominando en los sedimentos de la laguna arrecifal arenas medias y finas colonizadas porThalassia testudinum y Halodule sp. No existen ríos, sin embargo la presencia de dolinas es común y el aporte de agua del subsuelo está directamente relacionado con las lluvias que se presentan usualmente en verano, teniendo un clima cálido húmedo. El cociente precipitación temperatura es mayor de 55.3, sin embargo, la temperatura en la orilla es suavizada por los vientos, que son predominantemente del este o sureste, con presencia de nortes en la parte final e inicial del año (Jordan, 1979). La temperatura del agua presenta rangos de 25.2 a 32.8°C, y salinidades de 34.34 a 36. 10‰. Los valores de oxigeno disuelto se encuentran en sobresaturación, y las concentraciones de nutrientes abajo de 1 Mg-at/1 (Merino y Otero, 1984). La zona muestreada comprende la orilla de la laguna arrecifal entre la estación Puerto Morelos (UNAM-ICML) y la tiburonera que forma una playa de arena calcárea de extensión corta (Fig. 1).Justo en el borde del agua y hacia la laguna, es común encontrar parches de Syringodium sp yHalodule sp que sustituyen parcialmente a.Thalassia testudinum formando pequeños bancos (Jordan, 1979). MATERIAL Y MÉTODOSLas capturas de peces se efectuaron en agosto de 1984 con un chinchorro playero, de 50 m de largo y malla de luz variable, de 3/4" en el copo y 1 1 /2" en las alas. Se hicieron capturas de peces cada 3 horas durante un ciclo nictemeral en un área de pastos marinos dominada por Halodule sp yThalassia testudinum, asociada a la barrera arrecifal (Fig. 1). Los individuos capturados, fueron fijados en formaldehido al 10% neutralizado con Borato de Sodio. Todo el material fue debidamente etiquetado, envasado y trasladado al laboratorio para su análisis. Con cada captura se tomó la temperatura del agua y temperatura ambiental. La salinidad presenta pequeñas variaciones a lo largo del año (Merino y Otero, 1984) por lo cual no se le considera importante en este estudio como factor limitante para los peces coralinos. Adicionalmente, se efectuaron observaciones de la vegetación y macrofauna bentónica acompañante de las capturas de peces. 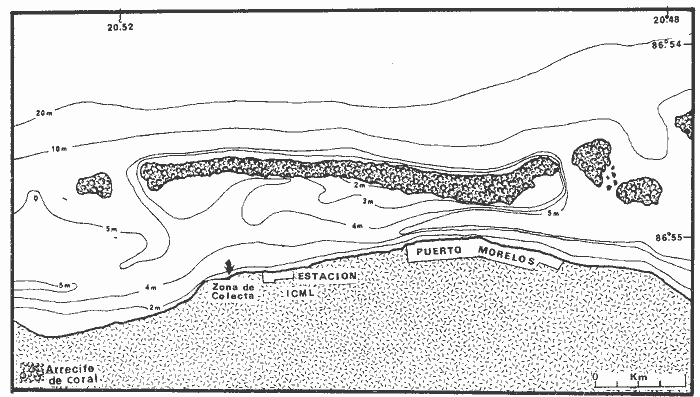 Fig. 1. Área de estudio de la Laguna Arrecifal de Puerto Morelos, Q. Roo. Localización de la zona de muestreo en los pastos marinos. Proporcionado por M. Merino, adaptada de la carta batimétrica Punta Tancharte-Punta Brava, Quintana Roo, México. ACTIVIDADES DE LABORATORIOEn el laboratorio, los peces, flora y macroinvertebrados, fueron separados, lavados, reetiquetados y reenvasados en frascos de vidrio, usando como preservador una mezcla de alcohol metílico al 70% y Formol al 20%. La ictiofauna se determinó taxonómicamente empleando la literatura básica de Jordan y Evermann (1896-1900), Meek e Hildebrand (1923-1928), Beebe y Tee-Van (1933), Norman (1934), Cervigón (1965), Randall (1968), Dahl (1971), Gallaway et al. (1972), Perry II y Perry (1974), Guitart (1977), Fischer (1978), Uyeno et al. (1983). El ordenamiento sistemático se basó en el criterio de Greenwood et al. (1966 y 1967) para categorías supragenéricas. Con los organismos mejor conservados y más representativos de cada especie se integró la Colección Científica de Referencia ICML-PF 0001/0239 (Q. Roo) y se depositó en el Laboratorio de Ictiología y Ecología Estuarina del Instituto de Ciencias del Mar y Limnología (UNAM). La elaboración de esta colección científica es una aportación de gran trascendencia para referencias científicas en investigación y docencia especializada. Los parámetros ambientales fueron tomados de Espinoza et al. (1983) quienes realizaron un muestreo nictemeral en la zona de playa de Puerto Morelos durante agosto de 1984. El cálculo de los diferentes índices ecológicos (H'n, diversidad; H'w, biomasa; D, riqueza de especies; J, 'equitatividad) y la determinación de las especies dominantes se hizo de acuerdo a los métodos indicados por Yáñez-Arancibia et al. (1980). La talla promedio de las poblaciones de peces fue estimada calculando el peso promedio por individuo, el cual se obtiene dividiendo la biomasa entre la densidad. Este índice (g Ind.-¹) aporta información que permite evaluar, en promedio, el tamaño de los peces (Yáñez-Arancibia et al., 1982a, b; Yáñez-Arancibia y Lara-Domínguez, 1983; Alvarez-. Guillén et al., 1985). Se determinó la relación talla-peso para las especies dominantes de acuerdo a la ecuación P = a Lb (Ricker, 1975). 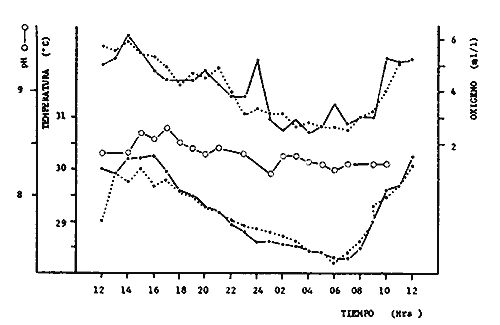 Fig. 2. Variación nictemeral (ciclo de 24 horas) de la temperatura, oxígeno y pH durante agosto de 1984, en la zona de playa de la Laguna Arrecifal de Puerto Morelos, Q. Roo. Las líneas punteadas indican valores de fondo y las continuas de superficie (tomado de Espinoza et al., 1983). Para la determinación del sexo y la madurez gonádica fue necesario disectar la gonáda y observarla al microscopio. La madurez gonádica se determinó de acuerdo a Nikolsky (1963). El análisis del contenido estomacal y hábitos alimenticios se realizó de acuerdo a los criterios expuestos en los trabajos especializados del tema: Darnell y Meierotto (1962), Hobson (1974), Yáñez-Arancibia et al. (1976), Lara-Domínguez et al. (1981), Yáñez-Arancibia (1975), Aguirre-León y Yáñez-Arancibia (1986) y Yáñez-Arancibiaet al. (1984). RESULTADOS Y DISCUSIÓN
PARÁRAMETROS AMBIENTALESDe acuerdo a la literatura consultada en relación al marco ambiental (Espinoza et al., 1983), el oxígeno presentó un máximo a las 12:00 hrs, y disminuyo paulatinamente hasta alcanzar un mínimo entre las 04:00 y las 06:00 hrs, la temperatura se correlación con las horas de iluminación y de obscuridad, y el pH presentó un comportamiento semejante. Estos parámetros permiten visualizar el clásico comportamiento, de un arrecife coralino con alta productividad en el día y alta respiración en la noche, lo que se refleja en el oxígeno presente (también por interacción agua-atmósfera). LISTA SISTEMÁTICA DE LAS ESPECIESFueron analizados un total de 1959 peces, distribuidos en 1 Clase, 2 Divisiones, 3 Superórdenes, 4 Ordenes, 10 Subórdenes, 22 Familias, 33 Géneros y 43 especies. Clase Osteichthys
División I Taeniopaedia
Superorden Clupeomorpha
Orden Clupeiformes
Suborden Clupeoidei
Familia I Clupeidae
Género 1.Harengula Cuvier y Valenciennes, 18471) Harengula humeralis (Cuvier, 1829) 2) Harengula jaguana Poey, 1865 Género 2. Jenkinsia Jordan y Evermann, 18963) Jenkinsia stolifera (Jordan y Gilbert, 1884) Género 3. Opisihonema Gill, 18614)Opisthonema oglinum (Le Sueur, 1818) Familia II Engraulidae
Género 4. Anchoa Jordan y Everman, 19275) Anchoa lamprotaenia Hildebrand, 1943 División III Euteleostei
Superorden Atherinomorpha
Orden Atherinoformes
Suborden Exocoetoidei
Familia III Hemirhamphidae
Género 5. Hyporhamphus Gill, 18596) Hyporhamphus unifasciatus(Ranzani, 1842) Familia IV Belonidae
Género 6. Platybelone Fowler, 19197) Platybelone argalus argalus (Le Sueur 1821) Género 7. Tylosurus Cocco, 19298) Tylosurus crocodilus crocodilus (Peron y Le Sueur, 1821) Suborden Atherinoidei
Familia V Atherinidae
Género 8. Atherinomorus Fowler, 19039) Atherinomorus stipes (Muller y Troschel, 1848) Superorden Acanthopterygii
Orden Perciformes
Suborden Percoidei
Familia VI Carangidae
Género 9. Caranx Lacépede, 180210) Caranx bartholomaei Cuvier, 1833 11) Caranx crysos (Mitchill, 1815) 12) Caranx latus (Linnaeus, 1758) 13) Caranx ruber Jordan y Everman, 1896 Género 10.Trachinotus Lacépede, 180214) Trachinotus falcatus (Linnaeus, 1766) 15) Trachinotus godei Jordan y Evermann, 1896 Género 11. Selene Lacépede, 180316) Selene vomer (Linnaeus, 1758) Familia VII Lutjanidae
Género 12. Lutjanus Bloch, 179017) Lutjanus analis (Cuvier, 1828) 18) Lutjanus griseus (Linnaeus, 1758) 19) Lutjanus synagris (Linnaeus, 1758) Género 13. Ocyurus Gill, 186220) Ocyurus chrysurus (Bloch, 1791) Familia VIII Gerreidae
Género 14. Eucinostomous Baird y Girard, 185521) Eucínostomus argenteusBaird y Girard, 1854 Género 15. Gerres Cuvier, 182422)Gerres cinereus (Walbaum, 1792) Familia IX Pomadasyidae
Género 16. Haemulon Cuvier, 182923)Haemulon aurolineatum Cuvier, 1829 24)Haemulon flavolineatum (Desmarest, 1823) 25) Haemulon plumieri (Lacépede, 1802) 26) Haemulon scyurus (Shaw, 1803) Familia X Sciaenidae
Género 17. Odontoscion Gill, 186227) Odontoscion dentex (Cuvier, 1830) Género 18. Umbrina Cuvier, 181728) Umbrina coroides (Cuvier, 1830) Familia XI Mullidae
Género 19. Pseudupeneus Bleeker, 186229) Pseudupeneus maculatus (Bloch, 1793) Familia XII Chaetodontidae
Género 20. Chaetodon Linnaeus, 175830) Chaetodon capistratus Linnaeus, 1758 Familia XIII Pomacentridae
Género 21. Abudefduf Forskal, 177531) Abudefduf saxatilis Linnaeus, 1758 Suborden Polynemoidei
Familia XIV Polynemidae
Género 22. Polydactilus Lacépede, 180332) Polydactylus oligodon(Günther, 1860) Suborden Labroidei
Familia XV Labridae
Género 23. Halichoeres Ruppell, 183533) Halichoeres bivittatus (Bloch, 1792) Género 24. Hemipteronotus Lacépede, 180234) Hemipteronotus splendens (Castelnau, 1855) Familia XVI Scaridae
Género 25. Sparisoma Swainson, 183135) Sparisoma radians (Valenciennes, 1839) Suborden Blennioidei
Familia XVII Clinidae
Género 26. Labrisomus Swainson, 183136) Labrisomus nuchipinnis I Quoy y Gainard, 1824 Suborden Scombroidei
Familia XVIII Scombridae
Género 27. Scomberomorus Lacepede, 180237) Scomberomorus cavalla (Cuvier, 1829) Orden Tetraodontiformes
Suborden Balistoidei
Familia XIX Balistidae
Género 28. Balistes. Linnaeus, 175838) Balistes capriscus Gmelin, 1788 Familia XX Monacanthidae
Género 29. Stephanolepis Gill, 186139) Siephanolepis setifer (Bennett, 1830) Género 30. Cantherhines Swainson, 183940) Cantherhines pullus (Ranzani, 1842) Familia XXI Acanthuridae
Género 31. Acanthurus Forskall41) Acanthurus bahianus Castelnau, 1855 Suborden Ostracioidei
Familia XXII Ostraciidae
Género 32. Acanthostracion42) Acanthostración polygonius Poey, 1876 Género 33. Lactophrys Swainson, 183943)Lactophrys trigonus (Linnaeus, 1758) ESTRUCTURA DE LA COMUNIDAD
Variación Nictemeral de los Parámetros Ecológicos y Poblacionales de la ComunidadLas Tablas 1 a 3 concentran los valores de los parámetros ecológicos analizados y las figuras 3 a 5 ilustran lo más trascendente de estos parámetros. En relación a los componentes de la comunidad se obtuvo que de las 22 familias, 11 aportan el 47 % de las especies; 4 familias aportan el 92% en abundancia numérica, 6 familias aportan el 92% en abundancia en peso. La familia con el más alto número de especies y la mayor abundancia en peso fue Carangidae con 7 especies (16%) y 4420g (24%) respectivamente. La familia que proporcionó mayor número de ejemplares fue Clupeidae con 925. De las 43 especies registradas 7 (16%) fueron consideradas como dominantes de la comunidad por su número, peso y frecuencia de aparición, estas especies son:Harengula jaguana, Harengula humeralis, Caranx bartholomaei, Caranx crysos, Eucinostomus argenteus, Haemulon aurolineatum yPolydactylus oligodon. La figura 5 muestra los parámetros ecológicos para la comunidad de peces en, las 24 hrs. Es evidente una amplia variación de biomasa, densidad y número de especies observándose sus mayores valores durante horas del día, entre las 09:00 y 15:00 hrs (22 especies, 3.70 en riqueza de especies, H'n = 2.30, 1.52 ind m-², 10.8 g. m-² y equitatividad 1.04), con tallas promedios pequeñas (3.98 g ind -¹ ). Los valores mínimos se presentaron entre las 18:00 hrs y las 01:00 hrs (6 especies, 1.27 en riqueza de especies, H'n = 0.25, 0.05 ind m-² 1.01 g m -² y equitatividad = 0. 1), con tallas promedio grandes (109.1 g ind-¹). Este patrón puede ser explicado por las actividades alimenticias de las especies y la disponibilidad del alimento presentándose durante el día aquellas de hábitos gregarios y zooplantófagos (i.e. Harengula jaguana, Harengula humeralis) y por ejemplares juveniles de Haemulon aurolineatum, Caranx crysos y Caranx bartholomaei; y durante la noche aquellas de hábitos solitarios (Acanthostracion polygonius y Lactophrys trigonus) y carnívoras Polydactylus oligodony Lutjanus griseus. En base a los resultados obtenidos se considera el atardecer (17:00 -19:00 hrs) como una etapa crítica en el intercambio o sustitución de organismos con actividad diurna por organismos con actividad nocturna. Estos resultados concuerdan con lo reportado para otros estudios nictemerales realizados en zonas de pastos marinos por Yáñez-Arancibia (1981), Yáñez-Arancibia et al. (1982a, c) y Yáñez-Arancibia y Lara-Domíngez (1983). 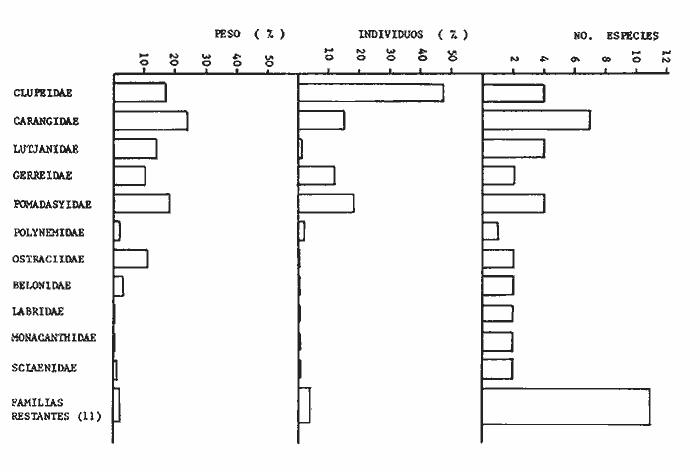 Fig. 3. Comparación del número de especies, porcentaje de individuos y en peso de las familias registradas en el área de estudio. El comportamiento de la relación longitud-peso así como los valores de los coeficientes a y b, de las especies dominantes estudiadas se muestra en las figuras 6 a 8. Para hacer una interpretación biológica sobre estos coeficientes es necesario tener información sobre las diferentes épocas del año para poder detectar sus variaciones, por lo que dan bases para posteriores estudios y para poder efectuar un análisis comparativo. Entre los antecedentes con los que se pueden hacer análisis comparativos existe el trabajo de Aguirre-León y Yáñez-Arancibia (1986) sobre la familia Gerreidae en la Laguna de Términos, Campeche, donde reportan para Eucinostomus argenteus valores de los coeficientes a y b muy semejantes a los obtenidos en este trabajo, explicando que el valor del coeficiente b(2.9 a 3.0) se debe a la homogeneidad de las tallas, lo que coincide con lo encontrado en este estudio (Fig. 8).
TABLA 1 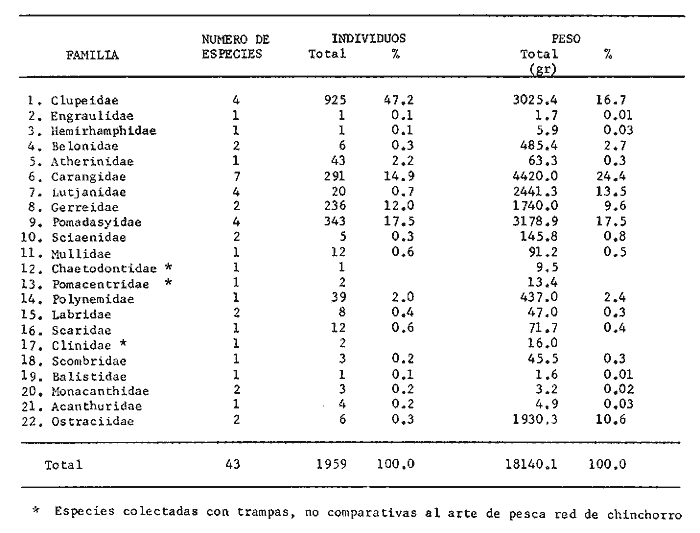 TABLA 2. DISTRIBUCIÓN PORCENTUAL DE LA ABUNDANCIA EN NÚMERO Y PESO DE LAS FAMILIAS DE PECES EN LA COMUNIDAD ASOCIADA A LOS PASTOS MARINOS Y ZONA ARRECIFAL DE PUERTO MORELOS, QUINTANA ROO. Díaz Ruiz y Yáñez-Arancibia (1985) en la Laguna de Términos hacen el mismo análisis para Haemulon aurolineatum, pero los valores de los coeficientes a y b son mayores comparados con los de este estudio. Esta diferencia se puede explicar en base al intervalo de tallas, que fue mucho menor en este estudio que el encontrado en el citado trabajo. Para las especies dominantes restantes no existen antecedentes para poder hacer un análisis comparativo, siendo la información obtenida en este estudio pionera en el área. Proporción de Sexos y Madurez GonadicaPara las especies dominantes analizadas fue difícil detectar el sexo de los individuos por el escaso desarrollo gonádico que presentaron. Para Harengula humeralis; H. Jaguana, Caranx crysos y Eucinostomus argenteusfue posible detectar el sexo y sus proporciones. H. humeralis tiene una proporción hembras:machos de 1:1;H. jaguana 2: 1; C. crysos 1:10; E argenteus 1:1, (Tablas 4). Estas proporciones no se pueden tomar como definitivas, tomando en cuenta que las especies dominantes presentaron solo individuos juveniles y por consiguiente inmaduros e indeterminados (Tabla 4, Fig. 9). El dominio de individuos indeterminados (I) e inmaduros (II) a diferentes tallas permite visualizar la presencia de juveniles. 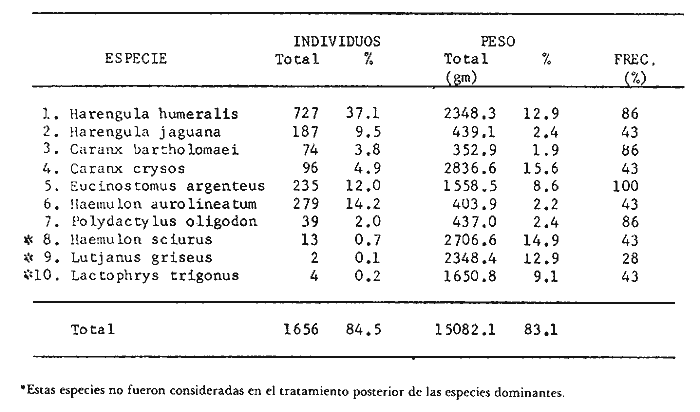 TABLA 3. DISTRIBUCIÓN PORCENTUAL DE LA ABUNDANCIA EN NÚMERO, PESO Y FRECUENCIA DE LAS ESPECIES DOMINANTES EN LAS COMUNIDADES ASOCIADAS A LOS PASTOS MARINOS Y ZONA ARRECIFAL EN PUERTO MORELOS, Q. ROO. Para Caranx crysos y C. bartholomaei, Fischer (1978) reporta desoves de enero a agosto coincidiendo con la subsecuente aparición de juveniles de este estudio. Harengula Jaguana desova de mayo a julio explicando también la presencia de organismos juveniles encontrados para agosto en este estudio, (Fischer, 1978). Para Haemulon aurolineatum y Eucinostomus argenteus, Díaz-Ruiz y Yáñez-Arancibia (1985) y Aguirre-León y Yáñez-Arancibia (1986) respectivamente reportan solo individuos juveniles para la época analizada (lluvias) permitiendo inferir un desove en esta época o previa a ella. De la discusión anterior se considera que las zonas de pastos marinos de Puerto Morelos, Q. Roo sirven como probable área de alimentación, protección y crianza, y que esta época (verano) coincidió con la aparición de juveniles de las especies analizadas. En el estudio del contenido estomacal se analizaron 139 estómagos de las especies consideradas como dominantes. Para la observación de sus hábitos alimenticios se eligieron horas contrastantes del día (horas con luz y horas de obscuridad) trabajándose las capturas más abundantes. Harengula jaguana. El análisis combinado del número, frecuencia y peso (IIR de Pinkas et al.,1971) para cuantificar los indices de importancia relativa, mostró que la materia orgánica, restos de crustáceos, copépodos, anfídopos y larvas megalopas presentan los valores más elevados (Fig. 10). En relación a esta misma figura, en base al índice de importancia relativa (IIR) de Yáñez-Arancibiaet al. (1976) se puede establecer que el alimento principal es la materia orgánica, los restos de crustáceos, anfípodos y larvas megalopas; el alimento secundario no fue detectado; y el alimento circunstancial está representado por los otros grupos tróficos encontrados. Esta especie mostró hábitos diurnos en su alimentación como lo muestra el mayor número de estómagos llenos y medio llenos, y en fases digestivas tempranas observadas a las 06:00 hrs. Por el contrario a las 18:00 hrs la mayoría de los estómagos se encontraron medio llenos y en fases digestivas avanzadas. De acuerdo al espectro trófico encontrado, se observa que se trata básicamente de una especie filtradora de zooplancton, tomando su alimento de la columna de agua en zonas cercanas a los pastos marinos de donde también ingiere perifauna. 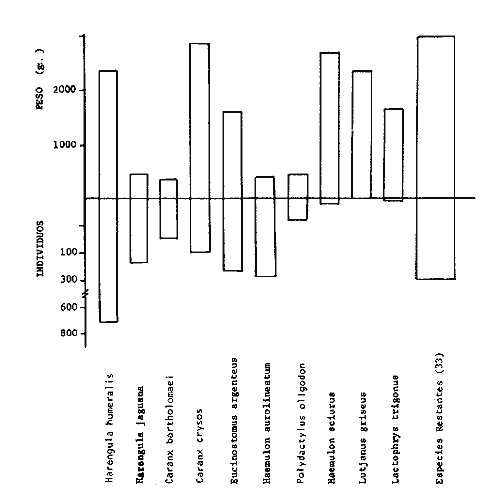 Fig. 4. Relación de la abundancia numérica y en peso de las especies dominantes con el resto de las especies colectadas. 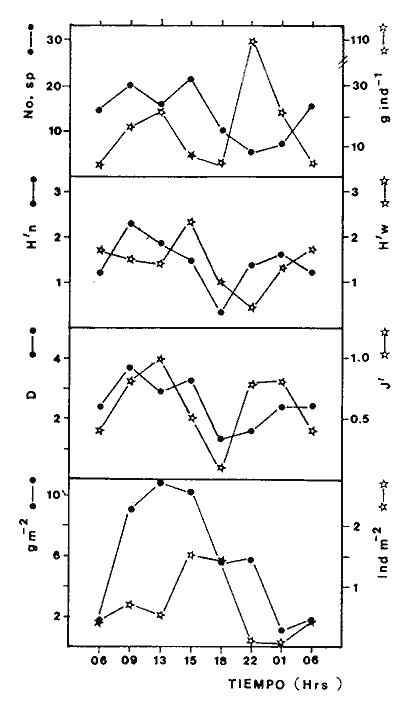 Fig. 5. Variación nictemeral de los parámetros de las comunidades de peces para el mes de agosto de 1984 en las praderas de pastos marinos en la Laguna Arrecifal, Puerto Morelos, Quintana Roo. Biomasa (g. m-²), densidad (ind. m-²), riqueza de especies (D), equitatividad (J'), diversidad numérica (H'n), diversidad (H'w), número de especies (No Spp) y talla promedio de las poblaciones(g. ind-²). Harengula humeralis. El análisis combinado de el número, frecuencia y peso para cuantificar los índices de importancia relativa (IRI), muestra que la materia orgánica, restos de crustáceos y larvas megalopas presentan los valores más elevados (Fig. 11). En relación a esta misma figura, en base al índice de importancia relativa (IIR) se puede establecer que el alimento principal es la materia orgánica, larvas megalopas y otras larvas de decápodos; el alimento secundario fueron los restos de crustáceos, anfípodos y ostracodos; y el alimento circunstancial está representado por copépodos, braquiuros, peces, peneidos y anomuros. Esta especie mostró un comportamiento alimenticio semejante al de Harengula jaguana, encontrándose a las 06:00 hrs la mayoría de los estómagos medio llenos y las fases alimenticias avanzadas (II, III y IV) aunque esto puede estar enmascarando que la especie se alimenta en las primeras horas de la mañana y que debido a los procesos digestivos tan rápidos en el trópico, se encuentran fases digestivas avanzadas en tan poco tiempo. A las 22:00 hrs la mayoría de los estómagos se encontraron llenos y en fase digestiva temprana (II) lo que estaría indicando que se alimentan en la noche. Esta especie presentó un espectro trófico amplio, observándose que se trata básicamente de una especie zooplanctófaga, filtrando en la columna de agua cerca de las hojas de los pastos marinos en donde captura alimento como anfípodos, ostrácodos y pequeños crustáceos. Observaciones simples han sido hechas por Cervigón (1966) y Randall (1967). Eucinostomus argenteus. El análisis combinado del número, frecuencia y peso (IRI) para cuantificar los índices de importancia relativa, muestra que la materia orgánica y los restos de poliquetos son los que presentaron los valores más elevados (Fig. 12). En relación a la misma figura, en base al índice de importancia relativa (IIR) se puede establecer que el alimento principal es la materia orgánica y los poliquetos; no existe alimento secundario; y el alimento circunstancial está representada por restos de poliquetos. En este caso, los restos de poliquetos no se consideran accidentales sino preferenciales ya que se trata del proceso digestivo de un poliqueto. Estos resultados coinciden con los obtenidos por Aguirre León y Yáñez-Arancibia (1986) en praderas de Thalassia testudinum en la Laguna de Términos, Campeche y con los reportados por Randall (1967). Esta especie presentó un comportamiento muy marcado en sus hábitos alimenticios con estómagos vacíos y alimentos muy digeridos en horas de la noche (22:00 hrs), esto indica que esta especie se alimenta durante el día. Haemulon aurolineatum. El análisis combinado del número, frecuencia y peso (IRI) para cuantificar los índices de importancia relativa, muestra que la materia orgánica y los anfípodos son los que presentaron los valores más altos (Fig. 13). En relación a la misma figura, en base al índice de importancia relativa (IIR), se puede establecer que el alimento principal es la materia orgánica y los anfípodos; no existe alimento secundario; y el alimento circunstancial está representado por cópepodos y larvas de crustáceos. De acuerdo a los resultados, los ejemplares de esta especie que varían de 43 a 58 mm de LT se consideran como consumidores de primer orden (zooplantófagos). 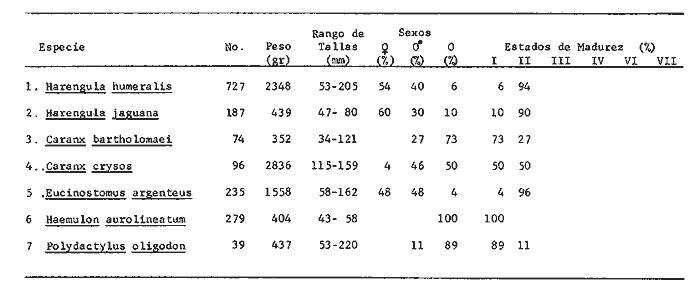 TABLA 4 PROPORCIÓN DE SEXOS, MADUREZ GONÁDICA Y SU RELACIÓN CON TALLAS DE LAS ESPECIES DOMINANTES DE PUERTO MORELOS, Q ROO. 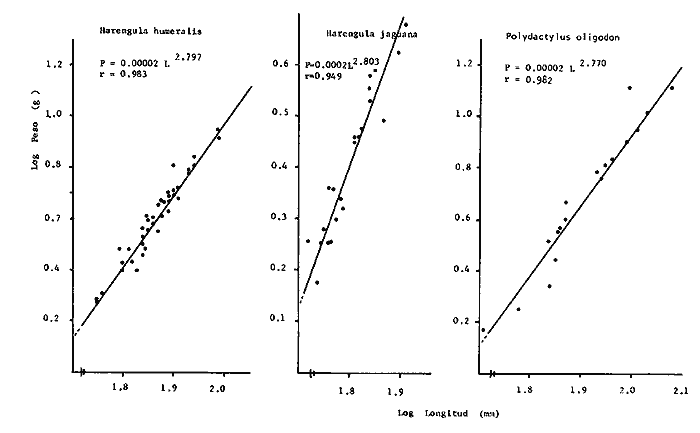 Fig. 6. Recta de regresión de la relación longitud-peso de Harengula humeralis, H. jaguana y Polydactylus oligodon en la Laguna Arrecifal de Puerto Morelos, Q. Roo durante agosto de 1984. 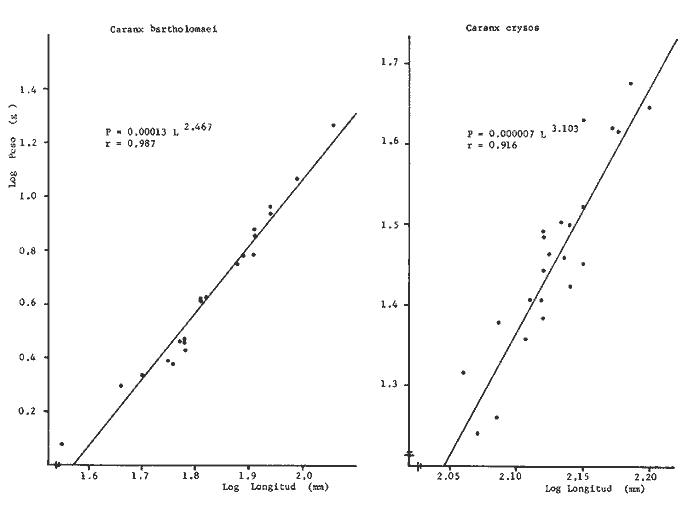 Fig. 7. Recta de regresión de la relación longitud-peso de Caranx bartholomaei y Caranx crysos en la Laguna Arrecifal de Puerto Morelos, Q. Roo durante agosto de 1984. Díaz Ruiz y Yáñez-Arancibia (1985) al referir los hábitos alimenticios de Haemolun aurolineatum indican que presentan una etapa planctófaga en individuos menores de 67 mm de longitud total durante la época de lluvias. Haemulon aurolineatumpresentó variaciones en sus hábitos alimenticios durante el día. De acuerdo al mayor número de estómagos llenos y medio llenos encontrados a las 15:00 hrs, así como a las fases tempranas de digestión, y a los estómagos vacíos en las primeras horas del día (06:00 hrs) con alimento muy digerido (IV) se detecta que es una especie de hábitos alimenticios preferencialmente diurnos. Caranx crysos. El análisis combinado del número, frecuencia y peso (IRI) para cuantificar los índices de importancia relativa, muestra que la materia orgánica y restos de pez son los que presentaron los valores más altos (Fig. 14). En relación a la misma figura, en el índice de importancia relativa (IIR) se puede establecer que el alimento principal es la materia orgánica y los restos de pez; el alimento secundario está representado por larvas de crustáceos y restos vegetales; y el alimento circunstancial lo componen camarones y restos de crustáceos. Esta especie es carnívora de tercer orden, donde los restos vegetales y plancton no forman parte de su dieta principal, que son los peces. Fischer (1978) establece que esta especie incluye en su dieta peces principalmente, así como camarones, cangrejos y otros invertebrados. Esta especie presentó una mayor actividad al mediodía, ya que en la noche no fue capturada. Se analizaron estómagos llenos y en fase III a las 13:00 hrs, en cambio a las 06:00 hrs la mayoría estaban casi vacíos, en fase III y IV. Caranx bartholomaei. El análisis combinado del número, frecuencia y peso (IRI) para cuantificar los índices de importancia relativa, mostró que los restos de crustáceos, restos de pez y la materia orgánica son los que presentaron los valores más altos (Fig. 15). En relación a esta misma figura, en base al índice de importancia relativa (IIR) en el diagrama trófico combinado se puede establecer que el alimento preferencial son restos de pez, restos de crustáceos, materia orgánica y larvas de decápodos; no se detectó alimento secundario; y el alimento circunstancial está representado por peneidos y larvas megalopas. Esta especie es carnívora, basando su dicta principalmente en peces; las tallas capturadas corresponden a juveniles por lo que se encuentran algunas larvas circunstanciales o accidentales dentro de su dieta. Fischer (1978) y Randalll (1967) hacen mención de los hábitos carnívoros de la especie, en particular observó que la especie ingiere Ocyurus chrysurus, Halichoeres maculipinna, Chaoeropsis ocellata, entre otros. 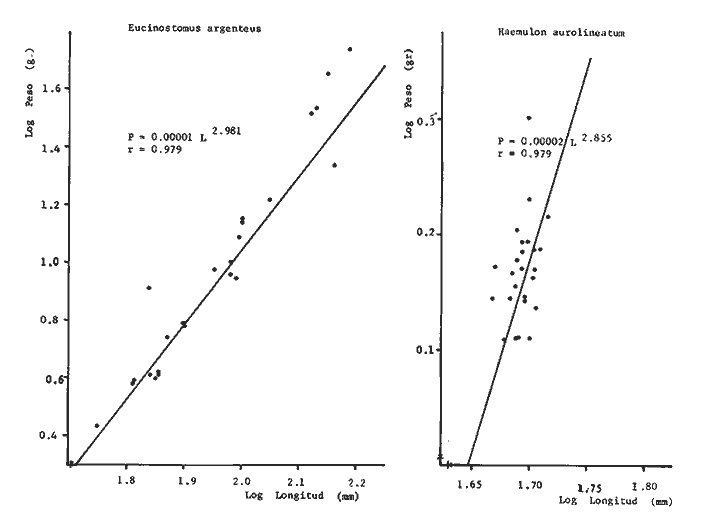 Fig. 8. Recta de regresión de la relación longitud-peso de Eucinostomus argenteus y Haemulon aurolineatum en la Laguna Arrecifal de Puerto Morelos, Q. Roo durante agosto de 1984. Esta especie presentó su mayor abundancia en horas con luz y el análisis de los estómagos reveló que en las estaciones de las 06:00 y 09:00 hrs la mayoría de estos se encontraron llenos y en fase digestiva II, esto podría ser un indicio de que se está alimentando a estas horas; en horas nocturnas fue escasamente capturado. Polydactylus oligodon. El análisis combinado del número, frecuencia y peso (IRI) para cuantificar los índices de importancia relativa, muestra que los restos de crustáceos y materia orgánica son los que presentaron los valores más altos (Fig. 16). En relación a esta misma figura, en base al índice de importancia relativa (IIR) se establece que el alimento preferencial son los restos de crustáceos, los anfipodos, la materia orgánica y las larvas de decápodos; el alimento secundario lo constituyeron las larvas megalopas, peneidos y peces; y el alimento circunstancial está representado por restos de peces, aunque puede suceder que estos restos en realidad corresponden a los peces del alimento secundario. De acuerdo a este análisis, la especie se considera consumidor primario, a las longitudes capturadas (49 - 120 mm LT). Presentó un comportamiento alimentario indistintamente en el día o en la noche. A las 22:00 hrs y a las 09:00 hrs los estómagos estuvieron llenos y en fases tempranas de digestión por lo que presenta una variación nictemeral marcada. De acuerdo al análisis estomacal se observó que en la mayoría de las especies la materia orgánica no determinada (MOND) ocupó un lugar predominante en el espectro trófico, esto podría deberse a que en la mayoría de los estómagos ya existían procesos digestivos que ocasionaron que gran parte del material alimenticio se encontrará ya digerido, debido a que en las regiones tropicales la digestión en peces es muy rápida (menos de una hora). Otra posible razón es que este detritus sea ingerido directamente de tal manera que la MOND ocupó una categoría preferencial aún cuando el alimento principal esté dado por otros grupos tróficos específicos ya que de todas las especies solo Eucinostomus argenteus es de hábitos alimenticios predominantes bentónicos, siendo las demás especies zooplantófagas y carnívoras. La conducta alimentaria de las especies mostró que los peces carnívoros (Caranx crysosy Caranx bartholomaei) se alimentan durante el día principalmente. Polydactylus oligodon se alimenta indistintamente a cualquier hora. Los filtradores (Harengula jaguana, Harengula humeralis y juveniles de Haemulon aurolineatum presentaron su mayor actividad alimenticia durante el día, al igual que la mojarra Eucinostomus argenteusque se alimenta de poliquetos. 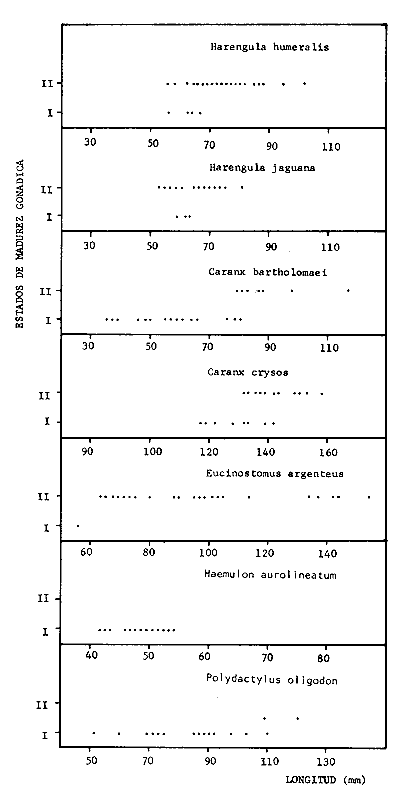 Fig. 9. Relación de la longitud total y las fases de desarrollo Harengula humeralis, Harengula jaguana, Caranx bartholomaei, Caranx crysos, Eucinostomus argenteus, Haemulon aurolineatum y Polydactylus oiigodon. Durante agosto de 1984 en la Laguna Arrecifal de Puerto Morelos, Q. Roo, para las especies gonádico. ABREVIATURAS UTILIZADAS EN LAS FIGURAS Y EL TEXTO An = Anfípodos Ar = Anomuro Bra = Braquiuro Ca = Camarón Co = Copépodo Fo = Foraminífero Ga = Gasterópodo Is = Isópodo LCr = Larvas Crustáceos LDe = Larvas Decápodos LMe = Larvas Megalopas LT = Longitud Total MOND = Materia Orgánica no Determinable Os = Ostrácodo Pel = Pelecípodo Pen = Peneido Pez = Pez POl = Poliquetos RPe = Restos de Pez RPo = Restos Poliquetos RCr = Restos de Crustáceos RVe = Restos Vegetales 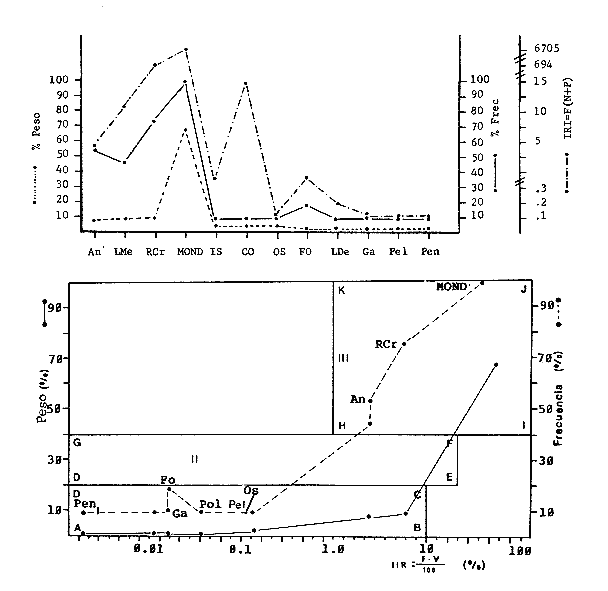 Fig. 10. Espectro trófico de la población de Harengula jaguana en praderas de pastos marinos asociados a la Laguna Arrecifal de Puerto Morelos, Q. Roo durante un muestreo de 24 hrs en agosto de 1984. Ver anexo de abreviaturas. 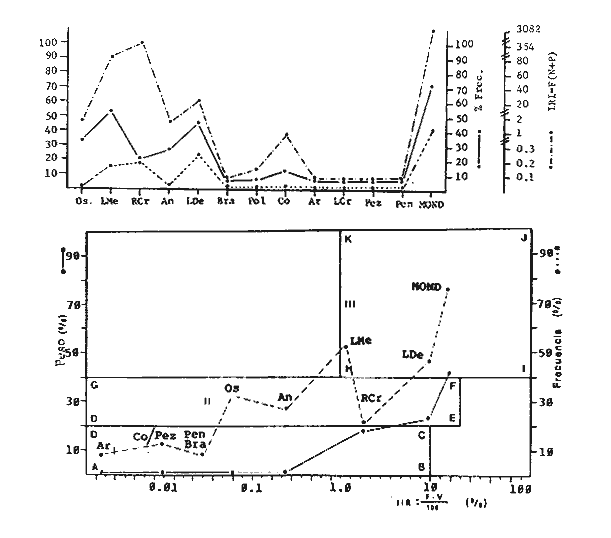 Fig. 11. Espectro trófico de la población de Harengula humeralis en praderas de pastos marinos asociados a la Laguna Arrecifal de Puerto Morelos, Q. Roo durante un muestreo de 24 hrs en agosto de 1984. Ver anexo de abreviaturas. 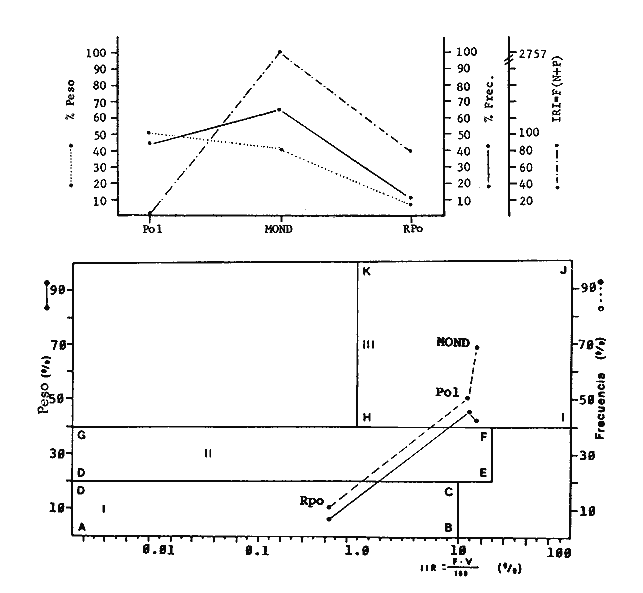 Fig. 12. Espectro trófico de la población de Eucinostomus argenteus en praderas de pastos marinos asociados a la Laguna Arrecifal de Puerto Morelos, Q. Roo durante un muestreo de 24 hrs en agosto de 1984. Ver anexo de abreviaturas. 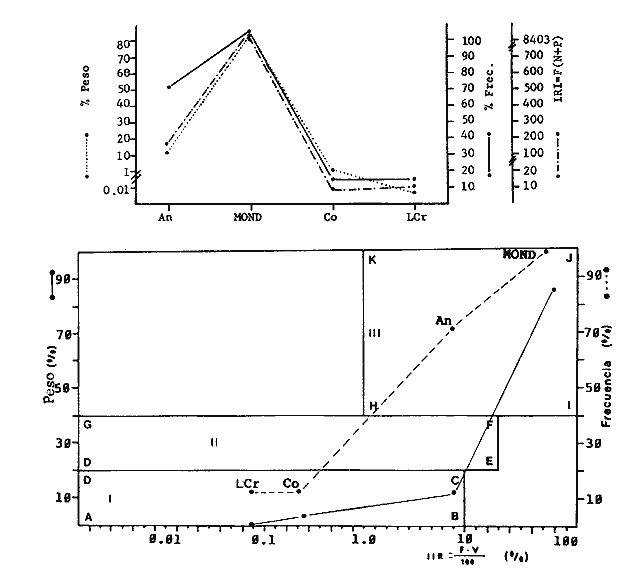 Fig. 13. Espectro trófico de la población de Haemulon aurolineatum en praderas de pastos marinos asociados a la Laguna Arrecifal de Puerto Morelos, Q. Roo durante un muestreo de 24 hrs en agosto de 1984. Ver anexo de abreviaturas. 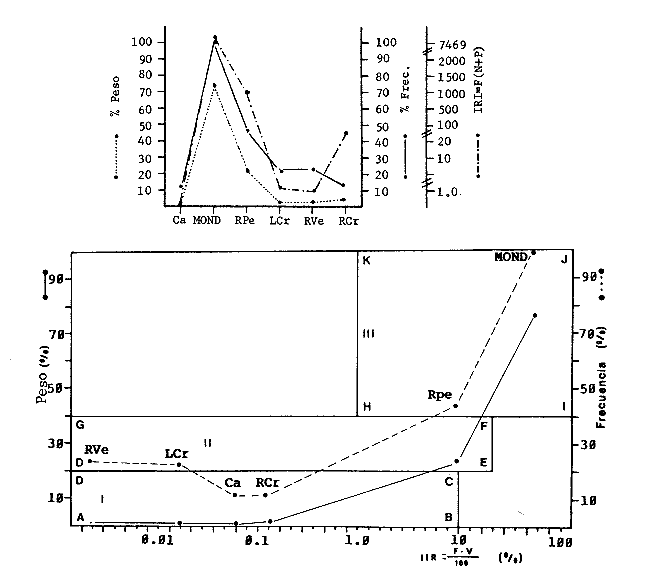 Fig 14. Espectro trófico de la población de Caranx crysos en praderas de pastos marinos asociados a la Laguna Arrecifal de Puerto Morelos, Q. Roo durante un muestreo de 24 hrs en agosto de 1984. Ver anexo de abreviaturas. 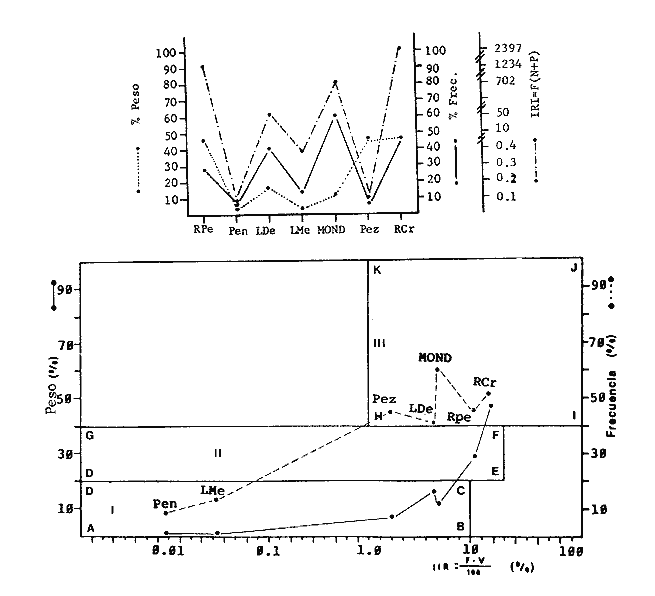 Fig. 15. Espectro trófico de la población de Caranx bartholomaei en praderas de pastos marinos asociados a la Laguna Arrecifal de Puerto Morelos, Q. Roo durante un muestreo de 24 hrs en agosto de 1984. Ver anexo de abreviaturas. 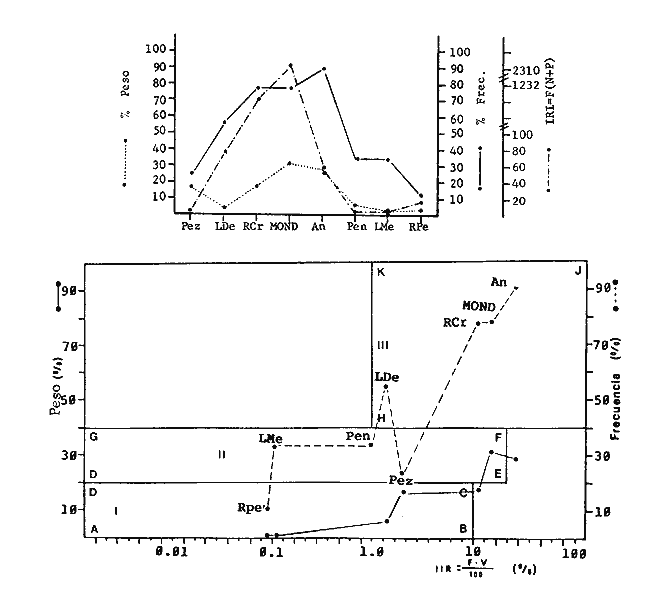 Fig. 16. Espectro trófico de la población de Polydactylus oligodon en praderas de pastos marinos asociados a la Laguna Arrecifal de Puerto Morelos, Q. Roo durante un muestreo de 24 hrs en agosto de 1984. Ver anexo de abreviaturas. LITERATURAADAMS, S.M., The ecology of eelgrass (Zostera marina) fish communities. I. Structural analysis. J. Exp. Mar. Biol. Ecol., 1976a.269-292. 22: ADAMS, S.M., The ecology of ee1grass (Zostera marina) fish communities. II. Structural analysis. J. Exp. Mar. Biol. Ecol.,1976b.293-312. 22: ADAMS, S.M., Feeding ecology of seagrass fish communities. Trans. Amer. Fish. Soc., 1977.514-520. 105: AGUIRRE-LEÓN, A. y A. YÁÑEZ-ARANCIBIA, An. Inst. Cienc. del Mar y Limnol. Univ. Nal. Autón. México, Las mojarras de la Laguna de Términos, Campeche: Taxonomía, biología, ecología y dinámica trófica (Pisces: Gerreidae). 1986. 369-444. 13 (1): ALVAREZ-GUILLÉN, H., A. YÁÑEZ-ARANCIBIA y A. L. LARA-DOMÍNGUEZ, An. Inst. Cienc. del Mar y Limnol. Univ. Nal. Autón. México, Ecología de la Boca del Carmen, Laguna de Términos. El hábitat y estructura de las comunidades de peses (sur del Golfo de México).1985.107-144.12 (1): BEEBE, W. y J. TEE-VAN Field Book of the Shore Fishes of Bermuda and the West Indias. ,Dover Publs. Inc. New York, 1933.337 p. BOHLKE, J. F. y C. B. CHAPLIN, Fishes of the Bahamas and Adjacent Tropical Waters. Acad. Nat. Sci. Philad.,1968. 771 p. 223 figs. CARR, W.E. y C.A. ADAMS, Food habits of juveniles marine fishes occupying seagrass beds in the estuarine zone near Crystal River, Florida.Trans. Amer. Fish. Soc., 1973:511-540. 102: CERVIGÓN, F., Los Peces Marinos de Venezuela. Monogr., Estación de Investigaciones Marinas de Margarita. Fundación La Salle de Ciencias Naturales, Caracas,1966. 1-951, 385 figs. 11 y 12: CERVIGÓN, F., Ecología Marina, Los Peces, Cap. 10: In: Margalef, R. (Ed.) Fundación La Salle de Ciencias Naturales, Caracas. 1967. 308-355. COLLETE, B.B., A reviewof coral toacifishes of the genus Sanopus with discription of two new species from Cozumel Island. México. Proc. Biol. Soc. Wash., 1974.185-204, 1 lam. 7 figs. 87 (18): CHÁVEZ, H., Acta Zool. Mex. Publ. Mus. Hist. Nal. México, Peces colectados en el arrecife Triángulo Oeste y en Cayo Arcas, Sonda de Campeche, México. 1966.1-11. 7 (1): DAHL, G., Los Peces del Norte de Colombia.Instituto de Desarrollo de los Recursos Naturales Renovables. (IDERENA), Ministerios de Agricultura.Bogotá, 1971. 391 p. DARNELL, R.M. y R.R. MEIEROTTO, Determination of feeding chronology in fishes.Trans. Amer. Fish. Soc., 1982.313-320.91 (3): DÍAZ RUIZ, S. y A. YÁÑEZ-ARANCIBIA, Los pomadásidos de la Laguna de Términos, Campeche: Taxonomía, biología, ecología y dinámica trófica, (Pisces: Pomadasyidae = Haemulidae) (Manuscrito inédito). 1985. EXDALE, A.A., Ms. S. Thesis. Ecology and paleoecology of marine invertebrate communities in calcareus substrates, northeast Quintana Roo, México. Rice University. 1972. 159 p. ESPINOZA, L., J. RIVERA, L. OTERO y M. MERINO, Informe Técnico Estudio preliminar de las diferentes variaciones medioambientales durante 50 horas en la época de verano en la zona de playa de Puerto Morelos, Quintana Roo; México:Inst. Cienc. del Mar y Limnol. Univ. Nal. Autón. México. 1983. FISCHER, E. FAO Species Identification Sheets for Fishery Purposes. FISCHER, E. (Ed.), Western Central Atlantic (Fishihg area 31). FAO, Roma, 1978. Vols. 1-7. FOLK, R. L., Ann. Mtg., New Orleans Geol. Soc.:Carbonate sediments of Isla Mujeres.Gdbk. Field Trip. No. 7. 1967.100-123. GALLAWAY, B.J., J.C. PARKER y D. MOORE, Key to the Estuarine and Marine Fishes of Texas. Texas A and M University Press, 1972.177p. GREENWOOD, P.H., D.E. ROSEN, S.H. WEITZMANN y G.S. MYERS, Bull. Ann. Mus. Nal. Hist.,Phyletic studies of teleostean fishes, with a provisional classification of living forms.1966.339-456. 131 (4): GREENWOOD, P.H., D.E. ROSEN, S.H. WEITZMANN y G.S. MYERS, Named main division of teleostean fishes. Proc. Biol. Soc. Wash.,1967.227-228. 80: GUITART, D. J., Sinopsis de los Peces Marinos de Cuba. Tomos I-V.Instituto de Oceanología. Academia de Ciencias de Cuba, La Habana,Cuba.1977. HECK, Jr. K.L. y R.J. ORTH, Estuarine Perspectives.Seagrasa habitat: the roles of habitat complexity, competition and predation in structoring asociated fish and motile macroinvertebrate assemblages. In: Kennedy, V. (Ed.) Academie Press, Inc., New York: 1980.449-464. HILDEBRAND, H. H., H. CHÁVEZ y H. COMPTON, Ciencia, Aporte al conocimiento de los peces del Arrecife Alacranes, Yucatán (México).1964. 107-134.23 (3): HOBSON E.S., Feeding patterns among tropical reef fishes. Amer. Scient.,1974.389-392. 63: HOESE, H.D. y R.S. JONES, Publ. Inst. Mar. Sci.Seasonality on large animales in a Texas turtle grass community. Univ. Texas,1963.37-48. 9: HUERTA, L. , An. Esc. Nal. Cienc. Biol., México,Contribución al conocimiento de las algas de los bajos de la Sonda de Campeche, Cozumel e Isla Mujeres.1958.115-123.9 (14): JORDAN, E., An. Centro Cienc. del Mar y Limnol. Unív. Nal. Autón. México, Estructura y composición de arrecifes coralinos en la región noreste de la Península de Yucatán, México. 1979.69-86.6 (1): JORDAN, E., M. ANGOT y R. DE LA TORRE, An. Centro Cienc. del Mar y Limnol. Univ. Nal. Autén. México,Prospección biológica de la Laguna Nichupté (Cancún), Q. Roo. México. Nota Científica. 1978.179-188. 5 (1): JORDAN, D.F. y B. W. EVERMANN, Bull. US. Nat. Mus., The fishes of north and midle America. 1896-1900. 1-3313, 398 lams., 958 figs.1-4 (47): KIKUCHI, T. y J.M. PERÈS, In: Mc Roy, C. y C. HeIfferich (Eds.) Consumer ecology of seagrass beds. Seagrass Ecosystems. MarceL Dekker, Inc., N.Y.: 1977.147-193. LARA-DOMÍNGUEZ, A.L., A. YÁÑEZ-ARANCIBIA, y F. AMEZCUA LINARES, An. Inst. Cienc. del Mar y Limnol. Univ. Nal. Autón. México, Biología y ecología del bagre Arius melanopus Günther en la Laguna de Términos, Sur del Golfo de México. (Pisces: Ariidae):1981.267-304.8 (1): McRoy, C.P. y D. HELFFERICH Seagras Ecosystems: A Scientific Perspectiva McRoy, C.P. y D. HELFFERICH (Eds.). UNESCO/UNDP- Marcel Dekker Inc. New York, 1977. 313 p. MEEK, E. S. y S. F. HILDEBRAND, The marine fishes of Panama. Field. Mus. Nat. Hist. Publ. Zool. Ser., 1923-1928. 1-1045, 118 láms.15 (215, 226 y 249): MERINO, M. y L. OTFRO., Inst. Cienc. del Mar y Limnol. Univ. Nal. Autón. México . Marco ambiental base para Puerto Morelos, Q. Roo. (Informe Técnico en elaboración). 1984. MUNRO, J.L. ICLARM Studies and Review 7,Caribbean Coral Reef Fishery Resarces. MUNRO, J.L. (Ed.), Manila Philippines. 1983. 276 p. NIKOLSKY, G.V., The Ecology of Fishes. Academic Press Inc. New York, 1963. 352 p. NORMAN, J.R., A Systematic monography of the Flatfishes (Heterosomaga). Psettodidae, Bothidae, Pleuronectidae. The trustees of the British Museum (Natural History), Londres, 1934. 1-459, 317 figs. 1: OGDEN, J.C. y E.H. GLADFELTER, UNESCO reports in Marine Science Coral reefs, seagrass beds and mangroves: Their interaction in the coastal zones of the Caribbean, Report of a Workshop. Heald al West Indies Laboratory St. Croix, U.S. Virgin. Islands 1983. 1-133. (23): May. 1982. PERRY II, J.A. y S.D. PERRY, Los Peces Comunes de la Costa Atlántica de Costa Rica. Serie Ciencias NaturalesUniversidad de Costa Rica, Fac. de Cienc. y Letras, Depto. de Biología.1974.225p. 7: PINKAS, L. M.S. OLIPHANT C I. L.K. IVERSON, .Dept. Fish. and Game Cal. Fish. Bull., Food habits of albacore, blue fin tuna and bonito in California waters1971.1-105. 152: RANDALL, J.E.,. Stud. Trop. Oceanogr. Miami, Food habits of reef fishes of the West Indies.1967.1-847. 5: RANDALL, J.E., Caribbean Reef Fishes. T.F.H. Publications Inc. New Yersey, 1968. 318 p., 324 figs. RICKER, W.E., Bull. Fish. Res. Bd. Can., Computation and interpretation of biological statistics of fish population.1975. 1-382. 191: RODRIGUEZ-CAPETILLO, R. A. YAÑEZ-ARANCIBIA y P. SANCHEZ-GIL, Biótica Diversidad, distribución y abundancia de los peses demersales en la plataforma continental de Yucatán (época de secas, 1983), Sur del Golfo de México. 1987.87-120.12 (2): SHERIDAN, P. F. y R.J. LIVINGSTON, Ecological Processes in Coastal and Marine Sci. Cyclic thropic relationship of fishes in an unpolled, river-dominated estuary in north Florida. In: Livingston, R.J. (Ed.) Plenum Press, N.Y.1979.143-161. 10: STODDART, D.R., Atoll. Res. Bull.,Three caribbean atolls.1962.1-137. 87: THAYER, G.W., D.A. WOLFE y R.B. WILLIAMS, Am . Sctentist., The impact of man on seagrass system. 1975. 228-296. 63: THORHAUG, A. y M. ROESSLER, Aquaculture, Seagrass community dynamics in a subtropical estuarine lagoon. 1977.253-278. 12: UYENO, T., K. MATSSURA y E. FUJII Fishes Trawled off Suriname and French Guiana. UYENO, T., K. MATSSURA y E. FUJII (Eds.), Japan Marine Fishery Resoursces Center. Tokyo, 1983. 519 p. VARGAS MALDONADO, L, A. YÁÑEZ-ARANCIBIA y F. AMEZCUA LINARES, An. Inst. Cienc. dei Mar y Limnol. Univ. Nal. Autón. México, Ecología y estructura de las comunidades de peces en las áreas de Rizophora mangle y Thalassia testudinum de la Isla del Carmen, Laguna de Términos, Sur del Golfo de México. 1981.241-266.8 (1): WARD, W.C., Shelf Island of Northeast Quintana Roo, México, Gdbk, Field Trip. No. 7.Ann. Mtg. New Orleans. Soc.;1967.124-136. WEINSTEIN, M.P. y K.L. HECK, Jr., Mar Biol., Ichthyofauna of seagrass meadow along the Caribbean coast of Panama and in the Gulf of México: Composition structure and community ecology. 1979.97-108. 50: WOOD, F.E.J.. W.E. ODUM Y J.C. ZIEMAN, Lagunas Costeras, un Simposio Influence of sea grasses in the productivity of coastal lagoons. In: Ayala Castañares, A. y F.B. Phleger (Eds.). Mem. Simp. Intern. Lagunas Costeras. UNAM-UNESCO.México,1969.495-502. Nov. 28-30, 1967: YÁÑEZ-ARANCIBIA, A., In: Informe Final de 2da. Etapa del Programa de Uso de la Zona Costera de Michoacán y Guerrero. Relaciones tróficas de la fauna ictiológica dei sistema lagunar costero de Guerrero y aspectos parciales de dinámica de poblaciones de los peces de importancia comercial. 230 p., Convenio Comisión del Río Balsas. SRH y Centro de Ciencias del Mar y Limnología, UNAM. México, Contrato No. OCE-03-74.1975. 750 p. 104 tablas, 71 figs. YÁÑEZ-ARANCIBIA, A., Ecological studies in Puerto Real Inlet, Laguna de Términos, México Discussion on the Trophic structur e of fish communities on Thalassia testudinum banks. Proc. Sem. Duke Univ. Mar. Lab. Beaufort N.C. USA, (UNESCO-JABO). UNESCO Tech. Pap. Mar. Sci.,1981.191-232. 33:Aug. 1978 YÁÑEZ-ARANCIBIA, A. y A.L. LARA-DOMINGUEZ, An. Inst. Cienc. del Mar y Limnol. México, Dinárnica ambiental de la Boca de Estero Pargo y estructura de sus comunidades de peces en cambios estacionales y ciclos de 24 horas (Laguna de Términos, Sur del Golfo de México.) 1983.85-116.10 (1): YÁÑEZ-ARANCIBIA, A. J. CURIEL-GÓMEZ, y V. LEYTON, An. Centro Cienc. del Mar y Limnol. Univ. Nal. Autón. México, Prospección biológica y ecológica del magre marino Galeichthys caerulences (Günther) en el sistema lagunar costero de Guerrero, México. (Pisces: Ariidae). 1976.125-180. 3 (1): YÁÑEZ-ARANCIBIA, A., F. AMEZCUA LINARES y J.W. DAY, Estuarine Perspectives. Fish community structure and function in Terminos Lagoon, a tropical estuary in the Southern Gulf of México. In: Kennedy, V. (Ed.) Academie Press Inc. New York: 1980.465-482. YÁÑEZ-ARANCIBIA, A. F. AMEZCUA LINARES y M. TAPIA GARCÍA, An. Inst. Cienc. del Mar y Limnol. Univ. Autón. Nal. México, Prospección ictioecológica del estuario del Río Champotón, Campeche, verano 1979. Nota Científica. 1982c. 395-398.9 (1): YÁÑEZ-ARANCIBIA, A. A.L. LARA-DOMÍNGUEZ y H. ALVAREZ-GUILLEN, Fish Community Ecology in Estuaries and Coastal Lagoons: Towards an Ecosystem Integration. Fish community ecology and dynarnic in est uarine inlets. Chap. 7. In: Yañez-Arancibia, A. (Ed.) Editorial Universitaria, UNAM-PUAL-ICNIL, México,1985. 754 p. YÁÑEZ-ARANCIBIA, A., A.L. LARA-DOMINGUEZ, A. AGUIRRE-LEÓN y S. DÍAZ RUIZ, In: Fourth Workshop on Fish Food Habit.(Abstract).Trophodynamic ecology of tropical estuarine fishes: Methodology and trophic levels analysis. GUTSHOP '84. California, EUA, 1984. Dic. 2-6, 1984. YÁÑEZ-ARANCIBIA, A., A.L. LARA-DNGUEZ, P. SÁNCHEZ-GIL, 1. VARGAS MALDONADO P. CHAVANCE. F. AMEZCUA LLINARES, A. AGUIRRE-LEÓN y S. DÍAZ-RUIZ, Vol. Spec., Coastal Lagoons. Oceanológica Acta. Ecosystem dinamics and nichthemeral and seasonal programming of fish community structure in a tropical estuarine inlet, México. In:Lasserre, P. and H. Postma (Eds.) 1982a. 431-440. 5(4): YÁÑEZ-ARANCIBIA, A., A.L. LARA-DOMINGIJEZ, P. SÁNCHEZ-GIL, I. VARGAS MALDONADO MA. DE LA C. GARCÍA-ABAD H. ÁLVAREZ GUI LLEN, M. TAPIA GARCÍA, D. FLORES HERNÁNDEZ y F. AMEZCUA LINARES, In: International Symposium on Utilization of Coastal Ecosystem: Plannig Pollution and Productivity. Ecology and evaluation of fish community in the Campeche Sound and Terminos Lagoon: Estuary shelf interactions in the Southern Gulf of México. Duke Univ. Mar Lab. USA and Univ. Rio Grande R.S. Brasil No. 22-27, 1982 Atlantica Río Grande,1982b. 130. 5(2):
|

