|
NUEVOS REGISTROS DE PORIFERA DEL ARRECIFE LA BLANQUILLA, VERACRUZ,
MÉXICO
Trabajo recibido el 21 de abril de 1985 y aceptado para su
publicación el 27 de agosto de 1985.
GERARDO GREEN, LAURA E. FUENTES VELÁZQUEZ y PATRICIA GÓMEZ LÓPEZ
Universidad Nacional
Autónoma de México, Instituto de Ciencias del Mar y
Limnología. Contribución 462 del Instituto de Ciencias del Mar y
Limnología, UNAM.
Se presenta un estudio
taxonómico de veinte especies de Porifera, colectadas en el Arrecife La
Blanquilla, Veracruz, en mayo de 1979, entre los 2 y los 15 m de profundidad.
Las especies estudiadas son: Epipolasis lithophaga, Tethya actinia,
Agelas dispar, Mycale laevis, Iotrochota birotulata, Desmapsamma anchorata,
Lissodendoryx isodictyalis, Holopsamma helwigi, Amphimedon compressa,
Amphimedon viridis, Niphates erecta, Callyspongia armigera, Xestospongia
subtriangularis, Ircinia felix, Ircinia strobilina, Dysidea fragilis, Halisarca
purpura, Aplysina fistularis insularis, Verongula rigida
yPseudoceratina crassa. Trece de estas especies son nuevos
reportes para el área, las siete restantes estudiadas por Green (1977),
se actualizan en su sinonimía y taxonomía.
A
taxonomic study of twenty species of Porifera collected at La Blanquilla cay,
Veracruz, during may 1979, between 2 to 15 m of depth, is presented. The
studied species are: Epipolasis lithophaga, Tethya actinia, Agelas
dispar, Mycale laevis, Iotrochota birotulata, Desmapsamma anchorata,
Lissodendoryx isodictyalis, Holopsamma helwigi, Amphimedon compressa,
Amphimedon viridis, Niphates erecta, Callyspongia armigera, Xestospongia
subtriangularis, Incinia felix, Ircinia strobilina, Dysidea fragilis, Halisarca
purpura, Aplysina fistularis insularis, Verongula rigida and
Pseudoceratina crassa. Thirteen of these species are new
records for the area, the remaining seven already studied by Green (1977), are
updated in their synonymy and taxonomy.
El presente trabajo es el resultado del estudio de una colección de esponjas que se obtuvo durante el mes de mayo de 1979, en la parte occidental del Arrecife La Blanquilla, Veracruz, a profundidades entre los 2 y los 15 m (Fig. 1). La colecta se llevó a cabo con un doble propósito, el primero para aportar más información sobre las especies de Porifera que se encuentran en el mencionado arrecife y que pueden considerarse representativas del área arrecifal del Puerto de Veracruz y el segundo para conducir con esas especies estudios para determinar la presencia de metabolitos bioactivos, en particular antimicrobianos y tóxicos. De las 20 especies de esponjas reportadas en el presente trabajo, trece se registran por primera vez en el área y las siete restantes ya estudiadas por Green (1977) durante los años de 1965 a 1968, se actualizan en su sinonimia y su taxonomía. Todas ellas forman parte de la colección de invertebrados del laboratorio de Farmacología Marina del Instituto de Ciencias del Mar y Limnología, UNAM. Sobre los estudios taxonómicos de esponjas en el Golfo de México, en el Mar Caribe y áreas adyacentes, no ha habido un incremento en el número pero si en la calidad, ya que por parte de Wiedenmayer (1977) y Van Soest (1978, 1980 y 1984), se han llevado a cabo esfuerzos importantes para organizar y unificar criterios en la sistemática del phylum Porifera en general. 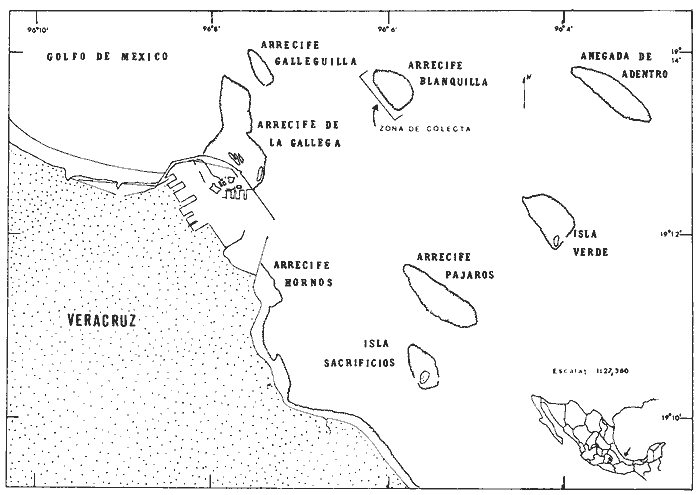 Fig. 1. Área de estudio. Arrecife La Blanquilla, Veracruz. En relación al área de estudio y la metodología del presente trabajo, se sugiere consultar a Green (1977) y Gómez y Green (1984). RESULTADOS
SISTEMÁTICAClase Demospongiae Subclase Tetractinomorpha Orden Epipolasida Familia Epipolasidae Epipolasis lithophaga Orden Hadromerida Familia Tethyidae Tethya actinia Orden Axinellida Familia Agelasidae Agelas dispar Subclase Ceractinomorpha Orden Poecilosclerida Familia Mycalidae Mycale laevis Familia Esperiopsidae Iotrochota birotulata Desmapsamma anchorata Familia Myxillidae Lyssodendoryx isodictyalis Familia Psammascidae Holopsamma helwigi Orden Haplosclerida Familia Niphatidae Amphimedon compressa Amphimedon viridis Niphates erecta Familia Callyspongiidae Callyspongia armigera Familia Petrosiidae Xestospongia subtriangularis Orden Dictyoceratida Familia Thorectidae Ircinia felix Ircinia strobilina Familia Dysideidae Dysidea fragilis Orden Dendroceratida Familia Halisarcidae Halisarca purpura Orden Verongida Familia Aplysinidae, Aplysina fistularis insularis Verongula rigida Familia Aplysinellidae Pseudoceratina crassa Epipolasis lithophaga Wiedenmayer, 1977Epipolasis lithophagaWiedenmayer, 1977: 175. Epipolasis angulospiculata (Carter) sensu de Laubenfels, 1936a: 162; 1950b: 168; Storr, 1964: 42. (No) Suberites angulo spiculatus Carter, 1879: 346. Esponja incrustante de 1.5 cm de grosor., cubriendo una área de 10 cm². Su color en vivo en el exterior es morado oscuro, en el interior y en su base, amarillo pardo. Congelada el exterior se torna castaño y el color amarillo del interior se conserva. Su consistencia es poco compresible y firme. Presenta superficie lisa ligeramente híspida debido a la proyección de sus espículas de 30 a 50 µm fuera de la superficie. Sus ósculos poco numerosos distribuidos irregularmente miden de 2 a 8 mm de diámetro. No presenta una especialización dérmica. El ectosoma abarca un grosor de 400 µm aproximadamente y se diferencía del endosoma por su mayor pigmentación. El endosoma presenta un arreglo radial en su parte periférica e indefinido en su parte interna, la cual contiene partículas foráneas. Sus espículas son óxeas fusiformes de 1.15 - 213 µm por 4.5 - 7.5 - 10.5 µm y estrongilóxeas de 210 - 800 - 1600 µm por 10 - 20 - 35 µm (Fig. 2). Tethya actinia de Laubenfels, 1950Tethya actinia de Laubenfels, 1950a: 116; 1954a: 234 (?); Hechtel, 1965: 66. Tethya diploderma de Laubenfels, 1953a: 545. Esponja semiesférica de 2 a 5 cm de diámetro. Su color en vivo en el exterior es amarillo con tonos verdosos, el interior anaranjado. Congelada su coloración palidece. Su consistencia es compresible y firme. Presenta en toda su superficie tubérculos de 1 a 2 mm de diámetro. El ectosoma es una corteza de 2 mm de grosor, fácilmente desprendible, que contiene tilásteres principalmente. Los tubérculos están sostenidos por haces de estrongilóxeas de 270 µm de diámetro promedio por 7 a 10 mm de longitud. Estos haces se encuentran rodeados por grupos de esferásteres. El endosoma presenta una organización radial. Los haces de estrongilóxeas parten del centro de la esponja al exterior. Presenta espículas estrongilóxeas 390 – 600 – 1200 µm por 6 - 9 - 12 µm, óxeas de 102 – 163 – 232 µm por 3.7 - 7.5 - 10.5 µm, esferásteres con diámetro total de 45 - 66 - 93 µm y tilásteres con diámetro total de 6 - 13 - 16.5 µm (Figs. 3 y 4). Angelas dispar Duchassaing y Michelotti, 1864Agelas dispar Duchassaing y Michelotti, 1864: 76; Burton y Rao, 1932: 356; Topsent, 1932: 104; Wiedenmayer, 1977: 128; Van Soest, 1981: 10. Ectyon sparsus Gray, 1867: 515; Carter, 1871: 269, 270, 272; 1883: 311-314. (No) Ectyon sparsus Gray sensu Carter, 1882: 281. Ectyon sparsus (Gray) de Laubenfels, 1936a: 73; 1949a: 15; Green, 1977: 92. Esponja semiesférica de 6 a 10 cm de diámetro. Su color en vivo así como congelada es anaranjado intenso en el exterior y amarillo en el interior. Su consistencia es compresible y elástica. Presenta una superficie acanalada con numerosos ósculos ovalados o circulares de 2 a 10 mm de diámetro, cubiertos por una formación dérmica. La dermis tiene un grosor de 500 µm y se diferencia del endosoma por su color anaranjado. El endosoma es cavernoso, distinguible desde el exterior por su sistema de canales integrado por canales primarios de 2 a 8 mm de diámetro y canales secundarios de 300 a 600 µm de diámetro. Presenta una reticulación de mallas poligonales formadas por tractos ascendentes de 60 µm de diámetro y tractos conectivos de 12 µm, ambos equinados por espículas acantoestiles. Presenta únicamente acantoestiles de 90 - 148 – 185 µm de largo por 6 - 12 - 16.5 µm de diámetro máximo, caracterizadas por un promedio de 6 espinas en la cabeza y de 4 a 5 hileras de éstas a lo largo de la espícula (Figs. 5 y 6). Mycale laevis (Carter, 1882)Esperia laevis Carter, 1882: 291. Mycale laevis (Carter) de Laubenfels, 1936a: 116; Hechtel, 1965: 46; Van Soest, 1984: 14. Esponja amorfa a lobulada, los lóbulos son de 3 a 4 cm de diámetro. Su color en vivo es naranja brillante en el exterior y amarillo pardo en el interior, congelada se torna castaño claro. Su consistencia es compresible y suave al tacto. Su superficie en general es rugosa con algunas partes, lisas, los ósculos son conspicuos con una membrana alrededor de ellos, tienen un diámetro de 0. 5 a 1 cm y se distribuyen regularmente, en su interior se pueden apreciar las divisiones de los canales exhalantes. Presenta una dermis fácilmente desprendible, sostenida por una reticulación sin arreglo definido con tractos de 3 a 15 estiles de diámetro y rosetas de 12 a 15 anisoquelas. El endosoma también tiene una reticulación sin un arreglo definido, los tractos que la forman, contienen a las espículas robustas, las finas se encuentran dispersas y las anisoquelas en rosetas como en el endosoma. La espiculación consiste de: estiles y subtiloestiles rectos o ligeramente curvos de 433 - 470 - 507 µm por 6 - 15 - 18.5 µm; sigmas de 14 - 33 - 45 µm por 3 µm y anisoquelas de 50 – 72 - 90 µm de longitud. En menor número presenta ráfides de 30 - 55 - 80 µm de longitud (Fig. 7). Iotrochota birotulata (Higgin, 1877)Halichondria birotulata Higgin, 1877: 296. Hyrtios musciformis Duchassaing y Michelotti, 1864: 75. Phorbas amaranthusDuchassaing y Michelotti sensu Carter, 1882: 287, (?). Hircinia atra Whitfield, 1901: 49. (No) Halichondria birotulata Carter, 1886: 52; 1887: 72. Iotrochota birotulata (Higgin) Ridley, 1884: 433; de Laubenfels, 1932a; 37; 1936a: 49; 1953a: 522; Hechtel, 1965: 24; Bergquist, 1965: 163; Wiedenmayer, 1977: 138; Van Soest, 1984: 38; Gómez y Green, 1984: 79.  Fig. 2. Estrongilóxeas y óxeas de Epipolasis lithophaga, 100X. Fig. 3. Oxiáster y tilásteres de Tethya actinia 200X. Fig. 4- Esferáster y tilásteres de Tactinia, 1100X. Fig. 5. Detalle del acantoesti le de Agelas dispar, 2200X. Fig. 6. Acantoestile de A. dispar, 600X. 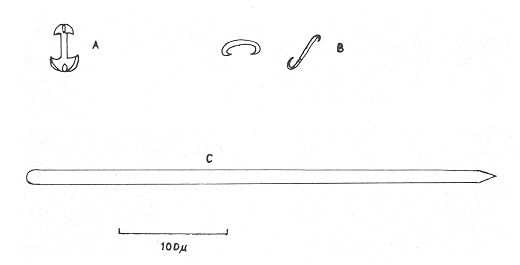 Fig. 7. A) anisoquela, B) sigmas y C) estile de Mycale laevis Esponja ramosa cuyas ramas tienen un diámetro de 1 a 2 cm y longitud de 2 a 15 cm. En vivo su color puede variar de verde oscuro a morado oscuro tendiendo a negro, congelada es completamente de color negro. Su consistencia es poco compresible, casi dura. Su superficie es rugosa, ya que presenta cónulos dendríticos de 2 a 4 mm de altura, las formaciones dendríticas miden 1 mm. Los ósculos no son numerosos y se encuentran dispersos en la superficie. Presenta una dermis de 400 a 800 µm de grosor, atravesada por numerosos ostios de 60 a 90 µm de diámetro y numerosas microscleras del tipo birótulo típica de esta especie. El endosoma no presenta una reticulación definida, los tractos que la forman tienen un diámetro de 90 a 185 µm, presentan en su interior gran cantidad de estrongiles. Las espículas son estrongiles de 162 - 189 - 237 µm por 3 – 7 - 9 µm y birótulos de 15 - 16 - 16.5 µm de longitud (Figs. 8 y 9). Desmapsamma anchorata (Carter, 1882)
Fibularia anchoratacarter, 1882: 283. Desmapsamma anchorata Burton, 1934: 547; 1956: 131; 1959a: 239; Lévi, 1959: 135; Hechtel, 1965: 21; Hartman, 1967: 20; Van Soest, 1984: 35. Desmacidon reptans Ridley y Dendy, 1886: 345; 1887: 105; Lindgren, 1897: 482; 1898: 303. Desmacidon carterianum Arndt, 1927: 147. Esponja ramosa con una base lobulada, las ramas miden de 0.8 a 1.5 cm de diámetro con algunas partes de 2.5 cm, de largo miden de 5 a 15 cm. Su color en vivo es rosa pálido en el exterior y anaranjado brillante en el interior. Congelada su coloración se torna castaño en el exterior y anaranjado pálido en el interior. La superficie es lisa con pliegues dispersos sobre la misma. Los ósculos son poco numerosos y se distribuyen irregularmente, están bordeados por una membrana y su diámetro es de 0.5 a 1 mm. Presenta una dermis bien definida, fácilmente desprendible, tiene un grosor de 300 a 500 µm y contiene gran cantidad de partículas foráneas sobre ella. Está adherida al ectosoma por medio de tractos plumosos que emergen de éste. La reticulación que se forma en el ectosoma es renieroide modificado, los tractos ascendentes miden de 15 a 60 µm de diámetro y los transversales de 9 a 40µm, con 5 a 6 espículas en el interior de los primeros y 3 a 4 en el interior de los segundos. El endosoma sigue la constitución renieroide con tractos ascendentes de 6 a 7 espículas en su interior y de 3 a 4 en los transversales. En algunas zonas la reticulación se hace isodictial. presenta espículas óxeas de 135 - 157 - 181 µm por 3 - 6 - 10.5 µm, sigmas de 15 - 27 - 37 µm por 1 - 1.5 - 3 µm e isoquelas de 9 - 12.5 - 18 µm de longitud (Figs. 10 y 11).
Lissodendoryx isodictyalis (Carter, 1882)
Halichondria isodictyalis Carter, 1882: 285; 1886: 52. Myxilla isodictyalis Dendy, 1896: 30; Row, 1911: 343. Lissodendoryx isodictyalis(Carter) Topsent, 1897: 456; 1925a: 701; 1936: 18; Burton, 1948: 755; de Laubenfels, 1936a: 93; 1947: 35; 1950a: 73; 1956: 2, 3; Dickinson, 1945:20; Lévi, 1952: 48; Hopkins, 1956: 24; Hartman, 1948: 41; Wells et al. , 1960: 212; Storr, 1964: 42; Sará y Siribelli, 1960: 53; Little 1963: 48; Hechtel, 1965: 38; Simpson, 1968: 81; Wiedenmayer, 1977: 135; Van Soest, 1984: 54. (?) Lissodendoryx isodictyalis paucispinosa Tópsent, 1928: 240. Tedania leptoderma Topsent, 1889: 49. Lissodendoryx leptoderma Topsent, 1894: 35. Lissodendoryx similis Thiele, 1899: 18; Burton y Rao, 1932: 331. Lissodendoryx caroliniensis Wilson, 1911: 11; George y Wilson, 1919: 150; McDougall, 1943: 331. (No) Lissodendoryx isodictyalis jacksoniana Burton, 1936 141. Eperiopsis fragilis Verrill, 1907: 333. Esponja masiva-incrustante con una altura de 2 a 6 cm, cubriendo una área de 10 cm². Su color en vivo es verde pardo, congelada su color se torna castaño claro. Su consistencia es compresible, elástica y se desmorona con facilidad. Presenta una superficie puntiforme, sus ósculos están bordeados por una membrana a manera de collar con un diámetro de 5 a 8 mm y en ellos desembocan 2 ó 3 canales exhalantes. El ectosoma tiene un grosor aproximado de 600 µm, está constituido por una reticulación subisodictial con tractos de hasta 9 tilotes y mallas con una abertura de la longitud de un tilote.  Fig. 8. Estrongile y birótulos de Iotrochota birotulata, 440X. Fig. 9. Birótulo de I. birotulata, 4400X. Fig. 10. Sigma de Desmapsamma anchorata, 3000X. Fig. 11. Isoquela de D. anchorata, 4800X. El endosoma lo forma una reticulación sin arreglo definido en el que se localizan principalmente espículas estiles, sigmas e isoquelas, es microcavernoso con canales de 0.5 a 3 mm de diámetro. Presenta espículas tilotes de 165 - 192 - 205 µm por 3.7 - 5 - 6 µm, estiles de 160 - 167 - 181 µm por 3 - 6 - 9 µm isoquelas de 24 - 26 - 28.5 µm de longitud y sigmas de 16.5 - 20 - 24 µm por 1.5 - 2 µm (Figs. 12, 13 y 14). Holopsamma helwigi de Laubenfels 1936aHolopsamma helwigi de Laubenfels, 1936a: 97; Gómez y Green, 1984: 81. Esponja ramosa, sus ramas crecen paralelas al sustrato de una base lobulada, tienen una longitud de 5 a 10 cm y un diámetro de 1 a 1.5 cm. En vivo su color es rosa pálido por el exterior y anaranjado intenso en el interior, congelada su exterior se torna castaño pardo y su interior anaranjado claro. Su consistencia es compresible y desmonorable. Presenta superficie lisa con pliegues dispersos. Los ósculos son poco evidentes ya que miden menos de 1 mm de diámetro. La dermis tiene un grosor aproximado de 400 µm, presenta numerosos ostios de 25 a 50 µm de diámetro, se desprende fácilmente e incluye gran cantidad de material foráneo. El endosoma presenta una reticulación con tractos ascendentes y transversales, los primeros tienen 5 espículas en su interior y los segundos 2. El diámetro promedio de los tractos es de 30 µm, esta reticulación se hace indefinida hacia el interior de la esponja. También en el endosoma se encuentra gran cantidad de material foráneo. Las cámaras flageladas son de forma oval con diámetro de 30 a 70 µm. Presenta espículas óxeas astadas de 94 - 122 - 135 µm por 1 - 2.5 - 3 µm (Fig. 15). Esta especie tiene una gran semejanza con Desmapsamma anchorata en cuanto a su forma, color y estructura pero con diferencias significativas en su espiculación,que hace que se consideren especies diferentes. Amphimedon compressa Duchassaing y Michelotti, 1864Amphimedon compressa Duchassaing y Michelotti, 1864: 78; Van Soest, 1980: 26; Gómez y Green, 1984: 74. Spongia rubens Pallas sensu Duchassaing y Michelotti, 1864: 41. Amphimedon arborescens Duchassaing y Michelotti, 1864: 79. (?) Spongia rubens Pallas, 1766: 389. (?) Spongia nodosa Lirnnaeus, 1759: 1348; 1767: 1298. Chalina rubens Pallas sensu Carter, 1882: 276. Haliclona subtriangularis(Duchassaing y Michelotti) sensu de Laubenfels, 1932a: 55; 1936a: 43. Haliclona rubens (Pallas) sensu de Laubenfels, 1932a: 59; 1936a: 40; 1949a: 9; 1953a: 519; Burton, 1954: 223; Hartman, 1955: 167; Little, 1963: 39; Storr, 1964: 41; Hechtel, 1965: 18; Green, 1977: 86. Pachychalina rubensSchmidt, 1870: 37; Wilson, 1902: 392. Haliclona -Amphimedon compressa (Duchassaing y Michelotti) Wiedenmayer, 1977: 82. Esponja ramosa erecta o rastrera, sus ramas tienen una longitud de 2 a 40 cm y de 1.5 a 4 cm de diámetro. Su color en vivo es rojo intenso, congelada su color palidece. Su consistencia es compresible y elástica. Su superficie es puntiforme ya que no presenta una especialización dérmica. Los ósculos tienen un diámetro de 1 a 5 mm, se encuentran dispersos irregularmente y de manera particular sobre un costado a lo largo de las ramas. Los ostios se forman de la proyección del interior hacia la superficie de tractos espiculares que sobresalen de ésta, 90 µm aproximadamente. El endosoma está formado por una reticulación irregular, con tractos que miden de 30 a 60 µm de diámetro y mallas redondeadas de hasta 600 µm de abertura. Presenta principalmente espículas óxeas del tipo fusiforme y astado que miden 90 - 130 - 160 µm por 2 - 5 - 12 µm. Además presenta en una menor proporción, estrongiles que miden 78 - 106 - 144 µm por 10 - 12 - 13 µm (Fig. 16). Amphimedon viridis Duchassaing y Michelotti, 1864Amphimedon viridis Duchassaing y Michelotti, 1864: 81; Van Soest, 1980: 29. Haliclona viridis (Duchassaing y Michelotti) de Laubenfels, 1936a: 42; 1949a: 10; 1950a: 47; 1953a: 519; 1954a: 63; Wells et al., 1960: 209; Tabb y Manning, 1961: 563; McNulty, et al., 1962: 229; Little, 1963: 39; Storr, 1964: 41. Hemihaliclona viridis (Duchassaing y Michelotti) Burton, 1937: 18. Pachychalina mollisWilson, 1902: 390. Pachychalina microporaVerrill, 1907: 337. Reniera tabernacula Row, 1911: 316. Haliclona (Amphimedon) viridis (Duchassaing y Michelotti) Wiedenmayer, 1977: 84. Esponja incrustante, con elevaciones en forma de volcán, se le encuentra sobre sustrato rocoso, cubriendo áreas de 5 a 15 cm². Su color en vivo es verde olivo, congelada se oscurece en algunas partes y se torna amarilla en otras. Su consistencia es compresible y se desmorona fácilmente. 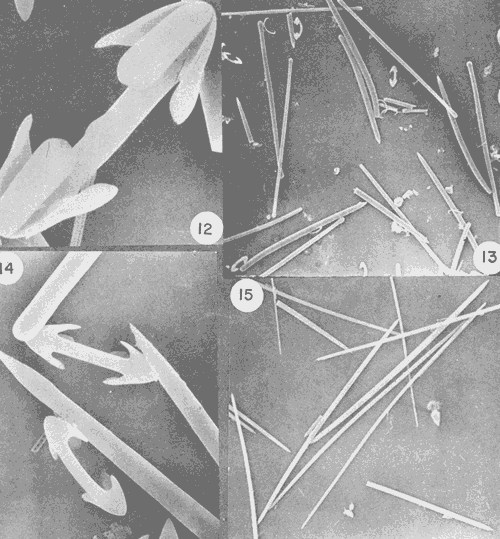 Fig. 12. Isoquela de Lissodendoryx isodictyalis 3200X. Fig. 13. Estiles, tilotes, sigmas e isoquelas de L. isodictalys, 220X. Fig. 14. Isoquelas y estiles de L. isodictyalis, 1300X. Fig. 15. Oxeas de Holopsamma helwigi, 660X. Su superficie es puntiforme, los ósculos tienen un diámetro de 1 a 4 mm y se encuentran en la cima de elevaciones en forma de volcán en los que desembocan de 2 a 3 canales exhalantes. No presenta especialización dérmica por lo que es visible el retículo ectosomal del que se proyectan conjuntos de espículas que sobresalen de la superficie de 60 a 90 µm. El endosoma presenta una reticulación con tractos ascendentes formados por 4 a 8 espículas y tractos conectivos de 1 a 2 espículas, dando la apariencia de una reticulación casi isodictial en algunas zonas. Presenta espículas óxeas fusiformes de 111 - 132 - 150 µm por 2.5 - 3.7 - 6 µm y óxeas astadas de 141 - 160 - 186 µm por 6 - 9 - 13.5 µm (Fig. 17). Niphates erecta Duchassaing y Mchelotti, 1864Niphates erecta Duchassaing y Michelotti, 1864: 93; Wiedenmayer, 1977: 96; Van Soest, 1980: 35. Pachychalina areolataWilson, 1902: 392. Haliclona areolata de Laubenfels, 1936a: 39; Wells et al., 1960: 207. Haliclona excelsa de Laubenfels (no Schnidt, 1870), 1947: 36. Niphates venosa Duchassaing y Michelotti, 1864: 94. Fibularia ramosaCarter, 1882: 283. (No) Fibularia ramosaCarter, 1887: 71. Geliodes ramosa(Carter) de Laubenfels, 1936a: 53; Hartman, 1967: 20. Geliodes ramosa (Carter) Hechtel, 1969: 7. Geliodes areolata (Wilson) Hechtel, 1965: 25; Green, 1977: 89. Haliclona variabilis (Dendy) sensu Storr, 1964: 41. Haliclona variabilis (Dendy) sensu de Laubenfels, 1950a: 42; 1953b: 19. Esponja ramosa, la longitud de sus ramas es de 15 a 45 cm y con un diámetro de 1.5 a 2 cm. Su color en vivo es rosa, congelada se torna castaño claro. Su consistencia es compresible y elástica. Su superficie es lisa, áspera al tacto, cubierta por numerosos zoantideos espaciados entre sí por 1 a 3 mm. Se observan numerosos ostios de 500 µm de diámetro constituidos por la reticulación del ectosoma. Los ósculos tienen un diámetro de 2 a 5 mm y se distribuyen a lo largo de las ramas. No existe una especialización dérmica. El ectosoma está constituido por un retículo poligonal. El endosoma presenta una reticulación de tractos que forman mallas rectangulares y circulares. Los tractos primarios tienen un diámetro de 180 a 240 µm con 15 hileras de espículas en su interior, los tractos secundarios tienen un diámetro de 60 a 120 µm, algunos de 30 µm, con 2 a 5 hileras de espículas en su interior. Presenta espículas óxeas astadas y fusiformes, las primeras miden 213 - 252 - 290 µm por 9 - 12 - 13.5 µm y las segundas 171 - 210 - 240 µm por 3 - 6 µm, microscleras del tipo sigma de 15 - 16.5 - 18 µm por 1 - 1.5 µm (Fig. 18). Callyspongia (Spinosella) vaginalis forma armigera (Duchassaing y Michelotti, 1864)Callyspongia (Spinosella) vaginalis. fo. armigera (Duchassaing y Michelotti) Van Soest, 1980: 60. Tuba armigera Duchassaing y Michelotti, 1864: 48. Tuba armigera (Duchassaing y Michelotti) Carter, 1882: 278. (?) Cladochalina armigera (Duchassaing y Michelotti) sensu Ridley, 1884: 394. Cladochalina armigera (Duchassaing y Michelotti) Schmidt, 1870: 35; Burton, 1934: 540. Callyspongia vaginalis (Duchassaing y Michelotti) sensu de Laubenfels, 1936a: 56; 1950a: 56. Callyspongia fallax (Duchassaing y Michelotti) sensu de Laubenfels, 1949: 13. Callyspongia fallax (Duchassaing y Michelotti) sensu Hechtel, 1965: 31; Green, 1977: 91. Spongia aspericornis Lamarck, 1814: 451; 1816, vol. 2: 378. Dasychalina fibrosa Ridley y Dendy, 1886: 330. Pachychalina fibrosa (Ridley y Dendy) Ridley y Dendy, 1887: 21. Cladochalina fibrosa(Ridley y Dendy) Topsent, 1932: 118. Callyspongia fibrosa (Ridley y Dendy) Burton, 1934: 540; 1959: 224. Spinosella vaginalis (Lamarck) fo. armigera (Duchassaing y Michelotti) Wiedenmayer, 1977: 104. Esponja ramosa con ramas bifurcadas de 6 a 40 cm de longitud y diámetros de 1 a 2 cm. Su color en vivo es castaño grisáceo, congelada su coloración se conserva. Su consistencia es compresible. Su superficie es conulosa, con partes rugosas y lisas, los cónulos miden de 1 a 4 mm de alto separados entre sí de 2 a 5 mm. Los ósculos tienen un diámetro de 3 a 5 mm y se encuentran dispersos a lo largo de las ramas. Tanto el ectosoma como el endosoma presentan una reticulación de dos tamaños en un mismo plano en la que se distinguen tractos primarios y secundarios. En el ectosoma los tractos primarios tienen un diámetro de 90 a 120 µm y los secundarios de 30 a 40 µm. En el endosoma los tractos son más finos, los primarios o ascendentes miden de 60 a 90 µm y contienen de 2 a 3 hileras de espículas, los secundarios o conectivos miden de 20 a 30 µm y son uniespiculares. Presenta espículas óxeas astadas, rectas y curvas de 91 - 118 - 135 µm por 2 - 7 - 10 µm (Fig. 19). Xestospongia subtriangularis (Duchassaing, 1850)Spongia subtriangularis Duchassaing, 1850: 26. Xestospongia subtriangularis(Duchassaing) Wiedenmayer, 1977: 113; Van Soest, 1980: 71.  Fig. 16. Oxeas de Amphimedon compressa, 660X. Fig. 17. Oxeas de Amphimedon viridis, 600X. Fig. 18. Sigma de Niphates erecta, 4400X. Fig. 19. Oxeas de Callyspongia armigera, 480X. Thalysias subtriangularis (Duchassaing) Duchassaing y Michelotti, 1864: 85. (No) Thalysias subtriangularis (Duchassaing) Carter, 1879: 287. (No) Haliclona subtriangularis (Duchassaing) sensu de Laubenfels, 1932a: 55, 1936a: 43. Thalysias rugosa Duchassaing y Michelotti, 1864: 84. Pachychalina rugosa (Duchassaing y Michelotti) Arndt, 1927: 153. Pachychalina rugosa(Duchassaing y Michelotti) var. rubens Arndt, 1927: 154. Schmidtia aulopora Schmidt, 1870: 44. Thalysias repens Carter, 1882: 282. Haliclona longleyi de Laubenfels, 1932a: 54; 1936a: 44; 1949a: 10; 1950b: 167. Neopetrosia longleyi (de Laubenfels) de Laubenfels, 1949a: 10; 1953a: 519; 1953b: 18; Storr, 1964: 41; Green, 1977: 88. (?) Spongia clavata Esper, 1794: 226. (?) Reniera clavata (Esper) Ehlers, 1870: 12. (No) Schmidtia clavata (Esper) sensu Balsamo-Crivelli, 1863: 292. Esponja ramosa-rastrera con ramas anastomosadas de 1.5 a 3 cm de diámetro, cubre una área de aproximadamente 25 cm ². Su color en vivo es amarillo verdoso en el exterior y amarillo claro en el interior, 1 mm por debajo de la superficie, se encuentra una capa de color verde olivo debido posiblemente a la presencia de algas. Congelada su color palidece. Su consistencia es firme, se desmorona fácilmente y es resistente al corte. Su superficie es lisa, los ósculos miden de 1 a 3 mm de diámetro, se distribuyen en la parte alta de las ramas de 1 a 1.5 cm de distancia entre ellos. El ectosoma lo constituye una reticulación de tractos de 120 a 250 µm de diámetro, completamente empacados de espículas, que forman mallas circulares de 240 a 360 µm de abertura. El endosoma presenta una reticulación también con tractos pluriespiculares de hasta 20 hileras de espículas y mallas circulares. Presenta espículas óxeas de 2 tamaños, las primeras de 136 - 210 - 278 µm por 6 - 11 - 15 µm y las segundas de 42 - 60 - 76 µm por 3 - 4.5 - 6 µm. Estiles de 78 - 163 - 225 µm. por 6 - 10.5 - 15 µm. Estrongiles de 2 tamaños, los primeros de 147 - 187 - 232 µm por 10 - 12 - 15 µm y los segundos de 45 - 66 - 85 µm por 4.7 - 6 - 9 µm (Fig. 20). Ircinia felix (Duchassaing y Michelotti, 1864)Polytherses felix Duchassaing y Michelotti, 1864: 72. Ircinia felix(Duchassaing y Michelotti) Wiedenmayer, 1977: 60; Van Soest, 1978: 33; Gómez y Green, 1984: 67. Spongia fasciculata Pallas, 1766: 381; Lamarck, 1813: 372. (No) Spongia fasciculata Esper, 1794: 253. Hircinia fasciculata Schmidt, 1862: 34; Lendenfeld, 1889: 587; Topsent, 1920: 320; 1930: 16. (No) Hircinia fasciculata Row, 1911: 373. Polytherses armata Duchassaing y Michelotti, 1864: 70. (?) Hircinia armata (Duchassaing y Michelotti) Verrill, 1907: 332. (?) Polytherses columnaris Duchassaing y Michelotti, 1864: 73. Polytherses de F. et M. Carter, 1882: 274. Ircinia fasciculata (Pallas) sensu de Laubenfels, 1948: 66; 1949a: 5; 1950a: 9; 1953a: 514; 1956: 2; Pearse y Williams, 1951: 135; Hartman, 1955: 165; Wells et al., 1960: 206; Tabb y Manning, 1961: 563; McNulty et al., 1962: 229; Little, 1963: 34; Storr, 1964: 41; Hechtel, 1965: 8; Green, 1977: 81. Ircinia fasciculata (Pallas) sensu Sarà, 1963: 213; 1964: 242; Sarà y Melone, 1963: 366. Hircinia fasciculata (Esper) Lévi, 1952: 37. Hircinia variabilis Lendenfeld (no Schmidt, 1862), 1889: 557; Wilson, 1902: 405; de Laubenfels, 1936a: 19; 1936b: 457; 1947: 35. (No) Ircinia variabilis de Laubenfels, 1950a: 14. Hircinia ectofibrosa George y Wilson, 1919: 166. 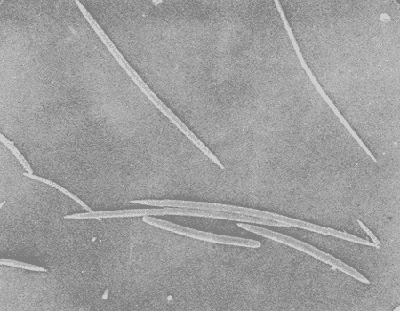 Fig. 20. Oxeas y estrongiles de Xestospongia subtriangularis, 260X. Esponja que presenta uno o varios tubos de 9 cm de diámetro y de 20 a 25 cm de altura, cada tubo posee una cloaca de 2 a 3 cm de diámetro. Su color en vivo es castaño grisáceo, congelada conserva su coloración. Su consistencia es compresible, resistente al corte. Su superficie presenta cónulos de 2 a 3 mm de altura y de 1 a 2 mm de separación entre ellos. Los ósculos tienen un diámetro de 2 a 5 mm, son poco numerosos y se distribuyen irregularmente en la superficie. Los ostios miden de 60 a 100 µm de diámetro y se localizan en los espacios interconulares. El ectosoma es una dermis de 800 a 1100 µm de grosor, no se desprende del endosoma debido a su elasticidad, contiene gran cantidad de partículas foráneas. El endosoma está constituido por una reticulación fascicular, cuyos fascículos ascienden hasta la superficie formando los cónulos. Las fibras primarias miden de 50 a 120 µm de diámetro, éstas contienen una cantidad variable de partículas foráneas. Los filamentos característicos del género, se encuentran densamente entrelazados en toda la esponja, su diámetro es de 4 a 7 µm y el diámetro de sus nodos terminales de 7 a 10 µm. Ircinia strobilina (Lamarck, 1816)Spongia strobilina Lamarck, 1816, vol. 2: 363; 1836: 573. Ircinia strobilina (Lamarck) de Laubenfels, 1948: 71; 1949a: 6; 1950a: 14; 1953a: 514; Sarà, 1958: 240 (?); Little, 1963: 35; Bayer y Work, 1964: 14; Hechtel, 1965: 10; Green, 1977: 84; Wiedenmayer, 1977: 61; Van Soest, 1978: 40; Gómez y Green, 1984: 69. Polytherses linguiformis Duchassaing y Michelotti, 1864: 69; Schmidt, 1870: 31. Spongia linteiformis Lamarck, 1813: 457. Polytherses longispina Duchassaing y Michelotti, 1864: 71. Polytherses acuta Duchassaing y Michelotti, 1864: 72. Hircinia acutaHyatt, 1877: 548; Verrill, 1907: 332. (Hircinia gigantea (Lendenfeld) sensu Topsent, 1933: 15. Hircinia strobilina de Laubenfels, 1936a: 18. Polytherses capitata Duchassaing y Michelotti, 1864: 72. Polytherses de F. et M., Carter, 1882: 274. (No) Ircinia strobilina irregularisde Laubenfels, 1954: 21. Esponja masiva, con 18 cm de altura por 20 de diámetro en su base. Su color en vivo así como congelada es gris oscuro con tonalidades negras en el exterior y amarillo blanquecino en la base y el interior. Despide un olor fétido. Su consistencia es compresible y elástica. Su superficie presenta cónulos que miden de 2 a 5 mm de altura separados entre sí por 2 a 8 mm. Los ósculos tienen un diámetro de 1 a 5 mm y se agrupan principalmente en la región apical de la esponja. El ectosoma es una dermis de 50 µm de grosor que incluye gran cantidad de partículas foráneas y así como en I. felix no se puede desprender. El endosoma está constituido por una reticulación fascicular, sus fibras miden de 60 a 200 µm de diámetro y contienen gran cantidad de partículas foráneas en su interior. Los filamentos no tienen un arreglo definido, son largos y se encuentran entrelazados, por lo que no es posible determinar su longitud, su diámetro es de 4.5 a 9 µm y el de sus nodos terminales de 5 a 12 µm. Se puede observar en el interior de algunos filamentos partículas foráneas finas en su interior. Dysidea fragilis (Montagu, 1818)Spongia fragilisMontagu, 1818: 114. Dysidea fragilisJohnston (recte Montagu) Bowerbank, 1863: 757. Duseideia fragilis (Montagu) Johnston, 1842: 187; Bowerbank, 1844b: 71. Dysidea fragilis(Montagu) Koltun, 1959: 222; Tabb y Manning, 1961: 563; Sarà y Siribelli, 1962: 56; Sarà y Melone, 1963: 366; Sarà, 1963: 212; 1964: 241; Hechtel, 1965: 14 (con sinonimia adicional); Wiedenmayer, 1977: 72. Dysidea sp Pearse y Williams, 1951: 135. (No) Dysidea fragilis (Montagu) sensu de Laubenfels, 1950a: 22; 1950b: 175. Esponja masiva de 10 cm de grosor con procesos lobulados, algunos de éstos semicilíndricos que surgen desde la base. En vivo su color es gris liláceo, congelada se torna color pardo. Su consistencia es compresible y elástica. Su superficie presenta cónulos finos de 0.5 a 1 mm de altura, separados entre sí por una distancia de 0.5 a 2 mm, son más numerosos en la región apical que en la base. Los ósculos tienen una membrana esfinteroide y un diámetro de 1 a 6 mm, se encuentran principalmente en el ápice de los lóbulos. El ectosoma está representado por una dermis gruesa, sostenida por una fibroreticulación más fina que la del endosoma. Una gran cantidad de partículas foráneas se encuentran incluidas en ella. El endosoma presenta una fibroreticulación irregular, sus fibras se caracterizan por contener gran cantidad de material foráneo que las cubren parcial o totalmente (Fig. 21). Halisarca purpura Little, 1963Halisarca purpura Little, 1963: 37. Esponja incrustante de 5 mm de grosor, de 6 a 8 cm de longitud y de 3 a 4 cm de ancho. 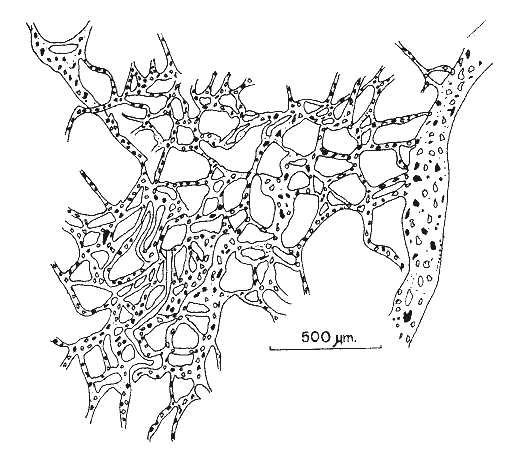 Fig. 21. Corte del esqueleto de Dysidea fragilis. En vivo su color es rojo púrpura intenso, congelada se torna morado oscuro casi negro. Su consistencia es compresible, fácil de cortar. Su superficie es lisa con numerosos ostios microscópicos se observa sólo un ósculo de 1.5 mm de diámetro. La dermis es delgada, mide de 500 a 600 µm de grosor, incluye gran cantidad de partículas foráneas. Se observan canales de 2 a 34 µm de diámetro. El endosoma se caracteriza por la ausencia de un esqueleto mineral o fibroso, en su lugar posee una sustancia coloidal mucilaginosa, en la que se encuentran cámaras flageladas ovales y ramificadas de 30 a 45 µm de diámetro. Aplysina fistularis insularis Duchassaing y Michelotti, 1864Luffaria insularis Duchassaing y Michelotti, 1864: 61. Aplysina fistularis insularis Van Soest, 1978: 56. Verongia fistularis sensu de Laubenfels, 1936a: 21; 1948: 82;. Storr, 1964: 41; Hechtel, 1965: 12; Green, 1977: 85. Aplysina fistularis fistularis Wiedenmayer, 1977: 64. (No)Spongia fistularis Pallas, 1766: 385; Linnaeus, 1767: 1297; Esper, 1794: pl. 20; Ehlers, 1870: 13; Lamarck, 1814: 435. (?) Spongia tubaeformis Lamarck, 1814: 435. (?) Aplysina fistularis aggregataTopsent, 1932: 72. Esta esponja consiste de un grupo de tubos cortos unidos en su base, miden de 6 a 15 cm de alto y de 2.5 a 3 cm de diámetro. Cada tubo presenta un atrio de 0.5 a 1 cm de diámetro el cual está recubierto por una membrana lisa y delgada. Su color en vivo es amarillo con tonos morados, congelada se torna castaño rojizo. Su consistencia es poco compresible. Su superficie es finamente conulosa, presenta cónulos pequeños de 0.5 mm de alto. La dermis es una delgada capa fuertemente pigmentada. El endosoma está formado por una fibroreticulación uniforme de mallas hexagonales a circulares de 200 a 1300 µm de abertura. Sus fibras miden de 50 a 120 µm de diámetro, son de color ámbar claro y presentan una médula que ocupa del 30 al 70% de su diámetro (Fig. 22). 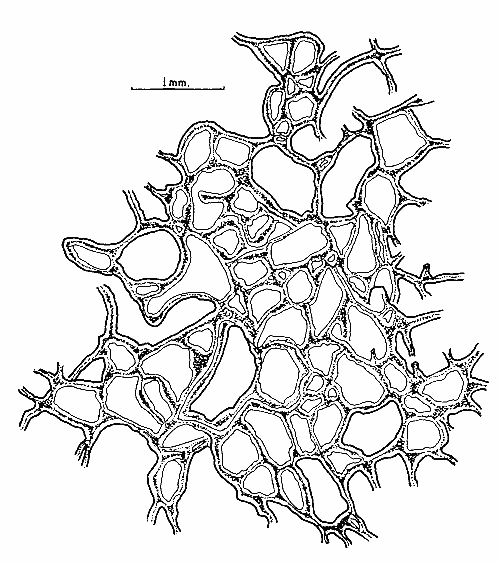 Fig. 22. Corte del esqueleto de Aplysina fistularis insularis. Verongula rigida (Esper, 1794)Verongula rigida (Esper) Van Soest, 1978: 67. Verongula ardis (de Laubenfels) Wiedenmayer, 1977: 77. (No) Ianthella ardisde Laubenfels, 1950a: 31. Ianthella basta (Pallas) sensu de Laubenfels, 1936a: 31. Aplysina aerophoba Nardo sensu Schmidt, 1870: 30; Hyatt, 1875: 406. Aplysina aerophobaNardo sensu Carter, 1882: 270. (?) Luffaria rigida (Esper) sensu Duchassaing y Michelotti, 1864: 61. Esponja masiva-lobada, los lóbulos miden de 2 a 4 cm de diámetro y 10 cm de longitud, cada uno de ellos posee un ósculo de 0.5 a 1.5 cm de diámetro en la parte apical. Su color en vivo es amarillo con tonos verdosos, congelada se torna negra. Su consistencia es compresible, fácil de cortar. Su superficie está constituida por depresiones en forma poligonal irregular con una amplitud de 1 a 3 cm, definidas por un borde de 0.5 mm de ancho y 2 mm de alto. La dermis presenta numerosas células pigmentadas y no se puede separar del endosoma. El endosoma está formado por una fibroreticulación de mallas poligonales alargadas con abertura de 250 a 1500 µm, las fibras son de color rojizo con diámetro de 60 a 155 µm éstas tienen una médula que ocupa aproximadamente el 70% de su diámetro (Figs. 23 y 24). 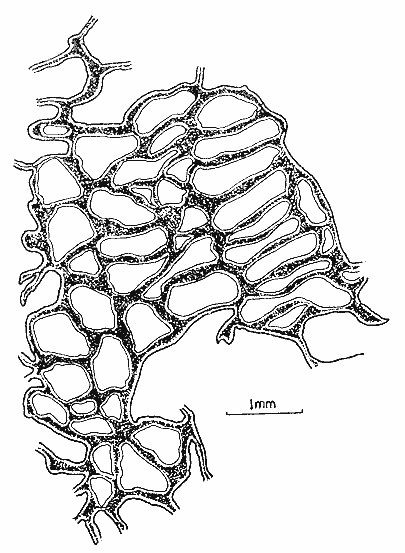 Fig. 23. Corte del esqueleto ectosomal de Verongula rigida. Pseudoceratina crassa (Hyatt, 1875)Dendrospongia crassa Hyatt, 1875: 401; Wilson, 1902: 409; Verrill, 1907: 332. Pseudoceratina crassa (Hyatt) Bergquist: y Hartman, 1969: 250, 253; Van Soest, 1981: 26, 33; Gómez y Green, 1984: 74. Aplysina crassa (Hyatt) Lendenfeld, 1889: 423. Verongia crassa (Hyatt) de Laubenfels, 1948: 36. 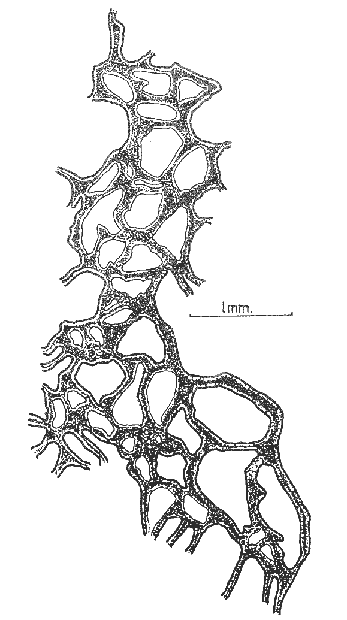 Fig. 24. Corte del esqueleto endosomal de V. rigida. Aplysina aerophoba Nardo sensu Schmidt, 1870: 30. Aplysina aerophoba Nardo sensu Carter, 1882: 270. Ianthella ianthella de Laubenfels, 1949a: 7. Ianthella ardis de Laubenfels, 1950a: 31; 1953a: 516; Little, 1963: 36; Hechtel, 1965: 16. Aiolochroia crassa (Hyatt) Wiedenmayer, 1977: 75; Van Soest, 1978: 65. Esponja masiva con procesos lobulados, tiene una altura de 7 cm y cubre una área hasta de 20 cm². Los lóbulos miden de 0.5 a 3 cm de diámetro y 2 a 4 cm de longitud. Su color en vivo es amarillo, congelada se torna morado azuloso, perdiendo gradualmente el color amarillo del interior. Su consistencia es poco compresible, con apariencia de caucho. Su superficie presenta cónulos de 1 a 2 mm de altura con una distancia entre ellos de 2 a 5 mm. Los ósculos tienen un diámetro de 1 a 2.5 mm, están bordeados por una membrana, que es prolongación de la misma dermis y que se eleva 1 mm, se encuentran de 1 a 2 en los ápices de los lóbulos o en grupos de 3 ó 4 en la región basal y en los espacios interconulares. La dermis no se desprende, tiene un grosor de 200 µm con gran cantidad de células pigmentadas de color púrpura y numerosos ostios de 60 a 80 µm de diámetro. La estructura esquelética del endosoma es un agregado de fibras del tipo dendrítico, irregulares, quebradizas, de color rojizo, con un diámetro de 150 a 480 µm y con una médula en su centro que abarca hasta el 70% de su diámetro (Fig. 25). 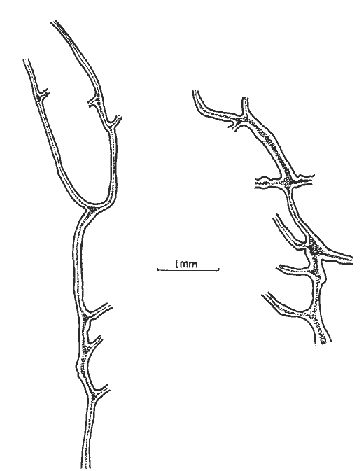 Fig. 25. Detalle de dos fibras dendríticas de Pseudoceratina crassa. AgradecimientosSe agradece a Agustín Ayala-Castañares y a sus colaboradores administrativos, su apoyo durante la realización del presente trabajo. Asimismo se agradece a Fernando González Farías y Yolanda Hornelas de Uribe por su ayuda en el microscopio electrónico de barrido y a César Merlo Camacho por la impresión de fotografías. LITERATURAARNDT, W., Bijd. Dierk., Kalk-und Kieselschwämme von Curaçao. 1927.133-158. 25: BALSAMO-CRIVELLI, G., Atti. Soc. Italiana Sci. Nat. Di alcuni spongiarii del Golfo di Napoli.1863.284-302. 5: BAYER, F. NI y R. C. WORK, Littoral Marine Life of Southern Florida. A guidebook for field trip No. 7, Geological Society of American Convention1964. 21 p. Nov. 1964: BERGQUIST, P. R., Pac. Sci. The sponges of Micronesia. Part. I. the Palau Archipelago.1965. 123-204.(2): 19 BERGQUIST, Sponges.Hutchinson Univ. Librar. Londres1978.268p. BERGQUIST, P. R. y W. D. HARTMAN, Mar. Biol. Free aminoacid patterns and the classification of the Demospongiae. 1969.247-268. (3): 3 BOWERBANK, J. S., Phil. Trans. r. Soc. On the anatomy and physiology of the Spongiadae. Part. II. Lond.1863.747-829.(1862): 152 BURTON, M., In: Great Barrier Reef Expedition 1928-29, scientific reports. Sponges. Lond. Brit. Mus. (Nal. Hist.),1934.513-621.(14): 4 BURTON, M., Ann. Mag. nal. Hist. Notes on sponges from South Africa with descriptions of new species.1936, 141-147. 17: BURTON, M., Bull. Madras Govt. Mus (n.s.), nat. Hist. Sect.,The littoral fauna of Krusadai Island and the Gulf of Manaar. 1937.158.1 (2): BURTON, M., Ann. Mag. nal. Hist. (ser. 12), The synonymies of Haliclona angulata (Bowerbank) and H. arcoferus Vosmaer. 1948.273-284. 1: BURTON, M. Bull. Brit. Mus. (nal. Hist.), Zool.,Sponges in: The "Rosaura" Expedition, pt. 5,1954. 215-239.(6): 2 BURTON, M. Atlantide Report. The sponges of West Africa. Danis Sci. Press,Copenhagen1956.111-147. 4: BURTON, M., The John Murray Expedition 1933-34. Scientific reports. Sponges. Lond. Brit. Mus. (nal. Hist.), 1959.151-281.(5): 10 BURTON, M. y H. S. RAO, Rec. Indian Mus. Report on the shallow water, marine sponges and the collection of the Indian Museum 1932. 299-358. 34: CARTER, H. J. Ann. Mag. nal. Hist. (ser. 4), On two undescribed sponges and two Esperiadae from the West Indies; also on the nomenclature of the calcisponge Clathrina, Gray.1871.268-283. 7: CARTER, H.J., Ann. Mag. nat. Hist. (ser. 5), Contributions to our knowledge of the Spongida. 1879. 284-304, 243-360. 3: CARTER, H.J., Ann. Mag. nal. Hist. (ser. 5), Some sponges from the West Indies and Acapulco in the Liverpool Free Museum described with general and classificatory remarks. 1882. 266-301, 346-368. 9: CARTER, H.J., Ann. Mag. nal. Hist. (ser. 5), Contributions to our knowledge of the Spongida.1883.302-329. 12: CARTER, H.J., Ann. Mag. nal. Hist. (ser. 5) Descriptions of sponges from the neighbourhod of Port Phillip Heads, South Australia, 1886. 40-53, 112-127, 431-441, 502-516., 34-55, 126-149. 17:, 18: CARTER, H.J., Report on the marine sponges, chiefly from King Island, and the Mergui Archipelago, collected for the trustees of the Indian Museum, Calcutta, by Dr. John Anderson. J. Linnean Soc. London, Zool.,1887. 61-84. 21: DENDY, A., Proc. r. Soc. Victoria (ser.2)Catalogue of non-calcareous sponges collected by J.B. Wilson, Esq., M.A. in the neighbourhood of Port Phillip Heads. Part. II. 1896.14-51. 8: DICKINSON, M. G., Allan Hancock Pacif. Sped.Sponges of the Gulf of California. 1945.1-251.(1): 11 DUCHASSAING, de F. P., J. B. Bailliere et Fils. Animaux radiaires des Antilles. Paris1850. 33 p. DUCHASSAING, de F. P. y G. MICHELOTTI, Spongiaires de la mer Caraibe.Naktd. Verh. holl. Maatsch. Wetensch. Haarlem. (ser. 2), 1864. 1-24. 21: EHLERS, E. H., Die Esper`schen Spongien in der zoologischen Sammlung der K. E. TI. Jacob, Universitat Erlangen. Erlangen1870. 36 p. ESPER, E. J. C., Die Pflazanthiere in Abbildungen mach der Natur mil Farben erleuchtet nebst beschreinbunger. Raspe Zweyter TheilNürnberg1791-9. 303 p. GEORGE, W.C. y H. WILSON, Bull. Bur. Fish., Sponges of Beaufórt (N.C.) Harbor and vicinity. 1919.130-179. 36: GÓMEZ L. P. y G. GREEN, An. Inst. Cienc. del Mar y Limnol. Univ. Nal. Autón. México, Sistemática de las esponjas marinas de Puerto Morales, Quintana Roo, Mexico. 1984.65-90.(1): 11 GRAY, J. E., Notes on the arrangement of sponges, with the descriptions of some new genera. Proc. Zool. Soc. London. 1867. 492-558. GREEN, G., An. Centro Cienc. del Mar y Limnol. Univ. Nal. Autón. México, Sinopsis taxonómica de trece especies de esponjas del arrecife La Blanquilla, Veracruz, Mexico. 1977.79-98.(1): 4 HARTMAN, W. D., Bull. marine Sci. Gulf Caribb.A collection of sponges from the West Coast of the Yucatan Peninsula with description of two new species. 1955.161-189. 5: HARTMAN, W.D. Bull. Peabody Mus. nal. Hist.,Natural history of the marine sponges of southern New England. 1958.1-155. 12: HARTMAN, W.D., . Postilla Peabody Mus. nal. Hist. Revision of Neofibularia (Porifera, Demospongiae), a genus of toxic sponges from the West Indies and Australia.1967.1-41 113: HECHTEL, J.G., Bull. Peabody Mus. nal. Hist.A systematic study of the Demospongiae of Port Royal, Jamaica. 1965.1-103. 20: HECHTEL, J.G., New species and records of shallow water Demospongiae from Barbados, West Indies. Postilla Peabody Mus. nal. Hist.1969. 1-38. 132: HIGGIN, T. H., An . Mag. nat. Hist. (ser. 4)Description of some sponges obtained during a cruise of the stearnyacht "Argo" in the Caribbean and neighbouring areas. 1877.291-299. 19: HOPKINS, S. H., Bull. Mar. Sci. Gulf Caribb.Notes on the boring sponges in gulf coast estuaries and their relations to salinity. 1956. 44-58.6: ***HYATT, A., Mem. Boston Soc. nat. Hist. Revision of the North American Poriferae; with remarks upon foreign species. Part. I.1874.399-408. 2: HYATT, A. Mem. Boston Soc. nat. Hist. Revision of the North American Poriferae; with remarks upon foreign species. Part. II. 1877. 481-554. 2: JOHNSTON, G. A history of British sponges and lithophytes. W. H. Lizars Edimburgh1842. XII-264. KOLTUN, V. M.Kremnerogonie gubki severnikh i dal'nevostochriikh morei SSSR (otryad Cornac uspongida). Opredeliteli po faune SSSR izdavaemie zoologicheskim institutom akademiy Nauk SSSR, 1959. 236p. 67: LAMARCK, J.B., Ann. Mus. Hist. nat. Sur les polypiers empâtés.Paris1813-4.294-312, 370-386, 432-458.20: LAMARCK, J.B. Mem. Mus. Hist. nat. Suite des polypiers empâtés Paris1814-15. 69-80, 162-168, 331-340.1: LAMARCK, J.B., Verdiere Historie naturelle des animaux sans vértebras. Paris.1816. 1-568; 3: 1-586. 2: LAUBENFELS, M. W. de, Physiology and morphology of Porifera exemplified by Iotrochota birotulata Higgisn. Carnegie Inst. Washington Publ.,1932.37-66. 435: LAUBENFELS, M. W. de, A discussion of the sponge fauna of the Dry Tortugas in particular, and the West Indies in general with material for a revision of the families and orders of the Porifera.Carnegie Inst. Washington Publ.1936a. 225 p. 467: LAUBENFELS, M. W. de, A comparison of the shallow water sponges near the Pacific end of the Panama Canal with those at the Caribbean end. Proc. U.S. nat. Mus.1936b.441-466. 83: LAUBENFELS, M. W. de, Ecol. Monogr.Ecology of the sponges of a brackish water environment at Beaufort, N.C. 1947.51-46. 17: LAUBENFELS, M. W. de, Occ. Papers Allan Hancock Found. The order Keratosa of the phylum Porifera. A monographic study. 1948.1-217. 3: LAUBENFELS, M. W. de, Amer. Mus. NovitatesSponges of the Western Bahamas. 1949.1-25. 1431: LAUBENFELS, M. W. de, Trans. Zool. Soc. The Porifera of the Bermuda Archipelago.London1950a.1-154. 27: LAUBENFELS, M. W. de, Pac. Sci. The sponges of the Kaneohe Bay, Oahu1950b.3-36. 4: LAUBENFELS, M. W. de, Bull. marine Sci. Gulf Caribb., Sponges from the Gulf of Mexico. 1953a.511-557. 2: LAUBENFELS, M. W. de, A special publication of the Marine Laboratory, A guide to the sponges of Eastern North America. Univ. Miami Press U. of Miami.1953b. 32 p. LAUBENFELS, M. W. de, Oregon State Monogr. Zool., The sponges of the WestCentral Pacific.1954.1-306. 7: LAUBENFELS, M. W. de, Oceanogr. Biol.Preliminary discussion of the sponges of Brasil. Contrib. Avulsas Inst. Oceanogr. Univ. Sao Paulo, 1956. 1-4. 1: LENDENFELD, R. L., A monograph of the horny sponges. Trubner and Co. London1889. 936 p. LÉVI, C., Bull. .Inst. Français Afrique Noire, Spongiaires de la ate du Senégal. 1952. 34-59. 14: LÉVI, C., Ann. Inst. Oceanogr. Spongiaires. Résult. Sci. Camp. "Calypso", fasc. 4, Monaco1959. 115-141. 37: LÉVI, C., Traité de ZoologieSystématique de la classe des Demospongiaria (Démosponges). 1973.577-631.(1): 3 LINDGREN, N. G., Zool. Anz.Beitrag zur Kennitniss der Spongienfauna des Malayischen Archipels und der chinesischen Meere. 1897. 480-487.20: LINDGREN, N. G., Beitrag zur Kermitniss der Spongienfauna des Malayischen Archipels und der chinesischen Meere. Zool. Jb., Syst., 1898.283-378. 11: LINNAEUS, C., Systema naturae. L. Salvius Editio decima, reformata. Stockolm, 1759. 825-1384. 2: LINNAEUS, C. Systema naturae. L. Salvius Editio decima, reformata. Stockolm 1767. 825-1384. 2: LITTLE, F. J., Tulane Studies Zool. The sponge fauna of the St. George's Sound, Apalache Bay and Panama City regions of the Florida Gulf Coast.1963.31-71. 11: MCDOUGALL, K. D., Ecol. Monogr.Sessile marine invertebrates of Beaufort, N.C.1943.321-374.(3): 13 MCNULTY, J. K., R. C. WORK y H. B. MOORE, Bull. marine Sci. Gulf Caribb. Level sea bottom communities in Biscayne Bay and neighbouring areas. 1962.204-233. 12: MONTAGU, G., Mem. Wernerian nat. Hist. Soc.An essay on sponges, with descriptions of al¡ the species that have been descovered on the coast of Great Britain.1814.67-122. 2: PALLAS, P. S., The Hague, Elenchus zoophytorum... P. van Cleef 1766. 451 p. PEARSE, A. S. y L. G. WILLIAMS, J. Elisha Mitchell Sci. Soc. The biota of the reefs off the Carolinas.1951.133-161. 67: RIDLEY, S. O., In: Report on the zoological collections made in the Indo-Pacific Ocean during the voyage of H.M.S. "Alert", 1881-2. Spongiida. London Brit. Mus. nat. Hist., 1884. 366-482, 582-630. 1:, 2: RIDLEY, S. O. y A. DENDY, Ann. Mag. nat. Hist. (Ser. 5),Preliminary report on the Monaxonida collected by H.M.S. "Challenger". 1886.325-351, 470-493. 18: RIDLEY, S.O. y A. DENDY, Zoology, Report on the Monaxonida collected by H.M.S. "Challenger" during the years 1873-76. 1887.1-275. 20: i-lxviii, Row, R. W. H., J. Linnean Soc. London Zool. Report on the sponges collected by Mr. Cyril Crossland in 1904-5. Part. II. Non-Calcarea. 1911.287-400. 31: SARÁ, M., Ann. Mus. Civ. Stor. Nat.Contributo alla conoscenza del Poriferi del Mar Ligure. Genova1958. 207-244. 70: SARÁ, M., Ann. Inst. Sci. S. ChiaraDistribuzione ed ecología del Poriferi in acque superficiali del Golfo di Policastro (Mar Tirreno).1963.191-215. 12: SARÁ, M., Arch. Zool. ItalianoDistribuzione ed ecologia de¡ Poriferi in acque superficiali della Riviera Ligure di Levante.1964.181-248. 49: SARÁ, M. y N. MELONE, Ann. Ist. Sup. Scí. Lett. S. Chiara Poriferi di acque superficiali del litorale pugliese presso Bari. 1963.343-372. 13: SARÁ, M. y L. SIRIBELLI, Ann. Ist. Mus. Zool. Univ. Napoli, La fauna di Poriferi delle "secche" del Golfo di Napoli. I. La "secca" della Gaiola.1960.1-93. 12: SCHMIDT, E. O., Die spongien des Adriatischen Meeres. Engelmann, Leipzig1862. viii-88. SCHMIDT, E.O., Grundzuge einer Spongien-Fauna des Atlantischen Gabietes. Engelmann Leipzig,1870. iv-88. SIMPSON, T. C., Bull. Peabody Mus. nat. Hist., The structure and function of sponge cells: new criteria for the taxonomy of poecilosclerid sponges (Demospongiae).1968.1-141. 25: SOEST, R. W. M. VAN, Stud. Fauna Curaçao Caribb. Isl.Marine sponges from Curaçao and other Caribbean localities. Part. I. Keratosa. 1978.1-94.(179): 56 SOEST, R.W.M. VAN Stud. Fauna caraçao Caribb. Isl., Part. II Haplosclerida1980.1-173.(104): 62 SOEST, R.W.M. VAN., Verslagen en Technische GegevensA checklist of the Curacao sponges (Porifera, Demospongiae) including a pictorlal key to the more common reef forms.1981. 44 p. 31: SOEST, R.W.M. VAN, Stud. Fauna Curaçao Caribb. Isl. Part. III. Poecilosclerida. 1984.1-167.(199): 66 STORR, J. F., Special Sci. Rept. Fish. Ecology of the Gulf of México commercial sponges and its relation to the fishery. U.S. Fish. Wildlife Serv. 1964.73 p. 466: TABB, D. C. y R. B. MANNING, Bull. marine Sci. Gulf Caribb.A checklist of the flora and fauna of northern Florida Bay and adjacent brackish waters of the Florida mainland collected during the period of july 1957 through September 1960.1961.552-649. 11: THIELE, J., Zoologica Studien uber pazifische Spongien, II Stuttgart, Heft,1899.1-33. 24: TOPSENT, E. E., Mem. Soc. Zool. FranceQuelques spongiaires du Banc de Carapêcho et de la Ponte-à-Pitre. 1889.30-52. 2: TOPSENT, E.E., Mém. Soc. Zool. FranceApplication de la taxonomie actualle à une collection de spongialres du Banc de Campéche et de la Guadeloupe décrite précédemment. 1894. 27-36.7: TOPSENT, E.E., Rev. suisse Zool. Spongiaires de la Baie d'Amboine. (Voyage de M. M. M. Bedot et C. Pictec dans l'archipel Malais.)1897. 421-487. 4: TOPSENT, E.E., Bull. Mus. natl. Hist. nat. Paris Tethya aurantium (Pallas) et les Tethya de Lamarck. 1920.640-646. 26: TOPSENT, E.E., Congr. natl. Soc. Sect. Sci., para 1924: Les Siphonochalina de la Méditerranée, C.R. 1925.236-241. TOPSENT, E.E., Résult Camp. Sci. Albert I Monaco, Spongiaires de l'Atlantique et de la Méditerranée provenant des croisiéres du Prince Albert ler. de Monaco. 1928.1-376. 74: TOPSENT, E.E., Arch. Mus. natl. Hist. Paris (ser. 6), Eponges de Lamarck conservées au Muséum de Paris. 1930.1-56. 5: TOPSENT, E.E., Arch. Mus. natl. Hist. nat. Paris (ser. 6), Eponges de Lamarck conservées au Muséum de Paris. 12éme partie. 1932. 61-124.8; TOPSENT, E.E., Arch. Mus. natl. Hist. nat. Paris (ser. 6) Eponges de Lamarck conservées au Muséum de Paris1933. 1-60. 10: TOPSENT, E.E., Bull Inst. Oceanogr. Etude sur Leucosolenia, Monaco,1936.1-47. 711: VERRIL, A. E., Trans. Connecticut Acad. Arts Sci., The Bermuda Islands. Part IV. Geology and paleontology, and part V. An account of the coral reefs.1907.45-348. 12: WELLS, H. W., M. J. WELLS y I. E. GRAY, J. Elisha Mitchell Sci. Soc. Marine sponges of North Carolina.1960. 200-245. 76: WHITFIELD, R. P., Bull. amer. Mus. nat. Hist.Notice of a new sponge from Bermuda, and of some other forms from the Bahamas. 1901.47-50. 14: WIEDENMAYER, F., Shallow-water sponges of the Western Bahamas. (Experientia Supplementum 28). Birkhäuser Verlag, Basel und Stuttgart1977. 287 p. WILSON, H., Bull. U S. Fish Comm., 2 para 1900: The sponges collected in Porto Rico in 1899 by the U.S. Fish Commission steamer Fish Hawk.1902.375-411. WILSON, H., Bull. Bur. Fish. Development of sponges from dissociated tissue cells. 1911.1-30. 30, para. 1910:
|

