|
TAXONOMÍA Y ANATOMÍA COMPARADA DE LAS OSTRAS EN LAS COSTAS DE MÉXICO. Trabajo recibido el 7 de septiembre de 1984 y aceptado para su publicación el 11 de diciembre de 1984.
ZOILA G. CASTILLO RODRIGUEZ
ANTONIO GARCÍA-CUBAS
Universidad Nacional Autónoma de México. Instituto de Ciencias del Mar y Limnología. Contribución 484 del Instituto de Ciencias del Mar y Limnología, UNAM.
RESUMENLa clasificación de las ostras teniendo en cuenta exclusivamente los caracteres conquiliológicos, es desde la época de Linnaeus (1758) de un gran valor, sin embargo, dichos caracteres resultan insuficientes para identificar plenamente las diferencias y afinidades, así como las tendencias evolutivas de un grupo tan bien definido como el de los ostréidos. Por tal motivo, este estudio destaca la disposición de las partes blandas en relación con la morfología de la concha y ésta a su vez con la del sustrato, así como las características del habitat, con objeto de proporcionar un apoyo más claro y definido al conocimiento de la función adaptativa de las ostras. Dentro de las características anatómicas, el sistema digestivo permite una mejor diferenciación, sobresaliendo fundamentalmente la disposición del intestino con respecto al estómago, así como el número y forma de los ciegos gástricos que en conjunto demuestran una sucesión progresiva para las especies de los tres géneros estudiados (Lopha, Ostrea y Crassostrea). Se detectaron grupos con elevado grado de similaridad (especies afines), basados en el procedimiento por análisis "cluster" contando con 17 características de la concha y 30 anatómicas. Se elaboraron claves para la identificación de las distintas especies de ostras, que habitan las costas de México. ABSTRACTThe classifications of oysters using soley their shell characteristics is, since the time of Linnaeus (1758) of great value. However, these features are often insuficient to reach the proper taxonomic identification and to discuss evolutive tendencies in this well-defined group. The present study illustrates the importance of the internal anatomy compared whith the shell morphology and this, with the type of sustrate and environment characteristics may provide the basis to understand the functional adaptation of oysters. The anatomical characteristics such as the digestive system permits a better differentation particulary when the position of intestinal tract is considered related to the stomach, and number and shape of the gastric caecum are also important, showing a progressive succession in the species of three genus estudied (Lopha, Ostrea and Crassostrea). Groups were detected with an elevated degree of similarity, based on cluster analysis using 17 shell an 30 anatomical characteristics. Keys were elaborated to identify individual oyster species from the coasts of Mexico.
INTRODUCCIÓNLa familia Ostreidae incluye a un número de especies altamente productivas e importantes, distribuidas en diversas regiones del mundo, favoreciendo al hombre como alimento. Este grupo ocupa también un lugar importante en geología para estudios de zonación, estratigráficos, interpretaciones paleoceológicas y estudios filogenéticos. Muchos problemas planteados actualmente dentro de la geología y biología son abordados por métodos puramente paleontológicos apoyados por la neontología. El estudio taxonómico de las ostras, ha sido entendido como derivado de una familia monofilética; sin embargo, Stenzel (1971) la propone como difilética, basándose en tres características fundamentales: a) la estructura charnelar de la prodisoconcha; b) la forma y posición de la impresión del músculo aductor, y e) el curso del intestino con respecto al corazón. Uno de los aspectos más importantes de esta familia, es la posición taxonómica de los dos tipos de ostras de importancia económica. Inicialmente, diversos autores como Linnaeus (1758), Bruguiére (1791) y Lamarck (1801) reconocieron a Ostrea como un nombre genérico, con la especie tipo Ostrea edulis. Posteriormente, Crassostrea y Ostrea s.s. se consideraron a nivel de subgénero y hacia fines del siglo pasado, Saceo (1897) propone cuatro subgéneros para el género Ostrea que son: Crassostrea, Cubitostrea, Cymlostrea y Gigantostrea. Finalmente, las diferencias observadas señalaron dos grupos básicos de especies que requieren de un detenido estudio, Orton (1928) fue el primero en enumerar las diferencias biológicas entre estos dos tipos de ostras, considerando larvíparas al género Ostrea y ovíparas al género Crassostrea. Hirase (1930) usó como carácter de identificación anatómica la fusión paleo-branquial, estableciendo que el género Pycnodonte es el único entre los ostréidos que se distingue por presentar el ventrículo atravesado por el intestino. Nelson (1938) descubre que la ausencia o presencia de la cámara promial es un carácter anatómico distintivo entre los dos tipos de ostras señalados anteriormente; Ranson (1948, 1960) continuó trabajando en la distinción genérica basándose en la ornamentación de la concha primitiva, a nivel de provinculum de la prodisconcha o concha larval, así como la posición del ligamento en relación con la charnela, fundamentando con estos caracteres los tres géneros de ostras válidos en la actualidad: Ostrea Linnaeus, 1758; Crassostrea Sacco, 1897, y Pycnodonte Fischer de Walheim, 1835. Algunos autores entre los que se puede citar a Yonge (1926), Graham (1949), Galtsoff (1964), Stenzel (1971), entre otros, han contribuido de manera importante a la revisión taxonómica de la familia Ostreidae; incluyendo a las principales ostras tanto fósiles como vivientes; sin embargo, es importante señalar que una clasificación no puede basarse exclusivamente por los caracteres conchológicos como se ha venido realizando, creando así una confusión desde los primeros intentos de clasificación hechos por Linnaeus (1758) y Lamarck (1801) y otros recientes como Ranson (1948-1960), Contreras (1932), Ramírez y Sevilla (1965). Estos últimos se refieren específicamente a los ostiones de las costas de México. Uno de los principales problemas en la sistemática de este grupo, es separar niveles genéricos los cuales hasta la fecha resultan confusos, como lo demuestran los diversos trabajos sobre ostras de México; basados en las características de las conchas. Sin embargo, los problemas que se presentan en la sistemática de diversos géneros y especies son el producto de similitudes y diferencias de sus características, que pueden variar con las condiciones del medio en el que se desarrollen, la acción hidrodinámica, los sedimentos en suspensión, la posición y naturaleza del sustrato de fijación, entre otros. Mc Lean (1941) estudió las variaciones en las conchas de las ostras y sus posibles relaciones con la disposición anatómica de las partes blandas, de tal manera que los ejes de simetría ocupan un lugar preponderante, especialmente los de la charnela y boca-ano para las partes blandas. Stuardo y Martínez (1976) y Castillo (1977) sugieren que el estudio de la concha, conjuntamente con el estudio anatómico de las partes blandas, y ecología inherentes a cada especie, constituyen una base sólida para el conocimiento y definición taxonómica de las mismas. En la actualidad, el campo de la investigación sobre ostréidos, ha encontrado apoyo en diversas disciplinas entre las que destacan la genétiea, ya que los componentes hereditarios ofrecen información en relación con el genotipo y a la vez ilustran sobre aspectos de especiación, distribución, dispersión e hibridación. Todo esto de vital importancia en la interpretación taxonómica y en la dinámica poblacional, como lo señala Rodríguez (1981) quien estudió el cariotipo de Crassostrea virginica, C. rhizophorae y C. corteziensis de las costas mexicanas. Teniendo en cuenta que el genotipo de un individuo se expresa en el fenotipo y éste puede variar dentro de los límites que le permita el primero como respuesta de adaptación al medio, se considera que una de las características más importantes, en las que se expresa un tipo de adaptación significativa a nivel de género y especie en las ostras es entre otros el sistema digestivo. El estudio anatómico de este sistema en las ostras, puede indicar con claridad las características adaptativas propias del género y especie, así como las diferencias y semejanzas, puntos de divergencia y caracteres evolutivos y, por ende, una ayuda para aclarar la incierta posición taxonómica de las especies que pertenecen a la familia Ostreidae. El presente trabajo tiene como objetivo fundamental el definir taxonómicamente las distintas especies que habitan las costas de México, basándose tanto en las características morfológicas de la concha como en el estudio anatómico de las partes blandas, lo cual resulta especialmente importante ya que comprende las principales diferencias morfoanatómicas que se presentan en las distintas especies así como su relación inmediata con otras especies dentro de la familia, aportando asimismo datos sobre su distribución y requerimientos ambientales de acuerdo a su estructura especialmente en lo que se refiere al tracto digestivo. ANTECEDENTES E IMPORTANCIALas ostras de la República Mexicana como en muchos otros países han sido objeto de estudios por tratarse de un recurso que desde hace muchos años ha contribuido a la alimentación. El hombre ha intervenido en su producción mediante técnicas de cultivo que actualmente precisan de una revisión debido a problemas relacionados con la contaminación en áreas ostrícolas. Además de considerar un reajuste en la aplicación de las técnicas ostrícolas, provenientes incluso de otros países adaptándolos a patrones estacionales de distribución de larvas, gradientes estacionales en los parámetros fisico-químicos óptimos para su desarrollo y reproducción, parásitos, así como sus adaptaciones ecológicas y anatómicas. Hasta hace pocos años, el estudio taxonómico de las ostras, ha estado basado en caracteres exclusivamente conchológicos como lo señalan: Vialov (1936), Thomson (1954), Sowerby (1871), Olsson (1961), Ranson (1948), Keen (1958,1971), Hertlein y Strong (1946), Hertlein (1951), Dall (1880), Abbott (1974), entre otros, de tal manera que se considera que existe un relativo desarrollo en el estudio taxonómico a nivel fisiológico y anatómico. Es importante señalar que aun existe controversia sobre el nombre genérico apropiado para el grupo de las ostras vivientes, incluyendo las de importancia económica (Castillo, 1977), considerándose que en la actualidad no existe un sistema uniforme para clasificación de las ostras (Stuardo et al., 1974). Ramírez y Sevilla (1965) efectuaron un estudio sobre las ostras de México con datos biológicos y planeación de cultivo, explicando las variables morfológicas de acuerdo con diferencias en el medio ambiente o condiciones ecóticas; indicando que la morfología de una ostra presenta variaciones intraespecíficas que deben considerarse para cada especie. Stauber (1947) y Loosanoff y Nomejko (1951) en su colaboración a estudios fisico- anatómicos, sugieren la existencia de razas fisiológicas en la ostra Crassostrea virginica (Gmelin), lo cual resulta un antecedente para aplicar a otras especies. Todo ello fundamenta un interés particular que ayuda a establecer con mayor exactitud los requerimientos biológicos más adecuados para el desarrollo de cultivos de las especies o subespecies. Estos estudios pueden aplicarse al potencial de hibridación de algunas razas, subespecies o especies. Según Contreras (1932), Ramírez y Sevilla (1965), Keen (1971) y Abbott (1974), existen 9 o 10 especies de "ostiones" distribuidas por las costas de México. Ramírez y Sevilla (1965), hacen referencia a la morfología externa de Crassostrea palmula, y detalles del aparato reproductor de C. cortedensis y C. virginica, este trabajo inició el estudio de la anatomía comparada de las ostras de México; Stuardo (1976) planteó la necesidad de llevar a cabo estudios anatómicos, y Castillo (1977) introduce una colaboración en el estudio anatómico de algunos ostreidos de las costas de México y Chile. En relación con los estudios de reproducción de las ostras Rogers y García-Cubas (1981), han aportado interesantes datos sobre la evolución gonádica de Crassostrea virginica en la Laguna de Términos, Campeche. Esta especie es importante para la costa del Golfo de México y aunque en las costas de E.U. ha sido ampliamente estudiada de acuerdo a su adaptación de ambiente regional, la información obtenida no puede aplicarse directamente a las áreas de México. Otras especies ampliamente estudiadas son: Ostrea edulis en Europa, Crassostrea ignativa del Japón y Corea, ambas especies han sido introducidas también en Francia, Gran Bretaña, Alemania del Este, Israel, Brasil, Sudáfrica, Australia, Nueva Zelanda, así como en las islas del Océano Pacífico incluyendo Hawai. En el presente trabajo se estudia la anatomía de las ostras existentes en las costas de México, independientemente de su importancia económica, incluyendo además algunas especies que habitan otros países con objeto de llevar a cabo un análisis comparativo a nivel anatómico considerando a géneros representativos de la familia Ostreidae tales como: Lopha, Ostrea y Crassostrea. El estudio taxonómico resulta importante, ya que permite aclarar las principales diferencias morfoanatómicas que existen entre las especies presentes en las costas mexicanas, así como su relación inmediata con otras especies dentro de la familia. MATERIALES Y MÉTODOSSe estudiaron un total de 12 especies de la familia Ostreidae, de las cuales 8 provienen de distintos puntos de las costas del Pacífico, desde la Bahía San Quintín, (Baja California), México, hasta el Archipiélago de Chiloé, Chile; 3 de las costas del Golfo de México y 1 del Indo-Pacífico. Las muestras fueron obtenidas por José Stuardo Barria, Alfredo Martínez Guerrero, Ramiro Román Contreras, José Angulo y Horacio Liedo. Las especies foráneas, no existentes en la colección del Instituto de Ciencias del Mar y Limnología, Universidad Nacional Autónoma de México (UNAM), se obtuvieron en préstamo y donación de las siguientes personas e instituciones: Joseph Rosewater, del National Museum of Natural History, Smithsonian Institution, Washington, D.C. USA; Kenneth J. Ross, Museum of Comparative Zoology, Harvard University, Cambridge, USA. Debido a las dificultades que implica llegar a una determinación específica basada exclusivamente en los caracteres conchológicos, las especies estudiadas se anotaron inicialmente dentro de los géneros considerados en la literatura, con objeto de someterlos posteriormente a un detallado estudio anatómico para confirmar su identificación sistemática válida. En el laboratorio, las partes blandas que incluían las conchas se conservaron en alcohol al 70 % y, previamente a su disección, se fijaron en formol al 50 % durante un mínimo de 8 días (pudiendo prolongarse en algunos casos) para obtener un adecuado endurecimiento de las mismas, y de esta manera facilitar su manejo para la disección, el estudio se dividió en 3 fases: A) Descripción de la Concha para el Reconocimiento de los Diversos Caracteres.Para tal efecto se siguió el criterio establecido por Stenzel (1971), considerando constantemente las once características siguientes: Tamaño de las valvas, máximo y mínimo en altura, longitud, espesor. Concavidad. Tipo de ornamentación. Presencia de pliegues en el borde. Coloración interna y externa. Posición y coloración de la impresión del músculo aductor. Características de la charnela. Características del resilífero. Profundidad del condróforo. Presencia y distribución de las comata. Impresiones de los músculos de Quenstedt. B) Descripción General de las Partes Blandas.Al remover las valvas y dejar al descubierto las partes blandas, se realizaron las siguientes observaciones: Tipo de adherencia del músculo de Quenstedt. Coloración externa. Presencia o ausencia de cámara promial. Características de los tentáculos del manto. Relación entre el tamaño del cuerpo y los palpos labiales y músculo aductor. Número de estrías en los palpos labiales. Número de estrías en las branquias. Relación entre el tamaño y posición de las branquias y el músculo aductor. C) Estudio Anatómico del Aparato Digestivo Bajo las Siguientes Observaciones.Posición y ubicación de la boca. Esófago (longitud y estructura interna). Número de ciegos gástricos y su posición respecto al estómago. Características de la cámara anterior y posterior. Forma de emersión del intestino desde el saco del estilo. Intestino (disposición de su recorrido hasta el ano). Grueso del intestino. Abertura del ángulo formado entre el rectoano y el saco del estilo. Emersión del tiflosol. Relación entre el tamaño del cuerpo y el músculo aductor. Relación entre el sistema digestivo y el músculo aductor. Todos estos caracteres se eligieron con el fin de cubrir satisfactoriamente el estudio anatómico comparativo y detallado de cada una de las especies, y poder establecer un criterio lo más acertado posible respecto a la posición sistemática de las 12 especies seleccionadas. La clasificación de las ostras basada en las características conchológicas y anatómicas, toma en consideración un amplio margen de variaciones en los individuos adultos, que a su vez responden también a una amplia gama de condiciones ecológicas. Sin embargo, como miembros de un status genérico dentro de la familia Ostreidae, existen determinados caracteres que destacan por el grado de similitud y diferencias. Con el fin de conocer esta relación, la taxonomía numérica propone obtener datos válidos del grupo taxonómico. La determinación del grado de similitud y diferencia entre las 12 especies en relación a las características de la concha y anatomía se realizó por medio de un análisis "cluster", se seleccionó al coeficiente de comparación simple expresado como: SMC = a+d/a+b+c+d = copresencia + conjunto de ausencia/ total de copresencias y conjunto de ausencias En el proceso de computación fue usado el: Program 46 Single-Linkage Cluster Analysis (Davies, 1971). Este proceso reúne en dos o más grupos a las unidades más o menos similares y diferentes basados en las características de mayor validez. El resultado se expresó en un agrupamiento, representado en dendogramas. RESULTADOS
MORFOLOGÍA GENERAL DE LAS OSTRAS
ConchaEl carácter distintivo de las conchas de los bivalvos es la presencia de 2 valvas calcificadas, unidas sobre la línea media dorsal por un ligamento flexible que forma el istmo con escaso carbonato de calcio y gran cantidad de proteínas. Estas valvas que constituyen una sola pieza, son el resultado de la adaptación morfológica efectuada durante la historia filogenética de la clase Bivalvia donde, a partir de la forma ancestral, la modificación básica involucra una comprensión lateral y elongación dorsoventral (Figs. 1 y 2). La forma de la concha de los bivalvos está relacionada con las actividades propias del animal. Las ostras, organismos sésiles carecen de mecanismos de locomoción una vez fijadas al sustrato. Presentan factores que determinan una amplia gama de características plásticas y variables en la forma y a veces en el tamaño, relacionados con el tipo de vida de un organismo adherido a un sustrato duro. Su forma por consiguiente, está determinada por sus hábitos de vida sedentaria, pero principalmente por razones filogenéticas y funcionales. De acuerdo con Stenzel (1971), los bivalvos sésiles tienden a presentar margenes redondeados con formas cilíndricas, cónicas o globulares tendiendo a desarrollar órganos dispuestos más o menos radialmente y a presentar una consistencia comparativamente gruesa, así como un mayor tamaño ya que estos factores a diferencia de los bivalvos móviles no afectan básicamente la forma de vida de la ostra. Galtsoff (1964), indica que Lison (1942) determina que la forma de la concha es considerada como una serie de arcos, que corresponden a la curvatura formada por espirales logarítmicos del mismo parámetro que tienen origen común: el umbo. 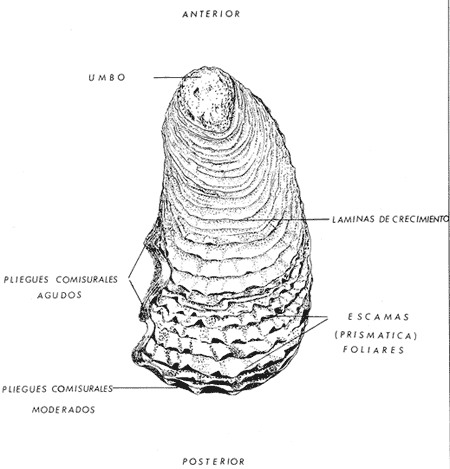 Fig. 1 . Características morfológicas externas de la concha en diferentes especies de ostión (concha tipo). La forma de las valvas analizada por Lison (1942) (citada por Owen, 1953) sigue como referencias 1) el margen de la curva generadora, 2) el ángulo espiral del eje normal, y 3) la forma del eje normal. Por otro lado, las branquias también influyen en la forma de las conchas, y proporcionalmente más en las ostras que en aquellos bivalvos que presentan un pie, esto se manifiesta en los márgenes de las valvas anterior y ventral que son casi paralelos a los márgenes distales. Stenzel (1971), considera este carácter típico de todas las ostras, pero indudablemente este no es el caso de algunos Lophinae (como Lopha, Agerostrea, Rastellum) y algunos Gryphaeidae fósiles donde la forma general de la concha sigue la de las branquias; es decir, los bordes dorsal y ventral de la concha son paralelos al eje de las branquias. Otro tipo de influencia del sustrato se manifiesta en la configuración de la superficie externa de una valva, que imita perfectamente la configuración del sustrato bajo la otra valva, lo que es denominado por Stenzel ( 1971 ) como xenomorfismo. Seg ún este autor y otros que han discutido el fenómeno está restringido a la región umbonal de la valva derecha; obviamente se trata de una condición no hereditaria bien ejemplificada en algunas especies que se fijan a octocoralarios, condición que sin embargo, no debe confundirse con la aparición de pliegues más o menos grandes en la comisura de las valvas, carácter de origen genético, como ocurre en especies de Rastellum, Agerostrea, Lopha megodon, L. cristagalli y L. frons, entre otras. 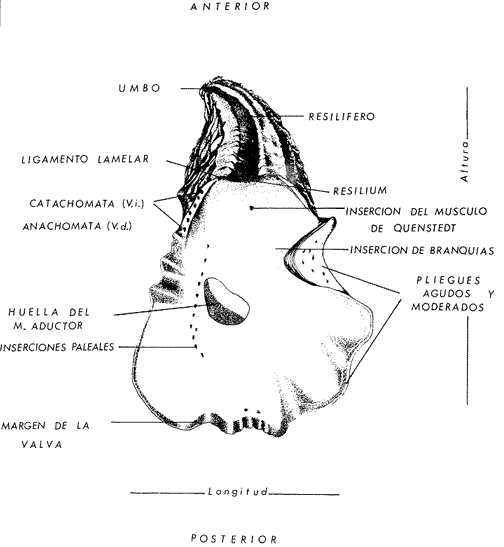 Fig. 2. Características morfológicas, internas de la concha en diferentes especies de ostión (concha tipo). Con respecto a las características de tamaño, se señala a Saccostrea cuccullata (Von Born, 1778) como a uno de los ejemplares más grandes según Awati y Raí (1931) (32 a 76 cm) entre ostréidos de la India. Indudablemente existen especies de talla pequeña, cuyos patrones genéticos no permiten el desarrollo de ejemplares de gran tamaño como L. frons (hasta 59 mm de al tura) y otros como Crassostrea iridescens (hasta 200 mm de altura). El crecimiento ha ocupado un lugar importante en los bivalvos en general. Thompson (1942), Lison (1942), Stasek (1963), Owen (1953), Orton (1923) y Huxley (1932) han proporcionado diversas hipótesis sobre los patrones de crecimiento. El estudio de la forma de crecimiento de los bivalvos, es aún confusa y no presenta un panorama suficientemente claro que proporcione datos precisos entre el fenómeno básico de secreción de la concha propia y la generación de las células del manto (Carter, 1968). En general la forma de la concha de los bivalos, presenta aspectos diferentes de acuerdo a sus características ecogenéticas, y específicamente en los ostreidos, ese factor depende de un sustrato que influirá directamente durante su ontogenia después de la fijación sobre la morfología de la valva izquierda e indirectamente sobre la valva derecha, Wilbur y Jodrey (1955) opinan que el crecimiento propio de las valvas presenta una variación muy amplia; sin embargo, deben existir límites dentro de esas variaciones -de amplio espectro- determinadas por diversos factores como son el sustrato, tipos de desarrollo debidos a las condiciones ambientales abióticas, así como acciones químicas que las gobiernan y determinan la talla, consistencia y composición del organismo. El análisis matemático de las valvas ha sido un instrumento que ha tratado de conducir más claramente los procesos de formación y patrones de crecimiento. Sporn (1926) llegó a la conclusión de que la curvatura de la concha es una conformación geométrica. Posteriormente, Lison (1942) al estudiar estas curvaturas mediante análisis matemáticos os, dedujo que la forma de crecimiento de las valvas corresponde a un incremento de curvatura (sobre el margen) dado por espirales basadas en el mismo parámetro que tiene en el umbo desde su origen común. Por otro lado, Owen (1953) sugiere que la dirección del movimiento de crecimiento, está dada por: a) una componente radial que parte del umbo, actuando en el plano de curvatura generadora, b) una componente transversal, que actúa hacia el ángulo recto o el plano de la curvatura generadora y tangencial a él. Sin intención de profundizar en este tema se considera que durante la formación de la concha de los ostreidos, existen cambios de forma debidos a variaciones en el gradiente de crecimiento sobre la curva generadora de cada valva y del manto. Impresiones muscularesMúsculo aductor. El proceso de cambio a la condición monomiaria, propia de los ostreidos, empieza en los Heteromiarios dando como resultado la carencia de un músculo aductor y una clara reorganización de las partes blandas. Se considera que a través de este proceso se originó la posición de los ejes del cuerpo, conformándose redondos (la cementación es ajena a este proceso) mientras que los órganos del cuerpo se disponen alrededor del músculo aductor, así como la falta de adherencia paleal característica de las condiciones monomiarias. Se asume naturalmente que todas las ostras son monomiarias, es decir, tienen sólo un gran músculo aductor, excepto en el estadio larvario donde aparece como en los otros bivalvos un músculo anterior y otro posterior. Aún entre las ostras más antiguas que han sido descritas hasta ahora, no se conoce la presencia o vestigio del aductor posterior (Stenzel, 1971). Los estudios de metamorfosis tampoco dejan dudas de que el músculo aductor existente corresponde al posterior de los bivalvos dimiarios. El músculo aductor está subdividido en dos partes denominadas músculo de contracción rápida en su parte anterior (color blanco amarillento y semitranslúcido) y músculo de contracción lenta que compone la parte posterior (de color blanco amarillento opaco y oscuro). Esta diferenciación no ha encontrado explicación taxonómica clara y por lo tanto no fue objeto de un examen detallado en este estudio. De gran importancia, sin embargo, es su forma y tamaño y la consiguiente impresión o huella que dejan sus inserciones en cada valva. Según Stenzel (1971) el género Ostrea tiene un músculo de contracción rápida más grande que Crassostrea y Saccostrea, y Hyotissa lo tendría menor; sin embargo, esta diferencia sería válida sólo entre las especies recientes, ya que estas características no se distinguen claramente en las especies fósiles. Entre las especies correspondientes a los géneros Lopha, Crassostrea y Ostrea aquí estudiadas, no se encontraron diferencias proporcionales apreciables. Respecto a su posición, Stenzel (1971) señala las siguientes diferencias: 1. El músculo aductor es más central en las es pecies de mayor talla de Ostrea s.s. que en otras. 2. Crassostrea lo tiene más cercano a las mar genes posterior y dorsal de las valvas. 3. Arctostrea y Rastellum tienen la impresión muy próxima a la charnela. 4. Los Gryphaeinae y Pycnodonteidae tienen la impresión más cercana a la charnela que al margen posterior de las valvas. En términos generales, estas diferencias fueron corroboradas en las especies estudiadas, salvo en Ostrea angelica y O. lurida en donde el músculo aductor se encuentra localizado hacia el margen posterior como en el caso de O. chilensis. Las especies del género Lopha aquí estudiadas, presentan el músculo aductor desplazado hacia el margen dorsal, casi adosado a él, en posición central anterior como en L. megodon, y más cercano a la charnela que en los géneros Ostrea y Crassostrea. Stenzel (1971) también diferencia dos grandes tipos de impresión muscular que él ha denominado el tipo cóncavo y el tipo convexo u orbicular. I. Al primero pertenecerían las siguientes formas: 1, Creciente (o de luna creciente) 2. Semilunar 3. De coma 4. De cinta 5. Reniforme (arriñonado) II. Al tipo convexo u orbicular: 1. Circular 2. Oval vertical 3. Oval horizontal 4. Oval oblícua Aparentemente, estas últimas cuatro formas del tipo convexo u orbicular serían características sólo de Gryphaeidae. Al respecto, la mayoría de las especies aquí estudiadas, caen dentro del tipo I; sin embargo, la especie Lopha megodon, representa un tipo de impresión intermedio que quizá sea más útil considerar en relación a los ejes primarios del cuerpo, que a su forma, como se discute más adelante. Músculos de Quenstedt. Están integrados por un par de pequeños haces musculares, adheridos por un lado a la región adoral de las branquias y por el otro a la superficie de las valvas, cuyas diminutas cicatrices o impresiones quedan ubicadas entre la charnela y el músculo aductor (Fig. 2). Ni su homología ni su función se han entendido claramente, Dall (1880) sugirió su homología con los m úsculos pedales de los bivalvos dimiarios, opinión que es compartida por Stenzel (1963, 1971). Otros autores los han interpretado como vestigios del músculo aductor anterior. Esta última interpretación es errónea según Stenzel (197L), pero igualmente errónea puede ser su identificación con los músculos pedales. La mayoría de los bivalvos presentan inserciones musculares de las branquias, que posiblemente sean homológos a estos músculos, es decir, que forman parte de una musculatura branquial común a todos los bivalvos y descritas para los Anisomiarios típicos como los Mytilidos y los Dimiarios propiamente dichos. En las especies estudiadas se encontraron impresiones claras de estos músculos en las conchas de Lopha megodon, L. frons, Crassostrea iridescens, C. palmula y Ostrea lurida. En las otras especies no se apreciaron con claridad. Su identificación en las partes blandas es difícil, una vez que éstas se han separado de las conchas ocupan una posición relativamente similar en las distintas especies, por lo que no se consideró necesario profundizar en su estudio por no presentar características claras, lo suficientemente diferenciables de posible valor taxonómico. Cavidad del MantoForma La forma de las partes blandas en las especies de ostréidos, se caracteriza por una compresión dorso-ventral entre los lóbulos derecho e izquierdo del manto, dando lugar a una cámara cuya función principal es cubrir básicamente a manera de protección los órganos de alimentación y reproducción. Los conductos excretores, genitales y de la masa visceral, vierten también a la cavidad del manto, sin olvidar que existen muchos ejemplos en donde los huevos son fertilizados, y retenidos en esta área durante los primeros estadios de desarrollo, su forma general refleja la morfología de la concha, y de acuerdo a ello Ostrea y Crassostrea presentan el aspecto semilunar y ovalado que no demuestra características específicas. En las especies del género Lopha por el contrario, la forma presenta características bien diferenciables: es larga y semilunar en L. cristagalli, semílunar en L., megodon y rectangular alargada en L. frons. Existen también diferencias claras en los bordes del manto, que forma pliegues a manera de festones que reflejan a su vez los pliegues de la concha. Indudablemente, la estructura anatómica de las ostras (removidas de las conchas) al ser observada en su forma general, presentan características uniformes; sin embargo, bajo un estudio minucioso y detallado, empiezan a sobresalir las diferencias. Elsey (1935) y Thomson (1942) indicaron la importancia de la ostia en la diagnosis taxonómica de los ostréidos; Castillo (1977) se refiere al número de ranuras en palpos y branquias, posición de las branquias con respecto al músculo aductor, presencia de cámara promial (tomada en cuenta por Olsson, 1938) y pliegues del manto. En este trabajo, se hace énfasis sobre la posición de la fusión paleobranquial y características de posición y forma de los tentáculos del manto. Estas difererencias son evidentemente sobresalientes, lo que las hace importantes dentro de las características taxonómicas. Manto. El manto constituye la parte externa que cubre las partes blandas y a su vez encierra casi completamente la masa visceral de las ostras. Forma dos lóbulos denominados "lóbulos del manto o paleales", libres en todas las ostras a lo largo de los márgenes mencionados. Morfológicamente se encontraron diferencias en los pliegues del manto de la concha. En las especies de Lopha, son más numerosos en L. cristagallí que en L. megodon y escasamente marcados en L. frons.  Fig. 3. Características de la cavidad del manto y branquias de la ostra. El color de la superficie del manto, después de remover la concha, es muy variable dentro de un margen que va desde blanquecino pardo, pasando por amarillo cremoso (características en ostras a punto de desovar) a verde oliváceo o púrpura (característico de localidades con alto contenido de cobre o por alto contenido de pigmento de algas azulverde en el medio) (Galtsoff, 1964) el cual se observa principalmente en C. rizophorae coincidiendo con el tipo de sustrato de mangle rojo; lo mismo sucede para L. frons con su concha y sustrato de gorgoniáceos. Algunas técnicas han adoptado el criterio empírico sobre los diferentes estadios gonadales, observados in situ basándose especialmente en el color y tamaño, además de otras características propias de la gónada. Por lo anteriormente mencionado, el manto se ha considerado por observaciones empíricas, como un indicador de las condiciones generales del molusco. Internamente, los bordes laterales del manto en todos los bivalvos, dejan un espacio denominado cavidad del manto, generalmente subdividida en cavidades virtuales o reales que reciben diferentes nombres. Se refieren en este trabajo a la cámara promial y a las cámaras inhalantes y exhalantes. Primitivamente, la cavidad del manto se comunicaba con el exterior, por una abertura extensa en la pared media, por ejemplo: en los géneros Glycymeris y Arca. Esta hendidura se hace más extensa en formas monomiarias como Ostrea, Pinctada y Pecten, así como en muchos miembros de los Anisomiaria. Cámara Promial. La cámara o pasaje promial es el espacio que separa el lóbulo derecho del manto, de la masa visceral, se ubica sobre la región pericárdica entre el músculo aductor y la charnela. Esta hendidura corre a lo largo del istmo del manto por la parte media dorsal hacia el músculo aductor, formado un gran espacio entre el lóbulo del manto derecho y la masa visceral, gónada y cavidad pericárdica. La cavidad o cámara promial, sólo se forma sobre el lado derecho del manto, ya que del lado izquiero éste va adherido sobre la gónada. Dicha cámara promial fue observada en primer término por Kellogg (1892); posteriormente Nelson (1938) y Elsey (1935) las señalan para Crassostrea virginica y C. gigas. Este carácter anatómico resulta de primordial importancia, desde Olsson (1961) ya que ha sido tomado en cuenta para la separación de dos de los géneros más importantes de la familia Ostreidae: Ostrea que no presenta cámara promial y Crassostrea con cámara promial (Fig. 3). Respecto a su función, son muchas las opiniones que diversos autores han dado, entre las que destacan: 1) Contribuir a descargar el esperma proveniente del gonoducto derecho. 2) Ayudar en parte a despejar el agua que ha participado en la oxigenación de las branquias. 3) Posibilidad de alguna relación entre la cámara promial y las demibranquias del lado derecho. 4) La presencia de cámara promial característica del género Crassostrea que habita en aguas costeras salobres, utilizan dicha cámara para tolerar grandes cantidades de sedimentos en suspensión y funciona como mecanismo de limpieza. Menzel (1955) considera a la cámara promial como una adaptación estructural que permite un gran flujo de agua, participación en el saneamiento interno y por tal motivo evita que la cámara exhalante se invada de sedimentos. Después de estas aseveraciones, aún su función prioritaria está en duda. Otra característica del manto para las especies de Ostrea (observadas para las costas mexicanas) son las líneas radiales que se presentan a lo largo del manto, conduciéndose principalmente hacia los bordes posteriores y ventrodorsales, por una línea casi paralela conspícua en algunas especies como Crassostrea virginica y, C. gigas. Thomson (1954) comenta que esta línea puede variar de intensidad o estar ausente. El borde del manto tiene 3 pliegues de los cuales el externo es liso a manera de banda, en muchas ocasiones pigmentada. Los bordes interno y medio presentan tentáculos que difieren entre las diferentes especies. Thomson (1954) los considera como parte importante en la diagnosis a nivel de especie (para el estudio detallado de estos tentáculos es recomendable efectuarlo cerca de la fusión paleobranquial, donde se presentan más notorios) (Fig. 3). Los 3 pliegues se encuentran bien representados en el borde del manto de las especies estudiadas; sin embargo, Hirase (1930) referido por Thompson (1954) encontró sólo 2 para especies japonesas. Thompson después de un minucioso estudio particularmente en especímenes de Crassostrea gigas introducida del Japón a Australia, encontró 3 pliegues típicos en el borde del manto a diferencia de los que indica Hirase (1930), por lo que propone un reexamen para ésta y otras especies japonesas. Este trabajo apoya la observación hecha por Thomson en C. gigas también introducida a Baja California Sur, México (Lám. 1). Función del Manto. Las corrientes ciliares a lo largo de las superficies internas del manto, forman un patrón definido que puede ser fácilmente observado, la dirección general de estas corrientes va desde la base del manto hacia su periferia (Galtsoff, 1964) por lo que el comportamiento del margen del manto se considera como un mecanismo regulador que controla el flujo de agua. Por otra parte, el manto tiene músculos radiales, vasos sanguíneos y nervios que pueden ser observados en claridad a través de una fuerte iluminación por transparencia o mediante colorantes vía aparato circulatorio. Cámara Inhalante. También llamada incurrente o infrabranquial es la de mayor tamaño está situada a los lados derecho e izquierdo del cuerpo y aparece delimitada lateralmente por los dos lóbulos del manto. En su parte proximal incluye a las branquias, la boca y los palpos labiales, mientras que el resto sigue la forma a general del cuerpo, terminando por arriba en el istmo del manto y posteriormente en la fusión paleobranquial. Fuera de las variaciones imprecisas en su longitud, no hay otras diferencias aplicables a los distintos géneros. Cámara Exhalante. Excurrente o suprabranquial, es más compleja que la anterior. Incluye un pasaje eloacal detrás del músculo aductor , que recibe ventralmente las secreciones de los riñones y los productos genitales y dorsalmente los desechos evacuados por el ano. Incluye además los 2 pasajes branquiales encerrados entre la pared de la masa visceral y las 4 lamelas de cada branquia. Dorsalmente puede considerarse que forma parte de la cámara exhalante, quedando el espacio encerrado entre los lóbulos del manto y la parte dorsal del aductor. En esta región se vacía el agua proveniente de la cámara promial en los grupos que la presentan. Su extensión depende en las distintas especies de la posición más o menos adelantada del aductor. Branquias o Ctenidios. Las branquias en las ostras, están formadas por 4 láminas denominadas demibranquias, suspendidas en su parte dorsal por la región ventral de la masa visceral. Estas 4 demibranquias están unidas en 2 partes, por el eje de la branquia que constituye el tejido conectivo y músculos propios de la región. (Fig. 3). Cada demibranquia tiene forma de V con su lamela ascendente y descendente. Las 4 demibranquias toman la forma de W, separadas tanto por su lado izquierdo como el derecho, por un septo o canal. Cada demibranquia a su vez presenta un gran número de lamelas o laminillas, las cuales fueron cuantificadas en cada una de las especies estudiadas. Cada lamela está constituida por un gran número de filamentos tubulares que según Galtsoff (1964) varían de 10 a 16 en Crassostrea virginica. La función ciliar de las branquias es muy importante y corresponde a otros estudios detallados, ya que existen especulaciones sobre el origen y posición basal de las células ciliadas a lo largo de las membranas donde aparecen. Hasta ahora no se han descrito diferencias morfológicas notables entre las branquias de los diferentes géneros y especies de ostras; sin embargo, en el presente estudio fue tomada en cuenta su disposición frente al músculo aductor, así como su curvatura y relación con respecto a la forma general de la concha. Una de las características sobresalientes, fue la que presentaron las branquias de Lopha megodon y L. cristagalli con lóbulos similares a los del borde del manto y comisura de la concha. A continuación se presenta la descripción básica de la concha y la anatomía de la cavidad del manto, branquias y sistema digestivo de las especies de la familia Ostreidae estudiadas (Fig. 4). 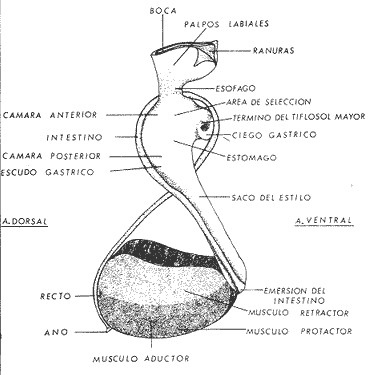 Fig. 4. Morfología del sistema digestivo y músculo aductor.  CLAVE DE LAS ABREVIATURAS PARA LA LECTURA DE LAS LAMINAS TAXONOMÍA
SUBORDEN OSTREINA FÉRUSSAC, 1822
SUPERFAMILIA OSTREACEA RAFINESQUE, 1815
FAMILIA OSTREIDAE RAFINESQUE, 1815Incubadoras o no incubadoras. La charnela de la prodisconcha de las larvas planetónicas lleva en cada valva 4 dientes precursores casi iguales y su correspondiente alvéolo divididos en dos grupos iguales por un área mediana lisa. Pasaje promial presente en los géneros no incubadores y ausente en los incubadores. El intestino pasadorsalmente al pericardio y no atraviesa el corazón. El músculo aductor posterior es reniforme o semicircular en sección transversal, ubicado casi centralmente o muy cerca del margen de la valva y opuesto a la charnela; su inserción sobre la valva inferior no es elevada. Las valvas son casi iguales o muy desiguales, con áreas de fijación grandes o pequeñas, sin surcos radiales posteriores. La cavidad umbonal varía entre muy profunda, poco profunda o ausente; comúnmente con cámaras. La capa prismática de la concha puede ser conspícua. Varios géneros son eurihalinos y otros habitan aguas salobres. Muchos forman agregaciones comunitarias muy densas. Triásico superior a reciente (Stenzel, 1971). SUBFAMILIA LOPHINAE VYALOV, 1936
GÉNERO LOPHA RÖDING, 1798Lopha Röding, 1798. (tipo Mytilus cristagalli Linnaeus, 1758; por designación subsecuente: Dall, 1898). Alectryonia Fischer de Waldheim, 1807. (tipo A. rara = Mytilus cristagalli por designación subsecuente: Gray, 1847). Dendostrea Swainson 1835. (tipo Ostrea folium Linnaeus, 1758 por designación subsecuente: Herrmanssen, 1847. Ostrea (Pretostrea) Iredale, 1939. (tipo O. (P.) bresia) = Lopha cristagalli (Linnaeus). Diagnosis. Ostréidos de tamaño pequeño a mediano (hasta 11 cm en longitud); ambas valvas convexas, desiguales con 6 o más de 50 pliegues radiales agudos, cuyo patrón no varía mucho en cada subgénero. Triásico a reciente. La mayoría son tropicales y subtropicales, de distribución mundial (Stenzel, 1971). Observaciones. Este subgénero fue subdividido según Stenzel (1971) en tres subgéneros: Lopha s.s., Abruptolopha Vyalov, 1936 y Actinostreon Bayle, 1878. 1. Lopha cristagalli (Linnaeus, 1758)Mytilus cristagalli Linnaeus, 1758. Syst. Nat. Ed. 10, 1: 704; Dillwyn, 1877. Descrip. Cat. Rec. Shells. 299; Wood, 1828. Index test.: 12, fig. 1 (fide Thomson, 1954). Ostrea crista-galli (Linnaeus) Chemnitz, 1786. Conch. Cab. 9: 150, lám. 116, fig. 998; Schumacher, 1817. Essal nouv. syst.: 109; Lamarck, 1819. Hist. Anim. s. vert., 6 1° p.: 213; Deshayes 1830. Encycl. Méth., Vers., 2: 299; Küster, 1845. Conch. Cab. 2a. ed.: 80, lám. 11, figs. 2-3 y lám. 13, fig. 4; Chenu, 1847. Ilustr. Conch., Ostrea, lám. 3, fig. 2-2a; Hanley, 1856. Cat. Rec. Biv. Shells: 308; Sowerby, 1871. In: Reeve, Conch, Icon., 18 Ostrea lám. 11, fig. 22 a-b; Dautzenberg, 1893. Bull. Soc. Zool. France, 18: 84; Pilsbry, 1985. Cat. Mar. Moll. Japan coll. Stearms: 146 y 184; Hedley, 1899. Mém. Austral. Mus., 3: 495; Hidalgo, 1905. Cat. Mol. Filipinas, Rev. R. Acad. Cienc. Madrid. 3:42; Lamy, 1909. Mém. Soc. Zool. France, 22: 341; Hedley, 1909. Austral. Assoe. Adv. Sej.,: 345; Lamy, 1924. Bull. Mus. Hist. Nat. 30: 317; Lamy, 1925. Ibid., 31: 256; 1930. Jour Conchliot., 73 (4): 254; Hirase, 1930. Jap. J. Zool., 3 (1): 19, figs. 31-34; Dodge, 1952 Bull. Amer. Mus. Nat. Hist., 100 (1): 190, 191, 205. Lopha cristagalli (Linnaeus) Bolter, 1798. Mus. Boltenianum 11: 9; Vyalov, 1936. C.R. Acad. Sej. URSS, n.s. 13, 4 (1), (105): 19; Stenzel, 1947. Jour. Paleont. 21 (2): 177; Iredale, 1939. Sej. Rep. Gr. Barrier Reef Exped. 5 (6): 401; Alla, 1950. Australian Shells: 273, lám. 30, fig. 19; Kira, 1962. Shells in Pac. 1: 144, lám. 52, fig. 7: Stenzel, 1971. Treat. Invert. Paleontol., 3 (parte N, Moll. 6): 158, fig. 1. 129. Ostrea (Lopha) cristagalli (Linnaeus) H. y A. Adams, 1858. Gen. Rec. Moll., 2: 569; Dall, 1898. Tert. Fauna Florida: 672. Ostrea cristagalli (Linnaeus) Cox, 1883. Proc. Linn. Soc. N.S.W. 7 (1): 131; Ranson, 1960. Bull. Inst. Oceanogr. Mónaco (1183): 25, figs. 73-76. Localidad tipo. Océano Índico (no se encontró en la bibliografía la localidad específica). Distribución geográfica. Indo Pacífico tropical, desde las islas Amami, Japón, hacia el sur (Kira, 1975). Hábitat. Se les encuentra en agregaciones unidos unos con otros por una porción de su superficie y sobre madréporas adheridas por proyecciones semejantes a lóbulos (Sowerby, 1871). Material estudiado. 1 ejemplar, Isla Rongelap, islas Marshall, Pacífico. Col. Brook no. 172224. Morfología de las valvas. Concha pequeña o mediana (hasta 110 mm de longitud), de forma generalmente casi cuadrada, variando desde algo globular a irregular. Charnela amplia, aplanada. Valvas convexas, equivalvas, con 6 a 9 y ocasionalmente 12 pliegues radiales amplios, agudos, profundos que continuan desde la charnela hasta el punto más alejado de ella. Superficie de ambas valvas cubiertas por granulaciones pequeñas y redondeadas, casi todas de igual tamaño, dispuestas en filas paralelas radiales. Sin escamas de crecimiento imbricadas. Con espinas hióticas huecas, recurvadas, originándose intermitentemente de las crestas de algunos pliegues, algunas de las cuales en la valva izquierda (inferior), como cuernos, pueden servir para adherirse al sustrato. De color púrpura, café púrpura y raramente blanco violáceo hacia los márgenes. Anatomía descriptiva del sistema digestivo. Boca en el extremo anterior, entre los dos pares de palpos labiales en forma de herradura. Esófago comprimido dorso-ventralmente, con varias canaladuras transversales internas. El estómago es alargado de forma irregular, ciego gástrico prominente; dirigido hacia el lado derecho; opuesto a éste se encuentra el capuchón (que incluye el área de selección) de mucho menor tamaño. Cámara anterior conspícua. Saco del estilo de mayor longitud que el estómago y casi tan grueso como él. Por la parte media inferior del saco emerge el intestino, amplio en su inicio, que asciende lateralmente pasando por la parte posterior del estómago y desciende ventralmente para terminar en recto y ano. El músculo aductor es muy grande en relación con el sistema digestivo (Fig. 5, Lám. 2, figs. a y b). Observaciones. Thomson (1954) en una revisión de las especies australianas, considera que Mytilus cristagalli Linnaeus, Ostrea folium Linnaeus y O. bresia Iredale son ecomórfos de una sola especie polimórfica. Sin estudios anatómicos profundos, Thomson (1954) basa su criterio sólo en observaciones de la concha y aparentemente de algunos rasgos externos de las partes blandas (tentáculos, branquias y ano) aunque és tas no son discutidas comparativamente. Autores posteriores (Stenzel, 1971) han aceptado el punto de vista de Thomson considerando menor el valor de otras estructuras morfológicas internas no estudiadas por ellos. 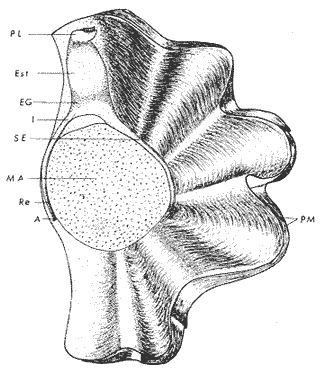 Fig. 5. Lopha cristagallí. Vista lateral de las partes blandas mostrando por transparencia del manto la posición de los palpos, masa visceral, saco del estilo y recto. El ejemplar de Lopha cristagalli estudiado se diferencia de L. frons por su gran tamaño, por el número de pliegues de la concha y por una serie de características anatómicas externas, entre las cuales se destacan: a) en L. cristagalli las estrías de la superficie interna del palpo cubren sus dos terceras partes y son numerosas, mientras que en L. frons las estrías cubren toda la superficie y su número es menor; b) en L. cristagalli el intestino emerge de la porción terminal ventral del saco del estilo directamente, mientras que en L. frons emerge formando un gancho; e) en L. cristagalli el eje anteroposterior del aductor es casi paralelo al eje estómagoestilo, y en L. frons estos ejes son oblicuos; d) en L. cristagalli el ciego gástrico es de mayor tamaño que en L. frons; e) en L. cristagalli el aductor es grande, exageradamente ancho, y en L. frons el tamaño comparativo con respecto al sistema digestivo es similar al patrón común de los ostréidos. 2. Lopha frons (Linnaeus) Lámina 3, figuras a, b, c y dMytilus frons Linnaeus, 1758. Syst. Nat., Ed. 10: 704, Hanley, 1855. Ipsa Linn. Conch.,: 137; Hanley, 1856. Cat. Rec. Biv. Sh.,: 307. Ostrea fons Chemnitz, 1785. Conch. Cab., 8,: 3 vignette 12, lit. 1: 61, lám. 75, fig. 686; Dillwyn, 1817. Descr. Cat. Rec. Shells, 1: 301; Küster, 1845. Conch. Cab., 2a. éd.,: 82, lám. 11, fig. 4; Hanley, 1854. Conch. Miscell., Ostrea, lám. 2, fig. 5; Sowerby, 1871. In: Reeve, Conch. Icon., lám. 19, fig. 41 a, e; Dall y Simpson, 1902. Moll. Puerto Rico, Bull. U.S. Fish. Comm., 20 (1900): 464; Dall, 1925. Proc. U. S. Nat. Mus., 66: 23; Larny, 1930. Jour. Conchyliol. 73 (4): 248; Abbott, 1954. American sea shells: 373, lam. 38, fig. c. Ostrea rubella Lamarck, 1819. Anim. S. Vert., 6: 210; Deshayes, 1830. Encycl. Méth., Vers, 2: 300; Deshayes, 1836. In: Lamarck, Hist. Anim. s. Vert., 2a. ed., 7: 231; Deshayes, 1836. In: Cuvier, Régne Anim., Moll., lám 72, fig. 2, 2a; Lamy, 1924. Bull. Mus. Hist. Nat., 30: 235. Ostrea limacella Lamarck, 1819. Hist. Anim. s. Vert., 6: 211; Deshayes, 1836. Anim. s. Vert., 2a. ed., 7: 231; Larny, 1924. Bull. Mus. Hist. Nat. 30: 236. Ostrea erucella Lamarck, 1819. Anim. s. Vert., 6: 211; Deshayes, 1836. Anim. s. Vert., 2a. éd. 6: 231; Larny, 1924. Bull. Mus. Nat. 30: 236. Ostrea folium Reeve (non L.) 184 1. Conch. System., 1: 169, lám. 121, fig. 3. Ostrea (Lopha) frons H. y A. Adams, Cen. 1858. Rec. Moll. 2: 569; Dodge, 1952. Amer. Mus. Nat. Hist. Bull. 100 (1): 190. Lopha frons Abbott, 1974. American sea shells, 2a. éd.: 457, lám. 22, figs. 5279-5279 a. Localidad tipo. Indias occidentales (?). Distribución geográfica. Florida, Louisiana, Bermudas, Golfo de México y Caribe hasta Brasil. Hábitat. Viven en zonas de mareas en poblaciones muy abundantes o en el horizonte superior del infralitoral semisumergidas, pero también se encuentran sobre raíces de mangle en algunos esteros o estuarios. Material estudiado. 9 ejemplares y 12 valvas. 22-29 mm altura. Florida., E.U. Morfología de las valvas. Concha frecuentemente alargada a veces oval; en el primer caso, más amplía en la parte anterior y central; equivalva y delgada. Mide hasta 60 mm de altura. Charnela estrecha, área ligamental ancha, resilífero elevado. Valvas convexas. Escultura radial bien marcada, formando numerosos pliegues bajos, redondeados a lo largo de sus bordes. Superficie de la valva izquierda con proyecciones alargadas, tubulares, que le sirven para fijarse a raíces de mangle o ramas de gorgónidos. Margen interno con comata. Huella del aductor en forma de coma, ubicada muy próxima a la charnela, color café rojizo o café púrpura; interior blanco nacarado o verde amarillento, con el reborde interno de las valvas de color café rojizo o púrpura (Lám. 3, figs. a, b. c y d). Anatomía descriptiva de la cavidad del manto. Forma alargada o subcircular color rojizo o púrpura, el borde del manto puede presentar grandes prolongaciones como se muestra en la Lámina 4. El extremo anterior de las branquias se une por una base acanalada a los palpos labiales. Las branquias presentan un promedio de 107 ranuras branquiales, pasaje cloacal amplio, ostiolo pequeño. Presencia de cámara promial (Lám. 4, fig. a). Anatomía descriptiva del sistema digestivo. Boca en el extremo anterior, entre los dos pares de palpos labiales en forma de herradura muy abierta. Esófago comprimido casi lateralmente, más ancho cerca de la boca, con una constricción en forma de cinturón acanalado. El estómago es de forma irregular; ciego anterior dirigido posteriormente y conspícuo. Saco del estilo de mayor longitud que el estómago, termina hacia la matan ventral del músculo aductor, donde emerge el intestino formando un gancho, asciende por la parte ventral del saco y cruza el lado izquierdo a la altura de la mitad del estómago y desciende ventralmente formando una gran asa que termina en recto y ano como un ápice vermiforme. Músculo aductor grande en relación con el sistema digestivo (Lám. 4, figs. b y c). Observaciones. En este trabajo se sigue a diversos autores (e. g. Abbott, 1974) al considerar a Lopha frons como una especie del Atlántico tropical occidental, conclusión que es reforzada por las diferencias anatómicas discutidas para la especie anterior. 3. Lopha megodon Hanley (1846) N.v. "Ostión de dientes grandes" Lámina 5, figuras a, b, e y dOstrea megodon Hanley, 1845. Proc. Zool. Soc. London pt. 13: 106, lám. 13; (emitida en febrero, 1846). Hanley, 1856. Cat. Rec. Biv. Shells: 309; H. H. y k Adams, 1858. Gén. Rec. Moll., 2: 568; Carpenter, 1864. Brit. Assn. Adv. Sej. Rept. para 1863; 528 y 668; Sowerby, 1871. In: Reeve Conch. Icon., 18 Ostrea: sp. 24 lám. 12, fig. 24 a, b; Dall, 1898. Tert. Fauna Florida: 685, 3 (4): 685; Dall, 1909. Proc. U. S. Nat. Mus., 37: 148 y 225; Lamy, 1910. Moll. rec. Rivet Payta, 9: 86; Dall, 1914. Nautilus 28 1; 1921. ln: Orcutti, West American Scientist, 19; 23; Jordan, 1926. Proc. Calif. Acad. Sej., Ser. 4, 15: 244: Jordan y Hertlein, 1926. Ibid. 15: 427-428, lám. 28, fig, 1; Hanna y Hertlein, 1927. Ibid, 16: 141 (fide Hertlein, 1931); Lamy, 1930. Jour Conchyliol. 73 (4): 256; Hertlein, 1931. San Diego Soc. Nat. Hist. 1: 150; Contreras, 1932. An. Inst. Biol.: 211 figs. 24-25; Smith, 1944. Panamic Marine Shells: 51, fig. 692 k; Hertlein y Strong, 1946. Zoologica, 31 (5): 55; Durham, 19.50. Mem. Geol. Soc. Amer. (43) pt. 2: 59, lám. 5, fig. 3; Sevilla, - Ostión Guaymas: 16, 17 figs.: 14; Ramírez y Sevilla, 1965. Ostras de México: 35, fig.: 33; Dushane y Poorman, 1967, Veliger 9 (4): 417; Dushane y Brennan. 1969. Ibid. 11 (4): 356; Abbott, 1974. American Sea Shells, 2a. ed.: 456. Ostrea gallus Carpenter, 1864, Brit. Assn. Adv. Sej., Rept. para 1863: Valenciennes, 1898. Voy. "Venus", Atlas Zool., Moll., Lám., 21, fig. 1 (fide Hertlein, 1931). Ostrea cerrosensis Gabb, 1866. Geol. Surv. Calif., Paleo., 2, 35; 1864. 9: 106, lám, 11, fig. 61 (fide Hertlein, 1931). Ostrea (Lopha) megodon Keen, 1958. Sea shells W. American: 1971. Ibid.: 84, fig. 173. Ostrea (Alectryonia) megodon Olsson, 1961. Panamic Pacific. Pelecypoda: 172, lám. 23, figs. 3, 3 a. Localidad tipo. Perú (la literatura no especifica la localidad). Distribución geográfica. Baja California, costas mexicanas del Océano Pacífico extendiéndose hasta Perú incluyendo las Islas Galápagos. Hábitat. Los individuos de esta especie se encuentran por lo general adheridos por la parte del umbo, en aguas relativamente someras, aunque también se han encontrado a profundidades que oscilan entre 42 y 61 brazas (Hertlein y Strong, 1946). Según Stuardo y Martínez (1976) habita en fondos arenosos de Bahía Magdalena (Baja California), México, entre 3 y 10 brazas y fija al mangle de la Laguna de Chautengo (Guerrero), México. Es comestible y ha habido intentos de exploración en Bahía Magdalena, para proceder a su enlatado. Registros fósiles. Plioceno a reciente (Hertlein, 1931). Diversos autores la han citado para la formación Gurabo de la República Dominicana, del mioceno de Jamaica y también de Costa Rica, pero según Olsson (1961) se trataría de formas estrechamente relacionadas a Lopha megodon que ocurre también en el mioceno del norte de Sudamérica. Este grupo estaría extinto en el área del Caribe. Según este mismo autor es común en "Los Tablazos del Perú". Material estudiado. 4 ejemplares y 8 valvas. 82-94 mm de altura. Bahía Magdalena (Baja California), México. Morfología de las valvas. Concha de tamaño mediano (hasta 100 mm de longitud), de forma alargada, arqueada, estrechándose gradualmente hacia los extremos contrarios a la charnela la cual, es de tamaño mediano y casi plana; área ligamental poco elevada, resilífero curvado; casi equivalva. Borde dorsal cóncavo; ventral convexo. Borde ventral con 3 a 6 pliegues agudos redondeados y profundos, foliados en su margen externo. Borde dorsal ligeramente plegado. Superficie de las conchas casi liso o marcado por líneas de crecimiento irregulares con bordes lamelares; de menor tamaño en el borde dorsal. Coloración externa blanquecina o verdosa, con matices púrpura o violáceos, internamente blanquecina, parcialmente brillante, con tonos verdosos y azul negruzco. Con comata a lo largo del borde interno dorsal y ventral, generalmente bien marcados sólo en el tercio cercano a la charnela. Huella del músculo aductor casi central, en forma de coma, de color verde opaco. Margen interno generalmente marcado por un reborde oscuro, a veces verdoso (Lám. 5, figs. a, b, c y d). Anatomía descriptiva de la cavidad del manto. Forma arriñonada, color amarillo cremoso, manto grueso, con grandes pliegues alternados (dos en el derecho y uno en el izquierdo). Los palpos labiales tienen aproximadamente entre 19-31 estrías que cubren casi totalmente la superficie de la cara interior de los palpos internos. Las branquias son amplias coincidiendo con el tamaño y forma del manto; su extremo anterior se une a la base de la canaladura posterior de los palpos labiales; su extremo posterior se une al manto posteroventralmente; con aproximadamente 170 ranuras branquiales. Cavidad pericárdica pequeña. Pasaje cloacal amplio, cavidad suprabranquial pequeña. Cámara promial ausente. Músculo aductor grande en relación con el total de las partes blandas (Fig. 6). Anatomía descriptiva del sistema digestivo. La boca en forma de herradura abierta se localiza en el extremo anterior entre los dos pares de palpos labiales. Esófago corto, comprimido casi dorsoventralmente; con pliegues transversales gruesos; hacia la abertura del estómago se encuentra un borde o cinturón con gran número de pliegues longitudinales que parecen perderse en toda la pared interna del esófago. Estómago de forma irregular; ciego anterior dirigido hacia el lado derecho; cámara anterior conspícua. En la región posterior del estómago se abre el saco del estilo que es más largo que el estómago. El intestino emerge ampliamente de este saco por su parte distal y asciende hacia la base del est ómago, continúa ventralmente hasta la base del esófago, lo rodea por el lado izquierdo y desciende sobre el ciego anterior formando una asa, posteriormente cruza hacia el lado izquierdo para terminar ventralmente sobre el músculo aductor en recto y ano. El músculo aductor es grande en relación al sistema digestivo (Lám. 6, figs. a, b y c). 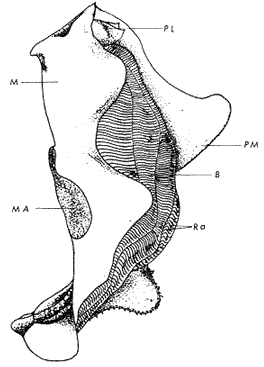 Fig. 6. Lopha megodon. Vista lateral derecha de la cavidad del manto y disposición de las branquias. SUBFAMILIA OSTREINAE RAFINESQUE, 1815
GÉNERO CRASSOSTREA SACCOCrassostrea Sacco, 1897: 15 (lista oficial CINZ Opin. 338). Ostrea (C.) virginica (Gmelin) 1791: 3336; por designación original; = Gryphaea Fischer, 1886; 927 (non Lamarck, 1801); tipo G. angulata Lamarck, 1819: 198; por designación original; Dioeciostrea Orton, 1928: 320; (tipo D. americana, nom. subst. pro. C. virginica (Gmelin); por designación original); Angustostrea Vyalov, 1936: 18 (tipo O. angusta Deshayes, 1824: 362; por designación original); Somalidacna Azzaroli, 1958; 115 (tipo S. lamellosa = C. gryphoides (Von Schlotheim, 1813); monotipia). (Stenzel, 1971). Diagnosis. Individuos de tallas que oscilan desde pequeñas a muy grandes (hasta 60 cm de altura), de contorno muy variable entre los individuos, pero muy altas. En general parecen predominar las formas espatuladas alargadas con márgenes anterior y posterior casi paralelos. Superficie áspera, con muchas escamas de crecimiento irregularmente espaciadas que no están aplastadas, simples u orladas a lo largo de sus extremos libres; costillas radiales de lados escarpados, redondeados en algunos individuos, más comunes en la valva izquierda que en la derecha tendiendo a proyectarse más allá del contorno general de los márgenes; algunas conchas llevan costillas radiales con ondulaciones variables terminando en los márgenes ventrales por una comisura valvar ondulante. Comúnmente con cámaras y valva izquierda con una cavidad umbonal bien desarrollada. Sin comata. Huella del músculo aductor ubicada cerca del margen posterior de la valva y más cercana al margen ventral que a la charnela; su contorno con dos esquinas moderadamente agudas y margen dorsal casi recto. Las formas espatuladas estrechas (alargadas) con el área ligamentosa de la valva izquierda más alta que larga con los límites anterior y posterior casi paralelos, ambos flanqueados por muchas foliaciones de crecimiento. Tales formas poseen un resilífero convexo poderoso y un área ligamentosa convexa en la valva derecha. Cretácico inferior a reciente (cosmopolita). (Stenzel, 1971). Observaciones. Gunter (1950) fue el primero en establecer que las especies asignadas al género Crassostrea presentan algunas características morfológicas y biológicas que permiten diferenciarlas de las especies del género Ostrea. Entre éstas se encuentran la fertilización y desarrollo larval observado en una cámara incubadora. GÉNERO CRASSOATREA SACCO, 1897
Crassostrea cortedensis (Hertlein, 1951) N.v. "ostión de placer Lámina 7, figuras a, b, c y dOstrea cortedensis Hertlein, 1951. Bulletin, South Calif. Acad. Sei. 50 (2): 68: lám. 24, figs. 1-2, lám. 26, fig. 7: Keen, 1958. Sea Shells W. American; Dushane y Poorman, 1967. Veliger: 417; Keen, 1971. Sea Shells W. American: 82, fig. 170. Ostrea chilensis de otros autores, non Philippi, 1845; Contreras, 1932. An. Inst. Biol. 3 (3): 201, figs. 10-11; Sevilla, 1959. Cultivo de ostión de Guaymas: 19 figs. Crassostrea cortedensis (Hertlein); Ramírez y Sevilla, 1965. Las ostras de México, 32, 45, figs.: 27, 39, 44, 46 y 50; Abbott, 1974. Amer. Sea Shells: 457; Castillo, 1977. Tesis profesional Fac. Ciencias, UNAM 108 p. Localidad tipo. Mazatlán, (Sinaloa) México. Distribución geográfica. Desde Punta Peñasco, Golfo de California a Nicaragua. Ocurre abundantemente en aguas de Panamá. (Hertlein, 1951); Norte de Baja California hasta Perú (Keen, 1971). Hábitat. Se encuentran principalmente en el nivel medio de mareas, adheridas a sustratos duros, como rocas, manglares, en fondos someros, o directamente sobre el fango (Hertlein 1951). Material estudiado. 12 ejemplares y 24 valvas. 64116 mm de altura, Nayarit, México; 11 ejemplares y 22 valvas. 60-100 mm de altura. Los Puentes, Sinaloa, México. Morfología de las valvas. Conchas de formas variables desde suborbicular (irregularmente redondeado) u oblonga hasta casi triangular, a menudo alrededor de 75 mm de altura pero alcanzando hasta aproximadamente 120 mm. Comprimida y delgada. Charnela relativamente pequeña pero con área ligamentosa ancha. Apice agudo generalmente recurvado. Valva inferior profunda, en forma de copa, foliácea regularmente fija por toda su superficie. Valva superior más pequeña comúnmente aplanada; parte externa próxima al umbo con un número variable de costillas radiales, débiles y escamosas, la parte distal y su margen presentan numerosas proyecciones lamelares concéntricas que a menudo se expanden en foliaciones onduladas. Margen interno liso sin comata. Escultura lisa o con costillas poco aparentes. Color externo púrpura oscuro, azul negruzco, verde amarillento o blanquecino rayado de púrpura. Interior de las valvas blanco con un amplio reborde marginal coloreado de púrpura o verde oliva. Huella del aductor arriñonado de color púrpura (Lám. 7, figs. a, b, c y d). Anatomía descriptiva de la cavidad del manto. Forma ovoide, color amarillento con bordes oscuros, lóbulos del manto moderadamente desiguales siendo el derecho ligeramente mayor; los 3 pliegues del borde del manto se disponen de la siguiente manera: externo totalmente liso y el medio e interno con abundantes tentáculos. El extremo anterior de las branquias va unido al acanalamiento de la base de los palpos labiales, en los que se localizan aproximadamente de 70 a 80 ranuras de selección que cubren su cara interna. Las branquias tienen un promedio de 115 a 120 ranuras branquiales. Presentan cámara promial (Fig. 7). Anatomía descriptiva del sistema digestivo. Boca en forma de herradura en el extremo anterior, entre los dos pares de palpos labiales en forma de herradura. Esófago corto, ancho y comprimido, con acanalamientos, visibles en el reborde de la abertura hacia el estómago; el ciego anterior del estómago se encuentra dispuesto lateralmente. El saco del estilo se localiza sobre el lado ventral del músculo aductor. El intestino emerge y asciende del saco del estilo cruzando hacia el lado ventral (a la altura del esófago) , posteriormente cruza nuevamente hacia el lado dorsal por la parte izquierda, colocándose sobre el músculo aductor para terminar en recto y ano (Lám. 8, figs. a y b). Crassostrea gigas (Thunberg, 1793) N.v. "ostión japonés" y "ostión del Pacífico" (en México) Lámina 9, figuras a, b, c y dOstrea gigas Thunberg, K. 1793. Vetensk Akad. Handl. 14, 1402 figs. 1-3. Lischke 1871, "Japonische Meeresconchylien", 2: 174; Dunker, 1882. "Index Mollusca Maris Japonici 240; Pilsbry, 1895. "Catalogueof Mollusca of Japan": 145, Iwakaioa, 1919. "Catalogue of Japonese Mollusca in the Natural History Department, Tokyo Imperial Museum",: 254; Takatsuki, 1927. Sci Rep. Tohoku Univ. (4) 3 (1): 19-37: 22; Amernyo, 1928. J. Coll. Agric. Tokyo, 9 (5): 33-382; Hirase, 1930. Jap. J. Zool, 3 (1): 1-65, figs. 61-64,: 45; Gunter, 1950. Amer. Midl. Nta. 43 (2); 429, 449. 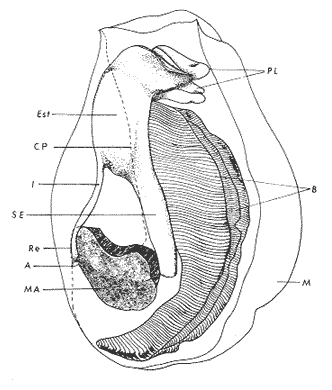 Fig. .7. Género Crassostrea. Vista lateral de las partes blandas, mostrando por transparencia del manto, la posición de los palpos labiales, masa visceral, saco del estilo, parte del intestino, recto, ano y branquias. Ostrea laperousi Schrenk, 1867. Bull. Acad. Sci St. Petersb. (3): 475, lám. 19, figs. 1-6; Waklya, 1929. Jap. J. Zool. 2 (3): 359367, lám. 8, figs. 1-3; Hirase, 1930. Jap. J. Zool. 3 (1): 1-65, figs. 65-80. Ostrea talienwhanensis Crosse, 1862. J. Conchyliol. 10, 148, lám. 6. Ostrea cucullata, Morse, 1879. Mem. Sci Dep. Univ. Tokyo (1): Mitsukuri, 1906. Nat. Geogr. Mag. 17 (9): 524-531; Iwakaioa, 1919. "Catologue of Japonese Mollusca in the Natural History Department, Tokyo Imperial Museurn-: 254. Crassostrea gigas (Thunberg, 1793); Thompson, 1954. Austr. Jour. Mar. and freshwater Research, 5: 132-168; Castillo, 1977. Tesis profesional Fac. Ciencias, UNAM 108p. Localidad tipo. Nativa de las principales islas de Japón, Hokkaido, Honshu y Kyusha. Distribución geográfica. Por motivos de mercado, ha sido introducida para cultivo en diversos países como Canadá, Corea y Taiwan (Bardach, 1972 y Abbott, 1974), Australia (Thomson, 1954), además de otros países europeos, así como en las costas del Océano Pacífico mexicano. Hábitat. Se desarrollan en aguas someras y protegidas, y las condiciones óptimas de salinidad varían entre 23 a 28/ppm y de 15 a 30°C de temperatura (Bardach, 1972). Material estudiado. 80 ejemplares y 20 valvas. 160158 mm de altura. La Paz, Baja California sur, México. 100-149 mm de altura. Los Mochis, Sinaloa, México. Morfología de las valvas. Concha grande y pesada, generalmente gruesa, su forma va desde alargada triangular hasta oval, en su mayoría inequivalvas. La valva inferior o izquierda es más profunda hacia la charnela a diferencia de la superior o derecha que es comparativamente gibosa o plana. La ornamentación externa está representada por costillas grandes y fuertes que se disponen en forma irregular en la valva izquierda para terminar en forma de pliegues en el borde de la concha que encajan perfectamente con la valva derecha donde hay presencia de lamelas principalmente hacia los bordes. La coloración externa varía de blanquecino opaco hasta amarillo cremoso, con leves tonos de púrpura a manera de manchas no conspícuas. La coloración interna es de blanco ópalo a perla sin llegar a ser iridiscentes, en ocasiones con manchas amarillo pardo. La huella del músculo aductor en ocasiones puede presentar una leve coloración violácea o solo estar delineado por amarillo pardo, pero generalmente la coloración está ausente. La charnela es moderada con un resilífero más bien corto, el condróforo es profundo así como el istmo. No presenta ningún tipo de comata a lo largo del borde interno de la concha. El músculo de Quenstedt está bien representado (Lám. 9, figs. a, b, c y d). Anatomía descriptiva de la cavidad del manto. Forma alargada u ovoide, color crema, lóbulos del manto desigual en forma, margen con 3 bordes: externo liso y medio e interno con tentáculos. Los palpos labiales presentan aproximadamente 75 ranuras o estrías, cubriendo la cara interna de ambos lados. El extremo anterior de las branquias, se fusiona con la base de canaladura de los palpos interiores y terminan por su parte inferior en la fusión paleobranquial; presentan aproximadamente de 155 a 162 ranuras branquiales. Cámara promial. Anatomía descriptiva del sistema digestivo. Boca, en el extremo anterior entre los 2 pares de palpos labiales, esófago con un estrecho conducto con estrías delgadas que conducen al estómago el cual presenta una marcada zona de selección. El estómago es amplio principalmente hacia la cámara posterior, con un ciego gástrico conspícuo. El tiflosol emerge de una manera visible a nivel medio del saco del estilo, rodea al estómago y termina ramificándose por el lado dorsal en dos prolongaciones a manera de herradura. El intestino emerge desde la porción inferior del saco del estilo por su parte derecha y en el primer tercio se quiebra para ascender lateralmente hasta pasar por la parte dorsal del estómago, da vuelta a nivel inferior del esófago y desciende por su lado izquierdo a la parte ventral del estomago para cruzar nuevamente hacia el lado ventral y terminar en recto y ano sobre el flanco del músculo aductor. El músculo aductor ocupa con respecto a la longitud total de las partes blandas en promedio de 11.2% y el sistema digestivo el 39.7% (Lám. 10, figs. a y b). Crassostrea iridescens (Hanley, 1854) N.v. "ostión de roca" Lámina 11, figuras a, b, c y dOstrea iridescens Hanley, 1854, Conch. Miscell., Ostrea, lám. 2, figs. 6-7; Carpenter, 1857. Cat. Mazatlán shells: 157; 1857. Brits. Assn. Adv. Sci Rept. para 1856: 162, 226, 250, 312, 365; H. y A. Adams, 1858. Gen. Rec. Moll., 2: 568; Carpenter, 1864. Brit. Assn. Adv. Sci., Rept. para 1863: 621; Dall, 1914. Nautilus 28: 1; Lamy, 1929. Jour. Conchyliol. 73 (3): 147, 149, 151, 243, 274; figs. 6-7; Contreras, 1932. An. Inst. Biol. 3 (3): 194, figs. 1-2 (Sin. ex parte ); Hertlein y Strong, 1946. Zoologica, 31 (5): 55; Keen, 1958. Sea Shells W. America; Olsson, 1961. Panamie-Pacific Pelecypoda: 174, lám. 22, fig. 7., lám. 23, figs. 2, 2 a; Keen, 1971. Sea Shells W. America: 84 fig. 172; Abbott, 1974. American Sea Shells: 456. Ostrea lucasiana Rochebrune, 1859. Bull. Mus. Hist. Nat. París, 1: 241. Ostrea spathulata Sowerby, 1871. In: Reeve, Conch. Icon. 18, Ostrea: sp. 13, lám. 8, fig. 13 (non Lamarck, 1819). Ostrea prismatica Sowerby, 1871. In: Reeve, Conch. Icon. 18, Ostrea: sp. 1, lám. 1, fig. 1. Ostrea turturina Rochebrune, 1895. Bull. Mus. Hist. Nat.París, 1: 242. Crassostrea iridescens (Hanley, 1854); Sevilla, 1959. Cultivo ostión de Guaymas: SIC, DGPIC: 13-20; figs., 1 lám.; Ramírez y Sevilla, 1965. Ostras de México: SIC, DGPIC, 1-36, 8 figs. Castillo, 1977. Tesis profesional Fac. Ciencias, UNAM. 108 p. Localidad tipo. Arrecife de Panamá (Hertlein y Strong, 1946). Distribución geográfica. América Central (Sowerby para O. prismatica, 1871). Cabo Palmo y Cabo San Lucas, B. C. México (Rochebrune para O. lucasiana, 1895). Bahía del Espíritu Santo (Rochebrune para O. turturiana, 1895). Guacomayo, de América (Sowerby, 1871). Bahía de la Isla del Espíritu Santo, Golfo de California (Contreras, 1932) (Rochebrune, 1895). La Paz, Baja California a Panamá (Hertlein y Strong, 1946). Baja California al norte de Perú. Panamá, Guanico. Ecuador: Esmeraldas, Manta. Perú: Caleto Mero, Caleto Sal; Mancora. (Olsson, 1961). La Paz, Baja California a Panamá (B. California, Guaymas, Sonora; Acapulco, Guerrero; Salina Cruz, Oaxaca). (Ramírez y Sevilla, 1965). La Paz, Golfo de California, México hasta el norte de Perú (Keen, 1971). Hábitat. Esta especie se encuentra desde las costas de Baja California sur al norte de Perú adherida a facies rocosas expuesta a mar abierto. En México actualmente es un recurso ostrícola importante en la costa del Océano Pacífico, especialmente por el gran tamaño que alcanzan las ostras. Material estudiado. 6 ejemplares y 12 valvas. 82107 mm de altura. Bucerías, jalisco, México. 13 ejemplares y 23 valvas. 90-162 mm de altura. Guayabitos, Nayarit, México. Morfología de las valvas. Concha grande, pesada y gruesa de forma algo alargada desde irregular oval hasta casi rectangular, los ejemplares adultos miden comúnmente alrededor de 162 mm de altura y 90 mm de longitud. Charnela casi recta amplia y relativamente cuadrada, con un área ligamentosa ancha y elevada; resilífero alargado; ápice curvado lateralmente. Valva superior casi plana ligeramente abovedada; la inferior poco profunda. Margen interno de las valvas con comata a ambos lados de la charnela. Superficie externa de textura subcórnea, de color púrpura o bronceada, con líneas concétricas formadas por láminas provistas de finas y numerosas estrías radiales. Superficie interna de textura densa, coloración aporcelanada blanquecna, a menudo con un lustre iridiscente o metálico. Huella del músculo aductor grande reniforme, más o menos central, de color variable blanquecino hasta café rojizo (Lám. 11, figs. a, b, c y d). Anatomía descriptiva de la cavídad del manto. Forma ovoide, color amarillento. El extremo anterior de las branquias se une a la canaladura base de los palpos labiales y presentan un promedio de 165 ranuras branquiales, pasaje cloacal pequeño, ostiolo grande. Presencia de cámara promial. Anatomía descriptiva del sistema digestivo. Boca en el extremo anterior, entre los pares de palpos labiales, esófago comprimido lateralmente, corto y con un reborde de finas estrías en la entrada del estómago. Estómago de forma irregular, ciego anterior en semiespiral. El saco del estilo es más largo que el estómago y termina en el extremo del músculo aductor. El intestino emerge de la porción inferior a la región media lateral del saco, desciende y asciende formando una asa que continúa lateralmente por el estómago hasta, llegar a la base del esófago, lo rodea parcialmente por el lado izquierdo y empieza a descender por el lado derecho hasta la región posterior del estómago cruza hacia el flanco dorsal del músculo aductor en donde se alarga para terminar en recto y ano. Músculo aductor grande en relación con el sistema digestivo (Lám. 12, figs. a y b). Observaciones. Esta especie se distingue fácilmente por su gran tomaño, ausencia de costillas extensas, existencia de dentículos (comata) internos, laterales a la charnela y sobre los amplios márgenes con una iridiscencia muy particular en el interior de las valvas. Crassostrea palmula (Carpenter, 1857) N.v. "ostión palmeado" Lámina 13, figuras a, b, c y dOstrea ?? conchaphila var. palmula Carpenter, 1857. Cat. Mazatlán Shells, Brit. Mus.: 163, 550, Contreras, 1932. An. Inst. Biol. 3: 206. Ostrea amara Carpenter, 1863. Zool. Soc. London: 363, Brit. Sci.: 541, 552, 621 y 666; Lamy, 1909. Jour. Conchyliol. 57: 223; 1930. Ibid., 73 (4): 242. Ostrea mexicana Sowerby, 1871. Conch. Icon. 18, Ostrea; sp 35, lám. 16, figs. 35 a, b y c. Ostrea serra Dall, 1914. (non. Lamarck, 1819) Nautilus, 28 (1): 1-3. Ostrea dalli Lamy, 1930. Bull. Mus. Hist. Nat. 71: 252. Ostrea amara var. mexicana (Sowerby); Lamy, 1930. Jour. Conchyliol. 73 (4): 243. Ostrea mexicana (Sowerby); Contreras, 1932. An. Inst. Biol. 3: 204, figs. 15-16. Ostrea palmula (Carpenter): Hertlein Strong, 1946. Zoologica, 31 (5): 55, Lám. 1, fig. 14; Keen, 1958. Sea Shells W. America: 66, fig. 124. Crassostrea palmula (Carpenter, 1857); Ramírez y Sevilla, 1965. Las ostras de Mexico SIC Direcc. Gral. de Pesca e Ind. Conexas: 136, 8 figs.; Castillo, 1977. Tesis profesional Fac. Ciencias, UNAM, Mexico, 108 p. Localidad tipo. Mazatlán, México. Distribución geográfica. Baja California, México hasta Panamá, Isla Galápagos y Ecuador (Hertlein y Strong, 1946); Golfo de California sur hasta Ecuador y las Galapagos (Olsson, 1961); Golfo de California, Laguna de San Ignacio hasta Ecuador (Keen, 1971). Hábitat. Esta especie es relativamente abundante en las zonas supralitorales y mesolitoral superior de Areas rocosas expuestas y también penetra moderadamente en los esteros y Areas de manglar resistiendo aguas salobres (Stuardo y Martínez, 1976). Por su tamaño reducido y escasez no tiene valor comercial. Material estudiado. 6 ejemplares y 12 valvas, 37-49 mm de altura. San Blas, Nayarit, México. 18-Nov 72. Morfologia de las valvas. Concha comparativamente pequeña, pesada, de forma semicircular hasta oval alargada. Valva superior generalmente plana, a menudo con una ligera depresión hacia el tercio posterior. Valva inferior casi siempre profunda en forma de copa, adherida por casi toda su superficie a rocas y raíces de mangle. Charnela más o menos amplia, Area ligamentosa pequeña, con el resilífero a menudo inclinado. Superficie de la valva superior casi lisa con líneas de crecimiento laminares hacia los márgenes, bordes de ambas valvas con 17 pliegues que ajustan perfectamente y que en la valva inferior se originan claramente de grandes costillas radiales. Coloración externa variando de blanco ceniza a verde, con venas transversales violiceas. Internamente su color es de tinte blanqueando o verde oliva amarillento y una banda marginal de color café a violeta, a veces duplicada por otra interna de color verde oliva. Huella del músculo aductor reniforme, ubicada hacia el borde postero-dorsal, coloración azul violeta o verde amarillento (Lám. 13, figs. a, b, c y d). Anatomía descriptiva de la cavidad del manto. Forma ovoide o alargada, color de un tinte verdoso, manto izquierdo más grande que el derecho, gruesos en la region anterior, lóbulos pequeños e irregulares en los bordes posteriores. Los palpos labiales tienen aproximadamente 75 ranuras en la cara interior de los palpos internos. El extremo anterior de las branquias se une a la base del acanalamiento de los palpos labiales internos, las branquias por su amplitud no sobresalen del borde del manto y se unen con 61 en el margen posterior, presentan aproximadamente 117 ranuras branquiales. Cavidad pericárdica mediana. Pasaje cloacal reducido, cavidad suprabranquial grande. Con cámara promial. Músculo aductor mediano en relación al total de las partes blandas. Anatomía descriptiva del sistema digestivo. Boca en el extremo anterior, entre los dos pares de palpos labiales. Esófago corto, casi comprimido lateralmente con canales longitudinales en la pared interna y en gran número hacia la abertura del est6mago que se estrecha. Estómago amplio, ciego anterior hacia el lado ventral conspictio. De la base media del estómago sale el saco del estilo y se dirige por el lado dorsal hasta el margen dorsal del músculo aductor. El intestino emerge a la región posterior del saco y asciende junto a 61, cruza el lado izquierdo hacia el costado ventral, sigue ventral al est6mago y rodea por el lado derecho, la base del est6mago, desciende sobre el ciego y cruza por el lado derecho hacia el lado ventral para terminar en recto y ano junto al flanco del músculo aductor. Músculo aductor mediano en relación con el sistema digestivo (Lám. 14, figs. a y b). Observaciones. Esta especie es fácilmente diferenciable de las otras especies de Crassostrea ya mencionadas, por su menor tamanño y por presentar fuertes costillas externas en la valva inferior que tiene además forma de copa y por su margen interno dentado. Las valvas presentan dentículos (comata) a lo largo del borde interno. Crassostrea rhizophorae (Guilding, 1828) N.v. "ostión de mangle" Lámina 15, figuras a, b, c y dOstrea rhizophorae Guilding, 1828. Zool. Jour., 3 (12): 542, 1871. Reeve, Conch. Icon., 18, lám. 9, sp. 17 a, 17b; Lorié, SammI. 1889. Geol. Reichs-Mus. Leiden, ser. 2, 1: 114 y 141; Dall, 1898., Wagner Free Inst. Sej., Trans., 3 (4): 687; Lamy, 1929. Jour. Conchyl., 73 95-99, 100, 108, 135, 137, 139 y 271; Me Lean, 1941. Acad. Nat. Sci. Philadelphia, Notulae Naturae (67): 5 y 9, lám. 1, figs. 5-7; Mattox, 1949. Ecol. Monogr., 19: 339-356; Olsson and Me Ginty, 1958. Bull. Amer. Paleont., 39 (1.77): 20. Ostrea arborea Chemnitz, 1785. Syst. Conchylian-Cabinet, 8: 4647, lám. 74, fig. 681; Chemnitz, 1949. Lange de Morretes, Mus. Paranaense, Arq., 7, art. 1: 16. Ostrea braziliana Lamarck; Deshayes, 1836. An. sans. vert., ed. 2, 7: 223. Ostrea rhizophora Chemnitz; Krebs, 1864. The west Indian Marine shells: 136. Ostrea parasitica Gmelin; Mörch, 1878 Catalogue of West India shells: 16 (no de Gmelin); Arango y Molina, 1878. Contribución a la fauna malacológica cubana,: 273 (no de Gmelin); Von Ihering, 1907. Mus. Nac. Buenos Aires, Anal., 14: 359, 374, 426 y 450; Richards, 1935. Jour. Paleont., 9 (3): 236 (no de Gmelin); Jaume and Pérez Farfante 1942. Soc. Cubana Hist. Nat. "Felipe Poey", Mem., 16: 38 (no de Gmelin). Ostrea adsociata Philippi, 1893. Mus. Nat. Chile, Anal.: 14, lám. 2, fig. 1. Ostrea virginica Gmelin, Dall y Simpson, 1901. U.S. Fish Com., Bull., 20, pt. 1,: 463 (no de Gmelin). Crassostrea rizhophorae (Guilding); Gunter, 1950. American Midland Naturalist, 43 (2): 446; Gunter, 1951. Bull. Marine Sej. Gulf and Caribbean, 1 (1): 44-45; Abbott, 1954. American Seashells: 374 y 375; Nowell/Usticke, 1959. A check list of the marine shells; of St. Croix: 9; Warmke and Abbott, 1961. Caribbean Seashells: 173, lám. 35 b. Ostrea (Crassostrea) rhizophorae (Guilding); Me Lean, 1951. N.Y. Acad. Sei, Scientific gurvey of Porto Rico and the Virgin Islands, 17 (1): 25, lám. 4, figs. 6. Localidad tipo. Islas del Caribe, Antillas. (Sowerby, 1871). Al sureste de Higuerote, Estado de Miranda, Venezuela, con una marca de adherencia que quizá fue sobre una raíz de mangle (Weisbord, 1964). Distribución geográfica. Región del Caribe, sur del Atlántico hasta Brasil (Abbott, 1974). Hábitat. En Puerto Rico, la concha se encuentra principalmente adherida a raíces de mangles a temperatura de 25 a 31°C, pH de 7.4 a 8.2 y salinidades de 37 a 44/ppm. (Mattox, 1949). En México y Cuba, el sustrato típico es Rhizophora mangle y Laguncularia racemosa entre otros. La salinidad varía entre 21 a 42/ppn (siendo los extremos de corta duración). La temperatura varía entre 18 y 34°C. El pH fluctúa entre 7.7. y 8.5 y la concentración de oxígeno entre 1.42 y 5.03 ml/1. Material estudiado. 17 ejemplares y 34 valvas. 5378 mm de altura (1973). 12 ejemplares y 24 valvas. 5.4-9.4 mm de altura. Estero Pargo, Laguna de Términos, Campeche, México (1982). Morfología de las valvas. Concha más bien pequeña, forma generalmente redonda u ovalada hasta elongada casi trigonal, no es equivalva y los adultos muestran claramente la valva inferior notablemente más cóncava que la superior que es lisa. Los ejemplares adultos llegan a medir hasta 80 mm de altura. La coloración externa café pardo a verde oliva con líneas irregulares violáceas o púrpuras (en ocasiones sobre un fondo claro) que van desde el umbo hasta el borde, internamente es blanquecino ocasionalmente con manchas verde- amarillento con marcada coloración púrpura en el margen posterior. La huella del músculo aductor está pigmentada de púrpura oscuro. La ornamentación externa de la valva superior es lisa desde el umbo o prodisoconcha hasta aproximadamente la parte media donde hay líneas que se dirigen hasta el borde en donde llegan a formar un cinturón f oliar que encaja perfectamente sobre la valva inferior la cual muestra la marca de fijación sobre el mangle, el resto presenta grandes costillas a lo largo de la concha que se levantan considerablemente, dispuestas más o menos radialmente, de tal manera que al llegar al borde de la concha forman pliegues que caracterizan a la especie. La charnela es generalmente estrecha con resilífero moderado y condróforo casi plano. Istmo profundo, comata a los lados de la charnela. Músculo de Quenstedt bien representado (Lám. 15, figs. a, b, c y d). Anatomía descriptiva de la cavidad del manto. Forma alargada a ovoide, color de amarillo cremoso verdoso hasta levemente púrpura y pigmentación oscura hacia el margen de los lóbulos del manto, donde hay 3 pliegues: externo liso y medio e interno con tentáculos. El extremo anterior de las branquias se une al acanalamiento de la base de los palpos labiales que muestran aproximadamente de 75 a 83 ranuras de selección. Las branquias presentan un promedio de 140 a 146 laminillas de selección. Presencia de cámara promial. Anatomía descriptiva del sistema digestivo. Boca en el extremo anterior, entre los pares internos de los palpos labiales, esófago comprimido lateralmente con una construcción al desembocar en el estómago, que es de forma alargada e irregular con la cámara posterior conspícua. Presenta un ciego en el lado derecho, en la porción superior casi ventral del estómago, a manera de espira (término del tifosol mayor) y un pequeño apéndice a manera de ciego en la región superior izquierda del estómago a manera de gancho. El intestino emerge de la porción inferior del saco del estilo y asciende hasta llegar al estómago, donde cruza a la altura del esófago por el lado izquierdo y desciende nuevamente para cruzar a la altura del estómago por su parte basal y terminar en recto y ano en el flanco dorsal del músculo aductor. Este músculo ocupa aproximadamente el 60 a 70% y el sistema digestivo del 25 al 30 % de la longitud total de las partes blandas (Lám. 16, figs. a y b). Crassostrea virginica (Gmelin, 1791) N.v. "ostión americano" Lámina 17, figuras a, b, c y dOstrea virginica Gmelin, 1791. Syst. Nat., ed. 13, 1 pt. 6, 3336; Guppy, 1867. Sej. Assoe. Trinidad, Proc.: 164; Gabb, 1873. Amer. Philos, Soc., Trans., 15: 257; Guppy, 1876. Geol. Soc. London, Quart. Jour., 32,: 531; Gabb, 1891. Acad. Nat. Sej. Philade1phia, Jour., ser. 2, S.- 380; Tryon, 1844. Structural and Systematic Conchology, 3: 297, lám. 133, fig. 34; Fischer, 1886. Manual de Conchyliologie et de Paléntologie Conchyliologique: 924; Simpson Devenport, 1889. Acad. Nat. Sei., `Proc., 5: 71; Dall, 1889. U.S. Nat. Mus., Bull., 37: 32; Whilfield, 1894. U. S. Geol. Sur., Mon. 24: 27-28, lám. 2, figs. 1-7; Dall, 1898. Wagner Free Inst. Sej., Trans., 3 pt. 4: 687 688; Dall and Simpson, 1901. U.S. Fish. Com., Bull., 20 para 1901, pt. 1: 463 (parte); Vanatta, 1903. Acad. Nat. Sei. Philadelphia, Proc., 55: 756; Clark, 1906. Maryland Geol. Sur., Pliocene and Pleistocene: 204-205, láms. 61-63; Böse, 1906. Inst. Geol. México, Bol. (22): 66, 69, 75; Guppy, 1910. Agric. Soc. Trinidad and Tobago, Soc. Paper (440): 7; Brown and Pi1sbry, 1913. Acad. Nat. Sej. Philadelphía, Proc., 6.- 96-97; Henderson and Bartsch, 1914. U.S. Nat. Mus., Proc., 47 (2055): 412; Maury, 1971. Bull. Amer. Paleont., 5 (29): 348; Mansfield, 1918. Florida State Geol. Sur., Eleventh An. Rept.: 115; Maury, 1920. Bull. Amer. Paleont., 8 (34): 56-57; Hubbard, 1920. N.Y. Acad. Sci. Scientific Survey of Porto Rico and the Virgín Inslands, 3 pt. 2: 100; Clench, 1923. Nautilus, 37 (2): 53-54; jacot, 1924. Nautilus, 38 (2): 49; Maury, 1925. Bull. Amer. Paleont., 10 (25): 232-233; Dall, 1925. Nautilus, 38 (4): 121; F. Hodson, H.K. Hodson y Harris, 1927. Bull. Amer. Paleont., 13 (49): 21-22; A. Wood y R. E. Wood, 1927. Nautilus, 41 (1, 12, 14-15); Clench, 1929. Nautilus, 43 (1): 25; Lamy, 1929. Jour., Conchyl., 73.- 14, 40, 97, 264, 265, 267-272, 273, 274; johnson, 1934. Boston Soc. Nat. Hist., Proc., 40 (1): 23; Richards, 1936. Nautilus, 49 (4): 132; Richards, 1938. Geol. Soc. Amer., Bull., 49 2: 1291; Mansfield, 1939, State of Florida. Dept. Conserv., Geol. Bull. (18): 16, 18, 19, 21, 30, 31; Me Lean, 1939. Nautilus, 52 (3): 107; Stubbs, 1940. Jour. Paleont., 14 (5): 511; Stenzel, 1940. Nautilus, 54 (1): 21; Richards, 1924. Acad. Nat. Sej. Philadelphia, Proc., 94: 187-188, lám. 9, fig. 4; Jacobson, 1943. Nautilus, 6 (4): 141; Hackney, 1944. Nautilus, 58 (2): 57; Van Bentham jutting, 1945. Geol. Mijnobouwk. Genootschap Nederland en Kolonien, Geol. Ser., 14: 77; Stewart, 1946. Nautilus, 60 (1): 19; Richards, 1947. Jour. Paleont., 2 (1): 25, 27; Alexander, 1947. Nautilus, 60 (3): 75, Rogers, 1951. The Shell Book: 423-424; Pulley, 1952. Texas Jour. Seo., 4 (2): 181, lám. 8, fig. 11. Ostrea virginiana Lister, 1692. Historiae Conchyl., lám. 200, fig. 5; Sowerby, 1822. The Genera of Recent and Fossil Shells, fig. 2; Holmes, 1860. Post Pleiocene Fossi1s of South Carolina: 10, lám. 2, fig. 9 a; Coues, 1871, Acad. Nat. Sej. Philadelphia, Proc., 23: 131. Ostrea rostrata maxima Chemnitz, 1785. Syst. Concylien-Cabinet, 8: 38-39, lám. 73, fig. 677. Ostrea crassa Chemnitz, 1785. Syst. Coneylian-Caginet, 6. 40-41, lám. 74, fig. 678. Ostrea elongata Solander, 1786. A catalogue of the Portland Museum: 55 (not Born, 1780). Ostrea brasiliana Lamarck, 1819. An. Sans. vert., 6: 205. Ostrea calladensis y Ostrea borealis Lamarck, 1819. An. Sans. vert., 6: 207; Deshayes, 1836. An. sans. vert., ed. 2, 7: 220; Lamy, 1924. Mus. Nat. Hist. Nat. París, Bull., 30: 94. Ostrea semicylindrica Say, 1822. Acad. Nat. Sej. Philadelphia, Jour., Ist. ser., 2: 228. Ostrea triangularis Holes; Elliott, 1856. Soc., Proc., 1: 29. Ostrea floridensis Sowerby, 1871. ln: Reeve, Conch. Icon., 18, lám. 29, sp. 76 a, b. Ostrea (Crassostrea) virginica (Gmelin), Me Lean, 1941. Acad. Nat. Sei. Philadelphia. Notulae, Naturae, (67), lám. 8, figs. 1-4; Lange de Morretes, 1949. Mus. Paranaense, Arq., 7, art. 1: 16; Me Lean, 1951. N.Y. Acad. Sei. Scientific Survey of Porto Rico and the Virgin Islands, 17 (1): 24-25, lám. 4, fig. Olsson y Harbison, 1953. Acad. Nat. Sei. Philadelphia, Mon. (8): 49, lám. 5, figs. 2, 2 a. Crassostrea virginica (Gmelin); Stenzel, 1947. Jour. Paleont., 21 (2): 172; Gunter, 1950. Amer. Midland Naturalist, 50 (2): 438, 440, 446; Gunter, 1951. Bull. Marine Sej. Gulf and Caribbean, 1 (1): 43, 44, 45; Abbott, 1954. American Seashells: 375, lám. 28 a; Parry y Schwengel, 1955. Marine Shells of the Western Coast of Florida: 43-44, lám. 4, fig. 19; Dubar, 1958. Florida Geol. Sur., Geol. Bull. (40); Nowell-Usticke, 1959. A check list of the marine shells of St. Croix: 9; Moore, 1961. Gulf Research Repts., 1 (1): 15, 39; Jacobson y Emerson, 1961. Shells of the New York City Area: 76, 1 fig.; Castillo, 1977. Tesis profesional, Fac. Ciencias UNAM 108 p. Localidad tipo. Sureste de la Bahía de Higuerote, Estado de Miranda, Venezuela. Se supone que la valva encontrada en este lugar fue acarreada desde ambientes de agua salobre. Distribución geográfica. Se cree que data desde principios del oligoceno. En el pleistoceno se registra desde la Isla Príncipe Eduardo hasta Florida; en América Central en el canal de Panamá y en Sudamérica, en la Península Goajirae Isla de Tortuga (Venezuela). En el plioceno es conocido desde la costa este y sur de EU, así como en las costas del Golfo de México, Costa Rica, Venezuela y Trinidad. En el mioceno, ocurre en el norte de Nueva jersey y extendiéndose por el litoral de las Carolinas hasta Florida. Su distribución se extiende desde Canadá a Brasil. Hábitat. En aguas someras, protegidas, sin azolvamiento contínuo, forman grandes y extensos bancos, preferentemente en una salinidad entre 1925/ppm y temperatura entre 18 y 27°C. Material estudiado. 16 ejemplares y 32 valvas, 6896 mm de altura. Lagunas Carmen y Machona, Tabasco, México. 14 ejemplares y 28 valvas. 87-104 mm de altura. Boca de Atasta, Laguna de Términos, Campeche. México. Morfología de las valvas. Concha de tamaño mediano a grande (hasta 474 mm de altura) forma elongada, inequivalvas, la valva inferior levemente convexa. Ornamentación externa de la valva superior casi lisa, con pronunciadas líneas de crecimiento que dan lugar a foliaciones que se dirigen hacia el borde formando un cinturón oscuro en el borde interno posterior de la concha, la valva inferior presenta costillas no simétricas, y las que se levantan hacia el borde posterior, dan la forma de pequeños pliegues, encajando eficazmente con el borde de la valva superior. Coloración externa café oscuro pardo con manchas o líneas irregulares púpura a todo lo largo de la concha, coloración intensa blanquecina, algunas veces con manchas violáceas o amarillas. Huella del músculo aductor pigmentada de púrpura oscuro, Charnela y resilífero de tamaño moderado, condróforo liso, istmo no profundo. Sin comata a lo largo del borde interno. Músculo de Quenstedt bien representado (Lám. 17, figs. a, b, c y d). Anatomía descriptiva de la cavidad del manto. Forma ovoide o alargada de color amarillo crema a verde oliva, lóbulos del manto grandes, con 3 pliegues en el borde; el extremo es liso y el medio e interno llevan tentáculos. Los palpos están unidos por un canal inferior con las branquias, y llevan aproximadamente de 105 a 130 ranuras de selección. Las branquias presentan una amplia gama, desde 44 a 110 ranuras de selección. (El músculo aductor ocupa aproximadamente el 26% del total del cuerpo). Presencia de cámara promial. Anatomía descriptiva del sistema digestivo. Boca en forma de herradura el extremo anterior entre los dos pares de palpos labiales internos. Esófago estrecho con pliegues transversales que conduce al estómago de forma irregular con cámara posterior muy conspícua. El estómago presenta dos ciegos que nacen del lado izquierdo uno que corre hacia el lado ventral para terminar en forma conspícua a manera de ganchillo en el lado derecho y el otro pequeño dirigido hacia el lado dorsal por el lado izquierdo. En la región posterior del estómago se abre el saco del estilo que corre lateralmente a lo largo del flanco ventral del músculo aductor. El intestino emerge de la parte inferior del saco del estilo y empieza a ascender engrosándose hacia el dorso del estómago, lo cruza a la altura del esófago y desciende por el lado contrario del estómago para cruzarlo por el lado izquierdo nuevamente y terminar en el recto y ano sobre el flanco dorsal del músculo aductor. El músculo aductor representa aproximadamente del 20 al 32 % y el sistema digestivo del 58 al 73 % de la longitud total del cuerpo (Lám. 18, figs. a y b) . GÉNERO OSTREA LINNEAUS, 1758(Tipo O. edulis; por designación subsecuente: CINZ Opin. 94): Ostreola Monterosato, 1884: 4 (tipo Ostrea stentina Payraudeau, 1826 (1927): 81; por designación original). Cymbulostrea Saceo, 1897 b: 12 (tipo Ostrea cymbula Lamarck, 1806: 165, por designación original). Ostrea (Eostrea) Ihering, 1907: 42 (tipo Ostrea puelchana D'Orbigny, 1841: 672; por designación subsecuente Iredale, 1939: 394). Ostrea (sección Anodontostrea) Suter, 1917: 86 (tipo Ostrea angassi G.B. Sowerby, Jr., 1871: 18, lám. 13; por designación subsecuente: Finlay, 1928: 264). Ostrea (Euostrea) Douvillé, 1920: 65 (non Jaworski, 1913: 192) (tipo Ostrea edulis Linné por designación original). Ostrea (Ostrea) Section Bellostrea Vyalov, 1936: 17 (tipo Ostrea bellovacina Lamarck, 1806: 159, por designación original) (Stenzel, 1971). Diagnosis. Ejemplares de tamaño mediano a grande (hasta 18 cm de longitud y 20 cm de altura), contorno variable, pero la mayoría de las conchas tienden a ser fuertemente orbiculares con umbos raramente prominentes, obtusamente puntiagudas y flanqueadas por aurículas pequeñas, muy grandes o ausentes; la aurícula posterior sí está presente, mucho más grande que la anterior. Espesor contenido alrededor de 0.25 veces en el largo, siendo así una concha bastante aplastada. Valva derecha aplanada, ligeramente convexa cubierta por muchas escamas de crecimiento, de conquíolina, frágiles y aplastadas; un extenso reborde periférico de conquiolina (hasta de 1.5 cm de ancho) hace que la parte calcárea de la valva derecha sea mucho más pequeña que la de la valva izquierda correspondiente y es tan visíble como en algunos especímenes bivalvos fósiles. Ondulaciones concéntricas presentes o ausentes, nunca conspícuas en la valva derecha. Valva izquierda ligeramente convexa casi nunca en forma de cuchara profunda, cubierta por numerosas costillas radiales, largas, desiguales, redondeadas, interrumpidas por delicadas escamas de crecimiento menos abundantes que en la valva derecha. Con algunas ondulaciones concéntricas. Aunque los patrones de costillas radiales difieren mucho de una especie a otra, no se desarrollan espinas hióticas. Areas de ligamento comúnmente más largas que altas, formando triángulos de base larga. Comata siempre presentes, pero difieren en prominencia de una especie a otra, pocos (4 o 5) en algunas, pequeños y tuberculiformes, abundantes y notables en otras, formando pustulas alargadas todas colocadas alrededor del contorno. Huella del músculo aductor reniforme; ambos extremos bien redondeados: GÉNERO OSTREA LINNAEUS, 1758
Ostrea angélica Rochebrune, 1895 N.v. "ostiónangélico" Lámina 19, figuras a, b, c y dOstrea angelica Rochebrune, 1895. Bull. Mus. Hist. Nat. París, 1: 241; Contreras, 1932. An. Inst. Biol., 3., 204, figs. 18, 19; Keen, 1958. Sea Shells W. America; Sevilla, 1959. Cultivo de Ostión de Guaymas, 16, 17, fig.: 15; Ramírez y Sevilla, 1965. Ostras de México; 35, fig.: 31; Dushame y Poorman, 1967. Veliger, 9(4): 417; Keen, 1971. Sea Shells W. America: 82, fig. 167; Abbott, 1974. Sea Shells, 2a. ed. 456, N' 5271. Ostrea cumingiana Dunker de otros autores, non Dunker, 1846. Ostrea veatchi Gabb de otros autores, non Gabb, 1866. Ostrea chilensis var. chiloensis Sowerby, 1871. In: Reeve, Conch. Icon. 9, Ostrea: sp. 33, lám. 15, fig. 33; Dall, 1914. Nautilus, 28: 3. Ostrea cibialis Hupé, 1854. In: Gay, Hist. Fis. Pol. Chile, Zool., 8: 281; Atlas 2 Malac., lám. 5, figs. 1-1 a (3); Mar tínez y Sáenz, 1869. Mol. viaje Pacífico. Biv. Mar.: 75, lám. 8, fig. 6. Localidad tipo. Bahía de Los Angeles, Golfo de California, México. Distribución geográfica. Bahía de Los Angeles, Baja California, donde se forman bancos de gran extensión (Rochebrune, 1895), Golfo de California, México (Contreras, 1932). Golfo de California, desde México al Ecuador (Ramírez y Sevilla, 1965; Keen, 1971). Hábitat. Según Rochebrune (1895), esta especie formaría bancos de considerable extensión en Bahía de Los Angeles, Baja California, México. Dushane y Poorman (1967) la consideran común en los alrededores de Guaymas, Sonora, en donde la hallaron a 17 brazas sobre conchas rotas y fondo rocoso. En la misma área, Ramírez y Sevilla (1965) la citan asociada con Crassostrea cortedensis y C. palmula, sobre raíces de mangle. Material estudiado. Dos ejemplares y 4 valvas. 3845 mm de altura, de Bahía de Guaymas, Sonora, México. 18-Nov-72. Morfología de las valvas. Concha comparativamente pequeña, de forma casi circular a ovoide, más o menos aplanada midiendo hasta 100 mm de altura y 62 mm de longitud. Valvas desiguales con márgenes dentados. Valva superior casi plana, ligeramente abovedada, valva inferior más o menos profunda, adherida por uno de sus bordes cercano a la charnela o por casi toda su cara interna. Superficie externa de la valva superior variable, lisa o rugosa, en este caso con grandes costillas radiales casi angulosas que generalmente no llegan a la parte central pero sí se extiende hacia los márgenes formando un número correspondiente de pliegues casi agudos, con líneas lamelares concéntricas. En la parte libre de la superficie externa de la valva inferior, la ornamentación es similar. Comata numerosos cercanos a la charnela. Charnela más o menos amplia, su área ligamentosa generalmente poco elevada, resilífero corto, curvado lateralmente. Coloración externa de blanquecina a café pardusco, interior blanquecino opaco, con grandes manchas con verde brillante a menudo formando una banda marginal interna. Huella del músculo aductor subcentral de forma variable, reniforme a semilunar; de color verde a blanco brillante (Lám. 19, figs. a, b, c y d). Anatomía descriptiva de la cavidad del manto. Forma alargada, color amarillo pardo, manto derecho más convexo que el izquierdo, grueso, lóbulos muy tenues en el margen posterior. Paralelamente al borde del manto corre una franja angosta de repliegues radiales pigmentados bien delimitados por un reborde en la región posterior y dorsal que desaparece en la región ventral, desde los repliegues radiales pigmentados bien delimitados por un reborde en la región posterior y dorsal que desaparece en la región ventral, donde los repliegues se hacen más largos. Los palpos labiales aproximadamente con 3437 estrías cubriendo la cara interior de los palpos internos. Las láminas branquiales presentan un ancho gradual del lado izquierdo al derecho. El extremo anterior de las branquias se une a la base del acanalado de los palpos labiales y se fusiona con él posteriormente, dando vuelta hacia el lado ventral. Presentan aproximadamente 77 ranuras branquiales. Cavidad pericárdica mediana, pasaje cloacal reducido, cámara suprabranquial pequeña y sin cámara promial. Músculo aductor grande en relación al total de las partes blandas y su eje mayor de la sección transversal ubicado casi vertical al resto del cuerpo (Fig. 8). Anatomía descriptiva del sistema digestivo. Boca en el extremo anterior entre los dos pares de palpos labiales en forma de herradura. Esófago corto comprimido lateralmente con estrías microscópicas en la pared interna. Estómago irregular y amplio; el ciego anterior dirigido posteriormente, cámara anterior prominente. El saco del estilo que es tan largo como el estómago y dirigido ventralmente, descansa en el extremo ventral de la cavidad pericárdica. El intestino surge del extremo distal del saco del estilo, asciende por el lado dorsal del estómago y rodea al esófago por el lado izquierdo, pasa por el ciego gástrico y desciende por el lado ventral hasta llegar a la base del estómago donde cruza por el lado izquierdo hasta el flanco ventral del músculo aductor en donde termina en recto y ano. Músculo aductor grande en relación con el sistema digestivo (Lám. 20, figs. a y b). 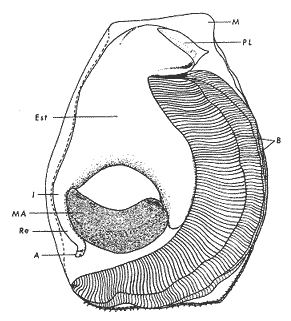 Fig. 8. Género Ostrea. Vista lateral de las partes blandas mostrando por transparencia del manto, la posición de los palpos labiales, masa visceral, saco del estilo, parte del intestino, recto, ano y branquias. Observaciones. Esta especie es fácilmente diferenciable de las otras dos especies del género Ostrea estudiadas, básicamente por las grandes costillas que forma la concha en los márgenes, con pliegues agudos. Según Keen (1971) esta especie se encuentra distribuida de Baja California (México) a Ecuador; pero tal distribución parece dudosa. Ha sido citada para las costas del Pacífico mexicano y encontrada solamente en el Golfo de California, de modo que su extensión hacia el sur es dudosa. Posiblemente esta especie haya sido confundida con C. palmula. Ostrea chilensis Philippi, 1849 N.v. "ostra" Lámina 21, figuras a, b, c y dOstrea chilensis Philippi, 1844. Kuster, Conchly. Cab., 2a. ed. 7 (1): 74, lám. 13, figs. 7, 8; Hanley, 1856. Cat. Rec. Biv. Sh.: 310; Stempell, 1899. Fauna chilensis, Zool. Jahrb., Suppl. Bd. V: 229; Von Ihering, 1907. An. Mus. Nac. B.A. Aries, 14: 246; Dall, 1909. Proc. U.S. Nat. Mus., 37: 148, 255 y 288. lám. 26, fig. 1; Dall, 1910. Nautilus, 28: 3; Lamy, 1929. Journ. Conchyl., 73 (1): 41; Hertlein, 1951. Bull. South Calif. Acad. Sei., 50 (parte 2): 68; Sevilla, 1959. SIC, Direcc. Gral. de Pesca e Ind. Conex.: 13-20, 21 figs., 1 lám.; Ramírez y Sevilla, 1965. SIC, Dir. Gral. de Pesca e Ind. Con.: 1-36, 8 figs.; Castillo, 1977. Tesis profesional Fac. Ciencias. 108p. Ostrea cibialis Hupé in Gay, 1848-58. Hist. Chile, Zool., 8: 281, lám. 5, fig. 1-1 a; Martínez y Sáenz, 1869. Moll. viaje Pacífico, Bív. mar.: 75, lám. 8, fig. 6. Ostrea virginica Carpenter (no de Gmelin), 1857. Rep. Moll. W. Coast. N. Amer.: 250-312 y 363; Carpenter (no de Gmelin), 1864. Suppl. Rep.: 621 y 666. Ostrea chilöensis Sowerby, 1871. In: Reeve, Conch. Icon., lám. 15, fig. 33; Dall, 1914. Nautilus, 28: 3. Localidad tipo. Coquimbo, Chile (Philippi, 1844). Distribución geográfica. Pullinque, Chiloé, sur de Chile. Hábitat. Estuarios, esteros o lagunas costeras, sobre fondos lodosos, arenosos o con gran porcentaje de concha o grava. Material estudiado. Seis ejemplares y 12 valvas, 4768 mm de altura. Pullinque, (Chiloé) sur de Chile, 18Nov-72. Morfología de las valvas. Concha comparativamente pequeña, moderadamente pesada, forma irregular, casi redondeada a oval trigonal. Valva superior generalmente casi plana, valva inferior profunda adherida parcialmente o por toda su superficie externa. Valva superior con líneas de crecimiento escamosas y costillas radiales, irregulares, variables en número. Charnela más o menos amplia; área ligamental mediana a pequeña; resilífero a menudo inclinado lateralmente. En ocasiones con algunos comata cerca de la charnela. Coloración externa café amarillo pardusco gris blanquecino con escasas manchas anaranjadas y violáceas en la valva inferior. Interior blanco opaco con grandes manchas doradas a veces verdosas y brillantes. Huella del músculo aductor reniforme, de color blanquecino a amarillo claro (Lám. 21, figs. a, b, c y d). Anatomía descriptiva de la cavidad del manto. Forma ovoide, color amarillento, ambos mantos iguales en tamaño, delgados, sin grandes lóbulos, de los tres bordes el segundo es más pequeño; repliegues radiales en todo el borde del manto, más visible en la región posterior, palpos interiores con aproximadamente 26 estrías en la cara interna. El extremo de las branquias se une a la base del acanalado de los palpos internos, su amplitud no pasa el borde del manto, se fusiona con él y posteriormente se dirige hacia el lado ventral, presenta aproximadamente 90 ranuras branquiales. Cavidad pericárdica pequeña, pasaje cloacal mediano, cámara suprabranquial pequeña, sin cámara promial. Músculo aductor grande en relación al total de las partes blandas. Anatomía descriptiva del sistema digestivo. Boca en el extremo anterior entre los dos pares de palpos labiales; esófago corto y estrecho hacia la abertura del estómago donde hay un reborde con muchos repliegues que se desvanecen hacia la boca. Estómago tan largo como el saco del estilo; cámara anterior poco prominente. El saco del estilo se dirige ventralmente y termina en el extremo ventral del músculo aductor. El intestino emerge lateralmente del saco y asciende junto a él haciéndose grueso; cruza hacia el lado dorsal del estómago, y continúa ascendiendo para rodear la base del esófago por el lado izquierdo y posteriormente por el lado ventral, desciende pasando por el lado ventral del estómago para cruzar nuevamente al lado dorsal del músculo aductor y terminar en recto y ano. Músculo aductor grande, en relación con el sistema digestivo (Lám. 22, figs. a, b, c y d). Observaciones. Las posibilidades de confundir a esta especie con algunas de las especies mexicanas que se asemejan son mínimas. Fue confundida originalmente por defectos de identificación con Crassostrea cortedensis, pero como lo hizo ver Hertlein (1951) ésta es una especie bastante diferente por su mayor tamaño y por presentar los márgenes de la concha lisos, además de poseer cámara promial. Como ha sido discutido por Stuardo y Martínez (1976), O. chilensis es una especie restringida a la parte central y sur de la costa chilena, aunque ha sido citada erróneamente por Dall (1909) para Perú. La especie en cuestión se diferencia de Ostrea angelica por su concha lisa sin costillas y de O. lurida por presentar estrías de crecimiento hacia los márgenes que se vuelven lamelares y foliáceas. Ostrea lurida Carpenter, 1864 N.v. "ostión cetrino" Lámina 23, figuras a, b, c y dOstrea lurida Carpenter, 1864. Brit. Assn. Adv. Sei. - 64; 1865. Jour. Conchyl., 12: 137; Gabb, 1869. Geol. Surv. Calif., Paleont., 2: 106; Sowerby, 1871. In.- Reeve Conch. Icon 18, Ostrea: sp 15, lám. 9, fig. 15; Cooper, 1888 7th. Ann. Rept. Calif. State Mineralogist: 256; Keep, 1892. West Coast Shells: 164; Williamson, 1892. Proc. U. S. Nat. Mus., 15: 193; Dall, 1898. Tert. Fauna Florida: 687; Arnold, 1903. Mem. Calif. Acad. Sei., 3: 102, 1910. U.S. Geol. Surv., Bull. 396: 167, lám. 30, fig. 12, jan. 15; Arnold y Anderson, 1910. Bull. 398: 153, lám. 52, fig. 12; Dall, 1914. Nautilus, 28 (1): 2; Clarck, 1915. Univ. Calif. Publ. Geol., 8: 419; Weymouth, 1920. Calif. Fish. and Game Comm., Fish. Bull. (4): 24; Dall, 1921. U. S. Nat. Mus., Bull. 112: 18, Diekerson, 1922. Proc. Calif. Acad. Sei., Ser. 4, 11: 563; I.S. Oldroyd, 1924. Standford Univ. Publ. Geol., 1: 50, lám. 37, figs. 10 a, b; T.S. Oldroyd, 1925. Proc. U.S. Nat. Mus., 65, Art. 22: 3; Jordan, 1926. Proc. Calif. Acad. Sej., Ser. 4, 15: 244; Waterfall, 1929. Univ. Calif. Publ. Geol., 18: 78; Lamy, 1929. Jour. Conchyliologie, 73: 39, Stephens, 1929. Trans. San Diego Soc. Canadá, 29: 131-160; Nelson, 1938. J. Mal., 63: 1-66; Korringa, 1956. Dept. Com. Ind. Div. Fish IV, Myt. (20): 1; 61; Wolke, 1960. Wach. Dept. Fish. Res. Bull., 6: 48-107; Owayle, 1969. Fish, Rev. Bol., 169: 1-192, Phibbs, 1969. Proc. Nat. She1f. Assoe. (1968) 59; Abbott, 1974. American Sea Shells 2a. ed.: 255, fig. 5267. Ostrea lurida var. laticaudata Carpenter, 1864. Brit. Assn. Adv. Sei. (Rept. para 1.863): 446; 1865. J. Conchyliol., 13: 137. Ostrea lurida var. expansa Carpenter, 1864. Brit. Assn. Adv. Sei., (Rept. para 1863); 615, 646; 1865. J. Conchyliol., 13: 138. Ostrea lurida var. rufoides Carpenter, 1864. Brit. Assn, Adv. Sei., (Rept. para 1863): 592, 615. Localidad tipo. Mazatlán, Sinaloa, México (Carpenter, 1864). Distribución geográfica. Sitka, Alaska, EU hasta Cabo San Lucas, (Baja California), México (Dall, 1914), Mazatlán, (Sinaloa), México (Sowerby, 1871). Hábitat. Según Hertlein (1951) esta especie vive, por lo general, en bahías y lagunas desde el nivel de bajamar hasta 71 m de profundidad. Material estudiado. 7 ejemplares y 14 valvas. 35-70 mm de altura, de Bahía San Quintín, Baja California, México. 28-Nov-72. Morfología de las valvas. Concha comparativamente pequeña, moderadamente delgada, de forma oval alargada a casi triangular, estrechándose hacia la charnela. Valva superior ligeramente convexa, la inferior relativamente cóncava. Hasta de 69 mm de altura y 45 mm de longitud. Ornamentación de la valva superior con líneas de crecimiento finas y ligeramente plegadas en su borde posterior. Superficie de la valva inferior libre con costillas radiales tenues e irregulares que forman, hacia el margen, un número correspondiente de pliegues; líneas de crecimiento finas, numerosas y laminares. Charnela poco amplia; área ligamental relativamente elevada, resilífero curvado lateralmente. Con algunos comata finos cerca de la charnela. Coloración externa blanco verdosa blanquecina opaca, con algunas manchas irregulares violáceas o negruzcas. Interno blanquecino con grandes manchas violáceas y tintes de color naranja. Huella del músculo aductor de forma variable, reniforme a semilunar, de color-ación verdosa a gris blancuzco teñido de púrpura (Lám. 23, figs. a, b, c y d). Anatomía descriptiva de la cavidad del manto. Forma alargada u ovoide, color amarillento, mantos desiguales en forma, delgados, sin grandes lóbulos, margen con tres bordes de casi igual tamaño, repliegues radiales del manto se observan sólo en su borde y distribuidos uniformemente. Los palpos labiales presentan aproximadamente de 37 a 43 estrías que cubren la cara interior de los palpos internos. El extremo anterior de las branquias se fusiona con la base del acanalado de los palpos interiores, el borde del manto cubre casi totalmente a las branquias y ambos de fusionan en el borde posterior hacia el lado ventral, éstas tienen aproximadamente 73 ranuras branquiales. Cavidad pericárdica y suprabranquial pequeñas, pasaje cloacal mediano, sin cámara promial. Músculo aductor grande en relación al total de las partes blandas. Anatomía descriptiva del sistema digestivo. Boca en el extremo anterior entre los dos pares de palpos labiales, esófago con estrías en la pared interna y un reborde hacia la abertura del estómago con mayor número de ellas. El estómago es amplio; cámara anterior amplia, ciego anterior en el lado ventral dirigido hacia el área posterior. El saco del estilo es más largo que el estómago y termina en el flanco ventral del músculo aductor; el intestino angosto emerge del saco y cruzando por el lado derecho se engrosa hasta llegar al lado ventral del estómago donde asciende, rodea la base del esófago, pasa sobre el ciego anterior y desciende para cruzar nuevamente hacia el lado dorsal por el lado izquierdo y terminar como recto y ano en el flanco del músculo aductor. Músculo aductor grande en comparación con el sistema digestivo (Lám. 24, figs. a y b). ESTIMACIÓN DE SIMILITUD POR ANÁLISIS "CLUSTER"
ConchaLos caracteres conchológicos muestran un grado de similitud del 99 al 100 % en Crassostrea corteziensis y C. virginica. Entre los principales caracteres similares se encuentran: concavidad moderada, posición del músculo aductor, tamaño, ornamentación externa, ausencia de comata y coloración violácea de la huella del músculo aductor que se encuentra más tenue en C. cortedensis. Carpenter (1857) y Morch (1868) con criterios semejantes llegaron básicamente al mismo acuerdo. Otro grupo de elevada similaridad (89 %) lo forma C. palmula y C. rhizophorae por caracteres tales como, talla moderada, pronunciada concavidad, posición subcentral del músculo aductor, presencia de pliegues moderados en el borde comisural de la concha. Sin embargo, a pesar de su similitud existen dos características notables que las diferencian entre sí: 1) presencia de numerosas comata en C. palmula y escasas en C. rhizophorae, 2) huella del músculo aductor bien pigmentado en C. rhizophorae. Estas dos especies son similares en los caracteres generales con el grupo anterior C. cortedensis y C. virginica; sin embargo, por lo antes mencionado ocupan un desplazamiento de diferenciación. Ostrea angelica, O. chilensis y O. lurida forman un grupo de similitud por el tamaño, posición del músculo aductor subcentral y la presencia de comata (en la mayoría de los casos difíciles de observar) a los lados de la charnela. Por otro lado, el grado de diferenciación entre ellas lo da la presencia de pliegues característicos y ausencia de pigmentación sólo en O. angelica; pigmentación del músculo aductor en C. rhizophorae y valvas sin concavidad (casi planas) en O. chilensis. Otra especie de menor similitud que las anteriores es C. iridescens que se separa de C. corteziensis y C. virginica por presentar comata a lo largo de todo el borde interno de la concha (similar a Lopha megadon), una iridiscencia muy particular (similar a L. frons) una concavidad de la concha como los representantes del género Ostrea y posición del músculo aductor, pero la ornamentación externa es similar al del grupo genérico Crassostrea, considerando que por naturaleza del sustrato al que se fija, generalmente se encuentra recubierta dando la impresión de una roca. Crassostrea gigas al igual que C. iridescens comparte también caracteres propios de las especies mencionadas pero se distingue por el característico color opalino en el interior de sus valvas (similar en algunos ejemplares de C. virginica), ausencia total de comata (como C. corteziensis), concavidad y variabilidad en la coloración de la huella del músculo aductor que se torna desde blanquecino a una marcada coloración púrpura. Por todos estos caracteres que comparte, ésta se muestra más cercana al grupo de especies del género Crassostrea. Lopha cristagalli y L. megodon forman un grupo con grado de similaridad del 90 %, basado en las características de talla mediana, concavidad moderada, ornamentación casi lisa, pliegues agudos en el borde comisural, posición del músculo aductor dorsal y anterior cerca de la charnela. El grado de diferenciación está dado por el numero de pliegues menor en L. cristagalli, así como la manera de formarse empezando desde cerca del umbo en forma casi triangular, a diferencia de L. megodon en donde los bordes son casi redondos y más grandes, además de que el espesor de los adultos es mucho mayor. L. frons ocupa el grado de similaridad más lejano de las 11 especies restantes, es la más pequeña, iridescente en el interior de las valvas, presencia de un gran número de comata a lo largo del borde interno de la concha, dispuestas en forma irregular (no presentes en ninguna otra) con pliegues agudos en el borde comisural de la concha (similar a L. cristagalli y L. megodon) que se originan desde el eje central, para terminar en el borde en forma angulosa; además, esta especie al igual que L. cristagalli, presenta espinas tubulares de fijación sobre o a lo largo del eje central de la valva interior. La similaridad de esta especie con L. cristagalli y L. Megodon está dada por la ausencia de pigmentación en la huella del músculo aductor, tipo de ornamentación externa, pliegues en el borde del manto, presencia de comata, presencia del músculo de Quenstedt. Sin embargo, un caracter de valor taxonómico que diferencia estas dos especies y L. frons, es que la última presenta la huella del músculo aductor más cercano a la charnela (Fig. 9). 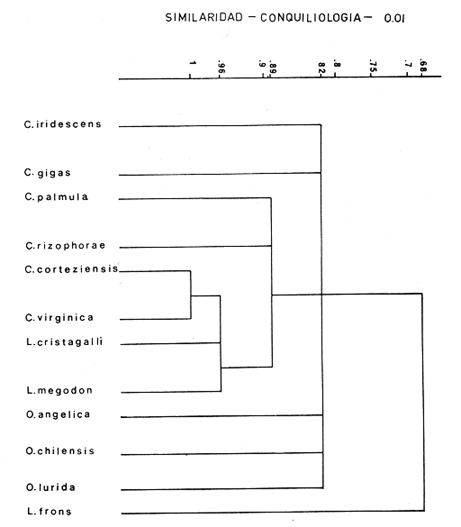 Fig. 9. Dendograma de similaridad de caracteres taxonómicos de la concha en las especies de Ostrea, Crassostrea y Lopha. AnatomíaAl igual que los caracteres de la concha donde se distinguen tres grandes grupos de especies, el resultado de similitud derivada del estudio anatómico señala tres grandes grupos. Durante el desarrollo de esta parte del trabajo, se observó la ventaja de llevar a cabo los análisis anatómicos que delimitan caracteres precisos y no tan dispersos como los que presentan las conchas (Fig. 10) En un primer grupo se encuentran Crassostrea corteziensis y C. virginica con un 98 a 99 % de grado en su similitud que lo da principalmente la presencia de cámara promial, disposición de los tentáculos en el borde del manto, disposición de las branquias, presencia de dos ciegos, uno ventro-lateral y otro por el lado izquierdo superior, disposición del intestino durante su recorrido desde el saco del estilo hasta el recto y ano pasado por todo el tubo digestivo en forma de 8. El pequeño grado de disimilitud está dado por que el número de ranuras en los palpos y branquias siempre menor en C. corteziensis. A continuación aparece C. rhizophorae con características también similares, sólo que el número de ranuras en los palpos labiales es menor que en C. virginica y los dos ciegos son de menor tamaño que en las dos especies mencionadas. Otro grupo lo forma C. gigas, con características anatómicas similares al patrón común de Crassostrea, haciéndose más distintiva por su notable diferencia en la forma del ciego ventro-lateral superior que se bifurca a manera de herradura, el pequeño tamaño del ciego izquierdo superior y la disposición acumulada de los tentáculos en el pliegue medio del borde el manto (carácter que sólo comparte con C. iridescens dentro de este grupo y con Lopha megodon y O. lurida de otros grupos). 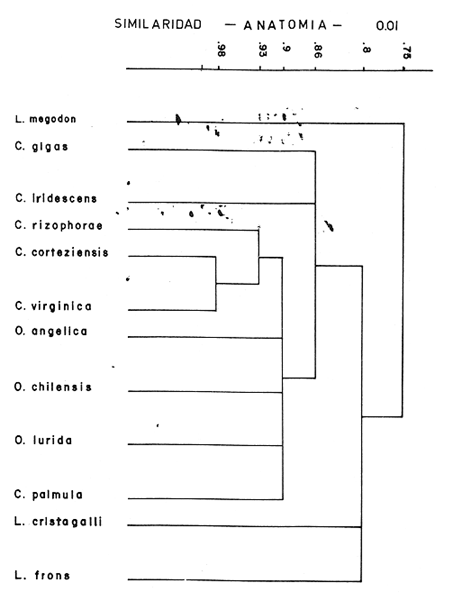 Fig. 10. Dendograma de similaridad de caracteres taxorfórnicos de anatomía de Ostrea, Cramostrea y Lopha. Otra especie en este grupo es C. iridescens que presenta diferencia dentro del marco de referencia dado para las especies anteriores. Esta disimilitud está marcada básicamente por la disposición de los tentáculos en cúmulo en el pliegue interno y medio del borde del manto y el pliegue a manera de S que forma el intestino sobre el saco del estilo al dirigirse hacia el conducto digestivo. A pesar de compartir otras características de las especies de su grupo, como la presencia de una cámara promial, número de ranuras en palpos labiales y branquias, así como la existencia de dos ciegos, esta especie al igual que C. gigas el valor que representan sus diferencias anatómicas en el análisis de agrupación o núcleo resulta de un 85% de similitud. En el segundo grupo, se encuentran ubicadas Ostrea angelica, O. chilensis, O. lurida y C. palmula, las tres primeras forman el mayor grado de similitud basado principalmente en la ausencia de una cámara promial, el número de estrías en las branquias y la presencia de un solo ciego lateral ventral superior. C. palmula sólo comparte de las características notables del grupo, la presencia de un solo ciego. Por otra parte, O. lurida se separa levemente por la forma de asa inclinada que adopta el ciego y O. chilensis por el ganchillo que forma al emerger el intestino del saco del estilo (similar a L. frons). L. frons y L. cristagalli forman otro grupo de similaridad por presentar la disposición del intestino de una manera muy sencilla a diferencia de los otros dos grupos (Crassostrea y Ostrea); este caracter se considera de gran valor para que las dos sean similares: sin embargo, existe otro caracter que las separa con la misma magnitud, y es la presencia de cámara promial solo en L. frons, además de variar notablemente de tamaño (más pequeña L. frons) y aunque ambas presentan branquias muy alargadas resultado del alargamiento propio de la concha, sólo en L. cristagalli se mantienen formados pliegues en el borde del manto reflejando los mismos bordes agudos de las valvas. Es importante hacer notar que el manto de L. frons forma principalmente hacia la parte posterior configuraciones que sugieren una adaptación sifonal a través de los pequeños orificios de la concha. Este car acter no se encuentran en ninguna otra especie de los grupos anteriores. L. megodon se encuentra en un lugar de transición entre este grupo y los dos anteriores basado en la disposición del intestino que adopta la forma de una asa al igual que las anteriores, sólo que ésta asciende más arriba de la parte media del conducto digestivo llegando al borde entre el esófago y el ciego ventro-lateral donde desciende para terminar en recto y ano sobre la parte dorsal del músculo aductor. Presenta al igual que L. cristagalli y L. frons un enorme ciego de menor tamaño que el primero y mayor que el segundo. Muchos son los caracteres que se presentan y deben tomarse en cuenta dentro del estudio anatómico de las ostras y que deben considerarse en el estudio taxonómico de las mismas. La filogenia de la familia Ostreidae se vería apoyada enormemente para su esclarecimiento y aunque en muchos registros fósiles no es posible tratar los datos anatómicos, es importante trabajar con los que actualmente se pueden estudiar. DISCUSIÓN Y CONSIDERACIONES FILOGÉNETICASEl phylum de los moluscos presenta un antepasado hipotético del cual han derivado entre otras, la clase de los bivalvos o pelecípodos como una respuesta a la acción ambiental en donde determinadas características adaptativas se desarrollaron, asi como la distribución y duración a través de muchos millones de años. La evolución de los bivalvos ha dado lugar a un valor de adaptación corto pero con una radiación de caracteres muy amplias principalmente en lo que se refiere al tipo ciliar. Muchos autores consideran que las especies que integran la familia Ostreidae, representan la cúspide de un proceso gradual evolutivo de los bivalvos; basándose en el nivel de organización progresivo que refleja tendencias evolutivas como en los Mytilidos y en los Pectinidos, diferentes a otros grupos correlacionados. La evolución de los caracteres de la concha y de las partes blandas de las especies estudiadas, hace necesario considerar su constancia como caracteres filogenéticos, es decir, su validez para la clasificación de los ostreidos en general. La clasificación de las ostras (Cuadro 1) considera a una familia probablemente difilética (Stenzel, 1971) distinguiendo básicamente 2 familias: 1) Gryphaeidae Vyalov, 1936, cuyos representantes se conocen desde el triásico, superior y, 2) Ostreidae Rafinesque, 1815, que se conocen desde el jurásico inferior. En la figura 11, se agrupan a las subfamilias y los géneros con especies actuales, incluyendo a los considerados en este estudio ilustrando su categoría geológica. La clasificación sigue a Sten zel (1971). También se han incluido a los géneros Agerostrea y Rastellum de Lophinae, discutidos en el texto.  CUADRO 1  Fig. 11. Categoría geológica de los representantes más antiguos de la familia Ostreidae, incluyendo subfamilias y géneros actuales. Las diferencias más notables entre las familias Ostreidae y Grypliaeidae según Stenzel (1971) se refieren a: la escultura charnelar de la prodisoconcha, forma de la impresión del músculo aductor en la concha y el curso del intestino con respecto al corazón. Comparando la variación de estas estructuras, se puede deducir que estas diferencias morfológicas representan un caracter filogenético que separa totalmente a las dos familias como unidades filogenéticas independientes. La opinión sobre el origen difilético de las ostras es bastante antiguo. Fue planteada por Pelsenner en 1826 y confirmada por diferentes autores, quienes consideran más primitivas las características de la familia Gryphaeidae, asumiendo que estaban presentes ya en los primeros representantes de Gryphaea en el triásico, aún cuando estos caracteres no dejaron trazas reconocibles en las conchas fósiles. Sin embargo, hay tres características que considerándose primitivas si han dejado huella en la concha. 1. La forma orbicular de la inserción del músculo aductor 2. La posición de esta inserción comparativamente más cercana a la charnela que en el familia Ostreidae 3. El eje de la charnela La importancia de estas dos últimas características no sólo son válidas para los Gryphaeidae, sino también en general para los otros ostreidos y bivalvos. El músculo aductor y otras estructuras internas están funcionalmente ligadas, de modo que cuando el primero cambia de posición se producen variaciones de orientación compensatorias, en las partes blandas. Esta relación ha sido discutida y establecida por Awati y Rai (1931) y especialmente por Yonge (1960), Stasek (1963) y Stenzel (1971). Indudablemente hay otras relaciones funcionales entre la forma general, la posición del músculo aductor y el conducto digestivo, que de acuerdo con los resultados del presente estudio son de interés discutir. Se considera que una de las características más sobresalientes dentro del valor adaptativo de los bivalvos, es el cambio de la condición dimiaria a monomiaria que provoca una reorganización del cuerpo y manto de la concha (Yonge, 1953). La condición monomiaria, derivada de la dimiaria, se completó cuando carecían completamente del músculo aductor anterior. La familia Ostreidae, corresponde a este grupo y ningún ejemplar fósil muestra indicios de la presencia del músculo aductor. Sin embargo, los ejes del cuerpo como el eje boca- ano, se encuentran bien representados según Stenzel (1971). Los ejes de orientación anatómica en los ostréidos, resultan más problemáticos que en otros grupos de bivalvos; sin embargo, los ejes que se representan en este trabajo son de importancia análoga a la del grupo de los dimiarios, excepto al eje anteroposterior, ausente en las ostras. Las especies de los géneros Crassostrea y Ostrea analizados en este trabajo, tienden a ser orbiculares cuando son juveniles y las líneas concéntricas llamadas "Líneas de Crecimiento" se diponen a partir del istmo de una manera casi circular: sin embargo, estas líneas concéntricas se convierten en ovoides en el estado adulto. Con respecto al eje boca-ano (en dimiarios eje antero-posterior) no se encontró una relación directa con el resto de los ejes (de no ser la ubicación imaginaria, que permite saber la posición de las partes blandas con respecto al eje de la charnela). Los paleontólogos han utilizado el eje de la charnela, como guía de orientación anatómica, identificándolo con el eje anteroposterior, de modo que la charnela y la región umbonal corresponden siempre al dorso. La mayoría de los neontólogos, sin embargo, han preferido la utilización del eje bocaano o boca-parte media-aductor posterior como indicador del eje antero-posterior del animal, de modo de que no siempre la charnela corresponde a la parte dorsal, ni las partes opuestas a la ventral. En espacial, Yonge (1963), ha contribuido en acelerar el concepto, sugiriendo que el manto más la concha y el cuerpo pueden considerarse como entidades separadas que, sin embargo, interactúan en mayor o menor grado en los distintos grupos de bivalvos. Esto fue lo que Stasek (1963) denominó por el concepto de "las entidades independientes" y las considera de escaso valor. Sin embargo, la evolución entre los bivalvos dimiarios y monomiarios con los anisomiarios como intermedios, demuestra irrefutablemente la validez de este concepto, ya que por una parte, las conchas de los bivalvos son el producto de cambios en los gradientes de crecimiento de los márgenes del manto; mientras que el cuerpo puede permanecer inalterado cambiando sólo su disposición en los animales no fijos, o cambiando considerablemente sus proporciones en el caso de los animales fijos, como en las ostras, de acuerdo con Yonge (1953) y Carter (1968), quienes expresan igualmente estos beneficios y añaden los resultados de efectos hidrodinámicos como beneficio en la alimentación y hacen una moderada comparación en la morfología de las branquias en forma de W con una trama de filtración elevada. Vermeij (1978), considera que muchas ostras, propias de áreas tropicales, así como otros bivalvos que también se fijan al sustrato, caracterizados por presentar márgenes en zig-zag, mantienen menos tiempo abiertas sus valvas en el medio, a diferencia de otras especies de áreas templadas o frías, que permanecen más tiempo abiertas lo cual puede atribuir-se a la presencia de un mayor número de depredadores en áreas tropicales. En este trabajo se considera la importancia de las comisuras, reforzada por las comata a lo largo del borde interno de la concha, como mecanismo para la obtención de una mayor fuerza en el cierre de las valvas, como sucede en Lopha frons, que la hace más vulnerable a sus enemigos, a diferencia de L. cristagalli y L. megodon especies subtropicales que presentan un menor número, pero esto queda compensado por una concha gruesa y de mayor tamaño. Recientemente, se ha propuesto dentro de la taxonomía numérica una forma de clasificación numérica en unidades taxonómicas basada en diversas características (Sneath y Sokal, 1973). La correlación hecha sobre las diferentes especies estudiadas determinó el grado de similaridad y disimilaridad entre ellas. De acuerdo a los dendogramas elaborados se concentran 3 grupos básicos de similaridad tomando en cuenta las características propias de las conchas. 1) Crassostrea corteziensis y C. virginica 2) C. palmula y C. rhizophorae 3) Lopha cristagalli y L. megodon C. cortedensis representa caracteres muy similares a C. virginica y en menor grado a C. palmula y C. rhizophorae, le siguen C. iridescens y C. gigas. Este grupo coincide para representar a las especies del género Crassostrea propuestas anteriormente y salen del grupo, por presentar caracteres con un mayor grado de disimilaridad Ostrea angelica, O. chilensis y O. lurida, coincidiendo con el género Ostrea propuesto anteriormente. Lopha cristagalli y L. megodon forman un grupo, separándose ampliamente de ellas L. frons que queda más cerca del grupo de Ostras (sólo los pliegues comisurales -similares a las dos especies anteriores- destacan su diferencia). Resulta importante aclarar que los paleontólogos ubican a L. frons dentro del género Ostrea. Este grado de similitud basado exclusivamente en los caracteres de las conchas se deforma cuando intervienen además los caracteres anatómicos mencionados. CARACTERISTICAS ANATÓMICASEl manto de las ostras aparentemente presenta características uniformes. Sin embargo, se encontraron dos aspectos al parecer importantes: 1) la presencia de pliegues en el borde del manto y, 2) la disposición de los tentáculos en los pliegues medio e interno. Cierto es que muchos autores toman en cuenta la coloración del animal, sin embargo, en la mayoría de las especies estudiadas, generalmente presentan un color blanco amarillento, que puede ser más o menos acentuado de acuerdo al estudio gonádico; con excepción de Lopha frons y Crassostrea rizophorae que muestran generalmente una coloración rojiza la primera, y rojo violáceo la segunda, lo cual se puede atribuir a la influencia de los sustratos típicos respectivamente gorgoniáceos y raíces de mangle (Rízhopora mangle). La presencia de pliegues en el manto, en correspondencia con los de la concha, se hallan muy bien representados en L. cristagalli, L. megodon y L. frons. Los pliegues agudos de la concha de estas especies influyen en el borde comisural, que bordea claramente el interior de la concha. En las especies del género Ostrea, como O. angelica, se presentan pliegues moderados; sin embargo, el borde del manto no está modificado. Las especies del género Crassostrea: C. palmula y C. rhizophorae también se caracterizan por llevar el borde de la concha ligeramente plegado, aún así el borde del manto no muestra ningún indicio de pliegues. Sin embargo, es importante hacer notar que el lóbulo izquierdo del manto es más profundo que el derecho, en especies cuya concha izquierda es más cóncava que la derecha. Este carácter está bien representado en C. gigas, C. rhizophorae. Los tentáculos del manto presentan variaciones muy interesantes, en número y disposición. Las especies del género Lopha muestran en detalle un pliegue externo liso; el pliegue medio lleva un mayor número de tentáculos como se observa en L. megodon y el pliegue interno se conserva con el mismo número y disposición en las tres especies. Las especies del género Crassostrea tampoco presentan tentáculos en el pliegue externo. En el pliegue medio, los tentáculos se disponen en tres a cuatro pequeños lóbulos alternando con uno mayor, esta disposición está generalizada para todas las especies, salvo para C. iridescens y C. gigas en las que se observan 5 hileras de tentáculos de forma heterogénea, el pliegue interno muestra una disposición uniforme en todas las especies. Las especies del género Ostrea presentan el patrón común del pliegue externo; el medio está constituido por dos a tres hileras de tentáculos y su disposición es similar a las especies del género Crassostrea exceptuando a O. lurida. El pliegue interno sigue el patrón común de las especies del género Crassostrea. Los representantes más antiguos de la familia Ostreidae son las especies de Lopha y todas ellas tienen como carácter común la impresión del aductor de forma de media luna a reniforme, colocada más cerca del margen posterior que del anterior (charnela), pero en otras, como las especies de Rastellum provenientes del jurásico y Agerostrea del cretácico superior, presentaban una forma falcada y una impresión del aductor en forma de coma, situada muy cerca de la charnela. Esta tendencia se ha manifestado según se observó en las especies estudiadas del género Lopha. En todas las especies, el sistema digestivo sigue un patrón común con respecto a su disposición general, desde el esófago, estómago, saco del estilo, forma de emersión del estilo y conformación del intestino con respecto al estómago y músculo aductor. Sin embargo, del estudio anatómico detallado de las especies de los 3 géneros aqui tratados, muestran características peculiares para cada una de las especies. La estimación de similaridad en los dendogramas, destaca que L. cristagalli y L. frons ocupan un grupo cercano al de L. megodon. En estas tres especies la posición del eje longitudinal (anteroposterior) del intestino es casi paralela al mismo eje del aductor. Dicha disposición representa un carácter definitivamente primitivo, correspondiendo quizás a una tendencia secundaria como resultado del alargamiento propio de la concha, o símplemente, a una línea evolutiva independiente de la forma subcircular típica de Actinostrea, Crassostrea, Ostrea y Pycnodonte. Las especies de los géneros Ostrea y Crassostrea muestran una disposición muy diferente ya que el eje antero-posterior del aductor es casi perpendícular al eje antero-posterior del estómago e intestino anterior, sin embargo, la disposición del intestino, con respecto al saco del estilo y su recorrido en torno al eje del sistema digestivo es más complejo en estas especies que en las del género Lopha y se constata una muy posible relación gradual entre las tres especies que sugieren el cambio inicial seguido por el alargamiento del intestino y su desplazamiento hacia el lado izquierdo característico de las especies de Crassostrea y Ostrea que se suponen más evolucionados. En el caso de L. frons y L. cristagalli el origen y curso del intestino es una simple asa lateral desplazada hacia la parte derecha del cuerpo. En L. megodon esta se alarga un poco más y gira hacia el lado izquierdo permaneciendo todavía en posición dorsal al estómago. En las especies de Ostrea y Crassostrea por el contrario el alargamiento se acentúa y el asa se desplaza ahora sobre la pared lateral izquierda del estómago constituyendo la figura de un 8, típica de estos géneros. Este hecho da pruebas evidentes de la evolución en la disposición del intestino desde la forma de una asa hasta la forma típica actual de un 8. Otra de las características que en el analísis de agrupación se destacan, es el número y forma de ciegos o tiflosoles en el sistema digestivo, con la organización de 3 grupos básicos: 1. L. frons, L. cristagalli y L. megodon cuyas similitudes son básicamente: la presencia de un solo ciego de gran tamaño, en comparación con las del género Crassostrea y Ostrea, la formación de pliegues comisurales en el manto (ausentes en las especies del género Crassostrea y Ostrea) siguiendo el pliegue de la concha. A este respecto cabe aclarar que L. frons presenta dichos pliegues de una manera más irregular, semejando en algunos casos verdaderos sifones que se conducen a través de la concha por espinas hióticas perforadas al exterior. Con respecto a las diferencias básicas de los tres géneros de Lopha, destaca la disposición del intestino en formasencilla, a manera de simple asa que corre sobre la parte media del tracto digestivo para L. frons y L. cristagalli pero para L. megodon el intestino cambia ligeramente el giro del asa, alcanzando mayor altura en el traeto digestivo, tratando de disponerse como las especies del género Crassostrea y Ostrea. 2. El segundo grupo lo forman O. angelica, O. chilensis, O. lurida y C. palmula que también presentan un solo ciego menos prominente que en los del grupo anterior y diferentes en forma al de O. lurida. La disposición del intestino se presenta en dichas especies de manera uniforme, siguiendo un recorrido en forma de 8 sobre el conducto digestivo, igual que en el género Crassostrea y diferente al género Lopha. 3. En el tercer grupo se encuentran el mayor número de especies, C. corteziensis con un elevado grupo de similitud con C. virginica y C. rhizophorae. Continúa en orden descendente C. iridescens y C. gigas que siguen en general el patrón común del grupo, pero se hacen diferentes por la presencia de un ciego dorso-lateral posterior bifurcado en la primera y la formación de un asa que hace el intestino sobre el saco del estilo durante su ascenso en la segunda. La organización para este grupo de especies que coinciden relativamente, permite establecer una hipótesis de líneas divergentes dentro del género, a partir del antepasado inmediato. HABITATLas especies de la familia Ostreidae, se encuentran habitando una larga faja costera, sobre el margen de los continentes dentro de las latitudes 64'N y 44'S (Galtsoff, 1964) evitando bajas temperaturas sobre todo en las regiones polares. Las ostras son habitantes típicos de los esteros, desembocaduras de ríos, lagunas costeras y de todas aquellas formaciones litorales en las que se mezclan las aguas marinas con las continentales, dando lugar a salinidades adecuadas y por supuesto el requisito indispensable de un sustrato, adecuado para que se fijen las larvas y prosperen los adultos. El sustrato para estos bivalvos, varía desde rocoso en áreas marinas (C. iridescens), gorgoniáceos y arrecifes, formando parte de ellos como varias especies del género Lopha, raíces de mangle en aguas salobres como C. rhizophorae, C. palmula y O. lurida hasta fondos fango-arenosos compactos cómo C. corteziensis y C. virginica entre otros. Esta adaptación a diferentes sustratos, ha sido aprovechada para el desarrollo de diferentes técnicas en el cultivo del ostión, como los bastidores y sartas, formas de cultivo en suspensión para la producción de semillas y adultos. Por lo que respecta a los parámetros ambientales, la temperatura ocupa un lugar importante tanto para los procesos reproductivos como en las actividades de nutrición y crecimiento así Como su relación con la presencia y distribución de larvas. Respecto a la salinidad, las ostras toleran gradientes amplios, pudiendo habitar en zonas con salinidades que oscilan desde 10 ppm hasta 27 ppm y sobreviven sólo por un tiempo limitado en condiciones con valores o menores, de lo contrario, son afectadas severamente, principalmente en los procesos de gametogénesis. Las especies del género Crassostrea parecen tolerar a un amplio gradiente de salinidad, por ejemplo, C. rhizophorae se desarrolla en agua salobres, hasta hipersalinas en diferentes entidades del país. En general, se opina que las ostras de mejor calidad son producidas en áreas de salinidades relativamente altas, que según Ramírez y Sevílla (1965), puede apreciarse en ciertas localidades del Golfo, como en Morón, Tamaulipas y diversas entidades de Veracruz, en pequeñas lagunas costeras con salinidades relativamente altas, en las que se producían ostras afamadas por su calidad; sin embargo hay que hacer notar que sí bien es importante el sabor de este recurso, también lo es la calidad y el tamaño así como las propiedades nutritivas que algunas especies de ostras presentan en áreas cuyas salinidades no son muy elevadas. La dinámica de las aguas es también de primordial importancia en la biología de las ostras, ya que las corrientes que se establecen en los cuerpos de agua habitados por estos bivalvos, afectan tanto a sus estadios larvarios como a los adultos, ya que por un lado incrementan la distribución de las larvas y además facilitan el transporte de alimento, presentando en este caso un efecto indirecto sobre la reproducción y crecimiento. Lo anterior es aplicable igual a las corrientes relacionadas con las mareas como las producidas por los vientos. Para tal motivo, los vientos y corrientes dominantes determinan los lugares de fijación más densa. Mucho son los factores que determinan el desarrollo de las ostras, sin embargo, no es el objetivo de este trabajo mencionarlos, sólo se quiere apoyar la importancia de los estudios de dinámica poblacional para las ostras que constituyen un recurso de gran importancia para el país, considerando la demanda interna y las amplias zonas que ofrecen nuestras costas susceptibles para el incremento de su producción y beneficio. Un análisis de agrupamiento basados en el habitat de las ostras, forma un grupo de elevado grado de similaridad con Crassostrea cortezien y C. palmula, le siguen C. gigas y por último se disponen Ostrea lurida y O. angelica. Este grupo es afin en la distribución, habitando las costas del Pacífico mexicano. C. gigas ha sido introducida, pero soporta las condiciones ambientales de Baja California Norte, Sonora y Los Mochis, (Sinaloa); O. lurida y O. angelica están mejor distribuidas hacia Baja California y Sonora. Por otro lado C. virginica y C. rhizophorae están esparcidas en una amplia zona desde las costas orientales del norte de EU hasta Brasil, exlotándose comercialmente en varias localidades. Pero la distribución al otro lado de la costa del continente Americano, las separa del primer grupo mencionado. O. chilensis se encuentra explotada principalmente hacia el sur de la costa del Pacífico, con temperaturas más estables propias de la zona de la costa de Chile de donde es nativa. Conclusiones1. Las especies de ostras a través de su filogenia han sufrido cambios estructurales dentro de sus limitaciones como organismos bentónicos, dentro de las cuales una de las más evidentes es la eficiencia de alimentación. 2. El hábitat preferencial de las ostras, está correlacionado con la forma y fijación de la concha, así como en la estructura adaptativa que les permite una mayor habilidad para obtener alimento; lo cual se refleja en el sistema digestivo, características propias a nivel genérico y de especie. 3. En relación a la afinidad genética de las especies, que constituyen a la familia Ostreidae, las tendencias evolutivas son muy amplias y por consiguiente difíciles de ubicar taxonómicamente, así el conocimiento de las variaciones estructurales, en este caso del sistema digestivo por, especie, desde sus disposiciones más antiguas hasta las actuales, demuestran y clasifican parte de su historia evolutiva, caracterizando las funciones básicas de adaptación propia de las ostras en ambientes salobres y marinos. 4. De acuerdo al criterio de similaridad respecto a la concha, se formaron tres grupos básicos Lopha, Ostrea y Crassostrea. 5. De acuerdo al criterio de similaridad con respecto al estudio anatómico se formaron los grupos Ostrea Crassostrea y Lopha; las especies de este último género demostraron una diferencia gradual en cuanto a la forma del intestino, desde la considerada más primitiva como en L. cristagalli y L. frons, hasta la forma más cercana a la actual como en L. megodon. 6. Los caracteres exclusivamente de la concha no permiten establecer claras diferencias entre los géneros Crassostrea y Ostrea; sin embargo, el estudio detallado del conducto digestivo presenta notables características entre las que destacan el número, tamaño y forma de ciegos gástricos, disposición del intestino en relación con el estómago y saco del estilo, número de ranuras en palpos labiales y branquias, así como la ubicación y forma del músculo aductor dentro de la disposición uniforme anatómica de las ostras. 7. Las especies del género Lopha como L. cristagalli, L. from y L. megodon coinciden con sus características conchológicas sobre todo en lo que se refiere a los bordes comisurales en zig-zag, pero anatómicamente difieren mostrando en el orden mencionado, una sucesión progresiva en la disposición del intestino desde una simple forma de asa, hasta el alargamiento y flexión de la misma semejante a la forma de un 8, como acontece en las especies de Crassostrea y Ostrea. Es probable que basándose en la disposición del intestino estas tres especies sean más antiguas que el resto de las especies de la familia Ostreidae. 8. Las especies del género Crassostrea, se agrupan de acuerdo con las siguientes bases: 1) la disposición del intestino desde su inicio en el saco del estilo hasta el ano en forma de 8, 2) por la presencia de dos ciegos gástricos (variable en C. gigas) y, 3) presencia de una cámara promial. Las especies del género Ostrea se agrupan basándose en a: 1) disposición del intestino desde el saco del estilo hasta el ano, 2) presencia de un ciego (variable en O. lurida) y, 3) ausencia de cámara promial. 9. Como resultado del análisis del grado de similaridad de concha y anatomía en las 12 especies dispuestas al azar para su estudio, es decir sin considerar su clasificación bajo determinados géneros, se organizaron tres grupos básicos Lopha, Crassostrea y Ostrea. 10. Lopha cristagalli, L. frons y L. megodon son especies que reflejan anatómicamente la separación más amplia entre los géneros Crassostrea y Ostrea. 11. Lopha megodon de acuerdo a las características conchológicas y a la ausencia de cámara promial, es clasificada bajo el género Ostrea; sin embargo, en este trabajo se consideró necesario colocar a esta especie bajo el género Lopha, porque las características anatómicas entre las que destacan las del sistema digestivo, curso del intestino, así como el número de ciegos gástricos, corresponden al género. CLAVES PARA LA IDENTIFICACIÓN DE 12 ESPECIES DE LA FAMILIA OSTREIDAE
A. BASADA EN CARACTERISTICAS DE LA CONCHAPliegues agudos en el margen de la comisura de concha........Lopha........1 Pliegues moderados en el margen de la comisura de concha. Ostrea y Crassostrea........2 1 Abundantes comata bien marcados en el borde interno de la concha, con ubicación anterior de la huella del músculo aductor, altura promedio 60 mm, con más de 10 pliegues agudos en la comisura de la concha ...........Lopha frons 1' Escasos comata, poco aparentes en el borde interno de la concha, ubicación subcentral de la huella del músculo aductor .... 3 2 Comata en el borde interno de la concha . .......................... 4 2' Sin comata en el borde interno de la concha . .................. 5, 3 Presencia de espinas hioticas en la valva izquierda para fijación con 3 a 4 pliegues agudos...................Lopha cristagalli 3' Sin espinas hióticas en la valva izquierda, con 4 a 5 pliegues agudos completos.................. Lopha megodon 4 Anacomata y Catacomata a lo largo del borde interno de las valvas ........................... . 6 4' Anacomata y Catacomata presentes principalmente a los lados de la charnela 7 5 Pliegues moderados conspícuos a lo largo de la comisura de la concha, huella del músculo aductor fuertemente pigmentado, valva izquierda comúnmente profunda y generalmente con una marca de fijación de raíz de mangle.......................Crassostrea rizophorae 5' Pliegues moderados de la comisura de la concha no conspícuos, huella del músculo aductor de leve a bien pigmentado ...............9 6 Superficie interna de las valvas, blanquecino con lustre iridiscente ..................Crassostrea iridescens 6' Superficie interna de las valvas verde olivo, comata generalmente distribuidos a los lados de la charnela pudiendo sobrepasar la mitad del margen de la concha, presencia de pliegues moderados conspícuos, concavidad de la valva izquierda profunda y generalmente con marcas de fijación de raíz de mangle, huella del músculo aductor casi sin pigmento. ................... Crassostrea palmula 7 Posición del músculo aductor generalmente postero-lateral, forma subtrigonal, superficie interna de las valvas blanquecinas con manchas violáceas, huella del músculo aductor moderadamente pigmentado, generalmente con una banda oscura violácea en el margen poste rior de la valva izquierda. ...................Ostrea lurida 7' Posición del músculo aductor generalmente subcentral. ..................... 8 8 Pliegues moderados conspícuos, huella del músculo aductor casi sin pigmento, superficie interna blanco y ocasionalmente con man chas verdes olivacea .................................Ostrea angelica 8' Pliegues moderados no conspícuos, huella del músculo aductor sin pigmentación forma generalmente subcircular, superficie interna de las valvas blanquecino con manchas violáceas. .......................Ostrea chilensis 9 Huella del músculo aductor fuertemente pigmentado. ........................Crassostrea virginica 9' Huella del músculo aductor levemente pigmentado. ..........................................10 10 Superficie interna de las valvas blanco opalino, huella del músculo aductor ocasionalmente con manchas púrpura o generalmente sin color. ...........................Crassostrea gigas 10' Superficie interna de las valvas blanco o blanco con líneas púrpura, huella del músculo aductor levemente pigmentado con líneas púrpura. ................................Crassostrea cortedensis CLAVE PARA LA IDENTIFICACIÓN DE 12 ESPECIES DE LA FAMILIA OSTREIDAE
B. BASADA EN CARACTERÍSTICAS ANATÓMICASPericardio rodea parte del intestino ........................ Pycnodonte Pericardio no rodea parte del intestino....................................Lopha, Ostrea y Crassostrea 1 1 Con cámara promial..........................................2 1' Sin cámara promial.......................................................3 2 Emersión del intestino sobre el saco del estilo formando una asa................................Crassostrea iridescens 2' Emersión del intestino sobre el saco del estilo sin asa.................................................4 3 Disposición del Intestino en forma de 8............................................................9 3' Disposición del Intestino en forma de asa..........................................10 4 Presencia de un ciego gástrico......................................5 4' Presencia de dos ciegos gástricos............................................................6 5 Intestino en forma de 8..............................................Crassostrea palmula 5´Intestino en forma de herradura o asa.............................................Lopha frons 6 Ciego antero-lateral en forma de herradura .... ............................ Crassostrea gigas 6' Ciego antero-lateral semicircular..................................7 7 Número de ranuras branquiales mayor de 140...........................................Crassostrea rizophorae 7´Número de ranuras branquiales menos de 140......................................8 8 Ciego antero-lateral en forma de cinta..............................................Crassostrea virginica 8' Ciego antero-lateral en forma circular....................................................Crassostrea corteziensis 9 Emersión del intestino del saco del estilo con gancho ............................. Ostrea chilensis 9' Emersión del intestino del saco del estilo sin gancho................................................. 11 10 Disposición del intestino en una asa sin llegar a la altura del esófago.....................................Lopha cristagalli 10' Disposición del intestino en una asa llegando a la altura del esófago.....................................Lopha megodon 11 Ciego antero-lateral con forma subcircular..........................................Ostrea angelica 11' Ciego antero-lateral en forma semielicoidal..................................................................Ostrea lurida  RELACION DE MUESTRAS SUPERFICIALES: LOCALIZACION Y PROFUNDIDAD DEL MAR AgradecimientosA Felipe Amezcua Linares, por sus valiosos comentarios y elaboración de material gráfico. A Margarito Alvarez Rubio, por su participación en el proceso de los resultados expresados en "cluster". A Eduardo Sáinz-Hernández por su asistencia en computación y aspectos editoriales y muy especialmente a la valiosa participación de José Stuardo Barria. LITERATURAABBOTT, R. T., American Sea Shells. Van Nostrand Reínhold Co. 1974 445-457 AHMED, M. y A. K. SPARKS A preliminary study of chromosomes of two species of oyster, (Ostrea lurida and Crassostrea gigas). J. Fish. Res. Bd. Can. 1967 2155-2159 24 AWATI, P. R. y H. S. RAI Ostrea cucullata (The Bombay oyster). Indian Zool. Mem. on Indian animal types 1931 107 p. (3) BARDACH, E. J., J. H. RYTHER y W. O. Mc LARNEY Aquaculture. The farming and husbrandry of freshwater and marine organisms. Wiley-Interscience, Inc. New York 1972 BRUGUIERE, J. Tableau encyclopédique et méthodique des trois régnes de la nature contenant l`helminthologie, ou les vers infusoires, les vers intestins, les vers mollusques . (Paris) 1791-1792 livr. 7, pt. 1 (1791), i-viii + 1-83 p., pl. 1 -95; pt. 2 (1792), p. 85-132, pl. 96-189 CARPENTER, P. P. Catalogue of the Reigen Collection of Mazatlan Shells in the British Museum London 1857 552p. CARTER, R. M. Paleontology Fuetional studies on the cretaceous oyster Arctostrea. 1968 458-484 11 (3) CASTILLO, R. Z. G. Tesis profesional. Contribución al estudio taxonómico de algunas especies mexicanas de la familia Ostreidae. Fac. Ciencias, Univ. Nal. Autón. México. 1977 108 p. CONTRERAS, F. An. Inst. Biol. Univ. Nal. Autón. México Datos para el estudio de los ostiones mexicanos. 1932 193-212 3 (3) DALL, W. H. Am. Naturalist. American work in the department of recent mollusca during the year 1879. 1880 426-436 14 (6) DALL, W. H. Report on the collection of shells from Perú. Proc. U.S. Nat. Mus. 1909 147-249, láms. 20-28. 37 DALL, W. H. Notes on west american oysters. Nautílus. 1914 1-3 28 (1) DAVIES, R. G. Computer Programin in Cuantitative Biology. Academic Press Inc. Londres 1971 429 p. DINAMANI, P. Malacología Variation in the stomach structure of the bivalvia. 1967 241-244, figs. 9 y 10. 5 (2) DUSHANE, H. y R. POORMAN. A checklist of mollusks for Guaymas, Son. México. Veliger 1967 9 (4) ELSEY, C. R. On the structure and funetion of the mantle and gill of Ostrea gigas (Thunberg) and Ostrea lurida (Carpenter). Royal Soc. Canada, Trans. 1935 29 sec. 5 GALTSOFF, P. S. Físh. Bull. The american oyster Crassostrea virginica Gmelin. U. S. Bur. Commercial Fisheries 1964 1-45 64 GRABAU, A. W. Early Permian fossi1s of China. pt. 2, Fauna of the Maping Limestone of Kwangsi and Kweichow. Geol. Survey China, Palaeontologia Sinica, ser. B 1936 320 p., 31 pl., 9 p. of summary in Chinese. 8 (4) GRAHAM, A. The molluscan stomach. Trans. Hoy. Soc. Edinb. 1949 737-776 61 GUNTER, G. The generic of living oyster and the scientific name of the common american species. Am. Midland Naturalist. 1950 438-447 43 (2) HANLEY, S. A description of new species of Ostrea' in the collection of H. Cuming Esq. Proc. Zool. Soc. London 1845 105-107 HERTLEIN, G. Pliocene and Pleistocene mollusca of California. Memoirs San Díego Soc. Nat. Hist. 1931 150-154 1 HERTLEIN, G. Bull. Soc. Calif. Acad. of Sci. Description of two new species of marine pelecypods from West México. 1951 68-74, 3 figs. 50 (2) HERTLEIN, G. The Veliger Notes on California oysters. 1959 5-8, 2 láms. 2 (1) HERTLEIN y STRONG. Zoologica Mollusks of México and Central America. New York Zoological Society. 1946 54-55, fig. 14. HIRASE, H. On the classification of japonese oyster Natl. Res. Councíl Japan, Japanese Jour. Zoology 1930 1-65 3 (1) HUXLEY, J. S. Problems of Relatíve Growth. Méthuen and Co. London 1932 JACKSON, R. T. Phylogeny of the Pelecypoda, the Aviculidae and their allíes. Mem. Boston Soc. Nat. Hist. 1890 277-400 4 (8) KEEN, A. M. Sea Shells of Tropical West America. Stanford Univ. Press. 1958 624 pp. 11 KEEN, A. M. Sea Shells of Tropical West America. Marine Mollusks from Baja Calífornia, México to Perú. Standford University Press. Second Ed. USA 1971 82-84, figs. 170, 172-174. KELLOGG, J. L. U. S. ,Fish. Comm., Bull. A contribution to our knowledge of the morphology of Lamellibranchiate mollusks 1892 10, art. 15. KIRA, T. Shells of the Western Pacific. Holkusha 1 Publisihg Co., LTD. 1975 144, lám. 52. 1 LAMARCK, J. B. Systeme des anímaux sans vertebres, ou table général des classes, des ordres et des genres de ces animaux Detervílle (Paris) 1801 432 p. LAMY, E. Révision des Ostrea vivants du Muséum National d'Histoire Naturelle de Paris. Jour. Conchyliologie 1929-1930 73 (ser. 4, 27) (1) LINNAEUS, C. V. Systema Naturae Per Regna Tria Naturae (Stockholm) 1758 824 p. 10 1 LISON, L. Bull. Class. Sei. Acad. Roy. Caractéristiques géométrique naturelles des Res de Lamellibranches. Belgique 1942 377-390 serie 5 28 LOOSANOFF, V. L. y C. A. NOMEJKO. Biol. Bull. Existence of physiologically different races of oysters, Crassostrea virgínica. (Woods hole) 1951 151-156 2 Mc LEAN, R. A. The oysters of the Western Atlantic. Acad. Nat. Sci. Philadelphia, Notulae Naturae 1941 1-14 67 MATTOX, N. T. Ecol. Mon. Studies on the biology of the edible oyster, Ostrea rhizophorae Guilding, in Puerto Rico. 1949 340-356, 14 figs. 19 (4) MENZEL, R.W. Some phases of the biology of Ostrea equestris (Cristata) Say and a comparison with Crassostrea virginica (Gmelin) Inst. of Mar. Sci. 1955 70-151 4 MÖRCH, O. A. L. Oversigt Islands Blodgry. Faunula Molluscorum Islandiae. Vidensk Meddel. Naurhist., Forening i Kjobenhavn 1868 185-227 1868 MORTON, J. The molluscan pattern: Evolutionary trends in a modern classification. Proc. Linn. Soc. London 1961 59-65 174 NELSON, T. C. The feeding mechanism of the oyster. I. On the pallium and the branchial chambers of Ostrea virginica, O. edulis and O. angulata, with comparisons with other species of the genus. Jour. Morphology 1938 1-161 63 (1) OLSSON, A. A. Mollusks of the tropical eastern Pacific particulary from the Southern half of the Panamic - Pacific faunal province (Panamá to Perú). Panamic Pacific Pelecypoda. Paleont. Research Inst. Ithaca N. Y. 1961 171-174, lám. 23. ORTON, J. H. Nature On the significance of "ring" on the shells of Cardium and others molluscs. 1923 112 (10) ORTON, J. H. Nature The dominant species of Ostrea. 1928 320-321 121 (3044) OWEN, G. The shell in the Lamellibranchia. Quart, Jour. Micr. Sci. 1953 57-70 94 (1) PELSENEER, P. Les Lamellibranches de I'expeditíon du Síboga, partíe anatomique. Siboga - Expeditie Mon. 1911 125 p., 26 láms. 53 a (61) PURCHON, R. D. The stomach in the Eulamellíbranchia: stomach types IV and V. Proc. Zool. Soc. Lond. 1960 431-489 135 PURCHON, R. D. y M. E. SOLARI Studies on the distribution of species of prosobranch and pulmonate snails on the limestone hills of Malaya. Proc. Symp. on Mollusca Emakulam India 1968 223-230 RAMÍREZ, R. G. y M. L. SEVILLA Las Ostras de México. Secretaría de Industria y Comercio. Dirección General de Pesca a Industrias Conexas 1965 1-36, 8 figs. RANSON, G. Bull. Mus. Roy. d'Hist. Nat. de Belgique Prodissoconques et clasification des Ostréides vivants 1948 a 24 112 RANSON, G. Bull. Inst. Ocean. Les prodissoconques (coquilles larvaries) des Ostréídes vivants 1960 41 p. 1 1183 ROCHEBRUNE, A. T. Bull. Mus. Hist. Nat. Diagnoses de mollusques nouveaux provenant du voyage de M. Diguet en Basse Californie Paris 1895 1 239-243 RODRIGUEZ-ROMERO, F. Tesis doctoral Estudios cromosómicos de expresión géníca en moluscos bivalvos de importancia económica Colegio de Ciencias y Humanidades, Instituto de Ciencias del Mar y Limnología, UNAM 1981 122 p., 24 láms. ROGERS P. y A. GARCíA-CUBAS. An. Inst, Cienc. del Mar y Limnol. Evolución gonádica a nivel histológico del ostión Crassostrea virginica (Gmelin, 1791) del sistema fluvio-lagunar Atasta-Pom, Laguna de Términos, Campeche, México. Univ. Nal. Autón. México 1981 21-42 8 (1) RUDWICK, M. J. S. Palaeontology The functions of zig - zag deflexions in the commissure of fossil brachiopods. 1964 135-171, 14 figs., 21-29 láms. 7 (1) RYDER, J. Bull. U.S. Fish. Comm. On the mode of fixation of the fry of the oyster. 1883 383-387 3 SACCO, F. Pelecypoda (Ostreidae, Anomiidae e Dirnydae). I mollushi del terreni Terziarri de Piemonte e della Liguria (Torino) 1897 30 pts. sep arately, pt. 23, 66 p., 11 láms SCHMMT-NIELSEN, K. Fisiología Animal. Ed. Omega, S.A. Barcelona 1976 SEVILLA, M. L. Datos Biológicos para el Cultivo del Ostión de Guaymas, Son. Secretaría de Industria y Comercio. Dirección General de Pesca e Industrias Conexas 1959 13-20, 2 figs., 1 lám. SHAW, B. L. y H. I. BATTLE. The gross and mieroscopie anatomy of the digestive tract of the oyster, Crassostrea virginica (Gmelin). Canadian Journal of Zoology 1957 325-347 35 (3) SNEATH P. H. A. y R. S. SOKAL. The Principles and Practice of Numerical Classification. Númerical Taxonomy. W. H. Freeman and Company. 1973 SOWERBY, G. G. Jr. Reeve, Conchologia Iconica. Monograph of the genus Ostrea, London 1870-1871 18, 33 láms. SPORN, E. Uber die Gesetzmassigkeiten im Baue der Muschelgehause. Wilhelm Roux Archiv fur Entwícklufrgsmechaník der organismen 1926 228-242 108 STASEK, C. R. Orientation and form in the bivalved mollusca. J. Morph. 1963 195-214 112 STAUBER, L. A. On possible physiological species in the oyster Ostrea virginica. Anat. Rec. 1947 614 99 (4) STEININGER, J. Observations sur les fossiles du calcaire intermédiaere de L'Eifel. Soc. Géol. France, Mém. 1834 331-371 ser 1, 1, pt. 2 STENZEL, H. B. A generic character, can it be laeldng in individuals of the species in a give genus? 1963 a Systematic Zoology 118-121 12 (3) STENZEL Treatise on Invertebrate Palaeontology. Geol. Soc. of Amer. University of Kansas. (N) 1971 N954-N1224 3 (6) STUARDO, J. y A. MARTÍNEZ An. Centro Cienc. del Mar y Limnol. Relaciones entre algunos factores ecológicos y la biología de poblaciones de Crassostrea corteziensis Hertlein, 1951, de San Blas, Nayarit, México. Univ. Nal. Autón. México 1976 84-130 2 (1) STUARDO, J., A. MARTíNEZ, A. YÁÑEZ, J.A. WINBORN y J. RUIZ Prospección de los recursos biológicos y pesqueros del sistema lagunar de Guerrero y en parte del litoral rocoso de Michoacán, México. Informe Final 1ra. Etapa Programa Uso de la Zona Costera de Michoacán y Guerrero. Convenio Comisión del Río Balsas, S. R. H. y Centro Cienc. del Mar y Limnol. Univ. Nal. Autón. México. Contrato de Estudios No. OC-E-03-73 1974 500 p. THOMSON, D. A. On Growth and Form. Cambridge University Press 2d. Ed. Cambridge England 1942 111 P. THOMSON, J. M. The genera of oysters and the Australian species. Australian Jour. Mar. & Freshwater Research 1954 132-168, láms. 1-11. 5 VERMEIJ, C. J. Biogeography and Adaptation Patterns of Marine Life. Ed. Harvard London 1978 VERNEUIL, E. de. R. I. Murchinson, Edoard de Verneuil & Alexander von Keyserling, 1845, the Geology of Russia in Europa and the Ural Mountain, 2 v., Paléontologie Géologie de la Russie d'Europe et des montagnes de I'Oural John Murray (London). (v. 2, pt. 3, is in French). 1845 v. 2, pt. 3, xxxii + 512 p., 43 + A-G lám. VIALOV, O.S. Sur la classification des huítres: Acad. Sci. URSS, Comptes rendus (Doklady) 1936 17-20 4 new ser. (13), No. 1 (105) WALLACE, L. R. Biol. Bull. Some factors affecting vertical distribution and resistance to desiccation in the limpet. 1972 186-192 142 WEISBORD, N. E. Bull. Amerc. Paleont Late Cenozoic pelecypods from Northern Venezulea. 1964 176-194 45 (204) WILBUR, K. M. y L. JODREY. Biol. Bull. Studies on shell formation. v. 1955 359-365 108 WINCHEL, A. Descriptions of new species of fossils, from the Marshall Group of Michigan, and its supposed equivalent, in the other states; with notes on some fossi1s of the same age previously described. Acad. Nat. Sci. Philadelphia, Proc. 1865 109-133 17 (1865) YONGE, C. M. Structure and physiology of the organs of feeding and digestion in Ostrea edulis. J. Mar. Biol. Assoc. U.K. 1926 295-386 14 (2) YONGE, C. M. The monomyarian condition in the Lamellibranquia Royal Soc. Ediinburgh 1953 443-478, 13 figs. 62, pt. 2 YONGE, C. M. Oysters Colling (London) 1960 IV + 209 p., 72 figs., 17 láms.
 Lám. 1. características de los tentáculos del manto: A. Lopha cristagalli; B. Lopha frons; C. Lopha megodon; D. Crassostrea cortezienn; E. Crassostrea gigas; F. Crassostrea iridescens; C. Crassostrea rhizophorae; I. Ostrea angelica; K. Ostrea chilensis; L. Ostrea lurida. 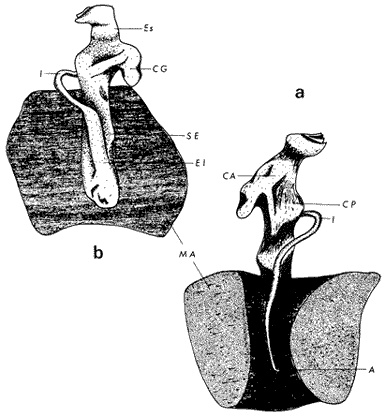 Lám. 2. Fig. a: Vista dorsal del aductor y del sistema digestivo de Lopha cristagalli; Fig. b: Vista ventral del aductor y del sistema digestivo de Lopha cristagalli; 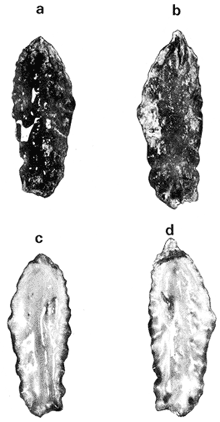 Lám. 3. Lopha frons. Florida, EUA. Fig. a: Valva derecha, vista externa. 43 mm de altura; Fig. b: Valva izquierda, vista externa. 44 mm de altura; Fig. c: Valva derecha, vista interna. 40 mm de altura; Fig. d: Valva izquierda, vista externa. 46 mm de altura. 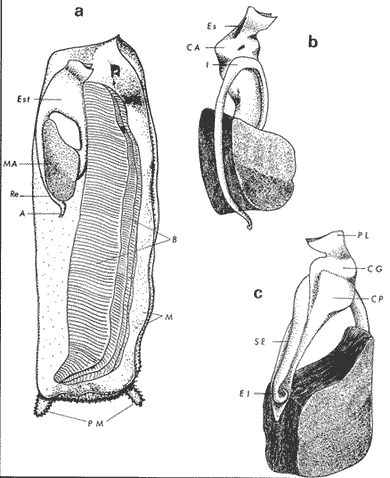 Lám. 4. Fig. a: Lopna frons vista lateral derecha de las partes blandas mostrando por transparencia del manto la posición de la masa visceral, recto y branquias; Fig. b: Vista dorso-lateral derecha del músculo aductor y conducto digestivo; Fig. c: Vista ventro-lateral izquierda del músculo aductor y conducto digestivo. 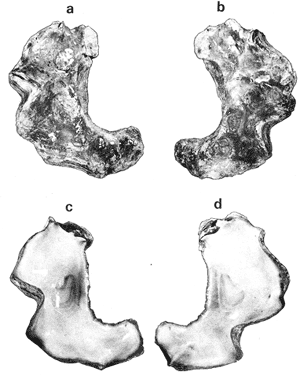 Lám. 5. Lopha megodon. Bahía Magdalena, Baja California Norte, México. Fig. a: Valva derecha, vista externa. 78 mm de altura; Fig. b: Valva izquierda, vista externa. 79 mm de altura; Fig. c: Valva derecha, vista interna. 83 mm de altura; Fig. d: Valva izquierda, vista interna. 80 mm de altura. 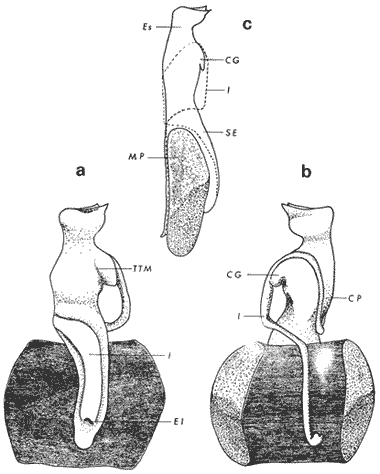 Lám. 6. Lopha megodon. Fig. a: Vista ventral del tracto digestivo y músculo aductor; Fig. b: Vista dorsal del tracto digestivo y músculo aductor; Fig. c: Vista lateral del tracto digestivo y músculo aductor. 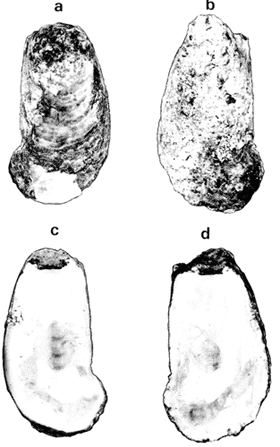 Lám. 7. Crossostrea cortedensis. San Blas, Nayarit, México. Fig. a: Valva derecha, vista externa. 72 mm de altura; Fig. b: Valva izquierda, vista externa. 69 mm de altura; Fig. c: Valva derecha, vista interna. 70 mm de altura; Fig. d: Valva izquierda, vista interna. 71 mm de altura. 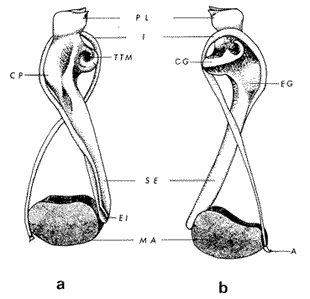 Lám. 8. Crassostrea corteziensis. Fig. a: Vista lateral derecha del conducto digestivo y músculo aductor; Fig. b: Vista lateral izquierda del conducto digestivo y músculo aductor. 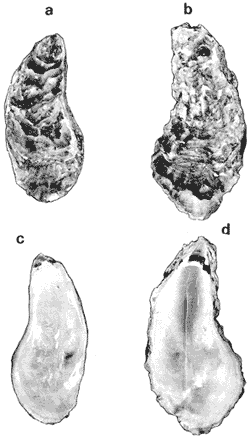 Lám. 9. Crassostrea gigas. La Paz, Baja California Sur. Fig. a: Valva derecha, vista externa. 130 mm de altura, Fig. b: Valva izquierda, vista externa. 134 mm de altura; Fig. c: Valva derecha, vista interna. 130 mm de altura; Fig. d: Valva izquierda, vista interna. 134 mm de altura. 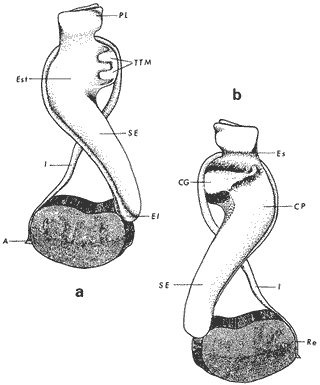 Lám. 10. Crassostrea gigas Fig. a: Vista lateral derecha del conducto digestivo y músculo aductor; Fig. b: Vista lateral izquierda del conducto digestivo y músculo aductor. 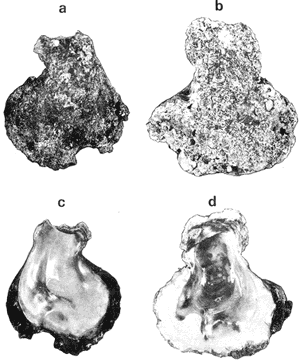 Lám. 11. Crassostrea iridescens. Fig. a: Valva derecha, vista externa. 95 mm de altura; Fig. b: Valva izquierda, vista externa. 100 mm de altura; Fig. c: Valva derecha, vista interna. 93 mm de altura; Fig. d: Valva izquierda, vista interna. 100 mm de altura. 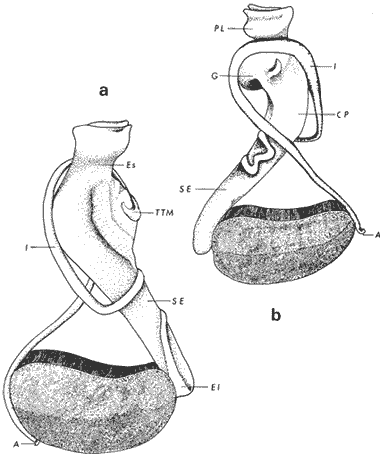 Lám. 12. Crassostrea iridescens. Fig. a: Vista lateral derecha del sistema digestivo y músculo aductor; Fig. b: Vista lateral izquierda del sistema digestivo y músculo aductor. 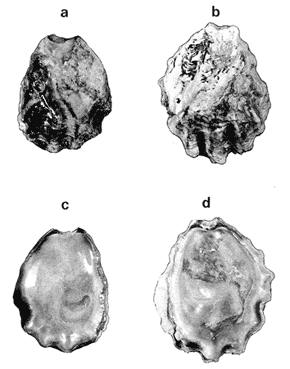 Lám. 13. Crassostrea palmula. San Blas, Nayarit, México. Fig. a: Valva derecha, vista externa. 45 mm de altura; Fig. b: Valva izquierda, vista externa. 48 mm de altura; Fig. c: Valva derecha, vista interna. 45 mm de altura; Fig. d: Valva izquierda, vista interna 48 mm de altura. 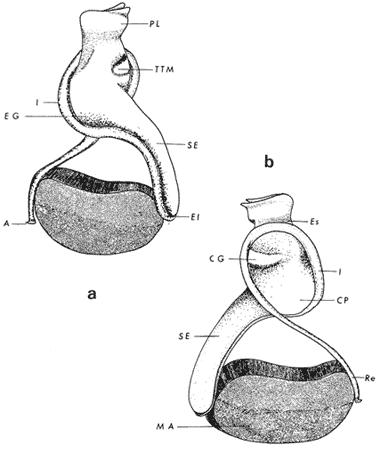 Lám. 14. Crassostrea palmula. Fig. a: Vista lateral derecha del conducto digestivo y músculo aductor; Fig. b: Vista lateral izquierda del conducto digestivo y músculo aductor. 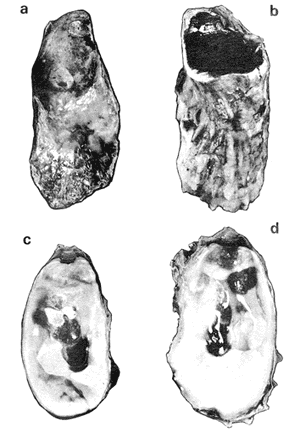 Lám. 15. Crassostrea rhizophorae. Estero Pargo, Laguna de Términos, Campeche, México. Fig. a: Valva derecha, vista externa. 67 mm de altura; Fig. b: Valva izquierda, vista externa. 71 mm de altura; Fig. c:. Valva derecha, vista interna. 67 mm de altura; Fig. d: Valva izquierda, vista interna, 71 mm de altura. 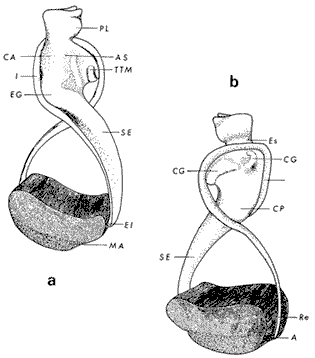 Lám. 16. Crassostrea rhizophorae. Fig. a: Vista lateral derecha del conducto digestivo y músculo aductor; Fig. b: Vista lateral izquierda del conducto digestivo y músculo aductor. 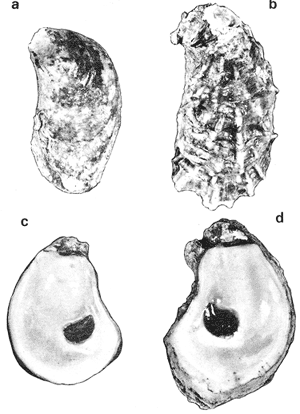 Lám. 17. Crassostrea virginica. Laguna El Carmen y Machona, Tabasco, México. Fig. a: Valva derecha, vista externa. 98 mm de altura; Fig. b: Valva izquierda, vista externa. 102 mm de altura; Fig. c: Valva derecha, vista interna. 98 mm de altura; Fig. d: Valva izquierda interna. 102 mm de altura. 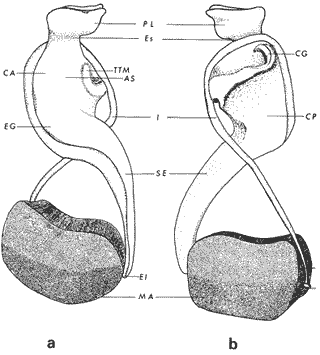 Lám. 18. Crassostrea virginica. Fig. a: Vista lateral derecha del conducto digestivo y músculo aductor; Fig. b: Vista lateral izquierda del conducto digestivo y músculo aductor. 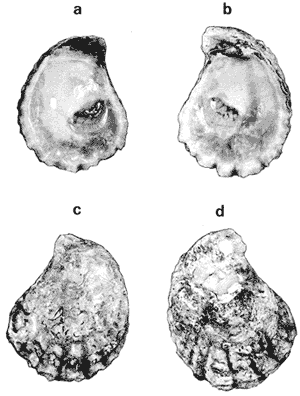 Lám. 19. Ostrea angélica. Bahía Guaymas, Sonora, México. Fig. a: Valva derecha, vista externa. 40 mm de altura; Fig. b: Valva izquierda, vista externa. 45 mm de altura; Fig. c: Valva derecha, vista interna. 40 mm de altura; Fig. d: Valva izquierda, vista interna. 45 mm de altura. 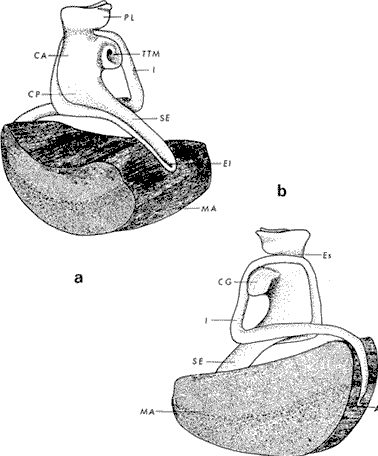 Lám. 20. Ostrea angélica. Fig. a: Vista lateral derecha del sistema digestivo y músculo aductor; Fig. b: Vista lateral izquierda del sistema digestivo y músculo aductor. 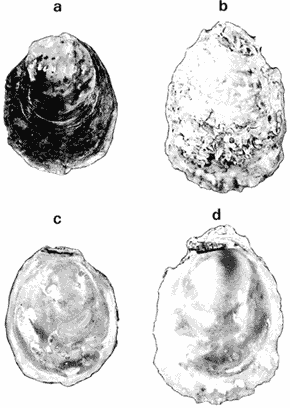 Lám. 21. Ostrea chilensis. Pullinque Chiloé, Santiago de Chile. Fig. a: Valva derecha, vista externa. 53 mm de altura; Fig. b: Valva izquierda, vista externa. 64 mm de altura; Fig. c: Valva derecha, vista interna. 53 mm de altura; Fig. d: Valva izquierda, vista interna. 64 mm de altura. 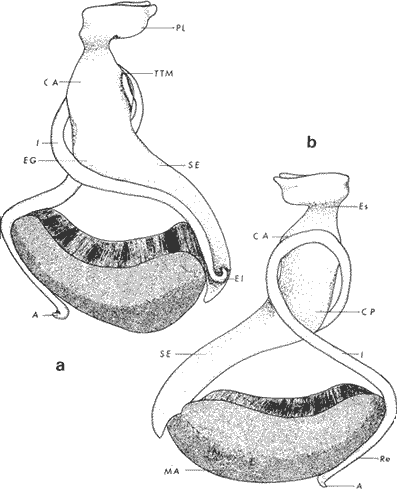 Lám. 22. Ostrea chilensis. Fig. a: Vista lateral derecha del conducto digestivo y músculo aductor; Fig. b: Vista lateral izquierda del conducto digestivo y músculo aductor. 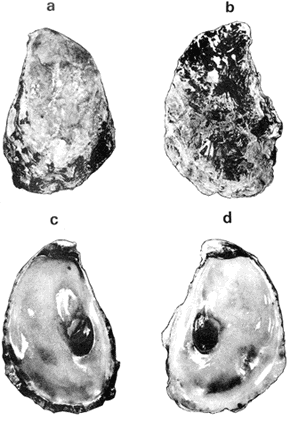 Lám. 23. Ostrea lurida. Bahía San Quintín, Baja California Norte, México. Fig. a: Valva derecha, vista externa. 46 mm de altura; Fig. b: Valva izquierda, vista externa. 53 mm de altura; Fig. c: Valva derecha, vista interna. 46 mm de altura; Fig. d: Valva izquierda, vista interna. 53 mm de altura. 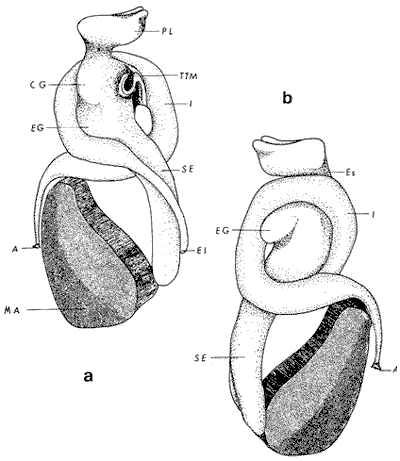 Lám. 24. Ostrea lurida. Fig. a: Vista lateral derecha del conducto digestivo y músculo aductor; Fig. b: Vista lateral izquierda del conducto digestivo y músculo aductor.
|

