|
ESSAI DE LA MÉTHODE DE DILUTION
SEMI-CONTINUE POUR DES ETUDES SUR LA CROISSANCE DU PHYTOPLANCTON EN
CULTURE.
Trabajo recibido el 12 de junio de 1984 y aceptado para su
publicación el 30 de enero de 1985.
CARLOS H. LECHUGA-DEVEZE
Centro de
Investigaciones Biológicas de Baja California, A. C. Apartado Postal
128, La Paz, B.C.S., 23000 México. Boursier du Consejo Nacional de
Ciencia y Tecnología, México. Sous Contrat No.
22879.
JACQUES GOSTAN
Station Zoologique de Villefranche, 06230
Villefranche-Sur-Mer, France. ERA 228 - CNRS.
Cultivos uniespecíficos
de Chaetoceros protuberans Lauder fueron utilizados para probar
la eficacia del método de dilución discontinua, como un
sustituto del quemostato, para estudios sobre el crecimiento de algas
unicelulares. Durante once días que se mantuvo la fase exponencial
de crecimiento de la especie estudiada, se determinó la evolución
de la biomasa y su tasa de crecimiento, así como proteínas
y glúcidos particulares y la asimilación de sales nutrientes.
Las conclusiones admiten que este método permite, como lo haría
un quemostato, establecer la variación de la tasa de crecimiento
y de los componentes bioquímicos celulares, ante la diferencia
en concentración de los nutrientes agregados, por lo que su uso
es recomendado. Chaetoceros
protuberans Lauder en culture fut utilisée pour tester l'efficacité
de la méthode de dilution semi continue, comme un substitut du
chémostat, sur la croissance des algues unicellulaires. La phase
exponentielle de la courbe de croissance fut maintenue pendant onze
jours et on a suivi pendant cette période l'évolution
de la biomasse et du taux de croissance. On a déterminé
également les concentrations en protéines et glucides
particulaires et l'assimilation des sels nutritifs. Nous admettons que
la méthode de dilution semi continue permet, comme le ferait
un chémostat, de mettre en évidence les variations du
taux de croissance et des composants biochimiques de la cellule, par
rapport aux changements des concentration en sels nutritifs; ainsi,
son utilisation est recommendé.
Divers auteurs, particulièrement Myers et Clarck (1944), Myers (1946), Novick et Slizard (1950), ont imaginé d'introduire de manière automatique et continue le milieu nutritif dans la culture pour maintenir un temps plus long une partie du stade de croissance. Comme le soulignent Myers et Clarck (1944), on pourrait penser à priori que si une culture est diluée de manire continue de sorte que les cellules puissent toujours être maintenues a un même point de leur courbe de croissance, les effets des variations des conditions internes peuvent être entièrement éliminés. Cette culture représente alors une source de matériel très uniforme, permettant de mieux apercevoir l'effet des variations des facteurs du milieu sur la croissance cellulaire. La culture en continu demande un ensemble de conditions qui ne peuvent pas toujours être reumes par certains laboratoires. Ainsi, nous nous sommes proposés de vérifier si des méthodes d'enrichissement et de dilutions manuelles et discontinues, déjà essayées par divers auteurs (Ketchum, et Redfield, 1949; Jørgensen et Steemann-Nielsen, 1961; Myklestad et Haug, 1972; Smith, 1983), peuvent conduire aux mêmes résultats que le chémostat, a savoir: obtenir une population de biomasse stable avec un taux de croissance constant; évaluer la croissance maximum pour une condition de température et d'éclairement donnée; et, enfin de vérifier le comportement d'autres paramètres que celui du nombre de cellules dans ces mêmes conditions de dilutions discontinues. Ce travail est: une version réduite d'un mémoire que, pour l'obtention du Diplôme d'Etudes Approfondies en Océanographie Biologique, a présenté C. H. Lechuga-Devéze sous la direction de J. Gostan à l'Université Pierre et Marie Curie, Paris VI, France. MATERIEL ET METHODESCharlaceros protuberans Lauder a été maintenue en culture (f/2, Guillard et Ryther, 1962) dans un incubateur à température constante (19°C) et à éclairement permanent de 150 Em-²s-¹ (filament tungstène-halogène, 1,500 Watts). L'énergie lumineuse est mesurée in sítu en faisant passer le capteur (QSL-100 Biospherical Instruments) par un orifice fait: sur le bac d'incubation. La croissance cellulaire a été estimée par dénombrement cellulaire: 3-4 m1 de culture furent prélevés et inimédiatement fixés avec une solution de lugol alcaline; le comptage est effectué par duplicate ou triplicata dans une cellule Lemaur de 40 mm3. Pour chaque comptage nous avons dénombré au moins 400 cellules (400-800) en observant une erreur moyenne de 16.6 % (95 % seuil limite). Les proteines et glucides cellulaires ont été determines par les méthodes de Lowry et al. (1951) et de Dubois et al. (1956), adaptées par Malara et Charra (1972a, b). Dans les deux cas, des filtres en fibre de verre (GF/C, 25 mmΦ) passés au four (5000 C, au moins 12 heures) ont été utilisés pour retenir le materiel particulaire. L'analyse des sels nutritifs a été réalisée à l'aide du technicon autoanalyseur II en utilisant les méthodes décrites par Tréguer et Le Corre (1974). La consommation des sels nutritifs, a été estimée par la différence en concentration de ces ions entre le début et la fin de chaque période de 24 heures de croissance cellulaire. Les cultures en semi-continu ont été realisées en ajoutant chaque 24 heures un volume adéquat du milieu frais au m ême temps qu'un volume similaire est enlevé de la culture. L'effluent issu de ces dilutions journalières a servi pour les différentes analyses de biomasse. Le taux de dilution (D) represente le rapport du volume enlevé sur le volume total de culture. Ainsi, le taux de croissance (k) peut être estimé par Ln (111-D) /Ln2 exprimé en divisions par jour. D'après Eppley (1972), pour une température donn ée il existe un taux de croissance maximum selon la relation log k = 0.0275T-0.070 oú T = temperature en OC. Une température de 190C doit donner un taux de croissance de 2.83 div/j; ce taux de croissance maximum théorique représente le taux de croissance maximum que théoriquement nos cultures peuvent atteindre. RESULTATSDes experiences préliminaires ont montré que notre milieu de culture de force f/2 et f/20 est capable d'induire un taux de croissance maximum dans une culture sans flux. Avec les cultures en semi-continu nous avons essayé de maintenir cette croissance maximum un certain temps comme le ferait un chémostat, mais en introduisant une dilution discontinue et manuelle du mílieu f/2 et f/20. Au même temps nous avons sui vi la composition biochimique et l'assimilation des sels nutritifs pour comprendre ce qui se passe quand les differences de croissance sont observables. Avec le milieu f/2 si la dilution est de 50 le taux de croissance (Fig. 2) compense les pertes par dilution et la biomasse reste stable (Fig. 1). En augmentant la dilution al 66 % on provoque une augrnentation du taux de croissance mais ce dernier reste légèrement inferieur au taux de dilution. De ce fait la croissance ne compense pas tout al fait les pertes et la biomasse decroìt lentement. 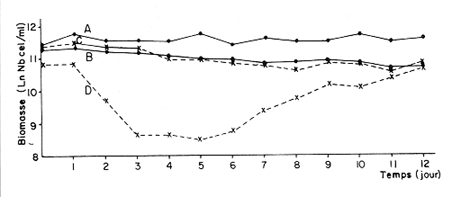 Fig. 1. Evolution de la biornasse des différentes combinaisons utilisées dans les cultures en semi-continu. A: f/2-50 %; B: f/2-66 %; C: f/20-50%; D: f/20-66%. 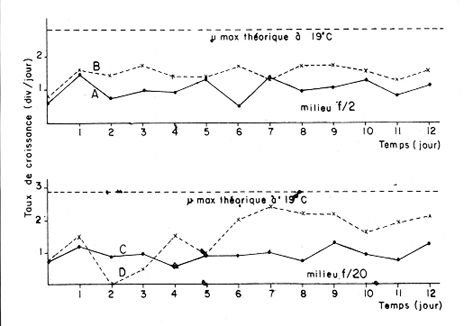 Fig. 2. Evolution du taux de croissance des différentes combinai sons utilisées dans les cultures en semi-continu. A: f/2-50%; B: 2-66 %, C: f/20-50 % 1 D: f/20-66 %. Pour les cultures qui ont été diluées avec du milieu f/20, les observations sont un peu différentes (Figs. 1, 2). Dans la premiére combinaison, f/20-50 %, une analyse de variance montre que le taux moyen de croissance n'est pas significativement différent de f /250 % (seuil limite 95 %), cependant cette croissance n'a pas pu compenser les pertes par dilution et la biomasse a diminuée lentement. Dans le deuxième combinaison, f/20-66%, nous avons trouvé d'abord une forte décroissance cellulaire suivie d'une forte croissance voisine du maximum théorique. Ce comportement particulier était dú à un changement de population causé par l'apparition d'une soudaine phase sexuelle, où les cellules de petite taille (—. 5 µ m) ont restitué leur taille initialle (—. 25 µ m). Dorénavant cette courbe ne sera plus prise en compte. Le comportement des protéines et des glucides des combinaisons du milieu f/2 (Figs. 3, 4) est le même quelque soit la dilution. Le rapport protéines/glucides (Pr/GI) (Fig. 5) est élevé, entre 3 et 6, ce qui signifie que la croissance de la culture n'a pas été limitée par une insuffisance en sels nutritifs (Barlow, 1980). Le comportement des protéines et des glucides de la combinaison f/20-50 % (Fig. 3, 4) montre une plus forte variabilité avec des oscillations presque synchrones et des concentrations superieures ô celles des cellules cultivées en milieu f/2, Cependant, le rapport: Pr/GI., un peu superieur à l'unité (Fig. 5), est trés peu variable, et il décroft faíblement d'une manière continue. La consommation des NO3 (Fig. 6) pour les combinaisons f/2-50 % et f/20-50 %, montre des très grandes oscillations, la consommation de f/2-50 % étant environ 3 fois plus élevée que celle de f/20-50 %. Les combinaisons f/2-66 % et f/20-66 % ne sont pas présentées paree que les valeurs ne semblent pas fiables. Les concentrations des PO4 et SiO, (Figs. 7, 8) dans la combinaison f/2-50 % présentent des oscillations analogues á celles de la courbe d'assimilation des NO 3. Pour la combinaison f/2-66 % les oscillations en PO, et SiO 3 sont presque semblables (le point 11 de la figure 7 correspondant à la consommation de PO 41 présente dans tous le cas une situation singuliére. Il est sans doute pas fiable, mais rien ne nous autorise à I'écarter de maniére certaine. Cependant si on le fait, les oscillations des courbes deviennent synchrones). 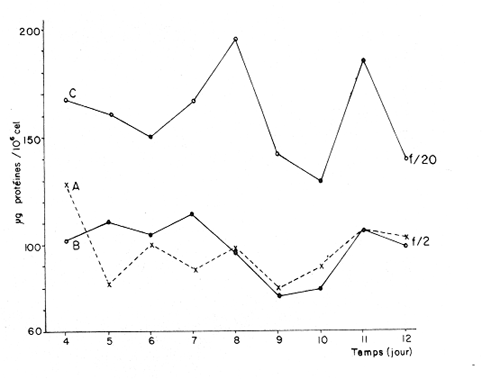 Fig. 3. Evolution des protéines des différentes combinaisons analy sées. Symboles comme figs. 3 et 4. 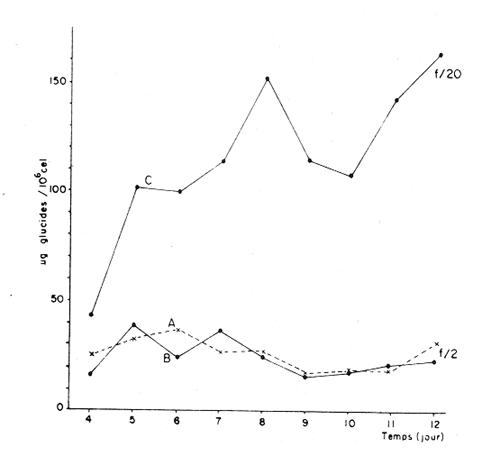 Fig. 4. Evolution des glucides des différentes combinaisons analysées. Symboles comme figures précedentes. 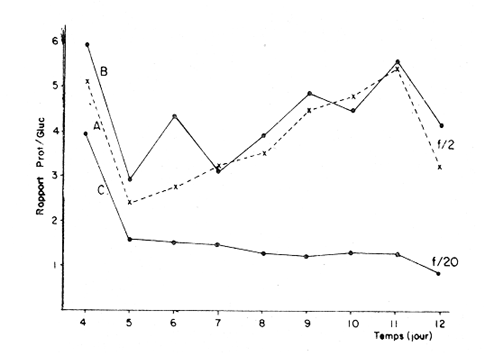 Fig. 5. Evolution du rapport Pr/Gl des différentes combinaisons analysées. 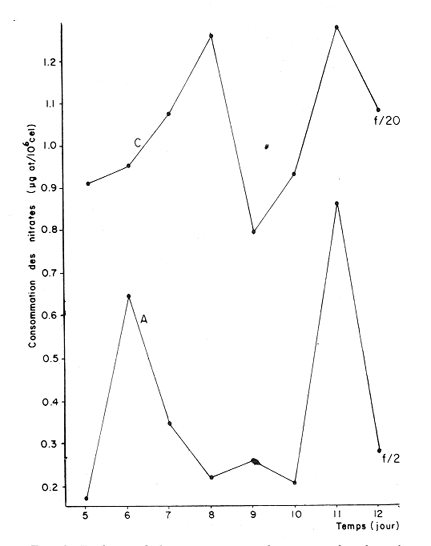 Fig. 6. Evolution de la consommation des nitrates dans les cultures en semi-continu. 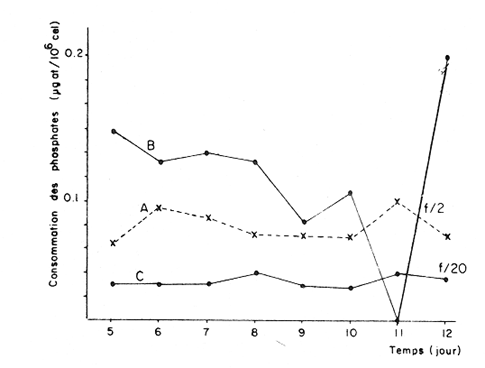 Fig. 7. Evolution de la consommation des phosphates dans les cultures en semi-continu. 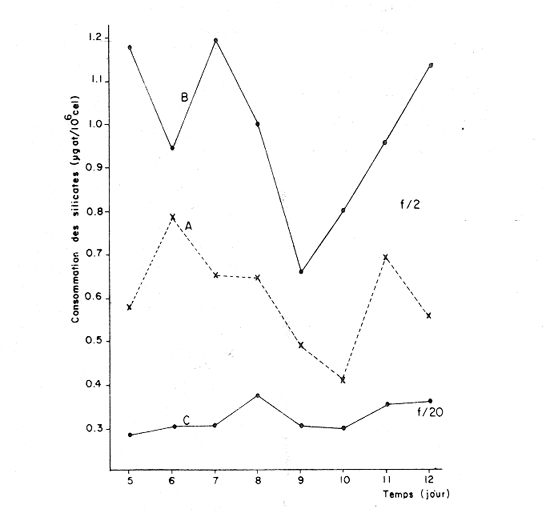 Fig. 8. Evolution de la consommation des silicates dans les cultures en semi-continu. ConclusionesDISCUSSION ET CONCLUSIONSLes données présentées M appartiennent à des cultures qui ont été maintenues pendant onze jours en phase exponentielle avec dilutions journaliéres manuelles. Certaines ont conservé leur biomasse stable, comme pour de cultures réalisées en chémostat parvenues à l'équilibre. Ceci représente déjà une preuve que la méthode manuelle peut remplacer éventuellement une méthode continue automatique de dilution. Cependant, aucune des combinaisons essayées n'a permis d' obtenir à la fois une biomasse stable et un taux de croissance maximum, bien que les conditions optimales de lumière et de milieu semblent avoir été réunies. Nous nous proposons ci-dessous d'analyser les raisons probables de cette constantatation á la lumière des résultats obtenus avec les autres paramètres: évolution des protéines, glucides et les consommations des trois principaux sels nutritifs. La méthode des dilutions permet de modifer les conditions nutritives par deux voies: soit par un changement de la concentration du milíeu d'enrichissement soit par un changement du taux de dilution de la culture. 11 semble que le seul fait de diminuer la concentration du milieu nutritif f/2 d'un facteur 10 modifie considérablement les conditions de croissance des cellules. En effect, on constate que pour un même taux de dilution de 50 % la vitesse spécifique de la consommation des nitrates double (Tableau l), tandis que celle des phosphates et des silieates diminue de m oitié (Figs. 7, 8). On a noté égalment que le taux de protéines augmente corrélativement á celui de la consommation des nitrates. Les oscillations ont une même période mais celles des protéines présentent un retard de phase de 24 heures par rapport á celles des NO3. 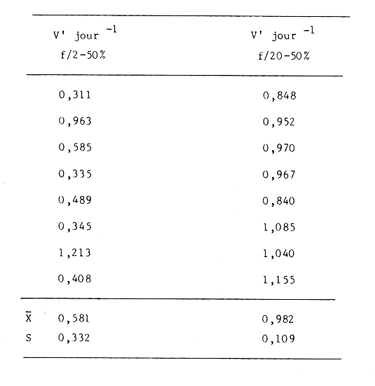 TABLEAU 1 VITESSE EPÉCIFIQUE DE CONSOMMATION DES NITRATES POUR LES COMBINAISONS F/2-50% ET F/20-50 % (LES VALEURS DES NITRATES CELLULAIRES ONT ETE CALCULEES A PARTIR DE LA RELATION PROTÉINE/6.25) L'évolution du taux de protéines par cellule dans la culture f/2 présente également deux pies, mais ceux-ci paraissent plus aigus. Ces observations confirment à la fois les travaux de Slawyk (1980), montrant que la cellule peut mettre une quantité de nitrates en réserve, et ceux de Holligan (1979) ou de MeCarthy et Goldman (1978), montrant qu'une diminution de la concentration d'un sel dans le milieu peut stimuler le taux de consommation de ce sel par la cellule. Nous retrouvons là les questions que posent les vitesses différentes de transport et d'utilisation des sels dans les différents compartiments cellulaires (Eppley et al., 1969; Eppley et Thomas, 1969; Caperon et Meyer, 1972; Conway et al., 1976; Conway et Harrison, 1977; Slawyk, 1980). Bien que le taux de protéines et de glucides par cellule soit plus élevé quand le mileu utilisé est f/20, le rapport Pr/Gl est relativement plus faible que dans le cas des cultures f/2. De plus il se caracterise par une lente et continue diminution au cours du déroulement de la culture. Vers la fin des observ ations il descend à une valeur légèrement ínferietire à l'unité ce qui d'après Barlow (1980), est: la limite en dessous de laquelle le rapport traduit un développement cellulaire s'éffectuant en conditions limitatives de sels nutritifs. Ainsi, 11 est peu vraisemeblable que les cultures f/2 et f/20, diluées à 50% se soient développées en conditions limitatives de nitrates, de phosphates ou de silicates. Pourtant, comme dans un chémostat établi dans des conditions limitatives pour un sel, le fait d'augrnenter la dilution de 50 % a 60 % provoque un nouvel état d'équilibre avec un taux de croissance plus élevé, sans cependant atteindre le taux de croissance maximum théorique. Cette situation est différente de celle que Eppley (1972) affirme pouvoir obtenir avec un chémostat maintenu sous des conditions non limitantes. Ceci suggére que dans nos experiences un facteur limite le taux de croissance. En effet, avec un taux de croissance maximum théorique de 2.8 div/J, la biomasse peut rester stable si elle est diluée de 86 % en 24 hr. Or, nous constatons qu'une dilution de 50 % avec le milieu f/2, permet déjà d'atteindre cet équilibre. En conditions non limitatives, une dilution de 50 % devrait étre insuffisante et provoquer des oscillations de la biomasse, l'effectif commençant par croitre. On constante également qu'une augmentation du taux de dilution al 66 %, provoque un lent et continu "lavage" de la culture. Ce même résultat est obtenu avec un milieu f/20 mais plus rapidement. Avec ce même milieu, une dilution de 50 % est suffisante pour faire apparaìtre une évolution identique à celle de la combinaison f/2-66%. Il ressort de cet ensemble d'observations que le taux de croissance ne peut étre atteint dans nos conditions experimentales que si la bíomasse est trés faible. Comme les principaux sels nutritifs ne semblant pas êntre en concentration limitante, on doit invoquer l'action d'autres composants du milieu (CO., oligoéléments, vitamines) ou bien la teclinique elle même. En conclusion, la méthode de culture al flux discontinu, lorsqu'on la practique avec une périodicité d'injection du milieu frais d'une fois par 24 heures, permet comme dans un chémostat, de maintenir une biomasse et un taux de croissance stables pour une combinaison définie de la concentration du milieu et pour un taux de dilution donné. Mais le taux de croissance obtenu dans ces conditions, demeure inféreur au taux de croissance maximum théorique defini par Eppley (1972) pour la même température. AgradecimientosREMERCIEMENTSNous remercions C. Cellario, M. R. Charra et M. G. Malara. Leur aide et leurs conseils ont été indispensables pour le développernent de ce travail. LITERATURABARLOW, R. G. The biochemical composition of phytoplankton in an upwelling region of South Africa. J. Exp. Mar. Biol. Ecol. 1980 83-93 45 CAYERON, J. et J. MEYER Nitrogen-limited growth of marine phytoplankton. II. Uptake kinetics and their role in nutrient limited growth of phytoplankton. DeepSea Res. 1972 619-632 19 CONWAY, L. H., P. J. HARRISON et C. O. DAVIS Mar. Biol. Marine diatoms growth in chemostats under silicate or ammonium limitation. II. Transient response of Skeletonema costatum to a single addition of the limiting nutrient. 1976 187-199 35 CONWAY, R. L. et P. J. HARRISON Mar. Biol. Marine diatoms growth in chemostats under silícate or ammonium limitation. IV. Transient response of Chaetoceros debílis, Skeletonema costatum and Tlalassiosíra gravida -to a single addition of the limiting nutrient. 1977 33-43 43 DUBOIS, M., K. A. GILLES, J. K. HAMILTON, P. A. REBERS, et F. SMITH Analyt. Chem. Colorimetric method for determination of sugars and related substances. 1976 350-356 28 EPPLEY, R. W. Fish. Bull. Temperature and phytoplankton growth in the sea. 1972 1063-1085 70 EPPLEY, R. W. et W. H. THOMAS Comparison of halfsaturation constants for growth and the nitrate uptake of marine phytoplankton. J. Phycol. 1969 375-379 5 EPPLEY, R. W., J. M. ROGERs et J. J. MCCARTHY Limnol. Oceanogr. Half-saturation constants for uptake of nitrate and ammonium by marine phytoplankton. 1969 912-920 14 GUILLARD, R. R. L. et J. H. RYTHER. J. Microbiol. Studies of marine planktonic diatoms. 1. Cyclotella nana Hustedt and Detonula confervacea (Cleve) Gran. Can. 1962 229-239 18 HOLLIGAN, P. M. The productive oceans. Nature 1979 191 279 JORGENSEN, E. C. et E. STEEMANN-NIELSEN Plant. Physiol. Effect of filtrates of unicellular algae on the growth of Staphyloccocus aureus. 1961 896-908 14 KETCHUM, B. H. et A. C. REDFIELD Some physical and chemical characteristics of algae growth in mass cultures. 1. Cell. Comp. Physiol. 1949 281-299 33 LOWRY, O. H., N. J. ROSENBROUGH, A. L. FARR et R. J. RANDALL Protein measurement with folin phenol reagent. 1. Biol. Chem. 1951 205-275 193 MALARA, C. et R. CHARRA Dosages des protéines particulaires selon la méthode de Lowry. Note interne de travail No. 5. Station Zoologique de Villefranche-Sur-Mer. 1972a MALARA, G. et R. CHARRA, . Dosage des glucides particulaires du. phytoplancton selon la méthode de Dubois. Note interne de travail No. 6. Station Zoologique de VillefrancheSur-Mer. 1972b MYERS, J. Culture conditions and the development of the photosynthetic mechanism. IV. Influence of light intensity on the phytosynthetie characteristics of ChIorella. 1. Cen. Physiol. 1946 429-440 29 MYERS, J. et L. B. CLARCK Culture conditions and the development of the photosynthetie mechanism. J. Cen. Physiol. 1944 103-112 28 MYKLESTAD, S. et A. HAUG J. Exp. Mar. Biol. Ecol. Production of carbohydrates by the marine diatom Chaetoceros afinis var, wíllei (Gran) Hustedt. 1 Effect of the concentration of nutrients in the culture medium. 1972 125-136 9 NOVICK, A. et L. SLIZARD Science Description of the chemostat 1950 715-716 112 SLAWYK, G., These de Doctorat d'Etat. Université d'AixMarseille L'absorption de composés azotés par le phytoplancton marin; role dans le production primaire. Relations avec la photosynthese et les variables du milieu extra et intracellulaire. 1980 II. SMITH, V. H. Light and nutrient dependence of photosynthesis by algae J. Phycol. 1983 306-313 19 TREGUER, P. et P. LE CORRE Manuel d,analyse. de sels nutritifs Dans L'eau de Mer. Utilisation de l'autoanalyser II. Tecnicon . Laboratoíre d'Océanographie chimique. Université de Bretagne Occidentale. 1974
|

