|
COMPORTAMIENTO NICTIMERAL DE
CRUSTÁCEOS DECÁPODOS EN LA BOCA DE ESTERO PARGO, LAGUNA DE
TÉRMINOS, CAMPECHE, MÉXICO.
Trabajo, presentado en el VIII
Simposio de Biologías de Campo e Investigación, 21 a 23 de
noviembre de 1984. ENEP Iztacala, UNAM. Recibido el 7 de diciembre de 1984 y
aceptado por su publicación el 25 de febrero de 1985.
RAMIRO ROMÁN-CONTRERAS
Instituto de Ciencias del Mar y Limnología, UNAM.
Contribución 478 del Instituto de Ciencias del Mar y Limnología,
UNAM.
En febrero de 1981, se
realizó una serie de mustreos en la Boca de Estero Pargo, Laguna de
Términos, Campeche, durante un lapso de 24 h con intervalos de 2 h entre
sí. Se colectaron 1,015 especímenes, pertenecientes a 8 familias
y a 10 especies de crustáceos decápodos, de las cuales las
más abundantes fueron Penaeus duorarum duorarum Burkenroad,
Callinectes sapidus Rathbun y Clibanarius víttatus (Basc). El
valor de biomasa más elevado calculado fue de 0.4580 g/m² para
C. sapidus, mientras que P. duorarum duorarum y C.
víttatus aportaron valores de 0.25 9 /m². P. duorarum
duorarum dominó durante el cielo con un ídice de predominio de
0.85; por su parte, C. sapidus y C. vittatus alcanzaron
valores de 0.077 y 0.028, respectivamente. La densidad más alta fue de
1.187 ind/m² ; la abundancia (H'w), de 0.8949; y la diversidad (H'n) de
las especies dominantes, de 0.36 y 0.34. El análisis de las colectas
señala una comunidad con alta disponibilidad de recursos alimentarios
que sostiene importantes poblaciones de epi e infauna.
On February
1981 during a series of collection at Estero Pargo inlet, Terminos Lagoon,
Campeche, in a period of 24 hs we collected 1,015 specimens which were included
in 8 families, and 10 species of crustacean decapods. The more abundant species
were Penaeus duorarum duorarum Burkenroad, Callinectes sapidus
Rathbun and Clibanarius víttatus (Bosc).
The highest value of biomass calculated was 0.4580 g /m² for C.
sapidus, and 0. 25 g / m² for P. duorarum
and C. vittatus. P. duorarum was the most conspicuos species
during the cycle, whit values of dominance of 0. 85; while C.
sapidus and C. vittatus get values of 0. 077 and
0.028, respectively. The highest value of density was 1.187 I m-² . The
value of abundance (H'w) was 0.8949 and the diversity (H'n) get values of 0.36
and 0.34 for the dominant species. The analysis of samples suggest a community
with high qua'ttity of available resources which support important epi and
infaunal population.
Las praderas de pastos marinos Zostera marina, Halodule wrightii, Halophila sp y Thalassia testudinum son abundantes en el sureste de Estados Unidos de Norteamérica, en el Golfo de México y en el Mar Caribe (Phillips, 1978; MeCoy y Heck, 1976). En esas latitudes, existen extensas comunidades de aguas someras que tanto por su composición como por sus repercusiones en la crianza y alimentación de peces (Yáñez-Arancibia y Day, 1981; Subrahmanyam y Coultas, 1980; Yáñez Arancibia y Lara-Domínguez, 1983), crustáceos (Hoese, 1960; Heck y Orth, 1980) y otros invertebrados (Hoese y Jones, 1963; Adams, 1976a; Lewis y Hollingworth, 1982) son muy importantes. Desde la década de los sesenta, la información sobre la Laguna de Términos se ha acrecentado con los trabajos pioneros de Ayala-Castañares (1963), García-Cubas (1963), Yáñez Correa (1963) y Silva-Bárcenas (1963); pero existe limitada información sobre las poblaciones animales que habitan las praderas de Thalassia testudinum que son abundantes en la Laguna de Términos, sobre todo en el litoral interno de la Isla del Carmen y Boca de Puerto Real, donde la comunidad se extiende a lo largo de grandes parches cercanos a la costa. Densos machones se extienden también, aunque en menor intensidad, en la región sureste de la laguna (Day y Yáñez-Arancibia, 1981; Phleger y Ayala Castañares, 1971). Entre los grupos animales del ecosistema de pastos marinos, los crustáceos son de gran significación porque varios grupos -entre los que están los anfípodos, isópodos de vida libre, Hippolyte, Palaemonetes y pequeños portúnidos (Callinectes spp)-, contribuyen con un alto poreentaje a la alimentación de peces (Adams, 1976b; Heck, 1979). Por su parte, ciertos crustáceos -como jaibas y estomatópodos- son depredadores activos que influyen de modo determinante en las poblaciones de otras especies de invertebrados existentes en el área. ÁREA DE ESTUDIOLa Laguna de Términos está ubicada aproximadamente entre los 91°15' y los 91°51', de longitud oeste; y entre los 18°27' y 18°50' de latitud norte. Tiene una longitud de 60 por 25 Km de ancho como máximo (Phleger y Ayala-Castañares, 1971). El clima es tropical con un período de lluvias en verano que oscila entre los 120 y 200 cms anuales. La temperatura máxima del aire es de 36°C; la mínima de 18 a 20°C, con poca variación anual, excepto durante los meses de invierno (Phleger y Ayala-Castañares, 1971). En la región predominan los vientos del este. Entre los meses de septiembre y febrero se presenta un período con vientos fuertes y fríos provenientes del norte. En la región norte del cuerpo lagunar se encuentra una barra sedimentaria de 38 km de largo por 2.5 km de ancho, con un relieve de 2 a 4 m sobre el nivel del mar (Phleger y Ayala-Castañares, 1971; Carvajal, 1973). Esta barra constituye la Isla del Carmen y está formada por fragmentos de conchas de moluscos (gasterópodos, principalmente) y foraminíferos, cuarzos, carbonatos y sedimentos terrígenos (Carvajal, 1973). En cada extremo de la barra existe una boca ancha y relativamente profunda; ambas constituyen la Boca de Puerto Real, en la porción noreste de la isla, y la Boca del Carmen en la porción sureste de la misma. Varios ríos fluyen a la laguna, entre ellos, el del Este, que desemboca en la Laguna de Términos por conducto del Palizada; el Chumpán que en su porción sur, forma parte de la Laguna Balchacah; el Candelaria, que junto con el Mamantel da origen a la Laguna de Panlau y, finalmente, el Sabancuy en la parte nororiental, que forma un arroyo alargado del mismo nombre, cuyas aguas son vertidas en la Laguna de Términos por el sureste de Isla Aguada (Reséndez, 1981). ESTERO PARGOEstá situado en la porción suroeste de la Isla del Carmen, con orientación oblicua en sentido NE-SO (Fig. 1). Su longitud aproximada es de 5,300 m con un ancho variable que varía desde 14 m en la parte media hasta 251 m en el extremo interno del mismo, se comunica con la laguna mediante una boca de 25 m de ancho. La profundidad promedio es de 2 m (Ley-Lou, 1979). El sustrato está compuesto predominantemente por limo-arcilla y arena-limosa (Segura y WongChang, 1980). Como sedimento existe una gran cantidad de detritus proveniente de los bosques de Rhizophora mangle y Avícennia germinans que lo circundan y que al mismo tiempo, aportan gran cantidad de taninos. Estas sustancias dan a las aguas del estero una coloración café rojiza que evita la visibilidad hacia el fondo, excepto cuando hay penetración de aguas marinas por efecto de la marea. En la boca del estero, existen praderas de Thalassia testudinum que albergan numerosas poblaciones de peces, crustáceos, moluscos, poliquetos y otros invertebrados. 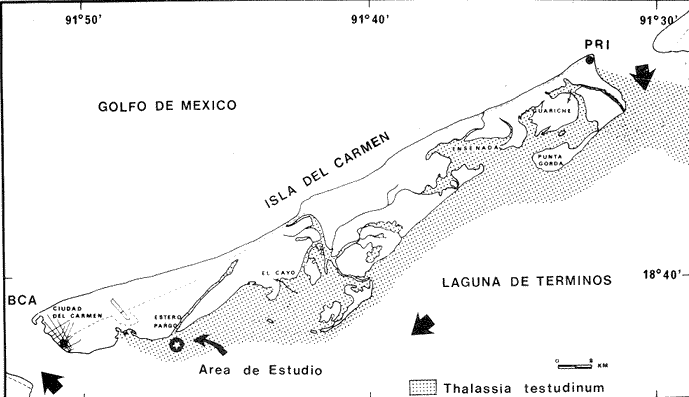 Fig. 1. Ubicación de la,boca de Estero Pargo en la Isla del Carmen, Laguna de Términos, Camp., Sur del Golfo de México. (Tomado de Yáñez-Arancibia y Lara-Domínguez, 1983). La salinidad del estero varía entre 26 y 430/00; y la temperatura, entre 23.9 y 32.2°C (Ley-Lou, 1979). La transparencia arroja valores promedio de 80 % en la zona de la boca (Yáñez-Arancibia y Day, 1982). MATERIALES Y MÉTODOSLos muestreos fueron realizados en un período de 24 horas, comprendido de las 8 horas del 7 de febrero de 1981 a las 6 horas del día siguiente. Para las colectas se utilizó una red de prueba camaronera con abertura de malla de ½ pulgada y tablas de 40 por 60 cm. Se realizaron a intervalos de 2 horas frente a la boca de Estero Pargo, a bordo de una lancha de 25 pies de eslora con motor fuera de borda de 50 H.P. Se arrastró la red a una velocidad promedio de 2 nudos durante 10 minutos a una distancia aproximada de 100 m del manglar. Las muestras fueron preservadas inmediatamente con formaldehido al 10 % para su posterior separación y recuento, identificación taxonómica y registros merísticos. Una vez separados los organismos fueron pesados, medidos y sexados. Se midió el ancho del caparazón (A.C.) a los cangrejos, y el largo del cefalotórax (L.C.) y la longitud total (L.T.) a los peneidos. Al mismo tiempo que los arrastres, se registraron la temperatura del agua, la salinidad, la profundidad, el estado de la marea y la transparencia durante las horas de luminosidad. Con los datos obtenidos se calcularon la biomasa y la densidad para describir el comportamiento de las poblaciones de crustáceos en el área de estudio. En consecuencia, los objetivos de este trabajo son, principalmente: 1) Conocer la composición de la comunidad en la boca del Estero Pargo. 2) Conocer el comportamiento de las poblaciones de crustáceos decápodos en un ciclo nictimeral en relación con diversos factores ambientales. RESULTADOSSe colectaron 1,015 ejemplares en total; taxonómicamente pertenecen a 8 familias y a 10 especies de decápodos (Tabla 1), de las cuales la más abundante fue Penaeus duorarum duorarum Burkenroad con 886 individuos; le siguieron Callínectes sapidus Rathbun y Clibanarius víttatus (Bose) con 78 y 28 ejemplares, respectivamente. Se colectó además un espécimen de estomatópodo identificado como Squilla neglecta Gibbes, especie muy común en los muestreos de la laguna y frente a ésta. Las especies de decápodos mencionados predominaron durante las horas del muestreo con frecuencias de 91.6 % para P. duorarum y C. sapidus; y de 75 % para C. vittatus (Tabla 3). juntas las tres especies representaron el 97.82 % del total de las colectas. Los cangrejos araña y de fango Libinia dubía H. Milne Edwards y Hexapanopeus angustifrons (Benedict y Rathbun), se colectaron en horas nocturnas y diurnas, respectivamente. L. dubia sólo se colectó entre las 20 y las 04 horas, mientras que H. angustifrons fue capturado en pequeña cantidad entre las 18 y las 24 horas. Es oportuno aclarar que mediante varias campañas de colecta en la Laguna de Términos, siempre se ha colectado H. angustifrons en diversas horas del día en diferentes zonas; este no es el caso de L. dubia, el cual sólo ha sido capturado en los muestreos nocturnos. También fueron halladas otras especies de decápodos de poca importancia comercial o sin ella, y que son componentes relevantes en la trama trófica de la comunidad, tales como el cangrejo de fango Panopeus herbstii H. Milne Edwards; los cangrejos de las familias Majidae (Phito Iherminieri) (Schramm) y Leueosiodae (Persephona mediterránea Guinot-Dumortier), y los pequeños camarones Palaemonetes vulgaris (Say) y Alpheus Fabricius, de las familias Palaemonidae y Alpheidae, respectivamente.  TABLA 1 TAXONOMÍA DE LAS ESPECIES COLECTADAS 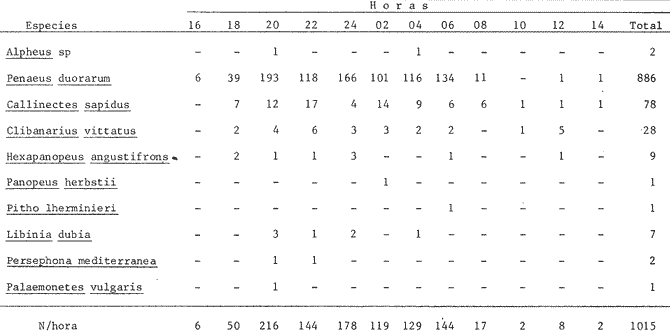 TABLA 2 COMPOSICION NICTEMERAL Y ABUNDANCIA NUMÉRICA DE DECÁPODOS  TABLA 3 FRECUENCIAS Y PORCENTAJES DE APARICIÓN DE LAS ESPECIES COLECTADAS BIOMASAEl camarón comercial P. duorarum fue la especie más representativa en número y frecuencia (Tablas 2, 3 y Fig. 3). Fue colectada desde el amanecer y hubo un aumento gradual relacionado con la oscuridad; se capturaron 193 ejemplares juveniles en el arrastre de las 20 horas. La composición de las colectas de los camarones, con rango de tallas de 35 a 106 mm de longitud total, está representada en la figura 2. Aunque fluctuante durante los muestreos nocturnos, el número de ejemplares fue menos abundante durante las horas de la mañana, período en que se colectaron sólo 19 individuos entre las 08 y las 16 horas (Tabla 2). Otra de las especies de crustáceos bien representada en las colectas del cielo nictemeral fue C. sapidus. Apareció en todos los muestreos, excepto en el de las 16 horas; fue más abundante en las horas de oscuridad, sobre todo entre las 20 y las 04 horas. De las especies de decápodos colectados, C. sapidus aportó el mayor índice de biomasa (Fig. 3b). Los valores fluctuaron entre 0.0458 y 0.4580 g/m², con valor promedio de 0. 1800 g/m². No obstante su mayor número con relación a las otras especies de decápodos., el camarón café aportó como valores más altos de biomasa 0.2500 g/m2 (Fig. 4). Es pertinente señalar que la presencia de esta especie en el área de estudio no es común en muestreos diurnos; su número relativamente elevado durante la noche sugiere posibles movimientos migratorios; pero además, su presencia pudo ser facilitada por el efecto de las mareas, como señalan Subrahmayam. y Coultas (1980) para ambientes similares. 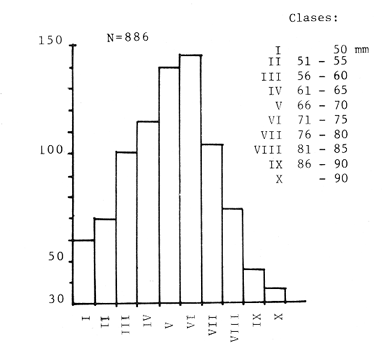 Fig. 2. Distribución de la frecuencia de tallas de los camarones (Panaeus duorarum) colectados en el área de estudio. 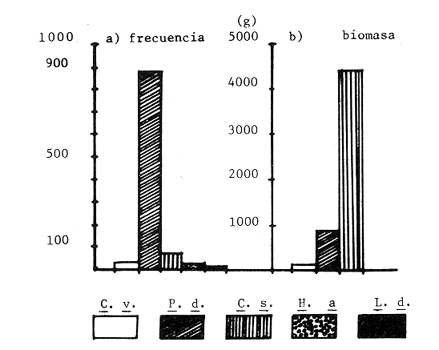 Fig. 3. Frecuencia (a) y biomasa (b) de Penaeus duorarum, Callinectes sapidus, Clibanarius vittatus, Hexapanopeus angustifrons y Libinia dubia durante los muestreos en la boca de Estero Pargo. 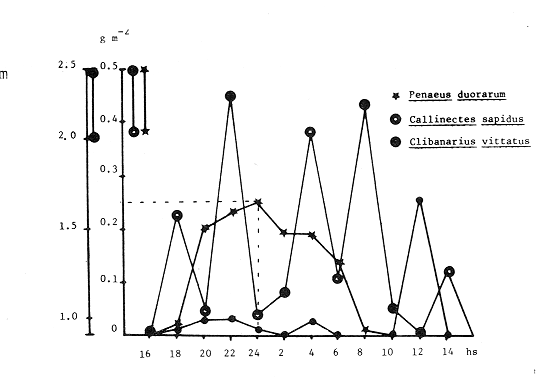 Fig. 4. Comportamiento de la biomasa de las especies dominantes. Clibanarius vittatus, la tercera especie en abundancia durante el cielo de muestreos, aportó valores de biomasa de 0.168 g/m2 en la colecta de las 22 horas. El valor más alto de la biomasa total (0.7716 g/m²) correspondió al muestreo de las 22 horas. Este valor elevado se debió sin duda a la presencia de un número relativamente alto de jaibas en la muestra y a su tamaño. El comportamiento poblacional y de biomasa de P. duorarum y de C. sapidus señala un aspecto importante. El primero presenta una alta correlación entre el núme ro de especímenes tratados y su biomasa, calculándose un r = 0.98; mientras que el valor para C. sapidus fue de sólo 0.29 (Fig. 5a y b). ÍNDICE DE PREDOMINIOLa variación temporal del índice depredominio (Fig. 6a) de las especies dominantes, refuerza la aseveración de que P. duorarum alcanzó los valores más altos respecto a las otras especies entre las 16 y las 06 horas; estos valores fueron: 0.8.5, 0.077 y 0.028 para P. duorarum, C. sapidus y C. vittatus, respectivamente. La comparación entre el índice de predominio y el índice de diversidad (Fig. 6b) para P. duorarum, presentó, valores opuestos entre las 16 y las 06 horas; los valores de ambos índices se acercan a 0.6 hacia las 08 horas y persisten con valores similares hasta las 14 horas. 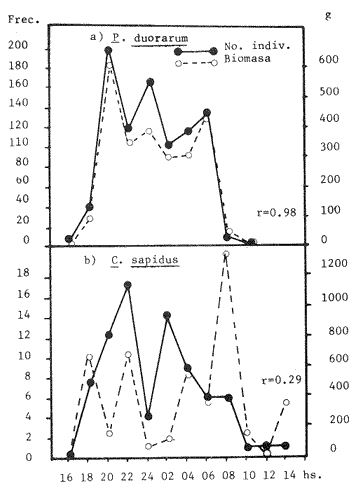 Fig. 5. Comportamiento poblacional y comparación entre el número de individuos y biomasa de: (a) P. duorarum y (b) C. sapidus. En ese período se registraron los valores más elevados tanto para la salinidad como para la temperatura del agua y ambiental. DENSIDAD Y ABUNDANCIALos valores de la densidad fluctuaron entre 0.007 y 1.187 ind/m2 por arrastre. Las muestras colectadas entre las 08 y las 18 horas arrojaron valores mas altos, mientras que la diversidad (H'n) y la abundancia (H`w) presentaron valores máximos de 1.0735 y 0.8946, respectivamente. La diversidad tuvo un comportamiento fluctuante con un aumento visible al aproximarse las horas de mayor luminosidad, mientras que la abundancia decayó en relación con el mismo parámetro. 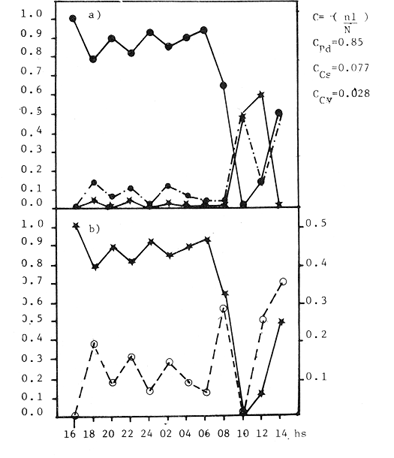 Fig. 6. (a) Variación temporal del índice de predominio (C) de P. duorarum (Pd), C. sapidus (Cs) y C. vittatus (Cv); y (b) comparación entre el índice de predominio e índice de diversidad de P. duorarum. DIVERSIDADSe calculó el índice de diversidad de Shannon y Weaver (H'n) con base en el número de individuos de las especies dominantes. Los valores m á s altos fueron de 0. 36 para C. sapidus; y de 0.34 para C. vittatus y P. duorarum durante las colectas realizadas entre las 08 y las 12 horas (Fig. 7). RELACIÓN ENTRE PARÁMETROS AMBIENTALES Y ECOLÓGICOS
Salinidad y temperaturaLos valores de salinidad registrados durante las horas de las colectas, variaron entre 23 y 250/00. Los valores más bajos fueron entre las 22 y las 02 horas, con 230/00; mientras que los mas altos fueron anotados entre las 14 y las 16 horas: 250/00. 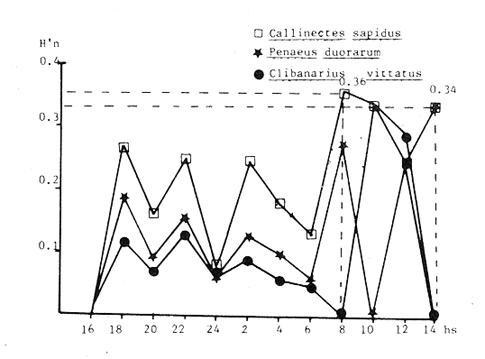 Fig.7. Valores del índice de diversidad de Shannon y Weaver de las especies dominantes. Los valores más altos de biomasa presentan una relación inversa con los valores más bajos de la temperatura y la salinidad. Estos factores se corresponden a su vez, con el período de menor luminosidad. Los valores más bajos de salinidad y temperatura de la masa de agua en el área estuvieron relacionados con el movimiento de la marea. A este respecto, Subrahmanyam et al. (1980) han señalado que es difícil diferenciar entre la influencia de los factores ambientales y las propiedades inherentes a las poblaciones, factores que determinan la composición de las comunidades en un momento dado. Como se ha mencionado, se observó una mayor abundancia de crustáceos relacionada con la disminución de la temperatura, salinidad y con el aumento de la columna de agua en el área de colectas. Esta observación está relacionada con el movimiento de las mareas locales; ello se ve reforzado con la ausencia de luminosidad y propicia un comportamienro gregario de las especies. ConclusionesDISCUSIÓN Y CONCLUSIONESLas colectas excluyeron, la mayoría de las veces, a los crustáceos de tamaños menores como son los carideos de los géneros Hippolyte y Thor, con excepción de Palaemonetes vulgaris y Alpheus sp; así como a isópodos de vida libre y otros mierocrustáceos presentes en el área. Sin duda, esta ausencia de debió a la alta selectividad de tallas ejercida por la red utilizada. Ello influyó de manera considerable en el registro de especies y en los cálculos matemáticos. La composición de las colectas de crustáceos sugiere una comunidad compleja y estable en el momento de los muestreos, donde por igual coexisten elementos de hábitos alimenticios detritívoros, así como depredadores y omnívoros. Esta variedad de formas indica un uso completo de los diversos niveles tróficos que conforman la comunidad de Thalassía, la cual soporta poblaciones de diversas especies de crustáceos permanentes y temporales, así como, indudablemente, de otras variadas formas de la epi e infauna. El número de especies registrado en el presente estudio, es similar al reportado por Abele (1974) y Heck y Orth (1980), quienes afirman que la abundancia está mas relacionada con el tipo de substrato que con los factores ambientales. Si bien éste juega un papel preponderante en el establecimiento de las poblaciones bénticas, también se considera que tanto los factores ambientales como la temperatura y la salinidad no son menos importantes cuando se trata de especies de habitat acuáticos. El mayor volúmen de las colectas nocturnas refleja, una vez más, el hecho de que los decápodos son más activos durante el período de oscuridad que durante el día cuando pueden excavar en los sedimentos y librarse de los depredadores (Heck y Orth, 1980; Heck, 1977). En la bibliografía disponible, existe poca información específica acerca de la biomasa de crustáceos decápodos. Por lo tanto, es difícil establecer comparaciones con los resultados de este trabajo. Sin embargo, se intentará equipararlos con otros grupos que viven en ambientes similares. Se ha mencionado que el valor mas alto de biomasa calculado fue. de 0.4580 g/m2 para el arrastre de las 22 horas, con promedio de 0. 1800 g/m² para el total de los organismos. Estos valores de biomasa se deben calificar como "altos” al comprarlos con la biomasa calculada para las poblaciones de peces, cuyos especímenes generalmente son de mayor talla y peso individuales que los de los crustáceos. Los valores de biomasa de crustáceos y poliquetos dados a conocer por Brook (1977), son de 1.27 y 2.98 g de peso seco por metro cuadrado durante la época de mayor abundancia; mientras que los valores calculados para los mismos grupos en una época diferente del año fue de 1.0 g/m². Los cálculos para peces son mas variables. Adams (1976a) encontró valores de 1.5 g/m2, y YáñezArancibia et al, (1980), un rango que fluctuó entre 0.97 y 2.23 g/m², en diversos ambientes de la Laguna de Términos. En cambio, los valores más altos de la diversidad calculados para las especies dominantes de crustáceos en el presente trabajo fueron de 0.34 y 0,36; mientras que Day et al., hallaron valores que oscilan entre 0.4 y 3.2 g/m² en ambientes de la Laguna de Términos; y Hoese (1968), valores de H'n que fluctuaron entre 0.92 y 2.09 en poblaciones de peces, por lo que los datos que se han calculado para estos parámetros pueden considerarse entre límites normales de diversidad. Finalmente, es posible que con la información obtenida de una sola serie de muestreos como en el presente caso, sólo es posible emitir conclusiones muy generales. En efecto, los resultados aquí presentados deben considerarse preliminares de estudios más completos. Éstos se han efectuado durante los tres últimos años y sus resultados serán motivo de escritos posteriores con el fin de dar a conocer con mayor amplitud, tanto la composición de la comunidad de crustáceos durante un período prolongado de muestreos, como sus fluctuaciones en relación a factores ambientales en tiempo y espacio. AgradecimientosSe agradece la participación en las colectas de campo al personal del Laboratorio de Ictiología y Ecología Estuarina del Instituto de Ciencias del Mar y Limnología; a Juan Luis Casanova y Luis S. Campos Lince por su colaboración en el trabajo de laboratorio; a Eugenio Mendoza N. por la revisión final del manuscrito y ú tiles sugestiones; y a Alejandro Yáñez-Arancibia y Eduardo Sáinz, por su constante apoyo y consejos en el aspecto editorial. LITERATURAABELE, L. G. Ecology Species diversity of decapod crustaceans in marine habitats. 1974 156-161 55 (1) ADAMS, S. M. The ecology of eelgrass, Zostera marina (L.), fish communities. 1. Structural analysis. J. Exp. Mar. Biol. Ecol. 1976a 269-291 22 ADAMS, S. M. Feeding ecology of eelgrass fish communities. Trans. Amer. Fish. Soc. 1976b 514-519 105 (4) AYALA-CASTAÑARES, A. Bol. Inst. Geol. Univ. Nal. Autón. México Sistemática y distribución de los foraminíferos recientes de la Laguna de Términos, Campeche, México. 1963 67 (3) BROOK, I. M. Trophic relationships in a seagrass community (Thalassia testudinum), in Card Sound, Florida. Fish diets in relation to macrobenthic and cryptic faunal abundance. Trans. Amer. Físh. Soc. 1977 219-229 106 (3) CARVAJAL, R. J. Condiciones ambientales y productividad de la Laguna de Términos, Campeche, México. Lagena 1973 35-38 31 DAY Jr., J. W. y A. YÁÑEZ-ARANCIBIA Primer Informe. Proyecto de Investigación Estudios Ecológicos de la Laguna de Términos, Campeche, México, con Referencia Especial a los Recursos Pesqueros y al Impacto Potencial del Hombre. (PCMABEU005322) Convenio Bilateral Internacional México-USA, UNAM/CONACYTINSF/LSU Coupling of physical and biological processes in the Terminos Lagoon, a tropical estuary in the southern Gulf of Mexico, p. 3-29. Yáñez-Arancibia, A. (Coord.). 1981 93 p. GARCÍA-CUBAS, A. Jr. Bol. Inst. Geol. Univ. Nal. Autón. México Sistemática y distribución de los micromoluscos recientes de la Laguna de Términos, Campeche, México. 1963 67 (4) HECK Jr., K. L. Mar. Biol. Comparative species richness, composition, and abundance of invertebrates in Caribbean seagrass (Thalassia testudinum) meadows (Panamá). 1977 335-348 41 HECK Jr., K. L. Some determinant of the composition and abundance of motile macroinvertebrate species in tropical and temperate turtlegrass (Thalassia testudinum) meadows. Jour. Biogeg. 1979 183-200 6 HECK Jr., K. L., y R. J. ORTH Estuaries Structural components of ee1grass (Zostera marina) meadows in the lower Chesapeake Bay decapod crustacea. 1980 289-295 3 (4) HOESE, H. D. Ecology Juvenile penaeid shrimp in the shallow Gulf of Mexico. 1960 592-593 41 (3) HOESE, H. D. y R. S. JONES Seasonality of larger animals in a Texas turtlegrass community. Publ. Inst. Mar. Sci. Univ. Texas 1963 37-46 9 LEWIS, J. B. y C. E. HOLLINGWORTH Mar. Biol. Leaf epifauña of the seagrass Thalassia testudinum 1982 41-49 71 LEY-LOU, F. Tesis profesional Algunos factores ecológico abióticos en Estero Pargo, Campeche. Fac. Ciencias, Universidad Nacional Autónoma de México 1979 39p. McCOY, E. D. y K. L. HECK Jr. Syst. Zool. Biogeography of corals, seagrasses, and mangroves: An alternative to the center of origin concept. 1976 201-210 25 PHILLIPS, R. C. Oceans Seagrasses and the coastal marine environment 1978 30-40 21 (3) PHLEGER, F. B. y A. AYALA-CASTAÑARES Amer. Assoc. Petrol. Geol. Bull. Processes and history of Terminos Lagoon, Mexico. 1971 2130-2140 55 (2) RESÉNDEZ M., A. Biótica Estudio de los peces de la Laguna de Términos, Campeche, México. I. 1981 239-291 6 (3) SEGURA, L. R. e I. WONG-CHANG An. Inst. Cienc. del Mar y Limnol. Foraminíferos recientes de Estero Pargo, Laguna de Términos, Campeche, México. Univ. Nal. Autón. México 1980 1-14 7 (1) SILVA-BÁRCENAS, A. Bol. Inst. Geol. Univ. Nal. Autón. México Sistemática y distribución de los géneros de diatomeas de la Laguna de Términos, Campeche, México. 1963 67 (2) SUBRAHMANYAM, C. B. y C. L. COULTAS Bull. Mar. Sci. Studies on the animal comunities in two North Florida salt marshes, Part III. Seasonal fluctuations of fish and macroinvertebrates. 1980 790-818 30 (4) YÁÑEZ-ARANCIBIA, A., F. AMÉZCUA-LINARES y J. W. DAY Jr. Estuarine Perspectives. Fish community structure and function in Terminos Lagoon, a tropical estuary in the southern Gulf of Mexico. V. Kennedy Academic Press Inc. New York 1980 465-482 YÁÑEZ-ARANCIBIA A. y J. W. DAY Jr. Informe Técnica. Proyecto de Investigación Estudios Ecológicos de la laguna de Términos, Campeche, México, con Referencia Especial a los Recursos Pesqueros y al Impacto Potencial de Hombre. (PCMABEU-005322). Convenio Bilateral Internacional MéxicoUSA, UNAM/CONACyT/NSF/LSU Estudios ecológicos de período corto (invierno) de los sistemas de pastos marinos en la Laguna de Términos (febrero 1981). 1981 15 p. YÁÑEZ-ARANCIBIA, A. y J. W. DAY Jr. Oceanológica Acta Ecological characterization of Terminos Lagoon, a tropical lagoconestuarine system in the southern Gulf of Mexico. Lasserre P. y H. Postma 1982 431-440 5 Vol. Spec. (4) YÁÑEZ-ARANCIBIA, A. y A. L. LARA-DOMÍNGUEZ An. Inst. Cienc. del Mar y LímnoI. Dinámica ambiental de la boca de Estero Pargo y estructura de sus comunidades de peces en cambios estacionales y cielos de 24 horas (Laguna de Términos, sur del Golfo de México). Univ. Nal. Autón. México 1983 85-116 10 (1) YÁÑEZ CORREA, A. Bol. Inst. Geol. Univ. Nal. Autón. México Batimetría, salinidad, temperatura y distribución de los sedimentos recientes de la Laguna de Términos, Campeche, México. 1963 67 (1)
|

