|
RESPUESTAS METABÓLICAS DE
SAROTHERODON MOSSAMBICUS MEDIDAS EXPERIMENTALMENTE EN UN GRADIENTE
TÉRMICO (PISCES: CICHLIDAE)
Trabajo recibido el 2 de abril de 1984
y aceptado para su publicación el 22 de julio de 1984.
CARLOS ROSAS, JOSÉ LATOURNERIE, ADOLFO SÁNCHEZ, SONIA ESPINA
Laboratorio de,
Ecofisiología, Facultad de Ciencias, Universidad Nacional
Autónoma de México, México 04510, D. F.
Un total de 83 ejemplares de una línea seleccionada
deSarotherodon mossambicus (tilapia roja) se sometieron a un
gradiente térmico horizontal, con el propósito de determinar la
temperatura seleccionada por los especímenes. Asimismo se midió
el metabolismo de los peces (1.1 a 45 g) a l as temperaturas seleccionadas en
regímenes estables y fluctuantes y se obtuvo la relación consumo
de oxígeno-peso corporal. El período de aclimatación de
los peces a estas condiciones fue de 40 a 50 días. Los resultados
muestran que S. mossambicus prefirieron temperaturas altas
en el día (30-32°C) y más bajas en la noche
(25-27°C). En dichas temperaturas el costo metabólico fue menor
(10 %) en el régimen fluctuante a 26°C. La asimilación del
alimento también se incrementó en esta condición. Los
valores se estimaron de las pendientes de las rectas logarítmicas que
relacionan la tasa de consumo de oxígeno y el peso de los organismos. Es
posible inferir por tanto que los peces mantenidos a 31°C durante el
día y a 26, en la noche, tendrían una mayor reserva
energética disponible para crecimiento, lo cual sería
recomendable tener en cuenta en la implementación de biotecnias
acuaculturales.
A total of 83
juvenilesSarotherodon mossambicus (red strain) were exposed
to an horizontal thermal gradient in order to determine the temperature that
animals actively selected. The aerobic metabolism of fishes (1. 1-45g) was
measured at those temperatures in both constant and fluctuant regimens. The
relationship between oxygen consumption and body weight was obtained. Animals
were acclimated for a minimum of 40-50 days to each conditions. Results show
that these fishes prefered higher temperatures (30-32ºC). Metabolic cost
was 10% lower at fluctuant regimen. Assimilation food, estimated from the slope
of the logarithmic line oxygen consumption versus body weight, was higher in
that condition. Therefore it can be inferred that maintenance of fishes at
different temperatures in daily cycle could augment their energetic reserves.
These results could served to improve present aquacultural
bioteclinics.
Los juveniles de tilapia objeto de este estudio, pertenecen a una línea seleccionada deSarotherodon mossambicus (Peters), que por su color se conoce como tilapia roja. Fueron introducidas al país en 1981, provenientes de los Estados Unidos de Norteamérica. En la estación piscícola de El Rodeo, Morelos (Secretaría de Pesca), se han adaptado en estanques, donde se reproducen en forma natural. Los peces que conforman el grupo de las tilapias han sido objeto de cultivo en varias partes del mundo, por lo que en las últimas décadas se han intensificado los trabajos sobre las diversas especies de este grupo de cíclidos. El objetivo de estos estudios se ha centrado principalmente en el efecto que tienen los factores ambientales sobre la supervivencia, reproducción, desarrollo y crecimiento de las especies (Allanson y Noble, 1964; Allanson, et al., 1971; Caulton, 1978; Mishrigi y Kubo, 1978; Balarin, 1979). Estas investigaciones se han realizado en lugares tan distantes como Hawaii y Sud Africa, India e Israel. En todos ellos se ha observado que las respuestas fisiológicas señaladas varían con el tipo y calidad del alimento tanto en condiciones naturales como en cautiverio. Asimismo varían con el clima y factores concomitantes (Balarin, 1979; Hepher y Pruginin, 1981). Ahora bien, el clima depende directamente de la altitud y aunque las tilapias toleran amplios intervalos de factores ambientales, la comprensión de sus capacidades en los confines del medio al que han sido introducidos, conducen al crecimiento y desarrollo óptimo de los especímenes (Beamish, et al.,1975). Por otra parte como lo señala Brett (1971), la utilización de la energía para las funciones mencionadas está íntimamente asociada con la adaptación a un ambiente particular. Es de interés por tanto aumentar los conocimientos sobre el desempeño de Sarotherodon mossambicus en estas latitudes (18º46' Lat. N y 99º18' Long. Oeste). Así, es propósito de este trabajo determinar el intervalo de temperatura que esta tilapia roja selecciona en un gradiente horizontal y medir el costo metabólico de los organismos a dicha temperatura. MATERIAL Y MÉTODOEl intervalo de peso de los 83 peces utilizados en este trabajo fue de 1. 1 g a 45 g. Los animales se trasladaron desde la piscifactoría El Rodeo, Morelos, al laboratorio, en bolsas de polietileno con oxígeno a saturación donde se mantuvieron en acuarios de 25 litros a temperatura de 22 ± 1.0º C, con aireación constante. Los peces se alimentaron diariamente con ración ad libitum de purina comercial al 3 % de su peso corporal. El alimento remanente se retiró de los acuarios después de dos horas y se recambió parcialmente el agua. El fotoperíodo se reguló de acuerdo a la estación en 12 horas luz, con cambio gradual entre el período de luz y oscuridad. GRADIENTE PREFERENCIALComo tanque de prueba se utilizó un tubo de asbesto de 3.7 m de largo por 0.3 m de diámetro, abierto en la parte superior y recubierto en su parte interna con resina plástica, Sylpil 100 (Fig. 1). En los extremos del tubo, se separaron dos compartimentos de 30 cm de largo cada uno, apartados del resto del dispositivo mediante una placa de acrílico perforada, de 0. 15 cm de espesor con el fin de permitir la difusión del agua caliente y el agua fría. En la cámara caliente se colocó un calentador de inmersión de 500 watts y en la cámara fría 16 kg de hielo picado mezclado con sal común. La mezcla se colocó en una bolsa de plástico para evitar alteraciones en el agua. Los tres metros restantes se dividieron en 20 compartimentos iguales con placas de acrílico de 0.3 cm de espesor dispuestas cada 15 cm. Las placas se adhirieron al tubo con silicón a 10 cm del fondo para permitir el paso libre de los peces a través de todo el tanque. Estos compartimentos se numeraron secuencialmente de la zona fría a la zona caliente (Fig. 1). Con el objeto de determinar el tipo de distribución espacial que presentarían los peces en el dispositivo, se introdujeron en el centro del tubo, primero en ausencia del gradiente y este experimento se consideró como control. En seguida en presencia del gradiente térmico en forma individual y luego se repitió el procedimiento empleando grupos de 10 especímenes. De este expeffinento, se realizaron tres réplicas. Los intervalos de temperatura preferenciales se determinaron observando los organismos en las diferentes cámaras del gradiente, tres veces por 5 minutos. Estas observaciones se espaciaron por lapsos de dos horas durante un cielo de 24 horas. Se llevó un registro de frecuencias de selección de temperaturas en el dispositivo. Los resultados obtenidos se sometieron a la prueba de agregación de Morisita; con el objeto de conocer si la tendencia encontrada era estadisticamente significativa, se empleó una modificación de X². Las diferencias entre las temperaturas seleccionadas durante el día y la noche, se contrastaron mediante la prueba de muestras pareadas de Wilcoxon (Zar, 1974; Brower y Zar, 1977). 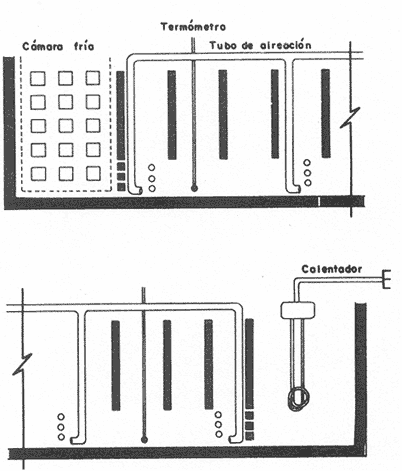 Fig. 1 Dispositivo Experimental MATABOLISMO AEROBIOEl consumo de oxigeno, medida indirecta del metabolismo aerobio se midió en respirómetro cerrado. Las cámaras respirométricas utilizadas (4 litros) se colocaron dentro de un baño termorregulado. Se utilizaron 48 peces distribuidos en 3 grupos, aclimatados durante 40 a 50 días a las temperaturas que los juveniles S. mossambicus seleccionaron en el gradiente, durante el cielo nictemeral. El primer grupo se mantuvo a 26°C, el segundo a 31° C y el tercero se sometió a una fluctuación diaria de 5° C entre 26° C y 31° C. La temperatura de los sistemas se mantuvo constante utilizando calentadores de inmersión de 75 watts y la fluctuación de temperatura en el tercer sistema se llevó a cabo por medio de un termorregulador (Forma Se. CH/P Modelo 2325 ± 0.02ºC). Los organismos se alimentaron como se mencionó anteriormente. Una vez que se introdujeron los peces individualmente en las cámaras, se esperó 48 horas antes de medir el con sumo de oxígeno (Wallace, 1973), se recambió el agua, se tomó una muestra inicial y se sellaron estas. Al cabo de dos horas se tomó la muestra final. La concentración del gas de dichas muestras se midió con un electrodo YSI 54 ARC Sc. Prod. ( ± 0. 1 ppm 02) y el consumo de oxígeno se determinó por diferencia entre las concentraciones de la muestra inicial y la final. Los resultados se expresaron en ppm 02/h y como ppm O2/h/g de peso vivo del animal (VO2) La significatividad (95%) de las diferencias encontradas entre el VO2 medido a las diferentes temperaturas se determinó mediante la prueba de t de Student (Zar, 1974). Se estableció la relación entre la tasa metabólica y el peso (g) de los organismos, en las diversas condiciones experimentales. Las rectas de regresión se ajustaron como usualmente, por el método de mínimos cuadrados y se realizó la prueba de diferencia de pendientes para contrastar las diferencias encontradas (Zar, 1974). RESULTADOS
COMPORTAMIENTO DE LOS PECES EN EL GRADIENTE TÉRMICO HORIZONTALEn la figura 2 se pueden observar claramente las diferencias del comportamiento de los organismos en el tanque de prueba. Así en el experimento control con una temperatura homogénea de 22º C (Fig. 2A) los peces se agregaron en los extremos del tanque lo que resultó significativo con respecto a una distribución homogénea (p < 0.01). Esta agregación fue también significativa en relación a la observada en presencia del gradiente térmico (p<0.01), como lo prueba el índice de agregaciónn de Morisita, mayor que la unidad. Los juveniles de S. mossambicus seleccionaron activamente un intervalo de temperatura entre 24ºC y 27ºC durante la noche (Fig. 2B) con máxima frecuencia en 26º C. Asimismo, durante el día el intervalo fue de 30ºC a 32ºC, con frecuencia máxima en 31ºC(Fig. 2C). 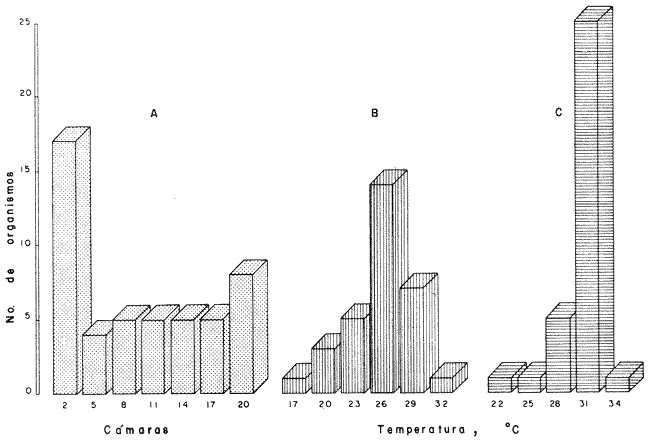 Fig. 2 Distribución de S. mossambicus en ausencia (A) y en presencia de un gradiente térmico: (B). nocturna y (C). Diurna En contraste, no se encontraron diferencias entre el comportamiento de los organismos cuando están en grupos o cuando se les coloca en forma individual en el tanque de prueba. (p > 0.05). Del mismo modo no se registraron diferencias respecto al peso corporal de los juveniles (1.1 g a 45 g) en relación a las temperaturas preferidas (p > 0.05). METABOLISMO AEROBIOEn este trabajo los juveniles de S. mossambicus se sometieron a tres condiciones diferentes de temperatura. Esto es, se mantuvieron en condiciones constantes a 26º C y 31º C durante 40-50 días y se midió el consumo de oxígeno de rutina en un experimento agudo de dos horas. La tercera condición se refiere a animales mantenidos en un régimen fluctuante con una media de 28.5 ± 2.5ºC con límite inferior a 26°C durante la noche y 31°C durante el día. Se estableció un fotoperíodo de 12 horas luz en el cielo de 24 horas acorde con la estación de verano. Esta medición se efectuó a 26°C lo que significó la prolongación de la situación nocturna de los peces. La medición a 31º C se llevó a cabo 48 horas después que las cámaras respirométricas alcanzaran dicha temperatura. Este diseño experimental se fundamenta en las preferendas de temperatura de los animales en el gradiente térmico. (Rosas, et al., 1982; Rosas, 1983). Los resultados mostraron que en la condición estable el consumo de oxígeno medido a 26ºC fue 1.5 veces menor que el obtenido a 31ºC (p < 0.05). En el régimen fluctuante se observó la misma tendencia (3 veces menor) y del mismo modo esta diferencia fue significativa (p < 0.05) en tanto que en temperaturas similares pero a diferentes regímenes no se registraron diferencias en 26ºC. En contraste a 31ºC la tasa metabólica en la condición fluctuante alcanzó el doble del nivel de dicha tasa en el régimen estable (Tabla 1). 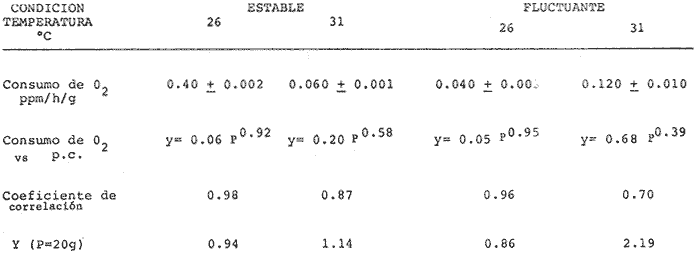 TABLA 1 Influencia del peso corporal (P.c.,g) y de la temperatura sobre el consumo de oxígeno de Sarotherodon mossambicus. medido en condiciones estables y fluctuantes de temperatura (ppm 02/h/g). Media ± Error Standard de la media. Por otra parte se conoce que el peso de los organismos influye en la tasa metabólica (SchmidtNielsen, 1975 entre otros). Tal efecto se visualiza como una recta en un sistema logarítmico de la forma log Y = log a + b log P, dondeY es el consumo de oxígeno (ppm/h),P es el peso corporal (g), a indica el nivel de la tasa metabólica y b es el coeficiente de regresión o pendiente de la recta. En los peces, el valor de dicha pendiente fluctúa entre 0.6 y 0.9; para la mayoría de las especies medidas este valor es de 0.8 y se relaciona con la eficiencia de asimilación de la dieta (Brett, 1971; Paloheimo y Dickie, 1966; Hastings, 1976). En la figura 3, se presentan las rectas de regresión obtenidas para los juveniles de S. mossambicus en las diferentes condiciones experimentales. Las constantes de las ecuaciones potenciales (Tabla 1) indican un nivel metabólico más alto y una eficiencia de asimilación menor a 31ºC que a 26' C en la condición estable. En tanto que en la condición fluctuante medida a ambas temperaturas, la eficiencia de asimilación fue máxima a 26º C y se redujo marcadamente a 31º C a ésta temperatura el nivel metabólico se incrementó 3.4 veces respecto del encontrado a 31°C en el régimen estable. 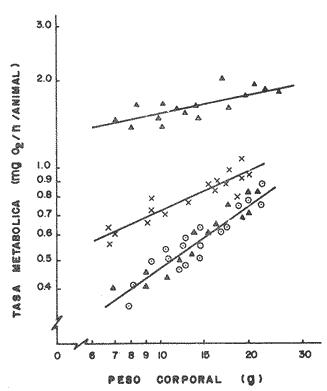 Fig. 3 Relación entre el consumo de oxígeno (mg 02/h/animal) el peso (g) de S. mossambicus en diferentes condiciones de temperatura. *31°C, régimen fluctuante; X 31°C, régimen estable; * y * 26° C, fluctuante y estable, respectivamente. El análisis de covarianza realizado para comparar las pendientes de las rectas obtenidas en las diferentes condiciones experimentales, mostró que en ambos tratamientos a 31°C, la eficiencia de asimilación declinó significativamente (p > 0.01), mientras que en los tratamientos restantes no se observaron diferencias (p > 0.05). Ahora bien, utilizando las ecuaciones logarítmicas se calculó el consumo de oxígeno para un animal promedio dentro de la muestra estudiada, de 20 g. Se observó que el gasto metabólico en el régimen estable fue 1. 2 veces mayor a 31ºC que a 26ºC y en el fluctuante fue 2.5 veces mayor, también a la más alta temperatura. DISCUSIÓNDentro de los factores del medio la temperatura ocupa un lugar preponderante ya que gobierna tanto las diferentes funciones del organismo como su distribución. Así, los animales seleccionan ciertas temperaturas dentro de su rango biocinético normal. Por otra parte, los preferenda de temperatura se correlacionan tanto con la historia térmica como con los óptimos fisiológicos de una especie. Ahora bien, los estudios de laboratorio sobre las preferencias de temperatura de los peces sometidos a un gradiente del factor, se relacionan estrechamente con su comportamiento en la naturaleza. Al respecto Kellog y Gift (1983) han enfatizado la coincidencia entre el crecimiento óptimo alcanzado por diferentes especies de peces (Morone saxatilis, M. americana., Ictalurus catus y Notropis hudsonius) dentro de un intervalo de temperatura y el seleccionado por dichas especies en un gradiente termal. La información obtenida de estos estudios se puede utilizar en empresas acuaculturales, como guía para seleccionar temperaturas que favorezcan el crecimiento de los especímenes en cautiverio (McCauley y Casselman, 1981). En este trabajo los especímenes de S. mossambicus, se mantuvieron en el laboratorio a 22º C que corresponde a la temperatura promedio de la época de captura en los estanques de El Rodeo. Al ser colocados en un gradiente térmico estos peces seleccionaron temperaturas más frías durante la noche que durante el día. Estos resultados contrastan con los señalados para la misma especie por Badenhuizen (1967), quien reporta unpreferendum final único de 28.5º C, con un intervalo de 27ºC a 33.5ºC, en peces aclimatados a diferentes temperaturas. Sin embargo para otras especies del grupo de las tilapias, también se ha encontrado una selección bimodal de temperatura en el cielo diurno. Así Caulton (1978) concluye que el régimen óptimo para T. rendalli sería uno con un máximo nocturno de 18º C, donde la especie mostró un potencial de crecimiento mayor. Asimismo, West (1964) señala que T. nigra presenta una tasa de crecimiento más alta cuando se cultiva en estanques de 30 cm de profundidad que en los de 60 cm de profundidad y sugiere que tales diferencias se deben fundamentalmente a las altas fluctuaciones termales (± 9º C) registradas durante el cielo diurno en los estanques mas someros. Por otra parte la selección de temperatura que los animales realizan en estas condiciones experimentales, podría ser reflejo de la historia biológica de la especie. Las tilapias son cíclidos de ancestros marinos (Balarin, 1979) que se han adaptado al agua dulce en ambientes tanto loticos como lénticos. Remontan los ríos en búsqueda de alimento o de condiciones más favorable para su reproducción, o bien para escapar de sus predadores. Al respecto Caulton (1978) señala además, que las tilapias efectúan migraciones aguas adentro, en búsqueda de temperaturas más favorables. Aunque en el laboratorio se trabajo en condiciones controladas, no obstante se puede sostener que S. mossambicus seleccionó temperaturas que favorecerían su supervivencia y desarrollo en las condiciones en que la especie se encuentra actualmente en el país. En El Rodeo, Morelos, la temperatura de los estanques fluctúa entre 14ºC en invierno y 33ºC en los meses cálidos del año. Luego, las temperaturas de 26ºC y 31ºC están contenidas en este intervalo. Por otra parte, los datos globales de consumo de oxígeno indican que en regímenes estables de temperatura, se incrementa el metabolismo de los especímenes, lo que conlleva un incremento del costo de mantención y por tanto la energía disponible para crecimiento, disminuye (Mironova, 1976; Caulton, 1978; Brett, 1979). En contraste en regímenes fluctuantes de temperatura, alta en el día y baja en la noche, es el más adecuado para S. mossambicus en esta latitud ya que es estas condiciones, presentó la máxima eficiencia de crecimiento, inferida del exponente de la ecuación consumo versus peso, lo que se visualiza también en el menor gasto metabólico calculado para un animal de 20 g. en las mismas condiciones (Tabla 1). Estos resultados concuerdan con la hipótesis bioenergética de Brett (1971), quien la sustenta en datos obtenidos paraOncorhynchus nerka. Esta especie migra verticalmente en el cuerpo de agua, entre temperaturas de 5ºC y 17ºC. En la temperatura inferior de este intervalo, los resultados reportados por el autor indican que el metabolismo de mantencion, se reduce a la mitad y por lo tanto los animales tendrían cierta reserva energética, disponible para su crecimiento. En conclusión, en este trabajo el régimen de temperatura y la temperatura inferior en dicho régimen seleccionado por S. mossambicus, concuerdan con la mayor eficiencia de asimilación de la especie, esto es 26ºC en la condición fluctuante. Apoyados en las investigaciones de Kellog y Gift (1983) quienes encontraron una estrecha relación entre elpreferendum termal y el crecimiento óptimo de los peces, es posible inferir de nuestros resultados que la especie en estudio tendría asimismo un mayor potencial de crecimiento en las condiciones medidas. Estos resultados por lo tanto tendrían incidencia en el mejoramiento del cultivo de la especie en el país. AgradecimientosEn forma especial se agradece a la Delegación de la Secretaría de Pesca así como al personal de la Piscifactoría El Rodeo, del Estado de Morelos, el haber proporcionado los organismos utilizados en este estudio. Se hacen extensivos los agradecimientos al personal del Acuario de la Facultad de Ciencias por la mantención de los peces. LITERATURAALLANSON, B. R. y R. G. NOBLE, The tolerance of Tilapia mossambica (Peters) to high temperature. Trans. Am. Fish. Soc., 1964. 323-332 93 (4): ALLANSON, B. R., A. BOK y N. I. VANWYK, The inffluence of exposure to low temperature on Tilapia mossambica (Peters, Cichlidae). J. Fish. Biol., 1971. 181-185 3:. BADENHUIZEN, T. R., Hydrobiology, Temperature selected by Tilapia mossambica (Peterg) in a test tank with horizontal temperature gradient. 1967. 541-554 30: . BALARIN, J.D., Tilapia. Univ. Stirling. Scotland. 1979. 110 P. BEAMISH, F.W.H., A.J. Numi y P.F.K.P. LETT, Bionergeties of teleost fishes: Environmental influences. In: Functional Aspects of Structural Materials. Bolis, L., S.H.P. Maddrell y K. Schmidt-Nielsen (Eds.) North-Holland Publ. Co. Amsterdam, 1975. 187-209. BRETT, J.R., Energetic response of salmon to temperature. A study of some thermal relations in the physiology and freshwater ecology of sockeye salmon (Oncorhynchtts nerka) Am. Zool. 1971. 99-113 ll: . BRETT, J.R., Environmental factors and growth. In: Fish Physiology. Hoar, W.S. D.J. Randall y J.R. Brett (Eds.) Academic Press New York, 1979. 599-675 VOL. VIII. BROWER, J.E. y H.J. ZAR, Field and Laboratory Methods for General Ecology. Wm. C. Brown Co. Publ., Iowa. 1977. 194 p. CAULTON, M. S., The importance of hábitat temperatures for growth in the tropical cielid Tilapia rendalli, Borulanger. J. Fish. Biol. 1978. 99-112 13: . HASTINGS, W.H., Fish nutrition and fish feed manufacture. FAO Tech. Conf. Aq., Kyoto, Japan. 1976. 23-45 26 May - 2 June 1976: . HEPHER, B. y Y. PRUCININ, Commercial Fish Farming. Interscience Publ. New York, 1981. 216 p. KELLOG, R.L. y Ji. CIFF, Relationship between optimum temperatures for growth and preferred temperatures for the young of four species. Trans. Am. Fish. Soc. 1983. 424-430 12: MC CAULEY, R.W. f J.M. CASSELMAN, The final preferendum as an index of the temperature optimum growth in fish. In: Proceedings of the world symposium on aquaculture in heated effluents and recirculation systems. Studen Aquaculture Association of the United Nations, Berlin Germany, 1981. vol. II. MIRONOVA, N. V., Changes in the energy balance of Tilapia mossambica in relation to temperature and ration size. J. Ichtiol, 1976. 120-129 16: . MISHRIGI, Y. S. y T. KuBo, Bull. The energy metabolism in Tilapia nilotica. II. active metabolism at 20ºC and 26ºC. Fac. Fish. Hokkaido. Univ., 1978. 313-321 29 (4): . PALOHEIMO, J.E. y L.M. DICKIE, Food growth of fishes. I. A growth curve derived from experimental data. J. Fish. Res. Bd. Canadá, 1966. 521-542 22 (2): ROSAS, V. C., J. LATOURNERIE y S. ESPINA, Influencia de la temperatura sobre la distribución horizontal de Tilapia mossambica en condiciones de laboratorio. VI. Congr. Nal. Zool. Res. 1982. 38 ROSAS, V. C., Tesis de Licenciatura. Estudios ecofisiológicos de Sarotherodon mossambicus en el laboratorio: gradiente preferencial y metabolismo aerobio. Fac. Ciencias Univ. Nal. Autón. México, 1983. 28 p. SCHMIDT NIELSEN, K., Animal Physiology. Cambridge University Press. 1975. 699 p. WALLACE, J.C., Observations on the relationship between the food consumption and metabolic rate of Blennius pholis L. Comp. Biochem. Physiol., 1973. 293-306 45 (A): WIEST. T., Relationship between the food consumption and growth in ponds. Trans. Am. Fish. Soc., Biostatistical Analysis. Prentice-Hall. Londres, 1964. 619 p.50-57 104 (l): ZAR, J.H. 1974.
|

