|
ECOLOGÍA Y ESTRUCTURA DE LAS
COMUNIDADES DE PECES EN EL SISTEMA LAGUNAR TEACAPÁN-AGUA BRAVA, NAYARIT
MÉXICO
Trabajo recibido el 22 de marzo de 1984 y aceptado para su
publicación el 11 de agosto de 1984.
MARGARITO ALVAREZ RUBIO, FELIPE AMEZCUA LINARES, ALEJANDRO YÁÑEZ-ARANCIBIA.
Universidad Nacional
Autónoma de México, Instituto de Ciencias del Mar y
Limnología, Laboratorio de Ictiología y Ecología
Estuarina. Contribución 434 del Instituto de Ciencias del Mar y
Limnología, UNAM.
El sistema lagunar estuarino
Teacapán-Agua Brava, presenta las áreas de Rhizophora
mangle y otra vegetación litoral asociada más
importante del Pacífico de México, que soporta importantes
recursos pesqueros litorales. La caracterización ecológica de
este sistema tropical se destaca además por un marcado pulso estacional
de descarga fluvial, la presencia de dos bocas estuarinas, y un extenso canal
meándrico que las conecta con el cuerpo central de la laguna. Fueron
analizados 3985 ejemplares que corresponden a 28 familias, 51 géneros y
76 especies de un total de 124 colectas entre 1979-1980. Dos aspectos
principales se han enfocado en el estudio cuantitativo de la ecología
del sistema y sus comunidades: a) La dinámica estructural de las
comunidades y b) Afinidad ecológica en la correlación
peces-habitat. Se analizó la diversidad (H'n H'w, D' y J'), abundancia
(indiv. m-², gm-² ) distribución de especies dominantes,
categorías ictiotróficas y componentes comunitarios. El indice
H'n fluctua de 1.3 a 2.8 dependiendo de la selectividad del arte de pesca, la
localidad, sus gradientes ambientales y la época del año. El
rango de la biomasa fue de 0. 12 a lo. 0 gm-² . Dominan en la comunidad
los consumidores del 2do. orden y esta tendencia es independiente del arte de
pesca, la localidad y época del año. Asimismo las especies
cíclicas o estacionales son mas abundantes que las residentes
permanentes. El análisis de "cluster" ,mostró elevada afinidad
ambiental para dos regiones principales: Las bocas y la laguna, donde el canal
es claramente un puente ecológico entre ambas regiones, esta
heterogeneidad ambiental o de habitat es el reflejo de variables
físicas, y las comunidades de peces están altamente
correlacionadas con asociaciones de poblaciones específicas para cada
uno de estos habitats. Dieciocho especies tipifican a la comunidad a
través de toda el área y durante todo el
año:Achirus mazatlanus, Arius liropus, Centropomus robalito,
Galeichthys caerulescens, Nematistius pectoralis, Lile stolifera, Hyporhamphus
unifasciatus, Diapterus peruvianus, Eucinostomus sp. (entomelas), Elops
affinis, Mugil curema, Dormitator latifrons, Caranx hippos, Eucinostomus dowii,
Oligoplites mundus, Citharichthys gilberti, Eugerres axillaris y Gerres
cinereus. El sistema es utilizado por un gran número de peces
como zona de alimentación, protección y crianza y sólo
unas cuantas especies se reproducen o completan todo su cielo de vida en el
área. El ambiente de amplios pantanos de manglares, la dinámica
del cuerpo de agua, la descarga de los ríos, el rango de las mareas, y
las comunidades de peces predominantemente juveniles y preadultos, sugieren que
el sistema Teacapán-Agua Brava puede desarrollar un importante papel
ecológico como mecanismo de producción del litoral de la
plataforma continental adyacente.
The lagoon-estuarine system of
Teacapan-Agua Brava contains the most important areas of Rhizophora
mangle and other associated littoral vegetation on the Pacific coast
of México which support important littoral fishery resources. The
ecological characterization of this tropical system stands out, furthermore,
because of a marked seasonal pulse of fluvial dis charge, the presence of two
estuarine in lets and a long meandring canal that connects them with the main
body of the lagoon. Three thousand nine hundred eighty five specimens
corresponding to 28 families, 51 genera and 76 species from a total of 124
collections made between 1979-1980 were analyzed. Two main aspects have been
the focus of the quantitative ecological study of the system and its
communities: a) The structural dynamic of the communities and b) Ecological
affinity in the correlation fish-habitat. The following factors were analyzed:
diversity (H'n, H'w, D' and J'), abundance (indiv. m-², gm-²),
distribution of dominant species, ichthyotrophic categories and community
components. The H'n index fluctuated from 1.3 to 2.8 depending on capture
method selectivity, locality, environmental gradients and the season of the
year. The biomass range was from 0.12 to 10.0 gm-². Second order
consumers were dominant in the community and this tendency was independent of
the capture method employed, locality and season, Also cyclical and seasonal
species are more abundant than permanent residents. A cluster analysis showed
high environmental affinity for two principal areas: the inlets and the lagoon,
where the canal is clearly an ecological bridge between both regions, this
environmental or habitat heterogeneity mirrors physical variables, and fish
communities are highly correlated with associations of species populations for
each of these habitats. Eighteen species typify the community throughout the
whole area and during the entire year: Achirus mazatlanus, Arius
liropus, Centropomus robalito, Galeichthys caerulescens, Nematistius
pectoralis, Lile stolifera, Hyporhamphus unifasciatus, Diapterus peruvianus,
Eucinostomus sp. (entomelas), Elops affinis, Mugil curema, Dormitator
latifrons, Caranx hippos, Eucinostomus dowii. Oligoplites mundus, Citharichthys
gilberti, Eugerres axillaris and Gerres cinereus. The system in used
by a great number of fish as a zone feeding, protection and growth and only a
few species reproduce or complete their entire cycle in the area. The
environment, with plenty of mangrove swamps, the dynamic of the body of water,
river discharge, tidal ranges and the predominantly juvenile and pre-adult fish
communities suggest that the Teacapan-Agua Brava system may play an important
ecological role as a littoral production mechanism of the adjacent continental
shelf.
Los sistemas lagunares se caracterizan por sus comunidades bióticamente distintas a las marinas y dulceacuícola. Estas lagunas, por constituir ecosistemas con características propias y presentar habitat muy peculiares, se ven afectados por numerosos factores e inciden en la productividad biológica como: geomorfología, batimetría, régimen de mareas, corrientes, descargas de ríos que aportan nutrientes (fosfatos, nitratos y materia orgánica en suspensión), temperatura, salinidad, vegetación circundante y sumergida (Day y Yáñez-Arancibia, 1982). Todo este conjunto determina condiciones propicias para las formas vivientes y la abundancia de especies de interés económico, (Smith et al., 1966). No obstante, su evidente importancia económica, los sistemas lagunares no están completamente conocidos y mucha de la dinámica queda aún por investigarse. Solo en ciertas lagunas se tienen conocimiento relativamente completos, ejemplos: Laguna de Términos (Yáñez-Arancibiaet al., 1980; Yáñez-Arancibia y Day, 1982.) Laguna de Tamiahua (Villalobos et al., 1969; Ayala-Castañares et al., 1969 b) Laguna de Nichupté (Jordan et al., 1978). Sistema lagunar Huizache-Caimanero (Edwards, 1978; Amezcua Linares, 1977). Sistema Lagunar de Guerrero (YáñezArancibia, 1978 b.) Laguna Oriental y Occidental en Oaxaca (Chávez, 1979) entre otras. El sistema lagunar de Teacapán-Agua Brava tiene gran importancia por la actividad pesquera desarrollada en la región. Además tiene un interés particular como ecosistema, por presentar características especiales, dadas por sus diferentes zonas que lo constituyen: Bocas, Parte Baja del Estero estero se refiere a una región geomorfológica que es parte del sistema lagunar-, Estero y Laguna; como también por la apertura reciente de una boca artificial al sur del estero que comunica en forma directa la laguna con el mar (Secretaría de Agricultura y Recursos Hidráulicos). Igualmente cabe señalar la importancia de los bosques de manglar en ésta región, debido a la gran productividad primaria que generan (Rollet, 1974). El mismo autor indica que estas extensiones de bosques sustentan diferentes comunidades de fauna y flora en sus diferentes estratos; algunos organismos (aves) son exportadores o importadores de energía al ecosistema. Mucha de la fauna marina que ahí habita está caracterizada por los diferentes tipos de manglar que sustentan. a peces, moluscos, crustáceos, poliquetos y ciertas algas, en otras localidades eso ha sido bien caracterizado (Rutzler, 1969; Heald et al., 1974). El presente estudio muestra un panorama del ecosistem a lagunar Teacapán-Agua Brava, para dar a conocer algunas características ecológicas de la fauna ictiológica, que además de contribuir a una interpretación adecuada del sistema, resulta por si mismo una información valiosa, puesto que es un complejo lagunar poco conocido. Asimismo por la necesidad de conocer el medio ambiente lagunar costero, ya que representan un potencial productivo importante para el desarrollo de la región como área pesquera. La escasa integración del conocimiento científico con que se cuenta actualmente en los sistemas lagunares en vías de explotación, determina la importancia de efectuar estudios que aporten información descriptiva adecuada de dichos ecosistemas, y con ello se sugiera un mejor aprovechamiento y administración de los recursos pesqueros. OBJETIVOS1. Identificación de la fauna de peces presente, en el sistema Teacapán-Agua Brava. 2. Caracterizar los hábitat en f unción de la temperatura, salinidad, oxígeno, fauna macrobéntica, mareas, sustrato y vegetación sumergida. 3. Determinar la estructura de la comunidad de peces, considerando los siguientes aspectos: diversidad, distribución, abundancia (en número y biomasa), especies dominantes y categorías ictiotróficas y comparar los resultados obtenidos bajo las diferentes artes de pesca empleados. 4. Determinar la similaridad ecológica de especies y estaciones, para analizar la heterogeneidad del sistema ecológico. ANTECEDENTESLos estudios ecológicos efectuados en las lagunas costeras del pacífico, no son numerosos. Generalmente se han referido a objetivos particulares de alguna especie y los menos tratan sobre características generales del ecosistema o incluyen las primeras integraciones. En el sistema Teacapán-Agua Brava existen algunos trabajos aislados, donde la mayoría versan sobre aspectos particulares de parámetros ambientales, prospección ictiológica, características generales de placton y geomorfología, pero ninguno describe el panorama ecológico del sistema. De los principales trabajos efectuados, se encuentran: vegetación circundante y bosques de manglar de Agua Brava (Rollet, 1974); corrientes y mareas (Cepeda, 1977); de hidrología (Núñez, 1973; Gómez-Aguirre, 1971), de ecología (Tirado, 1976; Yáñez-Arancibia y Nugent, 1975), prospección ictiológica (Carranza Y Amezcua Linares, 1971; Amezcua Linares, 1972). Por otra parte algunos trabajos realizados en áreas lagunares cercanas, constituyen un buen marco de referencia: geología Ayala-Castañares et al.(1969a), Curray et al. (1969); hidrología Arenas (1970), Soto (1969); plancton Gómez-Aguirre et al.(1974); biología de moluscos García-Cubas (1969); plancton Gómez-Aguirre et al. (1974); biología de moluscos, García-Cubas (1969); productividad camaronera y pesquera, Chapa-Saldaña et al. (1966); ecología, Ramírez (1952), Carranza (1970), Yáñez-Arancibia (1975a), Yáñez-Arancibia (1976), Yáñez-Arancibia (1977), Yáñez-Arancibia et al. (1976), Amezcua Linares (1977), Yáñez-Arancibia (1978b), Edwards (1978), Warburton (1978), Yáñez-Arancibia (1981); biología de algunas especies de peces, González (1972), Amezcua Linares (1977), Yáñez-Arancibia y Díaz (1977) y Yáñez-Arancibia (1976b). ÁREA DE ESTUDIOEl complejo lagunar Teacapán-Agua Brava, está situado al noroeste de la República entre los paralelos 22° 04' y 22° 35' latitud norte y los meridianos 105° 50' de longitud oeste (Fig. l). El sistema se localiza entre los límites norte-sur de los estados de Nayarit y Sinaloa, donde abundan lagunas, esteros y marismas, en constante cambio (Currayet al., 1969). Esta limitado al norte, con el Estero del Mezcal y Laguna de Agua Grande, Sinaloa. Al sur con las marismas de Canoas y Laguna Pericos Nayarit (Amezcua Linares, 1972). Originalmente el sistema Teacapán-Agua Brava fue descrito, considerándose cuatro ambientes: (a) Boca de Teacapán, (b) Estuario, (e) Estero y (d) Laguna (Amezcua Linares, 1972; Núñez-Pasten, 1.973). Por razones prácticas de desarrollo de éste trabajo, se consideran esas regiones, que al mismo tiempo se plantean como hipótesis conducente a confirmación o a un nuevo planteamiento general que las agrupe de una manera diferente. Lo que tales autores consideran como (b) estuario es denominado en este trabajo como "parte baja del estero" (PBE), que es el estero con mayor influencia marina. Esta aclaración parece útil y pertinente por cuanto todas esas regiones en su conjunto, constituyen el sistema lagunarestuarino de Teacapán-Agua Brava. La Boca de Teacapán (estaciones 1 y 2; Fig. 1) tiene un ancho de 1660 m aproximadamente, con una profundidad variable de 3 a 9 m; ésta última corresponde al canal de marea. La Parte Baja del Estero (estaciones 3-6; Fig. 1) está orientado en forma perpendicular y situado frente al embarcadero de San Cayetano y es el canal más profundo del sistema, con 12 m. El Estero (estaciones 7-14; Fig. 1) se orienta paralelo a la costa separado del mar por una barra con bermas arenosas y con una profundidad promedio de 4 m y puede ser situado desde Cruz de San Marcos hasta el límite entre Corcovadas y punta de Cuautla. (Estaciones 7, 14 y 15 respectivamente). La Boca de Cuautla (estación 15) es un canal artificial de la boca que comunica a la laguna con el mar en la parte sur del estero. Este canal tiene aproximadamente 200 m de ancho, pero está ampliándose continuamente debido a las fuertes corrientes litorales, la profundidad del canal es de 8 m aproximadamente. 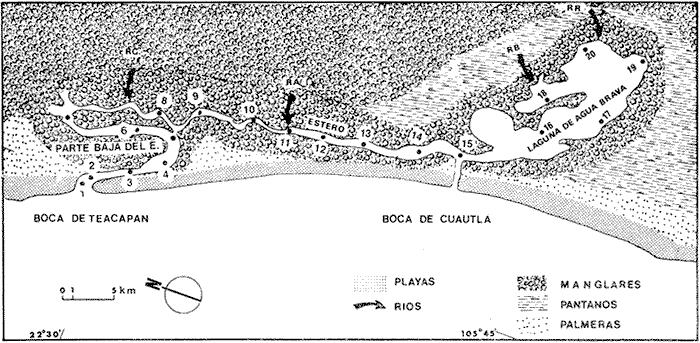 Fig. 1 Sistema Teacapán-Agua Brava, Nayarit, México. Se señalan los rasgos principales de vegetación, topografía y estaciones de colecta, se destacan las amplias zonas de bosques de manglar que caracterizan a la zona. Así como las cuatro regiones del sistema (boca, Parte Baja del Estero y laguna). Las abreviaturas corresponden a los sistemas fluviales RC = Río Cañas; RA = Río Acaponeta; RB =Río Bejuco; RR = Río Rosa Morada. La Laguna (estaciones 16 a 20; Fig. 1) es de tipo costero, separada de litoral por una faja corta de terrenos bajos; está orientado diagonalmente con respecto a la costa. Las profundidades promedio varían de 2.50 m y comprende desde la Punta del Arco hasta la parte más anterior del sistema, con un ancho de 0.8 a 1.5 km aproximadamente; ésta se comunica a través del estero y de la boca artificial con el mar. CLÍMAEl clima de la región es sub-tropical a tropical, de tipo Aw o (w) (e) según el sistema de Köepen, modificado por García (1973). La temperatura promedio anual es de 25° C, con cambios de precipitación de aproximadamente 850 mm al norte en Mazatlán y de 1200 mm, en Tepic, Nayarit y cerca de 1660 mm en la costa sur, en las proximidades de San Blas (Curray et al., 1969). Muchas de las lluvias caen al finalizar el verano e inicios de otoño, frecuentemente acompañadas de tormentas tropicales o pequeños chubascos que vienen del sur. El patrón predominante de vientos presentan dos fases: los que vienen del noroeste en los meses de invierno, y los de oeste a sureste en el verano, este es un régimen de brisas que decrecen en la tarde. Los vientos son un factor importante y dinámico, puesto que determinan la circulación, grados de depositación de materiales, oxigenación, estratificación, grados de mezcla, aislamientos de masas de agua, turbidez, etc. HIDROGRAFÍALos ríos que descargan en el sistema son importantes, Núñez (1973) hace notar que solo ocurren los ríos Acaponeta y Cañas, en tanto que el San Pedro y Santiago forman otros sistemas al sur y el Baluarte al norte de la región. En la laguna descargan directamente los ríos Bejuco y Rosa Morada. La mayoría de los ríos son secos en la época del estio, con excepción del río Acaponeta. La mayoría de los ríos que entran al área tienen descargas limitadas (Currayet al. 1969). Todos ellos tienen un gran efecto sobre la naturaleza de la región y aportan grandes cantidades de sedimentos a la línea costera de Nayarit. Estos ríos fueron importantes en el Pleistoceno por la acumulación de sedimentos en las áreas deltaicas (Curray y Moore, 1964; Curray et al., (1969). HIDROLOGÍASegún datos obtenidos por Amezcua Linares (1972) y Núñez (1973) antes de la apertura del canal artificial, el sistema de Teacapán-Agua Brava presentaba el siguiente cuadro ambiental (Tabla l). Todos estos parámetros están influenciados en mayor o menor medida por el rango de mareas, descarga de los ríos, vientos y el patrón de circulación de la laguna. Esta última mantenía estabilidad a través del año. MAREASEstudios efectuados en el canal artificial (Boca de Cuautla) del sistema de Teacapán-Agua Brava, por el Instituto de Geofísica de la Universidad Nacional Autónoma de México (Cepeda, 1977), indican que el tipo de mareas es mixto. La boca artificial presenta una inestabilidad en su flujo, lo cual fue demostrado al observarse una desigualdad diurna en los pleamares y bajamares. Asimismo pudo establecerse que el mes de diciembre es crítico para el sistema, debido a que la velocidad media de las corrientes es de 0.96 m/seg, lo cual es capaz de erosionar el fondo y los márgenes del canal. En general los valores observados de los registros de mareas, son superiores a un metro por segundo en el reflujo para el área, lo cual indica que existe un autodragamiento del canal. La condición de equilibrio se presentará cuando el canal sea lo suficientemente ancho para que permita una velocidad dentro de los límites no erosionables. Datos de mareas en Agua Brava obtenidos en 1972, antes de la apertura del canal artificial en la Boca de Teacapán (Rollet, 1974), indican que las mareas tenían influencia hasta Puerta del Río (estación 11), y casi nulas, en las proximidades del canal artificial. 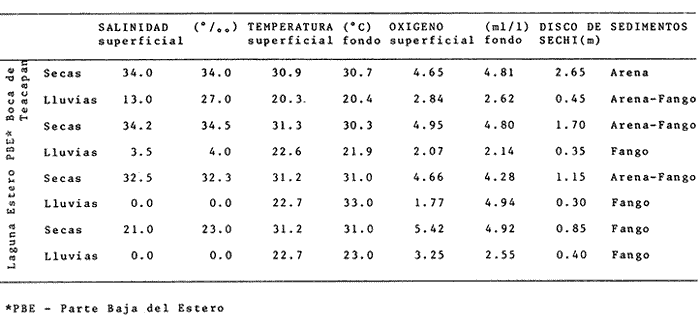 TABLA 1 DISTRIBUCIÓN PROMEDIO DE PARÁMETROS HIDROLÓGICOS EN EL SISTEMA DE TEACAPÁN-AGUABRAVA, DURANTE LOS AÑOS 1970-1971. VEGETACIÓN CIRCUNDANTEA lo largo del sistema se establecen diferencias fitogeomorfológicas. Las zonas de la Boca de Teacapán y Parte Baja del Estero, constan de tres tipos de vegetación (Rollet, 1974): a) el bosque deciduo, b) los matorrales de las marismas, e) el manglar. Los mejor representados son el árbol Bursera simaruba (jiote),Enterolobium cyclocarpum (Guanacaste) y leguminosas, la mayoría de ellas espinosas y algunas cactáceas y gramíneas terrestres. En las marismas hay Conocarpus sp, así como Avicennia sp. Asimismo aquí existe el mangle chino Languncularia racemosa. En la región del estero se observa una dominancia, principalmente en su parte norte (estaciones 7, 8, 9 y 10) de: Laguncularia sp,Conocarpus sp (jovenes) y Avicennia sp, que abundan en la región. Conforme se avanza hacia la Boca de Teacapán, se observa que la hipersalinidad tiende a disminuir hasta tener características marinas, la principal representante es elRhizophora mangle. La Boca de Cuautla presenta abundancia deAvicennia sp precisamente en las proximidades del poblado, otras especies de mangle como Laguncularia racemosa Conocarpus sp y Rhizophora mangle abundan en menor grado. En la laguna, Avicennia sp yConocarpus sp son poco abundantes, sin embargo se registra un aumento de Rhizophora mangle yLagunculana sp, que se localiza en algunas zonas de la Punta del Burro y Punta del Arco (estación 18). MATERIAL Y MÉTODOS
ACTIVIDADES DE CAMPOLos muestreos se efectuaron en 20 estaciones distribuidas a lo largo del sistema, tratando de cubrir todas las regiones: Boca de Teacapán, Parte Baja del Estero, Boca de Cuautla y Laguna de Agua Brava, (Fig. 1). Se efectuaron colectas diurnas en las 4 estaciones del año, de junio de 1979 a mayo de 1980, a bordo de una lancha tipo trimarán de 5.0 m de eslora, con un motor fuera de borda de 40 HP, desde la cual se operaron tres artes de pesca:red de arrastre camaronera, con 13 m de longitud, 5 m de amplitud de la boca, 2.5 m de abertura de trabajo y tablas de 0.60 m de largo, luz de malla de 1/4 de pulgada; red agallera fabricada con monofilamento de nylon, 60 m de longitud por 2.5 m de altura y abertura de malla de 2 pulgadas; chinchorro de playa con bolsa, de 45.2 m de largo por 3.6 m de alto y malla de una pulgada. La profundidad a la que se efectuaron las capturas en general, no excedió a los 7 m. Las mayores corresponden a las bocas y algunas partes de la Parte Baja del Estero y canal del estero. Se efectuaron cuatro campañas en las diferentes estaciones climáticas del año: 1er. Campaña: del 21 al 26 de junio de 1979 (verano), en 15 estaciones. 2da. Campaña: del 3 al 17 de septiembre de 1979 (otoño) en 18 estaciones. 3era. Campaña: del 9 al 14 de enero de 1980 (invierno), en 16 estaciones. 4ta. Campaña: del 16 al 20 de mayo de 1980 (primavera), en 20 estaciones. Para algunas estaciones de colecta se utilizaron todas las artes de pesca, pero en otras solamente algunas de ellas, según lo permitían las cindiciones topográficas de la zona. Los ejemplares colectados fueron fijados en formalina al 10 % , para ser procesados posteriormente en el laboratorio. Todo el material fue debidamente etiquetado. En varias ocasiones se procesaron ejemplares, cuando los individuos en número o en talla eran superiores a la capacidad de los recipientes. Para cada estación se tomaron muestras de agua con una botella Van-Dorn horizontal de 5 1, efectuándose mediciones de temperatura (superficie y fondo), la cual fue determinada con un termómetro de cubeta convencional graduado, con una precisión de 0.1°C y escala de 0 a 50°C. La salinidad (superficie y fondo) fue determinada con un refractómetro American Optical de lectura directa, escala de 0 a 50°/oo y temperatura compensada. El oxígeno fue determinado por el método Winkler. La profundidad fue medida con una sondaleza y al transparencia con un disco de Secehi. Los sedimentos fueron determinados como sigue a) fondo limoarcilloso o fangoso, b) fondo mixto de arenaarcilla o arenoso - fangoso, e) arenoso. Los parámetros climatológicos para el área del sistema de Teacapán-Agua- Brava, fueron proporcionados por el departamento de Hidrometría de la Secretaría de Agricultura y Recursos Hidráulicos (SARH), a partir de los anos de 1977-1980. Por lo que se refiere a la fauna macrobéntica (esponjas, anélidos, moluscos, crustáceos, etc.), fue separada y etiquetada para estudios de identificación y cuantificación. De la misma forma fue procesada la vegetación sumergida (algas).
Actividades de Laboratorio
La determinación de las especies fue efectuada por medio de la literatura clásica de: Jordan y Evermann (1896-1900); Meek e Hildebrand (1923-1928); Hildebrand (1943) entre otros. Para la ordenación sistemática supragenérica se siguió el criterio de Greenwood et al. (1966 y 1967). La colección se encuentra depositada en el laboratorio de Ictiología y Ecología Estuarina del Instituto de Ciencias del Mar y Limnología, UNAM. Los componentes comunitarios fueron determinados en base a: frecuencia, distribución, procedencia y tolerancia a las salinidades, según estudios en las lagunas costeras (Gunter, 1956; Hedgpeth, 1957; Me Hugh, 1967; Yáñez-Arancibia, 1975b; Yáñez-Arancibia y Nugent, 1977). Tales criterios se complementan con observaciones de madurez gonadica, tamaño, hábitos alimenticios y migraciones (Yáñez-Arancibia et al., 1980). La diversidad fue calculada por varias expresiones matemáticas, que a continuación se describen: el índice de información o diversidad (Shannon-Weiner, 1963; Margalef, 1957); la cual es una expresión de la medida de la información que aporta un sistema: H'π=-ΣPi ln Pi; " bel nat" / ind. donde: Pi = ni/N (Proporción de individuos), ni = número de individuos,N = total de individuos en una colecta. Otras de las expresiones matemáticas es la de (Lloyd y Ghelardi, 1964), que afirmaron que la fórmula de Shannon-Weuber se oyede separar en dos elementos: "equitatividad" o "uniformidad" de especies abundantes y "riqueza de especies", donde S, es el número de especies en el muestreo. La expresión de "equitatividad" se enuncia como: J' = H'/Hmax = H' lns (2) Esta es una medida de la abundancia relativa, y representa la proporción de la diversidad observada, para cuando esta tiene sus valores máximos posibles, para un mismo número de especies, es decir, cuando todas son igualmente abundantes. Indice "riqueza de especies" (Margalef, 1958); el cual tiene la siguiente expresión matemática: D= (S-I) / ln N (3) donde: S = número total de especies en una colecta N = total de individuos de todas las colectas Esta es una expresión simple de especies en función del logaritmo de la extensión de la muestra. El índice de biomasa, es una modificación de la fórmula de Shannon-Weiner (1963); propuesta por Wilhm (1968) solo que ésta no utiliza individuos, sino los gramos, según la fórmula siguiente: H'w=-ΣPi ln Pi; " bel nat" / ind; Pi = wi/W (4) donde: P1 = wi es el número de gramos por individuo W = total de gramos en la colecta Todos los cálculos de estos índices se efectuaron sobre la base de los logaritmos naturales. Tanto el índice de biomasa H'w como el numérico (H'n) se complementan para describir el grado de entropía (orden) del sistema En general el uso de estos índices permiten interpretaciones en relación a la estructura de la comunidad, la afinidad ecológica entre las estaciones de colecta. Asimismo se efectúan interpretaciones en relación a los diferentes patrones de distribución de las poblaciones. La abundancia poblacional, fue expresada en dos formas: el número de individuos (densidad) por unidad de área (ind.M-2) y la biomasa de la población en número de gramos por unidad de área (g. m-²). SIMILARIDAD Y ANÁLISIS "CLUSTER"El estudio del ordenamiento taxonómico y ecológico sobre la base de la clasificación numérica, tiene un desarrollo considerable (Sneath y Sokal, 1973) y se ha extendido bastante en estudios de clasificación ecológica y comunidades de peces; (Horn y Allen, 1976; Warburton, 1978; Daniels, 1979; Yáñez-Arancibia et al, 1980). Con el fin de determinar el grado de similaridad y disimilaridad entre las distintas colectas, en relación a sus especies y estaciones de colecta, se seleccionó al Simple-Matching Coeficient- (Sokal y Michener, 1958) expresado en la forma siguiente:  Lo anterior fue computarizado por: (Program, 46 Single-Linkage Cluster analysisIn: Davies, 1971). que consiste en el proceso de reunir en grupos a las unidades en relación al criterio usado en las clasificaciones ecológicas, en donde las entidades son sitios (estaciones) y los atributos (especies). El resultado del "cluster" o agrupamiento fue graficado en un dendrograma de afinidad, por el método de Nearest-Neighbor (Clifford y Sthephenson, 1975). Este tipo de programa permitió efectuar tres análisis "cluster" de afinidad. 1) Similaridad (disimilaridad) de especies presentes, en base a sus estaciones. 2) Similaridad (disimilaridad) de estaciones en base a la presencia o ausencia de especies. 3) Estaciones de colecta similares (disímiles) en relación a sus características ambientales. Las categorías ictiotróficas fueron determinadas siguiendo los criterios de Yáñez-Arancibia (1978a). RESULTADOSDe los cuatro campañas efectuadas al sistema lagunar, a continuación se describe la cuantificación total para cada arte de pesca de junio de 1979 a mayo de 1980. Arrastre: 752 ejemplares, en 47 colectas Agallera: 175 ejemplares, en 45 colectas Chinchorro: 2958 ejemplares, en 32 colectas En síntesis, fueron analizados 3985 individuos, distribuidos en 28 familias, 51 géneros y 76 especies, en un total de 124 colectas, a través del cielo anual estudiado. LISTA SISTEMÁTICA
A. Clase Chondreichthyes
Orden Batoidei
Suborden Myliobatoidea
Familia I. Urolophidae
Género 1 Urotrygon Gill, 1863 1) Urotrygon asterias Jordan y Gilbert,1882 B. Clase Osteichthyes
División I Taeniopaedia
Superorden Elopomorpha
Orden Elopiformes
Suborden Elopoidei
Familia II. Elopidae
Género 2. Elops Linnaeus, 1766 2). Elops affinis Reagan, 1909 Orden Angilliformes
Suborden Anguilloidei
Familia III Xenocongridae (Myridae)
Género 3. Myrichthys Girard, 1856 3) Myrichthys tigrinus Girard, 1859 Superorden Clupeomorpha
Orden Clupeiformes
Suborden Clupeoidei
Familia IV. Clupeidae
Género 4. Lile Jordan y Evermann, 1896 4) Lile stolifera Jordan y Gilbert, 1896
Género 5. Dorosoma Rafinesque, 1820 5) Dorosoma smithi Hubbs y Miller
Género 6. Opisthonema Gill, 1861 6) Opisthonema libertate Gunther, 1866 Familia V. Engraulidae
Género 7. Anchovia Jordan y Evermann, 1896 7) Anchovia macrolepidotaKner y Steindachner, 1865 8) Anchovia rastralis (Gilbert y Pierson, 1923)
Género 8. Anchoa Jordan y Evermann, 1927 9) Anchoa compresa (Girard, 1858) 10) Anchoa ischana Jordan y Gilbert, 1881 11) Anchoa panamensis (Steindachner, 1875) División III. Euteleostei
Superorden Protacanthopterygii
Orden Salmoniformes
Suborden Myctophoidei
Familia VI. Synodontidae
Género 9. Synodus Gronow, 1810 12) Synodus scituliceps Jordan y Gilbert, 1881 Orden Gonorynchiformes
Suborden Chanoidei
Familia VII. Chanidae
Género 10. Chanos Lacépéde, 1803 13. Chanos chanos Forskal, 1775 Superorden Ostariophysi
Orden Siluriformes
Familia VIII. Ariidae
Género 11. Galeichthys Cuvier y Valenciennes, 1840 14) Galeichthys caerulecens Guther, 1864 15)Galeichthys gilberti Jordan y Williams, 1895
Género 12. Arius Cuvier y Valenciennes, 1858 16) Arius liropus Bristol, 1846 Superorden Atherinomorpha
Orden Atheriniformes
Suborden Exocoetoidei
Familia IX. Exocoetidae (Hemirhamphidae)
Género 13. Hyporhamphus Gill, 1860 17) Hyporhamhus unifasciatusRanzani, 1842 Familia X. Belonidae
Género 14. Strongylura Van Hasselt, 1823 18) Strongylura stoIzmanni Steindacher, 1878 Género 15.Tylosurus Coceo, 1833 19)Tylosurus fodiator Jordan y Gilbert, 1881 Superorden Superorden Acanthopterygii
Orden Gasterosteiformes
Suborden Syngnathoidei
Familia XI. Syngnathidae
Género 16. Syngnathus Linnaeus, 1757 20) Syngnathus auliscus Swain, 1882 21) Syngnathus sp. Orden Perciformes
Suborden Percoidei
Familia XII. Centropomidae
Género 17. CentropomusLacépéde, 1802 22) Centropomus robalito Jordan y Gilbert, 1881 Familia XIII. Carangidae
Género 18. Nematistius Gill, 1862 23) Nematistius pectoralis Gill, 18622
Género 19. Caranx Lacépéde, 1802 25) Caranx hippos (Linnaeus, 1766)
Género 20. Selene Lacépède, 1802 26) Selene brevoortii Gill, 1863 27) Selene oerstedii Lutken, 1880
Género 21. Oligoplites Gill, 1863 28) Oligoplites mundus Jordan y Starks, 1896 29) Oligoplites saurus Bloch y Schaneider, 1801 30) Oligoplites refulgens Gilbert yStarks, 1904
Género 22.Trachinotus Lacépède, 1802 **31) Trachinotus culveri Jordan yStarks, 1904 32) Trachinotus paloma Jordan yStarks, 1895 33) Trachinotus rhodopusGill, 1863
Género 23. Citula Cuvier, 1817 34) Citula dorsalis (Gill, 1863)
Género 24. Chloroscombrus Girard, 1858 35) Chloroscombrus orquetaGirard,1859 Familia XIV. Lutjanidae
Género 25. Lutjanus Bloch, 1970 36) Lutjanus argentiventris Peters,1869 37) Lutjanus colorado Jordan y Gilbert, 1881 **38) Lutjanus guttatusSteindachner,1869 39) Lutjanus novemfasciatus Gill,1862 Familia XV. Gerridae
Género 26. Diapterus Ranzani, 1840 40) Diapteurs peruvianus Cuvier yValenciennes, 1830
Género 27. Gerres Cuvier, 1839 41) Gerres cinereus Walbaum, 1792
Género 28. Eugerres Jordan y Evermann,1927 42) Eugerres auxillarisGunther, 1864
Género 29. Eucinostomus Baird y Girard,1854 *43) Eucinostomus sp (currani) *44)Eucinostomus sp (entomelas) 45) Euconostomus dowii Gill, 1863 46) Eucinostomus gracilis Gill, 1862 Familia XVI. Pomadasyidae (Haemulidae)
Género 30. Pomadasys Lacépède, 1803 47) Pomadasys leuciscusGunther,1864 48) Pomadasys macracanthusGunther, 1864 Familia XVII. Scianidae
Género 31. Micropogon Cuvier y Valenciennes, 1830 49) Micropogon ectenes Jordan y Gilbert, 1881
Género 32.Cynoscion Gillo, 1861 50)Cynoscion xanthulus Jordan y Gilbert, 1881
Género 33. Bairdiella Gill, 1861 51) Bairdiella icistia Jordan y Gilbert, 1881
Género 34. Isopisthus Gill, 1862 52) Isopisthus remijer Jordan y Gilbert, 1881 Familia XVIII. Ephippidae
Género 35. ChaetodipterusLacépéde, 1803 53) Chaetodipterus zonatus Girard, 1858 Familia XIX. Chaetodontidae
Género 36. Chaetodon Linnaeus, 1758 54) Chaetodon humeralis Gunther, 1860 Familia XX. Pomacentridae
Género 37. Abudefduf Forskal, 1775 55) Abudefduf saxatilis Linnaeus, 1758 Suborden Mugiloidei
Familia XXI. Mugilidae
Género 38. Mugil Linnaeus, 1758 56) Mugil cephalus Linnaeus, 1758 57) Mugil curema Cuvier y Valenciennes, 1836 Suborden Polynemoidei
Familia XXII. Polynemidae
Género 39. PolydactylusLacépède, 1803 58) Polydactylus aproximans Lay y Bennet, 1839 Suborden Gobioidei
Familia XXIII. Gobiidae
Género 40. GobiomorusLacépéde, 1798 59) Gobiomorus macultatus Gunther, 1859
Género 41. Dormitator Gill, 1861 60) Dormitator latifrons Richardson, 1837
Género 42. Microgobius Poey, 1876 61) Micorgobius emblematicus Jordan y Gilbert, 1881
Género 43. Gobionellus Girard, 1853 **62) Gobionellus microdon Gilbert, 1891 63) Gobionellus sagittula Gunther, 1861 Suborden Scombroidei
Familia XXIV. Scombridae
Género 44. ScomberomorusLacépède, 1802 64) Scomberomorus maculatus (Mitchill, 1815 Orden Pleuronectiformes
Suborden Pleuronectoidei
Familia XXV. Bothidae
Género 45. Citharichthys Bleeker, 1862 65) Citharichthys gilberti Jenkis y Evermann 1889
Género 46. Etropus Jordan y Gilbert, 1881 66) Etropus crossotus Jordan y Gilbert, 1882 Familia XXVI Soleidae
Género 47. AchirusLacépéde, 1803 67). Achirus mazatlanus Steindachner, 1869
Género 48.Tinectes Rafinesque, 1831 ** 68))Trinectes fonsecensis, Gunther, 1862 Familia XXVII. Cynoglossidae
Género 3 49. Symphurus Rafinesque, 1810 69) Symphurus atricaudus Jordan y Gilbert, 1880 70) Symphurus elongatusGunther, 1869 71) Symphurus leei Jordan y Boll man, 1889 Orden Tetraodontiformes
Suborden Balistoidei
Familia XXVIII. Balistidae
Género 50. Balistes Linnaeus 72) Balistes naufragium Jordan y Starks, 1895 Suborden Tetraodontoidei
Familia XXIX. Tetraodontidae
Género 51. SphoeroidesLacépède, 1798 73) Sphoeroides angusticeps (Jenyns, 1842) 74)Sphoeroides annulatus (Jenyns, 1852) 75)Sphoeroides lobatus (Steindachner 1870 76) Caranx sp * Los nombres fueron propuestos por Zahuranec, 1967. No obstante este trabajo no ha sido publicado, sin embargo por ser especies perfectamente reconocibles han sido utilizados por varios autores recientemente (Amézcua Linares, 1972; Yáñez-Arancíbia, 1978). * * Estas especies fueron capturadas con atarraya, este arte de pesca no se incluye en este trabajo para efectos cuantitativos. CARACTERIZACIÓN AMBIENTAL DEL HABITAT
Clima Los parámetros fisicoquímicos dependientes del régimen climáticos como descarga fluvial, tabla 2 e hidrología, tabla 3, se presentan para cada época del año (Figs. 2-4). Desde el punto de vista climático-meteorológico, las máximas temperaturas se observan en primavera y verano: la región de Tecuala con 29.6°C de promedio mensual y Rosa Morada 30.2°C. Las mínimas se presentan en invierno con 20.3°C de promedio mensual para Tecuala y 21.05°C en Rosa Morada. 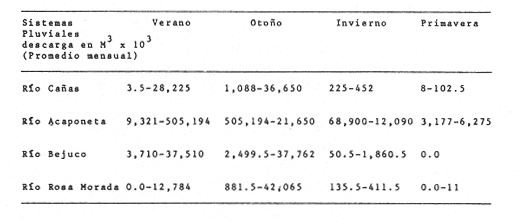 TABLA 2 PROMEDIO ESTACIONAL DE LAS DESCARGAS DE LOS RÍOS EN EL SISTEMA TEACAPÁN - AGUABRAVA. 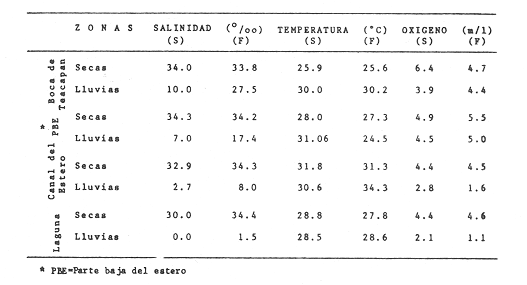 TABLA 3 DISTRIBUCIÓN PROMEDIO DE PARÁMETROS HIDROLÓGICOS EN EL SISTEMA TEACAPÁN - AGUABRAVA. La evaporación tiene un comportamiento similar a la temperatura, los más altos valores se registran en primavera y verano: en Tecuala con 172.7 mm de promedio mensual y 222.4 mm para Rosa Morada. La evaporación más baja es en invierno con 87.7 mm y 66.7 mm para Tecuala y Rosa Morada respectivamente. La máxima precipitación se observa a finales de verano en la región de Tecuala con 342.6 mm de promedio mensual y 473.1 mm en Rosa Morada. En primavera e inicios de verano sólo llueve esporádicamente. La región de Tecuala presenta valores de 0.0 mm y Rosa Morada de 0.9 mm de promedio mensual. Los tres parámetros climatológicos analizados se comportan con el mismo patrón y elevada correlación, a través del año. 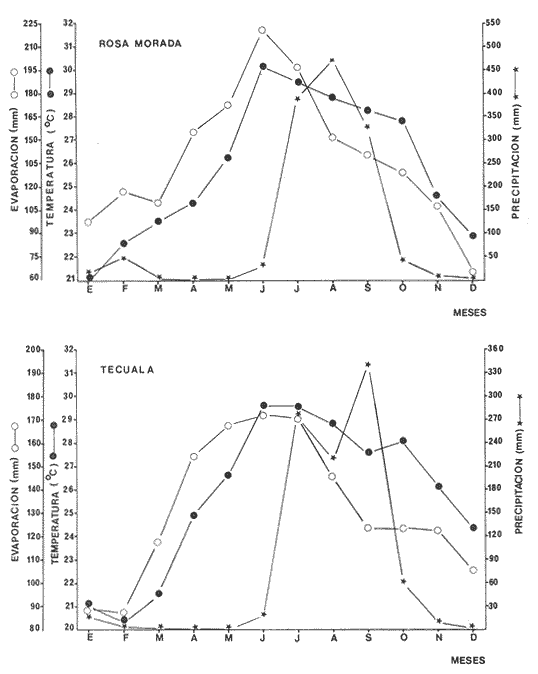 Fig. 2. Gráfica que presenta a los parámetros climatológicos en el sistema Teacapán-Agua Brava. Se indican las variaciones temporales de dos estaciones meteorológicas: Tecuala, en el norte del estado y Rosa Morada al sur. 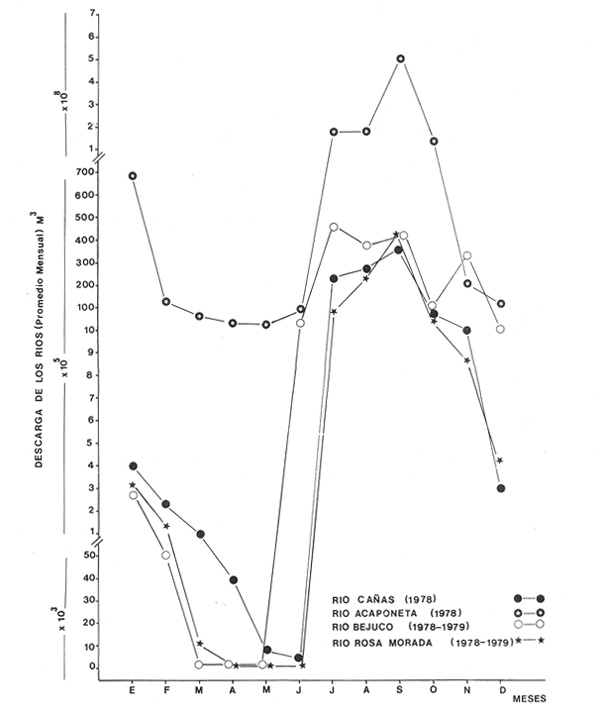 Fig. 3. Descarga de los Ríos durante, 1978- 1979. Se señalan los promedios mensuales del aporte fluvial, en cuatro principales ríos a través del sistema. 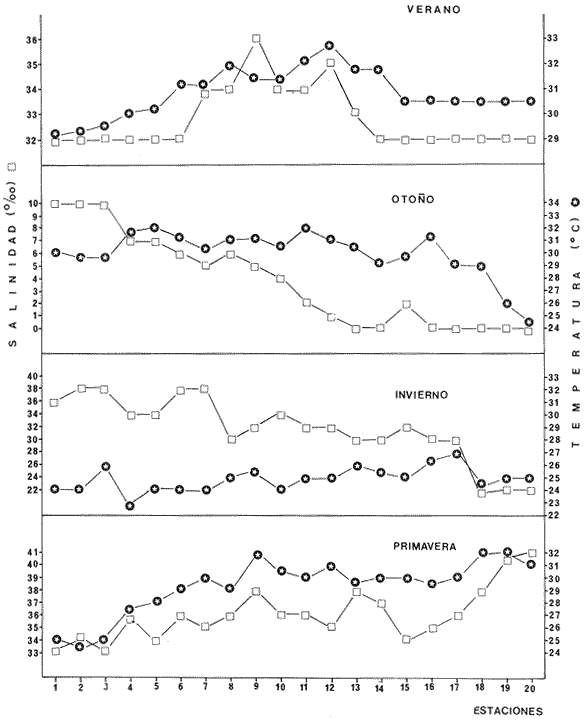 Fig. 4. Se señala la variación de la salinidad y la temperatura superficial, en las 20 estaciones de colecta durante el cielo estacional. HidrografíaEn la Tabla 2, se presentan los principales rasgos de promedio mensual de descarga de los ríos para los años 1977 a 1979.
Hidrología Se observa, Tabla 3 y figura 4, que los parámetros se distribuyen en un patrón estacional y en gradientes del sistema. Los promedios más importantes de los parámetros ambientales, en época de lluvia y secas se presentan en la tabla 3.
Profundidad Las profundidades menores se localizan en la zona del canal del estero de 1.5 a 6.0 m, y laguna de 1.1 a 2.0 m. Las mayores se registran en las bocas de 5.0 a 6.0 m y en cierta partes del estero.
Sedimentos El sustrato presentó un patrón característico de los sistemas lagunares. En primavera y verano, en las zonas de las bocas y parte baja del estero, está compuesto esencialmente de arena. En tanto que en el canal de estero y laguna es principalmente fangoso, con algunas partes de arenafango. En la época de lluvias (otoño), en casi todo el sistema se observa sustrato fangoso y en las bocas una mezcla de arena-fango.
Transparencia La mayor transparencia se tiene en primavera y verano con 2.0 m y 3.3 m respectivamente. En otoño (época de lluvias) se presentan las mínimas con 0.40 m. Los máximos valores se observan en las bocas y partes bajas del estero y laguna. En otoño, la transparencia es casi nula, registrándose los valores más altos en la Boca de Teacapán y parte baja del estero. En el canal del estero y laguna, la transparencia es prácticamente nula.
Fauna Macrobéntica La distribución de la macrofauna para las distintas zonas del sistema se presenta en la Tabla 4. 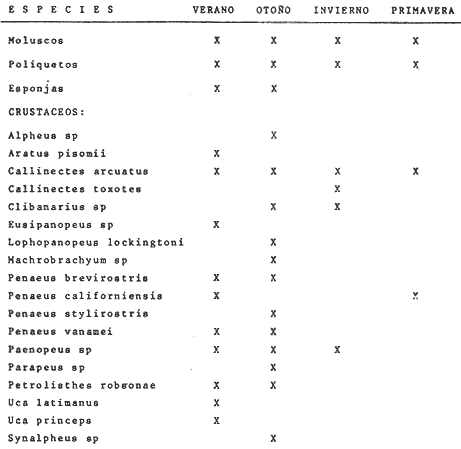 TABLA 4 DISTRIBUCIÓN ESTACIONAL DE LA PRESENCIA DE FAUNA MACROBÉNTICA, CON ÉNFASIS EN CRUSTÁCEOS, EN EL SISTEMA DE TEACAPÁN - AGUA BRAVA.
Similaridad del Hábitat El análisis de "cluster" efectuado, muestra localidades similares ecológicamente. La tendencia más evidente parece ser la presencia de dos grupos de estaciones, que corresponden al reflejo de hábitat mejor definidos. En algunas épocas del año ciertas regiones del sistema ecológico presentan mayor afinidad y la variación ambiental determina los cambios y tendencias que a continuación se señalan. En el verano (Fig. 5), las bocas y sus áreas de influencia inmediata presentan la suficiente afinidad ecológica, para quedar integrados en un grupo homogéneo. Por otra parte el resto de las estaciones de colecta, conforman lo que la figura 5 muestra como grupo I. Este grupo por incluir áreas distantes e ininterrumpidas es más heterogéneo que el grupo II Ambas regiones particularizan a habitat respectivos, que son el reflejo de las características ambientales que se señalan en la figura 5. Desde luego, la influencia marina condiciona los atributos del grupo II que son, frente al grupo I, de menores salinidades, menores temperaturas, mayor transparencia, sustrato arenoso y fauna macrobéntica escasa. Las aguas someras y tranquilas de las estaciones que conformanel grupo I, acusan mayor impacto a la evaporación y consecuentemente salinidades y temperaturas más elevadas; así también se predisponen condiciones de transición y vegetación circundante propicia para una mayor diversidad macrofaunística. 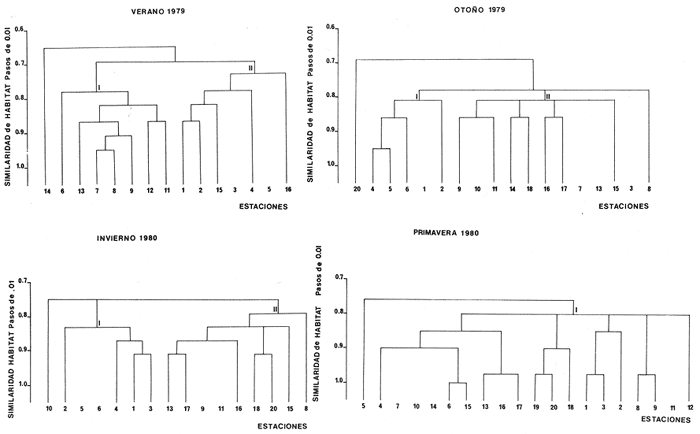 Fig. 5. Dendrogramas que muestran la similaridad de las estaciones de acuerdo a los parámetros ambientales, en un ciclo anual 1979- 1980. Explicación en el texto. En el otoño (Fig. 5) se observa a un grupo I, muy pequeño, que presenta características bien definidas, como son altas salinidades, temperaturas bajas, transparencias mayores, sustrato de arena-fango y fauna macrobéntica escasa. Otro grupo II mucho más grande, que incluye la mayor parte del sistema, caracteriza a un habitat homogéneo dado principalmente por sus bajas salinidades, así como también temperaturas mayores, abundancia de fauna macrobéntica y al gas rodofíceas. En general, el mayor conjunto de estaciones del grupo II, muestra una homogeneidad ocasionada por la estación lluviosa y la gran descarga de aguas dulces de comienzos de otoño, que circula hacia el mar principalmente por la Boca de Cuautla. En el invierno (Fig. 5), se muestra a dos grandes grupos de estaciones. El grupo I, tiene alta salinidades (típicamente marinas), temperaturas bajas, sustrato principalmente arenoso, transparencia alta y fauna macrobéntica escasa. En forma contrastante el grupo II, presenta bajas salinidades (principalmente en la laguna), temperaturas altas, sustrato fangoso, fauna macrobéntica y vegetación sumergida abundante. Estos dos grupos tienen elevada correlación con las condiciones de otoño, pero debido a que la descarga fluvial continua en descenso, la separación entre ellos es más contrastante. En la primavera (Fig.5), se tiene a un solo grupo homogéneo de estaciones, debido principalmente a vientos, disminución de las descargas de los sistemas fluviales y consecuentemente a una mayor dominancia de la salinidad. Este se caracteriza por presentar las temperaturas, salinidades y transparencias más altas del año, con marcada influencia del mar en todo el sistema ecológico. El cambio climático-metereológico, que se sucede a continuación de la primavera, determina el reincido del cielo ambiental que caracteriza los habitat, arriba descritos. ESTRUCTURA DE LA COMUNIDAD
Diversidad Se examinaron 3985 ejemplares, fueron determinadas 75 especies. El análisis de los diferentes índices calculados para cada época del año, las distintas artes de pesca utilizadas y las diferentes localidades muestreadas se detallan en la Tabla 5. Esta diversidad cambia en función de las variables mencionadas: época, localidad, arte de pesca y de las características intrínsecas de la comunidad. En algunas especies tipifican épocas del año y localidades y otras presentan una distribución generalizada en el sistema. En la Tabla 6, presenta especies "dominantes de la comunidad- que aportan mayor información de diversidad al sistema, en el ciclo anual. Para las tres artes de pesca, la biomasa presentó los valores más altos en verano, así también se detectó, que la comunidad tiene los valores más bajos en biomasa durante el otoño. En invierno este parámetro poblacional de la comunidad se incrementa y, al menos, esto se observa con las capturas de las redes de arrastre y chinchorro, sin embargo, con la red de agallera esto no se detecta. Hacia la primavera la biomasa de la comunidad de peces aparentemente disminuye, por lo menos en las poblaciones colectadas con redes de arrastre y chinchorro, y lo inverso se presentó en la red de agallera (Figs. 6-8). La "riqueza de especies" (D) y "equitatividad" (J') de especies se comportan de manera inversa. Estos parámetros no siempre dan información dentro de un patrón establecido (Livingston, 1976; Yáñez-Arancibia et al., 1980, Yáñez-Arancibia et al., 1982), puesto que uno mide la variedad de especies (D), y el otro la abundancia relativa (J'). La diversidad (H'n), es parámetro independientemente del tamaño de la muestra, efectua la proporción de individuos por especie y con mayor frecuencia refleja la tendencia real (estimada), en un conjunto de asociaciones muestreadas. De esta manera H'n, presenta una relación directa con el número de especies e individuos. Lo cual es observado con las muestras de las redes de arrastre y agallera mayormente y en menor medida con la red de chinchorro. Donde solamente se refleja esto con el número de especies, pero no con el número de individuos. Tabla 5 El comportamiento inverso entre el índice de biomasa (H'w) y el número de individuos, normalmente es el reflejo de un sistema ecológico utilizado como área de alimentación y protección de juveniles, así como también de crianza y maduración para algunas especies que pueden alcanzar tallas mayores. Un gran número de individuos de pequeño tamaño y poco peso, contra un número menor de individuos con mayor peso. En el otoño predominan los valores más altos del índice de biomasa, contrastado con el mayor número de individuos. Por el contrario, el mayor número de individuos de invierno que se reclutan como juveniles al área, son de pequeño tamaño y poco peso. Por lo cual H'w es el pulso más bajo. El índice de Shannon (H'n) se comporta paralelo al índice de biomasa (H'w), excepto durante el invierno, en que hay una ligera relación inversa. Esto parece indicar que el aumento del número de individuos en invierno controla al índice de H'n. A una mayor equitatividad de los individuos entre las especies representadas, esto es pocas o muchas especies, pero con una buena proporcionalidad de individuos, provoca un incremento del índice (J'). Por el contrario, disminuye cuando no hay armonía en la uniformidad de la proporción. Esto explica la relación directa que J' tiene con H'n en muestras tomadas con chinchorro, y en menor grado con red agallera, pero el comportamiento "anómalo" de estos dos parámetros con la red de arrastre, es complicado de explicar al nivel actual de resultados. El número de individuos como parámetro aislado de la estructura ecológica de la comunidad, se comporta, en algunos casos de manera inversa, con H'w o J', pero en otros casos manifiesta una relación directa. Los parámetros ecológicos (H'n, J' y D) tienen una estrecha relación, pero dos de ellos consideran proporcionalidad, uno (H'n) lo hace en forma directa sobre la muestra y el otro (J') está en función del valor teórico de H'max, por lo cual, aun cuando la información que los tres parámetros ecológicos buscan, sobre el número de ejemplares colectados, no necesariamente mostraron relación directa o inversa. La mayor diversidad (H'n) se presenta en otoño, coincidiendo con las menores biomasas. Esto puede ser el reflejo de un patrón de utilización del sistema donde la mayor diversidad de otoño, está representada por especies de tamaño pequeño (juveniles) y pocas especies dominantes, asimismo la menor diversidad del verano coincide con las especies de mayor tamaño y peso, que han completado un período en el sistema y que serán reemplazados por la alta diversidad específica de juveniles de la estación climática siguiente (Figs. 6-8). 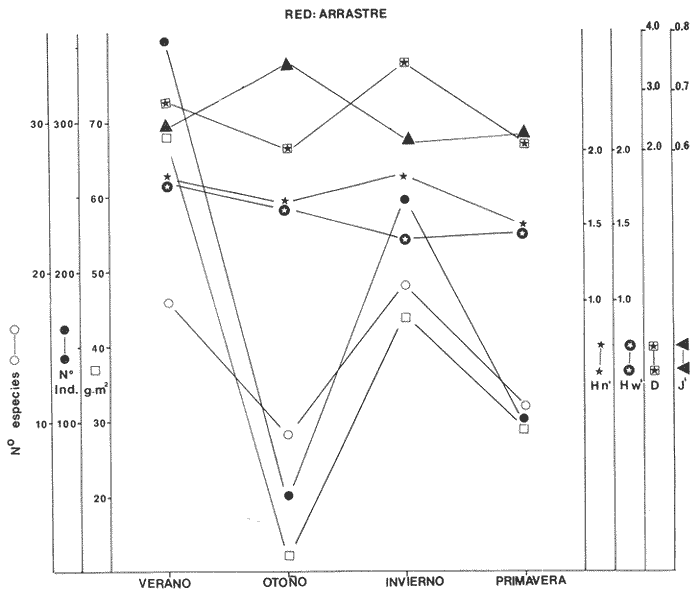 Fig. 6. Variación de los parámetros ecológicos de la comunidad muestreada con la red de arrastre: índice de diversidad, especies, abundancia numérica y biomasa, durante el ciclo anual, 1979-1980. Explicación en el texto 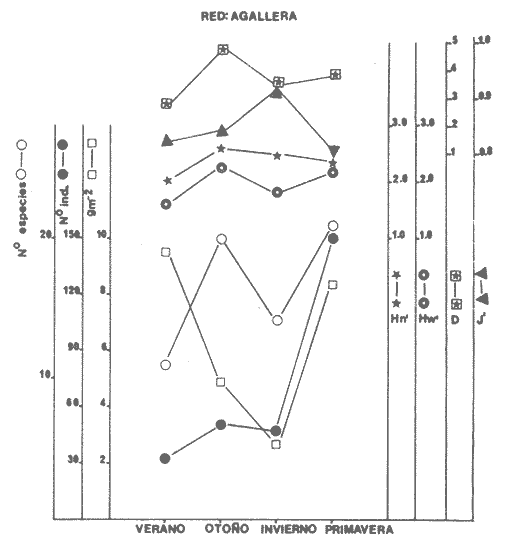 Fig. 7. Variación de los parámetros ecológicos de la comunidad muestreada con la red de agallera: índices de diversidad. especies, abundancia numérica v biomasa, durante el ciclo anual 1979-1980. Explicación en el texto. 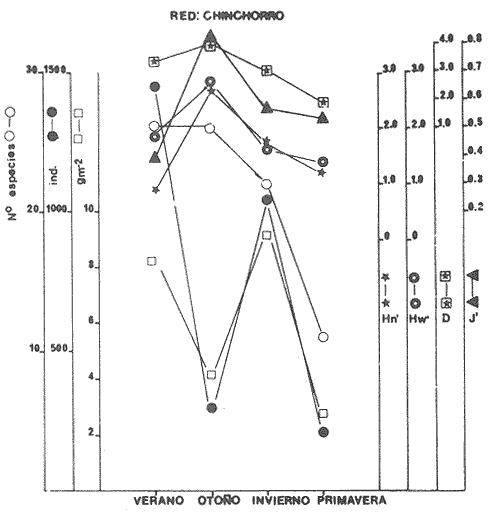 Fig. 8. Variación de los parámetros ecológicos de la comunidad con la red de chinchorro; índice de diversidad, especies, abundancia numérica y biomasa, durante elciclo anual de 1979-1980. Explicación en el texto.
Distribución y Abundancia de las Especies dominantes Las distintas artes de pesca utilizados muestran variación en los parámetros de frecuencia, número y peso, y las especies determinadas como dominantes para esos parámetros, pueden o no ser los mismos. Asimismo ciertas especies son dominantes independientes del arte de pesca como: Opisthonema libertate, Oligoplites saurus, Gerres cinereus, Eugerres axillaris, Galeichthys caerulescens, Citharichthys gilberti, Arius liropus, Centropomus robalito, Diapterus peruvianus y Mugil curema; de las cuales las 8 últimas son las más abundantes. Algunas de las anteriores especies son dominantes en cierta época del año, esta variación es en cuanto a sus propias estrategias alimenticias, reproductivas, fluctuación ambiental y selectividad de las redes. Sin embargo, se considera que 18 especies son típicas o dominantes de toda la comunidad (Tablas 7-8). Algunas de estas 18 especies parecen estar bien representadas en dos artes de pesca como: arrastrechinchorro, chinchorro-agallera o arrastre agallera como se aprecia en la Tabla 7. 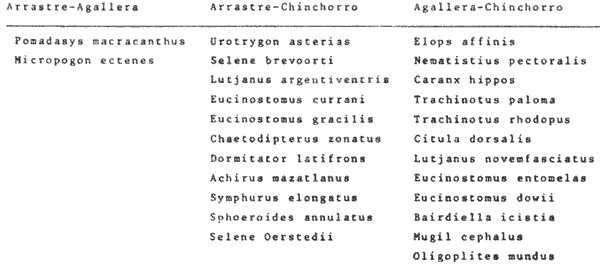 TABLA 7 ESPECIES REPRESENTATIVAS EN DOS ARTES DE PESCA : ARRASTRE-CHINCHORRO, AGALLERA-CHINCHORRO Y ARRASTRE-AGALLERA, EN UN CICLO ANUAL. Se observa que la combinación de agallerachinchorro, presentan más especies dominantes entre ellas y que en realidad son las que mayor información aportan al sistema. En la combinacion arrastre-chinchorro hay muchas especies, pero no representan a especies dominantes (excepto dos). En la combinación arrastre-agallera solo dos especies presentan una tendencia a ser capturadas, debido principalmente a que la red de arrastre opera en el fondo y la otra en la superficie del agua, ninguna de estas especies son frecuentes ni dominantes. Otras especies fueron relevantes solo con un arte de pesca, y puede ser considerada como una tendencia típica o exclusiva para capturar a dichos peces con alguna arte de pesca en particular (Tabla 8). En la Tabla 8 se puede apreciar las especies características para cada red. Las especies anteriormente referidas, varían estacionalmente ese cambio y la distribución que las caracteriza, controla en mayor medida la afinidad entre asociaciones de poblaciones de peces en la distribución espacial del sistema analizado (Figs. 9-23). 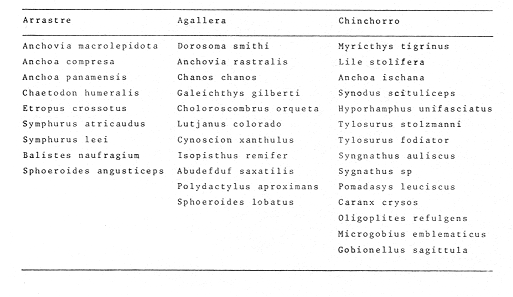 TABLA 8 ESPECIES TÍPICAS PARA CADA UNA DE LAS ARTES DE PESCA, A TRAVÉS DE UN CICLO ANUAL.
Componentes Comunitarios Los componentes comunitarios se destacan en la Tabla 9 y figuras 24-26, en ellas se observa la diversidad de los componentes a los que pertenece cada una de las especies dentro del cielo anual. En general, a través del cielo anual las especies cíclicas, son los componentes dominantes. El aumento o disminución o incluso la ausencia de algún componente, está en función de: época del año, lugar de muestreo (próximo a la playa, bajo el manglar o en el canal del sistema), afinidad o comportamiento y arte de pesca utilizado. Algunos componentes cíclicos importantes como recurso pesquero son: Centropomus robalito, Diapterus peruvianus y Mugil curema. Las especies típicamente estuarinas, con potencialidad explotable, debido a su gran abundancia son: Arius liropus, y Lile stolífera. Los visitantes ocasionales no son de interés comercial, pero si en el aspecto ecológico. En la Tabla 9, se presenta una distribución y cuantificación temporal de los principales valores en los componentes comunitarios, para las tres artes de pesca utilizadas. 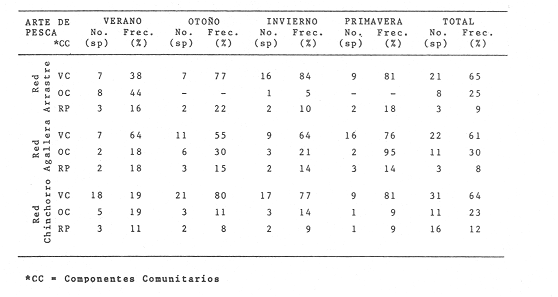 TABLA 9 DISTRIBUCIÓN DEL NÚMERO DE ESPECIES Y FRECUENCIA DE LOS COMPONENTES COMUNITARIOS EN EL SISTEMA ECOLÓGICO.
Categorías Ictiotróficas La distribución y cuantificación de las categorías ictiotróficas se presentan en la Tabla 10 y figuras 27-29 para el cielo anual. En general a través del cielo anual, se observa a una gran cantidad de especies de 2do. orden. El aumento o disminución e incluso la ausencia de alguna categoría, está en función de la época del año, lugar de muestreo, comportamiento y arte de pesca utilizado. 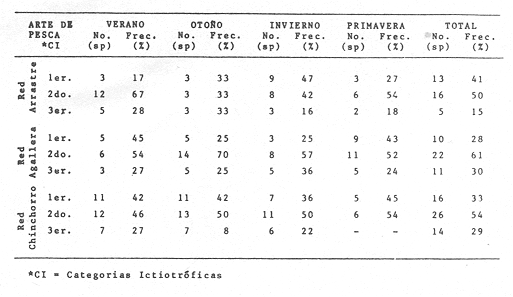 TABLA 10 DISTRIBUCIÓN DEL NÚMERO DE ESPECIES Y LA FRECUENCIA DE LAS CATEGORÍAS ICTIOTRÓFICAS EN EL SISTEMA ECOLÓGICO. 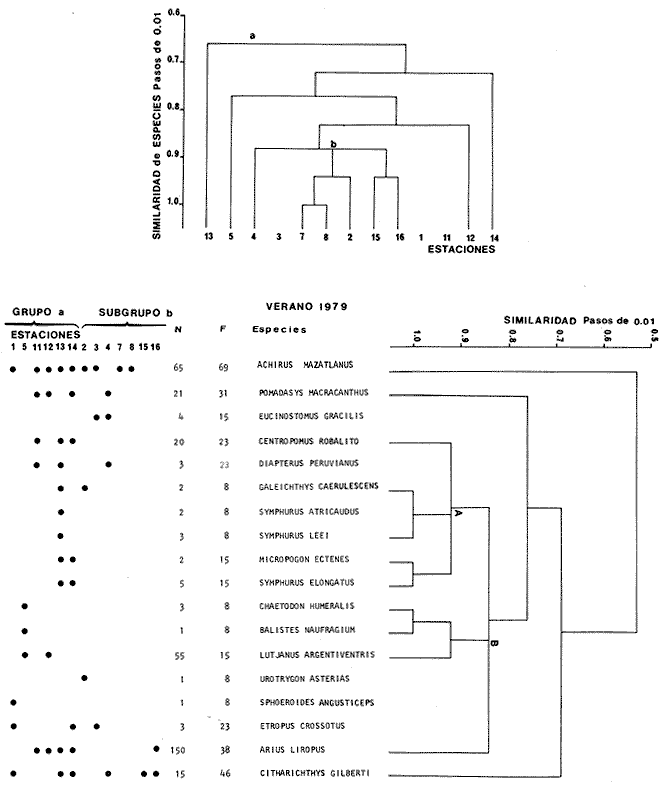 Fig. 9. Análisis de similaridad ecológica, diversidad, abundancia numérica (N) frecuencia (F) y distribución de la ictiofauna durante el verano con red de arrastre. El dendrograma de especies cuantifica dos grupos: A de distribución restringida (grupo a de estaciones) y el B con amplia distribución, subgrupo b de estaciones. 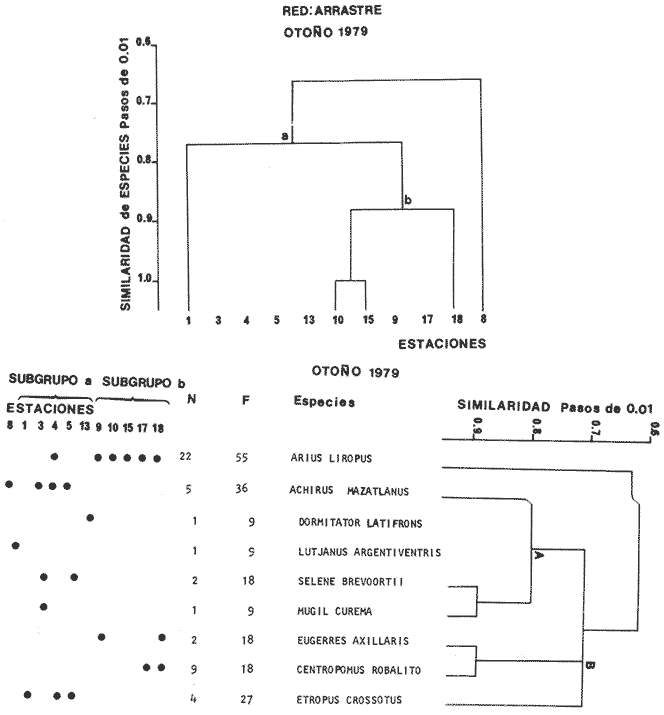 Fig. 10. Análisis de similaridad ecológica, diversidad, abundancia numérica (N) frecuencia (F) y distribución de la ictiofauna durante el otoño con red de arrastre. El dengrograma de especies detecta dos grupos: A con tendencia a distribuirse en la zona norte, grupo a de estaciones y B con distribución dispersa. 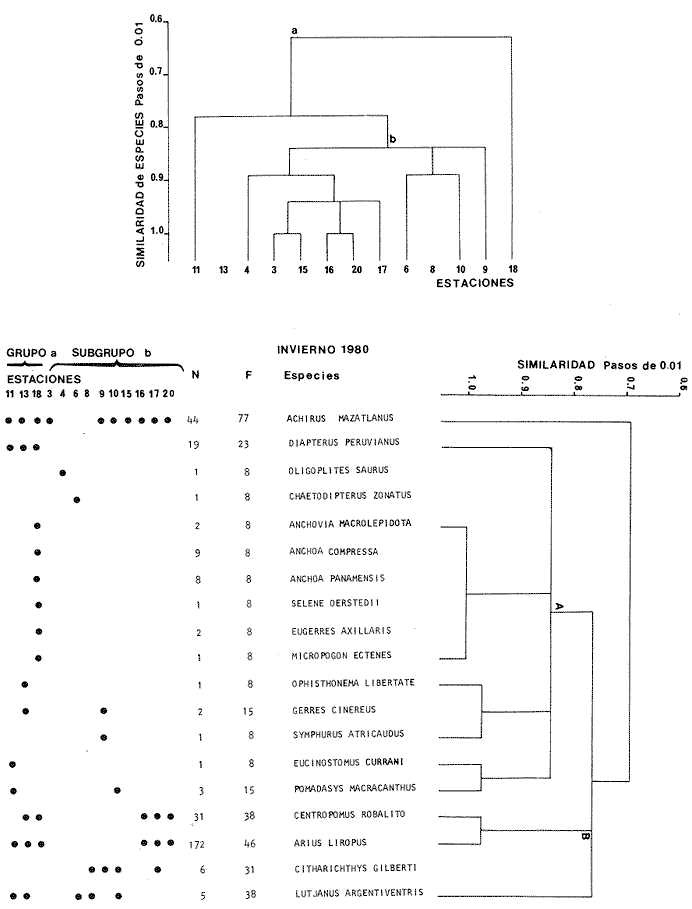 Fig. 11 . Análisis de la similaridad ecológica, diversidad, abundancia numérica (N), frecuencia (F) y distribución de la ictiofauna durante el invierno con red de arrastre. En el dendrograma de especies aparecen 2 grupos, uno con distribución restringida, grupo A, (grupo a de estaciones) y otro con amplia distribución (grupo b de estaciones). 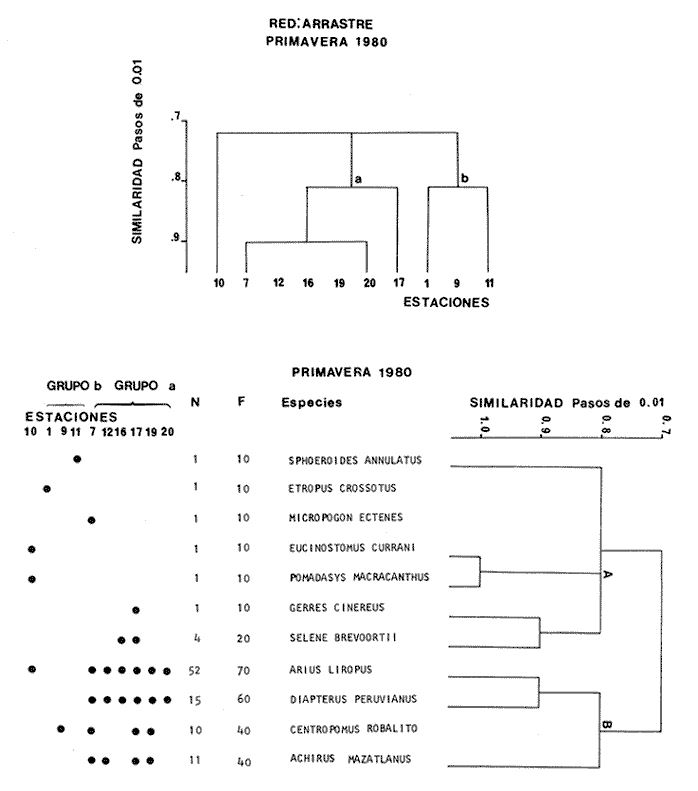 Fig. 12. Análisis de la similaridad ecológica, diversidad, abundancia numérica (N), frecuencia (F) y distribución de la ictiofauna durante la primavera con red de arrastre. Los dendrogramas presentan también 2 grupos: A para el de especies que presentan distribución (b de las estaciones) y B de especies distribuidas en el área sur (grupo a de estaciones). 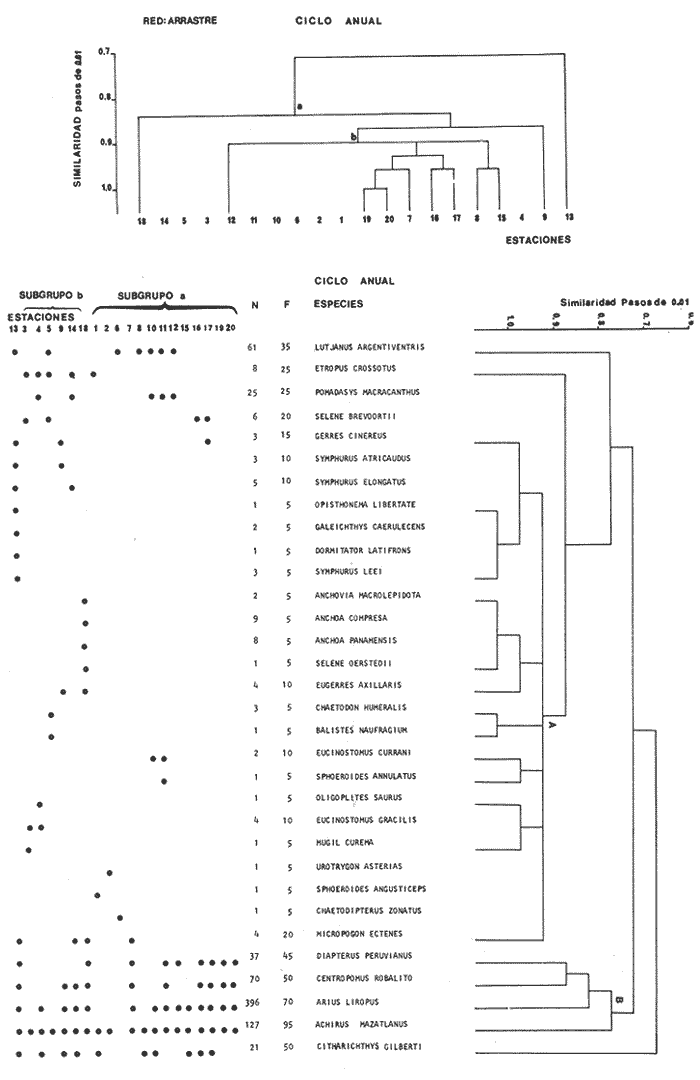 Fig. 13. Similaridad ecológica, diversidad, abundancia numérica (N), frecuencia (N), y distribución de la ictiofauna durante el ciclo anual estudiado. Se observa los 2 grupos: A con distribución escasa (grupo a de estaciones) y B con amplia distribución en todo el sistema y que incluye a pocas especies (grupos b de estaciones). 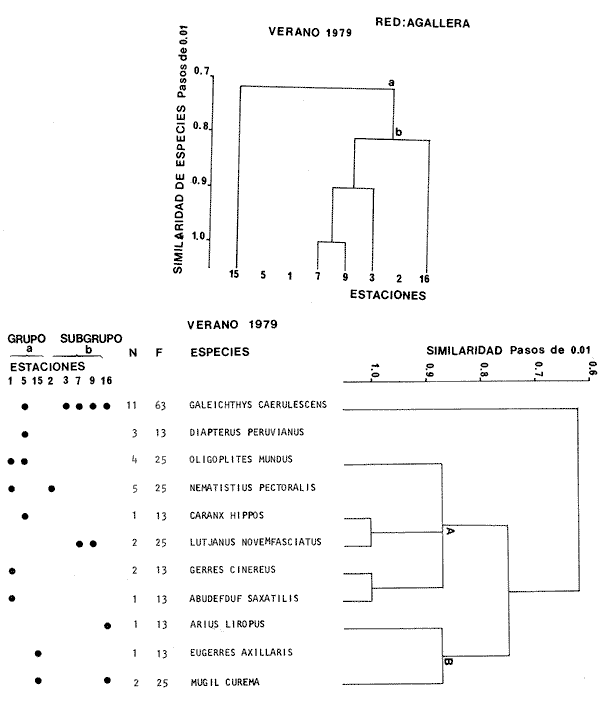 Fig. 14. Análisis de similaridad ecológica, diversidad, abundancia numérica (N), frecuencia (F) y distribución de la ictiofauna durante el verano con red agallera. El dendrograma de especies cuantifica a dos grupos, A con distribución hacia la Boca de Teacapán y parte baja del estero (grupo a de estaciones) y el grupo B con amplia distribución (subgrupo b de estaciones). 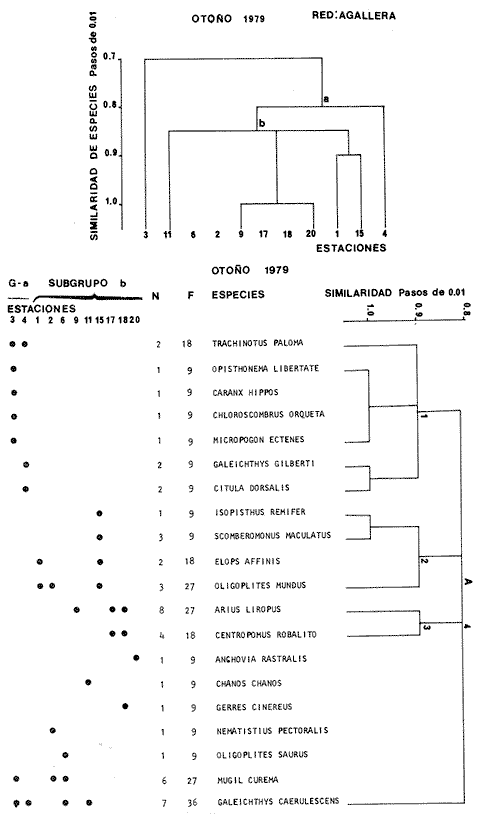 Fig. 15. Análisis de similaridad ecológica, diversidad, abundancia numérica (N), frecuencia (F) y distribución de la ictiofauna durante el otoño con red gallera. El dendrograma de especies cuantifica principalmente a un grupo A de alta similaridad, dividido en subgrupos: 1 y 2 con distribución hacia la Boca de Teacapán y parte baja del estero (grupo a de estaciones) y 3 y 4 subgrupos con una distribución hacia el estero y laguna (subgrupo b de estaciones). 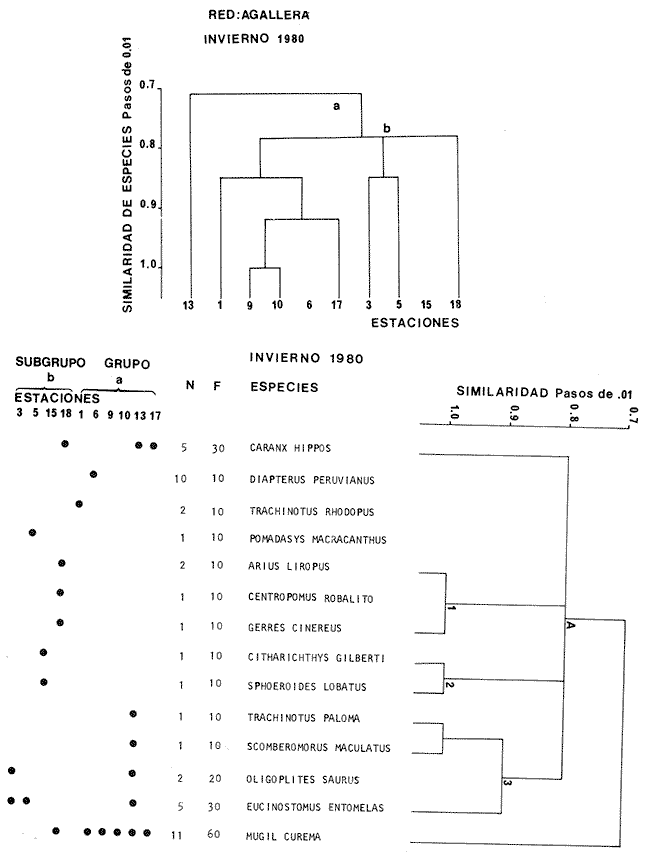 Fig. 16. Análisis de similaridad ecológica, diversidad, abundancia numérica (N), frecuencia (F) y distribución de la ictio fauna durante el invierno con red agallera. El dendrograma de especies cuantifica principalmente a un grupo A de alta similaridad, con distribución en el estero y laguna (grupo a de estaciones y parte del subgrupo b); las demás especies son de amplia distribución. 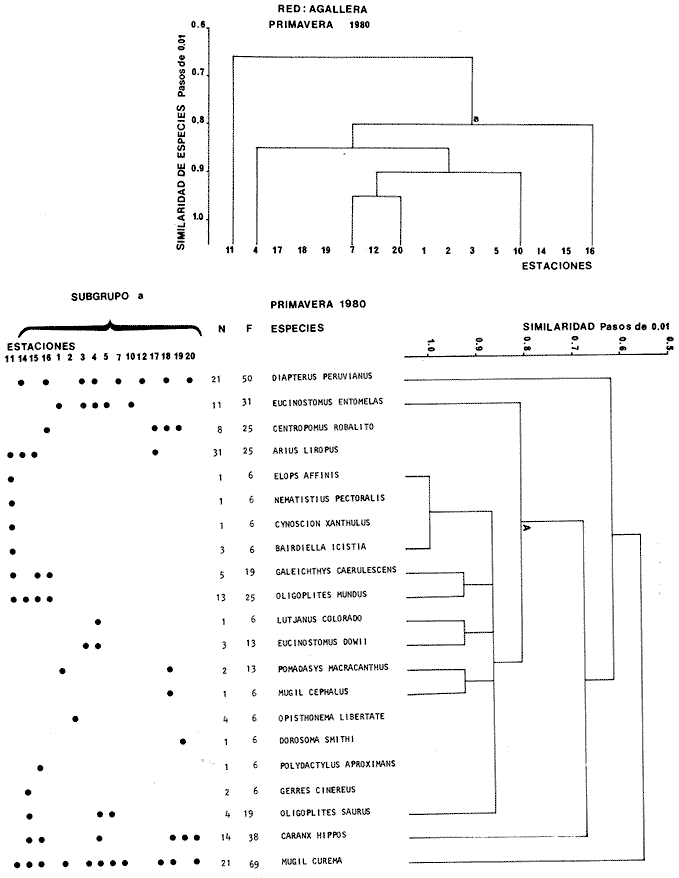 Fig. 17. Análisis de similaridad ecológica, diversidad, abundancia numérica (N), frecuencia (F) y distribución de la ictiofauna durante la primavera con red agallera. El dendrograma de especies cuantifica a un grupo A de especies con una distribución principal en el estero y laguna (subgrupo a de estaciones). 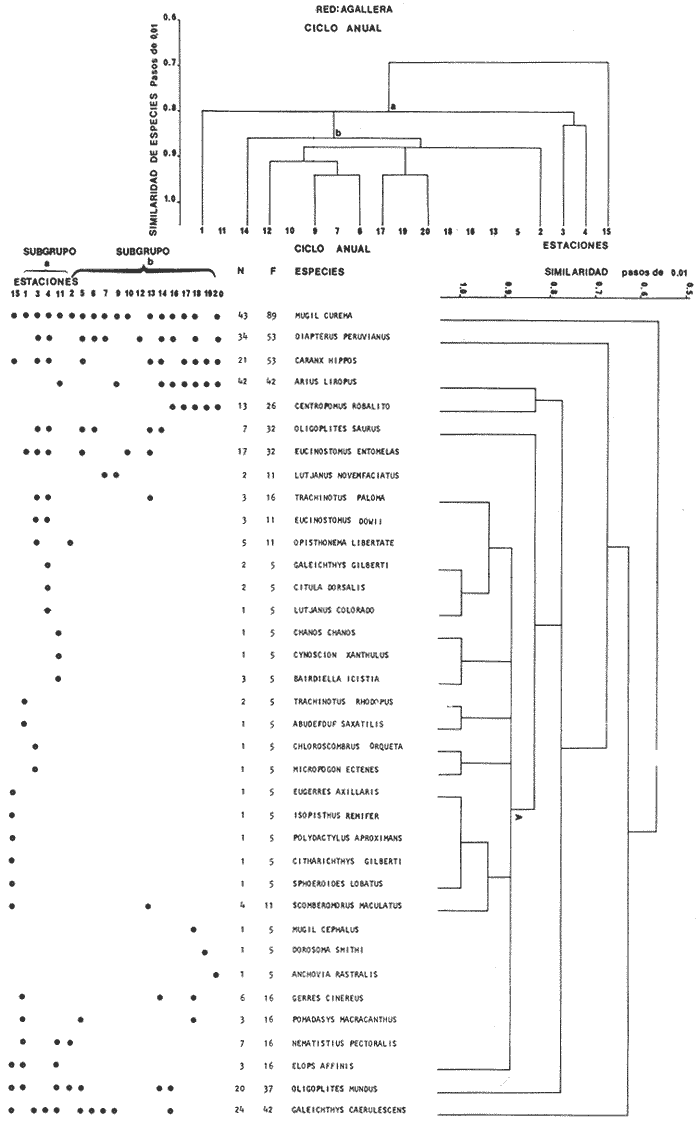 Fig. 18. Análisis de similaridad ecológica, diversidad, abundancia numérica (N), frecuencia (F) y distribución de la ictiofauna durante el cielo anual con red agallera. El dendrograma de especies cuantifica a un grupo de especies: A con una distribución principal en Boca de Teacapán y parte baja del estero (subgrupo a de estaciones), las demás especies son de amplia distribución. 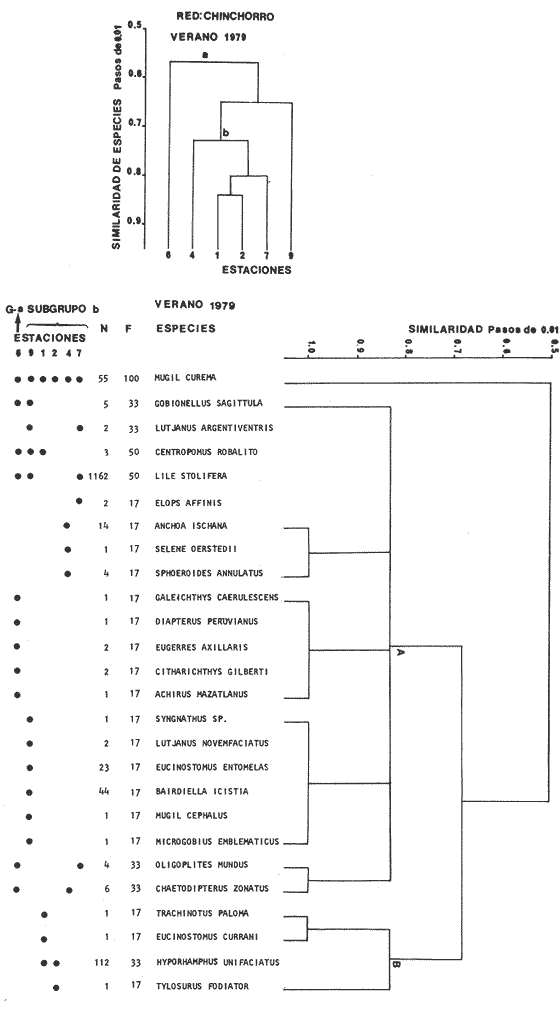 Fig. 19. Análisis de similaridad ecológica, diversidad, abundancia numérica (N), frecuencia (F) y distribución de la ictiofauna durante el verano con red de chinchorro. El dendrograma de especies cuantifica a dos grupos: A con distribución hacia la parte baja del estero y estero (grupo a y subgrupo b de estaciones) y el B con una distribución restringida a la Boca de Teacapán y canal del estero (subgrupo de estaciones). 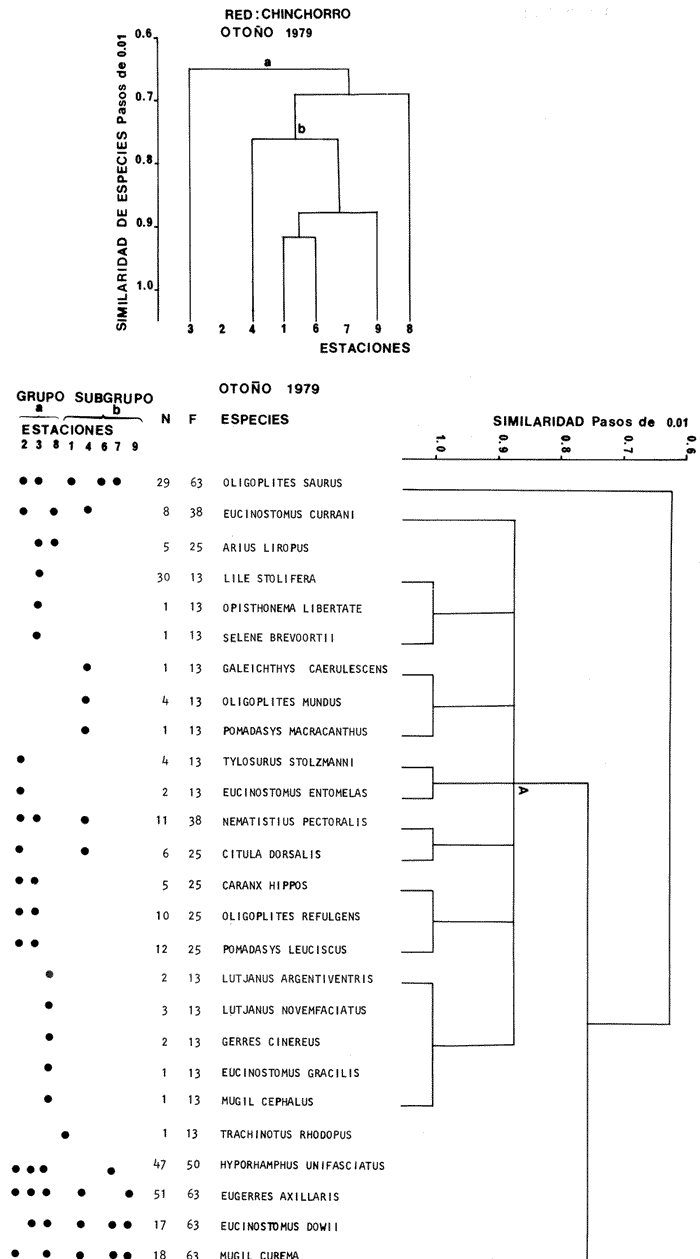 Fig. 20 Análisis de similaridad ecológica, diversidad,abundancia numérica (N), frecuencia (F) y distribución de la ictiofauna durante el otoño con red de chinchorro. El dendrograma de especies cuantifica a un grupo A. que tiene a distribuirse en la Boca de Teacapán y parte baja del estero (grupo a y subgrupo b de estaciones); las demás especies son deamplia distribución. 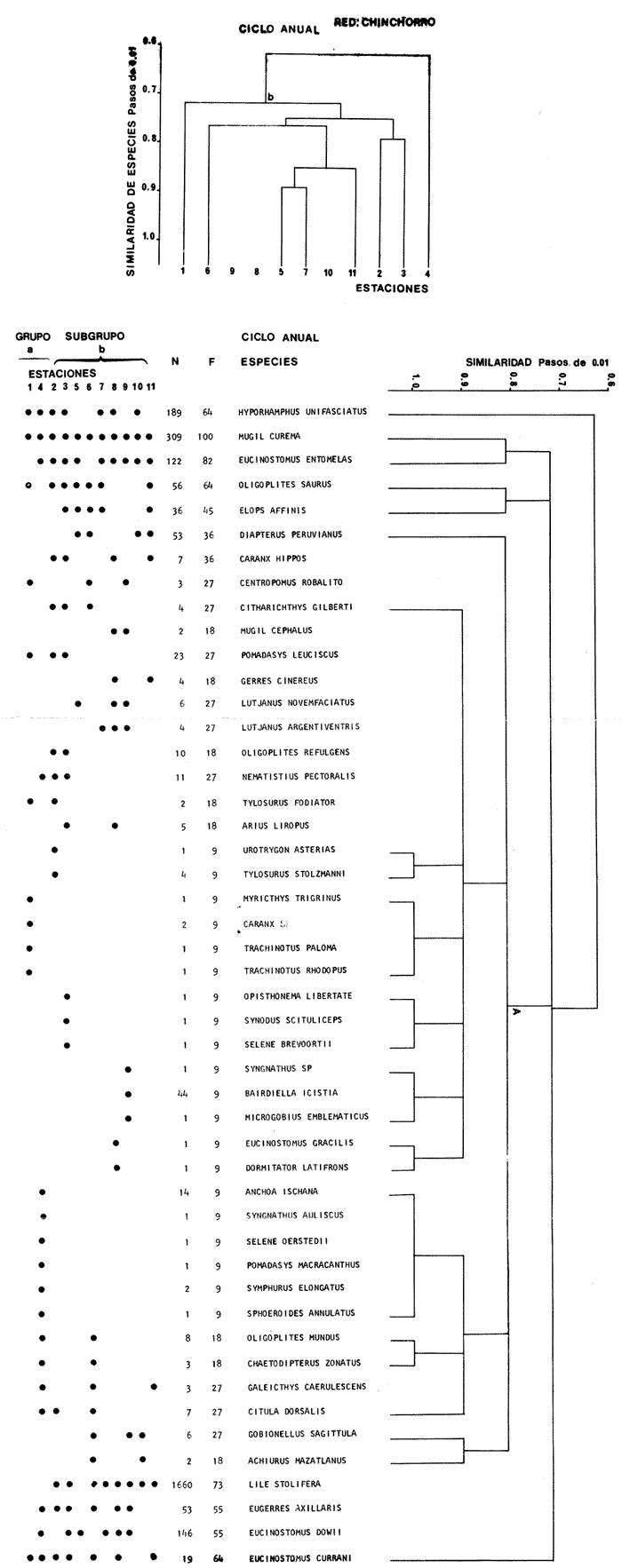 Fig. 23 Análisis de similaridad ecológica, diversidad,abundancia numérica (N), frecuencia (F) y distribución de la ictiofauna durante un ciclo anual con red de chinchorro. El dendrograma de especies cuantifica a un grupo A. que tiene a distribuirse en la Boca de Teacapán y parte baja del estero (grupo a y subgrupo b de estaciones); las demás especies son deamplia distribución. 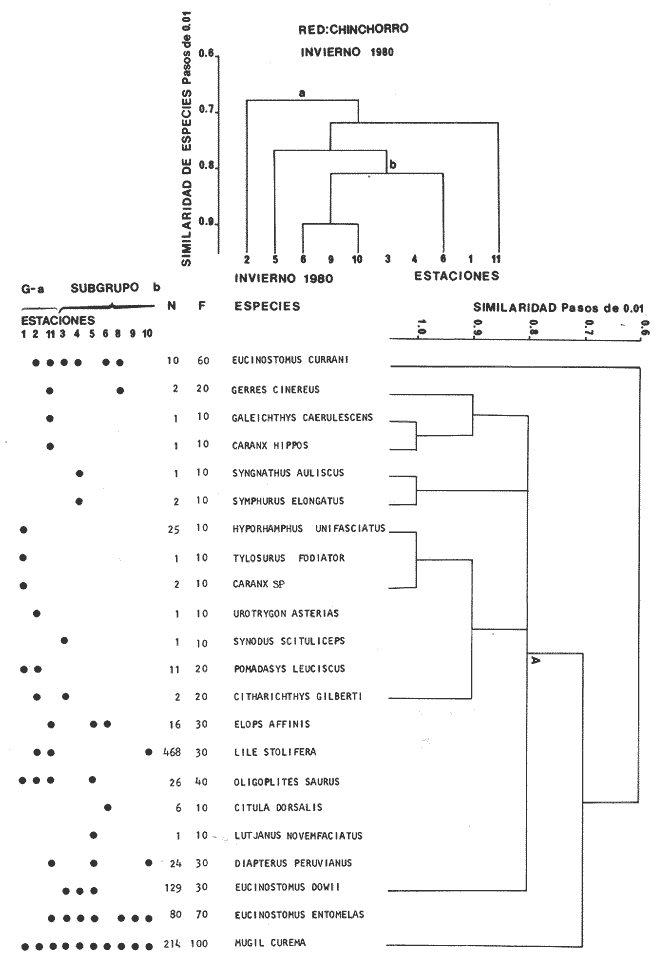 Fig. 21. Análisis de similaridad ecológica, diversidad, abundancia numérica (N), frecuencia (F) y distribución de la ictiofauna durante el invierno con red de chinchorro. El dendrograma de especies cuantifica a un solo grupo A con distribución hacia la Boca de Teacapán y parte baja del estero (grupo a y subgrupo b de estaciones), las demás especies son de amplia distribución. 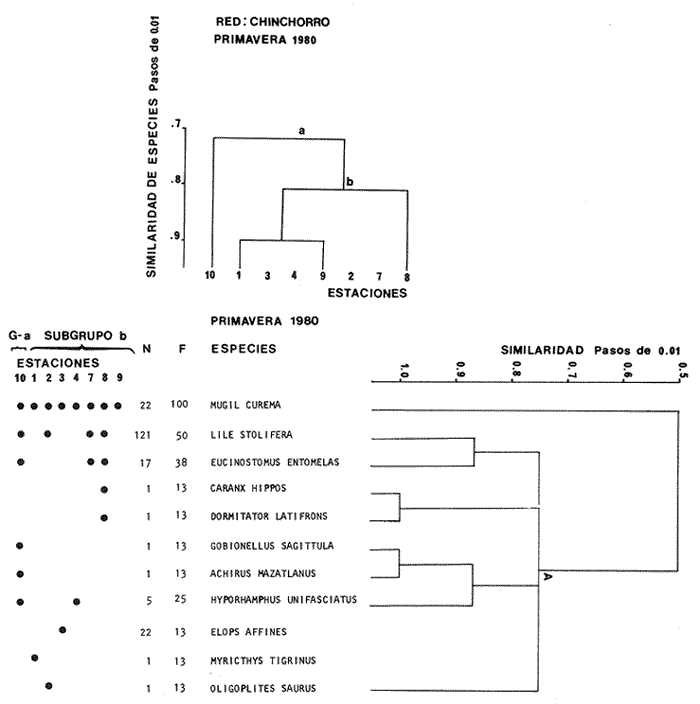 Fig. 22. Análisis de similaridad ecológica, diversidad, abundancia numérica (N), frecuencia (F) y distribución de la ictiofauna durante la primavera con red de chinchorro. El dendrograma de especies cuantifica a un solo grupo A con distribución hacia el estero (grupo a y subgrupo b de estaciones); las demás especies son de amplia distribución. 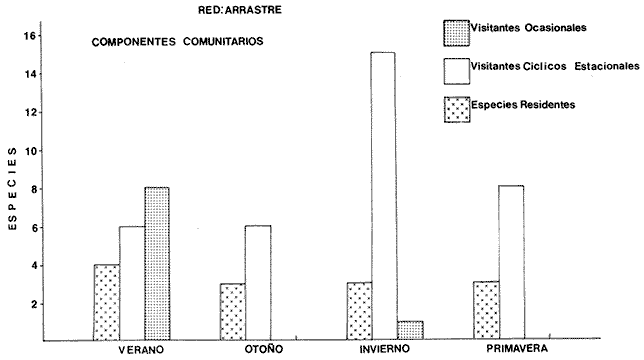 Fig. 24. Variaciones de los componenetes comunitarios colectados en la red de arrastre, en el ciclo anual, 1979-1980. Explicación en el texto. 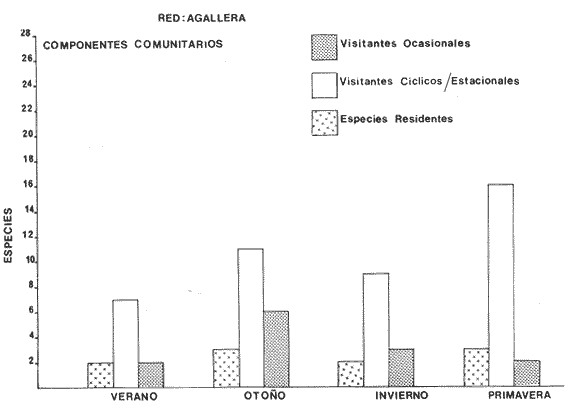 Fig. 25. Variación de los componentes comunitarios colectados en la red agallera en el cielo anual, 1979-1980. Explicación en el texto. 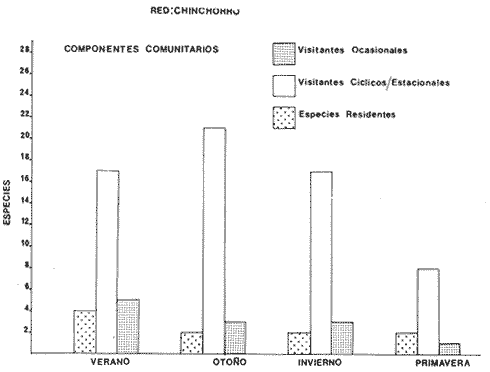 Fig. 26. Variación de los componenetes comunitarios colectados en la red de chinchorro en el cielo anual, 1979-1980. Explicación en el texto. 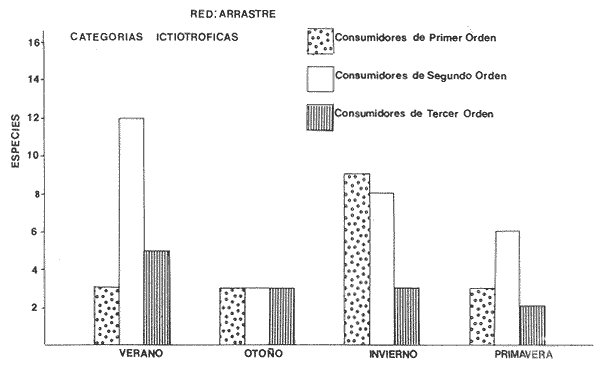 Fig. 27 Variación de las categorías ictiotróficas delas especies en la red de arrastre en el ciclo anual, 1979-1980. Explicación en el texto. 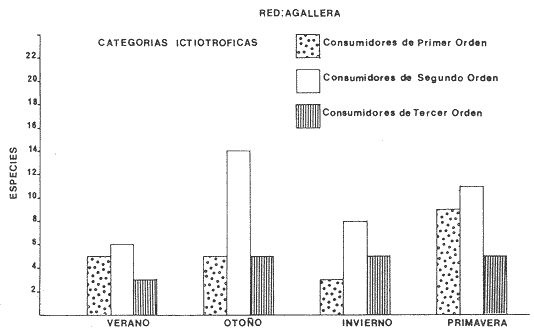 Fig. 28. Variación de las categorías ictiotróficas de las especies en la red agallera durante, 1979-1980. Explicación en el texto. 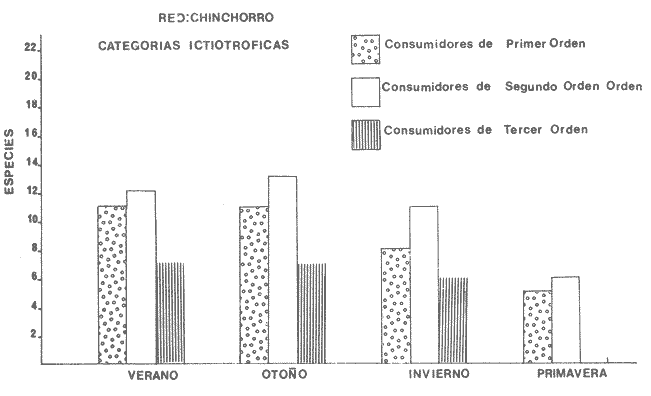 Fig. 29. Variación de las categorías ictiotróficas de las especies en la red chinchorro durante, 1979-1980. Explicación en el texto. Algunos niveles tróficos tipifican a determinadas artes de pesca, así tenemos que: los consumidores de primer orden, abundan en chinchorro, los de 3er. orden en agallera y lro. y 2do. en la red de arrastre. En la Tabla 10, se presenta una distribución y cuantificación temporal, de los principales pulsos de las categorías ictiotróficas, para las diferentes artes de pesca. En el ciclo anual, solo cinco especies estuvieron presentes y con una dominancia de densidad poblacional (g.m-² e ind. m-²), índice de diversidad (H'n) e índice de biomasa (H'w). Las variaciones observadas para los anteriores parámetros, están en función de: lugar de muestreo (en las proximidades de la playa, bajo el manglar o en el canal), comportamiento, época del año y selectividad de las redes. A continuación se describe el comportamiento para cada una de las especies, en las distintas artes de pesca empleada a través de un año de muestreo. Red de arrastre. Tres especies estuvieron siempre presentes y fueron: Arius liropus, Centropomus robalito y Achirus mazatlanus. Arius liropus, presentó valores de H'n y H'w similares en verano y otoño en una relación directa. En el invierno se observa un incremento de H'n y una disminución en H'w en forma inversa. La primavera se caracterizó por un aumento de los índices, la biomasa y densidad presentaron una relación directa, con valores relativamente altos en verano e invierno, los más bajos se registran en otoño y primavera (Fig. 30). La especieCentropomus robalito, tuvo valores de H'n y H'w bajos en verano e invierno y los máximos en otoño en una relación directa. En primavera, se observó un incremento de H'w y una disminución de H'n en forma inversa. La biomasa y densidad presentaron los máximos valores en invierno y los mínimos en primavera y otoño (Fig. 30). En la especie Achirus mazatlanus se observó a valores de H'w, H'n, biomasa y densidad altos en verano e invierno y bajos en otoño y primavera (Fig. 30). 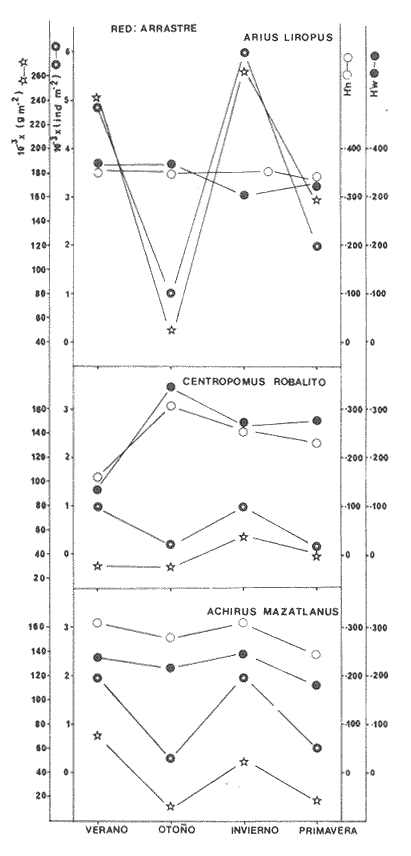 Fig. 30. La gráfica corresponde a los valores de los índices de diversidad y biomasa (H'w, H'W) densidad poblacional (numérica y biomasa) para: Centropomus robalíto, Arius liropus y Achirus mazatlanus, que fueron especies dominantes en el ecosistema, tanto especial como temporalmente con la red de arrastre durante un cielo anual. Explicación en el texto. Red de agallera. Solo una especie presenta una alta frecuencia de aparición, Mugil curema, esta aportó mayor información de H'n y H'w que otras especies, así como una dominancia en número, densidad, biomasa y frecuencia. Estos parámetros ecológicos tienen un comportamiento directo, con valores máximos en invierno y los mínimos en verano, en tanto que en otoño y primavera se observó un valor medio (Fig. 31). Red de chinchorro. Solo dos especies están mejor representadas a través de un año de muestreo y son: Mugil curema y Líle stolifera. La especieMugil curema en el verano presenta un valor alto de H'w y bajo en H'n en una relación inversa, en tanto que la biomasa y densidad son máximos en una forma directa, es común observar a ejemplares adultos que rebasan los 200 mm de longitud total. En otoño H'w disminuye, pero H'n se ve incrementada en forma inversa. La biomasa y densidad diminuyen y frecuentemente se presentan en individuos adultos y de tallas de 94 a 249 mm. En el invierno los valores de H'w, H'n, biomasa y densidad aumentan en una relación directa, ésta época tiene a una gran cantidad de individuos, de tallas medianas de 100 mm de longitud total. En la primavera se observa un descenso de H'n y un aumento de H'w en un aumento de H'w en una relación inversa, muy similar a la del verano, en tanto que la biomasa y densidad disminuyen en forma opuesta. Muchos de los individuos tienen un promedio de 250 mm de longitud total, alcanzando en esta estación del año, su máximo crecimiento. Generalmente fueron colectados pocos individuos, pero con un gran aporte de biomasa (Fig. 31). La otra especie, con una frecuencia total en el año es Lile stolifera, en verano presentó valores altos de H'w y bajos de H'n con un comportamiento inverso, los individuos son adultos con algunos juveniles, y pocos rebasan los 100 mm de longitud total. En otoño, la biomasa, densidad y los índices (H'n, H'w), tienen una disminución directa. En ésta época del año se presentó a pocos individuos y en su mayoría son adultos que rebasan los 100 mm de longitud. En el invierno, hay un aumento de H'n, H'w, biomasa y densidad. Es frecuente observar a individuos de tallas de más de 100 mm de longitud total. En la primavera existe una disminución de H'n y un incremento de H'w en una relación inversa y directa para la biomasa y densidad. La mayoría de los ejemplares colectados rebasan los 100 mm de longitud total (Fig. 32). 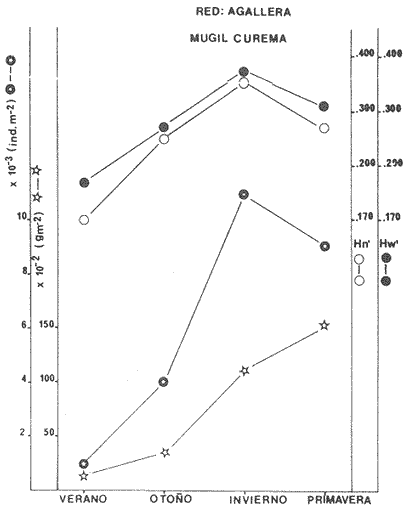 Fig. 31. La gráfica corresponde a los índices de diversidad y biomasa (H'n, H'w) y densidad poblacional (numérico y biomasa), para: Mugil curema, que fue una especie dominante tanto espacialmente como temporal, con la red de agallera, durante un cielo anual. Explicación en el texto.
Afinidad de Especies y de Hábitat En el análisis "cluster" efectuado, las especies y estaciones responden al cuadro ambiental descrito, presentando distribuciones específicas en áreas restringidas para algunos grupos de especies y muy amplia en otras. Los cambios sucesionales de los grupos de especies de la comunidad, su distribución en los hábitats, su frecuencia y abundancia numérica para las distintas artes de pesca, presentan una elevada correlación con la dinámica ambiental (Figs. 9-23). A continuación se describe el comportamiento de los grupos de especies observados en los dendrogramas de las distintas artes de pesca empleados en un cielo anual. 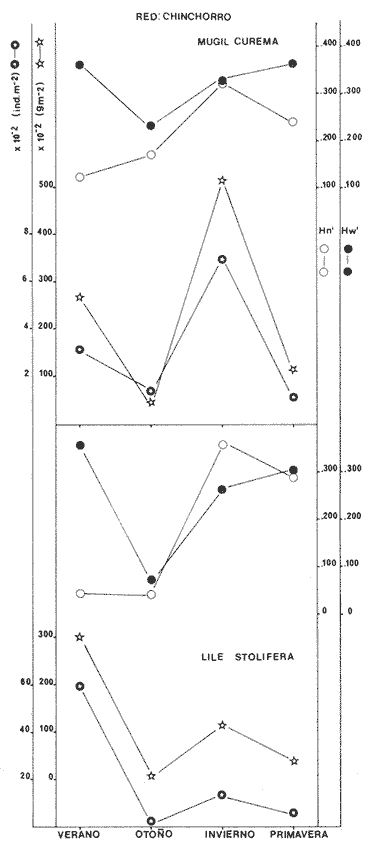 Fig. 32. La gráfica corresponde a los valores de los índices de diversidad y biomasa (H'n, H'w) y densidad poblacional (numérico y biomasa), para las especies: Lile stolifera y Mugíl curema; las que fueron dominantes tanto espacial como temporalmente, con la red de chinchorro, en un ciclo anual. Explicación en el texto. En el verano, los grupos A de las especies en las redes de chinchorros y arrastre tienden a distribuírse hacia la parte baja del estero y canal. En tanto que los grupos A de agallera y B de chinchorro se localizan principalmente en la Boca de Teacapán y parte baja del estero. Los demás grupos B de agallera y arrastre, presentan una amplia distribución en el sistema. El cuadro de distribución de los grupos de especies presentan cierta variación en relación al sitio de muestreo (manglar, playa o el canal) y tipo de red empleado. En término generales, se observa una tendencia de las especies a distribuirse en todo el sistema en un hábitat uniforme, con cierta inclinación relativa hacia el canal del estero en un hábitat caracterizado por el grupo 1 (Fig. 5). En el otoño, los sub-grupos A de especies de arrastre y chinchorro y sub-grupos 1 y 2 de agallera presentan una tendencia a distribuirse hacia la Boca de Teacapán y parte baja del estero. En tanto que los sub-grupos B de arrastre y subgrupos 3ro. y 4to. de agallera se distribuyen principalmente en el canal del estero y laguna. En general se observa que existe una tendencia en todos los sub-grupos de especies a desplazarse hacia zonas de mayor salinidad y menor influencia fluvial (Boca de Teacapán y parte baja del estero), en un habitat que tiene como característica principal las salinidades más altas del sistema (grupo I de estaciones del habitat, Fig. 5). En el invierno, el sub-grupo A de las especies en las redes de agallera y de arrastre, presentan una tendencia a distribuirse hacia el canal del estero y laguna, hacia un hábitat caracterizado por el grupo II (Fig. 5). En tanto que el subgrupo A de especies de chinchorro se distribuye hacia la parte de la Boca de Teacapán y parte baja del estero en un habitat caracterizado por el grupo I (Fig. 5). El resto de las especies se distribuyen prácticamente en todo el sistema. En forma global se observa que el desplazamiento de la ictiofauna, se efectúa desde la Boca de Teacapán hacia el interior del estero. Esta dinámica de la comunidad, se manifiesta, conforme la salinidad penetra hacia el interior del sistema. Aunque esta distribución de la salinidad aún es menor, esto llega a suceder totalmente cuando se aproxima la época de secas y disminuye la afluencia fluvial. En la primavera, los sub-grupos de especies A de las redes de agallera y chinchorro y subgrupos B de la red de arrastre presentan una tendencia de distribución hacia el canal del estero y laguna y en una frecuencia menor hacia la Boca de Teacapán y parte baja del estero. Por lo que respecta al sub grupo A de especies de arrastre, se distribuyen en casi todo el sistema; el cual presenta un hábitat homogéneo en cuanto a la salinidad, (Fig. 5). En general, los "cluster" muestran que las especies de la comunidad se distribuyen prácticamente en todo un sistema con características marinas e incluso hiperhalinas (como el extremo sur de la laguna). El análisis "cluster" de especies en un ciclo anual indica que los sug-grupos A, de especies de las redes de agallera y chinchorro presentan una tendencia de distribución hacia la Boca de Teacapán y parte baja del estero. El comportamiento de la red de arrastre presenta cierta similitud con respecto a las otras redes, excepto que el sub-grupo A de especies tiene una tendencia de distribución hacia el canal del estero y parte baja del estero y en menor frecuencia en la laguna. El otro sub-grupo B observado en la red de arrastre, presenta la particularidad, de formar un grupo de especies que coexisten a lo largo del año y con amplia distribución en el sistema (Figs. 9-13). En general, se observa un grupo de especies en la comunidad que se desplazan a través del sistema en función del régimen climático, al cual ocasiona un gradiente salino, que limita la distribución de las especies. Este mismo comportamiento es observado en la fauna macrobéntica, especialmente en los crustáceos. DISCUSIÓN
HABITAT
Clima El clima de la región que predomina en el sistema presenta un patrón que está definido en dos grandes zonas; la norte y sur. La primera cuyo centro de información es Tecuala, incluye las áreas de la Boca de Teacapán, parte baja del estero y el estero en su porción norte; y la segunda localizada en Rosa Morada, que comprende el área sur del estero, Boca de Cuautla y laguna, En la zona norte siempre se observa valores más bajos de temperatura, evaporación y precipitación a los de la zona sur. En general para las dos zonas, los máximos valores de temperatura y evaporación se presentan en primavera (época de secas) y parte de verano, con una precipitación casi nula. En otoño las temperaturas y evaporación decrecen en forma gradual y por el contrario aumentan las precipitaciones (época de lluvias). El invierno es característico por presentar los rangos más bajos de temperatura y evaporación, disminuyendo directamente las precipitaciones, y ocasionalmente llueve a fines de invierno (Fig. 2).
Vegetación Circundante La macroflora circundante semiacuática del sistema ésta bien caracterizada. Así en la Boca de Teacapán y parte baja del estero abundan el bosque deciduo, teniendo como mejor representante a Bursera simaruba (jiote) pequeños árboles con dominancia deConocarpus y al mangle chino Laguncularia racemosa. En el estero norte, se observa una dominancia de los géneros Laguncularia, Conocarpus y Avicenia. En la zona sur del sistema, se presenta un incremento y dominancia del bosque de manglar, formado por Laguncularia racemosa y Rhizophora mangle, mientras que disminuye Avicenia y Conocarpus principalmente en la laguna. Los bosques de manglar en el sistema y principalmente en su región sur, tienen un papel determinante en cuanto a la mayor producción primaria, como fuente de alimento para la comunidad acuática, que aparentemente utilizan un 95 % de la producción total de las hojas y solo un 5 % es consumido por animales terrestres (Rollet 1974). Con los cambios ambientales generados por la nueva boca, los manglares podrían sufrir ciertas alteraciones que influirían en el sistema en un futuro cercano. El aporte fluvial en Teacapán-Agua Brava es un factor importante; ya que se ha encontrado que ese fenómeno influye en la distribución de algunas especies, acuerdo a la época del año. Así en otoño, las cuencas de los sistemas fluviales acarrean los máximos volúmenes de agua, contrarrestado a las corrientes litorales, a tal grado que el sistema es prácticamente dulceacuícola. Las bocas son los únicos sitios donde se conserva un cierto grado de salinidad. En general, los cambios observados en el sistema se deben al flujo marino, corrientes de mareas, al aporte de agua dulce y a la incidencia de los vientos predominantes. Conforme termina la temporada de lluvias, el flujo de los ríos Cañas, Rosa Morada y Bejuco, disminuye secándose totalmente en primavera y parte del verano, con esto nuevamente se restablece la dominancia marina en el sistema. Solamente el río Acaponeta, sigue aportando agua, incluso en época de secas; sin embargo, como está situado entre las dos bocas, la influencia marina se observa en varios cientos de metros ríos arriba (Fig. 1).
Salinidad La distribución de la salinidad sigue un patrón definido, y es de importancia ecológica para el sistema. En verano se tienen los valores máximos en el estero y la laguna, y los menores en las bocas y parte baja del estero. Esto se debe fundamentalmente a las profundidades, así en fondos someros el calentamiento es homogéneo, provocado una fuerte evaporación y por consiguiente una concentración salina. En tanto que en lugares profundos, no sucede lo mismo. Ocasionalmente los valores de salinidad de fondos son menores que los de la superficie. Esto puede ser debido a la fuerte evaporación que existe, lo cual se ve corroborado por las altas temperaturas superficiales de las capas sub-yacentes de agua (Reid y Wood, 1976). En algunas partes del sistema, es común observar este fenómeno de la inversión de la estratificación salina. En otoño cuando se presenta el máximo aporte de agua dulce en el sistema, por las descargas de los ríos e indirectamente de la lluvia, se manifiesta una fuerte disminución de la salinidad en comparación a primavera y verano. Los máximos valores se registran en la Boca de Teacapán; los cuales decrecen hacia el interior del sistema. La Laguna presenta valores típicos de agua dulce; porque en estos lugares desembocan dos ríos y sus distributarios. La Boca de Cuautla no está exenta a esta influencia de los sistemas fluviales. En el invierno, se restablecen las salinidades altas en casi todo el sistema, conforme disminuye la precipitación y, por consiguiente, las descargas de los ríos. Las salinidades son muy similares a la época de secas, registrándose las mayores en Boca de Teacapán y parte baja del estero, debido a que la influencia del río Cañas es menor por estar lejos de estas áreas. Los valores mínimos están en la laguna, aquí persiste aún la influencia de los ríos. En la primavera, cuando la evaporación y temperatura son máximas y las precipitaciones nulas, se observan áreas hipersalinas en el sistema; estas se presentan en la laguna y en menor proporción en el estero. La Boca de Teacapán y parte baja del estero presentan los valores más bajos, típicos marinos. De hecho existe una estabilidad en la salinidad a través de todo el año, incluso en época de lluvias.
Temperatura La distribución de las temperaturas están en función de las profundidades, con efectos relativos del intercambio de descargas de los sistemas fluviales y las mareas. En primavera y verano se presentan las temperaturas más altas. El estero y la laguna, presentan las máximas temperaturas debido a que tienen profundidades someras y, la mezcla de agua tiende hacia la homotermia vertical, e indirectamente por las corrientes que son menores. Las bocas y parte baja del estero tienden a presentar las temperaturas más bajas, porque no existe un calentamiento homogéneo en lugares profundos y con mayores velocidades de las corrientes. En otoño se presentaron cambios significativos, en relación a la primavera y verano. Pero existe una inversión en cuanto al gradiente térmico de algunas áreas. Así en Boca de Teacapán y parte baja del estero, están las máximas temperaturas. Las menores se registran en el estero y laguna; aunque esta última área no tiene un patrón definido y existen indistintamente valores bajos y altos. Estos cambios se deben a variaciones diurnas, relacionadas con la insolación y con las corrientes fluviales. El invierno se caracteriza por tener las temperaturas más bajas del año. Los valores mínimos se presentan en Boca de Teacapán y parte baja del estero, los que se incrementan ligeramente en el estero. Los máximos se registran en la laguna, no observándose variaciones importantes a lo largo del sistema (son homogéneos principalmente).
Oxígeno Este parámetro químico se distribuye en el sistema de acuerdo con la turbulencia, corrientes, actividades biológicas, efectos de salinidad y temperatura. En otoño los valores más altos se presentan en Boca de Teacapán y parte baja del estero. Debido a que en estos lugares, la turbulencia es mayor y existe una agitación e intercambio mayor de atmósfera-hidrósfera. La transparencia en estos sitios es alta y presenta una relación directa con el oxígeno. En el estero y laguna se observan los mínimos valores, esto es debido a que la transparencia es escasa, por el efecto de la turbulencia y corrientes fluviales que acarrean material terrígeno y otros materiales. En primavera, el oxígeno tiene rangos superiores a, los de la curva de saturación normal. Los máximos se localizan en Boca de Teacapán y parte baja del estero; las cuales disminuyen en el canal del estero; en tanto que en la laguna se presentan irregularidades, debido a la variabilidad de esta área. En la primavera el oxígeno disminuye en comparación al invierno. En la Boca de Teacapan se localizan los más altos; los cuales decrecen en el estero. La laguna registra los valores más bajos, aunque existen algunas excepciones, lo cual refleja la variabilidad de esta área. Muchas de las variaciones estacionales del oxígeno que se presentan en el sistema se debe a la descarga de los ríos, la hora del día y sus efectos biológicos
Transparencia La transparencia del agua es de gran importancia en las áreas con vegetación acuática y animales (Reid y Wood, 1976). El papel más importante en cuanto al grado de transparencia en un ecosistema acuático, surge del efecto del material en suspensión que impide o permite la mayor o menor entrada de luz y que presenta una atención especial en relación a la productividad primaria y al flujo de energía en la comunidad. La mayor transparencia es en primavera y verano. Los máximos valores se presentaron en las bocas y parte baja del estero, debido a que en estas áreas no se registraron aportes continentales que lleven materiales en suspensión. En el estero y laguna disminuye en forma notable, principalmente por el humus, detritus orgánicos y material coloidal en la escasa columna de agua. En otoño la transparencia es casi nula, esto es debido a las fuertes corrientes de los ríos que arrastran material terrígeno y otros elementos, que ocasionan una gran turbidez. La mayor transparencia se observa en la Boca de Teacapán y parte baja del estero debido a que está alejado de las descargas fluviales directas. El estero y laguna presentan valores bajos por estar directamente influenciados, por los ríos y sus menores profundidades son vulnerables a efectos de turbulencia. En el invierno, con la disminución gradual de las lluvias se restablece una transparencia similar a la encontrada en primavera y verano. Las profundidades son irregulares y no guardan un patrón bien definido que influya de manera considerable en la distribución de este parámetro.
Sustrato La naturaleza, textura y actividad del sustrato es conocida por ejercer una considerable influencia sobre plantas y animales (Lasserre et al. 1981). Algunos estudios indican que en las mezclas de arena y fango, se presenta la mayor riqueza de especies. En el sistema Teacapán-Agua Brava el sustrato presenta un gradiente característicos de los estuarios en primavera y verano, las bocas y partes baja del estero son principalmente de arena, y en el estero y la laguna de fango mezclado con algunas partes de arena. En otoño casi todo el sistema es fangoso, sin embargo, en las bocas y sus proximidades se mezcla con arena. En el invierno con el decremento gradual de las lluvias, se restablece el sustrato característico que prevalece en primavera y verano.
Fauna Macrobéntica En verano está representada principalmente por moluscos, crustáceos y poliquetos. La mayor proporción de biomasa de crustáceos y de otros grupos, se ubican en Boca de Teacapán y parte baja del estero, pero la mayor diversidad está en el canal del estero; en general se distribuyen en casi todo el sistema. En otoño los crustáceos son abundantes en la parte baja del estero, y menor proporción en el estero, observándose un desplazamiento de la fauna hacia lugares con mayor salinidad. En invierno, la fauna macrobéntica presenta un desplazamiento hacia la parte sur del estero y laguna, en áreas preferentemente fangosas con profundidad, transparencia, salinidad y temperatura menor, solo pocas especies tienen una amplia distribución. En primavera la fauna macrobéntica se desplaza hacia la parte baja del estero ya que esta parte no es hipersalina, la temperatura y evaporación es menor y muchas especies no colonizan áreas con marcadas fluctuaciones de salinidad y fuertes movimientos del agua debidos al régimen de mareas (Barnes, 1981).
Similaridad del Hábitat El estudio del hábitat efectuado por medio de programas de computación, que involucra métodos de "cluster", utilizando características ambientales (abióticas y bióticas), muestran el grado de similaridad o disimilaridad de las áreas en el sistema. Diversos estudios ambientales, en base al sistema de clasificación numérica, se han efectuado en áreas neríticas y estuarinas (Daniels, 1979; Chávez, 1979; Yáñez-Arancibia et al., 1980. La dinámica ambiental en el sistema de Teacapán-Agua Brava, presentan un medio cambiante fundamentalmente en la región sur del sistema. Varios son los factores que provocan este medio variable, principalmente por efecto de las estaciones climatológicas, corrientes litorales, aportes fluviales y al flujo de la Boca de Cuautla. Los cambios observados para cada estación del año caracterizan a habitats particulares y se presentan comunidades "tipo" de organismos, en estrecha relación al ambiente. La periodicidad de estos cambios determina cierto nivel de estabilidad como lo sugiere Day y Yáñez-Arancibia (1982). Así en el verano, se observa a dos grandes ambientes, subsistemas o hábitat (I y II); el primero caracterizado por tener salinidades y temperaturas altas, profundidades someras, transparencias mínimas, sustrato esencialmente de de arena -fango, fauna macrobéntica relativamente abundante y vegetación sumergida numerosa; este ambiente es característico del estero y parte de la laguna. En tanto que el grupo II, es caracterizado por la presencia de salinidades marinas y temperaturas bajas, transparencias y profundidades altas, sustrato arenoso y fauna macrobéntica escasa. Este tipo de habitat es representativo de las bocas y parte baja del estero, que están directamente influenciados por el mar. Cada grupo ambiental descrito, claramente está influenciado por las bocas, lo cual determina un incremento y un gradiente salino a través del sistema (Fig. 5). Para el otoño, se sigue observando el mismo patrón presentado en la época anterior, es decir a dos grupos de hábitat (I y II), excepto que en la mayor parte del sistema predomina un medio dulceacuícola, provocado por las lluvias. El primer grupo de hábitat (I), involucra a salinidades, temperatura, transparencias y profundidades altas, sustrato de mezcla de arena-fango y con escasa fauna macrobética. Este tipo de habitat es representativo de la Boca de Teacapán y parte baja del estero. El segundo grupo (II), altamente contrastante, está caracterizado por tener un medio prácticamente dulceacuícola, profundidades menores, abundancia de rodofíceas y fauna macrobéntica, este tipo de habitat incluye al canal del estero y laguna. Los habitat incluye al canal del estero y laguna. Los habitat descritos en ésta época de lluvias, reflejan a la Boca de Teacapán y parte baja del estero, como el único lugar que tiene una alta influencia marina, el resto del sistema es homogéneo en cuanto a la dominancia fluvial, atenuando el efecto de las corrientes de marea de la Boca de Cuautla (Fig. 5). En el invierno, la dinámica ambiental comienza a tener las características presentadas en verano, debido a la disminución fluvial y, por consiguiente, las corrientes litorales comienzan gradualmente a invadir al sistema impregnándole un carácter salino. En esta época del año se observan dos grupos de estaciones (I y II), el primer grupo, presenta a un habitat de salinidades y transparencias altas, temperatura baja, fauna macrobéntica y vegetación sumergida escasa. Este habitat es representativo de la Boca de Teacapán y parte baja del estero. En forma opuesta se observa el segundo grupo (II), que describe a un hábitat de salinidades y transparencias bajas, temperaturas altas, fauna macrobéntica y vegetación relativamente abundante, que caracteriza a las áreas del canal y la laguna. Esta época del año es una fase intermedia, que muestra aún la influencia existente de las lluvias en ciertas áreas, así como también la gradual aparición de un habitat de la época de secas (Fig. 5). En la primavera, con la disminución total de las lluvias y con varios de los ríos y sus. distributarios secos, se presenta un cambio radical en todo el sistema, observándose a un solo grupo (I), que incluye a toda el área, lo cual describe a un habitat relativamente homogéneo, dado principalmente por la salinidad. Sin embargo, un análisis a pequeños sub-grupos, indican la existencia de algunas áreas particulares relacionadas por algunas características ambientales bien específicas (Fig. 5). Esta homogeneidad se debe principalmente a la fuerte dominancia marina ocasionada por las dos bocas y al nulo aporte fluvial. Incluso el río Acaponeta que no se seca, no escapa a ésta influencia marina, hasta varios metros río arriba, originando un pequeño, estuario" (Fig. 5). Los cambios climático meteorológicos que suceden con la llegada de las primeras lluvias del verano, se rompe la homogeneidad observada y determinan el reinicio del cielo ambiental, que caracteriza a los habitat antes descritos. En forma general, se observa a través de un cielo anual, que el hábitat del ecosistema, está influenciado por la geomorfología, salinidad, temperatura, profundidad, sustrato, corrientes litorales y aporte de agua dulce, los cuales están estrechamente ligados al régimen climático. Un medio como el descrito con cambios de gradientes espaciales y temporales, se ve reflejado en las características de la comunidad de peces las que varían y que se mueven a través del gradiente de salinidad y temperatura. Así también se observa que la inestabilidad de la Boca de Cuautla, se debe a lo estrecho del canal y a las altas velocidades del movimiento de sus aguas (Cepeda, 1977). Esta área sólo alcanzará su condición de equilibrio cuando sea lo suficientemente ancha. Mientras eso sucede es de esperarse una fuerte erosión en el área y sus alrededores, que se verá reflejada en la morfología de la barrera, la comunidad de manglar y por lo tanto en las comunidades acuáticas de la laguna y sus proximidades. ESTRUCTURA DE LA COMUNIDAD
Diversidad La diversidad es una característica importante en las comunidades, y por lo general está relacionada con otras propiedades, así como a su estabilidad y las condiciones ambientales a que está expuesta (Pianka, 1966, y 1978; Pielou, 1975 y 1977, Krebs, 1978 y Fager, 1963). El comportamiento de los diferentes índices (diversidad y biomasa) presentaron un patrón definido en relación a las propiedades intrínsecas de la comunidad; las cuales tienen variaciones de acuerdo al número de especies, individuos y peso. Estos parámetros ecológicos, están influenciados por diversos factores como época climatológica, lugar de muestreo y por la selectividad de las redes. La relación del índice de "riqueza de especies" (D) y "diversidad" (H'n) representan frecuentemente una relación inversa al "indice de abundancia relativa" o de "equitatividad" (J'); debido a que este índice es en realidad una expresión de la abundancia relativa y presenta un valor máximo de la unidad, cuando todas las especies guardan una abundancia igual (Tramer, 1969). Es decir, una proporción equifrecuente de los individuos entre las especies representadas. Esto es pocas o muchas especies pero con una buena proporcionalidad de individuos, provoca un incremento del índice (J'). Por el contrario, disminuye cuando no hay armonía de la uniformidad de la proporción (Patten, 1962; Lloyd y Ghelardi, 1964; Whittaker, 1972). Sin embargo, es difícil predecir un patrón de comportamiento entre los distintos índices, a través del año para las distintas redes de pesca. Esto explica en cierta manera la relación directa de J', que se observa con H'n, en muestras con chinchorro. Mac Arthur (1969) y Hill (1973), según estudios de comunidades terrestres de aves y plantas, encuentran que lo más común es esperar una correlación negativa en ecosistemas con baja dominancia numérica y comunidades ricas en especies. Sin embargo, la hipótesis por ellos planteada fue sometida a un análisis estadístico para comunidades bénticas marinas, a partir de una gran cantidad de datos publicados en artículos que incluyen tablas de H'n y J' (Douglass, 1981), se encontró que existen casos particulares, donde una correlación negativa, es poco probable (Gage, 1972). Esto parece interesante por cuanto una vez más, los métodos y técnicas de la ecología terrestre no se aplican en sentido estricto a los ecosistemas acuáticos. Una correlación negativa indicaría que son muestras de diferentes hábitat y de muestreos espaciados. Del análisis estadísticos efectuado por Douglass (1981) se concluye que las correlaciones positivas, no son un resultado "anómalo" (como se presentó en la sección de resultados) del índice de información de H'n, sino más bien es el reflejo de un hábitat similar o con muestras poco espaciadas. Asimismo Douglass, concluyó que la "tendencia de incremento en dominancia con incremento de la riqueza de especies, es producto de factores importantes como: competencia y predación, que conducen a una mejor distribución equitativa de la abundancia en la riqueza de especies de comunidades marinas", y de esto y de otros factores ecológicos, existen investigaciones que aportan datos, (Yáñez-Arancibia et al.,1980). El comportamiento descrito, se presentó con más frecuencia en la red de chinchorro, en menor grado en la red agallera para algunas áreas y épocas del año (esencialmente en la zona norte del sistema) mientras que en la red de arrastre muestra la típica correlación negativa o inversa entre H'n y J' (Tabla 5). Los parámetros ecológicos (H'n, J' y D) presentaron una estrecha relación, los dos primeros incluyen proporcionalidad y lo hacen en forma directa sobre la muestra (H'n y D), en tanto que (J') está en función del valor teórico de la diversidad máxima de la comunidad o simplemente H'max (Patten, 1962; Pielou, 1975). Por lo cual, aún cuando la información de los tres parámetros ecológicos se basan en el número de individuos y especies, no implica necesariamente una relación directa o inversa, sino más bien su dominancia numérica (Yodzis, 1978). Por lo que respecta a H'w, este se comporta paralelo al índice de H'n, con excepción del invierno, en que existe una ligera relación inversa. Principalmente por el incremento de los individuos que afectan a H'n. Es interesante que H'w presente la mayor información en lugares donde la diversidad es baja, lo cual indica claramente la abundancia en peso (energía) de algunas especies dominantes (Wilhm, 1968), esto sucede en lugares con condiciones fluctuantes y rigurosas (Odum, 1969, 1972; Krebs, 1978; Yáñez-Arancibia et al., 1980), como lo es la laguna, que siempre manifiesta un hábitat variable. La mayor diversidad (H'n) se presenta en otoño, coincidiendo con la menor biomasa. Es probable que esto se deba al flujo de un patrón de utilización del sistema, donde la mayor diversidad de otoño está representada por especies de tamaño pequeño (juveniles) y pocas especies dominantes, con lo cual se establece una correlación negativa, asimismo la menor diversidad de verano coincide con las especies de mayor tamaño y peso que han completado un período en el sistema, y que serán reemplazados por la alta diversidad específica de juveniles de la estación climática siguiente. Así, debido a que el sistema no cuenta en ésta época del año (esto sucede también en primavera) con una gran heterogeneidad de hábitat, más bien refleja ambientes homogéneos dados principalmente por su salinidad. Es bien conocido que la mayor diversidad se presenta en áreas que contienen diferentes habitat, y por consiguiente más especies (Krebs, 1978). Una discusión parecida fue propuesta por Yáñez-Arancibia (1978b) al analizar la diversidad y abundancia de los peces, como consecuencia de la heterogeneidad espacial y temporal de diferentes ecosistemas lagunares. La máxima diversidad observada dentro del sistema Teacapán-Agua Brava, son en Boca de Teacapán, parte baja del estero y canal del estero, hacia los sitios con salinidades típicamente marinas. Esta parte norte del sistema, es la más regular a través del año, a diferencia de la región sur del sistema que se caracteriza por su variabilidad ambiental principalmente, por la hipersalinidad que se presenta en épocas de secas y a los valores típicos de agua dulce en la temporada de lluvias. Se ha observado que en ambientes severos y fluctuantes es impredecible la diversidad (Sanders, 1968) como en el caso concreto de la laguna de Agua Brava, esto se presenta en ciertas épocas del año. La diversidad de las especies depende de factores ambientales, factores biológicos, y aspectos técnicos del muestreo. Por lo general en el sistema de Teacapán-Agua Brava, la diversidad de los peces es comparable a la de otros ecosistemas costeros subtropicales. Esta diversidad no es muy alta y la comunidad presenta especies dominantes a través de todo el año, las cuales en términos ecológicos aportan la mejor información en el sistema, además que en gran medida controlan el balance energético del ecosistema. Así también la diversidad es sensible al tipo de red empleada en la pesca, aumenta con el tamaño de malla de la red, probablemente porque las redes de malla grande dejan escapar una parte de los individuos de especies pequeñas, que en número suelen ser dominantes, a las vez que retienen más fácilmente a individuos de especie de mayor talla. La diversidad de los peces también disminuye con una sobre explotación pesquera (1974), Margalef. DISTRIBUCIÓN Y ABUNDANCIA DE LAS ESPECIES DOMINANTES COMPONENTES COMUNITARIOSLos conceptos de distribución y abundancia están estrechamente relacionados, aunque a primera vista pudiese ser considerada como distinta (Andrewartha y Birch, 1954). Un punto importante de interés en el estudio de las comunidades es conocer la distribución de las especies, las que varían de manera considerable dependiendo de factores ambientales, biológicos y ecológicos. Por otra parte la abundancia fluctúa desde especies muy comunes hasta muy raras, y tanto unas como las otras pueden ser abundantes en peso pero diferir sustancialmente en su abundancia en número de individuos. Para una gran mayoría de especies, el parámetro determinante para su distribución fue la salinidad, en tanto que las especies dominantes mostraron ser eurihalinas, y se han reportado con frecuencia en aguas estuarinas (Yáñez-Arancibia, 1978b). Las especies dominantes, por lo general son casi las mismas a lo largo de un ciclo anual. Ciertas especies fueron dominantes e independientes del arte de pesca con que se les colectó como: Galeichthys caerulescens, Arius liropus, Centropomus robalíto, Diapterus peruvianus, Mugil curema, Oligoplites saurus, Citharichthys gilberti. La importancia de la información sobre relaciones tróficas, determina que para cada especie dominante se resuma lo más trascendente encontrado en el área o regiones próximas por autores o literatura selecta. La especie Galeichthys caerulescens,se distribuye en casi todo el sistema, su principal alimento consiste en anélidos, crustáceos, insectos y peces, e inclusive es capaz de ampliar su aspecto trófico e ingerir materia orgánica y vegetales como algas y algunas plantas superiores (Amezcua Linares, 1972 y 1977; Yáñez-Arancibia, 1978b). Algunas veces su distribución se ve restringida a la Boca de Teacapán y parte baja del estero en la época de otoño, precisamente cuando la mayoría de la macrofauna béntica y diversidad en general, se concentra hacia esos sitios de influencia marina, Carranza, (1970). Arius liropus, presentó una distribución desde la parte media del canal del estero hasta la laguna, pero en épocas como otoño es posible localizarla hasta la Boca de Teacapán. Esta especie es rara en otras lagunas del Pacífico como las de Guerrero (Yáñez-Arancibia, 1978b), pero en Agua Brava es una especie muy abundante, se alimenta de pequeños peces, macroinvertebrados y aún de vegetales (Amezcu a Linares, 1972). Centropomus robalito, tiene una distribución principalmente desde el canal de estero a la laguna, por lo general en habitat caracterizados por bajas salinidades, precisamente en las desembocaduras de los ríos (Castro et al., 1970), su mayor abundancia en el sistema de Teacapán-Agua Brava es en el otoño, sin embargo, es capaz de tolerar altas salinidades como en la primavera. Esta especie se alimenta principalmente de peces y crustáceos; ingiriendo a veces larvas de insectos (Amezcua Linares, 1972 y Yáñez-Arancibia, 1978b). Otros estudios indican que C. robalito come esencialmente peces, de preferencia scienidos y en menor proporción gérridos y algunos eleótridos, así como crustáceos camarones e insectos acuáticos (Carranza, 1969). En este trabajo fue muy frecuente encontrarlo en los fondos someros y lod osos, o en sitios donde abunda el manglar. Esto puede explicarse debido a la gran diversidad faunística en los bosques del manglar en términos generales (Rutzler, 1969). Diapterus peruvianus, presenta una distribución desde la parte baja del estero hasta la laguna. Esta especie es abundante solo en invierno y primavera. Su mayor dominancia se manifiesta hacia el sur del sistema (laguna), sus hábitos son carnívoros, preferentemente sobre pequeños peces y en menor proporción anélidos, crustáceos y moluscos, sin embargo también es capaz de ingerir vegetales y detritus, es decir puede ampliar su espectro trófico de ler. orden a 2do. orden, según las necesidades alimenticias. Por lo común se le encuentra en sitios fangosos y someros, donde existe una alta productividad primaria. Mugil curema, tiene distribución muy amplia desde la Boca de Teacapán a la laguna, en redes como agallera y chinchorro su dominancia (número y biomasa), y su frecuencia es alta mientras que en la red de arrastre es baja, esto es probable que se deba a sus hábitos alimenticios. Es muy común encontrarla cerca de las playas, donde existen parches de algas y otros vegetales, así como también en las cercanías del mangle y lugares fangosos y someros. Debido a su alta dominancia a través del año, se considera que esta especie contribuye en forma considerable, como un canal energético entre el mar y el complejo lagunar, ya que parece ser una especie con gran capacidad fisiológica de osmorregulación que le permite adaptarse al sistema. Oligoplites saurus, es una especie que se distribuye en forma regular y abundante desde la Boca de Teacapán hasta la parte norte del canal del estero. Su mayor dominancia es en otoño, y la mínima en invierno. Todo parece indicar que su distribución está restringida, en particular a zonas con influencia marina, y parece ser que no tiene altos rangos de tolerancia o variaciones de salinidad. No se tiene datos de su alimentación, pero es muy probable que sea similar a la deOligoplites mundus, quien es consumidor de 2do orden por ser especies muy emparentadas, siendo por tanto muy difícil de encontrarlas juntas. Algunas especies están perfectamente bien representadas en cuanto a número de individuos, peso y frecuencia de aparición para artes de pesca como en agallera-chinchorro, que tienen a muchas especies dominantes como lo son: Elops affinis, Nematistius pectoralis, Caranx hippos, Trachinotus paloma, Eucinostomus entomelas, Eucinostomus dowii y Oligoplites mundus. La especie Elops affinis, se encuentra en lugares de altas salinidades y no llega a ser muy abundante, con excepción de algunas épocas del año, pero es de tomarse en cuenta por su dominancia en determinadas áreas. Esta especie se alimenta de engraulidos, clupeidos, aterinidos, poecilidos, crustáceos (camarones) e insectos. Nematistius pectoralis, es típicamente marina y por lo general solo se encuentra en Boca de Teacapán y parte baja del estero, cerca de fondos arenosos, no se tiene datos acerca de su alimentación en el sistema. Caranx hippos, es de amplia distribución en el sistema, se le capturó desde la Boca de Teacapán a la laguna, precisamente donde existe una fuerte influencia marina y conforme el ambiente se vuelve más homogéneo debido a la salinidad, es posible que su distribución sea en todo el sistema. Tiene poca importancia económica local, pero existen indicios de ser abundantes en el Océano Pacífico, lo cual podría ser un potencial (Berdegué, 1956). Esta especie según Alvarez (1970) puede penetrar hasta aguas dulces. En el sistema de Teacapán-Agua Brava siempre se le encontró en lugares de salinidades marinas o próximas a ellas, posiblemente porque predan sobre áreas en donde existe una gran abundancia de organismos. Se alimenta de peces pequeños, así como de macroinvertebrados (Amezcua Linares, 1972; Yáñez-Arancibia, 1978b). Su dominancia se manifiesta con la red de chinchorro, solo en alguna época del año, pero no es consistente su abundancia. Trachinotus paloma, su distribución es restringida y solo es posible localizarla en las partes bajas del estero, esta es una especie ocasional y es difícil que en la temporada de lluvias se distribuya en lugares con salinidades bajas. No se conocen sus hábitos alimenticios para esta área.Eucinostomus sp (entomelas) yEucinostomus dowii, presentan una distribución amplia, que va desde la Boca de Teacapán hasta la laguna, son peces de pequeñas tallas y no se puede considerar como importantes económicamente, pero si desde el punto de vista ecológico. Su abundancia varía dependiendo de la época del año, lugar de muestreo y selectividad de estas dos artes de pesca (agallera-chinchorro). Estas son especies omnívoras son consumidores primarios; principalmente se les encuentra en lugares de altas salinidades. En el caso particular de la combinación arrastre-chinchorro, solo una especie presenta una dominancia en número, peso y frecuencia Achirus mazatlanus; la cual tiene amplia distribución en el sistema, en relación al gradiente de salinidad. Sus hábitos alimenticios son preferentemente carnívoros, aunque algunas veces incorporan detritus accidentalmente (Yáñez-Arancibia, 1978 b), existen reportes sobre ésta área en el sentido de que tiene una amplia distribución dentro del estero y laguna, precisamente en lugares someros (Amezcua Linares, 1972). Otras especies fueron significativas sólo con un arte de pesca y puede en cierta forma, considerarse como una tendencia típica o exclusiva en capturar ciertas especies con un arte de pesca en particular. Del análisis efectuado en la Tabla 7 se deduce lo siguiente: en la red de arrastre y agallera no existe ninguna especie que pueda considerarse como dominante, y más bien son especies raras y su captura puede deberse al comportamiento de las mismas, alimentación y modo operacional de las redes. Sin embargo, debe de existir cierto grado que puede ser atribuído al azar. En la red de chinchorro, existen muchas especies que son exclusivamente capturadas con esta red, debido a factores descritos anteriormente para cada una de las artes de pesca. Sin embargo, se puede notar cierta tendencia a capturar poblaciones de peces típicas y en cierta forma diferentes a las capturas de otras artes de pesca descritas, principalmente muchas especies que son consumidores primarios y secundarios. Varias de las poblaciones de peces capturadas forman grandes cardúmenes cerca de las playas y en fondos someros, en su mayoría son especies planctófagas (clupeidos, engraulidos y hemirámfidos). Investigaciones efectuadas con chinchorro en la laguna de Huizache-Caimanero, así lo demuestran (Warburton, 1978). En la red de chinchorro, existen varias especies características de esta red, pero solo dos especies fueron importantes por su dominancia, en peso, número, y alta frecuencia de distribución como lo es Hyporhamphus unifasciatus y Lile stolifera. La especie Hyporhamphus unifasciatus, es de distribución restringida, y es posible localizarla desde la Boca de Teacapán a la parte norte del canal de estero, principalmente en fondos arenosos y próximos a las playas, con salinidades cercanas a las típicamente marinas. Sus hábitos son pelágicos costeros (Cervigón, 1966), se alimenta de pequeños organismos y algas. Lile stolifera, se distribuye desde la parte baja del estero y canal del estero, principalmente en lugares con sustrato de arenafango y abundante rodofíceas en fondos someros. Su abundancia disminuye en el otoño, debido a las bajas salinidades, y llega a restringirse solo a la Boca de Teacapán, el resto del año su dominancia se ve claramente manifestada. Sus hábitos alimenticios son planctívoros y lo hacen por filtración (Amezcua Linares, 1972; Yáñez-Arancibia, 1978; Warburton, 1978). En un ciclo anual, solo cinco especies estuvieron presentes en todo el año y con amplia distribución en el sistema. Ciertas variaciones observadas en los parámetros poblacionales (gm-² ind. m-²) y ecológicos (H'n, H'w), se deben fundamentalmente al arte de pesca. Las especies Mugil curema, Lile stolifera, Achirus mazatlanus y Arius liropus, presentan un patrón general de comportamiento similar en cuanto a sus parámetros ecológicos y en menor medida a los poblacionales. Los máximos valores de H'n, H'w, ind.m-² y g m-², se observan en verano e invierno precisamente cuando se tuvieron las mayores tallas, y los mínimos valores en otoño, que es cuando las tallas de los ejemplares son menores. Es probablemente que su época de desove ocurra entre enero y junio (invierno y verano) y en ese rango de tiempo se presenta su madurez sexual y sale al mar a desovar en las proximidades de la costa. Un estudio efectuado sobre la biología y ecología de Mugil curema, en las lagunas de Guerrero, del Océano Pacífico (Yañez-Arancibia, 1976b, describe una dominancia poblacional donde se indica que es posible que la "lisa" desove entre marzo y junio y en épocas de lluvias como en agosto-septiembre, penetran hacia las lagunas en grandes cardúmenes, justamente como una estrategia alimenticia, este comportamiento descrito por dicho autor, parece ser el mismo para la especie citada anteriormente. En cuanto a la especieCentropomus robalito, presenta un comportamiento totalmente distinto a las demás especies sus máximos valores de ind.m-² y g m-² son en otoño, inversamente a H'n y H'w que tiene valores bajos. Las máximas tallas son en otoño y en esta época es cuando existe la probabilidad que alcance su madurez sexual (Yáñez-Arancibia, 1978b); las mínimas tallas se presentan en invierno y verano. Poco se sabe de su dinamica y madurez sexual. COMPONENTES COMUNITARIOSEn general, a través de un año de muestreo las especies cíclicas son los componentes dominantes. Esta dominancia indica su importancia ecológica en el sistema de Teacapán-Agua Brava, ya que son organismos que utilizan el ecosistema para diversos objetivos, tales como: alimentación, crianza, desove y protección (Yáñez-Arancibia, 1978 b). Así también parece ser que estas especies tienen capacidades osmorreguladoras más tolerantes y por tanto soportan mayor variación salina. Este patrón de abundancia de componentes se presenta con cualquiera de las artes de pesca utilizadas, las especies representativas de esta categoría son:Mugil curema, Diapterus peruvianus, Pomadasys macracanthus, Lutjanus argentiventris, Sphoeroides annulatus, Gerres cinereus, Elops affinis, Caranx híppos, Eugerres axillaris, Oligoplites mundus, y Oligoplites saurus. Los componentes ocasionales ocupan el segundo lugar en importancia de la comunidad, su aumento o disminución depende de la época del año, lugar de muestreo y selectividad de las redes. Así se tiene que la red agallera es mas apropiada para la captura de especies ocasionales, que con otras artes de pesca, principalmente porque muchos de estos peces son capturados en las bocas y parte baja del estero, en donde existen condiciones típicamente marinas. Rara vez son encontradas en el estero y laguna y solo amplían su distribución espacial cuando existe alta salinidad en el sistema (verano, invierno y primavera), ya que son especies estenohalinas. Las especies representativas más importantes de esta categoría son:Urotrygon asterias, Symphurus elongatus, Anchoa compresa, Hyporhamphus unifasciatus, Citula dorsalis, Nematistius pectoralis, Chanos chanos y Dorosoma smithi. Con la red de arrastre, algunas veces los visitantes ocasionales predominan más en verano, debido a la homogeneidad salina en el sistema, que permite una mayor distribución en estas especies. Otras veces no se colecta ningún visitante ocasional, sin embargo, la utilización de otras artes de pesca demuestran su existencia. Las especies residentes permanentes, solo representan un pequeño porcentaje como componentes comunitarios pero por su adaptación amplia en el medio y por su abundancia y distribución son las que intercambian y conducen en gran parte la energía dentro del sistema. Las especies representativas más importantes de esta categoría son;Lile stolifera, Centropomus robalito, Arius liropus y Galeichthys caerulescens. La dominancia de componentes residentes algunas veces es mayor en chinchorro, que en otras artes de pesca utilizados. Sin embargo, debe de considerarse que existen variaciones para cada uno de los componentes comunitarios, posiblemente ocasionados por factores como la época del año, ciertas estrategias reproductivas y alimenticias o a las relaciones predador-presa.
Categorías Ictiotróficas El nivel trófico mejor representado numericamente en especies, a través del cielo anual, fueron los consumidores de segundo orden, puesto que su espectro trófico es amplio y les permite ser dominantes, por tener distintas alternativas de alimentación ante situaciones diversas, como respuesta a capacidades adaptativas. Algunas investigaciones afirman que la dominancia de consumidores de segundo orden puede ser la respuesta a una alta disponibilidad de maerofauna en todo el año, apoyada por la estabilidad de corrientes, sustrato, temperatura y salinidad (Vargas-Maldonado et al., 1981). En el caso del sistema Teacapán-Agua Brava, sus variaciones ambientales son cíclicas y estos factores actuan con mayor o menor medida, pues parece producir el mismo efecto de dominancia en consumidores de segundo orden. Solo el efecto de corrientes no puede ser claramente explicado al momento. En circunstancias especiales la falta de alimento en los peces modificarían su comportamiento alimenticio a lo largo del año y en función de la edad, pudiendo cambiar de primero a segundo orden, por ejemplo:Diapterus peruvianus, Galeichthys caerulescens, Chaetodipterus zonatus y Dorosoma smithi. El resto de los niveles tróficos (ler y 3er orden) están representadas por especies que varían en relación a sus hábitos alimenticios y comportamiento social puesto que algunas prefieren el fondo, otras habitan cerca del manglar y un gran porcentaje sobre las playas de fondos someros (principalmente especies capturadas con chinchorro) en su mayoría están asociadas a praderas de algas y pastos, pero la abundancia de cierto nivel trófico esta de algún modo relacionado a la selectividad de las artes de pesca. Así en la red de chinchorro, se caracterizan principalmente peces que en su mayoría son consumidores primarios los que se localizan en grandes parches de algas, en fondos de arena-fango (como en canal del estero), donde existe una gran abundancia de microorganismos y detritus orgánicos. Este mismo comportamiento, fue visualizado en estudios efectuados con chinchorro en el Sistema Huizache-Caimanero (Warburton, 1978), para especies como Lile stolifera, Hyporhamphus unificíatus, Mugil curema, Eucinostomus entomelas, Eucinostomus dowii y Eucinostomus currani. En la red de agallera se observa cierta tendencia a capturar especies consumidoras de tercer orden, que son principalmente ocasionales (de hábitos solitarios). En esta arte de pesca y en otras, este nivel representa un porcentaje muy pequeño. En el caso de la red de arrastre, las especies de primer y tercer orden presentan cierta tendencia a una abundancia similar, como especies representativas: Eucinostomus gracilis, Diapterus peruvianus, Dormitator latifrons, Mugil curema, Eugerres axillaris, Ophistonema libertate, Anchovia macrolepidota, Anchoa compresa, Citharichthys gilberti, Lutjanus argentiventris, Centropomus robalito, Etropus crossotus, Urotrygon asterias y Lutjanus argentiventris entre otras.
Afinidad de Especies y de Habitat La utilización de métodos, de clasificación numérica en ecología, permite hacer análisis ecológicos muy amplios. Una de las razones por el interés en asociaciones (grupos afines), es que parecen ser el reflejo de similitudes ambientales que les confieren grados de similaridad (o disimilaridad). Esto puede hacer posible el asociar y clarificar a los grupos de especies por causas ambientales (Clifford y Stephenson, 1975). Este tipo de métodos han sido ampliamente usados en descripciones de comunidades de peces en lagunas costeras del Golfo de México y Golfo de Tehuantepec en el Océano Pacífico (Chávez, 1979; Sánchez-Gil et al., 1981; Vargas Maldonado et al., 1981; Yáñez-Arancibia et al., 1982). El análisis "cluster" de afinidad de especies y estaciones, corresponde al cuadro ambiental descrito, con distribuciones específicas en áreas restringidas para algunos grupos de especies y muy amplia en otras. Así, se puede observar que la dinámica presentada para los "cluster" de hábitat es la misma para los "cluster- de especies, lo cual refuerza que los distintos grupos de peces están en estrecha relación al ambiente. Esto está caracterizado para cada una de las estaciones climáticas del año. En el verano se observa tres grupos de peces, el primero de ellos (grupo A de la red de agallera y B de chinchorro), presentan una tendencia a distribuirse hacia la Boca de Teacapán y Parte Baja del Estero en un hábitat (grupo 11 del habitat), que se caracteriza por tener menores salinidades, menores temperaturas, mayor transparencia, sustrato arenoso y fauna macrobéntica escasa (Figs. 5, 9 y 19). Las especies Olígoplites mundanus Nematistius pectoralís, Caranx hippos, Lutjanus novemfasciatus, Gerres cinereus. Abudefduf saxatilis, Trachinotus paloma, Eucinostomus curraní, Hyporhamphus unifasciatus y Tylosurus fodiator, son características de este grupo, y muestran una distribución restringida y una alta similitud ecológica. El segundo grupo de peces (grupo A de las de chinchorro y arrastre), se localizan principalmente hacia la parte baja del estero y canal del estero, en un habitat (grupo I del hábitat), que es particularizado por tener aguas someras y tranquilas, por lo que acusan mayor impacto a la evaporación y consecuentemente las salinidades y temperaturas son más elevadas, debido al rápido calentamiento de la columna de agua (Figs. 5, 9 y 19). Las especiesChaetodipterus zonatus, Achirus mazatlanus, Diapterus peruvianus, Centropomus robalito, Gobionellus sagittula, Lutjanus argentiventris, Symphurus elongatus, Mi cropogon ectenes, Symphurus leei, Galeichthys caerulescens, Centropomus robalito y otras especies, son características de este grupo y que muestran una distribución restringida y una alta similitud ecológica. Así también se predisponen condiciones de transición y vegetación circundante, propia para una mayor diversidad macrofaunística. El tercer grupo (grupos B de las redes y arrastre), no definen un patrón de restricción hacia un habitat en particular, teniendo amplia distribución en el sistema, representado por especies dominantes y con capacidades de resistencia a las fluctuaciones del medio (Figs. 5, 9 y 19). Las especies Chaetodon humeralis, Balistes naufragium, Urotrygon asterias, Sphoeroides angusticeps, Etropus crossotus, Arius liropus, Citharichthys gilberti, Eugerres axillaris y Mugil curema, son especies que caractrizan a este grupo y su similitud ecológica tiende a ser baja, debido a su mayor ocurrencia en el área. El patrón de distribución de los grupos de especies representan ciertas variaciones, debido al sitio de muestreo (manglar, playa o en el canal) y tipo de red empleada. Estos tres grandes grupos, indican que en general la tendencia de las especies es en presentar una distribución en todo el sistema, en un hábitat relativamente uniforme principalmente por la salinidad, con cierta inclinación relativa hacia el canal del estero. En el otoño se presentan a dos grandes grupos de peces, el primer grupo, sub-grupos A de especies de arrastre y chinchorro y sub-grupo 1 y 2 de agallera, (Figs. 5, 10 y 20), tienen una tendencia de distribución hacia la Boca de Teacapán y parte baja del estero, donde existe la mayor concentración de peces en un habitat, grupo I del habitat (Fig. 5), que es caracterizado por presentar salinídades, temperaturas, transparencias y profundidades mayores, sustrato de arena-fango, y con escasa fauna macrobéntica (esta última es difícil de precisarla, con el solo empleo de las redes). Este hábitat, es el único lugar del sistema que presenta en ésta época de lluvias, caracterísiticas marinas o muy próximas a ellas, hacia este ambiente se observa un movimiento de las especies en favor de un gradiente salino constante, así mismo en estos lugares se tiene la mayor diversidad de los organismos. Las especies Achirus mazatlanus, Dormitator latifrons, Lutjanus argentiventris, Selene brevoorffi, Mugíl curema, Trachinotus paloma, Ophistonema libertate, Caranx hippos, Chloroscombrus orqueta, Mícropogon ectenes, Galeichthys gilberti, Citula dorsalis, Isopisthus remifer, Scomberomorus maculatus, Elops affinis y Oligoplites mundus, son característicos de este grupo y que presentan una alta similaridad ecológica y una distribución restringida. El segundo grupo de especies es más pequeño, sub-grupos B de arrastre y sub-grupos 3° y 4° de agallera (Figs. 5, 10 y 20), con una distribución principal hacia el canal del estero y laguna en un hábitat (grupo II del hábitat), claramente definido por constituir a un medio prácticamente dulce acuíola, profundidades someras, abundancia de rodoficeas y de fauna macrobéntica. Las especies Eugerres axillaris, Etropus crossotus, Arius liropus, Centropomus robalito, Anchovia rastralis, Chanos chanos, Gerres cínereus, Nematistius pectoralís, Oligoplites saurus, Mugil curema y Galeichthys caerulescens, caracterizan a este grupo y presentan una distribución mucho más amplia y una baja similaridad ecológica y contiene algunas especies altamente dominantes. Muchas especies que frecuentemente se les encontraba en el canal del estero y laguna, como por ejemplo Arius liropus, en esta época del año su desplazamiento y dominancia es manifiesta hacia la Boca de Teacapán y parte baja del estero, probablemente su dinámica esta en función del desplazamiento de otras especies (peces o macroinvertebrados) sobre las cuales depreda, más que a los factores ambientales puesto que este pez tiene amplia capacidad euritermohalina. En el invierno, presentó un patrón similar a la anterior época. Se observaron dos grupos de especies, el primer grupo (sub-grupo A de las especies en las redes de agallera y arrastre, Figs. 5, 11.y 16) tienen una tendencia a distribuirse hacia el canal del estero y laguna en un hábitat (grupos II del hábitat Figs. 5) que describe a salinidades y transparencias bajas, temperaturas altas, fauna macrobéntica y vegetación relativamente abundante. Las especies mejor representadas como ejemplo de este grupo son:Eucinostomus dowii, Diapterus peruvianus, Oligoplites saurus, Gerres cinereus, Galeichthys caerulescens, Hyporhamphus unifasciatus, Citharichthys gilberti, y que se caracterizan por una similitud ecológica relativamente alta y poca dominancia de especies. El segundo grupo (subgrupo A de especies de chinchorro) se distribuye hacia la Boca de Teacapán y parte baja del estero, en un habitat (grupo I del habitat, Figs. 5, 11 y 16) particularizado por presentar salinidades y transparencias altas, temperaturas bajas, fauna macrobéntica y vegetación sumergida escasa, como ejemplo de especies características de este grupo son: Caranx hippos, Syngnat-hus auliscus, Urotrygon asterias, Pomadasys leuciscus, Elops affinis, Lile stolifera, Eucinostomus dowii, estas especies presentan una similaridad ecológica alta, casi como una tendencia en dominancia de número de individuos y frecuencia de algunos peces. El resto de las especies se distribuyen practicamente en todo el sistema. En forma global se observó que el movimiento de la ictiofauna se efectúa desde la Boca de Teacapán hacia el interior del estero. Esta dinámica de la comunidad, comienza a manifestarse conforme la salinidad penetra hacia dentro del sistema. La distribución total y casi uniforme de las especies se lleva a cabo en forma gradual, conforme se aproxima la época de secas y por tanto la disminución de las condiciones fluviales. En primavera, se completa el patrón descrito en invierno. En esta época de secas, se observaron dos grupos de peces, el primer grupo, grupo A de especies de agallera y chinchorro y sub grupo B de la red de arrastre Figs. 5, 17 y22) con una tendencia de distribución hacia el canal del estero y laguna, y en una frecuencia menor hacia la Boca de Teacapan y parte baja del estero en un hábitat, grupo I del hábitat (Fig. 5), que se caracteriza por presentar salinidades superiores a las marinas en la región sur del sistema y típicamente marinas al norte. Como ejemplo de especies que caracterizan a este grupo son: Oligoplites saurus, Gerres cinereus, Polidactylus aproximans, Pomadasys macracanthus, Eucinostomus dowii, Lutjanus colorado, Oligoplites mundus, Galeichthys caerulescens, Arius liropus, Eucinostomus entomelas, Caranx hippos, Hyporhamphus unifasciatus, y Lile stolifera, estas especies presentan una mayor similaridad ecológica y una distribución relativamente baja. El segundo grupo de especies (sub-grupo A de especies de arrastre), se distribuye prácticamente en todo el sistema (Figs. 5, 17 y 22). Las especies Diapterus peruvianus, Centropomus robalito y Achirus mazatlanus, caracterizan a un grupo "tipo" de peces que coexisten tanto espacial como temporal y que es significativo por tener a especies altamente dominantes en número, frecuencia y peso, y puede también ser considerado con una similitud ecológica relativamente alta. En términos generalmente se observa que los grupos de especies de la comunidad se distribuyen en casi todo el sistema, y que incluso es muy difícil establecer los grupos de peces, debido a una distribución en un hábitat con características marinas e incluso hipersalino (extremo sur de la laguna). Un análisis de grupos de especies, en su totalidad, tanto de estaciones climatológicas como de las distintas artes de pesca, presentan a tres grandes grupos de especies. El primero sub-grupo A, de especies de las redes agallera y chinchorro, (Figs. 13, 18 y 23) se localiza principalmente en Boca de Teacapán y parte baja del estero, que a lo largo del año fue un habitat estable y poco sensible a los cambios climatológicos, especies características de este grupo son: Elops affinis, Nematistius pectoralis, Gerres cinereus, Scomberomorus maculatus, Oligoplites saurus, Eucinostomus dowii, Eugerres axillaris, Chaetodipterus zonatus, Tylosurus fodiator, Lutjanus argentiventris, Pomadasys leucíscus y Galeichthys caerulescens. Estas especies presentan alta similaridad ecológica y una baja distribución, restringida hacia ambientes marinos. El segundo grupo, sub-grupo A de especies con arrastre, tiene una tendencia a distribuirse hacia el canal del estero y parte baja del estero, con menos frecuencia en la laguna (Fig. 13). Esta red, presentó características similares en sus grupos de especies en relación a otras redes, sin embargo manifiesta una tendencia a capturar especies que se localizan en el estero y laguna, debido probablemente, al modo de operar del arte de pesca, (Fig. 13). Las especies Symphurus atricaudus, Eucinostomus sp. (currani), Sphoeroides annulatus, Urotrygon asterias, Micropogon ectenes, son características de este grupo y presentan una distribución baja y una alta similaridad ecológica. El tercer grupo (solo el grupo B de arrastre), tiene la particularidad de formar a un conjunto de especies que coexisten durante el año y con una distribución amplia (Fig. 13). Este conjunto de peces hace suponer que forma un "grupo tipo o dominantes ecológicos", pero esto solo es observado con esta red, las otras artes de pesca no manifiestan "grupos tipo". Estas especies típicas son:Diapterus peruvianus, Centropomus robalito, Arius liropus, Achirus mazatlanus y Citharichthys gilberti y se caracterizan porque presentan una baja similaridad ecológica y una amplia distribución en el sistema. En términos generales, se detecto que existe un grupo de especies de la comunidad que se desplaza a través del sistema en función del régimen climático, el que ocasiona un gradiente salino que parece controlar la abundancia y distribución, pero no necesariamente limita a la presencia de las especies. Este reemplazo de los grupos de especies en cada estación del año, describe una sucesión temporal en la comunidad. Finalmente, el uso de diferentes artes de pesca, tienen la ventaja de obtener mayor información sobre la estructura de las comunidades, ya que las redes presentan cierta selectividad ocasionada por su técnica de operación, el tamaño de la abertura de malla y los habitos de las especies, principalmente. Así es frecuente encontrar variaciones en los valores de los diferentes índices observados. El uso de una sola arte de pesca puede ser un factor limitante, aun si se aumenta el esfuerzo pesquero debido a que existe la tendencia a ser capturadas las mismas especies típicas representativas de determinado ambiente (Yáñez-Arancibia, 1981). En todo caso, en el uso de la red de arrastre se observa una distribución más equilibrada de los representantes de la comunidad a diferencia del chinchorro donde son capturadas especies con hábitos de playa y gregarios, que se localizan en áreas someras con vegetación. En la red agallera se capturan especies raras o de poca abundancia y de tamaños proporcionales a la luz de malla. Conclusiones1. El sistema lagunar de Teacapán-Agua Brava, presenta las más importantes áreas de bosques de manglar del Pacífico de México con gran diversidad florística donde predomina Rhizophora mangle, que con otra vegetación litoral soporta importantes recursos pesqueros. 2. El sistema de Teacapán-Agua Brava, tiene un comportamiento cíclico anual del ambiente en relación al aporte fluvial principalmente, como resultado del régimen climático. Estas condiciones caracterizan a dos regiones esencialmente diferentes: la zona sur que comprende la Boca de Cuautla y laguna, y la zona norte que incluye la Boca de Teacapán y parte baja del estero. La zona sur identifica a un habitat que se caracteriza por presentar salinidades altas en verano y primavera y bajas en otoño, temperaturas máximas en verano y primavera y mínimas en invierno. La transparencia es la más baja en esta parte de la región, con los mayores valores en primavera y verano y los menores en otoño. El oxígeno presenta en general los valores más bajos en esta zona del sistema, con los máximos registros en invierno y los mínimos en otoño. La fauna macrobéntica está representada y dominada por tres grupos de organismos: anélidos, crustáceos y moluscos, su mayor abundancia es en el invierno y la menor en otoño. La zona norte identifica a un habitat que se caracteriza por presentar salinidades marinas con regularidad. Las temperaturas máximas son en primavera y verano y las mínimas en invierno, en general no se presentan cambios significativos durante el cielo anual. El oxígeno presenta por lo regular los mayores valores de saturación, con los registros más altos en invierno y bajos en primavera. La transparencia en esta zona es generalmente la más alta del sistema, con los máximos valores registrados en primavera y verano y los mínimos en otoño. La fauna macrobéntica está representada por anélidos, crustáceos y moluscos principalmente, su mayor abundancia es en otoño y primavera y la menor en invierno. 3. La diversidad, distribución y abundancia de las poblaciones de peces, tienen una dinámica en relación a las fluctuaciones ambientales (principalmente salinidad), que prevalece con las estaciones del año, y por lo tanto la estructura de la comunidad está controlada por procesos físicos y presenta cambios en estrecha relación con el ambiente. 4. El índice de diversidad (H'n) se encuentran relacionado con el ambiente, las características biológicas de las especies y la selectividad de las redes. Los índices de H'w y D, presentan un comportamiento similar a H'n, mientras que en J' muestra con frecuencia una correlación inversa de sus valores, debido a la mayor o menor presencia de especies dominantes, el reemplazo y cambio de frecuencia de aparición de especies que entran o salen del sistema, esto es más evidente en la red de arrastre. Sin embargo, en redes como chinchorro y agallera es más frecuente observar un incremento en dominancia con un aumento en las especies, es decir una correlación positiva. 5. La máxima diversidad (Hn) se presentó en otoño, coincidiendo con la menor biomasa. Es probable que esto refleje un patrón de utilización del sistema donde la alta diversidad esta representada por especies juveniles y pocas especies dominantes, la baja diversidad se observo en primavera y verano, que coincide con las especies de mayor talla, peso y H'w, que han completado un período en el sistema, y que serán reemplazadas por la alta diversidad específica de juveniles de la estación siguiente. Esto refleja la distribución bimodal de la biomasa durante el período de alta inmigración de juveniles y la presencia de poblaciones más uniformes de grandes peces durante la época de secas. 6. La mayor diversidad dentro del sistema, se manifiesta en Boca de Teacapán y parte baja del estero, es decir en áreas con ambiente estable que presenta salinidades típicamente marinas. Esta diversidad se manifiesta por especies ocasionales y cíclicas. 7. Se determinaron un total de dieciocho especies dominantes, que tipifican a la comunidad: Achirus mazatlanus, Arius liropus, Centropomus robalito, Galeichthys caerulescens, Nematistius pectoralis, Lile stolifera, Hyporhampus unifaciatus, Diapterus peruvianus, Eucinostomus sp. (entomelas), Elops affinis, Mugil curema, Dormitator latifrons, Caranx hippos, Eucinostomus, dowii, Oligoplites mundus, Citharichthys gilberti, Eugerres, axillaris y Gerres cinereus. De los cuales cinco, Mugil curema, Centropomus robalito, Lile stolifera, Hyporhamphus unifasciatus y Arius liropus, persisten durante el cielo anual, a través del sistema. 8. Los componentes comunitarios, presentan una dinámica que es el reflejo de la época del año, sitio de muestreo, comportamiento de las especies y arte de pesca utilizado. Las más frecuentes son los componentes cíclicos (65.3 %), las especies como recurso pesquero son:Diapterus peruvianus y Mugil curema, las especies típicamente estuarinas (6.7 %) con potencialidad explotable, debido a su gran abundancia son: Arius liropus, Lile stolifera y Centropomm robalito. Los ocasionales (21.0 %), importantes económicamente son: Chanos chanos; Trachinotus paloma y Sphoeroides lobatus. 9. Las fluctuaciones en los niveles tróficos están en función del comportamiento de las especies, lugar de muestreo, ambiente y selectividad de las redes. Las categorías ictiotróficas más frecuentes son las de segundo orden (54.7 %), de las cuales con importancia económica son:Pomadasys macracanthus, Diapterus peruvian us, Lutjan us colorado, Trachinotus paloma, Sphoeroides lobatus, Sphoeroides annulatus, Elops affinis e Hyporhamp- hus unifasciatus. Entre los consumidores de primer orden (30.7%) más importante son: Mugil curema, Lile stolifera, Gerres cínereus y Eugerres axíllaris. Los consumidores de tercer orden (28. 0 %) más importantes son: Lutjanus novemfasciatus, Galeichthys caerulescens, Lutianus argentiventris, Centropomus robalito y otras especies que presentan variaciones en su espectro trófico. 10. En análisis "cluster" en el cielo anual, se clasificaron dos grupos de poblaciones de peces en la comunidad, independiente del arte de pesca, éstas presentaron tendencias de distribución según el cuadro ambiental que prevalece para las distintas épocas del año. Un grupo de especies en general, se localiza en la Boca de Teacapán y parte baja del estero (zona norte), en tanto que una segunda serie de grupos de especies tiende a distribuirse hacia el canal del estero y laguna (zona sur). El verano se caracterizo por presentar a un tercer grupo que involucra a especies altamente dominantes en numero y peso. 11. Los grupos de especies identificados por medio de "cluster" presentan movimientos a favor de los gradientes de salinidad que se suscitan en el cielo anual. Comúnmente se observó una mayor tendencia de las especies en agruparse hacia áreas relativamente más regulares, como Boca de Teacapán, parte baja del estero y en algunas zonas centrales del estero. Otro grupo se distribuye hacia la laguna y parte del estero y se encuentra constituido principalmente por especies dominantes. AgradecimientosAl Instituto de Ciencia del Mar y Limnología quien proporcionó el apoyo institucional y financiero de este trabajo, adscrito al proyecto Estudio Ecológico Comparativo del Sistema Teacapán Agua Brava, Nayarit. A Zoila Castillo, por su valiosa participación en la obtención de muestras y procesamientos de información. A Martha Ortega, por la identificación de la vegetación sumergida (algas). A Antonio García- Cubas, Rafael Segura Vernis, César Flores Coto y Guadalupe Palomino, por sus comentarios y sugerencias. A los companeros del Laboratorio de letiología y Ecología Estuarina, por las valiosas sugerencias y revisión del manuscrito. Al personal de la Estación "Mazatlán" por el apoyo logístico en el trabajo de campo. A Alejandra Estrada, por mecanografiar el escrito. LITERATURAALVAREZ, V. J., Peces mexicanos (claves). Inst. Nal. Inv. Bíol. Pesq., Com. Nal. Consul. Pes. INIBP. 1970. 116 p. 62 figs. AMEZCUA LINARES, F., Tesis profesional Aportación al conocimiento de los peces del sistema de Agua Brava, Nayarit. Fac. Ciencias .Univ. Nal. Autón. México, 1972. 209 p. 13 lám AMEZCUA LINARES F., An. Centro Cienc. del Mar y Limnol. Univ. Nal. Autón. México, Generalidades ictiológicas del sistema lagunar costero de Huizache-Caimanero Sinaloa, México. 1977. 1-26 4 (1): ANDREWARTHA, H. G. y L. C. BIRCH, The Distribution and Abundance of Animals.University of Chicago, Chicago Press, Chicago. 1954. 281 p. ARENAS, V., Hidrología y productividad en el área de Escuinapa y Yavaros. Informe final de los trabajos contratados en los planes piloto de Escuinapa-Yavaros. Inst. Bíol. Unív. Nal. Autón. México, 1970. 191-233. AYALA-CASTAÑARES, A.., M. GUTIÉRREZ y V. M. MALPICA, Informe preliminar sobre la fisiografía y característica de los sedimentos de la región de Yavaros, Son. Inst. Biol. Univ. Nal. Autón. México: Depto. Ciene. del Mar y Lim nol. 1969a. 1-12, 8 figs. 3 tab. AYALA-CASTAÑARES, A., R. CRUZ, A. GARCÍA-CUBAS y L.R. SEGURA, Síntesis de los conocimientos sobre la geología marina de la laguna de Tamiahua, Veracruz, México. In: Lagunas Costeras un Simposio, Mem. Simp. Intern., Lagunas costeras, Ayala -Castañares, A. y F. B. Phleger (Eds.) UNAM-UNESCO, 1969b. 39-48. Nov. 28-30, 1967: BARNES, R. S. K., Coastal Lagoons; The Natural History of a Neglected Habitat. Cambridge University Press, Gran Bretaña, 1981. 106 p. BERDEGUÉ, Peces de importancia comercial en la costa noroccidental de México. Secretaría de Marina, Dir. Gral. Pes. Ind. Com. México, 1956. 345 p. 206 figs. CARRANZA, J., Informe Secretaría de Recursos Hidráulicos e Instituto de Biología, Informe preliminar sobre alimentación y hábitos alimenticios de las principales especies de peces de las zonas de los planes piloto y Yavaros y Escuinapa, 3er. Univ. Nal. Autón. México. Contrato de estudios No. EI-69-51, 1969. 50 p. 7 figs, CARRANZA, J., Informe final sobre la primera etapa del estudio. Estudios de la fauna ictiológica y depredadores del camarón en las lagunas y esteros de los planes piloto Escuinapa, Sin., y Yavaros, Son. Inst, Biol. Univ. Nal. Autón. México. 1970. 28 p. CARRANZA, J. y F. AMEZCUA LINARES, Resultados finales de hidrología, plancton y fauna ictiológica en el sistema Teacapán-Agua Brava (octubre 1970 a junio de 1971). 2da. parte, Teacapán-Agua Brava, Sin-Nay), Informe Técnico. Inst. Biol. Univ, Nal, Autón. México. 1971. 27p, CASTRO, J. L., J. ARvízu y J. PÁEZ, Contribución al conocimiento de los peces del Golfo de California. Revta. Soc, Méx. Hist. Nat., 1970. 107-181. 31: CEPEDA, G.H., Características mareográficas en Machona, Tabasco y Agua Brava, Nayarit. An. Inst. Geof., 1977. 105-115. 5 (22-23): CERVIGÓN, F., Los peces marinos de Venezuela. Estación de Investigaciones Marinas de Margarita, Fundación la Salle de Ciencias Naturales, Monogr., Caracas, 1966. 1-951, 385 figs. 11 y 12: CHÁPA-SALDAÑA, H., La laguna del Caimanero, su producción camaronera y un proyecto para la realización de obras encaminadas a su incremento. Inst. Nal. Invest. Biol. Pes. Méx. Serie de trabajos de divulgación 1966. 1-37 2 (103): CHÁVEZ, E. A., An. Centro Cienc. del Mar y Lim nol. Univ. Nal. Autón. México. Análisis de la comunidad de una laguna costera en la costa sur occidental de México. 1979. 15-44. 6 (2): CLIFFORD, H. T. y W. STEPHENSON, An. Introdution to Numerical Classification. Academic Press. Inc. Nueva York, 229 p. 1975. CURRAY, J. R. y D. G. MOORE, Pleistocene deltaic progradation of continental terrace, costa de Nayarit, México In:Marine Geology of the Gulf of California Am. Van Andel. T. H. and Shor, G. G., Jr. (Eds.) Assoc. Petrol. Geol. Tulsa, Oklahoma: 1964. 913-215. CURRAY, J. R., E. J. E. EMMEL, y P. J. S. CRAMTON, Holoceno History of a strand plain, lagoonal coast. Nayarit, México: 63-100. In: Lagunas costeras un Simposio, Mem. Simp. Intern. Lagunas Costeras. Ayala-Castafiares, A y F. B. Phleger (Eds.) UNAM-UNESCO, 1969. 631 p. Nov. 28-30, 1967. DANIELS, K., Hábitat designation based on cluster anilisis of ichtyofauna. In: Proc. Third Coastal Marsh and Estuary Management Symposium. Day J. W., D. D. Culley, R. E. Turner y A. J. M uphrey (Eds.) Luisiana State University División of Countinuing Education, Baton Rouge, La., 1979. 317-324 DAVIES, R. G., Computer Programing in Cuantitative Biology. Academic Press Inc., Londres, 1971. 429 p. DAY, Jr. J. W. Y YAREZ-ARANCIBIA A., Coastal lagoons and estuaries, ecosystem approach. Ciencia Interamericana, OEA Washington, 1982. 11-26. 22 (1 y 2): DOUGLASS, W. B., Dominance in Marine Ecosystem. Am. Nat. 1981. 262-274 (118): EDWARDS, R. R. C., Ecology of a Coastal lagoon complex in México. Estuar. Coast. Mar. Sci., 1978. 75-92. 6: FAGER, E. W., Communities of organisms. In: The Sea. Ideas Observations on Progress in Study of Seas II, The Composition Sea-water Comparative and Pescriptive Oceanography. M. N. Hill (Ed.) Interscience Publ., Londres: 1963. 415-437. GACE, J., Introduction and species diversity. Mar. Biol., Community structure of tne benthos in scottish sea-lochs. I. 1972. 281-297. 14: GARCIA-CUBAS, jr, A., Resultados Preliminares del estudio de los moluscos en las lagunas del Calmancro y Huizache, Sinaloa y Yavaros Sonora (informe inédito). Univ. Nal. Aut6n. México, Centro Cienc. del Mai y Limnol. 1969. GARCIA, E., Modificaciones al Sistema de Clasificación Climática de Koppen. Univ. Nal. Autón. México. Inst. Geogr. 1973. 246 p. GOMEZ-ACUIRRE, S., Informe final del contrato de estudio Nay, est-7 Plan Nayarit, S.R.H. Resultados finales de hidrologia y fauna ictiologica en el sistema de Teacapfin-Agua Brava (octubre de 1970-junio 1971). Inst. Biol. Univ. Nal. Autón. México: 1970-1971. 1-87. GOMEZ-AGUIRRE, S. LICEA DURAN, y C. FLORES-COTO, An. Centro Cienc. del Mar y Limnol. Univ. Nal. Autón. México, Ciclo anual del placton en el sistema HuizacheCaimanero (1969-1970) 1974. 83-98. 1 (1): CONZALEZ, L. L, Tesis prof., Aspectos biológicos y distribución de algunas especies de la familia Arfidae de las lagunas litorales del Noroeste de México. Fac. Ciencias Univ. Nal. Autón. México. 1972. 88 p. GREENWOOD, P. H., D. E. ROSEN, S. H. WEITZMAN y C. S. MYERS, Bull. Phylectics studies of teleostean fishes, with a provisional classification of living froms. An. Mus. Nat. Hist., 1966. 341-455. 131 (4): G REENWOOD, P. H., G. S. MYERS, D. E. ROSEN y S. H. HEITZMANN, Named main divisions of teleostean fishes. Proc. Biol. Soc. Wash., 1967. 227-228 80: . GUNTER, G., A revised list of eurybalin fishes of North and Middle America. Am. Midl. Nat., 1956. 345-354 56 (2): HEALD, E. j., W. E. ODUM y D. C. TABB, Mangroves in the estuarine food chain. In: Environments of South Florida: Present and Past. P.J. Glearson (Ed.) Geol. Soc. Mem. Miami 1974. 182-189. (2): HEDGPETH, J. W., Estuaries and lagoons. II. Biological aspects. In: Treatise on Marine Ecology and Paleoecology. J. W. Hedgpeth (Ed.) Geol. Soc. Amer. Mem., 1957. 673-750 67 (l): HILDEBRAND, S. F., Bull. A review of the American anchovies (Family Engraulidae). Bingham Oceanogr. Coll., 1943. 1-165 8 (2): HILL, M. O., Ecology, Diversity and evenness: a unifying notation and its consecuences. 1973. 427-432 54: HORN, M. H., y L. G. ALLEN, Bull. Numbers of species and faunal resemblance of marine fishes in California bays and estuaries. South. Cal. Acad. Sci., 1976. 159-170 75 (2): JORDAN, E. M., ANCOT, y R. DE LA TORRE, An Centro Cienc. del Mar y Limnol. Univ. Nal. Auffin. México, Prospección biológica de la laguna de Nichupt6 (Cancdn), Q ' Roo, México. Nota cientlfica. 1978. 179-188. 5 (l): JORDAN, D. S. y B. W. EVERMANN, Bull. The fishes of North and Middle America. U.S. Nat. Mus., 1896-1900. 1-3313, 398 lims. 958 figs. 1-4 (47): KIKEBS, C. j., Ecology the Experimental Analysis of Distribution and Abundance. Harper International., 2a. ed., Nueva York 1978. 678 p. LASSERRE, P., H. POSTMA, J. COSTLOW y M. STEYERT (Eds.), Coastal Lagoons Research: Present and Future. II Proc. UNESCO/IABO Seminar Duke Univ. Mar. Lab. Beaufort N.C. Tech. Pap. Mar. Sci. UNESCO, 33. 1981. Sept. 1978 LIVINGSTON, J. R., Estuar. Diurnal and seasonal fluctuations of organisms in a North Florida estuary. Coast. Mar. Sci., 1976. 373-400. 4: LLOYD, M. y R. J. CHELARDI, At table for calculating the equitability" component of species diversity. J. Anim. Ecol., 1964. 217-225. 33: MAc ARTHUR, R. H., Patterns of communities in the tropics. Biol. J. Linn. Soc., 1969. 19-30. 1: MARGALEF, D. R., Information theory in ecology. Gen. Syst. 1957. 37-71. 3: MARGALEF, D.R., Information Theory in ecology. General Systems 3: 36-71. Transi. From Mem. Real Acad. Cienc. Arts. Barcelona 1958. 373-449. 32: MARGALEF, D.R., Ecología, . Ed. Omega, Barcelona, España, 1974. 951 p MC HUGH, G. M., . Estuaries. Estuarine nekton. In: Lauff, G. H. (Ed.) Am. Assoc. Adv. Sci. Spec. Publ. 1967. 581-619. 83 MEEK, E. S. y S. F. HILDEBRAND, The marine fishes of Panami. Fiel. Mus. Nat. Hist. Publ. Zool. Ser., 1923-1928. 1-1045. 15 (215, 226 y 249): NúÑEZ-PASTEN, A., Tesis profesional, Escuela de Biología Hidrología del sistema Teacapán-Agua Brava, en la planicie costera de los Estados de Sinaloa y Nayarít, Univ. Autón. Edo. Mor. México. 1973. 38 p. ODUM, E. P., Science, The strategy of ecosystem development. 1969. 262-270. (164): ODUM, E.P., Ecologia. Interamericana. 3a. ed. México 1972. 639 p PATTEN, C., Species Diversity in net phytoplancton of Raritan Bay. . J. Mar. Res., 1962. 57-75 20: PIANKA. E. R., Latitudinal gradients in species diversity: a review of concepts. Amer. Naturl 1966. 33-46 100 (910): PIANKA, E.R., Evolutionary Ecology, Harper and Row. 2a. ed. San Francisco. 1978. 397 p. PIELOU, E.C., Ecological Diversity. Interscienre, John Wiley and Sons. New York, 1975. 165 p. PIEL0U, E.C., Mathematical Ecology. Nueva York 1977. 385 p. RAMIREZ, R., Estudio ecológico preliminar de las lagunas costeras cercanas a Acapulco, Gro. Revta. Soc. mex. Hist. Nat., 1952. 199-218 13: . REID, K. G. y D. R. WOOD, Ecology of Inland Water and Estuaries. Van Nostrand Company. 2a. ed. New York 1976. 485 p. ROLLET, B, Ecología y reforestación de los manglares en México. Programa de investigaciones y fomento pesquero, Informe técnico 6. FAO.FI: SFIMEX 15. México 1974. 126 p. 34 fotogr. RUTZLER, R., The mangrove comuniry aspects of ecology. 645-652. In: Lagunas Costeras un Simposio. Mem. Simp. Inter. Lagunas Costeras, Ayala-Castafiares, A. y F. B. Pheleger (Eds.) UNAM-UNESCO, México, 1969. 631 p. Nov. 28-30, 1967: SANCHEZ-CIL, P. A., YAÑEZ-ARANCIBIA, F. AMEZCUA LINARES, An. Inst. Cienc. del Mar y Limnol. Univ. Nal. Auffin. México, Diversidad, distribución y abundancia de las especies y poblaciones de peces demersales de la Sonda de Campeche (verano 1978). 1981. 209-240 8 (l): . SANDERS, A. L., Marine benthic diversity: A comparative study. Amer. Nat. 1968. 243-282 102 (925) . SHANNON, E. C. y N. WEAVER, The Mathematical Theory of Communication. University of Illinois Press. Urbana, 1963. 117 p. SMITH, R.F., A. H. SWARTZ y W. G. MASSMANN (Eds.), A Symposium on Estuarine Fisheries. Amer. Fish. Soc. Spec. Publ. 1966. 1-154 3: . SNEATH, P. H. A. y R. R. SOKAL, Numerical Taxonomy Freeman and Company. San Francisco, 1973. 573 p. SOIKAL, R. R. y C. D. MICHENER, Bull., A Statistical method for evaluating systematic relationship. Univ. Kansas Sci. 1958. 1409-1438 38. . SOTO LÓPEZ, R., Mecanismos hidrológicos del sistema de lagunas litorales Huitzache-Caimanero y su influencia sobre la producción camaronera. Univ. Autón. Baja California, México, tesis. 1969. 80 p. TIRADO, J.C., Contribución de información ecológica para el conocimiento del sistema lagunar de Agua Brava, Nayarit, México. II Simposio sobre Oceanografla Biológica. Univ. de Oriente Cumaná, Venezuela. 1976. Resúmenes: 42 p. Del 24 al 28 de noviembre de 1975. TRAMER, E. J., Ecology, Bird species diversity: Components of Shannon's formula. 1969. 957-929. 50: VARGAS MALDONAD O. I. A. YÁÑEZ-ARANCIBIA y F. AMEZCUA LINARES, Ecología y estructura de las comunidades de peces en áreas de Rhizophora mangle y Thalassia testudinum de Isla del Carmen, Laguna de Términos, sur del Golfo de México. An. Inst. Cienc. del Mar y Límnol. Univ. Nal. Autón. México, 1981. 241-266. 8 (1): VILLALOBOS, A.J., J. CABRERA, F. MANRIQUE, S. GÓMEZ, V. ARENAS y C. DE LA LANZA, Relaciones entre postlarvas planetonicas de Penaeus sp y caracteres ambientales en la Laguna de Alvarado, Veracruz, México. 601-620. In: Lagunas Costeras un Simposio, Ayala Castañares, A. y F. B. Pheleger, (Eds.) Mem. Simp. Inter. Lagunas Costeras, UNAM-UNESCO, México, 1969. 631 p. Nov. 29-30, 1967: WARBURTON, K., Community structure, abundance and diversity of fish is a Mexican Coastal Lagoon System. Estuar. Coast. mar. Sci., 1978. 497-519 7: . WIHLM, J. L., Ecology, Use of biomass unites in Shannon's formula. 1968. 153-156 p. 49: WHITTAKER, R.H., Evolution and measurement of species diversity. Taxon, 1972. 213-351 21: . YÁÑEZ-ARANCIBIA, A., Relaciones tróficas de la fauna ictiológica del sistema lagunar costero de Guerrero y aspectos parciales de dinámica de poblaciones de los peces de importancia comercial, In: Informe final 2da. Etapa Programa Uso de la Zona Costera de Michoacan y Guerrero. Convenio Comisión del Río Balsas, S. R. H. y Centro Cienc. del Mar y Límnol. Univ. Nal. Autón. México. Contrato de estudios No. OCE-03-74, 1975a. 750 p.230 p., 71 figs. YÁÑEZ-ARANCIBIA, A., An. Centro Cienc. del Mar y Limnol. Univ. Nal. Atitón. México, Sobre los estudios de peces en las lagunas costeras: Nota Científica. 1975b. 53-60 2 (1): YÁÑEZ-ARANCIBIA., An. Centro Cienc. del Mar y Límnol. Univ. Nal. Autón. México, Observaciones sobre Mugil curema. Cuvier y Valenciennes en áreas naturales de crianza, México. Alimentación, crecimiento, madurez y relaciones ecológicas. 1976. 92-124 3 (1): YAÑEZ-ARANCIBIA, A Fish culture in coastal lagoons: Perspectives M46xico. Progress in Marine Research in the Caribbean and adjacent Regions. In: CICAR-II Symposium, H.B. Steart (Ed.) FAO Fish. Rep. Caracas, Venezuela, 1977. 529-547 200: . July 12-16, 1976. YÁÑEZ-ARANCIBIA, A., Patrones ecológicos y variación cielica de la estructura trofica de las comunidades nectónicas en lagunas costeras del Pacífico de México. Rev. Biol. Trcp. 1978a. 189-218 26 (1): YAREZ-ARANCIBIA. A., Taxonomía, Ecología y Estructura de las Comunidades de Peces en Laguna Costeras con Bocas Efimeras del Pacifico de México. Centro Cienc. del Mar y Limnol. Univ. Nal. Autón. México Publ. Esp. 1978b. 1-306 2: YAÑEZ-ARANCIBIA, A., The ocurrence, diversity and abundance of fishes in two tropical coastal lagoons with ephemeral inlets on the Pacific coast of México. Tech. Pap. Mar. Sci. UNESCO 1981. 233-260 33: YAÑEZ-ARANCIBIA. A. y R. S. NUCENT, Sintesis de antecedentes bióticos y abiáticos de los ecosistemas estuarinos de Nayarit, México. Publ. Ciencias Biológicas, Univ. Autón. Nuevo León, México. 1975. Vol. in memorian Dr. E. Caballero (en prensa). YAÑEZ-ARANCIBIA, A. y G. DIAZ, An. Centro Cienc. del Mar y Limnol. Univ. Nal. Autón. México Ecología trofo dinámica de Dormitator latifrons (Richarson) en nueve lagunas costeras del Pacifico de México (Pisces: Eleotridae). 1977. 125-140 4 (l): YAÑEZ-ARANCIBIA, A. y R. NUCENT, An. Centro Cienc. del Mar y Limnol. Univ. Nal. Autón. México, El papel ecológico de los peces en estuarios y lagunas costeras. 1977. 107-114 4 (l): YAÑEZ-ARANCIBIA, A., F. AMEZCUA LINARES y J. W. DAY Jr., Fish community estructure and function in Terminos Lagoon, a tropical estuary in the southern Gulf of México. . In: Estuarine Perspectives. Academic Press. V. Kennedy (Ed.). Inc. Nueva York. 1980. 465-482 YAÑEZ-ARANCIBIA, A. y L. W. DAY, Jr., Ciencia Interamencana, Coastal Lagoons and Estuaries, Ecosystem Approach. OEA, Washington, 1982. 11-26 22 (1 y 2): . YAÑEZ-ARANCIBIA, A., A.L. LARA DOMINGUEZ, P. SANCHEZ GIL, I. VARGAS MALDONADO, P. CHAVANCE, F. AMEZCUA LINARES, A. AGUIRRE LEON y S. Díaz Ruiz, Ecosystem dynamics and nichthemeral and seasonal of fish comunity structure in a tropical estuarine inlet, México. (ISCOL-UNESCO) Bordeaux, France, Oceanologica Acta, 1982. 417-429 5 (4): . Sept. 7-14, 1981. YODZIS, P., Competition for space and the structure of ecological communities. In: Leetures Notes in Biomathematics, Springer-Verlag. S. Levin (Ed.). Nueva York 1978. 191 p. ZAURANECH, J.B., Tesis Master of Science in Oceannography. The gerrid fishes of Eucinostomus in the Eastern Pacific. Univ. California, La Jolla, 1967. 74 p.
|

