|
SISTEMÁTICA Y ECOLOGÍA DE MOLUSCOS EN
LAS LAGUNAS COSTERAS CARMEN Y MACHONA, TABASCO, MÉXICO
Trabajo
presentado parcialmente en el "International Symposium on Coastal Lagoons,
ISCOL-UNESCO 8l". Bordeaux, France, sept. 7-14, 1981. Recibido el 4 de
septiembre de 1983 y aceptado para su publicación el 9 de noviembre de
1983.
VICENTE ANTOLÍ F.
ANTONIO GARCÍA-CUBAS
Universidad Nacional Autónoma
de México, Instituto de Ciencias del Mar y Limnología.
Laboratorio de Malacología. Contribución 361 del Instituto de
Ciencias del Mar y Limnología,
UNAM.
Se
estudia la fauna malacológica del sistema lagunar Carmen y Machona en el
litoral del estado de Tabasco.
Se colectaron 19,921
ejemplares distribuidos en 2 clases, 5 subclases, 11 órdenes, 34
superfamilias, 49 familias, 73 géneros y 95 especies. Por su abundancia
relativa y distribución generalizada, las especies
características son:Acteocina canaliculata, Rangia cuneata,
Littoridina sphinctostoma, Cerithidea pliculosa, Rangia flexuosa y Mulinia
lateralis.El 48.3% de las especies identificadas de moluscos son
epifaunales, el 44.1% infaunales. El 63% son de habitat marino, el 40.9% de
nutrición filtradora y el 29.4%
carnivora-carroñera.
De acuerdo con las condiciones
hidrológicas y fauna presente, se establecen cuatro zonas
características en el sistema lagunar.
Se analiza la
diversidad, obteniéndose valores medios de 0.91 para los bivalvos, de
1.16 para los gasterópodos y de 1.92 para la población total de
moluscos. Respecto a la afinidad los valores medios resultaron 31.25% para los
bivalvos, de 36.95% para los gasterópodos y para la población
total de los moluscos
34.86%.
Study
of the malacological fauna from Carmen y Machona lagoons system in the Tabasco
State coast. A colect of 19,921 moluscs were distributed as follow: 2 classes,
5 subclasses, 11 orders, 34 superfamilies, 49 families, 73 genus and 95
species. Due to relative abundance and general distribution the following
species: Acteocina canaliculata, Rangia cuneata, Littoridina
sphinctostoma, Cerithidea pliculosa, Rangia flexuosa, and Mulinia
lateralis, were more distinctive. 48.3% of the moluscs species
founded were from the epifauna, 44.1% were infauna, 63% were marine inhabitans,
and 40.9% had filtering nutrition while 29.4% had carnivore-rotten nutrition.
Acordin to the hidrological conditions and present fauna it was fund that this
lagoon system has four tipical zones, Moluscs diversity was analyzed
gíven mean values of 0.91 for bivalves 1.16 for gastropods and 1.92 for
the total moluscs population. With respect of moluscs afinity the mean values
were for bivalves 31.25%, for gastropods 36.95% and for the complete moluscs
population was
34.86%.
Este trabajo forma parte de un proyecto a largo plazo del laboratorio de Malacología del Instituto de Ciencias del Mar y Limnología. Comprende el estudio de la biología, ecología y sistemática de la fauna malacológica de 22 lagunas costeras y estuarios del litoral mexicano del Golfo de México. La importancia de las lagunas costeras y estuarios ya ha sido ampliamente discutida, Yáñez-Arancibia y Nugent (1977), Yáñez-Arancibia (1978), García-Cubas (1981) y otros. Únicamente se resaltarán algunos hechos que se consideran importantes. Estos ecosistemas, dado su potencial biológico en especies sujetas a explotación a diversos niveles, desde una sub a sobreexplotación y susceptibles de verse afectados por la contaminación, hace necesario el conocimiento integral de sus componentes tanto biológicos como abióticos. La fauna malacológica como componente biótico de estos complejos, ecológicos juega un papel muy importante, tanto como un elemento de la trama trófica, como por las especies que están sujetas a explotación por el hombre en ocasiones en forma indiscriminada. De tal manera, el conocimiento integral de su composición cuali y cuantitativa, su comportamiento y relaciones con los demás componentes biológicos del sistema harán más racional su explotación y conservación. Poca información existe sobre el área de estudio; los antecedentes se concretan a los recursos ostrícolas: De Lara (1972), Gutiérrez (1973), De Lara y Gutiérrez (1974). Sobre genética, Diupotexet al. (1978); sedimentos: Galaviz-Solís (1980); sistemática de moluscos: Antolí (1981) y contaminación: Romero-Jarero et al.(1982). ÁREA DE ESTUDIOEl sistema lagunar de Carmen y Machona se localiza en el extremo oeste de la costa del estado de Tabasco. Se extiende entre los paralelos 18º15' y 18º30' de latitud N y los meridianos 93º30' y 93º,35' de longitud W. Esta parte del litoral suroeste del Golfo de México está constituido por una llanura deltaica originada por los ríos Grijalva, Mezcalapa y Usumacinta; caracterizándose por ser un terreno llano, con poco relieve y con numerosas llanuras costeras y deltas de ríos. El sistema lagunar, está integrado por dos cuerpos principales de agua, intercomunicados por un amplio canal, esteros y cuerpos de agua menores. Se encuentra separado del mar por una larga barrera litoral de unos 35 km de largo y un ancho que varía entre 1 y 0.5 km, Esta barrera está formada por arenas y zonas de manglar en su litoral lagunar. La laguna del Carmen, situada en el extremo SW del sistema es la de mayores dimensiones, 15 km de largo por un ancho de 6 km y una superficie de 90 km² aproximadamente. El otro cuerpo principal corresponde a la laguna Machona, de dimensiones ligeramente menores; 14 km de largo por un ancho de 5.5 km y un área de 85 km². Estas dos lagunas se intercomunican por un amplio canal, considerado por algunos autores como una tercera laguna, llamada el Pajonal, con una longitud de 9.5 km, un ancho promedio de 1.5 km y una superficie aproximada de 15 km² (Fig. 1). A la laguna del Carmen en su litoral sur desemboca un estero conocido como laguna de la Palma de unos 4 km de largo y un ancho de 1.5 km. A la laguna de Machona desemboca un estrecho canal llamado Arroyo Hondo que se comunica a una pequeña laguna conocida como Laguna Redonda. El área total del sistema lagunar, incluyendo los esteros y lagunas menores asociadas es de unos 200 km² aproximados. La comunicación con el mar se establece a través de dos bocas: la boca Santana en la laguna del Carmen, de unos 400 metros de ancho en el extremo NE de la laguna. En la Machona la Boca Panteón, en su extremo S con un ancho de 250 m. Esta boca es artificial y muy inestable. El aporte de agua dulce proviene, principalmente de los ríos San Felipe y Chico Zapote que desembocan en la laguna del Carmen y el río Santana en la laguna Machona. Durante la época de lluvias se forman numerosos escurrimientos temporales, principalmente en el litoral sur del sistema. 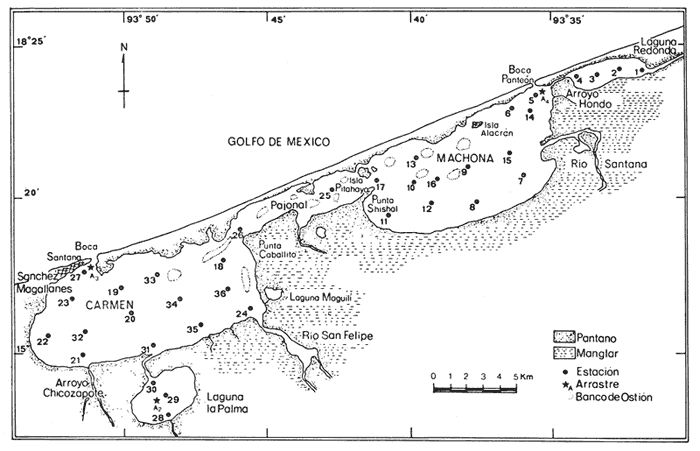 Fig. 1. Area de estudio, con los rasgos geográficos y toponimia. Se señalan las estaciones de muestreo y arrastres. CLIMAEl clima es cálido húmedo con lluvias intensas en verano y una época relativamente seca a fines de invierno. El tipo es Amw (García, 1973). La temperatura media anual es de 26ºC y la precipitación media de 2 000 mm, con una mínima variable entre 30 y 40 mm. A fines del otoño y durante el invierno suelen presentarse en la zona tormentas tropicales o "Nortes" con vientos de dirección N acompañados con lluvias y notables descensos de la temperatura. Durante el resto del año, los vientos dominantes siguen una dirección SE y NE. SEDIMENTOSLos sedimentos predominantes en todo el sistema lagunar son los limos de grano fino a grueso, con áreas arenosas en las bocas y sus proximidades. De acuerdo con Galaviz-Solís (1980) se puede establecer una distribución generalizada de los siguientes grupos texturales: Grupo I Arena de grano medio a muy fino. Grupo II Limo grueso. Grupo III Limo grueso a fino. Grupo IV Limo muy fino. La distribución de estos grupos texturales se muestra en la figura 2. A rasgos generales, en la laguna del Carmen y en el Pajonal predominan las arenas de grano medio a muy fino, mientras que en la Machona son abundantes los sedimentos limosos con un área de arenas muy activa próxima a la boca Panteón. La presencia de esta zona arenosa obedece en gran medida a la abertura de esta boca en el año de 1975 originándose un flujo de agua marina y sedimentos arenosos hacia el interior de la laguna, donde anteriormente predominaban aguas salobres quietas y sedimentos limosos provenientes del río Santana. 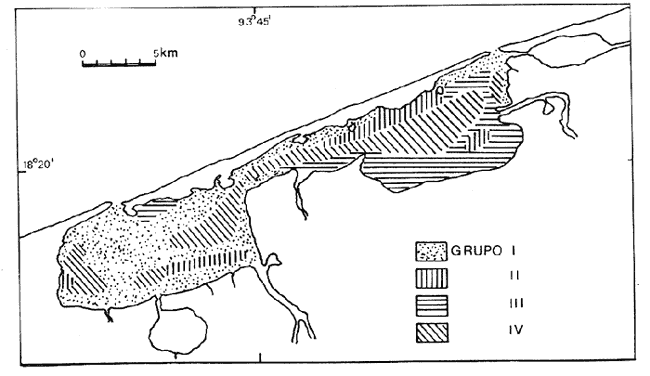 Fig. 2. Distribución de los principales grupos de sedimentos. BATIMETRÍAEste sistema lagunar es somero; su profundidad media es de 0.90 m, con profundidades máximas en la boca Santana de 6 m y en la boca Panteón de 3 m. El fondo lagunar es notablemente llano, con canales de marea poco desarrollados en la parte interna de las bocas. En la parte central del sistema en dirección al eje principal corre un canal artificial parcialmente rellenado por los sedimentos, con una profundidad media de 1.5 m. Se localizan bancos de ostión en diversos grados de desarrollo, principalmente en la parte NW de la Machona y parte media del Pajonal. La mayor parte de los bancos ostrícolas están cubiertos parcialmente por una capa de sedimentos transportados por las corrientes. VEGETACIÓNLa vegetación circundante esta representada por los manglares, siendo la especie más abundante Rizophora mangle,asociada conLaguncularia racemosa yAvicennia. germinans. Estos bosques de manglar ocupan la mayor parte del litoral lagunar, con excepción de las zonas pantanosas del margen sur de la laguna Machona y la costa arenosa de la barrera (Fig. 1). Según Galaviz-Solís (1980) la abertura de la boca Panteón ha permitido la entrada de las mareas y oleaje a la laguna Machona erosionando la costa NE cayendo la vegetación con un retroceso de la ribera, alterándose las condiciones ecológicas del lugar. TURBIDEZEn la mayor parte del cuerpo de agua la turbidez es bastante elevada; la transparencia promedio es de 0.50 m, debido a la mezcla del agua lagunar con la fluvial cargada de sedimentos. En las zonas de las bocas y canales próximos a ellas, la transparencia llega a los 2 metros. TEMPERATURALa temperatura promedio anual es de 30ºC, estable en la mayor parte del cuerpo de agua y una variación mínima entre la superficial y la del fondo. En las zonas de las bocas, la temperatura varía entre los 25 y 33ºC, dependiendo de las condiciones de flujo y reflujo. SALINIDADLos valores de salinidad muestran un rango que va desde zonas francamente limnéticas hasta salinidades marinas. Los valores mínimos fueron obtenidos en los ríos San Felipe y Santana (0-0.5‰) y los máximos en las bocas Santana y Panteón (34‰). En las figuras 3 y 4 se muestran la distribución de las salinidades en la época de secas (Marzo) y de lluvias (Octubre). En el mes de Marzo (Fig. 3) la mayor parte del cuerpo lagunar muestra salinidades con valores entre 18 a 25‰; las zonas de las desembocaduras de los ríos, la laguna de la Palma, parte del Pajonal y porción SW de la laguna del Carmen tienen salinidades entre 10 y 18‰; por otro lado, en las bocas la salinidad va de 25 a 34‰. En el mes de Octubre (Fig. 4) en la mayor parte del cuerpo de agua la salinidad es de 10 a 18‰; en las desembocaduras de los ríos va de 0.0 a 5‰ y en el Pajonal en su totalidad muestra valores de 5 a 10‰, extendiéndose hacia la parte central de la laguna del Carmen. En las bocas y sus proximidades la salinidad es de 18 a 25‰, 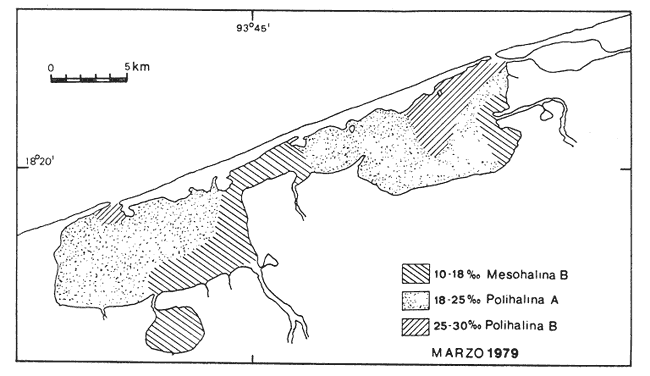 Fig. 3. Distribución de la salinidad en época de secas. 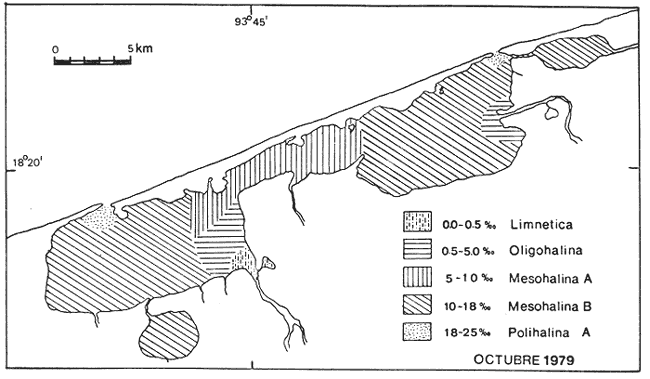 Fig. 4. Distribución de la salinidad en época de lluvias. A rasgos generales, en la época de secas, los valores de la salinidad van de 10 a 30‰ y en la época de lluvias de 0 a 25‰. De acuerdo con los valores obtenidos, con un gradiente que va de la boca Panteón (35‰) disminuyendo hacia el Pajonal (5‰). Este gradiente se debe en gran parte a la mayor actividad de la boca Panteón que la boca Santana. OXÍGENO DISUELTODe acuerdo con Galaviz-Solís (1980), el oxígeno disuelto en la parte central del sistema lagunar varía entre las 5 y 8 p.p.m. En las desembocaduras de los ríos los valores son los máximos (19 p.p.m.) y en las bocas Santana y Panteón los valores mínimos (4 p.p.m.). MATERIALES Y MÉTODOSLos materiales estudiados, así como los datos de parámetros ambientales: temperatura, salinidad y transparencia provienen de dos campañas de muestreos en los meses de marzo y octubre de 1979, correspondiendo a primavera y otoño. Las muestras se obtuvieron de una red de 36 estaciones repartidas en el sistema lagunar (Fig. 1) y en cada una de ellas se obtuvo un volumen de cinco litros de sedimento superficial húmedo, mediante una draga tipo van Veen de dos litros de capacidad, efectuándose los lances necesarios para la cantidad deseada. Los sedimentos obtenidos fueron tamizados en el lugar mediante un tamiz de plástico con una abertura de malla de 1.5 mm. El material resultante fue preservado con formol al 10% neutralizado con borato de sodio y conservado en bolsas de polietileno, debidamente etiquetadas con la fecha, localidad y número de la estación. Los parámetros de la temperatura y salinidad fueron medidos con un salinómetro de inducción Beckman; la transparencia con un disco de Secchi y la profundidad mediante una sondaleza de mano. Para fines cualitativos se efectuaron tres dragados de arrastre con una red biológica con una boca de 300 cm² y malla de 2 cm durante cinco minutos en cada ocasión a una velocidad de dos nudos. Las especies obtenidas se consignan en la tabla 1. Los valores no se consideraron para el análisis de las comunidades ya que el mecanismo de captura no es cuantitativo, como es el caso de los muestreos en las estaciones. Todo el material fue procesado en el laboratorio de Malacología del Instituto de Ciencias del Mar y Limnología. Las muestras fueron lavadas y tamizadas para la identificación y cuantificación de los moluscos presentes. Con los datos obtenidos se elaboraron las tablas y cuadros de los valores totales y parciales de la población necesarios para la interpretación ecológica. Con los ejemplares representativos se elaboró una colección de referencia y se incorporó a la Colección Malacológica del Instituto de Ciencias del Mar y Limnología. Para el análisis ecológico de la población de moluscos, se calcularon la diversidad y afinidad de las poblaciones parciales de bivalvos y gasterópodos así como la total de los moluscos. Para el cálculo del índice de diversidad, se aplicó la fórmula propuesta por Shanon y Wiener (1963): H' = Σ pi (log2pi) En donde Pi es igual al valor de la abundancia relativa total/100. Para cada estación se calculó el índice de diversidad H', la diversidad máxima esperada H'max y la igualdad o equitatividad J'; tanto para bivalvos, gasterópodos así como para la población total de moluscos. Para el análisis de la afinidad se empleó la fórmula de Czechanovski (1913): A=100 2Nc/Na+Nb  TABLA 1 ESPECIES DE MOLUSCOS COLECTADOS MANUALMENTE Y MEDIANTE RED DE ARRASTRE En donde Na es igual al número de especies en la estación a; Nb el número de especies en la estación b y Nc el número de especies comunes entre a y b. Con los valores de afinidad obtenidos se elaboró un diagrama en enrejado confrontando todas las estaciones entre sí para los bivalvos, gasterópodos y población total de los moluscos. RESULTADOS Y DISCUSIÓNDel material obtenido, se identificaron 19,921 ejemplares distribuidos en 2 clases, 5 subclases, 11 órdenes, 34 superfamilias, 49 familias, 73 géneros y 95 especies. ARREGLO SISTEMÁTICOPara el arreglo sistemático, los bivalvos se dispusieron de acuerdo a la clasificación de N. D. Newell (1965) y los gasterópodos según la clasificación propuesta por J. Thiele (1935). Clase GASTROPODA Cuvier, 1797
Subclase Prosobranchia Milne-Edwards, 1848
Orden Archaeogastropoda Thiele, 1929
Superfamilia Fissurellacea Fleming, 1822
Familia Fissurellidae Fleming, 1822
Subfamilia Diodorinae Odhner, 1932
GéneroDiodoraGray, 1821 1) Diodora cayenensis(Lamarck) (lám. 1, Fig. 1) Fissuridea cayenensis Lamarck, 1822. Hist. Nat. Anim. sans Vert., 6(2): 12. Distribución local. En la estación LCM-5, en la laguna Machona. Distribución geográfica. Maryland a Florida, Bermudas, Costas del Golfo de México, hasta Brasil. Habitat y tipo de nutrición. Especie epifaunal, común en zonas de intermareas; hábitos alimenticios micrófagos raspadores. Superfamilia Neritacea Rafinesque, 1815
Familia Neritidae Rafinesque, 1815
Género Neritina Lamarck, 1816
Subgénero Vitta Mörch, 18522)Neritina (Vitta) virginea(Linnaeus) (Lám. 1, Fig. 2) Nerita virginea Linnaeus,, 1758. Syst. Nt., 10 Ed., :778. Distribución local. En las estaciones LCM-2 y LCM-4 de la laguna Redonda. En la laguna Machona: LCM-10, LCM-II, LCM-13 y LCM-14. En la laguna del Carmen: LCM-20, LCM-21, LCM-22, LCM-24, LCM-32, LCM3-3 y LCM-36. En el arrastre A-4. Distribución geográfica. Florida, Golfo de México, Bermudas, Antillas hasta Brasil. Habitat y tipo de nutrición. Especie epifaunal entre la vegetación. Muy frecuente en zonas de intermareas y aguas salobres; nutrición micrófaga raspando la vegetación. Orden Mesogastropoda Thiele, 1925
Superfamilia Rissoacea Gray, 1847
Familia Rissoidae Gray, 1847
GéneroCingulaFleming, 1828
SubgéneroMicrodochusRedher, 1943 3) Cingula (Microdochus) floridana(Redher) (Lám. 1, Fig. 3) Microdochus floridanus Redher, 1943. Proc. U. S. Nat. Mus., 93 (3161): 193, lám. 20, fig. 6. Distribución local. En la estación LCM-17 de la laguna Machona y en las estaciones LCM-21 y LCM-22 de la laguna del Carmen. Distribución geográfica. Florida, Golfo de México y parte de las Antillas. Habitat y tipo de nutrición. Especie epifaunal, desde la zona de mareas hasta 60 metros de profundidad. Nutrición micrófaga. Familia Vitrinellidae Bush, 1897
Subfamilia Vitrinellinae Bush, 1897
Género Vitrinella C. B. Adams, 1850
4) Vitrinella helicoideaC. B. Adams (Lám. 1, Fig. 4) Vitrinella helicoidea C. B. Adams, 1850. Monograph. ofVitrinella:9. Distribución local. En la estación LCM-5 de la laguna Machona y en la estación LCM-22 de la laguna del Carmen. Distribución geográfica. Carolina del Norte a Florida, Golfo de México, Antillas y Bermudas. Habitat y tipo de nutrición. Especie epifaunal sobre arena y entre rocas; aguas someras. Nutrición micrófaga de partículas orgánicas depositadas sobre el sustrato. 5)Vitrinella multistriata(Verrill) (Lám. 1, Fig. 5) Ethalia multistriata Verrill, 1884. Trans. Conn. Ac. Art. Sci., 6(6): 142-43. Distribución local. En la estación LCM-22 de la laguna del Carmen. Distribución geográfica. Carolina del Norte a las Antillas y Golfo de México. Habitat y tipo de nutrición. Forma epifaunal sobre arenas; en aguas someras marinas y lagunares. Nutrición micrófaga de materia orgánica depositada sobre el sustrato.
SubgéneroVitrinella. s. s.
6)Vitrinella (Vitrinella) floridanaPilsbry y McGinty (Lám. 1, Fig. 6) Vitrinella (Vitrinella) floridanaPilsbry y McGinty, 1946. Nautilus,60(1): 16, lám. 2, figs. 4, 4a. Distribución local. En las estaciones LCM-19 y LCM-21 de la laguna del Carmen; en la estación LCM-4 de la laguna Redonda y en el arrastre A-4. Distribución geográfica. Florida y Golfo de México. Habitat y tipo de nutrición. Especie epifaunal, entre rocas y aguas someras marinas y lagunares. Nutrición micrófaga de materia orgánica depositada sobre el sustrato. GéneroCyclostremiscusPilsbry y Olsson, 1945
SubgéneroPonocyclusPilsbry, 1953
7) Cyclostremiscus (Ponocyclus) Pentagonus(Gabb) ( Lám. 1, Fig. 7) Cyclostrema pentagona Gabb, 1873. Trans. Amer. Phil. Soc., 15: 243. Distribución local. En las estaciones LCM-20, LCM-21 y LCM-22 de la laguna del Carmen y en el arrastre A-4. Distribución geográfica. Carolina del Norte a Florida, Golfo de México y Antillas. Habitat y tipo de nutrición. Forma epifaunal, en zonas de rompientes y lagunas costeras. Nutrición herbívora. SubfamiliaTeinostomatinaeCossmann, 1917
GéneroTeinostomeH. y A. Adams, 1854
8) Teinostoma cryptospira (Verrill) (Lám. 1, Fig. 8) Rotella cryptospira Verrill, 1884. Trans Conn. Ac. Art. Sci.,6 (6): 241-42. Distribución local. En la estación LCM-4 de la laguna Redonda y en las estaciones LCM-20, LCM-21, LCM-22 y LCM-24 de la laguna del Carmen. Distribución geográfica. Carolina del Norte, Golfo de México y Antillas. Habitat y tipo de nutrición. Forma epifaunal sobre arenas y entre rocas, en zonas de mareas bajas. Nutrición de partículas orgánicas depositadas sobre el sustrato. 9) Teinostoma parvicallumPilsbry y McGinty (Lám. 1, Fig. 9) Teinostoma parvicallum pilsbry y Mc Ginty, 1945. Nautilus, 59 (1): 4. Distribución local. En la estación LCM-3 de la laguna Redonda. Distribución geográfica. Florida y Golfo de México. Habitat y tipo de nutrición. Forma epifaunal en aguas someras marinas y lagunares. Nutrición de partículas orgánicas depositadas sobre el sustrato. Familia Cyclostremellidae D. R. Moore, 1966
GéneroCyclostremellaBush, 1897
10)Cyclostremella humilisBush (Lám. 2, Fig. 1) Cyclostremella humilis Bush, 1897. Trans. Conn. Ac. Art. Sci.,10(1) :140. Distribución local. En la estación LCM-22 de la laguna del Carmen. Distribución geográfica. Carolina del Norte al Golfo de México y Antillas. Habitat y tipo de nutrición. Especie epifaunal sobre arenas en zonas de mareas. Forma ectoparásita. Familia Hydrobiidae Stimpson, 1865
GéneroHydrobiaHartman, 1821
11)Hydrobia totteniMorrison (Lám. 2, Fig. 2) Hydrobia totteni Morrison, 1954. J. Wash. Ac. Sci., 441 (1): 26. Distribución local. En la estación LCM-17 de la laguna Machona y en las estaciones LCM-20, LCM-21 y LCM-22 de la laguna del Carmen. Distribución geográfica.Península del Labrador al Golfo de México. Habitat y tipo de nutrición.Especie epifaunal; abundante en aguas someras y estancadas. Nutrición micrófaga, asociada con algas verdes. Género Littoridina Eydoux y Souleyet, 1852 Subgénero Texadina Abbott y Ladd, 1951 12) Littoridina (Texadina) sphinctostoma Abbott y Ladd (Lám. 2, Fig. 3) Littoridina (Texadina) sphinctostomaAbott y Ladd, 1951. J. Wash. Ac. Sci., 41 (10: 335, fig. 12. Distribución local. En las estaciones LCM-I, LCM-2, LCM3 y LCM-4 de la laguna Redonda. En las estaciones LCM-6, LCM-7, LCM-8, LCM-9, LCM-10, LCM-11, LCM-12, LCM-13, LCM-14, LCM-15, LCM-16 y LCM-17 en la laguna Machona. En las estaciones LCM-19, LCM-20, LCM-21, LCM-22, LCM-24, LCM-26, LCM-34 y LCM-35 en la laguna del Carmen. En el arrastre A-4. Distribución geográfica. Costas del Golfo de México. Habitat y tipo de nutrición. Especie epifaunal, muy frecuente en aguas dulces y salobres de zonas lagunares y estuarinas con fondos limoarenosos. Alimentación de partículas orgánicas depositadas sobre el sustrato. Superfamilia Cerithiacea Fleming, 1822
Familia Cerithidae Fleming, 1822
Subfamilia Diastominae Cossmann, 1895
GéneroAlabaH. y A. Adams, 1853
13) Alaba incerta(d'Orbigny) (Lám. 2, Fig. 4) Rissoa incerta d'Orbigny, 1842.In: De la Sagra Ed., Hist. Fis. Pol. Nat. Isla de Cuba, 1: 218. Distribución local. En la estación LCM-22 de la laguna del Carmen. Distribución geográfica. Florida, Golfo de México, Bermudas, Antillas hasta Brasil. Habitat y tipo de nutrición. Forma epifaunal, común entre pastos deThalassia y sobre fondos arenosos. Nutrición herbívora. Subfamilia Bittiinae Cossmann, 1906
GéneroCerithiopsisForbes y Hanley, 1849
14)Cerithiopsis greeni(C. B. Adams) (Lám. 2, Fig. 5) Cerithium greeniC. B. Adams, 1839. Bost. J. Nat. Hist., 2 (2): 287, lám. 4, fig. 12. Distribución local. En las estaciones LCM-19, LCM-21 y LCM-22 en la laguna del Carmen. Distribución geográfica. Del Cabo Cod a Florida, Bermudas, Golfo de México hasta Brasil. Habitat y tipo de nutrición. Especie epifaunal de aguas costeras y lagunares. Nutrición carnívora. GéneroDiastomaDeshayes, 1850
SubgéneroBittiumGray, 1847
15) Diastoma (Bíttium) varium(Pfeifer) (Lám. 2, Fig. 6) Cerithium varium Pfeifer, 1840. Arch. f. Natur., 6 (1): 256-57. Distribución local. En la estación LCM-3 de la laguna Redonda. En las estaciones LCM-19, LCM-21, LCM-22, LCM-32 y LCM-33 de la laguna del Carmen. En la estación LCM-28 de la laguna de la Palma. Distribución geográfica. Maryland a Florida, Costas del Golfo de México hasta Brasil. Habitat y tipo de nutrición. Especie epifaunal entre la vegetación sumergida de bahías y lagunas costeras. Alimentación carnívora. Familia Triphoridae Gray, 1847
Subfamilia Triphorinae Gray, 1847
GéneroTriphoraBlainville, 1828
16) Triphora nigracincta(C. B. Adams) (Lám. 2, Fig. 7) Cerithium nigrocinctum C. B. Adams, 1839. Bost. J. Nat. Hist., 2 (2): 286, lám. 4, fig. 11. Distribución local. En las estaciones LCM-19, LCM-21 y LCM-22 de la laguna del Carmen. Distribución geográfica. Carolina del Norte, Bermudas, Golfo de México, Antillas hasta Brasil. Habitat y tipo de nutrición. Forma epifaunal sobre Iodos y arenas; aguas someras salobres. Nutrición carnívora y detritófaga. 17) Triphora triserialis(Dall) (Lám. 2, Fig. 8) Triphora triserialis Dall. 1881. Bull. Mus. Comp. Zool., 9(2): 84. Distribución local. En la estación LCM-5 de la laguna Machona. Distribución geográfica. Carolina del Norte, Antillas y Golfo de México. Habitat y tipo de nutrición. Especie epifaunal sobre fangos y arenas de aguas salobres someras. Nutrición carnívora. Familia Potamididae H. y A. Adams, 1854
Subfamilia Potamidinae H. y A. Adams, 1854
GéneroCerithideaSwainson, 1840
SubgéneroCerithideopsisThiele, 1929
18) Cerithidea(Cerithideopsis) Pliculosa(Menke) (Lám. 2, Fig. 9) Cerithium pliculosum Menke, 1829. Verz. Conchy-Samm. Pyremont, 2 Ed., :27. Distribución local. En las estaciones LCM-9, LCM-10, LCM-13, LCM-14, LCM-16 y LCM-17 en la laguna de Machona. En las estaciones LCM-18, LCM-19, LCM-20, LCM-21, LCM-22, LCM-24, LCM-26, LCM-32, LCM-33, LCM-34, LCM-35 y LCM-36 en la laguna del Carmen, en las estaciones LCM-28 y LCM-29 en la laguna de la Palma. En el arrastre A-4. Distribución geográfica. Golfo de México, Antillas y América Central. Habitat y tipo de nutrición. Epifaunal, frecuente en aguas someras marinas y salobres. Alimentación de materia orgánica depositada en el sustrato. Superfamilia Strombacea Rafinesque, 1815
Familia Strombidae Rafinesque, 1815
GéneroStrombusLinnaeus, 1758
19)Strombus pugilisLinnaeus (Lám. 2, Fig. 10) Strombus pugilis Linnaeus, 1758. Syst. Nat., 10 Ed.: 744. Distribución local.Colectado a mano en las playas próximas a la boca Panteón. Distribución geográfica. Sur de Florida, Antillas, Costas del Golfo de México hasta Brasil. Habitat y tipo de nutrición. Especie epifaunal sobre sustratos arenosos y cerca de pastos marinos. Alimentación herbívora. Superfamilia Epitoniacea S. S. Berry, 1910
Familia Epitoniidae S. S. Berry, 1910
GéneroEpitoniumRöding, 1798
SubgéneroGyroscalade Boury, 1887
20) Epitonium (Gyroscala) rupicola(Kurtz) (Lám. 2, Fig. 11) Scalaria rupicola Kurtz, 1860. Cat. Rec. Mar. Moll. Port land Mus., :7. Distribución local. En la estación LCM-11 de la laguna Machona y en laLCM-24 de la laguna del Carmen. Distribución geográfica. Cabo Cod a Florida y costas del Golfo de México. Habitat y tipo de nutrición. Forma epifaunal en aguas someras salinas a salobres. Nutrición carnívora. Superfamilia Calyptraeacea Blainville, 1824
Familia Calyptraeidae Blainville, 1824
Subfamilia Crepidulinae Fleming, 1822
GéneroCrepidulaLamarck, 1799
SubgéneroIanacusMörch, 1852
21) Crepidula (Ianacus) planaSay (Lám. 3, Fig. 1) Crepidula planaSay, 1822. J. Ac. Nat. Sci. Phila., 2 (1): 226. Distribución local.En las estaciones LCM-2 y LCM-4 de la laguna Redonda. En las estaciones LCM-6, LCM-7, LCM12, LCM-13 y LCM-17 de la laguna Machona. En las estaciones LCM-19, LCM-20, LCM-21, LCM-26, LCM-35 y LCM-36 de la laguna del Carmen. Distribución geográfica.Canadá al Golfo de México, Bermudas, Antillas hasta Brasil. Habitat y tipo de nutrición.Especie epifaunal sobre objetos duros, en aguas marinas someras y salobres. Nutrición por filtración de partículas orgánicas en suspensión. Superfamilia Naticacea Gray, 1840
Familia Naticidae Gray, 1840
Subfamilia Naticinae Swainson, 1840
GéneroNaticaScopoli, 1777
SubgéneroCryptonaticaDall, 1892
22) Natica (Cryptonatica) pusillaSay (Lám. 3, Fig. 2) Natica pusilla Say,1822. J. Ac. Nat. Sci. Phila.,2 (1) 257. Distribución local. En la estación LCM-27 de la laguna del Carmen. Distribución geográfica. Maine a Florida, Golfo de México, Antillas hasta Brasil. Habitat y tipo de nutrición. Forma infaunal entre arenas, en aguas someras marinas y salobres. Nutrición carnívora Superfamilia Cymatiacea Iredale, 1913
Familia Cymatiidae Iredale, 1913
GéneroCymatiumRöding, 1798
SubgéneroSeptaPerry, 1810 23) Cymatium (Septa) pileare(Linnaeus) (Lám. 3, Fig. 3) Triton pileareLinnaeus, 1758. Syst. Nat., 10 Ed., :749. Distribución local. Colectada a mano en la playa próxima a la boca Panteón Distribución geográfica. Carolina del sur al Golfo de México, Bermudas, Antillas hasta Brasil. del Golfo de California hasta Panamá. Habitat y tipo de nutrición.Especie semifaunal en aguas someras. Forma carnívora. SubgéneroCymatritonClench y Turner, 1957
24)Cymatium (Cymatriton) nicobaricum(Röding) (Lám. 3, Fig. 4) Triton nicobaricum Rödng, 1798. Cat. Mus. Bolten., :126. Distribución local. Colectada a mano en la playa próxima a la boca Panteón. Distribución geográfica. Florida, Golfo de México, Antillas hasta Brasil, Costas Indopacíficas. Habitat y tipo de nutrición. Especie epifaunal en zonas de mareas de mares cálidos. Nutrición carnívora. SubgéneroGutturniumMörch, 1852
25)Cymatium (Gutturnium) muricinum(Röding) (Lám. 3, Fig. 5) Triton muricinumRöding, 1798. Cat. Mus. Bolten., :133. Distribución local. Colectada a mano en las playas próximas a la boca Panteón. Distribución geográfica. Florida, Golfo de México, Antillas hasta Brasil. Costas Indopacíficas. Habitat y tipo de nutrición. Especie epifaunal en la zona intermareal de mares cálidos. Alimentación de tipo carnívora.
Orden Neogastropoda Wenz, 1938 Superfamilia Muricacea Da Costa, 1776 Familia Thaidinaea Suter, 1913
GéneroThaisRöding, 1798 SubgéneroStramonitaSchumacher, 1817 26) Thais ( Stramonita) haemastoma floridana(Conrad) Lám. 3, Fig. 6) Purpura Haemastoma floridanaConrad, 1837. J. Ac. Nat. Sci. Phila., 7: 265, lám. 20, fig. 21. Distribución local.En el arrastre A-4 en la boca Panteón. Distribución geográfica.Carolina del Norte a Florida, Costas del Golfo de México y Caribe. Habitat y tipo de nutrición.Forma epifaunal sobre rocas y bancos de ostión, en aguas someras. Hábitos alimenticios carnívoros. Superfamilia Buccinacea Rafinesque, 1815 Familia Buccinidae Rafinesque, 1815 Subfamilia Pisaniinae Tryon, 1880 GéneroAntilloposWoodring, 1928 27) Antillophos candei (d'Orbigny) (Lám. 3, Fig. 7) Cancellaria candei d' Orbigny, 1842.In: De la Sagra Ed., Hist. Fis. Pol. Nat. de la Isla de Cuba, 2:129, lám. 2, figs. 23-25. Distribución local.En la estación LCM-4 de la laguna Redonda. En las estaciones LCM-32 y LCM-35 de la laguna del Carmen. Distribución geográfica. Carolina del Norte a Florida, Golfo de México, Antillas hasta Brasil. Habitat y tipo de nutrición.Especie epifaunal de fondos arenosos y aguas someras. Nutrición carnívora y carroñera. Familia Columbellidae Swainson, 1840 GéneroAnachisH. y A. Adams, 1853 SungéneroCostanachis Sacco, 1890 28) Anachis (Costanachis) semiplicata (Stearns) (Lám. 3, Fig. 8) Columbella semiplicataSterns, 1873. Proc. Ac. Nat. Sci. Philla.,25:344. Distribución local.En la estación LCM-2 de la laguna Redonda. Distribución geográfica.Florida, Golfo de México, Bermudas hasta Brasil y Uruguay. Habitat y tipo de nutriciónEpifaunal, frecuentemente sobre la vegetación, en bahías someras y lagunas. Nutrición carnívora. GéneroMitrellaRisso, 1826 SubgéneroAstyrisH. y A. Adams, 1853 29) Mitrella (Astyris) lunata (Say) (Lám. 3, Fig. 9) Nassa lunataSay, 1826. J. Ac. Nat. Sci. Phila., 5(1): 213. Distribución local.En la estación LCM-4 de la laguna Redonda y en el arrastre A-4 en la boca Panteón. Distribución geográficaMassachusetts a Florida, Bermudas, Golfo de México hasta Brasil. Habitat y tipo de nutriciónEspecie epifaunal sobre fondos arenosos y entre la vegetación, en aguas marinas y salobres. Nutrición carnívora. Familia Melongenidae Gill, 1867 GéneroMelongenaShumacher, 1817 SubgéneroMelongenaShumacher, 1817 30) Melongena (Melongena) melongena(Linnaeus) (Lám. 3, Fig. 10) Murex melongena(Linnaeus, 1758. Syst. Nat., 10 Ed., : 751 Distribución local.En el arrastre A-44 en la boca Panteón. Distribución geográfica.Golfo de México, Antillas y América del Sur. Habitat y tipo de nutrición.Especie semifaunal en aguas someras. Nutrición carnívora y necrófaga. Subfamilia Busiconinae Finlay y Marwick, 1937 GéneroBusyconRöding, 1798 SubgéneroFulguropisE. S. Marks, 1950 31) Busycon (Fulguropsis spiratum plagosum (Conrad) (Lám. 3, Fig. 11) Murex spiratum plagosum Conrad, 1863. Proc. Ac. Nat. Sci. Phila., 14: 583. Distribución local.Especie colectada a mano en la boca Panteón. Distribución geográfica. Costas del golfo de México. Habitat y tipo de nutrición.Forma infaunal en sustratos arenosos. Nutrición carnívora y carroñera. Familia Nassariidae Iredale, 1916 GéneroNassariusDuméril, 1806 SubgéneroNassariusDuméril, 1806 32) Nassarius (Nasarius) acutus (Say) (Lám. 4, Fig. 1) Nassa acutus Say, 1822. J. Ac. Sci. Phila., 2 (1): 234. Distribución local.En las estaciones LCM-7 y lcm-11 de la laguna Machona. En las estaciones LCM-26, LCM-33 Y LCM-34 de la laguna del Carmen. Distribución geográfica.Carolina del Norte a Florida y Golfo de México. Habitat y tipo de nutrición.Especie seminfaunal en sustratos arenosos y fangosos, en bahías someras y lagunas. Nutrición carnívora y en ocasiones carroñera. 33) Nassarius (Nassarius) vibex (Say) Nassa vibexSay, 1822. J. Ac. Nat. Sci. Phila.,2(1): 231. Distribución local.En las estaciones LCM-15 y LCM-16 de la laguna Machona. En las estaciones LCM-19, LCM-20, LCM-21, LCM-22, LCM-24, LCM-32 y LCM-36 de la laguna del Carmen. Distribución geográfica.Cabo Cod al Golfo de México y Antillas. Habitat y tipo de nutrición.Especie seminfaunal en sustratos arenosos y fangosos de bahías someras y lagunas. Nutrición carnívora y ocasionalmente carroñera. Superfamilia Volutacea Rafinesque, 1815 Familia Olividae Latreille, 1825 Subfamilia Olivellinae Troschel, 1869 GéneroOlivellaSwainson, 1831 SubgéneroNiteoliviaOlsson, 1956 34) Olivella (Niteoliva) minuta(Link) Lám. 4, Fig.3) Oliva monutaLink, 1807. Bersch. Natur.,4:13. Distribución local.En las estaciones LCM-20, LCM-21, LCM-22, LCM-23, LCM-27, LCM-32 y Lcm-33 de la laguna del Carmen. En el arrastre A-4 en la boca Panteón. Distribución geográfica.Golfo de México, Caribe, Antillas hasta Brasil. Habitat y tipo de nutrición.Especie infaunal en fondos arenosos, en aguas someras. Alimentación carnívora y carroñera Superfamilia Conacea Rafinesque, 1815 Familia Turridae H. y A. Adams, 1853 Subfamilia Mangelidae Fischer, 1887 GéneroPyrgocytharaWoodring, 1928 35) Pyrgocythara plicosa(C. B. Adams) (Lám. 4, Fig. 4 ) Pleurotoma plicosaC. B. Adams, 1850. Contr. Conch.,1 (3): 54 Distribución local.Colectada a mano en la playa de la boca Panteón Distribución geográficaCabo Cod a Florida y Golfo de México Habitat y tipo de nutrición. Especie epifaunal sobre lodos y entre la vegetación en lagunas costeras. Nutrición de tipo carnívora. Subclase Opisthobranchia Milne-Edwards, 1848
Orden Pyramidelloida Gray, 1840
Superfamilia Pyramidellacea Gray, 1840
Familia Pyramidellidae Gray, 1840
GéneroPyramidellaLamarck, 1799
36) Pyramidella crenulata(Holmes) (Lám. 4, Fig. 5) Obeliscus crenulatus Holmes, 1859. Post. Plio. Fos. S. Caorl., : 88, láb. 13, figs. 14, l4a. Distribución local. En el arrastre A-4 en la boca Panteón. Distribución geográfica. Carolina del Sur al Golfo de México y Antillas. Habitat y tipo de nutrición. Especie epifaunal en Iodos y entre pastos; en aguas someras marinas y salobres. Nutrición ectoparásita. 37) Pyramidella fusca(C. B. Adams) (Lám. 4, Fig. 6) Pyramis fuscaC. B. Adams, 1839. Bost. J. Nat. Hist.,2 (2): 282, lám. 4, fig. 9. Distribución local. En la estación LCM-4 de la laguna Redonda. En las estaciones LCM-18, LCM-19 y LCM-32 de la laguna del Carmen y en la estación LCM-30 de la laguna de la Palma. Distribución geográfica. Carolina del Sur al Golfo de México y Antillas. Habitat y tipo de nutrición. Especie epifaunal, en aguas someras marinas y salobres. Nutrición ectoparásita. Subfamilia Odostomiinae Pelseneer, 1928
GéneroAdostomiaFleming, 1813
38) Odostomia weberiMorrison (Lám. 4, Fig. 7) Odostomia weberi Morrison, 1965. Proc. Biol. Soc. Wash., 78: 221, fig. 3. Distribución local. En la estación LCM-4 de la laguna Redonda. En las estaciones LCM-22, LCM-31, LCM-32 y LCM-35 de la laguna del Carmen. En la estación LCM-30 de la laguna de la Palma. Distribución geográfica. Costas del Golfo de México. Habitat y tipo de nutrición. Especie epifaunal, en aguas salobres. Nutrición ectoparásita. SubgéneroMenesthoMöller, 1842
39) Odostomia (Menestho) impressa (Say) (Lám. 4, Fig. 8) Turritella impressa Say, 1822. J. Ac. Nat. Sci. Phila., 2 (1): 244. Distribución local En la estación LCM-4 de la laguna Redonda. En las estaciones LCM-10, LCM-12, LCM-13, LCM-15 y LCM-17 en la laguna de Machona. En las estaciones LCM-20, LCM-21, LCM-22 y LCM-36 de la laguna del Carmen. En el arrastre A-4 de la boca Panteón. Distribución geográfica.Massachusetts a Florida y Golfo de México. Habitat y tipo de nutrición. Especie epifaunal, frecuente en los bancos de ostión. Nutrición ectoparásita. SubgéneroOdostomiaFleming, 1817 40) Odostomia (Odostomia) laevigata(d'Orbigny) (Lám. 4, Fig. 9) Odontostoma laevigata d'Orbigny, 1842.In: De la Sagra Ed., Hist. Fis. Pol. Nat. de la Isla de Cuba, 1: 227. Distribución local. En las estaciones LCM-18, LCM-21, LCM-24, LCM-33 y LCM-36 de la laguna del Carmen y en la estación LCM-10 de la laguna Machona. Distribución geográfica. Carolina del Norte a Florida, Golfo de México, Antillas hasta Brasil. Habitat y tipo de nutrición. Especie epifaunal, en aguas marinas y salobres someras. Nutrición ectoparásita. Subfamilia Turbonillinae Simroth, 1907
GéneroTurbonillaRisso, 1826
41) Turbonilla abruptaBush (Lám. 4, Fig. 10) Turbonilla abrupta Bush, 1899. Proc. Ac. Nat. Sci. Phila., 51: 168, lám. 8, fig. 4. Distribución local. En la estación LCM-10 de la laguna Machona. En las estaciones LCM-18-, LCM-20, LCM-21, LCM-22, LCM-24 y LCM32 de la laguna del Carmen. En el arrastre A-4. Distribución geográfica. Golfo de San Lorenzo al Golfo de México, Antillas hasta Brasil. Habitat y tipo de nutrición. Especie epifaunal, en aguas someras marinas y salobres. Nutrición ectoparásita. 42) Turbonilla interrupta(Totten) (Lám. 4, Fig. 11) Turritella interrupta Totten, 1835. Amer. J. Sci., 28 (2): 352, fig. 7. Distribución local. En la estación LCM-10 de la laguna Machona. Distribución geográfica. Maine al Golfo de México, Antillas hasta Brasil. Habitat y tipo de nutrición. Especie epifaunal, frecuente en aguas someras marinas y salobres. Ectoparásita. Orden Cephalaspidea Fischer, 1883
Superfamilia Acteonacead'Orbigny, 1842
Familia Acteonidaed'Orbigny, 1842
GéneroActeonMontfort, 1810
43) Acteon punctostriatus(C. B. Adams) (Lám. 4, Fig. 12) Tornatella punctostriata C. B. Adams, 1840. J. Bost. Soc. Nat. Hist., 3 (3) : 323, lám. 3, fig. 9. Distribución local. En las estaciones LCM-I, LCM-2, LCM3 y LCM-4 de la laguna Redonda. En la estación LCM-31 de la laguna del Carmen. Distribución geográfica. Cabo Cod a Florida, Golfo de México y Antillas. Habitat y tipo de nutrición.Especie infaunal, en bahías y lagunas costeras. Hábitos alimenticios carnívoros. Familia Acteocinidae pilsbry, 1921
GéneroActeocinaGray, 1847
44) Acteocina canaliculata (Say) (Lám. 4, Fig. 15) Volvaria canaliculata Say, 1826. J. Ac. Nat. Sci. Phila., 5 (1): 21 1. Distribución local. En las estaciones LCM-1 LCM-2, LCM3 y LCM-4 de la laguna Redonda. En las estaciones LCM6, LCM-8, LCM-9, LCM-10, LCM-11, LCM-12, LCM-13, LCM-14, LCM-15, LCM-16 y LCM-17 de la laguna Machona. En las estaciones LCM-18, LCM-19, LCM-20, LCM-21, LCM-22, LCM-23, LCM-24, LCM-26, LCM-27, LCM-31, LCM-32, LCM-33, LCM-34, LCM-35 y LCM-36 de la laguna del Carmen. En la estación LCM-25 del Pajonal y en las LCM-28 y LCM-30 de la laguna de la Palma. Distribución geográfica, Nueva Escocia a Florida, Golfo de México, Antillas hasta Brasil. Habitat y tipo de nutrición. Especie epifaunal en bahías y lagunas costeras salobres. Alimentación de tipo carnívoro. Superfamilia Bullacea Rafinesque, 1815
Familia Bullidae Rafinesque,1815
GéneroBullaLinnaeus, 1758
45) Bulla striataBruguière (Lám. 4, Fig. 13) Bulla striata Bruguiére, 1792. Hist. Nat. Vers. In: Ency. Meth., 1(2): 572. Distribución local. En la estación LCM-11 de la laguna Machona. En las estaciones LCM-19 y LCM-21de la laguna del Carmen. Distribución geográfica. Bermudas, Golfo de México, Antillas hasta Brasil. Habitat y tipo de nutrición. Especie seminfaunal en lagunas y bahías someras. Nutrición carnívora. Familia Atyidae Thiele, 1926
GéneroHaminoeaTurton y Kingston, 1830
46) Haminoea succinea (Conrad)(Lám. 4, Fig. 14) Bulla succinea Conrad, 1846. Proc. Ac. Nat. Sci. Phila., 3 (1): 26, lám. 1, fig. 5. Distribución local. En las estaciones LCM-1 1 y LCM-14 de la laguna de Machona. En las estaciones LCM-19, LCM20, LCM-21, LCM-22, LCM-24 y LCM-32 de la laguna del Carmen. Distribución geográfica. Florida, Golfo de México, Bermudas, Antillas hasta Brasil. Habitat y tipo de nutrición. Especie seminfaunal, en aguas someras y protegidas. Alimentación de tipo carnívora, Clase BIVALVIA Linnaeus, 1758
Subclase Palaeotaxodonta Korobkov, 1954
Orden Nuculoida Morton, 1963
Superfamilia Nuculanacea Meek, 1864
Familia Nuculanidae Meek, 1864
GéneroNuculanaLink, 1807
SubgéneroSaccellaWoodring, 1925
47) Nuculana (Saccella) acuta(Conrad) (Lám. 5, Fig. 1) Nucula acuta (Conrad, 1831). Amer. Mar. Conch., : 32, lám. 6, fig. 3. Distribución local. En la estación LCM-21 de la laguna del Carmen. Distribución geográfica. Cabo Cod al Golfo de México, hasta Brasil. Habitat y tipo de nutrición.Especie infaunal en fondos arenosos, aguas someras. Nutrición de partículas orgánicas depositadas en el sustrato. Subclase Pteriomorphia Beurlen, 1944
Orden Arcoida Stoliczka, 1871
Superfamilia Arcacea Lamarck, 1809
Familia Arcidae Lamarck, 1809
Subfamilia Arcinae Lamarck, 1809
GéneroBarbatiaGray, 1842
SubgéneroAcarGray, 1857
48) Barbatia (Acar) domingensis(Lamarck) (Lám. 5, Fig. 2) Arca domingensis Lamarck, 1819. Hist. Nat. Anim. Sans Vert., 6: 40. Distribución local. En el arrastre A-4 en la boca Panteón. Distribución geográfica. Carolina del Norte, Golfo de México, Bermudas hasta Brasil. Habitat y tipo de nutrición. Especie epifaunal en fondos arenosos y aguas someras. Alimentación de partículas orgánicas en suspensión. Subfamilia Anadarinae Reinhart, 1935
GéneroAnadaraGray, 1847
SubgéneroCunearcaDall, 1898
49) Anadara (Cunearca) brasiliana(Lamarck) (Lám. 5, Fig. 3) Arca brasilianaLamarck, 1819. Hist. Nat. Anim. Sans Vert., 6. 44. Distribución local. En la estación LCM-5 en la laguna Machona. En el arrastre A-3 en la boca Santana. Distribución geográfica. Costas del Golfo de México, Antillas hasta Brasil. Habitat y tipo de nutrición. Especie epifaunal de fondos arenosos y aguas someras. Alimentación de partículas orgánicas en suspensión. 50)Anadara (Cunearca) chemnitzii(Philippi) (Lám. 5, Fig. 4) Arca chemnitzii Philippi, 1851. Zeit. f. Malak., 8 (4): 50. Distribución local. En el arrastre A-3 de la boca Santana. Distribución geográfica. Golfo de México, Antillas hasta Brasil. Habitat y tipo de nutrición. Especie poco común, epifaunal en fondos arenosos y aguas someras. Alimentación de partículas orgánicas en suspensión. SubgéneroLunarcaGray, 1857
51) Anadara (Lunarca) ovalis(Bruguière) (Lám. 5, Fig. 5) Arca ovalis Bruguière, 1789. Hist. Nat. Vers.,In: Ency... Meth.,1(1) : 110. Distribución local. En la estaciónLCM-20 de la laguna del Carmen y en el arrastre A-4 de la boca Panteón. Distribución geográfica. Cabo Cod a Costas del Golfo de México, Antillas hasta Brasil. Habitat y tipo de nutrición. Especie infaunal superficial, en fondos arenosos, aguas someras. Nutrición de partículas orgánicas en suspensión. Subfamilia Striarcinae MacNeil, 1938
GéneroArcopsisVon Koenen, 1885
52) Arcopsis adamsi(Dall) (Lám. 5, Fig. 6) Arca adamsi Dall, 1886. Bull. Mus. Comp. Zool., 12 (6): 243. Distribución local. En el arrastre A-4 en la boca Panteón. Distribución geográfica. Carolina del Norte, Golfo de México, Bermudas hasta Brasil. Habitat y tipo de nutrición. Especie epifaunal, frecuentemente fijos sobre rocas, en aguas poco profundas. Nutrición de partículas orgánicas en suspensión. Familia Noetiidae Stewart, 1930
Subfamilia NoetiinaeStewart, 1930
GéneroNoetiaGray, 1857
SubgéneroEontiaMacNeil, 1938
53) Noetia (Eontia) ponderosa(Say) (Lám. 5, Fig. 7) Arca ponderosa Say, 1822. J. Ac. Nat. Sci. Phila.,2(1): 267. Distribución local. En el arrastreA-4 en la boca Panteón. Distribución geográfica. Virginia a Florida, Golfo de México. Habitat y tipo de nutrición. Especie infaunal superficial, entre arenas, aguas marinas someras. Nutrición de partículas orgánicas en suspensión. Superfamilia Limopsacea Dall, 1895
Familia Glycymerididae Newton, 1922
GéneroGlycymerisDa Costa, 1778
SubgéneroTucetonaIredale, 1931
54) Glycymeris (Tucetona) Pectinata (Gmelin) (Lám. 5, Fig. 8) Arca pectinata Gmelin, 1791. Syst. Nat., 13 Ed., (6): 3313. Distribución local.Colectada a mano en la playa próxima a la boca Panteón. Distribución geográfica. Carolina del Norte al Golfo de México, Antillas hasta Brasil. Habitat y tipo de nutrición. Especie infaunal en sustratos arenosos, en aguas marinas someras. Nutrición suspensívora. Orden Mytiloidea Férussac, 1822
Superfamilia Mytililacea Rafinesque, 1815
Familia Mytilidae Rafinesque, 1815
Subfamilia Mytilinae Rafinesque, 1815
GéneroBrachidontesSwainson, 1840
SubgéneroHormomyaMörch, 1853
55) Brachidontes (Hormomya) exustus(Linnaeus) (Lám. 6, Fig. 1) Mytilus exustus Linneaeus, 1758. Sist. Nat., 10 Ed., : 705. Distribución local. En las estaciones LCM-2 y LCM-4 de la laguna Redonda. En las estaciones LCM-6, LCM-7 y LCM-15 de la laguna Machona. En las estaciones LCM-18, LCM-19, LCM-21, LCM-22 y LCM-36 de la laguna del Carmen y en el arrastre A-2 de la laguna de la Palma. Distribución geográfica. Carolina del Norte al Golfo de México, Antillas hasta Brasil y Uruguay. Habitat y tipo de nutrición. Forma epifaunal sobre rocas y bancos ostrícolas, fijos mediante un biso; muy frecuente en aguas someras salobres. Nutrición suspensívora. GéneroIschadiumJukes-Brown, 1905
56) Ischadium recurvus(Rafinesque) (Lám. 6, Fig. 2) Mytilus recurvus Rafinesque, 1820. Ann. Gen. Sci. Phys. Bruxelles, 5: 320. Distribución local. En las estaciones LCM-6, LCM-13 y LCM-15 de la laguna Machona. En LCM-20, LCM-22 y LCM-24 en la laguna del Carmen. Distribución geográfica. Cabo Cod al Golfo de México y Antillas.. Habitat y tipo de nutrición. Especie epifaunal, fijos sobre rocas y bancos de ostión mediante un biso, de aguas someras y salobres. Nutrición de partículas orgánicas en suspensión. Subfamilia Lithophaginae H. y A. Adams, 1857
GéneroLithophagaRöding, 1798
SubgéneroDiberusDall, 1898
57) Lithophaga (Diberus) bisulcata(d'Orbigny) (Lám. 6, Fig. 3) Lithodomus bisulcatus d'Orbigny, 1842. In: De la Sagra Ed., Hist. Fis. Pol. Nat. de la Isla de Cuba, 2:333, lám. 28, figs. 14-16. Distribución local.En los arrastresA-3 de la boca Santana yA-4 de la boca Panteón. Distribución geográfica. Carolina del Norte, Florida, Golfo de México hasta Brasil. Habitat y tipo de nutrición. Especie infaunal perforante de rocas y madera; de aguas someras a profundas. Nutrición de partículas orgánicas en suspensión. Orden Pteroida Newell, 1965
Suborden Pteriina Newell, 1965
Superfamilia Pectinacea Rafinesque, 1815
Familia Pectinidae Rafinesque, 1815
Subfamilia Chlamydinae Korobkov, 1960
GéneroArgopectenMonterosato, 1889
58) Argopecten gibbus (Linnaeus) (Lám. 6, Fig. 4) Ostrea gibba Linnaeus, 1758. Syst. Nat., 10 Ed., : 698. Distribución local. En los arrastres A-3 de la boca Santana y A-4 de la boca Panteón. Distribución geográfica. Maryland a Florida, Bermudas, Golfo de México hasta Brasil. Habitat y tipo de nutrición. Especie epifaunal de sustratos arenosos, en aguas tropicales de someras a profundas. Nutrición de tipo suspensívora. Superfamilia Anomiacea Rafinesque, 1815Familia Anomiidae Rafinesque, 1815
GéneroAnomiaLinnaeus, 1758
59) Anomia simplexd'Orbigny (Lám. 6, Fig. 5) Anomia simplex d'Orbigny, 1842.In: De la Sagra Ed., Hist. Fis. Pol. Nat. de la Isla de Cuba, 2: 367, lám. 38, figs. 31-33 Distribución local. En la estación LCM-24 de la laguna del Carmen y en el arrastre A-3 de la boca Santana. Distribución geográfica.Cabo Cod a Florida, Bermudas, Golfo de México hasta Brasil. Habitat y tipo de nutrición. Especie epifaunal de sustratos duros. Nutrición de partículas orgánicas en suspensión. Suborden Ostreina Ferussac, 1822
Superfamilia Ostreacea Rafinesque, 1815
Familia Ostreidae Rafinesque, 1815
GéneroCrassostreaSacco, 1897
60) Crassostrea virginica(Gmelin) (Lám. 6, Fig. 6) Ostrea virginicaGmelin, 1791. Syst. Nat., 13 Ed., 1 (6): 3336. Distribución local.Esta especie constituye numerosos bancos en diversas etapas de producción distribuidos en casi todo el sistema lagunar, predominando en el Pajonal y en las zonas próximas al canal en las lagunas Carmen y Machona. Distribución geográfica. Del Golfo de San Lorenzo al Golfo de México y Antillas. Habitat y tipo de nutrición. Especie epifaunal constituyendo bancos. Nutrición por filtración de partículas orgánicas en suspensión. GéneroOstreaLinnaeus, 1758
61) Ostrea equestrisSay (Lám. 7, Fig. 1) Ostrea equestris Say, 1834. Amer. Conch., 6: 218, lám. 58. Distribución local. Colectada a mano en la playa de la boca Panteón. Distribución geográfica.Virginia al Golfo de México, Antillas hasta Brasil y Argentina. Habitat y tipo de nutrición. Especie epifaunal de sustratos duros, aguas someras marinas. Nutrición por filtración de partículas orgánicas en suspensión. Subclase Heterodonta Neumayr, 1884
Orden Veneroidea H. y A. Adams, 1858
Suborden Lucinina Dall, 1889
Superfamilia Lucinacea Fleming, 1828
Familia Lucinidae Fleming, 1828
GéneroLucinaBruguière, 1797
SubgéneroPhacoidesBlainville, 1825
62) Lucina (Phacoides) pectinata(Gmelin) (Lám. 7, Fig. 2) Tellina pectinata Gmelin, 1791. Syst. Nat., 13 Ed., 1 (6) : 3236. Distribución local.En las estaciones LCM-1 y LCM-2 en la laguna Redonda. En las estaciones LCM-7, LCM-8, LCM-9 y LCM-13 en la laguna Machona. En las estaciones LCM-18, LCM-20, LCM-21, LCM-24, LCM-32 y LCM-36 de la laguna del Carmen y en el arrastre A-3 de la boca Santana. Distribución geográfica. Carolina del Norte a Florida, Golfo de México, Antillas hasta Brasil. Habitat y tipo de nutrición. Especie infaunal superficial en aguas someras de lagunas y estuarios. Nutrición de partículas orgánicas en suspensión. Familia Ungulinidae H. y A. Adams, 1857
GéneroDiplodontaBronn, 1831
SubgéneroDiplodontaBronn, 1831
63) Diplodonta (Diplodonta) punctata(Say) (Lám. 7, Fig. 3) Amphidesma punctata Say, 1822. J. Ac. Nat. Sci. Phila., 2 (2) : 308. Distribución local. En la estación LCM-21 de la laguna del Carmen. Distribución geográfica. Carolina del Norte a Florida, Bermudas', Golfo de México hasta Brasil. Habitat y tipo de nutrición. Especie infaunal superficial, en aguas someras a profundas. Nutrición de partículas orgánicas en suspensión. Superfamilia Crassatellacea Ferussac, 1822
Familia Crassatellidae Ferussac, 1822
Subfamilia Scambulinae Chavan, 1952
GéneroCrassinellaGuppy, 1874
64) Crassinella lunulata(Conrad) (Lám. 7, Fig. 4) Astarte lunulata Conrad, 1834. J. Ac. Nat. Sci. Phila., 7 (1): 133. Distribución local. En el arrastre A-4 de la boca Panteón. Distribución geográfica.Massachusetts a Florida, Bermudas, Golfo de México hasta Brasil. Habitat y tipo de nutrición. Especie infaunal superficial entre concheríos, de aguas someras a profundas. Alimentación de partículas orgánicas en suspensión. Superfamilia Cardíacea Oken, 1818
Familia Cardiidae Oken, 1818
Subfamilia Trachycardiinae Stewart, 1930
GéneroTrachycardiumMörch, 1853
SubgéneroTrachycardiumMörch, 1853
65 Cardium isocardia Linnaeus,1758. Syst. Nat., 10 Ed.:679. (Lám. 7, Fig. 5) Distribución local. En la estación LCM-2 de la laguna Redonda y en la estación LCM-13 de la laguna Machona. Distribución geográfica. Bermudas, Golfo de México, Antillas hasta Brasil. Habitat y tipo de nutrición. Especie infaunal en aguas someras. Nutrición de partículas orgánicas en suspensión. SubgéneroDallocardiaStewart, 1930
66) Trachycardium (Dallocardia) muricatum(Linnaeus) (Lám. 7, Fig. 6) Cardium muricatum Linnaeus, 1758. Syst. Nat., 10 Ed.,: 679. Distribución local. En el arrastre A-3 de la boca Santana. Distribución geográfica. Carolina del Norte a - Florida, Golfo de México, Antillas hasta Brasil. Habitat y tipo de nutrición. Infaunal superficial, frecuente en aguas someras. Nutrición suspensívora. Subfamilia Laevicardiinae Keen, 1936
Género Laevicardium Swainson, 1840
67) Laevicardium mortoni(Conrad) (Lám. 7, Fig. 7) Cardium mortoniConrad, 1831. J. Ac. Nat. Sci. Phila.,6: 259, lám. 10, figs.5-7. Distribución local. En el arrastre A-3 de la boca Santana. Distribución geográfica. Cabo Cod a Florida, Golfo de México y Antillas. Habitat y tipo de nutrición. Especie infaunal superficial en fondos fangosos con vegetación. Frecuente en aguas someras hipersalinas. Nutrición por filtración de partículas orgánicas en suspensión. GéneroDinocardiumDall, 1900
68) Dinocardium robustum (Solander) (Lám. 8, Fig. 1) Cardium Robustus Solander, 1786. Portland Mus. Cat., :58. Distribución local. En el arrastre A-3 en la boca Santana. Distribución geográfica. Virginia a Florida y Golfo de México. Habitat y tipo de nutrición. Forma infaunal superficial, de aguas someras. Nutrición filtrante. Superfamilia Mactracea Lamarck, 1809
Familia Mactridae Lamarck, 1809
Subfamilia Mactrinae Lamarck, 1809
GéneroMuliniaGray, 1837
69) Mulinia lateralis(Say) (Lám. 8, Fig. 2) Mactra lateralisSay, 1822. J. Ac. Nat. Sci. Phila., 2(2): 309. Distribución local. En las estaciones LCM-I, LCM-2, LCM-3 y LCM-4 de la laguna Redonda. En las estaciones LCM-8, LCM-9, LCM-10, LCM-11 y LCM-13 en la laguna Machona. En la laguna del Carmen: LCM-26, LCM-31, LCM-32, LCM-33, LCM-34, LCM-35 y LCM-36. En la laguna de la Palma, las estaciones LCM-28, LCM-29 y LCM-30.En la estación LCM-25 del Pajonal. Distribución geográfica. Maine hasta el Golfo de México. Habitat y tipo de nutrición. Especie infaunal de sustratos arenosos y fangosos; aguas someras templadas y cálidas. Nutrición suspensívora. GéneroRangiaDesmoulins, 1832
70) Rangia cuneata(Gray) (Lám. 8, Fig. 3) Gnathodon cuneatus Gray, 1831. In: Sowerby, Gen. Shells, lám. 36, figs. 1-4. Distribución local. En la laguna Redonda: LCM-2 y LCM-4. En la laguna Machona: LCM-7, LCM-8, LCM-9, LCM-10, LCM-12, LCM-13, LCM-14, LCM-15, LCM-16 y LCM-17. En la laguna del Carmen:LCM-18, LCM-19, LCM-20, LCM-21, LCM-22 y LCM-24. En la estación LCM-29 de la laguna de la Palma y en el arrastre A-3 de la boca Santana y el A-4 de la boca Panteón. Distribución geográfica. De Virginia al Golfo de México. Habitat y tipo de nutrición. Forma infaunal de sustratos blandos de áreas costeras con influencia de ríos, aguas salobres a dulces. Nutrición por filtración de partículas orgánicas suspendidas. SubgéneroRangianellaConrad, 1868
71) Rangia (Rangianella) flexuosa (Conrad) (Lám. 8, Fig. 4) Gnathodon flexuosa Conrad, 1839. Am. J. Sci. Arts., 38 (1): 92, fig. 1. Distribución local. En la laguna Redonda: LCM-2 y LCM4. En la laguna de Machona: LCM-5, LCM-6, LCM-7, LCM-8, LCM-9, LCM-10, LCM-11, LCM-12, LCM-13, LCM-14, LCM-15, LCM-16 y LCM-17. En la laguna del Carmen: LCM-21, LCM-22, LCM-23, LCM-32, LCM-33, LCM-34 y LCM-36. En la estación LCM-25 del Pajonal. En el arrastre A-2 de la laguna de la Palma y en los arrastres A-3 de la boca Santana y A-4 de la boca Panteón. Distribución geográfica. De Louisiana al Golfo de México. Habitat y tipo de nutrición.Especie infaunal en sustratos blandos y en aguas salobres influidas por ríos, Nutrición de partículas orgánicas en suspensión. Superfamilia Tellinacea Blainville, 1814
Familia Tellinidae Blainville, 1814
Subfamilia Tellininae Blainville, 1814
GéneroStrigillaTurton, 1822
SubgéneroStrigillaTurton, 1822
72) Strigilla (Strigilla) mirabilis(Philippi) (Lám. 8, Fig. 5) Tellina mirabilisPhilippi, 1841. Archiv. f. Nat., 7 (1): 260. Distribución local. En el arrastre A-4 de la boca Panteón. Distribución geográfica. Carolina del Norte, Bermudas, Golfo de México, Caribe hasta Brasil. Habitat y tipo de nutrición. Especie infaunal, en aguas someras templadas a cálidas. Nutrición de partículas orgánicas depositadas en el sustrato. Subfamilia Macominae Olsson, 1961
GéneroMacomaLeach, 1819
73) Macoma tenta(Say) (Lám. 8, Fig. 6) Tellina tenta Say, 1834. Amer. Conch., 7: 228, lám. 65, fig. 3. Distribución local. En la estación LCM-4 de la laguna Redonda. En las estacionesLCM-15 y LCM-17 de la laguna Machona. En la laguna del Carmen: LCM-18, LCM-20, LCM-21, LCM-22, LCM-23, LCM-24, LCM-32 y LCM-33. Distribución geográfica. Cabo Cod a Florida, Bermudas, Golfo de México hasta Brasil. Habitat y tipo de nutrición. Especie infaunal de aguas someras. Nutrición de partículas depositadas en el sustrato. Subgénero Austromacoma Olsson, 1961
74) Macoma (Austromacoma) constricta(Bruguière) (Lám. 8, Fig. 7) Solen constricta Bruguiére,1792. Hist. Nat. Vers., 1 (1): 126. Distribución local. En la estación LCM-11 de la laguna Machona. En la estación LCM-25 del Pajonal y en el arrastre A-4 de la boca Panteón. Distribución geográfica. Florida, Golfo de México, Antillas hasta Brasil. Habitat y tipo de nutrición. Especie infaunal en playas de aguas poco profundas. Nutrición de partículas orgánicas depositadas en el sustrato. SubgéneroPsammacomaDall, 1900
75) Macoma (Psammacoma) brevifrons(Say) (Lám. 9, Fig. 1) Tellina brevifrons Say, 1834. Amer. Conch., 7: 227,lám. 64, fig. 1. Distribución local. En la estación LCM-13 de la laguna de Machona y en la estación LCM-22 de la laguna del Carmen. Distribución geográfica. Carolina del Sur, Florida, Golfo de México hasta Brasil. Habitat y tipo de nutrición. Especie infaunal en aguas someras. Nutrición de partículas orgánicas depositadas en el sustrato. 76) Macoma (Psammacoma) tageliformisDall (Lám. 9, Fig. 2) Macoma lageliformis Dall, 1900. Proc. U. S. Nat. Mus., 23 (1210) : 300, 315. Distribución local. En las estaciones LCM-8 y LCM-9 de la laguna Machona y en la estación LCM-32 de la laguna del Carmen. Distribución geográfica. Louisiana, Golfo de México, Antillas hasta Brasil. Habitat y tipo de nutrición. Especie infaunal en fondos arenosos y fangosos de costas someras. Nutrición de partículas depositadas en el sustrato. Familia Donacidae Fleming, 1828GéneroDonaxLinnaeus, 1758
77) Donax variabilis texasianaPhilippi (Lám. 9, Fig. 3) Donax texasianaPhilippi, 1847. Zeit. f. Malakozool., 4: 77. Distribución local. En la estaciónLCM-5 de la laguna Machona. En la estaciónLCM-27 de la laguna del Carmen y en los arrastresA-3 y A-4. Distribución geográfica. Golfo de México. Habitat y tipo de nutrición. Especie ingaunal de sustratos arenosos. Nutrición filtrante de partículas en suspensión. GéneroIphigeniaSchumacher, 1817
78) Iphigenia brasiliana(Lamarck) (Lám. 9, Fig. 4) Capsa brasiliana Lamarck, 1818. Hist. Nat. Anm. sansVert., 5: 553. Distribución local. En la estación LCM-22 de la laguna del Carmen y en el arrastre A-3 de la boca Santana. Distribución geográfica. Sur de Florida, Golfo de México hasta Brasil. Habitat y tipo de nutrición. Especie infaunal en sustratos arenosos y aguas someras. Nutrición suspensívora. Familia Semelidae Stoliczka, 1870
Género Semele Schumacher, 1817
79) Semele proficua(Pulteney) (Lám. 9, Fig. 5 ) Tellina proficua Pulteney, 1799. In: Hutchins, Dorsetshire, : 29, lám. 5, fig. 4. Distribución local. En el arrastre A-3 de la boca Santana. Distribución geográfica. Carolina del Norte, Bermudas, Golfo de México hasta Brasil. Habitat y tipo de nutrición. Especie infaunal de aguas someras. Nutrición de partículas orgánicas depositadas. Familia Solecurtidae d'Orbigny, 1846
GéneroTagelusGray, 1847
80) Tagelus plebeius(Lightfoot) (Lám. 9, Fig. 6) Solen plebeius Lightfoot, 1786. Portland Mus. Cat.: 42, 101, 156. Distribución local.En la estación LCM-2 de la laguna Redonda y en las estaciones LCM-9 y LCM-13 de la laguna Machona. Distribución geográfica. Cabo Cod a Florida, Golfo de México, Antillas hasta Brasil. Habitat y tipo de nutrición. Especie infaunal de aguas someras a moderadamente profundas. Nutrición de partículas depositadas en el sustrato. SubgéneroMesopleuraConrad, 1868
81) Tagelus (Mesopleura) divisus (Spengler) (Lám. 10, Fig. 1) Solen divisusSpengler, 1794. Skr. Nat. Selk., 3 (2): 96. Distribución local. En la estación LCM-4 de la laguna Redonda. En las estaciones LCM-19, LCM-20, LCM-21 y LCM-22 de la laguna del Carmen. Distribución geográfica.Cabo Cod a Florida, Bermudas, Golfo de México hasta Brasil. Habitat y tipo de nutrición. Especie infaunal, común en aguas someras. Nutrición de partículas orgánicas depositadas en el sustrato. Suborden Arcticina Newell, 1965
Superfamilia Dreissenacea Gray, 1840
Familia Dreissenidae Gray, 1840
GéneroMytilopsisConrad, 1858
82) Mytilopsis leucophaeata(Conrad) (Lám. 10, Fig. 2) Mytilus leucophaeatus Conrad, 1831. J. Ac. Nat. Sci. Phila., 6: 263, lám. 11, fig. 13. Distribución local. En las estaciones LCM-I, LCM-3 y LCM-4 de la laguna Redonda. En la estación LCM-5 de la laguna Machona. Distribución geográfica.. Nueva York a Florida, Golfo de México. Habitat y tipo de nutrición. Especie epifaunal fija sobre rocas; de aguas dulces y salobres. Nutrición de partículas en suspensión. Superfamilia Veneracea Rafinesque, 1815
Familia Veneridae Rafinesque, 1815
Subfamilia Chioninae Frizzell, 1936
GéneroChioneMühlfeld, 1811
SubgéneroChioneMühfeld, 1811
84) Chione (Chione) cancellata (Linnaeus)(Lám. 10, Fig. 4) Venus cancellata Linnaeus, 1767. Syst. Nat., 12 Ed., :1130. Distribución local. En la estación LCM-5 de la laguna Machona. En las estaciones LCM-21 y LCM-22 de la laguna del Carmen. En los arrastres A-3 y A-4. Distribución geográfica. De Carolina del Norte a Florida, Golfo de México, Antillas hasta Brasil. Habitat y tipo de nutrición. Especie infaunal en sustratos arenosos de aguas someras. Nutrición suspensívora. 85) Chione (Chione) intapurpurea (Conrad)(Lám. 10, Fig. 5) Venus intapurpurea Conrad, 1849. J. Ac. Nat. Sci. Phila., 1(3): 209, lám. 39, fig. 9. Distribución local. En el arrastre A-3 de la boca Santana y el A-4 de la boca Panteón. Distribución geográfica. Carolina del Norte, Golfo de México, Antillas hasta Brasil. Habitat y tipo de nutrición. Especie infaunal de sustratos arenosos, poco común. Nutrición de partículas orgánicas en suspensión. Subgénero Lirophora Conrad, 1863
86) Chione (Lirophora) clenchi Pulley(Lám. 10, Fig. 6) Chione (Lirophora) clenchi Pulley, 1952. Tex. Jour. Sci., 4(1): 61. lám. 1. Distribución local. Colectada a mano en la playa de la boca Panteón. Distribución geográfica. Golfo de México. Habitat y tipo de nutrición. Especie infaunal de sustratos arenosos y aguas marinas someras. Nutrición de partículas orgánicas en suspensión. Subgénero Timoclea Brown, 1827
87) Chione (Timoclea) grus (Holmes)(Lám. 10, Fig. 7) Tapes grus Holmes, 1858. Post. Plio. Fos. S. Carol., :37, lám. 7, fig. 5. Distribución local. En los arrastres A-3 y A-4. Distribución geográfica. Carolina del Norte, Florida y Golfo de México. Habitat y tipo de nutrición. Especie infaunal superficial de fondos arenosos; en aguas marinas someras. Nutrición de partículas orgánicas en suspensión. GéneroAnomalocardiaSchumacher, 1817
88) Anomalocardia auberiana (d'Orbigny) (Lám. 11, Fig. 1) Venus auberiana d'Orbigny, 1842. In: De la Sagra Ed., Hist. Fis. Pol. Nat. de la Isla de Cuba., :319, lám. 26, figs. 35-37. Distribución local. En el arrastreA-4 en la boca Panteón. Distribución geográfica. Florida, Golfo de México hasta Brasil. Habitat y tipo de nutrición. Especie infaunal superficial, en aguas marinas y salobres someras. Nutrición suspensívora. GéneroMercenariaSchumacher, 1817
89) Mercenaria campechiensis(Gmelin) (Lám. 11, Fig. 2) Venus campechiensis Gmelin, 1791. Syst. Nat., 13 Ed., 5: 3287. Distribución local.Colectada a mano en la playa de la boca Panteón. Distribución geográfica. Sur de Nueva jersey a Florida, Golfo de México y Cuba. Habitat y tipo de nutrición. Especie infaunal en sustratos arenosos, de aguas marinas. Nutrición micrófaga. Subfamilia Meretricinae Gray, 1847 GéneroTivelaLink, 1807
90) Tivela mactroides(Born) (Lám. 11, Fig. 3) Venus macrotidesBorn, 1778. Index. Mus. Caes. Vind., :53. Distribución local.En la estación LCM-13 de la laguna Machona y en el arrastre A-4 de la boca Panteón. Distribución geográfica.Golfo de México, Antillas hasta brasil. Habitat y tipo de nutrición.Especie infaunal, frecuente en aguas someras. Nutrición suspensívora de partículas orgánicas. Subfamilia Pitarinae Stewart, 1930 GeneroMacrocallistaMeek, 1876
91) Macrocallista maculata(Linnaeus) (Lám. 11, Fig. 4) Venus maculataLinnaeus, 1758. Syst. Nat., 10 Ed., :686. Distribución local. Colectada a mano en la playa de la boca Panteón. Distribución geográfica. Carolina del Norte, Bermudas, Golfo de México, Antillas hasta Brasil. Habitat y tipo de nutrición. Forma infaunal, de aguas someras. Nutrición suspensívora micrófaga. Subfamilia Cyclininae Frizzell., 1936
GéneroCyclinellaDall, 1902
92) Cyclinella tenuis(Récluz) (Lám. 11, Fig. 5) Dosinia tenuis Réduz, 1852. Jour. Conch., 3: 250, lám. 10, fig. 1. Distribución local. En las estacionesLCM-14 y LCM-15 de la laguna Machona. En la estaciónLCM-20 de la laguna del Carmen. Distribución geográfica. Virginia a Florida Golfo de México hasta Brasil. Habitat y tipo de nutrición.Especie infaunal, en aguas someras. Nutrición suspensívora. Superfamilia Arcticacea Newton, 1891Familia Trapeziidae Lamy, 1920 GéneroCoralliophagaBlainville, 1824
93) Coralliophaga coralliophaga (Gmelin) (Lám. 11, Fig. 6) Chama coralliophaga Gmelin, 1791. Syst. Natur., 13 Ed., : 3305. Distribución local. En el arrastre A-4 de la boca Panteón. Distribución geográfica. Carolina del Norte, Bermudas, Golfo de México, Antillas hasta Brasil. Habitat y tipo de nutrición. Forma infaunal perforante de otros moluscos. Nutrición suspensívora. Orden Myoida Stoliczka, 1870
Suborden Myina Newell, 1965
Superfamilia Myacea Lamarck, 1809
Familia Corbulidae Lamarck, 1818
GéneroCorbulaBruguiere, 1792
SubgéneroCaryocorbulaGardner, 1926
94) Corbula (Caryocorbula) contracta Say (Lám. 11, Fig. 7) Corbula contracta Say, 1822. J. Ac. Nat. Sci. Phila., 2 (2): 312. Distribución local. En la estación LCM-5 de la laguna Machona. En las estaciones LCM-21 y LCM-22 de la laguna del Carmen. Distribución geográfica. Cabo Cod a Florida, Golfo de México, Antillas hasta Brasil. Habitat y tipo de nutrición. Especie infaunal de sustratos arenosos, aguas someras. Nutrición suspensívora. Suborden Pholadina Newell, 1965 S
Superfamilia Pholadacea Rafinesque, 1815
Familia Pholadidae Rafinesque, 1815
Subfamilia Martesiinae Grant y Gale, 1931
GéneroMartesiaSowerby, 1824
95) Martesia cuneiformis (Say) (Lám. 11, Fig. 8) Pholas cuneiformis Say, 1822. J. Ac. Nat. Sci. Phila., 2 (2): 322. Distribución local. En la estación LCM-20 de la laguna del Carmen. Distribución geográfica. Carolina del Norte al Golfo de México, hasta Brasil. Habitat y tipo de nutrición. Especie infaunal perforante de madera. Nutrición suspensívora. OBSERVACIONES ECOLÓGICAS
Análisis porcentual En la tabla 2, se enlistan las especies de gasterópodos, con la cantidad de individuos, así como el porcentaje en cada estación. En la tabla 3, de igual manera se representa para los bivalvos. Las especies más abundantes de gasterópodos fueron:  Estas cinco especies representan casi el 97% de la población total de los gasterópodos. Por lo que respecta a los bivalvos, las especies más abundantes fueron: 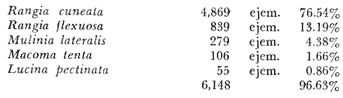 Estas cinco especies representan más del 96% de la población total de los bivalvos. Considerando la población total de moluscos colectados, las especies más abundantes son:  Estas seis especies, tres gasterópodos y tres bivalvos, constituyen el 94% de la población total de moluscos colectados en el sistema lagunar. Tabla 2 Tabla 3 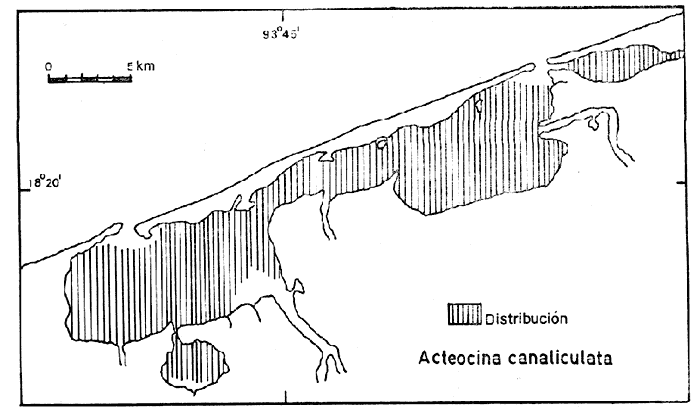 Fig. 5. Distribución de Acteocina canaliculata de acuerdo a las estaciones de muestreo. 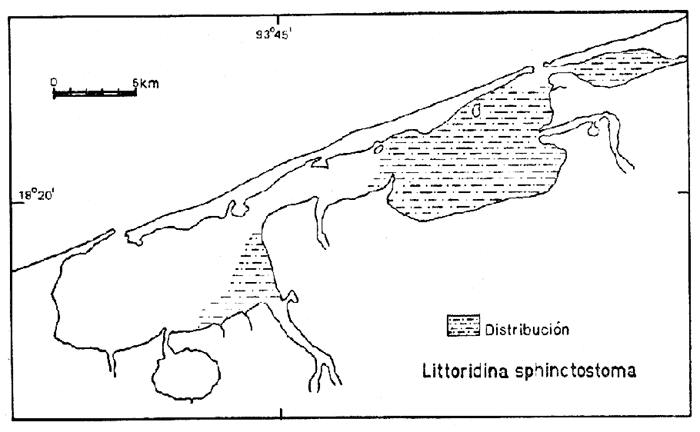 Fig. 6. Distribución de Littoridina sphinctostoma de acuerdo a las estaciones de muestreo. 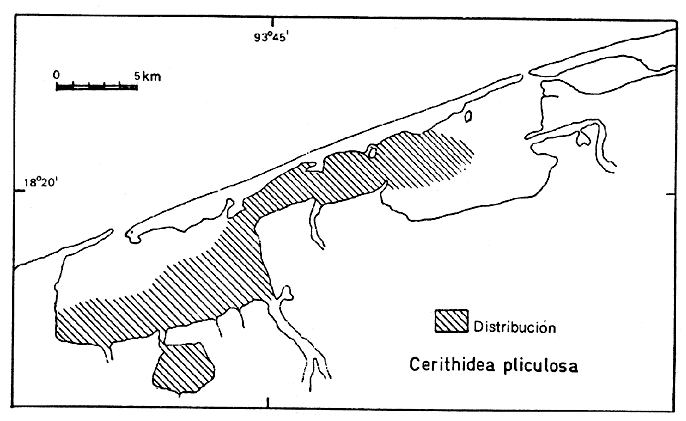 Fig. 7. Distribución de Cerithidea pliculosa de acuerdo a las estaciones de muestreo. 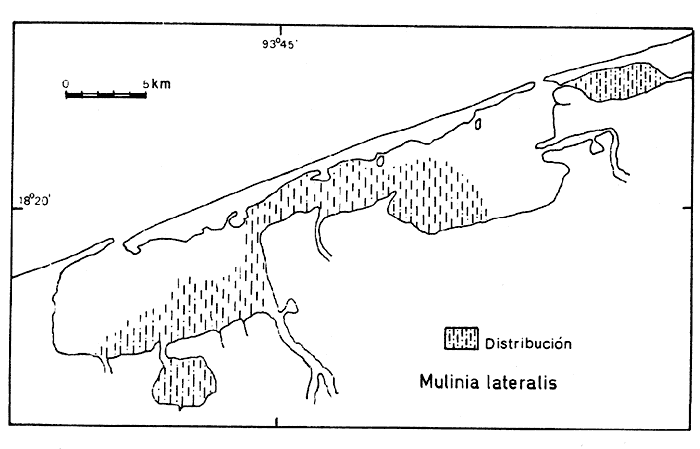 Fig. 8. Distribución de Mulinia lateralis de acuerdo a las estaciones de muestreo. En relación con la distribución en el sistema, las especies que están presentes en el mayor número de estaciones son:  Distribución y habitat de las especies En las figuras 5 a 10 se ilustra la distribución de estas seis especies, que al mismo tiempo que son las que predominan por su mayor abundancia relativa, son las de distribución más amplia. En relación a las estaciones que muestran mayor cantidad de ejemplares colectados y especies identificadas, tanto en bivalvos, gasterópodos como en población total de moluscos, se muestra en la Tabla 4. Sin embargo, hay que hacer notar, que la estación con mayor cantidad de ejemplares y especies es la LCM-21. 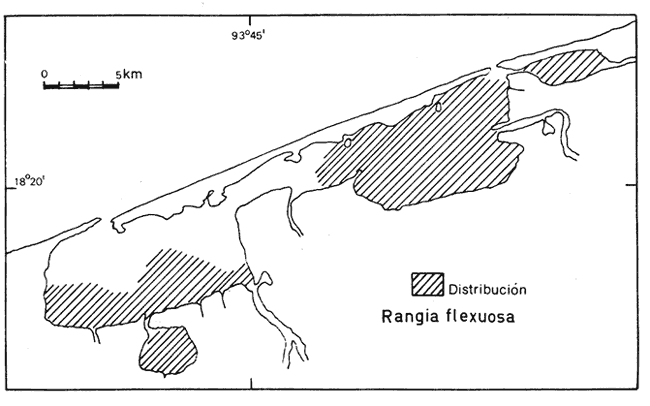 Fig. 9. Distribución de Rangia flexuosa de acuerdo a las estaciones de muestreo. 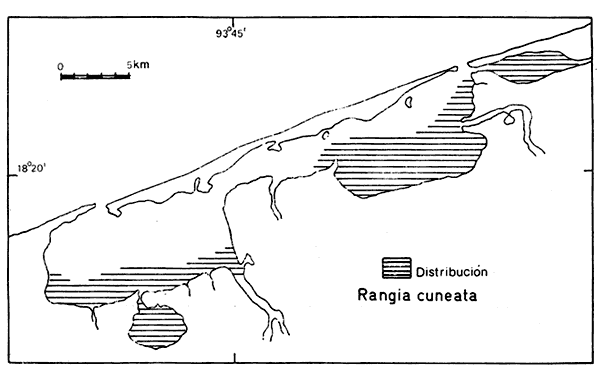 Fig. 10. Distribución de Rangia cuncata de acuerdo a las estaciones de muestreo 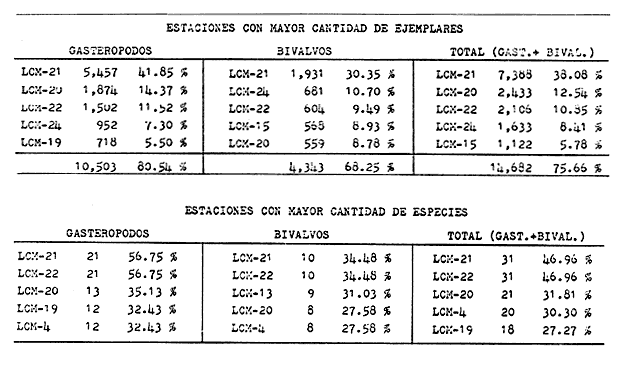 TABLA 4 ESTACIONES CON MAYOR CANTIDAD DE EJEMPLARES Y DE ESPECIES DE GASTROPODOS, BIVALVOS Y POBLACIÓN TOTAL DE MOLUSCOS. 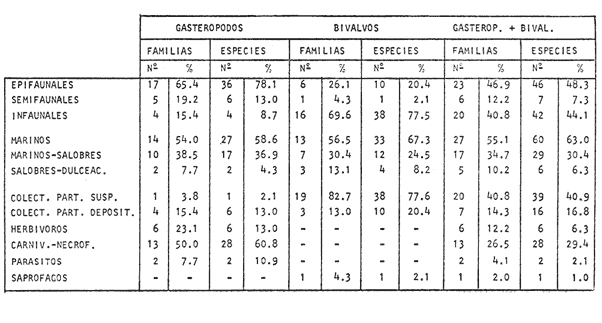 TABLA 5 CARACTERÍSTICAS DE TIPO DE HABITAT, NUTRICIÓN Y RELACIÓN CON EL SUSTRATO DE LAS FAMILIAS Y ESPECIES DE BIVALVOS, GASTERÓPODOS Y MOLUSCOS EN GENERAL, INDICANDO CANTIDAD Y PORCENTAJE De las especies de bivalvos identificadas en el sistema lagunar, de acuerdo con la información reportada en la bibliografía, el tipo de nutrición más frecuente corresponde a la filtradora de partículas orgánicas en suspensión con 38 especies (77.6% del total de bivalvos). Referente a su relación con el sustrato y rango salino del habitat, 38 especies (77.5%) son infaunales y 33 (67.3%) son de habitat marino. En los gasterópodos el tipo de nutrición dominante es la carnívora-necrófaga con 28 especies (60.8%) y su relación con el sustrato y habitat, 36 especies son epifaunales (78.1%) y 27 (58.6%) son de habitat marino. Para la población total de moluscos, 46 especies (48.31%) son epifaunales y 42 (44.1%) infaunales; 60 especies (63%) son de habitat marino y respecto al tipo de nutrición, 39 (40.9%) son filtradoras y 28 (29.4%) carnívora necrófaga. El análisis detallado se muestra en la Tabla 5. 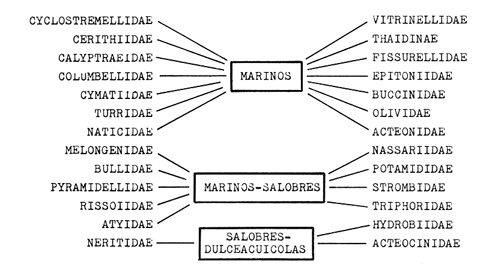 Fig. 11. Tipos de habitat de las familias de Gasterópodos identificados. 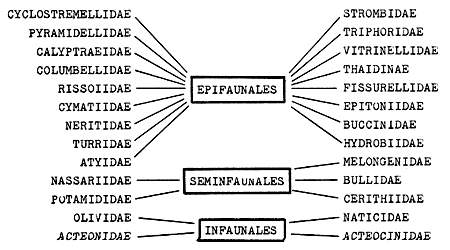 Fig. 12. Relación con el sustrato de las familias de Gasterópodos identificados. 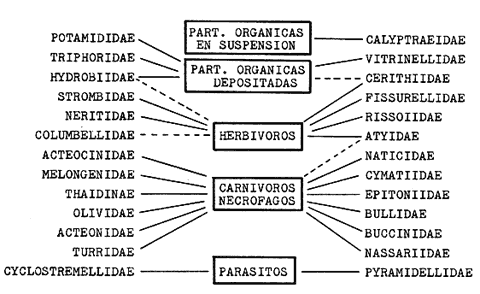 Fig. 13 Tipos de nutrición de las familias de gastrópodos identificados. De acuerdo con la información obtenida de la literatura especializada, en las figuras 11, 12 y 13, se enlistan las familias de los gasterópodos presentes en el sistema lagunar relacionándolas con el rango de salinidad en que habitan, su relación con el sustrato y el tipo de nutrición dominante. En forma semejante se procede para los bivalvos en las figuras 14, 15 y 16. Considerando la distribución y abundancia de las especies de los moluscos presentes y las condiciones hidrológicas del sistema lagunar, se pueden establecer cuatro zonas con características hidrológicas y fauna malacológica típicas de ellas. 1) Areas lagunares correspondientes a las desembocaduras de los ríos. Son las zonas alejadas de la influencia marina con una notable acción limnética y rango salino de 0.0 a 0.5 ‰, en la época de lluvias, elevándose en época de secas sin rebasar las 18 ‰. Corresponde en el sistema, a las desembocaduras de los ríos Santana y San Felipe. Las especies características son: Rangia cuneta y Rangia flexuosa. 2) Lagunas y esteros interiores comunicados al cuerpo principal. Son zonas mesohalinas que mantienen un rango de salinidad entre los 18 y 20 ‰ durante la mayor parte del año, con periodos cortos de salinidades menores. Son la laguna la Palma, Laguna Redonda y la mayor parte del Pajonal. Las especies características son el ostión Crassostrea virginica y la fauna acompañante representada porBrachidontes exustus, Ischadium recurvus y varias especies del género Odostomia. 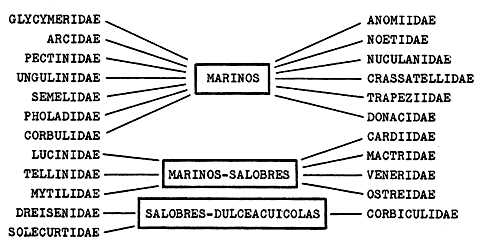 Fig. 14. Tipos de habitat de las familias de bivalvos identificados. 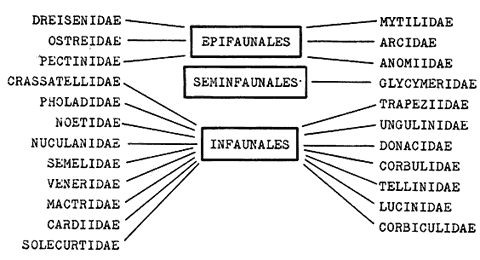 Fig. 15. Relación con el sustrato de las familias de bivalvos identificados. 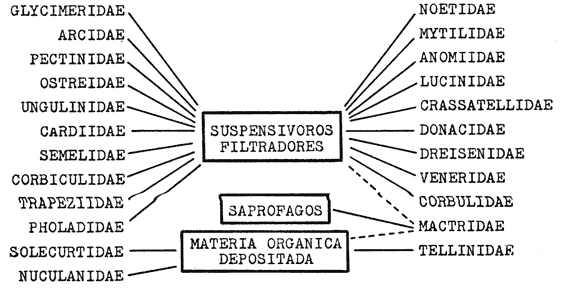 Fig. 16. Tipos de nutrición de las familias de bivalvos identificados 3) Cuerpo central del sistema. Es un área eminentemente polihalina con salinidades de 20 a 25 ‰, descendiendo a 18 ‰ durante la época de lluvias. La fauna malacológica es diversa y son las especies más abundantes: Cerithidea Pliculosa, Littoridina sphinctostoma, Mulinia lateralis y Acteocina. canaliculata. Siendo esta última especie la de mayor distribución en todo el sistema lagunar. 4) Bocas de comunicación con el mar y zonas adyacentes. Son áreas con marcada acción de las marcas y corrientes, manteniéndose todo el año con salinidades marinas. Corresponden a las bocas Santana y Panteón. La fauna malacológica caracterizada por ser en su mayoría especies marinas: Lucina pectinata, Trachycardium isocardia, Macoma tenla, Chione cancellata, Neritina virginea, Cingula floridana, Crepidula plana, Nassarius vibex y Nassarius acutus. Como una prueba de la validez del muestreo se elaboró la gráfica correspondiente al área mínima (figura 17) en donde se consideran las estaciones como muestras y por otro lado la aparición de especies acumuladas en tanto por ciento. Se observa que al nivel de la estación 21, el número de especies presentes es del 90% y a partir de la estación 26, no aparecen nuevas especies. Si se aumentaran los muestreos, las especies nuevas serían pocas y de escasa significación estadística. Diversidad El concepto de diversidad, es de reciente aplicación en la ecología de lagunas costeras. El empleo adecuado de este concepto permite evaluar y cuantificar la complejidad estructural, grado de madurez y niveles de contaminación de los ecosistemas. Diversas fórmulas se han propuesto para obtener índices de diversidad, los más importantes son los desarrollados por Margalef (1957), Simpson (1949), MacArthur (1957), Brillouin (1962), Shannon y Weaver (1963) y Pielou (1966). Dadas las características ecológicas de los sistemas lagunares, las colecciones o conjuntos de muestras obtenidas en dichos sistemas, según la clasificación de colecciones propuesta por Pielou (1966), éstas serían del Tipo B: Colecciones grandes, ilimitadas en especies e individuos, en las que una muestra tomada al azar puede delimitarse con un número de especies conocido. De acuerdo con este autor la fórmula indicada para obtener el índice de diversidad es la propuesta por Shannon y Weaver (1963). Este índice está basado en el principio de incertidumbre, ampliamente empleado en la teoría de la información. De acuerdo con este principio, una diversidad alta está asociada a una incertidumbre alta. En la fórmula propuesta: H' = - pi lognpi, la base logarítmica es = 2, dándose por lo tanto la diversidad H' en unidades bits. Los valores de diversidad sin un marco de referencia, poco indican en sí, para darle significado, se obtuvieron el índice de diversidad máxima esperada (H') y el valor de la equitatividad o igualdad (J'). Los valores obtenidos de H', H'max y J' se enlistan en la tabla 6, En la columna Clase I se refieren los valores a la población de los gasterópodos, en la Clase II a los bivalvos y la última se refiere a la población total de los moluscos. Los valores generales de las tres columnas son: 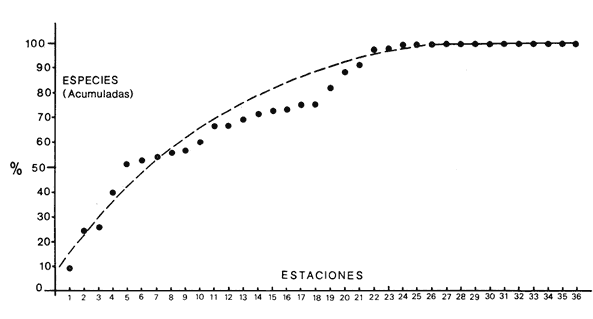 Fig. 17. Curva del área mínima de muestreo.  En las figuras 18, 19 y 20 se observan las gráficas de la diversidad en cada estación, expresándose los valores del índice de diversidad de mayor a menor y su relación con la media. 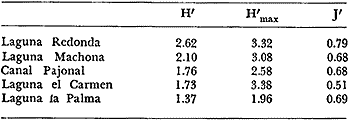 TABLA 6 VALORES DE LA DIVERSIDAD (14% DIVERSIDAD MÁXIMA (H' max) Y EQUITABILIDAD (J') DE LOS BIVALVOS, GASTERÓPODOS Y POBLACIÓN TOTAL DE OLUSCOS PARA CADA ESTACÓN DE MUESTREO De las estaciones que poseen una diversidad superior a la media y que son comunes a la clase I, clase II y Total (Estaciones 1, 2, 4, 5, 10, 11, 13, 33 y 36) y de acuerdo a su posición en el sistema lagunar, se pueden diferenciar tres conjuntos: un conjunto en la laguna Redonda (Estaciones 1, 2, 4 y 5) otro en la laguna del Carmen (Estaciones 33 y 36) y otro en la laguna Machona con las estaciones 10, 11 y 13. Estos dos últimos conjuntos están próximos al canal Pajonal. Localmente se observa un gradiente en los valores de la diversidad en el sistema lagunar. Los valores medios más altos de la diversidad corresponden a la laguna Redonda con 2.62 y los mínimos a la laguna La Palma con 1.37. Los valores medios de la diversidad, diversidad máxima y equitabilidad para la laguna Redonda, Machona, Pajonal, Carmen y la Palma se dan a continuación: 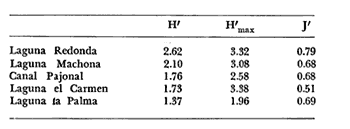 De los datos anteriores, se puede afirmar que la zona de mayor diversidad corresponde a la laguna Redonda, tanto por el valor del índice H'. por la diversidad máxima esperada, así como por la relación numérica de los dos conceptos anteriores, o sea, el índice J' de la equitabilidad. Por otro lado, la menor diversidad corresponde a la laguna del Carmen y la Palma. No hay literatura que haga referencia a índices de diversidad de la fauna malacológica en sistemas lagunares costeros, de tal forma que no se puede establecer una relación comparativa de la afinidad del área de estudio con otras localidades. Sanders (1968) empleando el método de rarefacción, por el propuesto, analiza la diversidad en diferentes localidades marinas y estuarinas, concluyendo que los sistemas lagunares costeros presentan comunidades físicamente controladas en donde los factores que influyen sobre las comunidades son esencialmente climáticos (tipo de sustrato, temperatura y salinidad), con un elevado estres, más que los factores biológicos (predación y competencia). 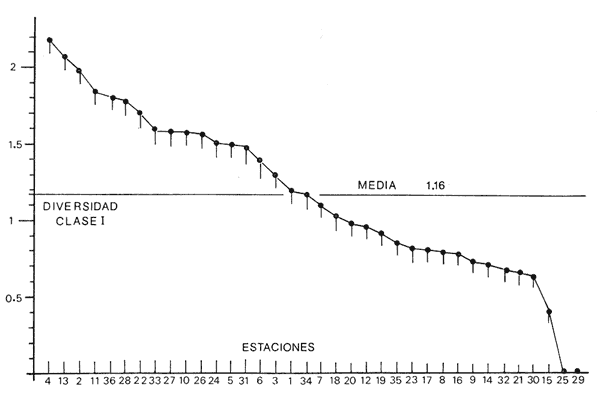 Fig. 18. Curva de los valores de la diversidad de los gasterópodos en cada estación de muestreo. 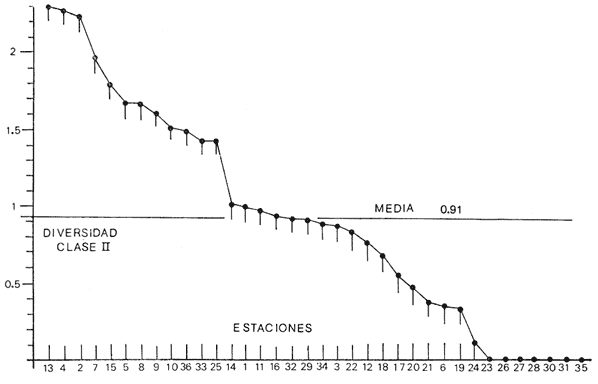 Fig. 19. Curva de los valores de diversidad de los bivalvos en cada estación de muestreo. 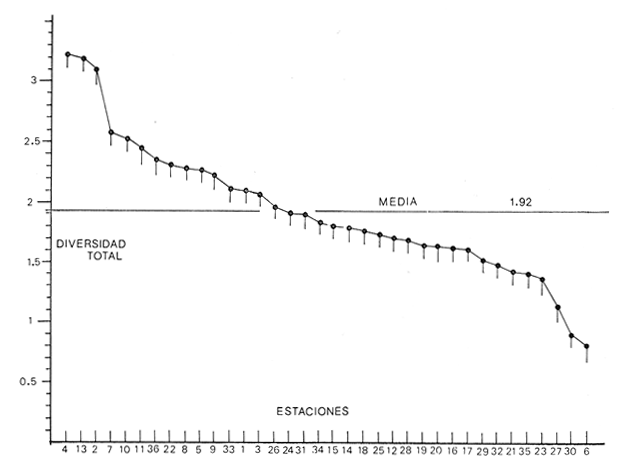 Fig. 20. Curva de los valores de la diversidad de la población total de moluscos en cada estación De acuerdo a la complejidad estructural, estabilidad del medio, condiciones climáticas y grados de contaminación se puede concluir que la fauna malacológica de los sistemas lagunares estuarinas es baja en comparación a otras zonas marinas costeras. Afinidad Lo mismo que la diversidad, la afinidad ha sido empleada como un elemento en la interpretación ecológica de las comunidades. La afinidad permite evaluar que tanto son semejantes los componentes específicos de las muestras o estaciones de un sistema. Para su cuantificación se han propuesto diversos índices; el empleado en el presente trabajo es el de Czechanowski (1913). Con los índices obtenidos al comparar las especies presentes en las 36 estaciones entre sí, tanto para los bivalvos, gasterópodos como para la población total de moluscos, se elaboraron los diagramas en enrejado (Trellis) (Figs. 21, 22 y 23). Para facilitar la simbología, los valores se normalizaron en cuatro categorías: A 0 - 24% B 25 - 49% C 50 - 74% D 75 - 100% 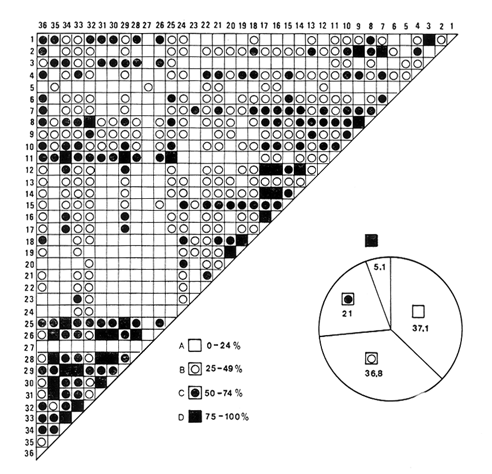 Fig. 21. Diagrama en enrejado de la afinidad de los bivalvos en las estaciones de muestreo. 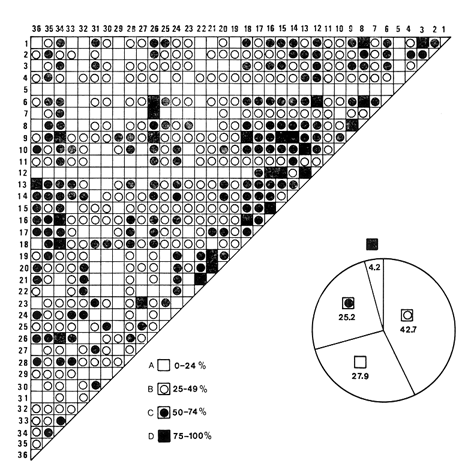 Fig. 22. Diagrama en enrejado de la afinidad de los gasterópodos en las estaciones de muestreo. 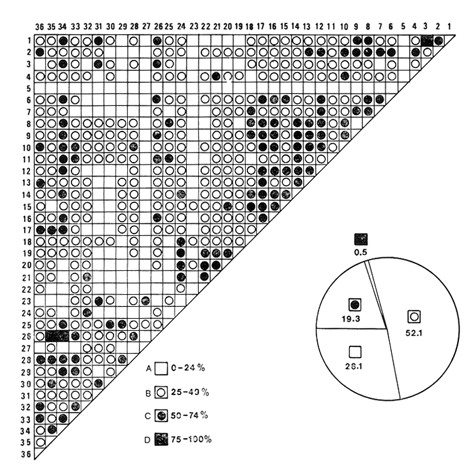 Fig. 23. Diagrama en enrejado de la afinidad de la población total de moluscos en las estaciones de muestreo. Porcentualmente los rangos de afinidad más frecuentes fueron: para los bivalvos la categoría A, para los gasterópodos la categoría B y para la población total de moluscos B. Localmente los bivalvos tienen los valores más altos de afinidad en la laguna del Carmen mientras que los gasterópodos y moluscos en general corresponden a la laguna Machona. ConclusionesCONCLUSIONES 1 . La composición y comportamiento de la fauna malacológica de este sistema lagunar, está determinada fundamentalmente por las condiciones climáticas, hidrológicas y fisiográficas. 2. El tipo de sustrato predominante en el sistema son las arenas y limos finos. 3. Hidrológicamente se caracteriza por una elevada turbidez (0.5 m), una temperatura promedio anual de 30ºC en la mayor parte del sistema con una variación mínima entre superficie y fondo. La salinidad, en época de secas va de 10 a 30 ‰ y en época de lluvias de 0 a 25 ‰. 4. Se colectaron casi 20,000 ejemplares representados en 95 especies, siendo las más abundantes:Acteocina canaliculata, Rangia cuneata, Littoridina sphinctostoma, Cerithidea pliculosa, Rangia flexuosa y Mulinia lateralis. Estas especies son de igual manera las de mayor distribución. 5. En los bivalvos, el tipo de nutrición más frecuente es la filtradora (38 especies, 77.6%) y en los gasterópodos la carnívoranecrófaga (28 especies 60.8%). 6. La relación con el sustrato y salinidad del habitat, en los bivalvos es infaunal (38 especies 77.5%) y marino (33 especies 67.3%). En los gasterópodos es epifaunal (36 especies 78.1%,) y marino (27 especies 58.6%). 7. Las estaciones con el mayor número de especies y ejemplares colectados son: LCM-20, LCM-21 y LCM-22 localizadas en la laguna del Carmen. 8. Considerando las condiciones hidrológicas y la fauna malacológica presente en ellas, se reconocen cuatro zonas o áreas en el sistema lagunar: 1) Areas lagunares asociadas a los ríos. 2) Lagunas y esteros internos. 3) Cuerpo central del sistema y 4) Zonas de influencia marina. Cada una de ellas con fauna característica. 9. Los valores medios de la diversidad para los bivalvos fue de 0.91, para los gasterópodos de 1. 16 y para la población total de moluscos de 1.92. Se observa un gradiente en los valores de la diversidad que va de la laguna Redonda (2.62) a la laguna la Palma (1.37). 10. Los valores medios de la afinidad para los bivalvos fue de 31.25%, para los gasterópodos de 36.95% y para la población total de moluscos de 34.86%. Los valores más altos de afinidad para los bivalvos corresponde a las estaciones de la laguna del Carmen y para los gasterópodos y moluscos en general en la laguna Machona. AgradecimientosLos autores hacen patente su agradecimiento a Alfredo Laguarda Figueras y José Luis Rojas Galaviz por su apoyo académico y administrativo. A Felipe Flores Andolais y Francisco Escobar de la Llata por la participación en los muestreos, preparación de materiales y valiosos comentarios. De igual manera a Alejandro Yáñez-Arancibia por la revisión crítica del manuscrito. LITERATURAABBOTT, R. T.,Amerícan Seashells. The Marine Mollusca of the Atlantic and Pacific Coast of North America.Van Nostrand Reinhold Co.2 Ed.,New York,1974.666 p. ––. y H. S. LADD), A new brackish water gastropod from Texas (Amnicolidae: Littoridina). J. Wash. Ac. Sci.,1951.335-338, 12 figs.41(10): ADAMS, C. B., Observations on some species of the marine shells of Massachusetts, with descriptions of five new species.Bost. J. Nat. Hist.,1839.262-288, lám. 4.2(2) : ---,Descriptions of thirteen new species of New England shells.Bost. J. Nat. Hist,1840.318-332, 4 láms.3(3): ---,Descriptions of supposed new species of marine shells wich inhabit Jamaica.Contr. Conch. N. Y.1850a.109-122.,76-108;, 69-75; 56-68; 50-55;1,1,1,1,1(7):, (6):, (5) :, (4) :, (3) : ---,Amherst, Mass.: Monograph of Vitrinella, a new genus of new species of Turbinidae.1850 b.1-10. ANDREWS, J., Shells and Shores of Texas.University of Texas Press. Austin y London.1977.365 p. ANTOLI, F. V., Tesis profesional.Estudio Preliminar sobre la Sistemática y Distribución de la Fauna Malacológica de las lagunas El Carmen y Machona en el estado de Tabasco, México. Fac. Ciencias. Univ. Nal. Autón. México.1981.81 p. BORN, I, Testacea. Index Rerum Naturalium Musei Caesarei Vindobonensis, 1,Vienna,1778.458 p., 1 lám. BOSC, A. G., Histoire naturelle des coquilles.Deterville Eds.,Paris,1802.5 vols. BRILLOUIN, L., Science and Information Theory. Academic Press,New York.1962. BRUGUIÉRE, J. G., Histoire Naturelle des Vers, in: Encyclopédie Méthodique.1789-92.345-757., 1-344;1, 1 (2):, (1): BUSH, K. J., Revision of the marine gastropods referred to the vitrinellids... Trans. Conn. Ac. Ars. Sci.,1897.97-144, lám. 22-23.10(1): ---,Descriptions of new species of Turbonilla of the Western Atlantic fauna, with notes on those previously known. Proc. Ac. Nat. Sci. Phila.,1899.145-177, lám. 8.51: CONRAD, T. A., Descriptions of fifteen new species of recent and three of fossil shells, chiefly from the coast of the United States.J. Ac. Nat. Sci. Phila.,1831a.256-268, lám. 11, figs. 1-20.6(2): ---,American Marine Conchology; or descrip tions and colored figures of the Shells of the Atlantic Coast of North America.Philadelphia,1831 b. 72 p. 17 láms. ---,Descriptions of new tertiary fossi1s from the southern states.J. Ac. Nat. Sci. Phila.,1834.130-157.7(1): ---,Descriptions of new marine shells from Upper California collected by Thomas Nutall Esq.,J. Ac. Nat. Sci. Phila.,1837.227-68, láms.17-20.7: ---,Observations on the Genus Gnathodon, with description of a new species.Am. J. Sci. Art.,1839.92, fig. 1.38(1): ---,Descriptions of new species of fossil and recent shells and corals.Proc. Ac. Nat. Sci. Phila.,1846.19-27, 2 láms.3(1): ---,Descriptions of new fossil and recent shells of the United States.J. Ac. Nat. Sci. Phila.,1849.207-209, lám. 39, figs. 8-10.1(3) ---,Descriptions of new, recent and miocene shells.Proc. Ac. Nat. Sci. Phila.'1863583-586.14 DALL, W. H., 15, Preliminar report on the mollusca.Reports on the results of dredging... in the Gulf of Mexico, and in the Caribbean Sea, 1877-79, by the .. . Steamer Blake.Bull. Mus. Comp. Zool.,1881.33-144.9(2): ---,29. Report on the mollusca,Reports on the results of dredging... in the Gulf of Mexico (1877-78) and the Caribbean Sea (1879-1889) by the... Steamer Blake, Brachiopoda and Pelecypoda. Bull. Mus. Comp. Zool., part 1,1886.171-318, láms. 1-9.12(6): ---,Contributions to the Tertiary Fauna of Florida.Trans. Wagner Free Inst. Sci. Phila.,1890-1903.1219-1654, láms. 48-60., 36-47; 949-1218, láms., 571-847, láms. 2335; , 483-570;, 201-473, láms. 1322, 1-120, láms. 1-12;3, 3, 3, 3, 3, 3 (6):, (5):, (4):, (3): , (2): , (1): ---,Synopsis of the family Tellinidae and of the North American species. Proc. U. S. Nat. Mus.,1900.285-326, láms. 2-4.23(1210): DANCE, S. P., The Collectors Encyclopedia of Shells.McGraw Hill Book Co.,2 Ed.,New York,1976.288 p. DE LARA, A. R., Tesis profesional.Evaluación de los recursos ostricolas de las lagunas Mecoacan, Machona y del Carmen, Tabasco. Fac. Ciencias. Univ. Nal. Autón. México.1972.33 p. ---. y M E. GUTIÉRREZ, Algunos aspectos sobre el cultivo de Crassotres virginica (Gmelin) en el sistema lagunar Carmen Machona Redonda, Tabasco, México. Informes de Pesca,1974.196-202.159(1): GABB, W. M., On the topography and geology of Santo Domingo.Trans. Amer. Philos. Soc., (N s)1873.49-259, 2 maps.15: GALAVIZ-SOLIS, J. A., Tesis profesional.Morfología y Sedimentos Recientes del Sistema Lagunar El Carmen-Machona, Tabasco, México. Fac. Ingeniería. Univ. Nal. Autón. México,1980.93 p. 10 láms. GARCÍA-CUBAS, A., Sistemática y distribución de los micromoluscos de la laguna de Términos, Campeche, México. Bol. Inst. Geol. Univ. Nal. Autón. México,1963.1-55, 24 figs., 4 láms.67(4): ---,Ecología y distribución de los micromoluscos recientes de la laguna Madre, Tamaulipas, México. Bol. Inst. Geol. Univ. Nal. Autón. México,1968.1-44, 15 figs. 8 láms.86: ---,Ecología y distribución de los micromoluscos recientes de la laguna de Tamiahua, Veracruz, México.Bol. Inst. Geol. Univ. Nal. Autón. México,19691-53, 32 figs. 11 láms.91: ---,Moluscos de un sistema lagunar tropical en el sur del Golfo de México (Laguna de Términos, Campeche).Inst. Cienc. del Mar y Limnol. Univ. Nal Autón. México.1981.1-182.Pub. Esp. 5: GARCÍA, E., Modificaciones al Sistema de Clasificación Climática de Köppen.México, D. F.1964.71 p., 9 gráf. 2 map. GMELIN, J. F., Leipzig. Caroli a Linné Systema Naturae per Regna tria Naturae, 13 Ed.,1791.3021-3910.1(6): GUTIÉRREZ, V. E.,Tesis profesional.Establecimiento de elementos bioecológicos para el cultivo del ostión Crassostrea virginica (Gmelin) en el sistema lagunar Carmen-Machona-Redonda, Tab. Fac. Ciencias. Univ. Nal. Autón. México.1973.67 p. HOLMES, F. S., Post-pleiocene fossils of South Carolina Charleston, S. C. Russell y Jones.1858-60.122 p., 1-28 láms. HUMFREY, M., Sea Shells of the West Indies. W. Collins and Sons Co.,London.1975.351 p. JOHNSON, C. W., List of marine mollusca of the Atlantic Coast from Labrador to Texas. Proc. Bost. Soc. Nal. Hist..,1934.1-204.40(1): KEEN, M. A., Sea Shells of Tropical West America. Marine Mollusks from Baja California to Peru. , Stanford University Press, 2 Ed.California1971.1065 p. 22 láms. ---, y E. COAN, Marine Molluscan Genera of Western North America. An Illustrated Key. Stanford University Press, 2 Ed.,California,1974.208 p. KURTZ, J. D., Portland. Catalogue of recent marine shells found on the coasts of North and South Carolina.,1860.9 p. LAMARCK, J. B., Histoire naturelle des animaux sans vertebres.Paris,1815-22.1-711.1-7: LANKFORD, R. R. Estuarine Processes. Circulation, Sediments and Transport of Material in the Estuary Coastal Lagoons of Mexico: their origin and classification. In: Cronin, L., Ed. Academic Press Inc.New York1977182-21526 LIGHFOOT, J., A Catalogue of the Portland Museum.London.1786.194 p. LINK, H. F., Beschrebung der Naturalien-Sammlung der Universitat zu Rostok.1806-1808.1-37.,1-160;1,(6):, (2-4): LINNAEUS, C., Systema naturae per regna tria naturae.Editio Duodecima, reformata.Stockholm,1758.1-8241 ---,Systema naturae per regna tria naturae.1, Regnum animale:Stockholm,1766-67.1-532, 533-1327 (1767)., (1766) ; MACARTHUR., R., Patterns of species Diversity.Biol. Rev.,1965.510-533.40: MARGALEF, R., La teoría de la información en ecología. Mem. R. Acad. Cienc. Artes.Barcelona,1957.79 p32(13) MAURY, C. J., Recent molluscs of the Gulf of Mexico, and Pleistocene and Pliocene species from the gulf States. Bull. Amer. Paleont., Reprint Paleont. Res. Inst.,1920-22., 34-172 (1922)., (1920) ; 1971 282 p.36-147, 9, 34-172 (38):, (34): McLEAN, R. A., The pelecypoda or bivalve mollusks of Puerto Rico and the Virgin Islands. Ac. Sci., N. Y.1951.1-183.17(1): MENKE, K. T., Verzeichniss der ansehnlichen ConchylienSammlung des Freiherrn von Malburg... Pyrmonti, H. Gelpke:1829.1-123. ---,Synopsis methodica molluscorum generum omnium et specierum earum, quae in Museo Menkeano adservatur; cum synonymia critica et novarum specierum diagnosibus:Pyrinonti: H. Gelpke.1830.1-168. MORRIS, P. A., A Field Guide to Shells of the Atlantic and Gulf Coasts and the West Indies. Houghton Mífflin Co.Boston.1975.330 p. 76 láms. MORRISON, J. P. E., New Brackish Water Mollusks from Louisiana. Proc. Biol. Soc. Wash.,1965.217-224, figs 1-9.78: NEWELL, N. D.,Classification of the Bivalvia.Amer. Mus. Nov.1965.1-24, figs. 1-3.(2206): ORBIGNY, A d'., Mollusques. Histoire Physique, Politique et Naturelle de l'lle de Cuba, In: R. de la Sagra Ed.,1841-46.1-380. 1-264 2:, 1: PFEIFFER, L., Uebersich der in Januar, Februar und Marz auf Cuba gesammelten Mollusken. Arch. fur Naturgeschichte,1840.250-261.6(1) : PHILIPPI, R. A., In: Archiv. fur Naturgeschichte,1836-41.2-7 N. p. ---,Testaceorum novorum centuria. Zeit. fur Malak.,1847.7177, 84-96, 113-1274: ---,Centuria quarta testaceorum novorum. Zeit fur Malak.,1851.49-64, 65-74.8(4): PIELOU, E. C., The measurement of diversity in different types of biological collections. J. Theoret. Biol.,1966.131-144.13: PILSBRY, H. A. y T. L. MCGINTY.,NautilusCyclostrematidae and Vitrinellidae of Florida. pt. I,1945.1-13, láms., 1-2.59(1): ---,Nautilus, Vitrinellidae of Florida. pt. IV.1946.12-18, lám. 2.60(1): PULTENEY, R., Catalogues of the Birds, Shells, and some of the more rare Plants of Dorsetshire. From Hutchins., History of that country.2 Ed.,London,1799.1813 p. PULLEY, T. E., A new species of Chione from the western Gulf of Mexico. Tex. J. Sci.,1952.61-64, 1 lám.4(1): RAFINESQUE, C. S., Monographie des coquilles bivalves et fluviatiles de la riviére Ohio. Ann. Gen. Sci. Phys. Bruxelles,1820.305-322.5: RÉCLUZ, C. A., Description de coquiles nouvelles. J. Conchyl.,1852.249-256, lám. 10.3: REHDER, H. A., New marine mollusks from the Antillean Region.Proc. U. S. Nat. Mus.,1943.187-203, láms 19-20.93(3161): ---,Field Guide to North American Seashells.A. A. Knopf Inc., New York.,1981894 p., 705 figs. RÖDING P. F., Museum Boltenianum sive catalogus cimeliorum et tribus regnis naturae Pars secunda, Conchylia size testacea, univalvia, bivalvia et multivalvia.Hamburg:1798.199.VIII ROMERO JARERO, J. y H. RODRÍGUEZ, An. Inst. Cienc. del Mar y Limnol. Univ. Nal. Autón. México. Niveles actuales de contaminación coliforme en el Sistema Lagunar del Carmen-Machona, Tabasco.1982.121-1269(1): SANDERS, H. L., Benthic studies in Buzzards Bay. III, The structure of the soft-bottom community.Limnol. Oceanogr.,1960.138-153.5: ---,Marine Benthic Diversity: A Comparative Study.Amer. Natur.,1968.243-282.102(925): SAY, T., An Account of some of the marine shells of the United States. , J. Ac. Nat. Sci. Phila.1822.302-322., 257-276;, 221-248,2, 2(2):, (1): ---,Descriptions of marine shells recently discovered on the coast of the United States. J. Ac. Nat. Sci. Phila.,1826.207-221.5(1): ---,American Conchology, or Descriptions of the Shells of North America. New Harmony, Indiana.1830-34.1-258, 68 láms.1-7: SHANNON C. E. y W. WEAVER, The mathematical theory of comunication. University of Illinois Press, Urbana,1963.117 p. SIMPSON, E. H., Nature,Measurement of diversity.1949.688.163: SOLANDER, D. C., A Catalogue of the Portland Museum,London.1786.194 p. SOWERBY , G. B., The genera of Recent an Fossil shells.Bernard Quaritch.London.1821-34.127-262. 1,- láms. 1-126; 2, láms. SPENGLER, L., Nojene Bestemmuelse og Udvidelse af Det Genas Solen III. Skrift. Nat. Selks. Copenhagen,1794.1-96.3(2): STEARNS, R. E. C., Descriptions of new marine shells from the west coast of Florida. Proc. Ac. Nat. Sci. Phila,1873.344-47, figs 1-4.25: THIELE, J., Handbuch der systematischen Weich tierkunde. jena.1934-35.779-1154, figs. 784-879.2: TOTTEN, J. G., Description of some new shells, belonging to the coast of New England. Amer. J. Sci.,1835.347-352, 1 lám., figs. 1-8.28(2): VERRILL, A. E., Second catalogue of Mollusca recently added to the fauna of the New England Coast.,Trans. Conn. Ac. Art. Sci.,1884.139-294, láms. 28-32.6(6): WARMKE, G. L., y R. T. ABBOTT, Caribbean Seashells.Dover Publications, Inc.,New York,1962.348 p. YÁÑEZ-ARANCIBIA, A., Taxonomia, ecología y estructura de las comunidades de peces en lagunas costeras con bocas efímeras del Pacífico de México. Centro Cienc. del Mar y Limnol. Univ. Nal. Autón. México.1978.1-306.Publ. Esp. 2: ---, y R. S. NUGENT, An. Centro Cienc. del Mar y Limnol. Univ. Nal. Autón. Mexico. El papel ecológico de los peces en estuarios y lagunas costeras.1977.107-113.4(1): laminas
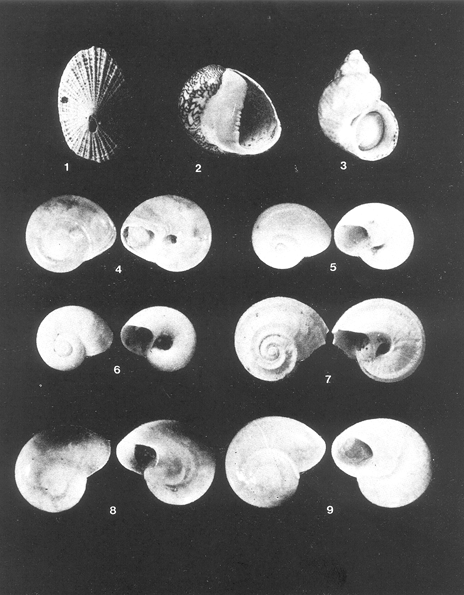 Lám. 1. Fig. 1: Diodora cayenensis (Lamarck, 1822). Fig. 2: Neriti(Vitta) virginea (Linnaeus, 1758). Fig. 3: Cingula (Michodochus) floridana (Redher, 1943). Fig. 4: Vitrinella helicoidea C. B. Adams, 1850. Fig. 5: Vitrinella ultistriata (Verril, 1884). Fig. 6. Vitrinella (Vitrinella) floridana Pilsbry y McGinty, 1946. Fig. 7: Cyclostremiscus (Ponocyclus) Pentagonus (Gabb, 1873). Fig. 8: Teinostoma cryptospira (Verrill, 1884). Fig. 9: Teinostoma arvicallum Pilsbry y McGinty, 1945.  Lám. 2. Fig .1: clostremella humilis Bush, 1897. Fig. 2: Hydrobia totteni Morrison, 1954. Fig. 3: Littoridina (Texaaina) sphinctostoma Abbott y Ladd, 1951. Fig. 4: Alaba incerta (d'Orbigny, 1842). Fig. 5: Cerithiopsis greeni (C. B. Adams, 1839). Fig. 6: Diastoma (Bittium) varium (Pfeifer, 1840). Fig. 7: Triphora nigracincta (C. B. Adams, 1839). Fig. 8: Triphora triserialis (Dall, 1881). Fig. 9; Cerithidea (Cerithideopsis) Pliculosa (Menke, 1829). Fig. 10: Strombus pugilis Linnaeus, 1758. Fig. 11:Epitonium (Gyrascala) rupicola (Kurtz, 1860). 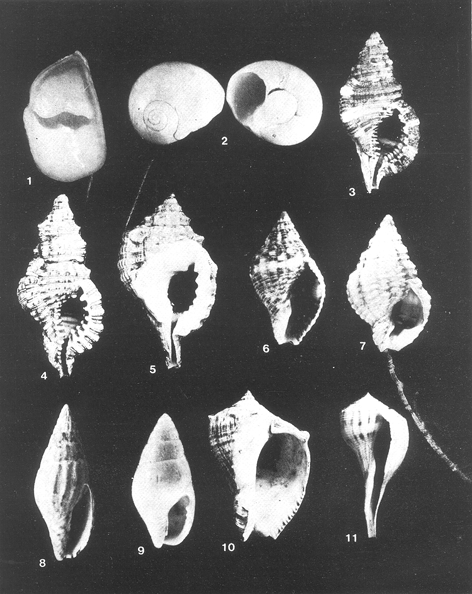 Lam. 3. Fig. 1: Crepicula (Ianacus) plana Say, 1822, Fig 2.Natica (Criptonatica) pusilla Say, 1822. Fig. 3: Cymatium (Septa) pileare (Linnaeus, 1758). Fig. 4: Cymatium (Cymatriton) nicobaricum (Röding, 1798). Fig. 5: Cymatium (Gutturnium) muricinum (Röding' 1798). Fig. 6: Thais (Stramonita) haemastoma floridana (Conrad, 1837). Fig. 7: Antillophos candei (d'Orbigny, 1842). Fig. 8: Anachis (Costanachis) semiplicata (Stearns, 1873). Fig. 9: Mitrella (Astyris)a (Say, 1826). Fig. 10: Melongena (Melongena) melongena (Linnaeus, 1758). Fig. 11: Busycon (Fulguropsis) spiratum lagosum (Conrad, 1863).  Lam. 4.Fig. 1: Nassarius (Nassarius) acutus (Say, 1822). Fig 2. Nassarius (Nassarius) vibex (Say, 1822). Fig. 3: Olivella (Niteoliva) minuta (Link, 1807). Fig. 4: Cymatium (Cymatriton) nicobaricum (Röding, 1798). Fig. 5: Cymatium (Gutturnium) muricinum (Röding' 1798). Fig. 6: Thais (Stramonita) haemastoma floridana (Conrad, 1837). Fig. 7: Antillophos candei (d'Orbigny, 1842). Fig. 8: Anachis (Costanachis) semiplicata (Stearns, 1873). Fig. 9: Mitrella (Astyris)a (Say, 1826). Fig. 10: Melongena (Melongena) melongena (Linnaeus, 1758). Fig. 11: Busycon (Fulguropsis) spiratum lagosum (Conrad, 1863).  Lam. 5. Fig. 1: Nuculana (Saccella) acuta (Conrad, 1831). Fig. 2: Barbatia (Acar) domingensis (Lamarck, 1819). Fig. 3: Anadara (Cunearca) brasiliana (Lamarck, 1819). Fig. 4: Anadara (Cunearca) chemnitzii (Philippi, 1851). Fig. 5: Anadara (Lunarca) ovalis (Bruguiére, 1789) Fig. 6: Arcopsis adamsi (Dall, 1886). Fig. 7: Noetia (Eontia) ponderosa (Say, 1822). Fig. 8: Glycymeris (Tucetona) pectinata (Gmelin, 1791).  Lám. 6. Fig. 1: Brachidontes (Hormomya) exustus (Linnaeus, 1758). Fig. 2: Ischadium recurvus (Rafinesque, 1820). Fig.3: Lithophaga (Diberus) bisulcata (d'Orbigny, 1842). Fig. 4: Argopecten gibbus (Linnaeus, 1758). Fig. 5: Anomia simplex d'Orbigny, 1842. Fig. 6: Crassostrea virginica (Gmelin,1791).  Lám. 7. Fig 1: Ostrea questris Say, 1834. Fig. 2: Lucina (Phacoides) pectinata (Gmelin, 1791). Fig. 3: Diplodonta (Diplodonta) punctata (Say, 1822). Fig. 4: Crassinella lunulata (Conrad, 1834). Fig. 5: Trachycardium (Trachycardium) isocardia (Linnaeus, 1758). Fig. 6: Trachycardium Dallocardia) muricatum (Linnaeus, 1758). Fig. 7: Laevicardium mortoni (Conrad, 1830).  Lám. 8. Fig. 1: Dinocardium robustum (Solander, 1786). Fig. 2: Mulinia lateralis (Say, 1822). Fig. 3: Rangia cuneata (Gray, 1831). Fig. 4: Rangia (Rangianella) flexuosa (Conrad, 1839). Fig. 5: Strigilla (Strigilla) mirabilis (Philippi, 1841). Fig. 6: Macoma tenta (Say, 1834). Fig. 7: Macoma (Austromacoma) constricta (Bruguiére, 1792).  Lám. 9. Fig. 1: Macoma (Psammacoma) brevifrons (Say, 1834). Fig. 2: Macoma (Psammacoma) tageliformis Dall, 1900. Fig. 3: Donax variabilis texasiana Philippi, 1847. Fig. 4: Iphigenia brasiliana Lamarck, 1818). Fig. 5: Semele Proficua (Pulteney, 1799). Fig. 6: Tagelus Plebeius (Lightfoot, 1786).  Lám. 10. Fig. 1: Tagelus (Mesopleura) divisus (Spengler, 1794). Fig. 2: Mytilopsis leucophaeata (Conrad, 1831) Fig. 3: Polymesoda caroliniana (Bosc, 1802). Fig. 4: Chione (Chione) cancellata (Linnaeus, 1767). Fig. 5: Chione (Chione) intapurpurea (Conrad, 1849). Fig. 6: Chione (Lirophora) clenchi Pulley, 1952. Fig. 7: Chione (Timoclea) grus (Holmes, 1858).  Lám. 11. Fig. 1: Anomalocardia auberiana (d'Orbigny, 1842). Fig. 2: Mercenaria campechiensis (Gmelin, 1791). Fig. 3: Tivela mactroides (Born, 1778). Fig. 4: Macrocallista maculata (Linnaeus, 1758). Fig. 5: Cyclinella tenuis (Récluz, 1852). Fig. 6: Coralliophaga coralliophaga (Gmelin, 1791) Fig. 7: Corbula (Caryocorbula) contracta Say, 1822. Fig. 8: Martesia cuneiformis (Say, 1822).
|

