|
ECOLOGÍA DE LA BOCA DEL CARMEN, LAGUNA DE TÉRMINOS. EL HABITAT Y ESTRUCTURA DE LAS COMUNIDADES DE PECES Trabajo presentado parcialmente en el Simposio Internacional IXTOC-1, México 2-5 junio de 1982. Recibido el 20 de abril de 1983 y aceptado para su publicación el 10 de noviembre de 1983.
HÉRNAN ÁLVAREZ GUILLÉN
ALEJANDRO YÁÑEZ-ARANCIBIA
ANA LAURA LARA-DOMINGUEZ
Universidad Nacional Autónoma de México, Instituto de Ciencias del Mar y Limnología, Laboratorio de Ictiología y Ecología Estuarina. Contribución 360 del Instituto de Ciencias del Mar y Limnología, UNAM. Proyectos UNAM-PCEESC-Pemex; UNAM-CONACYT PCMABEU 005322 y UNAM-CONACYT QCMACFR 001698
RESUMENLa Boca del Carmen es una comunicación natural entre la Laguna de Términos y la Sonda de Campeche. Se realizó un crucero mensual durante el ciclo que comprende de febrero de 1980 a abril de 1981 en tres áreas que caracterizan los diferentes ambientes de la boca. Las mediciones de salinidad, temperatura y transparencia presentaron un comportamiento estacional con los valores más altos durante la época de secas y principio de lluvias (33.5 ppm, 31.2ºC) y los más bajos durante la época de nortes (2.5 ppm, 22.0ºC). El análisis de 2740 peces colectados permite caracterizar las poblaciones de peces en términos de diversidad y abundancia, los cuales presentaron valores máximos durante nortes (28 especies, 0.078 ind. m-², 2.07 g. m-² y tallas promedio pequeñas) los valores mínimos durante secas (8 especies, 0.005 ind. m-², 0.024 g m-² y tallas promedio grandes) ; este comportamiento muestra un patrón de utilización de la boca por parte de las especies de peces que aprovechan la mayor disponibilidad de nutrientes, de materia orgánica y la mayor producción primaria que existe a fines de lluvias y durante nortes y un tránsito reducido durante secas. Existen 47 especies de las cuales 11 comprendieron el 82% en número y 73% en peso total de las capturas, tales especies son:Anchoa mitchilli, Cetengraulis edentulus, Arius felis, A. mlanopus, Eucinostomus gula, Bairdiella chrysoura, Cynoscion arenarius, Stellifer colonensis, Chaetodipterus faber, Citharichthys spilopterus y Sphoeroides testudineus. El 15% de las especies son consideradas sedentarias, 38% usan el área de estudio como área de alimentación y/o crianza y 47% son visitantes ocasionales. Los consumidores de primer orden constituyeron el 21%, los de segundo orden el 32%, los de tercer orden el 21% y las que presentaron un comportamiento tanto de segundo como de tercer orden formaron el 26%. Este subsistema particular y definido de la Laguna de Términos es utilizado preferentemente por peces juveniles y preadultos como área de emigración al mar y/o como una zona de alimentación y/o crianza. La Boca del Carmen es un subsistema dinámico, de ictiofauna transicional y poco propicio para el establecimiento de comunidades permanentes, además, es un área de gran importancia en la interacción estuario-boca-plataforma continental con la cual comparte 41 especies en común (57%). ABSTRACTThe Boca del Carmen is a natural inlet between the Terminos Lagoon and Campeche Sound. A monthly crossing was undertaken during a period from February 1980 to April 1981 in three areas that are characteristic of the inlets various environments. The measurements of salinity, temperature and transparency showed a seasonal variation with the highest values during the dry season and the beginning of the rainy season (33.5 ppm. 31.2ºC) and the lowest during the season of the northerly rains (2.5 ppm, 22.0ºC). The analysis of 2470 fish collected allowed a clasification of them according to diversity and abundance, of which the highest values were present during the periodo of the northerly rains (28 species, 0.078 ind. m-², 2.07 g m-² and the average size small) the lowest values were during the dry season (S species, 0.005 ind. m-², 0.024 g m-² and the average size large); this behavior shows a pattern. of utilization of the inlet by these species that takes advantage of the higher availability of nutrients, organic material and higher primary production that is present at the end of the rainy season and during the northerly storm season and a lowering of activity during the dry season. There are 47 species of which 11 comprise 82% of the total count and 73% of the total weight of the catches, these species are; Anchoa mitchilli, Cetengraulis edentulus, Arius felis, Arius melanopus, Eucinostomus gula, Bairdiella chrysoura, Cynoscion arenarius, Stellifer colonensis, Chaetodipterus faber, Citharichthys spilopterus and Sphoeroides testudineus. Of the total, 15% are considered sedentary, 38% use the study area for feeding and/or growing and 47% are non-Permanent residents Primary order consumers comprise 21%, second order consumers 32%, third order 21% and those with behavior that could be classified as either second or third order 26%. This particular and well-defined subsystem, the Terminos Lagoon is used chiefly by juvenile and pre-adult fish as an emigration area en transit to the sea and/or as a feeding area and/or growing area. The Boca del Carmen is a dynamic subsystem, with a transitional ictiofauna and is not well-adapted to the establishment of permanent communities. It is also a very important area in the interaction of the estuaryinlet-continental shelf region, the latter shares 41 species with the Boca del Carmen (57%).
INTRODUCCIÓNEl estudio de las lagunas costeras reviste una considerable importancia por ser áreas ecológicamente estratégicas como mecanismos de producción de la zona costera y sus efectos en la producción pesquera marina litoral. Los peces constituyen un gran potencial de estos ambientes lagunares-estuarinos desarollando un papel muy importante en el balance energético de estos sistemas ecológicos (Yáñez-Arancibia, 1975 y Yáñez-Arancibia y Nugent, 1977). La Laguna de Términos en el sur del Golfo de México es una de las lagunas costeras más extensas del país, de gran productividad y situada frente a la Sonda de Campeche, siendo ésta una de las principales regiones pesqueras y la de mayor explotación petrolera. Yáñez-Arancibia et al.(1982a) han detectado que la Laguna de Términos tiene incidencia directa en la productividad pesquera de la Sonda de Campeche ya que han comprobado que gran cantidad de especies de peces comerciales utilizan esta área en algún momento de su vida (Yáñez-Arancibia y Lara-Domínguez, 1983). Este tipo de lagunas formadas por islas de barrera, se interrumpen por aberturas relativamente estrechas, es decir presentan bocas estuarinas. Las bocas de estas lagunas son subsistemas bien definidos dentro de la ecología de estos sistemas costeros, y a través de ellas hay intercambio físico, químico y biológico entre las aguas protegidas y el mar. La Boca del Carmen es un habitat particular en la Laguna de Términos, siendo una de las conexiones entre el estuario y la plataforma continental adyacente, los cuales en conjunto forman un sistema ecológico de interacción influenciados por factores físicos. La mayoría de los peces comerciales del sur del Golfo de México (± 75%) desovan en el mar y en la línea de costa y sus estadios de postlarvas y juveniles penetran a los sistemas lagunares estuarinos a través de las bocas (Yáñez-Arancibiaet al. 1982a y b). Las primeras fases del ciclo de vida son las más críticas, muchas especies marinas dependientes de estuarios pasan gran parte de este periodo crítico en las bocas, algunas especies de peces desovan en la vecindad inmediata de la boca, unas cuantas completan sus ciclos enteros en las bocas mismas (Günther, 1967; King, 1971; Sabins y Truesdale, 1974; Darnell y Soniat, 1979; Bravo-Núñez y Yáñez-Arancibia, 1979 y Yáñez-Arancibia et al. 1982a y c). Muy pocos estudios se refieren a la ecología de los peces en estas áreas para el Golfo de México en general. OBJETIVOSDe acuerdo a la importancia que estos estudios revisten, el Laboratorio de Ictiología y Ecología Estuarina del Instituto de Ciencias del Mar y Limnología de la Universidad Nacional Autónoma de México, entre sus Programas de Investigación iniciados en 1976 estableció desde febrero de 1980 diferentes estudios sobre la ecología y evaluación de las comunidades de peces de la Laguna de Términos, Campeche, específicamente sobre la Boca del Carmen por lo cual se planteó este estudio sobre la base de los siguientes objetivos: 1. Describir la dinámica ambiental de la Boca del Carmen sobre la base de los siguientes parámetros: salinidad, temperatura y transparencia. 2. Presentación de un catálogo ictiológico de la Boca del Carmen. 3. Determinar la estructura de las comunidades de peces sobre la base de los siguientes parámetros ecológicos de las poblaciones: diversidad, frecuencia, densidad, biomasa, categorías ictiotróficas y componentes comunitarios. 4. Discutir el papel ecológico de las especies dominantes. 5. Discutir las variaciones estacionales de las poblaciones de peces en relación con el comportamiento físico del área de estudio. 6. Caracterizar ecológicamente el área de estudio analizando su papel o función en el ecosistema estuario-boca-plataforma continental. ANTECEDENTESLa Laguna de Términos ha sido objeto de diversos estudios ictiológicos, entre los cuales se destacan: El estudio de los cíclidos por Toral y Reséndez (1974), el que trata aspectos de la biología de dos especies de robalos por Carvajal (1975). Sobre taxonomía, diversidad y abundancia de las mojarras por Aguirre León et al.(1982), sobre taxonomía, diversidad y abundancia de los pomadásidos por Díaz Ruiz et al. (1982). La biología y la ecología de la rayaUrolophus jamaicensis (Cuvier) es tratada por Yáñez-Arancibia y Amezcua Linares (1979), la biología y ecología del bagreArius melanopusGünther es estudiada por Lara-Domínguezet al. (1981). Los estudios sobre la ecología, biología y dinámica de las poblaciones del espáridoArchosargus rhomboidalis(Linnaeus) hecho por Chavanceet al.1985), sobre la biología y dinámica de las poblaciones del sciaenidoBairdiella chrysoura(Lacépède) por Chavanceet al. (1984) , sobre taxonomía y aspectos biológicos y ecológicos de la familiaTetraodontidae por MallardColmenero et al. (1982) y un estudio de las especies de la laguna por Reséndez (1981a y b). Algunas investigaciones se han llevado a cabo referente a la caracterización ambiental y estructura de las comunidades de peces en los diferentes habitat o subsistemas de la Laguna de Términos, tales son: Amezcua Linares y Yáñez-Arancibia (1980) tratan sobre el comportamiento de las comunidades de peces de los sistemas fluvio-lagunares; Vargas Maldonado et al. (1981), estudian las comunidades ícticas en áreas de manglares y de pastos marinos; Yáñez-Arancibia et al. (1980 y 1981) establecen los diferentes habitat y su relación con las poblaciones de peces. Finalmente, Yáñez-Arancibia y Day (1982) y Yáñez-Arancibia et al. (1982a y 1983) caracterizan ambiental y ecológicamente la Laguna de Términos. Muy pocos estudios ictioecológicos se han efectuado en las bocas de la laguna. Bravo-Núñez y Yáñez-Arancibia (1979), discuten la estructura y la dinámica de las poblaciones de peces de la Boca de Puerto Real; Yáñez-Arancibia (1978a), discute la estructura trófica de las comunidades de peces sobre praderas de Thalassia testudinum en Puerto Real. Yáñez-Arancibia et al. (1982c y d) analizan las variaciones nictemerales y estacionales de las comunidades de peces de la Boca de Puerto Real y Boca de Estero Pargo respectivamente. Existen trabajos en los cuales se estudia la ecología de los peces en las bocas estuarinas o acerca del estado de peces marino-costeros juveniles y de su relación que guardan entre los sistemas estuarinos y la plataforma continental adyacente (Simmons y Hoese, 1959; Copeland, 1965; Hoese et al. 1968; King, 1971 y Sabins y Truesdale, 1974). ÁREA DE ESTUDIOLa Laguna de Términos se localiza en el sur del Golfo de México frente a la Sonda de Campeche. Es un área somera y amplia, con un promedio de 3.5 m de profundidad y 2 500 km² de superficie. Dos bocas conectan la laguna con el mar. Existe una gran diversidad de ambientes estuarinos (subsistemas o habitat), incluyendo pantanos de manglar salobre y de baja salinidad, pastos marinos, pastos de pantanos, áreas de alta sedimentación, arrecifes de ostión y la cuenca central salobre. La Boca del Carmen se localiza en la porción oeste de la Laguna de Términos entre los 92º00'-92º50' oeste y los 18º30'-18º40' norte con aproximadamente 6,250 m en su parte más ancha (Fig. 1). Gierloff-Emden (1977), Mancilla y Vargas (1980), Graham et al. (1981) y Dressler (1981) señalan la existencia de un flujo neto desde el mar que penetra a la laguna a través de la Boca de Puerto Real y sale de la laguna hacia el mar a través de la Boca del Carmen, cuantificándolo en un modelo matemático. 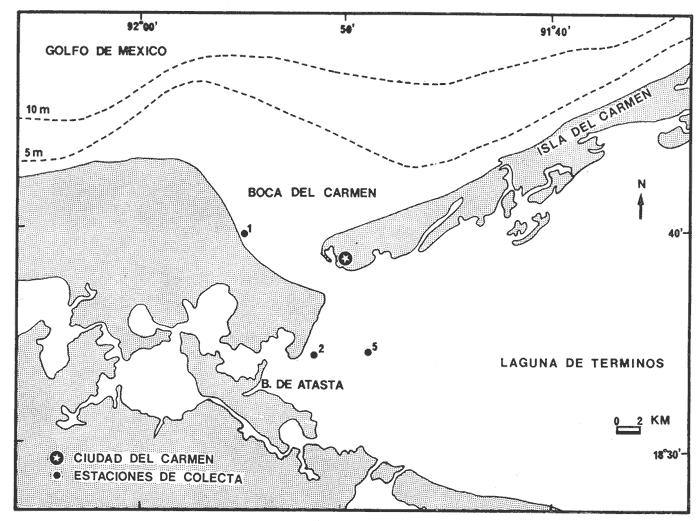 Fig. 1. Área de estudio. Localización de la Boca del Carmen entre Punta Zacatal y la Isla del Carmen. Se señala la ubicación de las estaciones de colecta, la Boca de Atasta del Sistema Fluvio-Lagunar Pom-Atasta y el delta externo de sedimentos terrígenos. Su régimen hidrológico presenta características muy variables que dependen de la meteorología estacional. Prevalecen las condiciones estuarinas por la mezcla de aguas provenientes de los sistemas fluvio-lagunares, la Cuenca Central de la laguna y el mar. En la época de lluvias y nortes predominan las condiciones dulceacuícolas y en época de secas prevalece la influencia marina. La topografía y el patrón de sedimentación también están influenciados por las corrientes (Yáñez-Correa, 1963). Se localiza un canal en el área hasta de 13.5 m recostado hacia la Isla del Carmen y controlado por actividad de dragado, un delta de sedimentación, principalmente terrígena, en el exterior de la laguna sobre la plataforma continental interna extendiendo la isobata de 5.0 m hacia el mar, caracteriza el flujo neto del sistema hacia la plataforma (Fig. 1) . Los sedimentos son de textura variable, resultado de la mezcla gradual de limos y arcillas aportados principalmente por los ríos, y arenas aportadas por el litoral marino de la Isla del Carmen Yáñez-Arancibia et al.1983). La vegetación sumergida la constituyen restos de macroalgas (Rhodophyceae y Phaeophyceae) , eventualmente lirio acuático (Eichhornia crassipes) y manglares poco consolidados en sus orillas (Rhizophora mangle y otros) y afectados por las actividades de erosión litoral. Yáñez-Arancibia y Day (1982) sugieren tres periodos climáticos meteorológicos en relación a la precipitación, descarga de los ríos, frecuencia de vientos y temperatura ambiente: época de secas, de febrero a mayo, época delluvias persistentes en la tarde y noche de junio a octubre y época de nortes con chubascos matinales efímeros de octubre-noviembre a febrero. Otras referencias que complementan información ecológica sobre la Boca del Carmen y sus áreas de influencia son: Ayala-Castañares (1963), Yáñez-Correa (1963), Phleger y Ayala-Castañares (1971), Gierloff-Emden (1971), Amezcua Linares y Yáñez-Arancibia (1980) y Yáñez-Arancibia et al. (1980, 1982a y 1983). MATERIAL Y MÉTODOS
ACTIVIDADES, DE CAMPOSe realizó un crucero mensual durante el ciclo que comprende de febrero de 1980 a abril de 1981. Las estaciones de colecta de la Boca del Carmen se señalan en la figura 1, éstas formaron parte de una red de 18 estaciones de colecta realizadas en la Laguna de Términos conservándose, en este trabajo, la numeración progresiva. Las capturas de peces se efectuaron durante el día en profundidades que no sobrepasaron los 4.0 m, con una red de arrastre de prueba camaronera de 5.0 m de largo y de 2.5 m de abertura de trabajo, con dos tablas de 0.6 X 0.3 m cada una y luz de malla de 3/4" durante 12 minutos a una velocidad de 2.0 a 2.5 nudos. De esta manera se estimó un área muestreada de 2,000 m² para los cálculos de densidad y biomasa (Loesch et al.1972). Durante cada colecta, se midió la salinidad, temperatura y transparencia. Se efectuaron observaciones de sustrato, vegetación sumergida y circundante, macrofauna bentónica y datos climáticos. MATERIAL DE ESTUDIOFueron capturados 2,740 ejemplares de peces en las 45 colectas realizadas en el área, distribuidos de la siguiente manera: Estación 1: 1,220 ejemplares Estación 2: 836 ejemplares Estación 5: 684 ejemplares ACTIVIDADES DE LABORATORIOParámetros Ambientales. Para el tratamiento de los datos ambientales se siguió la metodología propuesta por Yáñez-Arancibiaet al.(1983). Taxonomía. La identificación taxonómica de los peces se hizo empleando la literatura básica, principalmente los trabajos de Jordan y Evermann (1896, 1900), Meek e Hildebrand (1923, 1925 y 1928), Norman (1934), Hildebrand (1943), Cervigón (1966), Gallaway et al. (1972), S. I. C. (1976), Hoese y Moore (1977), Fischer (1978), Castro-Aguirre (1978), Reséndez (1981a y b), Aguirre León et al. (1982) y Mallard Colmenero et al.(1982). Parámetros Ecológicos de las Comunidades. Los peces fueron identificados, contados, pesados y medidos. La talla promedio de las poblaciones de peces fue estimada calculando el peso promedio por individuo, el cual se obtiene dividiendo la biomasa entre la densidad. Este índice (g ind.-¹) aporta información que permite evaluar, en promedio, el tamaño de los peces Yáñez-Arancibia et al. 1982a, c y d). Con base en la talla de los peces, contenido estomacal, morfología del intestino, boca y branquiespinas, se determinó la posición trófica usando el criterio de Yáñez-Arancibia (1978b) y siguiendo la clasificación de los primeros estudios en el área, Bravo-Núñez y Yáñez-Arancibia (1979), Amezcua Linares y Yáñez-Arancibia (1980), Yáñez-Arancibia et al. (1980, 1981) y Vargas Maldonado et al. (1981). Las categorías tróficas descritas en esas referencias son: 1) Consumidores de Primer Orden, 2) Consumidores de Segundo Orden y, 3) Consumidores de Tercer Orden. Basándose en la frecuencia de aparición, madurez gonádica, hábitos alimenticios, patrones de migración, talla y referencias previas en otras áreas similares, se clasificó a cada especie como: 1) Visitante Ocasional o Accidental, 2) Visitante Cíclico o Estacional, 3) Especies Residentes o Típicamente Estuarinas. Estos componentes se basan en una clasificación propuesta por Yáñez-Arancibia et al. (1980). Las especies dominantes se determinaron por índices ecológicos, así como por el análisis de frecuencia, biomasa y abundancia numérica. Se calculó la función H'n de Shannon y Weaver (1963), que se incrementa al aumentar el número de especies (riqueza) y la equitatividad de la abundancia de las especies. Es recomendable considerar por separado los índices que evalúan la riqueza y equitatividad, debido a que estos dos componentes de la diversidad pueden comportarse de forma diferente a ciertos factores. Para el componente de "riqueza de especies" se seleccionó la función (D) sugerida por Margalef (1969). El índice J' de Pielou, (1966), se utilizó para estimar la equitatividad de la abundancia de especies. Todos los cálculos se basaron en logaritmos naturales. La abundancia de peces se calculó por número, densidad (ind. m-²), y biomasa (g · m-²), Se calculó también la función H'w de Wihlm (1968). La afinidad entre las estaciones de colecta se obtuvo de acuerdo a la ictiofauna típica de cada una de ellas en relación a la diversidad, componentes comunitarios, categorías ictiotróficas y especies dominantes de acuerdo al índice sugerido por Amezcua Linares y Yáñez-Arancibia (1980). RESULTADOS
CARACTERIZACIÓN AMBIENTAL DEL SISTEMA ECOLÓGICOLa salinidad de la Boca del Carmen está directamente influenciada por la descarga de los ríos a la Laguna de Términos y por la introducción eventual de las aguas provenientes del Golfo de México. Los registros de salinidad a lo largo de un ciclo anual presentaron un rango de 2.5 ppm (Estación 2) en noviembre siendo este mes el final de la época de lluvias y el comienzo de la época de nortes coincidiendo con la mayor descarga fluvial que reduce apreciablemente la salinidad por las aguas diluidas estuarinas, a 33.5 ppm (Estación 1) en mayo que corresponde al final de la época de secas con valor promedio anual para la Boca de 21.2 ppm (Tablas 1, 2 y 3, Fig. 2). El rango de temperatura fue de 22.0ºC en enero (Estaciones 2 y 5) que es época de nortes, a 31.2°C (Estación 5) en junio que es el comienzo de la época de lluvias, con un valor promedio anual de 27.1ºC. La Boca del Carmen se caracteriza, en general, por presentar alta turbidez, de aquí que la transparencia sea baja, durante el ciclo anual ( 1980-1981) el rango fluctuó de 10.40% en el mes de abril (Estaciones 1 y 2), a 52.00% en junio (Estación 5), con valor promedio anual de 24.51% (Tablas 1, 2 y 3) . Existe un pulso a lo largo del año para los tres parámetros considerados. Se observó que para la salinidad los valores promedios más bajos se presentaron en los meses de octubre a febrero y los más altos de abril a junio. Con lo que respecta a la temperatura( los valores promedios más bajos se registraron en los meses de diciembre a febrero y los más elevados de abril a septiembre. Para la transparencia los valores promedios más bajos se encontraron de octubre a enero y los más altos de junio-julio y febrero-marzo (Tablas 1 a 3). 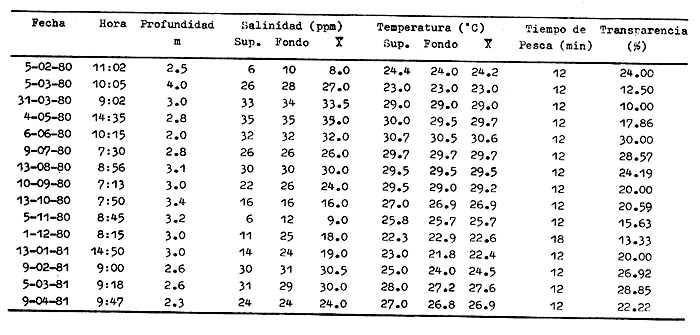 TABLA 1 DISTRIBUCIÓN TEMPORAL DE LA SALINIDAD, TEMPERATURA Y TRANSPARENCIA EN BOCA DEL CARMEN, ESTACIÓN 1 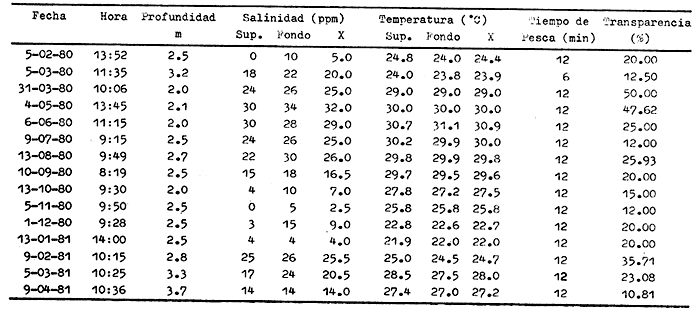 TABLA 2 DISTRIBUCIÓN TEMPORAL DE LA SALINIDAD, TEMPERATURA Y TRANSPARENCIA EN BOCA DEL CARMEN, ESTACIÓN 2 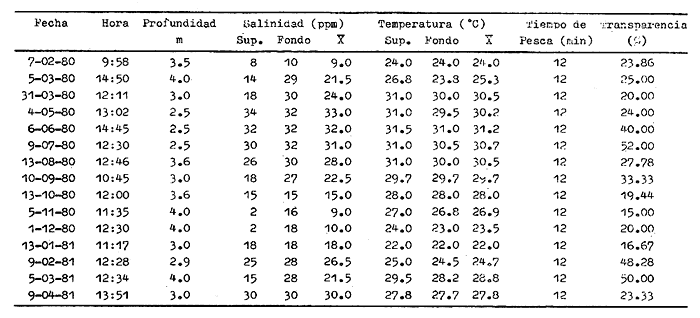 TABLA 3 DISTRIBUCIÓN TEMPORAL DE LA SALINIDAD, TEMPERATURA Y TRANSPARENCIA EN BOCA DEL CARMEN, ESTACIÓN 5 El patrón estacional de la salinidad está altamente correlacionado con el patrón de temperatura y transparencia. Los valores promedios más bajos se registraron durante la época de nortes, la salinidad fue de 6.8 ppm y la transparencia de 14.21% ambos en el mes de noviembre, y defazada dos meses la temperatura con 22.1ºC en enero. Durante la época de secas (mayo) se registraron los valores más altos en salinidad con 32.8 ppm y a finales de la misma época, en junio, la temperatura presentó un valor de 30.9ºC; la transparencia presentó un valor de 36.97% en el mes de febrero a comienzos de secas. Las estaciones de colecta de este estudio (Fig. 1, Estaciones 1, 2 y 5) son estudiadas en conjunto como una sola unidad por Yáñez-Arancibia et al. (1983) quienes establecen una correlación positiva entre los patrones estacionales de la salinidad, la temperatura y la transparencia de las aguas, corroborando los resultados de este trabajo. LAS COMUNIDADES DE PECESFueron colectados 2,740 ejemplares de peces y posteriormente a su análisis se determinaron: 2 clases, 2 divisiones, 6 superórdenes, 10 órdenes, 13 subórdenes, 21 familias, 34 géneros y 47 especies. El ordenamiento sistemático fue hecho de acuerdo al criterio de Greenwood et al. (1966 y 1967) para categorías supragenéricas, mientras que para géneros y especies se adoptó principalmente el criterio de Jordan y Evermann (18961900), Meek e Hildebrand (1923-1928) y Cervigón (1966). Se presenta a continuación una lista sistemática de los peces colectados. 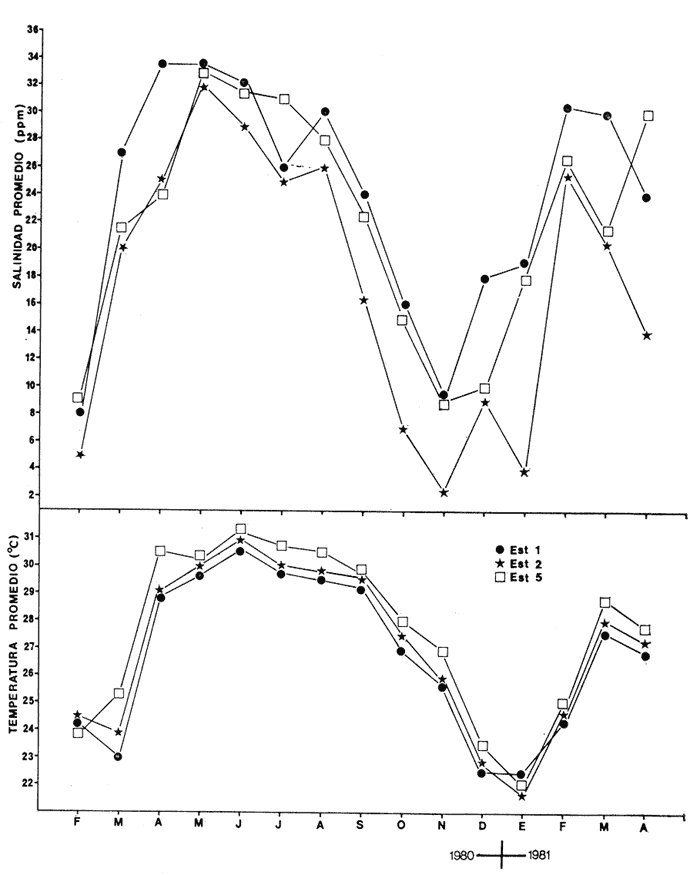 Fig. 2. Variación estacional de los promedios de salinidad y temperatura de las tres estaciones de colecta que caracterizan la Boca del Carmen. Los valores más altos de salinidad se presentan en abril y mayo; los valores mínimos de noviembre a enero. La temperatura es máxima en junio y mínima en enero.  LISTA SISTEMÁTICA DE LA ICTIOFAUNA   DIVERSIDADEstación 1.El menor número de especies se presentó en el mes de mayo de 1980 que corresponde a secas con 4 especies, y el máximo con 12 especies en noviembre del mismo año (nortes) (Tabla 4, Fig. 3). Los valores del índice de diversidad H'n tuvieron un rango de 0.84 en enero de 1981 a 2.11 en junio de 1980 (lluvias). El rango del índice de biomasa H'w fue de 1.28 en febrero de 1981 a 2.00 en agosto de 1980 (lluvias). Los valores de la riqueza de especies (D) fueron de 1.11 en mayo a 3.04 en febrero, ambos en 1980. El índice de equitatividad (J') varió de 0.36 en febrero de 1981 a 0.97 en febrero de 1980 (Tabla 4, Fig. 3). El comportamiento seguido por la diversidad en esta estación parece estar influido por las variaciones del medio en el cual, los mayores valores se presentaron al final de la época de lluvias y durante los primeros meses de nortes (octubre-noviembre), cuando la descarga de los ríos es mayor trayendo como consecuencia que la salinidad y la transparencia disminuyan drásticamente (Tabla 1, Fig. 2), la temperatura empieza a disminuir y los niveles de productividad primaria son más altos en la laguna (Yáñez-Arancibia y Day, 1982; Day et al.1982), esto puede ocasionar que durante esta época lleguen a la laguna numerosas especies con fines de crianza, reproducción y/o alimentación (Amezcua Linares y Yáñez-Arancibia 1980 y Yáñez-Arancibia et al.1981). El alto valor de diversidad que se presentó a finales de nortes y principios de secas podría deberse al abandono de la laguna por parte de algunas especies, el que es detectado en el área de estudio. Los menores valores de diversidad se presentaron a finales de nortes y en general durante toda la época de secas cuando la salinidad en el área es mayor y la temperatura es alta aun cuando no alcanza su máximo valor. Estación 2. El menor número de especies corresponde al mes de mayo de 1980 (secas) con 2 especies y existen dos meses con valores altos con 15 especies cada uno, septiembre del mismo año (lluvias) y febrero de 1981 (Tabla 5, Fig. 4). Los valores del índice de diversidad tuvieron un rango de 0.50 en mayo de 1980 a 1.99 en febrero de 1981. El índice de biomasa varió de 0.32 en julio de 1980 a 2.11 en febrero de 1981. Los valores de la riqueza de especies van de 0.62 en mayo de 1980 a 3.5 en febrero de 1981. El rango del índice de equitatividad fluctuó de 0.53 en septiembre a 0.92 en marzo, ambos en 1980 Tabla 5, Fig. 4). Tabla 4 Tabla 5 Tabla 6 Tabla 7 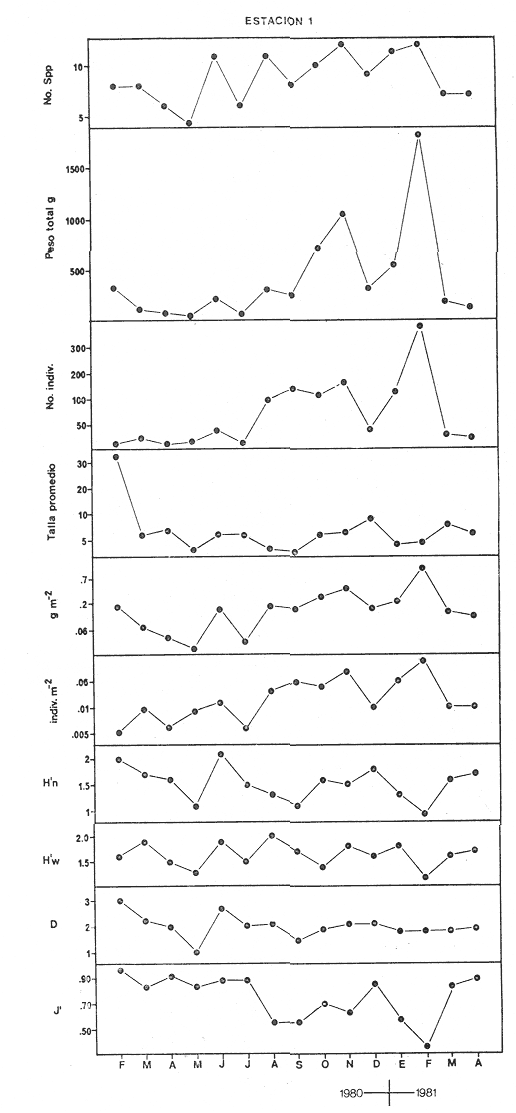 Fig. 3. Variación temporal y relación entre la diversidad, abundancia, sus índices ecológicos respectivos y la talla promedio en las comunidades de peces de la Boca del Carmen (Estación I). 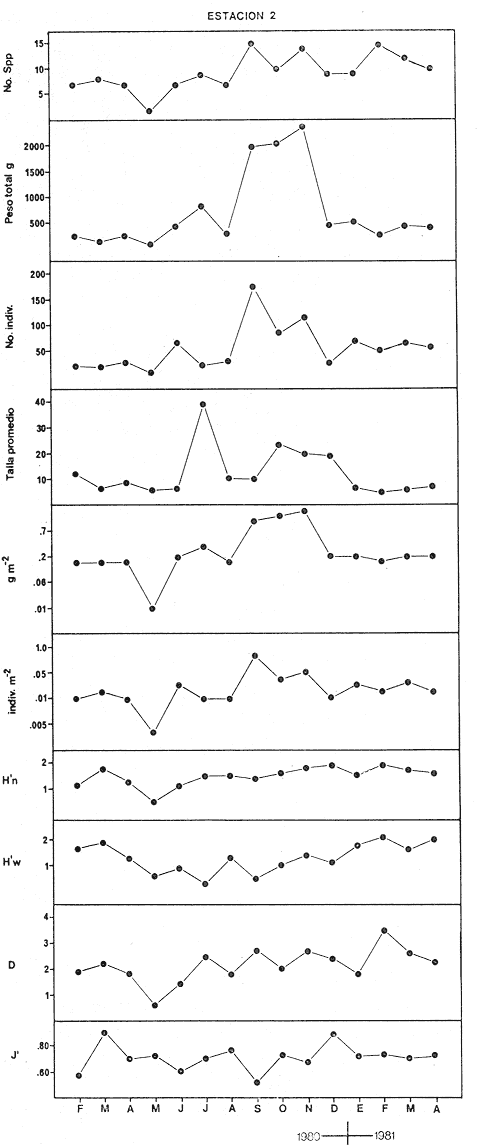 Fig. 4. Variación temporal y relación entre la diversidad, abundancia, sus índices ecológicos respectivos y la talla promedio en las comunidades de peces de la Boca del Carmen (Estación 2). En esta estación se observaron dos valores altos de diversidad, uno en septiembre, mes en el que hay gran descarga fluvial a la laguna, y en consecuencia se presentó un claro descenso de la salinidad, en cambio, la temperatura aún se conserva alta; la transparencia es baja aunque no alcanza sus menores valores (Tabla 2, Fig. 2). Este hecho puede estar representando la llegada al área de estudio de especies provenientes de algunos subsistemas cercanos como de la Cuenca Central, Sistemas Fluvio-Lagunares o al inicio del arribo de especies marinas dependientes estuarinas. Otro valor alto se presentó en febrero de 1981 cuando la salinidad está incrementándose, los valores de temperatura todavía se encuentran bajos y la transparencia es medianamente alta (Tabla 2, Fig. 2). Este hecho podría estar causado por una emigración desde el área de estudio hacia el mar o hacia los diferentes habitat de la laguna. Los menores valores de diversidad se presentaron durante mayo que es el mes de mayor influencia marina y la temperatura es alta. La transparencia en este mes es baja. Estación 5. El menor número de especies se presentó durante el mes de abril de 1980 que corresponde a la época de secas con 2 especies, y el mayor valor en noviembre del mismo año al inicio de nortes con 19 especies (Tabla 6, Fig. 5). Los valores del índice de diversidad tuvieron un rango de 0.50 en abril de 1980 con una tendencia a aumentar hacia los meses de lluvias presentando su máximo valor en diciembre del mismo año (nortes) c on 2.45. El rango del índice de biomasa fue de 0.69 en abril a 2.14 en diciembre, ambos en 1980. Los valores de la riqueza de especies fueron de 0.62 en abril de 1980 hasta 4.01 en diciembre del mismo año. El índice de equitatividad varió de 0.50 en febrero a 0.99 en mayo, ambos en 1980 (Tabla 6, Fig. 5). Se observó un gradiente de diversidad en esta estación con los valores más bajos durante la época de secas cuando la salinidad, la temperatura y la transparencia son altas, aunque no alcanzan sus valores máximos. 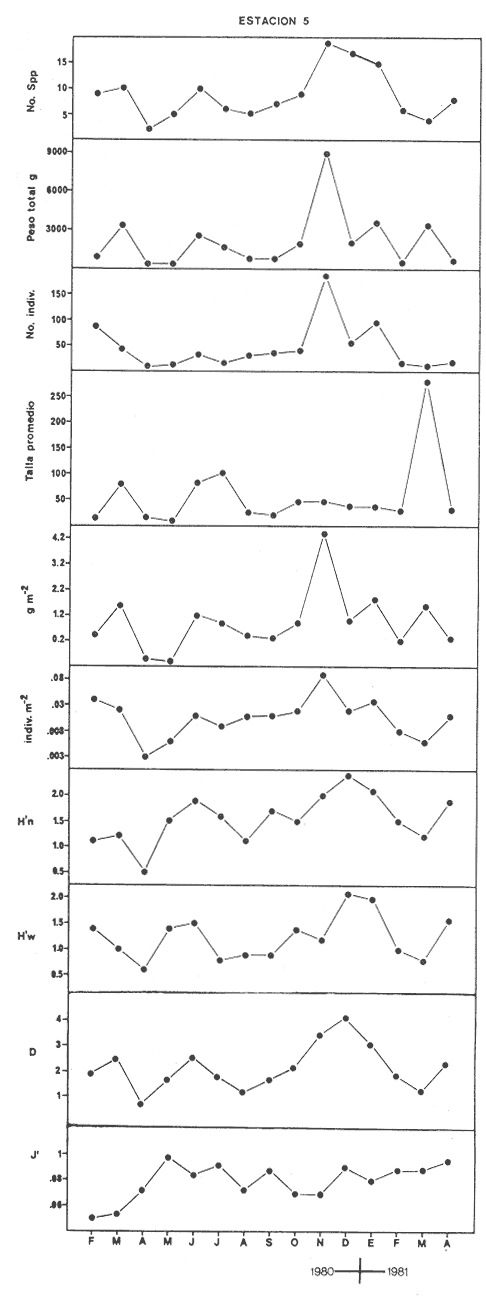 Fig. 5. Variación temporal y relación entre la diversidad, abundancia, sus índices ecológicos respectivos y la talla promedio en las comunidades de peces de la Boca del Carmen (Estación 5). El aumento de la diversidad que existió durante nortes (noviembre-diciembre) al parecer guarda relación con los factores físicos del medio que han sido mencionados en las otras estaciones de colecta, es decir, la salinidad que tiene sus valores más bajos durante estos meses y la temperatura que está muy próxima a llegar a sus menores valores, además, la transparencia tuvo sus valores más bajos durante esta época climática. Total anual. En cuanto a la sumatoria de los valores de las tres estaciones que representa el total anual (Tabla 7, Fig. 6), el menor número de especies se presentó en mayo con 8 y el mayor valor en noviembre con 28 especies, ambos en 1980. Los valores del índice de diversidad tuvieron un rango de 1.23 en octubre de 1980 a 2.79 en diciembre del mismo año. El rango del índice de biomasa fue de 1. 19 en septiembre de 1980 a 2.41 en diciembre de 1980 y en enero de 1981. Los valores de la riqueza de especies fueron de 2.02 en mayo a 4.40 en noviembre y diciembre del mismo año El índice de equitatividad varió de 0.40 en octubre de 0.90 en diciembre, ambos en 1980 (Tabla 7, Fig. 6). La diversidad refleja en parte las diferencias hidrológicas que rigen en el área de estudio. Los menores valores de este parámetro ecológico estuvieron asociados a la salinidad más alta y a temperaturas altas aunque no a la máxima (Fig. 2). Por el contrario, los mayores valores de la diversidad, en general, se presentaron cuando en el área hubo fuerte precipitación, gran descarga de los ríos y altos niveles de productividad primaria en la laguna (Yáñez-Arancibia y Day, 1982; Day et al.1982). Ahora bien, la mayor diversidad que se observó durante los últimos meses de lluvias y a principio de nortes puede estar representando una inmigración desde el mar hacia la laguna de especies dependientes estuarinas (Amezcua Linares y Yáñez-Arancibia, 1980; Yáñez-Arancibia et al. 1980 y 1982a). Asimismo, a fines de nortes muchas de estas especies podrían abandonar la laguna por esta misma boca, esto estaría representado por el alto valor de diversidad que se presentó en esta fecha en las estaciones 1 y 2. Similares relaciones de las variables físicas con la diversidad en bocas estuarinas ya han sido destacadas por Yáñez-Arancibia (1978b). 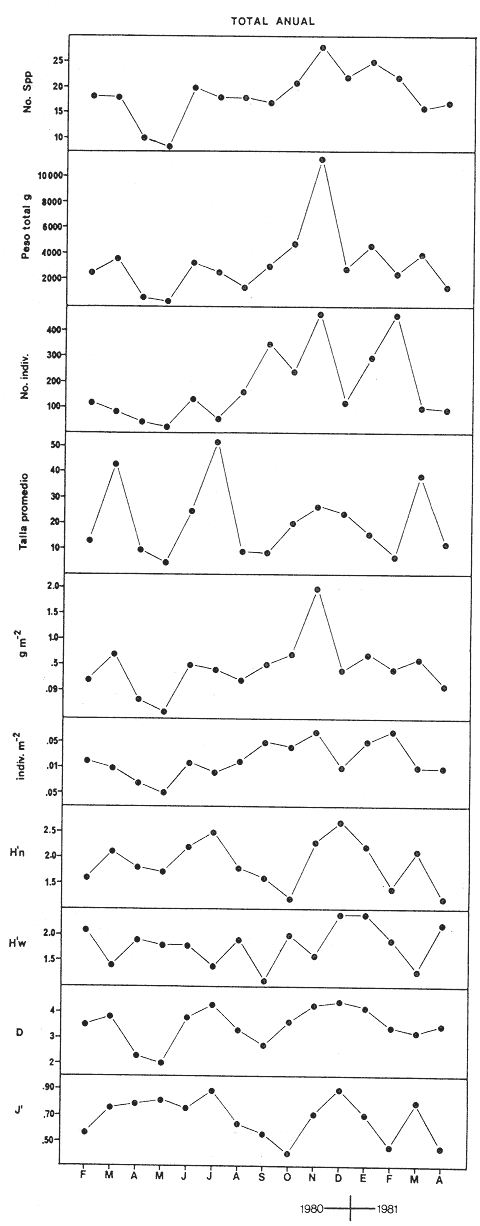 Fig. 6. Variación temporal y relación entre la diversidad, abundancia, sus índices ecológicos respectivos y la talla promedio en las comunidades de peces de la Boca del Carmen durante el ciclo Total Anual. ABUNDANCIAEstación 1. La densidad tuvo un rango que fue de 0.005 ind. m-² en febrero de 1980 a 0.193 en febrero de 1981, ambos meses correspondientes al fin de la época de nortes y principio de secas. En cuanto a la biomasa, su menor valor se presentó en mayo de 1980 con 0.024 g m-² y el mayor valor en febrero de 1981 con 0.91 (Tabla 4, Fig. 3). La abundancia en esta estación mostró gran variabilidad, ya que su menor y mayor valor se presentaron en un mismo mes pero de diferente año. Esto puede explicarse por el hecho de que en febrero de 1981 hubo una numerosa captura de dos especies consideradas como dominantes:Cetengraulis edentulus y Stellifer colonensis las cuales aumentaron considerablemente la abundancia. Además, podrá implicar que durante este mes haya sido registrada en esta estación una emigración hacia el mar de especies que se encontraban en la laguna o en la boca misma y esto podría estar relacionado con la salinidad que se está incrementando rápidamente en el área. Durante febrero de 1980 no fue registrado este fenómeno por lo que los valores de abundancia fueron bajos. Estación 2. La densidad varió de 0.003 ind. m-² en mayo de 1980 a 0.089 en septiembre del mismo año. La biomasa tuvo su menor valor en el mes de mayo con 0.016 g m-² y el mayor en noviembre con 1.195, ambos meses en 1980 (Tabla 5, Fig. 4). La abundancia en esta estación presentó sus picos más altos en la última etapa de la época de lluvias y durante nortes, esto está relacionado con los valores más bajos de la salinidad, la disminución de la temperatura (Tabla 2, Fig. 2) y el incremento de la productividad primaria en la laguna lo que promueve la llegada de numerosos ejemplares, principalmente de juveniles. En cuanto a los menores valores, éstos se presentaron durante la época de secas cuando la salinidad, la temperatura y la transparencia son mayores. Estación 5. Los valores de la densidad fueron de 0.003 ind. m-² en abril de 1980 a 0.093 en noviembre del mismo año. El rango de los valores de la biomasa fue de 0.035 g m² en mayo a 4.475 en noviembre, ambos de 1980 (Tabla 6, Fig. 5). En esta estación como sucede en las otras, la mayor abundancia estuvo relacionada con la época de menor salinidad y cuando la temperatura va decreciendo (Tabla 3, Fig. 2), por otro lado, los mayores valores de abundancia se presentaron durante la mayor salinización del área y la temperatura está llegando a sus más altos valores. La transparencia presentó sus valores más bajos. Total anual. En cuanto a la sumatoria de los valores de las tres estaciones y que representa el total anual (Tabla 7, Fig. 6), muestra que la menor densidad se presentó en mayo de 1980 con 0.005 ind. m-² y la mayor en noviembre con 0.078 del mismo año, un valor muy cercano a éste se presentó en febrero de 1981 con 0.076. La biomasa fue de 0.024 g m-² en mayo a 2.07 en noviembre, ambos en el año de 1980. La información anterior muestra la relación que existe entre el medio y la abundancia. La salinidad muestra mayor relación con la abundancia durante el ciclo estudiado donde los menores valores de densidad y biomasa se presentaron cuando en el área de estudio la salinidad fue mayor. Por el contrario, la abundancia tuvo sus picos más altos cuando la influencia dulceacuícola fue mayor y la salinidad estuvo disminuida. Las posibles causas de la alta densidad que se presentó en febrero de 1981 fueron mencionadas al referirse la abundancia en la estación 1. Un hecho que estuvo relacionado con la mayor abundancia fue la alta productividad primaria que de acuerdo con Yáñez-Arancibia y Day (1982) y Day et al.(1982) se presenta en la laguna cuando existe el mayor aporte fluvial (octubre-noviembre). En apariencia la temperatura no estuvo incidiendo directamente en la abundancia debido a que sus valores extremos no coincidieron con los valores críticos de la abundancia sino que se presentaron retrazados un mes con relación al valor más bajo de abundancia y en dos meses al valor máximo. En ambos casos, puede considerarse despreciable ese defazamiento ya que los valores presentados por la temperatura durante esos meses en que la abundancia tuvo valores críticos son muy cercanos a sus valores extremos (Fig. 2). Por lo que se considera que la temperatura es un factor del medio que influye en la abundancia en la Boca del Carmen. En general los valores bajos de transparencia estuvieron asociados a valores altos de abundancia y en cambio, cuando la transparencia fue alta la abundancia tuvo sus menores valores. Esta relación no fue muy evidente debido a que este factor físico no siguió un patrón definido a lo largo del ciclo. (Tablas 1-3). TALLA PROMEDIOEl tamaño promedio de las poblaciones de peces fue estimado utilizando el peso promedio (g ind.-¹) . De acuerdo a lo anterior se obtuvieron los siguientes resultados: Estación 1. Aquí se presentaron las menores tallas promedio por lo que se establece que se tratan de peces juveniles. No existió una marcada variación en ellas a través del ciclo estacional (Fig. 3). Estación 2. Los ejemplares que fueron capturados en esta estación no presentaron grandes tallas promedio, más bien se tratan de organismos de tamaño intermedio entre las estaciones 1 y 5. Las mayores tallas (Fig. 4) se registraron en lluvias y durante nortes, en los demás meses las tallas fueron pequeñas De acuerdo a esto, se establece que se tratan de peces juveniles. Estación 5. Aquí se presentaron las tallas promedio más grandes de las tres estaciones de colecta (Fig. 5). En marzo de los dos años que abarcó el estudio hubo un incremento en las tallas debido a la presencia en ambos meses de ejemplares de gran tamaño de especies dominantes como Arius felis, Chaetodipterus faber y Sphoeroides testudineus, además de la raya Dasyatis sabina que aún no siendo dominante aportó bastante peso a la captura. Existe un ligero aumento a principios de lluvias, en junio, el cual se debió a la captura de ejemplares grandes de especies que son dominantes, tales son: A. felis, A. melanopus y Ch. faber. En julio hubo un incremento en las tallas., producto de la captura de un ejemplar de gran tamaño de D. sabina (Tabla 6). Total anual. Las tallas de los peces capturados en el área de estudio fueron en su mayoría pequeñas con un promedio de 17.67 g ind.-¹ (Tabla 7) por lo que se tratan de ejemplares juveniles. Existen algunos valores altos debido principalmente a la presencia de la raya Dasyatis sabina durante los meses de marzo de ambos años de muestreo así como en julio de 1980. Además, cuatro especies dominantes influyeron en el aumento de las tallas promedio durante el ciclo estudiado, Arius felis, A. melanopus, Chaetodipterus faber y Sphoeroides testudineus. COMPONENTES COMUNITARIOSDurante la época de secas hubo un claro dominio en número de las especies visitantes ocasionales (Fig. 7), constituyendo 64% en la estación 1 con 16 especies, el 76% en la estación 2 con 22 especies y el 70% en la estación 5 con 14 especies. Le siguieron en abundancia las visitantes cíclicas con 8 especies (32%) en la estación 1; 4 especies (14%) en la estación 2, y 5 especies (25%) en la estación 5. En esta época se presentó en menor número de especies sedentarias y/o típicamente estuarinas, formando el 4%, en la estación 1 con una especie, el 10% en la estación 2 con tres especies y el 5% en la estación 5 con una especie. Durante lluvias se presentó una evidente disminución de las especies visitantes ocasionales en las tres estaciones (Fig. 7) con 12 especies (50%) en la estación 1; 9 especies (41%) en la estación 2, y 11 especies (55 %) en la estación 5. Es notable el aumento de los otros tipos de componentes, los visitantes cíclicos formaron el 37% en la estación 1 con 9 especies, el 45% en la estación 2 con 10 especies y el 30% en la estación 5 con 6 especies. Las especies sedentarias y/o típicamente estuarinas formaron el 13% en la estación 1, el 14% en la estación 2 y el 15% en la estación 5 con tres especies en cada estación. 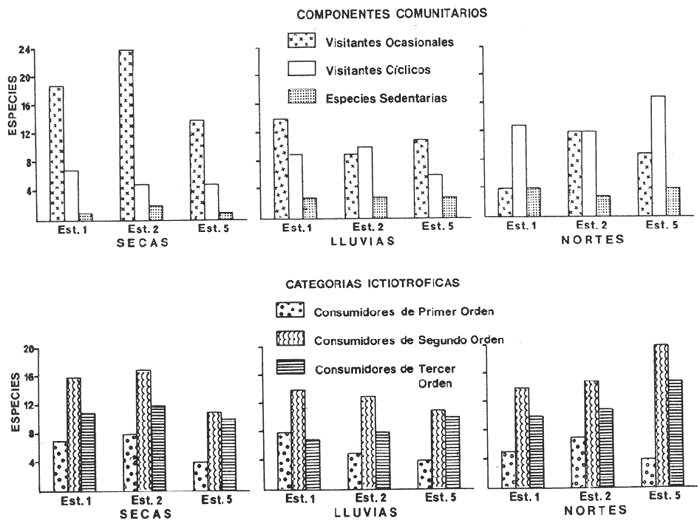 Fig. 7. Distribución estacional de los componentes comunitarios (CC) y categorías ictiotróficas (CI) de las comunidades de peces en las tres estaciones de colecta de la Boca del Carmen durante el ciclo 1980-1981. En nortes fue más evidente la disminución de los visitantes ocasionales (Fig. 7), constituyeron el 20%, con 4 especies en la estación 1; el 44% con 11 especies en la estación 2, y el 30% en la estación 5 con 9 especies. Las especies visitantes cíclicas fueron las más numerosas con 12 especies (60%) en la estación 1; 12 especies (46%) en la estación 2, y 17 especies (57%) en la estación 5. Las sedentarias y/o típicamente estuarinas presentaron durante esta época sus mayores valores con 4 especies (20%) en la estación 1; 3 especies (12%) en la estación 2, y 4 especies (13%) en la estación 5. El balance anual individual de cada una de las estaciones (Tabla 4, 5 y 6, Fig. 8) mostró que en todas ellas las especies visitantes ocasionales fueron las más numerosas, le siguen las especies visitantes cíclicas, y las especies sedentarias y/o típicamente estuarinas fueron las menos representadas. Finalmente, el balance de las comunidades de peces de la Boca del Carmen hecho por la sumatoria de los valores de las tres estaciones que representa el total anual (Tabla 7, Fig. S), mostró que en el área de estudio hay 22 especies visitantes ocasionales (47%), 18 especies visitantes cíclicas (38%) y 7 especies sedentarias y/o típicamente estuarinas (15%). 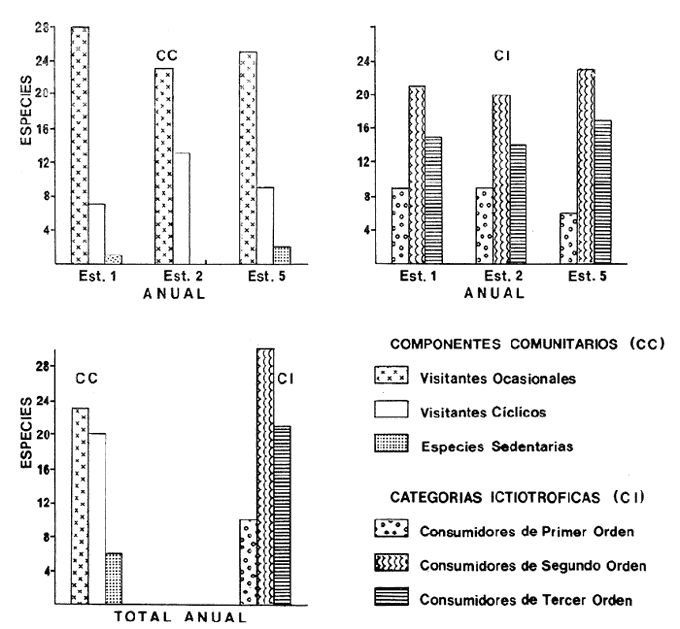 Fig. 8. Distribución anual de los componentes comunitarios (CC) y categorías ictiotróficas (CI) de las comunidades de peces en cada una de las tres estaciones de colecta (parte superior de la figura). En el extremo izquierdo inferior se muestra la integración anual para la Boca del Carmen que incluye la sumatoria de las estaciones analizadas. CATEGORÍAS ICTIOTRÓFICASAlgunas especies pueden cambiar de primer a segundo orden o bien de segundo a tercer orden dependiendo de la disponibilidad de alimento y edad, de esta manera las especies que se comportaron como consumidoras de primero o segundo orden quedaron agrupadas en ambas categorías, lo mismo para las especies que funcionaron como consumidoras de segundo o tercer orden. Durante la época de secas en la estación 1 (Fig. 7), las especies consumidoras de primer orden formaron el 28%, las consumidores de segundo orden el 28% y las de tercer orden el 16%; las que se comportaron como de segundo o tercer orden formaron el 28%. En la misma época, en la estación 2, las especies consumidoras de primer orden constituyeron el 27%, las de segundo orden el 31% y las de tercer orden el 21%; las que se comportaron como de segundo o tercer orden formaron el 21 %. En la estación 5 las especies consumidoras de primer orden formaron el 20%, las consumidoras de segundo orden el 30% y las de tercer orden el 25%; las que se comportaron corno de segundo o tercer orden formaron el 25% El análisis por estaciones mostró que durante secas las especies que se comportaron como consumidoras de segundo orden fueron las más numerosas, en menor número las de tercer orden y por último, las de primer orden. En la época de lluvias, nuevamente las especies consumidoras de segundo orden fueron las mejor representadas en número. En la estación 1, las consumidoras de primer orden formaron el 33%, las de segundo orden el 37% y las de tercer orden el 17%; las que presentaron un comportamiento como de segundo o tercer orden formaron el 13%. Durante esta misma época, en la estación 2, las especies consumidoras de primer orden constituyeron el 23%, las de segundo orden el 41 % y las de tercer orden el 18%; las especies que se comportaron como de segundo o tercer orden el 18%. En la estación 5, las especies consumidoras de primer orden formaron el 20%, las de segundo orden el 30% y las de tercer orden el 25%; las que se comportaron como de segundo o tercer orden formaron el 25%. Durante nortes, en la estación 1, las especies consumidoras de primer orden formaron el 25%, las de segundo orden el 25% y las de tercer orden el 10%; las que se comportaron como de segundo o tercer orden formaron el 40%. En la estación 2 las consumidoras de primer orden constituyeron el 27%, las de segundo orden el 31% y las de tercer orden el 19%; las que presentaron un comportamiento como de segundo o tercer orden formaron el 23%. En la estación 5, las especies consumidoras de primer orden formaron el 13%, las de segundo orden el 37% y las de tercer orden el 20%; las que se comportaron como de segundo o tercer orden formaron el 30% (Fig. 7). Los resultados obtenidos al tratar cada una de las estaciones en particular a través del ciclo anual completo (Fig. 8) mostró que las especies más abundantes fueron las consumidoras de segundo orden, le siguieron las de tercer orden y las menos numerosas fueron las de primer orden. La distribución de las categorías en las estaciones quedó de la siguiente manera: En la estación 1, las consumidoras de primer orden formaron el 26%, las de segundo orden el 30% y las de tercer orden el 18%; las que se comportaron como de segundo o tercer orden formaron el 26%. En la estación 2 las especies consumidoras de primer orden constituyeron el 26%, las de segundo orden el 32% y las de tercer orden el 21%; las especies que presentaron un comportamiento como de segundo o tercer orden formaron el 21 %. En la estación 5 las especies consumidoras de primer orden formaron el 17%, las de segundo orden el 36% y las de tercer orden el 19%; las que se comportaron como de segundo o tercer orden formaron el 28%. Referente ya no al número de especímenes que conforman cada categoría ictiotrófica en las estaciones en particular, sino al total de las especies capturadas en el área de estudio (Fig. 8), se obtuvo que las consumidoras de segundo orden fueron las más abundantes con 15 especies (32%), le siguieron las consumidoras de tercer orden con 10 especies (21%) y las de primer orden con 10 especies (21%). Las que presentaron un comportamiento tanto de segundo como de tercer orden formaron el 26% con 12 especies (Tabla 7). ESPECIES DOMINANTESEstación 1. Nueve especies (26%) resultaron ser dominantes las cuales formaron el 85% en número y el 70% en peso de la captura total en esta estación. Estas especies son:Cynoscion arenarius, Stellifer colonensis, Trichiurus lepturus, Eucinostomus gula, Symphurus civitatus, Bagre marinus, Anchoa mitchilli y Arius melanopus (Tabla 4). Estación 2. Diez especies (29%) constituyeron el 86% en número y el 74% en peso de la captura total en esta estación, tales especies son:Citharichthys spilopterus, A. felis, Sphoeroides testudineus, E. gula, Micropogonias undulatus, S. colonensis, A. melanopus, B. marinus, A. mitchilli y C. arenarius(Tabla 5). Estación 5. Diez especies (29%) fueron dominantes, formaron el 81% en número y el 64% en peso de la captura total en esta estación, tales especies son:Synodus foetens, E. gula, Bairdiella chrysoura, C. spilopterus, S. testudineus, A. felis, Chaetodipterus faber, S. greeleyi, C. arenarius y Menticirrhus saxatilis (Tabla 6). Total anual. De la sumatoria de los valores de las tres estaciones y que representa el total anual (Tabla 7), once especies (23%) resultaron ser dominantes y constituyeron el 82% en número y el 73% en peso de la captura total en el área de estudio, estas especies son:A. felis, B. chrysoura, C. aranarius, S. colonensis, S. testudineus, E. gula, C. spilopterus, Ch. faber, C. edentulus, A. melanopus y A. mitchilli. Se hace notar que existen algunas especies que a pesar de ser dominantes en alguna estación en particular no lograron, sin embargo ser consideradas dominantes en el ciclo total anual, debido a que sólo presentaron ese comportamiento en determinada estación. Así es como, T. lepturus y S. civitatus fueron dominantes únicamente en la estación 1; M. undulatus lo fue solamente en la estación 2, y B. marinus lo fue en ambas estaciones,S. foetens, S. greeleyi y M. saxatilissólo tomaron esa función en la estación 5. COMPORTAMIENTO DE LAS ESPECIES DOMINANTES
Anchoa mitchilli (Tabla 7, Fig. 9) La mayor abundancia de esta especie ocurrió en la época de lluvias siendo septiembre y octubre los meses donde se obtuvieron los mayores valores, durante nortes tienden a bajar y en secas sus valores fueron los más bajos, no mostró un comportamiento regular en esta época, estuvo presente en un año y ausente en el otro. El rango de tallas promedio no presentó una marcada variación. Los resultados obtenidos indican una correspondencia entre la mayor abundancia y los puntos donde hay desalinización y la temperatura y la transparencia empiezan a descender. Diversos trabajos realizados sobre la ictiofauna de la Laguna de Términos mencionan a esta especie. Entre los que están, el realizado por Yáñez-Arancibia et al. (1980) quienes la detectan como visitante cíclico en la laguna con su mayor abundancia numérica en Estero Pargo. Amezcua Linares y Yáñez-Arancibia (1980), la registran como una especie característica de los Sistemas Fluvio-Lagunares con los mayores valores de abundancia numérica en Chumpan-Balchacah y en la Boca de Atasta siendo en esta última donde obtuvieron las mayores capturas. Vargas Maldonado et al. (1981) en el Litoral Interno de la Isla del Carmen la catalogan como una especie ocasional para las épocas de secas y de lluvias. Yáñez-Arancibia et al. (1982c) en un estudio nictemeral y estacional en la Boca de Puerto Real mencionan a esta especie como visitante cíclica. Yáñez-Arancibiaet al. (1982d) en un ciclo anual nictemeral en la Boca de Estero Pargo la registran como una especie dominante con los mayores valores de abundancia durante nortes y los menores durante la época de secas. Yáñez-Arancibia et al. (1982a) reportan que esta especie es dominante en los Sistemas Fluvio-Lagunares, en la Cuenca Central, en el Interior de la Isla del Carmen y en la Boca del Carmen, además, la capturaron con baja frecuencia en la plataforma continental adyacente. 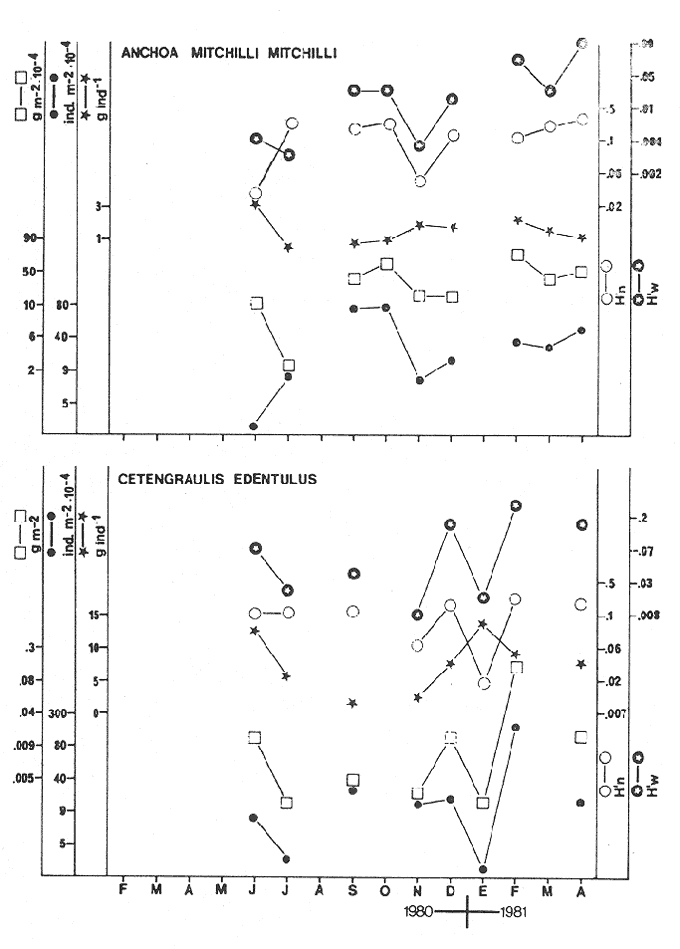 Fig. 9. Variación de la densidad numérica, biomasa, sus índices respectivos y la talla promedio de Anchoa mitchilli y Cetengraulis edentulus en la Boca del Carmen. En lo que respecta a ictioplancton, Flores-Coto y Alvarez Cadena (1980) obtuvieron el mayor número de larvas de esta especie en el área comprendida entre Boca Chica y la Boca de Atasta. Méndez y Velarde (1982) en un estudio estacional del ictioplancton de la Boca del Carmen encontraron la mayor abundancia numérica de la familia Engraulidae en invierno y una disminución gradual de la misma hasta otoño, además, los valores son mayores en el área cercana a Punta Zacatal. Aun cuando en este trabajo no se dan datos a nivel específico, puede señalarse que A. mitchilli está influyendo en la elevada abundancia de la familia Engraulidae en el ictioplancton debido a la alta frecuencia y a la elevada abundancia de esta especie que la hacen ser dominante en el presente estudio, y también por el reducido número de las otras especies de la misma familia presentes en el área, excepto en el caso de C. edentulus que se tratará más adelante. Los datos obtenidos en el presente trabajo y los antecedentes muestran que esta especie utiliza el área de la Boca del Carmen como una zona de crianza y/o alimentación durante las épocas de lluvias y nortes principalmente, aprovechando los altos niveles de producción primaria. Durante secas migra hacia otros subsistemas de la laguna o bien hacia la plataforma continental adyacente. Cetengraulis edentulus(Tabla 7, Fig. 9) La mayor abundancia ocurrió durante nortes y principio de secas, durante esta época, tuvo sus menores valores habiendo sido capturado en un solo mes. Durante lluvias se notó una tendencia a incrementar sus valores. Las mayores tallas promedio se presentaron principalmente durante nortes y en junio de 1980 que corresponde al inicio de lluvias. Esta especie ha sido reportada en varios trabajos en la Laguna de Términos. En los Sistemas Fluvio-Lagunares, Amezcua Linares y Yáñez-Arancibia (1980), la consideran como característica de estos habitat, presentó su mayor abundancia durante las épocas de lluvias y nortes, principalmente en el área de Pom-Atasta, ocasionalmente fue capturado en secas en estos sistemas. Vargas Maldonado et al . (1981) reportan a esta especie como visitante ocasional en el Litoral Interno de la Isla del Carmen con baja densidad. Yáñez-Arancibia et al.(1982c y d) Yáñez-Arancibia y Lara-Domínguez (1983) la consideran como especie ocasional en la Boca de Puerto Real y en la Boca de Estero Pargo respectivamente en dos ciclos anuales nictemerales. Es importante el hecho que esta especie es dominante en las poblaciones de peces demersales en la Sonda de Campeche donde presentó los valores más altos de abundancia y frecuencia durante el verano de 1979 (lluvias) con la mayor biomasa en zonas muy cercanas a la Boca del Carmen (Sánchez-Gil et al. 1981 y Yáñez-Arancibia et al.1982a). En el estudio estacional del ictioplancton en la Boca del Carmen realizado por Méndez y Velarde (1982), mencionan que la familia Engraulidae fue la más abundante con sus mayores valores en invierno y los mínimos en otoño. Además, obtuvieron la mayor captura de larvas de esta familia en el área cercana a Punta Zacatal. Es probable que esta gran abundancia que presenta la familia esté influida en parte por la densidad deC. edentulus de la misma manera que puede suceder conA. mitchilli y que fue tratada con anterioridad. El comportamiento presentado por esta especie en el área de estudio y los antecedentes, hacen suponer que desova en la línea de costa, posiblemente en zonas muy cercanas a la Boca del Carmen durante nortes y las larvas penetran por esta misma en nortes y a principios de secas, y se dirigen hacia los Sistemas Fluvio-Lagunares a crecer y/o alimentarse, y los juveniles abandonan la laguna por la misma boca a fines de lluvias y durante nortes. En este contexto, el área de estudio y zonas adyacentes como Boca de Atasta y Palizada del Este son utilizadas porC. edentulus como zonas de tránsito, crecimiento y/o alimentación en su ruta hacia el mar donde completa su crecimiento. Arius felis (Tabla 7, Fig. 10) Estuvo presente en todo el ciclo anual. La mayor abundancia se presentó a fines de lluvias y en algunos meses de nortes, en secas se presentaron los valores más bajos. Las tallas promedio más pequeñas se presentaron en lluvias y nortes lo que representa individuos juveniles, las mayores durante secas lo que indica la presencia de individuos adultos. Esta especie ha sido reportada en diversos trabajos: Amezcua Linares y Yáñez-Arancibia (1980), la detectan como sedentaria y característica de los Sistemas Fluvio-Lagunares, estuvo bien representada durante lluvias y nortes, y ocasionalmente en secas, además, mencionan su mayor captura en el área de Pom-Atasta principalmente en la boca del mismo sistema con las menores tallas. Vargas Maldonado et al. (1981) consideran aA . feliscomo una especie sedentaria en el Litoral Interno de la Isla del Carmen con la mayor abundancia numérica y las menores tallas durante la época de secas, durante lluvias se presentó el caso contrario. Bravo-Núñez y Yáñez-Arancibia (1979), la mencionan como una especie en tránsito en la Boca de Puerto Real. Yáñez-Arancibia et al. (1982c) en un ciclo anual nictemeral la encuentran corno dominante en las poblaciones de peces de la Boca de Puerto Real con su mayor abundancia durante nortes y secas. Méndez y Velarde (1982), indican la presencia de pequeños juveniles de la familia Ariidae en el ictioplancton de la Boca del Carmen exclusivamente en la zona próxima a Punta Zacatal. Finalmente, Yáñez-Arancibia et al. (1982a) señalan que A. felis es una especie sedentaria y/o típicamente estuarina de la Laguna de Términos, dominante en todos los habitat de ella y también en las poblaciones de peces demersales de la Sonda de Campeche durante todo el año. En base a los datos expuestos, puede indicarse que esta especie podría reproducirse en el área que comprende la Boca del Carmen y en áreas adyacentes como la Boca de Atasta durante la época de secas, y los juveniles permanecen en el área de estudio en lluvias y nortes realizando funciones de alimentación, crecimiento y protegiéndose. Arius melanopus (Tabla 7, Fig. 10) La mayor abundancia se presentó durante lluvias y en menor medida en nortes. En la época de secas fue capturado en un mes por lo que sus valores fueron los más bajos. En general, las tallas promedio más numerosas correspondieron a juveniles, además, durante lluvias fueron capturados ejemplares adultos, disminuyendo en número hacia los primeros meses de nortes. 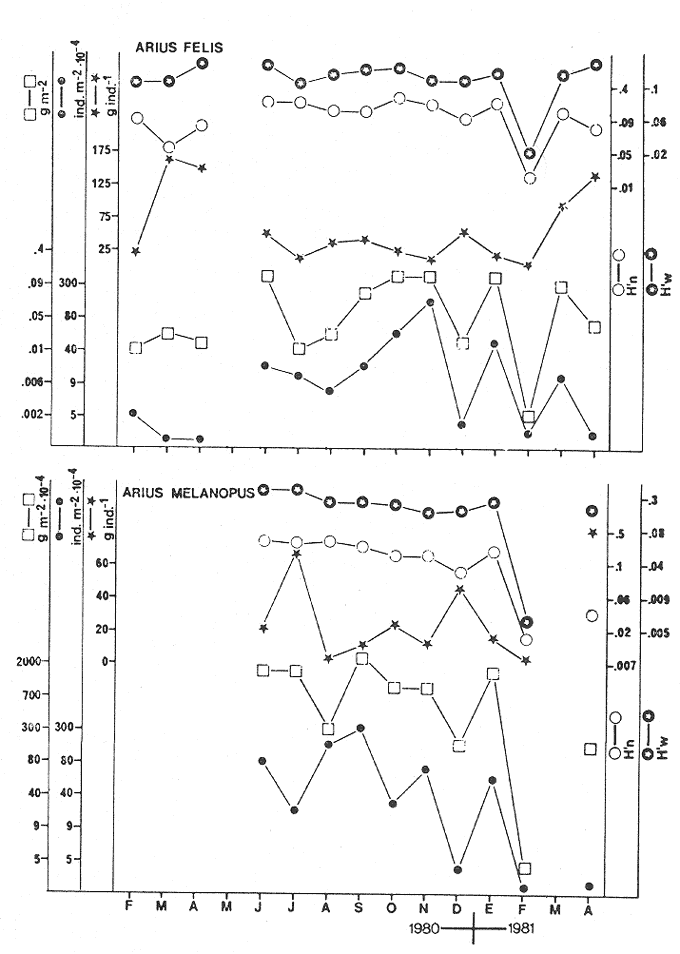 Fig. 10. Variación de la densidad numérica, biomasa, sus índices respectivos y la talla promedio de Arius felis y A. melanopus en Boca del Carmen. Lara-Domínguezet al (1981) mencionan que esta especie utiliza los Sistemas Fluvio-Lagunares como áreas de reproducción y crianza durante la época de lluvias, y los juveniles y adultos posreproductivos, durante secas, se dirigen al Litoral Interno de la Isla del Carmen a alimentarse. De acuerdo a esto, el gran número de juveniles que fueron capturados durante lluvias en el área de estudio se tratan de organismos provenientes de los Sistemas Fluvio-Lagunares como Pom-Atasta y Palizada del Este, los cuales realizan en ella funciones de crianza y alimentación de igual manera, los ejemplares de gran talla que fueron capturados en esta misma época se tratan de adultos posreproductivos. A finales de la época de nortes se notó una disminución en el número de organismos, y de acuerdo a Lara-Domínguez et al. (1981), éstos se dirigen a áreas de alimentación y crecimiento en el Litoral Interno de la Isla del Carmen. Eucinostomus gula. (Tabla 7, Fig. 11) Se encontró durante todo el ciclo anual. Se comportó en general siguiendo un patrón en el que su mayor densidad y biomasa se presentaron en lluvias y durante nortes (agosto-febrero) . Los valores más bajos de abundancia se presentaron durante secas. Las tallas promedio fueron pequeñas los ejemplares de mayor tamaño fueron capturados a fines de nortes y en los primeros meses de secas, y los ejemplares de menor tamaño, durante toda la época de lluvias y a principio de nortes. 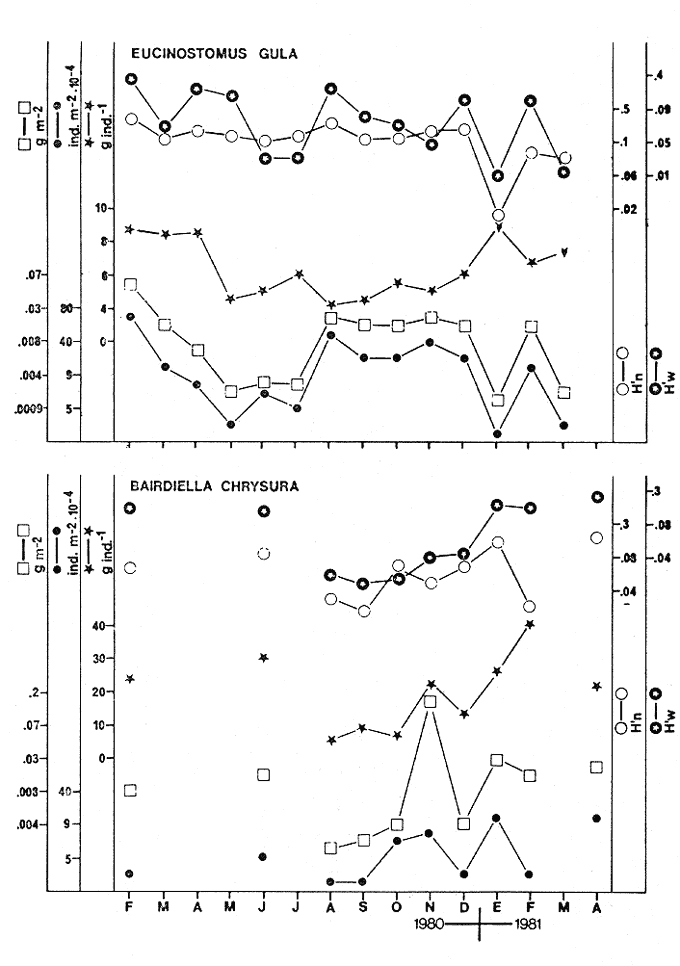 Fig. 11. Variación de la densidad numérica, biomasa, sus índices respectivos y la talla promedio de Eucinostomus gula y Bairdiella chrysura en la Boca del Carmen. Aguirre León et al. (1982) la consideran como residente permanente en la Laguna de Términos siendo la especie que mayor abundancia presentó de las 8 especies de la familia Gerridae que encontraron en ella, además, coloniza todos sus habitat o subsistemas y es capaz de soportar grandes rangos de salinidad, temperatura y transparencia. Sánchez-Gil et al.(1981) y Yáñez-Arancibia et al. (1982a) reportan a esta especie como dominante por abundancia y frecuencia de aparición en la laguna y en la Sonda de Campeche durante todo el año. Yáñez-Arancibia et al. (1982c y d) la mencionan como dominante en las comunidades de peces de la Boca de Puerto Real y Estero Pargo respectivamente en ciclos anuales nictemerales. Méndez y Velarde (1982) indican haber capturado larvas de la familia Gerreidae en la Boca del Carmen con la mayor abundancia principalmente a fines de primavera y principios de verano. Estos datos podrían estar causados por la presencia de E. gula en el área de estudio, basados en la gran dominancia que presenta esta especie en relación con las otras especies de la familia que se encuentran en la laguna y además por las pequeñas tallas que presenta; aunque esto no puede asegurarse. Los datos obtenidos en el presente trabajo y los antecedentes presentados indican que juveniles de E. gulason residentes permanentes de la Boca del Carmen en la cual efectúa funciones de alimentación y/o crecimiento. Es probable que los ejemplares colectados en el área de estudio provengan de lugares más protegidos y cercanos a ella como Estero Pargo y Pom-Atasta donde son abundantes. Bairdiella chrysoura (Tabla 7, Fig. 11) La mayor abundancia de esta especie se presentó a finales de la época de lluvias y durante nortes (octubre-febrero) . En secas estuvo poco representada no habiendo sido capturada en algunos meses de esta época. Las menores tallas promedio se presentaron a fines de lluvias (agosto-octubre) y las mayores durante nortes. Diversos trabajos mencionan a esta especie en la Laguna de Términos: Amezcua Linares y Yáñez-Arancibia (1980), consideran a esta especie como característica de los Sistemas Fluvio-Lagunares por su elevada abundancia y frecuencia, principalmente en Candelaria Panlau. Yáñez-Arancibia et al. (1980) reportan su mayor abundancia en Candelaria Panlau. Vargas Maldonado et al. (1981) reportan que esta especie es dominante en el Litoral Interno de la Isla del Carmen en lluvias y secas. Yáñez-Arancibiaet al. (1982c) la detectan como una especie residente permanente y dominante en un ciclo anual nictemeral, en la Boca de Puerto Real. Yáñez-Arancibia et al.(1982d) la detectan como residente permanente y dominante en las comunidades de peces de la Boca de Estero Pargo. Chavance et al. (1984) encuentra su mayor área de reproducción en Candelaria Panlau durante secas, y también presenta pequeñas áreas de reproducción en diferentes habitat o subsistemas de la Laguna de Términos, consideran a la Boca del Carmen y zonas adyacentes como áreas de baja frecuencia. Yáñez-Arancibia et al. (1982a) catalogan a B. chrysoura como residente permanente y dominante en todos los subsistemas de la laguna. De acuerdo a los resultados obtenidos en este estudio y a la información presentada, se sugiere que B. chrysoura utiliza el área de estudio como una zona de alimentación y/o crianza principalmente. La baja frecuencia que presentó durante la época de secas puede estar relacionado con la etapa de reproducción de la especie, que se dirige a aguas más protegidas y de menor salinidad (Chavance et al.1984). Cynoscion arenarius(Tabla 7, Fig. 12) Su mayor abundancia se presentó a fines de lluvias y principios de nortes (octubre-noviembre) y decrece hasta secas siendo en esta época cuando se presentaron los menores valores, no habiendo sido capturado en abril de 1980 y en los tres primeros meses de lluvias. Las mayores tallas promedio se presentaron durante nortes, de diciembre de 1980 a febrero de 1981. La mayoría de los ejemplares capturados en el área de estudio fueron de tallas pequeñas tratándose de juveniles. Esta especie ha sido reportada por varios autores en la Laguna de Términos: Yáñez-Arancibia et al. (1980) la consideran visitante cíclica y la capturaron únicamente en Pom-Atasta. Reséndez (1981b), la reporta hacia el lado occidental de la laguna y obtuvo la mayor captura en la Laguna de Atasta en julio de 1970, la cual estuvo formada en su mayoría por organismos pequeños. Sánchez-Gilet al. (1981) y Yáñez-Arancibia et al. (1982a) la consideran como dominante en la Sonda de Campeche donde presentó su mayor biomasa en áreas cercanas al área de estudio, durante la época de lluvias, en junio de 1979 y julio de 1981 respectivamente. Flores-Coto y Alvarez Cadena (1980), capturaron larvas deCynoscion sp en la laguna con mayor abundancia en nortes y secas; hubo una captura de 14 larvas en la Boca del Carmen en mayo de 1976. Estas larvas podrían ser deC. arenarius ya que Shlosman y Chittenden (1981), mencionan que esta especie en el norte del Golfo de México, tiene un desove durante marzo-mayo, y que sus huevos y larvas penetran a estuarios a crecer y protegerse. Debido a la presencia de dos especies más en la laguna, C. nothus y C. nebulosusmencionadas por Yáñez-Arancibia et al.(1982a), impide asegurar tal hecho. 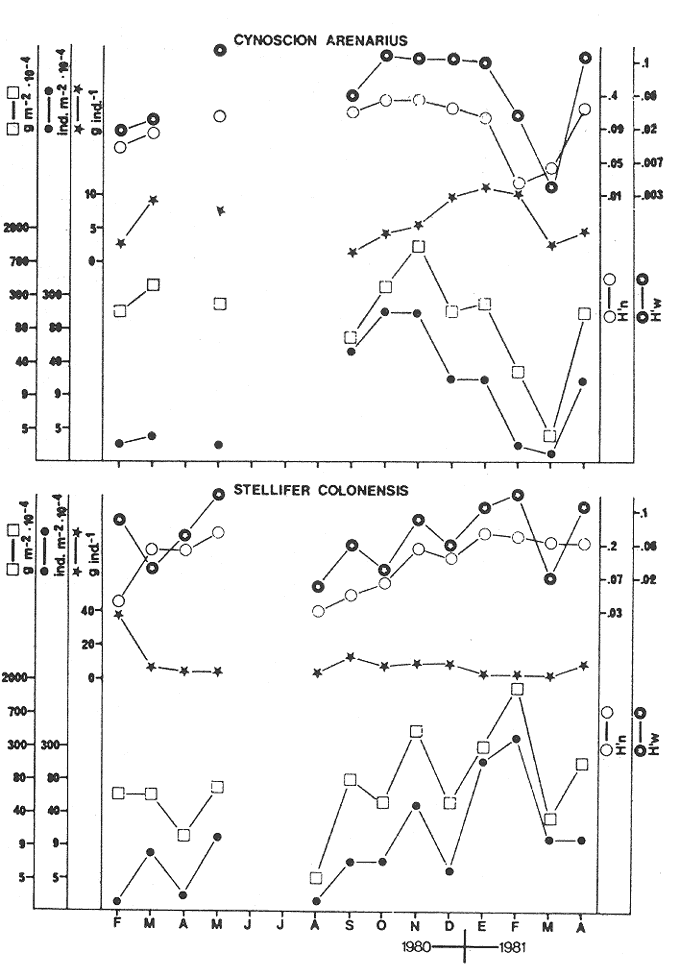 Fig. 12. Variación de la densidad numérica, biomasa, sus índices respectivos y la talla promedio de Cynoscion arenarius y Stellifer colonensis en Boca del Carmen En base a la información anterior, se sugiere que esta especie desova en la línea de costa en zonas cercanas al área de estudio durante la época de secas y los primeros meses de lluvias. Los huevos y las larvas penetran a la laguna por la Boca del Carmen probablemente a principios de lluvias (junio-agosto), en la cual se alimentan y crecen durante la época de nortes, distribuyéndose en todas las entradas de los Sistemas Fluvio-Lagunares llegando hasta las cercanías de la Boca de Puerto Real (Yáñez-Arancibia et al. 1981) pero no utiliza esta boca como lo muestran los trabajos de Bravo-Núñez y Yáñez-Arancibia (1979) y Yáñez-Arancibiaet al. (1982c) quienes no la capturaron en dos ciclos anuales diferentes en esa área. A fines de nortes y principio de secas abandona la laguna dirigiéndose a la Sonda de Campeche a completar su ciclo de vida. En esta interacción estuario-boca-plataforma continental, C. arenarius, es una especie sedentaria en la Boca del Carmen la que utiliza como vía de comunicación entre el estuario y el mar, además, realiza en ella y en zonas adyacentes como Boca de Atasta y Boca Chica, funciones de crecimiento y alimentación. Stellifer colonensis (Tabla 7, Fig. 12) Estuvo presente la mayor parte del ciclo. Durante la época de secas presentó la menor abundancia y no fue capturado en los dos primeros meses de lluvias (junio-julio). Se notó un aumento en los valores hacia los meses finales de lluvias y obtuvo su mayor abundancia durante la época de nortes. Las tallas promedio no presentaron una marcada variación manteniéndose constante a través del ciclo, y de acuerdo a éstas, se tratan de ejemplares juveniles. Esta especie ha sido reportada en las costas mexicanas por S.I.C. (1976), su distribución abarca de las costas de Veracruz a Panamá. Existen pocos trabajos en la Laguna de Términos en los que se le mencione: Yáñez-Arancibiaet al. (1982a) la consideran visitante cíclica en la laguna con distribución limitada a las entradas de los Sistemas Fluvio-Lagunares y a la Boca del Carmen, siendo en este subsistema donde se encuentra bien representada, además, es considerada como una especie dominante en las poblaciones de peces demersales de la Sonda de Campeche durante julio de 1979 y marzo de 1982 siendo capturada únicamente en la zona de influencia de la laguna. Puede decirse en base a los resultados del presente trabajo y con los antecedentes, que S. colonensis es una especie sedentaria en la Boca del Carmen en la cual realiza funciones de alimentación y/o crecimiento. Es de suponerse que se reproduce a finales de secas (mayo-junio) en la línea de costa en zonas cercanas al área de estudio, sus huevos y larvas penetran por esta misma a la laguna durante lluvias. Prefiere esta boca para establecerse por las condiciones ambientales que presenta, estando bien representada en las estaciones 1 y 2 del presente trabajo, donde es dominante. Efectúa visitas ocasionales a las entradas de los Sistemas Fluvio-Lagunares durante nortes pudiendo abandonar la laguna a fines de esta época y principios de secas, dirigiéndose al mar a completar su ciclo biológico. Es evidente que esta especie sólo utiliza la Boca del Carmen en sus movimientos de migración hacia la laguna y/o hacia la plataforma continental adyacente, ya que Bravo-Núñez y Yáñez-Arancibia (1979), y Yáñez-Arancibia et al. (1982c) no la capturaron en la Boca de Puerto Real en dos ciclos anuales diferentes. Es por lo tanto, una especie característica del área de estudio. Citharichthys spilopterus(Tabla 7, Fig. 13) Se encontró presente en el área de estudio durante gran parte del ciclo anual, no fue capturado de agosto a octubre de 1980. La biomasa tuvo su pico más alto durante nortes siendo evidente una disminución de sus valores en las épocas de secas y de lluvias. En general la densidad no presentó notables variaciones. Las mayores tallas promedio se presentaron en nortes (diciembre-enero), en las demás épocas climáticas no hubo gran variación estando representadas por tallas pequeñas. 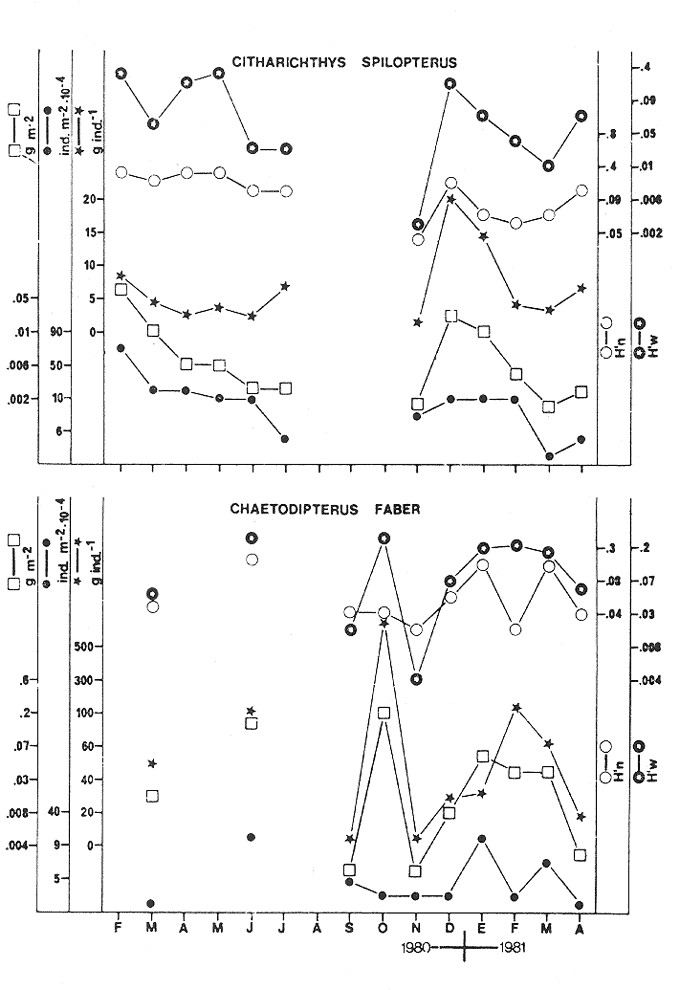 Fig. 13. Variación de la densidad numérica, biomasa, sus índices respectivos y la talla promedio de Citharichthys spilopterus y Chaetodipterus faber en la Boca del Carmen.. Esta especie ha sido reportada en diversos trabajos en la Laguna de Términos: Yáñez-Arancibia et al. (1980) la detectan como sedentaria en la laguna con mayor abundancia numérica en Pom-Atasta. Amezcua Linares y Yáñez-Arancibia (1980), la consideran visitante cíclica en los Sistemas Fluvio-Lagunares con su mayor captura en Pom-Atasta. Vargas Maldonado et al. (1981) la mencionan como visitante cíclica en el Litoral Interno de la Isla del Carmen durante la época de secas, en lluvias no fue capturada. Reséndez (1981b), reporta su mayor frecuencia y abundancia numérica en Boca Chica y Boca de Atasta. Yáñez-Arancibia et al. (1982c) mencionan a esta especie como ocasional en la Boca de Puerto Real. Yáñez-Arancibia et al. (1982a) la consideran dominante en las poblaciones de peces demersales de la Sonda de Campeche durante julio de 1981. Por los resultados obtenidos en el presente trabajo y los antecedentes, se detecta que C. spilopterus es sedentaria en la Boca del Carmen en la que realiza funcione3 de alimentación y/o crianza, además, de ser la vía de comunicación que podría utilizar en sus migraciones hacia el mar y en sentido opuesto. Es notoria la preferencia que presenta por el lado occidental de los Sistemas Fluvio-Lagunares donde la salinidad es baja y la turbidez alta. Chaetodipterus faber (Tabla 7, Fig. 13) Estuvo presente a finales de lluvias (septiembre-octubre), durante todo nortes y a principios de secas (marzo-abril de 1981). La densidad no presentó grandes rangos, el valor máximo se registró en enero de 1981 (nortes) y los más bajos en marzo de 1980 y en abril de 1981 (secas). La biomasa y tallas promedio tuvieron un valor máximo en octubre de 1980 y los valores más bajos un mes antes y uno después del máximo valor, además, se notó un incremento en ambos parámetros a finales de nortes. Se encuentra ampliamente distribuida en la Laguna de Términos como lo muestran los trabajos de Yáñez-Arancibiaet al. (1980) quienes la consideran sedentaria en la laguna. Amezcua Linares y Yáñez-Arancibia (1980), la mencionan como una especie que utiliza los Sistemas Fluvio-Lagunares como áreas de crianza y/o alimentación, siendo Pom-Atasta el sistema que presentó los mayores valores de abundancia numérica y en peso. Vargas Maldonadoet al. (1981) la catalogan como visitante cíclica en el Litoral Interno de la Isla del Carmen durante las épocas de secas y lluvias. Reséndez (1981b), reporta las mayores capturas de esta especie en el área que comprende desde la Laguna de Panlau hasta Boca Chica y la Laguna de San Francisco. Yáñez-Arancibia et al. (1982c) la consideran sedentaria en la Boca de Puerto Real. Yáñez-Arancibia et al. (1982d) la detectan como visitante cíclica en la Boca de Estero Pargo. Finalmente, Yáñez-Arancibia et al.(1982a) mencionan que es una especie visitante cíclica en los subsiste mas de la Cuenca Central y en la Boca de Puerto Real, es sedentaria en el Litoral Interno de la Isla del Carmen, y en los Sistemas Fluvio-Lagunares, además, se encuentra distribuida en la plataforma continental adyacente. Los resultados obtenidos y los antecedentes permiten determinar aCh. faber como una especie visitante cíclica en el área de estudio con su mayor frecuencia durante nortes, realiza en ella funciones básicamente de alimentación y/o crianza. Sphoeroides testudineus(Tabla 7, Fig. 14) Estuvo presente la mayor parte del ciclo. Presentó su mayor abundancia durante nortes y en un mes de secas (marzo de 1980). Las mayores tallas promedio se presentaron durante nortes y secas. Esta especie es la que mayor biomasa aportó en la comunidad de la Boca del Carmen con 0.143 g m-². Amezcua Linares y Yáñez-Arancibia (1980), reportan que la especie es residente permanente y característica de las comunidades de peces de los Sistemas Fluvio-Lagunares. Mallar Colmeneroet al. (1982) mencionan que es una especie euritermohalina, de amplia distribución, abundante y característica de todos los subsistemas de la Laguna de Términos, presenta su mayor abundancia en aguas claras sobre praderas deThalassia testudinum,además, es la única de las 6 especies de la familia Tetraodontidae de la laguna que presentó todas las fases de desarrollo gonádico. Los datos obtenidos en el presente trabajo y los antecedentes mencionados, permiten considerar a S. testudineus residente permanente en la Boca del Carmen. Utiliza principalmente los ambientes de las estaciones 2 y 5 como áreas de alimentación, principalmente del ostiónCrassostrea virginica que se encuentra formando bancos en la Boca de Atasta (Amezcua Linares y Yáñez-Arancibia, 1980 y García-Cubas, 1981). 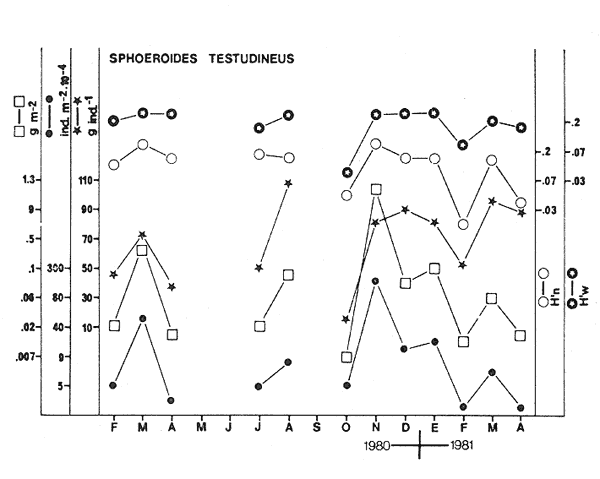 Fig. 14. Variación de la densidad numérica, biomasa, sus índices respectivos y la talla promedio de Sphoeroides testudineus en Boca del Carmen. AFINIDADLa afinidad establecida entre las estaciones estudiadas fue obtenida aplicando el índice porcentual de afinidad propuesto por Amezcua Linares y Yáñez-Arancibia (1980). Comparando el número total de especies capturadas se observó que las estaciones 1 y 2 tienen entre sí 28 especies comunes de un total de 44, lo que corresponde a una afinidad de 82%, Entre las estaciones 2 y 5 fue de 74% con 26 especies en común de un total de 44. Entre las estaciones 1 y 5 fue de 77% con 27 especies comunes de un total de 43. Las tres estaciones comparten entre sí 24 especies en común de un total de 47 lo que corresponde a una afinidad de 69%. Estas son: Cetengraulis edentulus Anchoa mitchilli Harengula jaguana Synodus foetens Bagre marinus Arius melanopus Arius felis Prionotus tribulus Chloroscombrus chrysurus Caranx hippos Diapterus rhombeus Eucinostomus gula Bairdiella chrysoura Stellifer colonensis Cynoscion arenarius Chaetodipterus faber Polydactylus octonemus Trichiurus lepturus Citharichthys spilopterus Symphurus civitatus Etropus crossotus Sphoeroides greeleyi Sphoeroides nephelus Sphoeroides testudineus Estas especies se encuentran ampliamente distribuidas en el área de estudio y aprovechan estratégicamente cada ambiente de ella. De acuerdo a lo anterior, se obtuvo que la afinidad a nivel de visitantes ocasionales (Tabla 8) entre las estaciones 1 y 2 fue de 61 % con 14 especies comunes de un total de 32. Entre las estaciones 2 y 5 fue de 48% con 11 especies comunes de un total de 35. Entre las estaciones 1 y 5 fue de 44% con 11 especies comunes de un total de 39. Las tres estaciones tienen entre sí 8 especies en común de un total de 43 lo que corresponde a una afinidad de 51%. 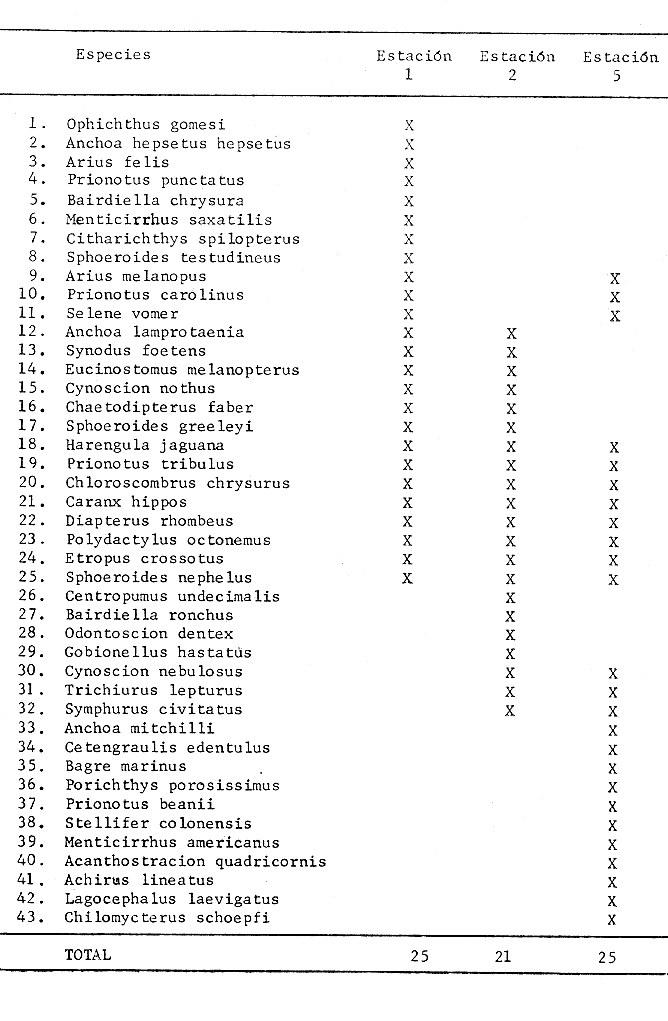 TABLA 8 DISTRIBUCIÓN ANUAL DE LAS ESPECIES VISITANTES OCASIONALES EN LAS TRES ESTACIONES DE COLECTA En cuanto a visitantes cíclicos (Tabla 9), la afinidad entre las estaciones 1 y 2 fue de 52% con 5 especies comunes de un total de 15. Entre las estaciones 2 y 5 fue de 39% con 4 especies comunes de un total de 17. Entre las estaciones 1 y 5 fue de 12% con una especie común de un total de 16; esta misma especie,Cynoscion arenarius, es la única que hay en común entre las tres estaciones de un total de 20, lo que corresponde a una afinidad de 16%. 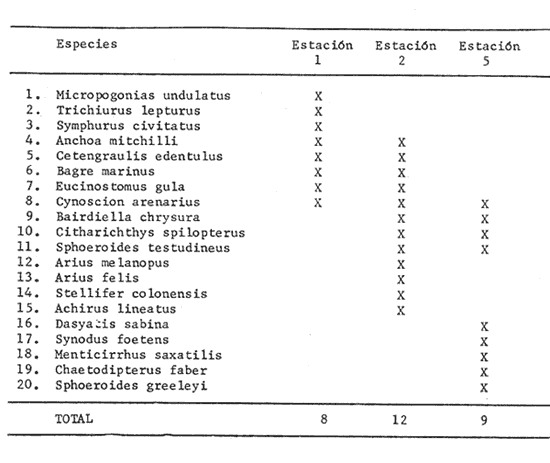 TABLA 9 DISTRIBUCIÓN ANUAL DE LAS ESPECIES VISITANTES CÍCLICAS EN LAS TRES ESTACIONES DE COLECTA No existe afinidad entre las estaciones en cuanto a especies sedentarias (Tabla 10), siendo éste un aspecto importante que muestra lo poco propicio del área para el establecimiento permanente de las especies. A nivel de especies dominantes (Tabla 11), la afinidad entre las estaciones 1 y 2 fue de 65% con 6 especies comunes de un total de 13. Entre las estaciones 2 y 5 fue de 50% con 5 especies comunes de un total de 15. Entre las estaciones 1 y 5 fue de 20% con 2 especies comunes de un total de 17; estas mismas especies,Eucinostomus gula y Cynoscion arenarius,son las únicas especies que hay en común entre las tres estaciones de un total de 18 que son dominantes en una o más estaciones, lo que corresponde a una afinidad de 20%.  TABLA 10 DISTRIBUCIÓN ANUAL DE LAS ESPECIES SEDENTARIAS Y/O TÍIPICAMENTE ESTUARINAS EN LAS TRES ESTACIONES DE COLECTA La comparación de la afinidad entre las tres estaciones de colecta mostró que las más semejantes son la 1 y la 2, y las menos afines la estación 1 y la 5. La mayor afinidad que se manifestó entre las estaciones 1 y 2, puede deberse a ciertas características ecológicas comunes entre ambas estaciones, como la cercanía que tienen a la costa, lo que las hace más someras y además brindan mayores zonas de protección.  TABLA 11 DISTRIBUCIÓN ANUAL DE LAS ESPECIES DOMINANTES EN LAS TRES ESTACIONES DE COLECTA DISCUSIÓNLas tres estaciones estudiadas presentaron un comportamiento ambiental muy similar a lo largo del ciclo anual. La que presentó mayores condiciones marinas fue la estación 1 (24.03 ppm y 26.7ºC, en promedio anual), y la que presentó las condiciones más dulceacuícolas fue la estación 2 (17.4 ppm y 27.5ºC, en promedio anual). La estación 5 tuvo un comportamiento ambiental intermedio. Esto refleja los diferentes ambientes del área de estudio, en los que se distinguen una zona con mayor influencia marina caracterizada por altos valores de salinidad y turbidez y baja temperatura, y una zona de condiciones estuarinas caracterizada por bajos valores de salinidad, altos valores de temperatura y alto porcentaje de transparencia, además se encuentra cerca a grandes e importantes arrecifes de ostiónCrassostrea virginica (Amezcua Linares y Yáñez-Arancibia, 1980 y García-Cubas, 1981). La disminución de la precipitación y de la descarga de los ríos a la Laguna de Términos originan que durante los meses de marzo-junio de 1980 (época de secas y principio de lluvias) predominen en la Boca del Carmen condiciones marinas con los mayores valores de salinidad (33.5 ppm) y temperatura (31.2ºC). De octubre de 1980 que es cuando se presenta la mayor descarga de los ríos a la laguna y la precipitación es alta, a enero de 1981 (época de nortes) se presentan las condiciones más dulceacuícolas en el área con salinidad de 2.5 ppm y temperatura de 22.0ºC (enero). Los valores promedio anuales de salinidad (21.2 ppm), temperatura (27.1ºC) y transparencia (24.51%,) registrados en este estudio indican que la Boca del Carmen es un área caracterizada por condiciones estuarinas, influenciada básicamente por la descarga de los ríos, así como por las lluvias en la laguna. Debido al patrón de circulación en la laguna, en el área de estudio hay un flujo neto de agua hacia el mar (Gierloff-Emden, 1977; Mancilla y Vargas, 1980 y Graham et al. 1981). Esto provoca que un volumen aproximado de 6 X 109 m³ de agua descargado anualmente por los ríos en la Laguna de Términos (Phleger y Ayala-Castañares, 1971) influyan de manera directa en las condiciones ambientales de la Boca del Carmen. Este análisis indica que el área de estudio es un habitat o subsistema definido dentro de la estructura de la Laguna de Términos a nivel de ecosistema el cual está caracterizado por baja salinidad y altas temperaturas y turbidez. La diversidad y la abundancia en las comunidades de peces presentaron un comportamiento estacional con los valores más bajos a fines de la época de nortes y durante secas principalmente en mayo de 1980 con 8 especies, 2.02 en riqueza de especies, 0.005 ind. b-² y 0.024 g m-². Durante este tiempo, el área de estudio es poco utilizada por las especies, funcionando básicamente como una zona de tránsito de especies entre los distintos habitat cercanos como pueden ser el Sistema Fluvio-Lagunar de Pom-Atasta y la parte occidental del Litoral Interno de la Isla del Carmen y/o con la plataforma continental adyacente. Este patrón de utilización de la boca se ve reforzado por el elevado número de visitantes ocasionales y el reducido número de especies sedentarias presentes durante esta época. Las elevadas temperaturas que se registran en secas y a principio de lluvias (marzo-julio de 1980), pueden dar lugar a que algunas especies de peces marinos se reproduzcan durante este periodo. Esto puede estar relacionado con la mayor diversidad de ictioplancton que Méndez y Velarde (1982), encontraron en la Boca del Carmen en primavera. Durante la época de lluvias se apreció un incremento de la diversidad y de la abundancia así como del número de especies sedentarias y de visitantes cíclicas, asimismo es notoria la disminución de las especies visitantes ocasionales. Esto muestra que el área de estudio está siendo más utilizada por especies de peces que aprovechan las condiciones ambientales predominantes durante esta época, como son la mayor turbidez, la disminución de la salinidad y el incremento de la producción primaria. Durante la época de nortes se presentó la mayor diversidad y abundancia con 28 especies, 4.40 en riqueza de especies, 0.078 ind. m-² y 2.07 g m-², siendo el mes de noviembre de 1980 cuando se registró la mayoría de estos valores. En este periodo climático, hay un aporte elevado de nutrientes, materia orgánica y la productividad primaria es mayor (Yáñez-Arancibia y Day, 1982; Day et al.1982). Estos recursos son utilizados estratégicamente por gran cantidad de peces juveniles y preadultos que se alimentan y crecen en el área de estudio, esto queda más evidente por el dominio que ejercen las especies visitantes cíclicas en esta época, así como el mayor número de especies sedentarias y la evidente disminución de las visitantes ocasionales. En el comportamiento anterior se manifiesta la existencia de una relación entre la mayor influencia fluvial, los altos niveles de productividad y el aumento de la diversidad y la abundancia íctica. Un comportamiento semejante es planteado para los Sistemas Fluvio-Lagunares por Amezcua Linares y Yáñez-Arancibia (1980). De acuerdo a esto, se sugiere que numerosas especies de peces de la Sonda de Campeche que son dependientes estuarinas, desovan en la línea de costa en primavera y principios de verano y que sus huevos y larvas penetran a la Laguna Términos por la Boca del Carmen (Méndez y Velarde, 1982). Las aguas que penetran a través de esta boca sólo afectan el primer tercio occidental de la laguna debido al efecto buffer provocado por la mezcla de aguas marinas y dulce evitando de esta manera que las aguas marinas fluyan directamente a lo largo del litoral sureste de la laguna (Yáñez-Arancibia et al. 1983). Este fenómeno puede ocasionar que numerosas especies que forman el ictioplancton que penetró por la Boca del Carmen se queden en esta parte de la laguna y completen aquí su desarrollo. De esta manera, numerosos juveniles y preadultos de estas especies marinas utilizan los Sistemas Fluvio-Lagunares y algunos ambientes de la Boca del Carmen como áreas de alimentación y/o crianza durante las épocas de lluvias y nortes, y abandonan la laguna hacia el mar a completar su ciclo de vida a fines de la época de nortes y durante secas (febrero-mayo). El análisis de las tallas promedio mostró que durante la época de secas (marzo de 1980 y 1981), existe un tránsito de ejemplares grandes particularmente en la estación 5 que corresponden a algunas especies dominantes como Arius felis, Chaetodipterus faber y Sphoeroides testildineus, y a una especie que no fue considerada como tal, Dasyatis sabina. Es probable que estas especies se dirijan a sus áreas de reproducción. A principio de lluvias (junio-julio de 1980), hubo otro incremento en las tallas promedio debido nuevamente a la presencia de especies dominantes, algunas de las cuales realizan todo o gran parte de su ciclo de vida en la laguna como Arius melanopus, Chaetodipterus faber, Sphoeroides testudineus y Dasyatis sabina. Asimismo fueron capturados ejemplares de grandes tallas promedio de especies marinas que utilizan la laguna para reproducirse comoArius felis, de especies que la utilizan como área de alimentación como Menticirrhus saxatilis,y de especies que la visitan ocasionalmente comoPolydactylus octonemus. A fines de lluvias y durante nortes, las tallas promedio son en general pequeñas lo que representa poblaciones de juveniles y preadultos que se encuentran realizando funciones de alimentación y/o crianza. Es notable el hecho de que la mayoría de las especies presentaron tallas promedio pequeñas durante gran parte del año, y sólo algunas como A. felis, A. melanopus, Ch. faber, S. testudineus y Dasyatis sabinapresentaron tallas grandes en algunos meses. Esto determina que la fauna ictiológica de la Boca del Carmen esté compuesta fundamentalmente por ejemplares juveniles y preadultos de especies dependientes estuarinas comoCetengraulis edentulus, A. felis, Cynoscion arenarius, Stellifer colonensis, y por especies que se efectúan todo o gran parte de su ciclo de vida en la laguna comoA. melanopus, Eucinostomus gula, Bairdiella chrysura y S. testudineus,entre otras. Estas especies realizan en el área de estudio y zonas cercanas, por ejemplo, la Boca de Pom-Atasta y Boca Chica funciones básicamente de alimentación y crianza a fines de lluvias y durante nortes. Existe luego una emigración desde el área tanto hacia el mar como al interior de la laguna a fines de nortes y comienzos de secas (febrero de 1980 y 1981). Ahora bien, la mayoría de estas especies ingresaron a la laguna por esta boca en forma de huevos y/o larvas en primavera y verano principalmente (Méndez y Velarde, 1982), otro grupo de estas especies tienen su área de reproducción en áreas cercanas a la boca. Once especies son consideradas dominantes en estas comunidades por número (81%), peso (73%) y frecuencia, de éstas,Arius felis, Eucinostomus gula, Cynoscion arenarius, Stellifer colonensis, Citharichthys spilopterus y Sphoeroides testudineus son residentes permanentes en la boca, yAnchoa mitchilli, Cetengraulis edentulus, Arius melanopus, Bairdiella chrysoura y Chaetodipterus faberson visitantes cíclicos o estacionales. La afinidad entre las tres estaciones es alta a nivel de especies totales (67%) con 24 especies comunes variablemente distribuidas en ellas. Esta variabilidad se manifiesta por la baja afinidad que presentaron las estaciones a nivel de componentes comunitarios. La Boca del Carmen presenta notable relación con los diferentes habitat o subsistemas de la Laguna de Términos. De las 47 especies capturadas en ella, 42 se encuentran en los Sistemas Fluvio-Lagunares lo que corresponde a una afinidad de 73%. En particular con los Sistemas Fluvio-Lagunares cercanos al área de estudio, se obtiene que la afinidad con Pom-Atasta es de 62% con 24 especies comunes; con Palizada del Este hay 21 especies comunes lo que corresponde a una afinidad de 60%. Treinta y seis especies (62%) son comunes con la Boca de Estero Pargo, y con la Cuenca Central de la laguna comparte 34 especies en común (73%). El análisis de estos valores muestra la estrecha relación que existe entre la boca y los subsistemas inmediatos a ella, destacándose los Sistemas Fluvio-Lagunares, en particular con los de Pom-Atasta y Palizada del Este los que son frecuentemente utilizados como áreas de protección, crecimiento y alimentación por numerosas especies comunes con la Boca del Carmen, en especial por las especies dominantes. Es también un área importante en la interacción estuario-boca-plataforma continental como se muestra por la presencia de 41 especies comunes con la Sonda de Campeche (Yáñez-Arancibiaet al. 1982a) lo que representa una afinidad de 57%. De las 47 especies presentes en la Boca del Carmen, 19 (40%) son dominantes en alguna época del año en la plataforma continental adyacente (Yáñez-Arancibia et al. 1982b). De estas 19 especies, 6 (32%) son también dominantes en la boca. Es importante destacar que de estas seis especies, cuatro son dominantes en el área de estudio y en ningún otro subsistema de la Laguna de Términos, tales especies son:Cetengraulis edentulus., Cynoscion arenarius, Stellifer colonensis y Citharichthys spilopterus(Yáñez-Arancibia et al.1982a). Es importante destacar que 27 especies son comunes entre la Boca de Puerto Real y el área de estudio lo que representa una afinidad de 45%, lo que refleja las diferentes condiciones ambientales en cada una de ellas. Finalmente, es notable la menor afinidad que presenta la Boca del Carmen con los Sistemas Fluvio-Lagunares que se encuentran al sureste de la laguna en comparación con los del lado occidental, de esta manera, con Candelaria-Panlau la afinidad es de 52% con 22 especies en común, con Chumpán-Balchacah es de 52% con 15 especies en común. Este hecho puede estar reflejando las diferentes influencias que ejercen las dos bocas en la laguna. El 32% de las especies de peces colectados fueron consumidores de segundo orden. Estas especies muestran elevada afinidad por un habitat en particular. Esto es de esperarse debido a que el arte de pesca utilizado presenta gran selectividad por especies de peces demersales y muchas de las cuales tienen hábitos alimenticios muy específicos. De este modo pueden relacionarse más estrechamente con habitats particulares, en comparación con los consumidores superiores los cuales tienen un rango de distribución más amplio, además de la boca. Asimismo, los consumidores de segundo orden son más importantes en determinadas características de las comunidades de peces, por su abundancia numérica y su especificidad de habitat (Yáñez-Arancibia et al.1980). Conclusiones1. Los valores promedio anuales de salinidad (21.2 ppm), temperatura (27.1ºC) y transparencia (24.51%) registrados en este estudio, indican que la Boca del Carmen es un área caracterizada por condiciones estuarinas, influenciada básicamente por la descarga de los ríos, así como por las lluvias en la laguna. 2. Las mediciones de estos parámetros presentaron un comportamiento estacional con los valores más altos durante la época de secas y principio de lluvias (mayo-junio de 1980) con 33.5 ppm, 31.2ºC y 31.7% de transparencia. Los valores más bajos fueron registrados durante la época de nortes (noviembre de 1980 y enero de 198 1) con 2.5 ppm, 22.0ºC y 14.3% de transparencia. 3. Las variaciones estacionales de las poblaciones de peces están relacionadas con las variaciones de los parámetros ambientales. Durante nortes se presentaron los valores más altos de diversidad, abundancia y tallas pequeñas (28 especies, 4.40 en riqueza de especies, 0.078 ind. m-² y 2.07 g m-²), y los Mínimos valores durante secas, con tallas grandes (8 especies, 2.02 en riqueza de especies, 0.005 ind. m-² y 0.024 g m-²). 4. Predominan las especies visitantes ocasionales (47%) y las consumidoras de segundo orden (32%). 5. La afinidad entre las tres estaciones a nivel de especies totales es alta (69%) con 24 especies variablemente distribuidas en los ambientes del área de estudio. 6. Once especies son consideradas dominantes en el área por número (82%), peso (73%) y análisis de frecuencia (>70%) estas son: Anchoa mitchilli, Cetengraulis edentulus, Arius felis, A. melanopus, Eucinostomus gula, Cynoscion arenarius, Bairdiella chrysoura, Stellifer colonensis, Chaetodipterus faber, Citharichthys spilopterus y Sphoeroides testudineus. 7. La Boca del Carmen es un habitat o subsistema particular y definido en la estructura de la Laguna de Términos a nivel de ecosistema, utilizado preferentemente por peces juveniles y preadultos dependientes estuarinos como un área de alimentación y/o crianza durante la época de nortes, y como una zona de emigración tanto hacia el mar como a la laguna a fines de esta misma época y a principios de secas. 8. La Boca del Carmen es un área de gran importancia en la interacción estuario-boca-plataforma continental con la cual comparte 41 especies en común (57%). AgradecimientosLos autores agradecen a Alfredo Laguarda-Figueras, Antonio García-Cubas, Luis Rafael Segura-Vernis y César Flores-Coto, la cuidadosa revisión del manuscrito, haciendo valiosos comentarios y sugerencias. A los compañeros del Laboratorio de Ictiología y Ecología Estuarina del Instituto de Ciencias del Mar y Limnología, por su colaboración en las colectas y en el manejo de las colecciones. El apoyo económico e institucional y las facilidades brindadas para la realización de estos estudios, correspondió al Instituto de Ciencias del Mar y Limnología de la Universidad Nacional Autónoma de México. Los resultados forman parte del Programa de Investigación: "Análisis Comparativo de las Poblaciones de Peces de la Sonda de Campeche y de la Laguna de Términos antes y después del Derrame Petrolero del Pozo IXTOC-1" Convenio UNAM-PCEESC-PEMEX. Asimismo, parte de estos resultados corresponden al Programa de Investigación: "Estudios Ecológicos de la Laguna de Términos, Campeche, con Referencia Especial a los Recursos Pesqueros y al Impacto Potencial del Hombre", Convenio UNAM-ICML-COACYT, Clave PCMABEU-005322; y al Proyecto de Investigación: "Mecanismos de Producción en Ecosistemas Costeros, Laguna de Términos, México y Laguna de Arcachon Francia", Convenio UNAM-ICML-CONACYT, Clave QCMACFR-001698. LITERATURAAGUIRRE LEÓN, A., A. YÁÑEZ-ARANCIBIA y F. AMEZCUA LINARES, An. Inst. Cienc. del Mar y Limnol. Univ. Nal. Autón. México,Taxonomía, diversidad, distribución y abundancia de las mojarras de la Laguna de Términos, sur del Golfo de México. (Pisces: Gerridae)1982.213-250.9(1): AMEZCUA LINARES, F. y A. YÁÑEZ-ARANCIBIA, An. Centro Cienc. del Mar y Limnol. Univ. Nal. Autón. México,Ecología de los sistemas fluvio-lagunares asociados a la Laguna de Términos. El habitat y estructura de las comunidades de peces.1980.69-118.7(1): AYALA-CASTAÑARES, A., Sistemática y distribución de los foraminíferos recientes de la Laguna de Términos, Campeche, México. Bol. Inst. Geol. Univ. Nal. Autón. México,1963.1130.67(3): BRAVO-NÚÑEZ, E. y A. YÁÑEZ-ARANCIBIA, An. Centro Cienc. del Mar y Limnol. Univ. Nal. Autón. México,Ecología de la Boca de Puerto Real, Laguna de Términos. I. Descripción del área y análisis estructural de las comunidades de peces.1979.125-182.6(1): CARVAJAL, R. J.,Contribución al conocimiento de los robalos Centropomus undecimalis y C. poeyi en la Laguna de Términos, Bol. Inst. Oceanogr. Univ. Oriente,Campeche,México.1975.51-70.14(1): CASTRO-AGUIRRE, J. L.,Catálogo sistemático de los peces marinos que penetran a las aguas continentales de México con aspectos zoogeográficos y ecológicos. Serie Científica,Dir. Gral. Inst. Nal. Pesca, México,1978.1-298.19 CERVIGON, M. F., Los Peces Marinos de Venezuela.Estación de Investigaciones Marinas de Margarita, Fundación La Salle de Ciencias Naturales, Caracas, Monogr.1966.1-951.11 y 12 CHAVANCE, P., D. FLORES HERNÁNDEZ, A. YÁÑEZ-ARANCIBIA y F. AMEZCUA LINARES,Ecología biología y dinámica de las poblaciones de Bairdiella chrysoura en la Laguna de Términos, sur del Golfo de México (Pisces: Sciaenidae). An. Inst. Cienc. del Mar y Limnol. Univ. Nal. Autón, México,1984.123-161.(1):11 CHAVANCE, P., A. YÁÑEZ-ARANCIBIA, D. FLORES HERNÁNDEZ, A. L. LARA-DOMINGUEZ y F. AMEZCUA LINARES,An. Inst. Cienc. del Mar y Limnol. Univ. Nal. Autón. México (en prensa).Ecology, biology and population dynarnics of Archosargus rhomboidalis (Pisces: Sparidae) in a tropical coastal lagoon, Southern Gulf of Mexico,1985. COPELAND, B. J., Fauna of the Aransas Pass Inlet, Texas. I. Emigration as shown by tide trap Collections, Publ. Inst. Mar. Sci. Univ. Texas,1965.9-21.10 DAY, J. W., JR., R. H. DAY, MA. T. BARREIRO, F. LEYLOU y CH. J. MADDEN,In: Lasserre, P. y H. Postma (Eds.)Primary production in the Laguna de Terminos, a tropical estuary in the Southern Gulf of Mexico, p. 269-276. .Oceanologica Acta, Vol. Spec. p. 269-276. Coastal Lagoons1982.462 p.5(4): DARNELL, R. M. y T. M. SONIAT,Ecological Processes in Coastal and Marine Systems. The estuary/ shelf as an interactive System. In: Livingston, R. J. (Ed.)Plenum Press,New York and London,1979.487-526. DIAZ RUIZ, S., A YÁÑEZ-ARANCIBIA y F. AMEZCUA LINARES,An. Inst. Cienc. del Mar y Limnol. Univ. Nal. Autón. México, Taxonomía, diversidad, distribución y abundancia de los pomadásidos de la Laguna de Términos, sur del Golfo de México (Pisces: Pomadasyidae).1982.251-278.9(1): DRESSLER, R., Informe Técnico OC-82; 01 C.I.C.E.S.E.Investigación sobre mareas y efectos del viento en la Laguna de Términos (México) mediante un modelo hidrodinámico numérico. Baja Calif.México1981.1-36. FISCHER, IV. (Ed.), FAO Species identification sheets for fishery purposes. Western Central Atlantic (Fishing area 31). FAO,Roma1978.1-7. FLORES-COTO, C. y J. ÁLVAREZ CADENA, An. Centro Cienc. del Mar y Limnol. Univ. Nal. Autón. México, Estudios preliminares sobre abundancia y distribución del ictioplancton en la Laguna de Términos, Campeche.1980.67-78.7(2): GALLAWAY, B. J., J. C. PARKER y D. MOORE, Key to the Estuarine and Marine Fishes of Texas. Department of wild life and Fisheries Sciences, Texas A & M University Press,1972.177 p. GARCÍA-CUBAS, A., Moluscos de un sistema lagunar tropical en el sur del Golfo de México (Laguna de Términos, Campeche).Inst. Cienc. del Mar y Limnol. Univ. Nal. Autón. México,Publ. Esp.1981.1-182.5: GIERLOFF-EMDEN, H. G., In: Orbital Remote Sensing of Coastal and Offshore Environments, Laguna de Términos and Campeche Bay, Gulf of Mexico: Water mass interaction lagoonal oceanic visible due to sediment laden waters, pp. 77-89. A. Manual of Interpretation. Walter de Gruyter, Ed.,Berlin.1977. GRAHAM, D. S., J. P. DANIELS, J. M. HILL Y J. W. DAY, JR.,An. Inst. Cienc. del Mar Y Limnol. Univ. Nal. Autón. México,A preliminary model of the circulation of Terminos Lagoon, Campeche, Mexico.1981.51-618(1): GREENWOOD, P. H., D. E. ROSEN, S. H. WEITZMANN Y G. S. MYERS, Phyletic studies of teleostean fishes, with a provisional classification of living forms. Bull. Amer. Mus. Nat. Hist.,1966.339-456.131(4): GREENWOOD, P. H., G. S. MYERS, D. E. ROSEN Y S. H. WEITZMANN, Named main divisions of teleostean fishes. Proc. Biol. Soc. Wash.,1967.227-228.80 GUNTHER, G., Some relationships of estuaries to fisheries the Gulf of Mexico. In: Lauff, G. (Ed.) Estuaries. Amer. Assoc. Adv. Sci. Spec. Publ,1967.621-638.83 HILDEBRAND, S. F., Bull. Bingham Oceanogr. Coll., A review of the American anchovies (Family Engraulidae).1943.1-165.8(2): HOESE, H. D., B. J. COPELAND, F. N. MOSELEY y E. D. LANE, Diel and seasonal variations in trawlable organisms of the adjacent area.Fauna of the Aranzas Pass Inlet, Texas, III.Tex. J. Sci.,1968.33-60.20 HOESE, H. D. y R. 1-1. MOORE, Fishes of the Gulf of Mexico (Texas, Louisiana and Adiacent Waters).Texas A & M University Press,1977.376 p. JORDAN, D. S. y B. W. EVERMANN,The fishes of North and Middle America. Bull. U. S. Nat. Mus.,1896-1900.1-3313.1-4(47): KING, B. D., III., Study of migratory patterns of fish and shellfish through a natural pass. Tex. Parks. Wild Dept. Austin, Tech.., Ser.1971.1-54.9: LARA-DOMÍNGUEZ, A. L., A. YÁÑEZ-ARANCIBIA y F. AMEZCUA LINARES,An. Inst. Cienc. del Mar y Limnol. Univ. Nal. Autón. México, Biología y ecología del bagre Arius melanopus Gúnther en la Laguna de Términos, sur del Golfo de México. (Pisces: Ariidae)1981.267-304.8(1): LOESCH, H., J. BISHOP, A. CROWE, R. KUXKYR Y P. WAGNER. Technique for estimating traw1 efficiency in catching brow shrimp (Penaeus aztecus), Atlantic croaker (Micropogon undulatus) and spot (Leiostomus xanthurus).Gulf Res. Rep.,1972.29-33.5(2): MALLARD COLMENERO, L., A. YÁÑEZ-ARANCIBIA y F. AMEZCUA LINARES, An. Inst. Cienc. del Mar y Limnol. Univ. Nal. Autón. México, Taxonomía, diversidad, distribución y abundancia de los tetraodontidos de la Laguna de Términos, sur del Golfo de México. (Pisces: Tetraodontidae).1982.161-212.9(1): MANCILLA, M. y M. VARGAS, An. Centro Cienc. del Alar y Limnol. Univ. Nal. Autón. México, Los primeros estudios sobre la circulación y el flujo neto de agua en la Laguna de Términos, Campeche.1980.1-14.7(2): MARGALEF, R., Perspectives in Ecological Theory.The University of Chicago Press,Chicago1969.111 p. MEEK, E. S. y S. F. HILDEBRAND, The marine fishes of Panama.Field Mus. Nat. Hist. Publ., Zool. Ser.,1923-1928.1-1045.15(215, 226 y 249): MÉNDEZ, V. S. F. y A. VELARDE, Estudio del Ictioplancton en la Boca del Carmen, Laguna de Términos, Campeche.Tesis profesional Fac. Ciencias Univ. Nal. Autón. México,1982.77 P. NORMAN, J. R., A Systematic Monography of the Flatfishes (Heterosomata). Psettodidae, Bothidae, Pleuronectidae.The Trustees of the Britisli Museum (Natural History),Londres1934.1459.1: PHLEGER, F. B. y A. AYALA-CASTAÑARES, Processes and history of Terminos Lagoon, Mexico. Bull. Am. Ass. Petrol. Geol.,1971.2130-2140.55(2): PIELOU, E. C., The measurement of diversity in different types of biological collections. J. Theoret. Biol.,1966.131-144.13: RESÉNDEZ, M. A., Biotica.Estudio de los peces de la Laguna de Términos, Campeche,México. I.1981a.239-291.6(3): RESÉNDEZ, M. A.,Biotica. Estudio de los peces de la Laguna de Términos, Campeche,México. II. Ultima parte.1981b.345-430.(4):6 SABINS, D. S. y F. M. TRUESDALE, Proc. Twentyeighth Ann. S. E. Assoc. Game and Fish. Comm., Diel and seasonal occurrence of inmature fislies in a Louisiana tidal pass. In: William. A. Rogers (Ed.)White Sulfur Spring, W. V.1974.161-170. SÁNCHEZ-GIL, P., A. YÁÑEZ-ARANCIBIA y F. AMEZCUA LINARES, An. Inst. Cienc. del Mar y Limnol. Univ. Nal. Autón. México,Diversidad, distribución y abundancia de las especies y poblaciones de peces demersales de la Sonda de Campeche (Verano 1978).1981.209-240.8(1): SHANNON, C. E. y W. WEAVER, The Mathematical Theory of Communication.University of Illinois Press. Urbana.1963.117 p. SHLOSSMAN, P. A. y CHITTENDEN, M. E., JR., Fish. Bull., U. S.,Reproduction, movements and population dynamics of the sand seatrout, Cynoscion arenarius.1981.649-669.79(4): S.I.C.,Catálogo de Peces Marinos Mexicanos,Secretaría de Industria y Comercio, Subsecretaria de Pesca, Instituto Nacional de Pesca, México,1976.462 p. SIMMONS, E. G. y H. D. HOESE, Publ. Inst. Mar. Sci. Univ. Texas, Studies on the hydrography and fish migrations of Cedar Bayou, a natural tidal inlet on the central Texas Coast.1959.56-80.6: TORAL, S. y A. RESÉNDEZ, Rev. Biol. Trop.,Los cíclidos (Pisces: Perciformes) de la Laguna de Términos y sus afluentes.1974.254-274.21(2): VARGAS MALDONADO, I., A. YÁÑEZ-ARANCIBIA y F. AMEZCUA LINARES,An. Inst. Cienc. del Mar y Limnol. Univ. Nal. Autón. México, Ecología y estructura de las comunidades de peces en áreas de Rhizophora mangle y Thalassia testudinum de la Isla del Carmen, Laguna de Términos, sur del Golfo de México.1981.241-266.8(1): WILHM, J. L., Ecology, Use of biomass units in Shanno's formula.1968.153-156.49(1): YÁÑEZ-ARANCIBIA, A., An. Centro Cienc. del Mar y Limnol. Univ. Nal. Autón. México, Sobre los estudios de peces en las lagunas costeras: Nota Científica.1975.53-60.2(1): YÁÑEZ-ARANCIBIA A., Coastal Lagoon Research: Present and Future. II.Ecology in the inlet of Puerto Real, Términos Lagoon. II. Discussion on trophic structure of fish communities in banks of Thalassia testudinum. In: Lasserre, P. H. Postma, J. Costlow y M. Steyert (Eds.).Proceedings. UNESCO/IABO Seminar. Duke University Mar. Lab. Tech. Pap. Mar. Sci. UNESCO,1978a.(1981).191-23233:Sept. 1978. YÁÑEZ-ARANCIBIA, A., Seminar on Present and Future Research in Coastal Lagoons. Fish occurrence, diversity and abundance in two tropical coastal lagoon with ephemeral inlets on the Pacific Coast of Mexico. Duke University Marine Laboratory, IABO and UNESCO, Beaufort N. C. Tech. Pap. Mar. Sci. UNESCO,1978b.(1981).233-26033:Aug. 28 Sept. 2, 1978. YÁÑEZ-ARANCIBIA A., Taxonomía, ecología y estructura de las comunidades de peces en lagunas costeras con bocas efímeras del Pacifico de México. Centro Cienc. del Mar y Limnol. Univ. Nal. Autón. México,Publ. Esp. 21978c.1-306. YÁÑEZ-ARANCIBIA A. y R. S. NUGENT, An. Centro Cienc. del Mar y Limnol. Univ. Nal. Autón. México, El papel ecológico de los peces en estuarios y lagunas costeras.1977.107-114.4(1): YÁÑEZ-ARANCIBIA A. y F. AMEZCUA LINARES, An. Centro Cienc. del Mar y Limnol. Univ. Nal. Autón. México, Ecología de Urolophus jamaicensis (Cuvier) en Laguna de Términos, un sistema estuarino al sur del Golfo de México. (Pisces: Urolophidae).1979.107-114.6(2): YÁÑEZ-ARANCIBIA A. y J. W. DAY, JR., Coastal Lagoons. Oceanologica Acta. Ecological characterization of Terminos lagoon-estuarine system. in the Southern Gulf of Mexico, p. 431-440. In: Lasserre, P. y H. Postma (Eds.)1982.462 p.5Vol. Spec. (4): YÁÑEZ-ARANCIBIA A. y A. L. LARA-DOMINGUEZ, An. Inst. Cienc. del Mar y Limnol. Univ. Nal. Autón. México, Dinámica ambiental de la Boca de Estero Pargo y Estructura de sus comunidades de peces en cambios estacionales y ciclos de 24 hrs. (Laguna de Términos, sur del Golfo de México)1983.85-116.10(1): YÁÑEZ-ARANCIBIA, A., y F. AMEZCUA LINARES y J. W. DAY, JR., Estuarine Perspectives. Fish community structure and function in Terminos Lagoon, a tropical estuary in the Southern Gulf of Mexico. In: Kennedy, V. (Ed.)Academic Press Inc.,New York,1980.465-482. YÁÑEZ-ARANCIBIA, A., A. L. LARA-DOMÍNGUEZ, P. CHAVANCE y D. FLORES HERNÁNDEZ, An. Inst. Cienc. del Mar y Limnol. Univ. Nal. Autón. México, Environmental behavior of Terminos Lagoon ecological system, Campeche, México.1983.137-176.10(1): YÁÑEZ-ARANCIBIA A., P. SÁNCHEZ-GIL, M. TAPIA GARCÍA y MA. DE LA C. GARCIA-ABAD,In: International Joint Oceanographic Assambly,Ecology and community structure of demersal fish in Campeche Sound in the Southern Gulf of Mexico: Ocean tropical resources.Halifax, Nova ScotiaCanadá1982b.Aug. 2-13, 1982. YÁÑEZ-ARANCIBIA, A., A. L. LARA-DOMÍNGUEZ, P. SÁNCHEZ-GIL, I. VARGAS MALDONADO, P. CHAVANCE, F. AMEZCUA LINARES, A. AGUIRRE LEÓN Y S. DÍAZ Ruiz,Coastal Lagoon. Oceanologica Acta.,Ecosystem dynamics and nichthemeral and seasonal programming of fish community structure in a tropical inlet, Mexico, p. 417-429. In: Lasserre, P. y H. Postma (Eds.)1982c.462 p.5Vol., Spec.(4): YÁÑEZ-ARANCIBIA, A., A. L. LARA-DOMÍNGUEZ, P. SÁNCHEZ-GIL, I. VARGAS MALDONADO, MA. DE LA C. GARCIA-ABAD, H. ÁLVAREZ GUILLÉN, M. TAPIA GARCÍA, D. FLORES HERNÁNDEZ y F. AMEZCUA LINARES,In: International Symposium on utilization of Coastal Ecosystems: Planning, Pollution and Productivity. Ecology and evaluation of fish community in the Campeche Sound and Terminos Lagoon: Estuaryshelf interactions in the Southern Gulf of Mexico.Duke Univ. Mar. Lab. USA and Univ. Rio Grande R. S. Brasil, Atlántica Rio Grande,1982a.130.5Nov. 22-27, 1982 (2): YÁÑEZ-ARANCIBIA A., A. L. LARA-DOMINGUEZ, P. SÁNCHEZ-GIL, I. VARGAS MALDONADO M. TAPIA GARCÍA, MA. DE LA C. GARCÍA-ABAD, H. ÁLVAREZ- GUILLÉN, D. FLORES HERNÁNDEZ y A. AGUIRRE LEÓN, In: Proyecto de Investigación "Análisis Comparativo de las Poblaciones de Peces de la Sonda de Campeche y de la Laguna de Términos antes y después del Derrame Petrolero del Pozo IXTOC1". (Quinto Informe).Análisis de la dinámica ambiental de la Boca de Estero Pargo y estructura de sus comunidades de peces en variaciones estacionales y ciclos de 24 horas; y resultados de los Cruceros de Otoño en la Sonda de Campeche. PCEESC/UNAM/ICML (QI),1982d.123 p., 24 tablas, 42 figs. YÁÑEZ-ARANCIBIA, A., A. L. LARA-DOMÍNGUEZ, P. SÁNCHEZ-GIL, I. VARGAS MALDONADO, P. CHAVANCE, H. ÁLVAREZ GUILLÉN, F. AMEZCUA LINARES, MA. DE LA C. GARCÍA-ABAD, D. FLORES HERNÁNDEZ, M. ÁLVAREZ RUBIO, M. TAPIA GARCIA, S. DÍAZ Ruiz, A. AGUIRRE- LEÓN y J. L. ROJAS GALAVIZ, In: Proyecto de Investigación "Análisis Comparativo de las Poblaciones de Peces de la Sonda de Campeche y de la Laguna de Términos antes y después del Derrame Petrolero del Pozo IXTOC-1". Las comunidades de peces y el habitat de la Laguna de Términos y de la Sonda de Campeche, durante los cruceros de Febrero de 1980 a Abril de 1981: Comparación y caracterización de las interacciones Laguna-Sonda. (Tercer Informe) PCEESC/UNAM/CCML (TI),1981.466 p. 337 tablas, 47 figs. YÁÑEZ-CORREA, A., Batimetria, salinidad, temperatura y distribución de los sedimentos recientes en la Laguna de Términos, Campeche, México. Bol. Inst. Geol. Univ. Nal. Autón. México,1963.1-47.67(1):
|

