|
OVOGENESE ET CYCLE REPRODUCTEUR DE CIONA
INTESTINALIS L. (1767) DE LA BAIE DE CADIX (SPAGNE)
Trabajo recibido el 11
de julio de 1983 y aceptado para su publicación el 16 de noviembre de
1983.
MA. LUISA GONZÁLEZ DE CANALES GARCÍA
Facultad de Ciencias, Departamento
de Biología, Universidad de Cádiz, Apartado de Correos 40, Puerto
Real (Cádiz) ,
Spagne.
Pendant
l'ovogénèse deCiona intestinalisL. (1767), on
observe différentes cellules ovariennes, selon la taille et
l'affinité chimique pour les colorants morphologiques
Hématoxiline-Eosine et Hématoxiline- V.O.F. de Gutiérrez
(1967). Dans ce travail on étudie ces différences et on
détermine le cycle reproducteur de cette espèce en suivant
l'évolution annuelle de la température, salinité,
oxygéne, pH et nitrites du milieu. Les mots significatives: Baie de
Cadix, ovogénése, cellules ovariennes, cicle reproducteur,
ovocites, ovules, basophiles, polichromatophiles et
acidophiles.
Durante
la ovogénesis de la ascidia Ciona intestinalis (L) se
observan diferentes células ováricas, según su talla y
afinidad química por los colorantes morfológicos
Hematoxilina-Eosina y Hematoxilina V.O.F. de Gutiérrez (1967). En este
trabajo se estudian esas diferencias y se determina el ciclo reproductor de
esta especie, siguiendo la evolución anual de la temperatura, salinidad,
oxígeno, pH y nitritos del medio. Palabras claves: Bahía de
Cádiz, ovogénesis, células ováricas, ciclo
reproductor, ovocitos, óvulos, basófilos, policromatófilos
y
acidófilos.
L'ascidieCiona intestinalis a été étudiée par de nombreux auteurs, de différents poínts de vue; nous pouvons, citer Berrill (1947), Godeaux (1963), Mancuso (1965), Barrington (1968) et Whittaker (1973), qui se sont consacrés surtout á son embriologie, métamorphose, développement, microscopie électronique de couches folliculaires et enzimologie. D'outres part, Peres en 1952 et 1953 décrit le fonctionnement ovarien et le cycle sexuel obtenant postérieurement des résultats similaires a Sabbadin (1957) dans la Lagune Veneto, travaux qui servirent de base a Escalera Liaci et al. (1977), pour observer la relation entre fixation et mise a la mer de Piccolo. L'influence de certains facteurs physiques (température, lumiére, salinité, etc.) sur l'expulsion des gamétes a été observée par Dybern (1965), Lambert (1967), Wittingham (1967), et Millar (1971). Tous les renseignements précédemment commentes nos ont motivé pour réaliser une étude sur les processus de maturation de cette espéce dans des conditions expérimentales. Nous avons réalisé des observations macroscopiques pondérales et histologiques pour déterminer le cycle sexuel, les caractéres de l'ovogenese ainsi que l'epoque de mise en conditions que nous analyserons cidessous. Ce travail a été réalisé à Instituto de Investigaciones Pesqueras (C.S.I.C.) de Cádiz Espagne). MATERIEL, ET METHODESOn a étudié 96 ovaires en prenant des échantillons Tous les quinze jours, quel'on a obtenu à partir de spécimens vivants, d'une taille variant entre 2,5 cm et 12 cm et un poids de 3 gr à 14,3 gr, procédent des Baie de Cadix (Espagne) et longées dans réservoin d'experimentation de 7000 litres d'eau. Les valeurs, monyennes des caractéristiques physicochimiques de l'eau qui contenait les spécimens, se trouvent sur le tableau 1. Les spécimens ont été mesuré réguliérement afin d'observer la possible influence que pouvait avoir la croissance (taille dans la maturation sexuelle de cette espéce dans des conditions expérimentales. 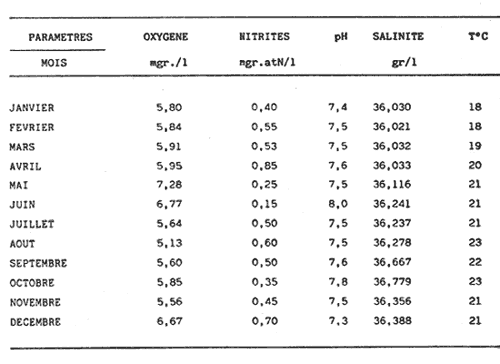 TABLEAU 1 CARACTÉRISTIQUES PHYSICO-CHIMIQUES DE L'EAU DU RÉSERVOIR D'EXPÉRIMENTATION. MG/1 = MILLIGRAMMES PAR LITRE, MG. AT. N/1 = MILLIGRAMMES ATOMES DE NITROGÉNE PAR LITRE Pour faciliter l'extration de la gonada, on a anesthésié les spécimens a l'aide d'une solution d'Hidrate de Chloral à 1% en eau de mer (environ 10 minutes) en faison attention de ne pas produíre d'asphysie. Ensuite on a établi les Indices Gonosomiques correspondants en appliquant la formule IG = poids gonade en grammes pour 100/ poids total de l'animal, ce qui nous a permis de rendre évident la possíble relation des deux poids. La fixation des échantillons fut réalisée dans le réactif de Bouin ainsi que dans le formol calcique de Baker. Ensuite ils furent déshydratés et enfermes dans la paraffine de P. F. 58ºC sous forme habituelle. Les coupes furent réalí sées dans un microtome Minot d'une épaisseur de 5-7 microns. Comme méthode morphologi que de coloration on a utilisé les techniques d'Hematoxiline-Eosine et Hématoxiline-V. O. F. de Gutiérrez (1967). Le colorant V.O. F. est composé de 0,2 gr de lumiére verte S. F., 0,25 gr d'orange G et 0,3 gr Fuchsine acide, dissous dans 150 ml d'Etanol de 70% en ajoutant comme mordent 1 gr d'acide phosphotungtique et 2 ml d'acide acétique, en obtenant á la fin un pH = 2,8-3. RESULTATSEn appliquant les méthodes citées, nous observons durant l'ovogénése différents types de cellules germinatives, Figura 1 (1) nous essayerons de donner une nomenclature valable pour chacune d'elles. Nous désignerons par oogones les cellules germinatives indifférencíées contenues dans diverses zones de prolofération dans les follicules et par ovocites toutes les formes comprises entre celles-ci, et celles qui sont complétement mûres, et réservant pour cette derniére la dénomination de ovules, comme on peut l'observer sur les photomicrographies de la Figure 1 (2 et 3). Dépendant de la taille et de l'affinité chimique des cellules pour les colorants et fixateurs utilisés, nous subdiviserons les ovocites selon les Tableaux 2 et 3 en: ovocite type I: ovocite basophile de cytoplasme uniforme ovocite type ovocite type II: ovocite basophile de cytoplasme granuleux ovocite type ovocite type III: ovocite políchromatophile ovocite type ovocite type IV: ovocite acidophile ou eosinophile dénommé ovule. 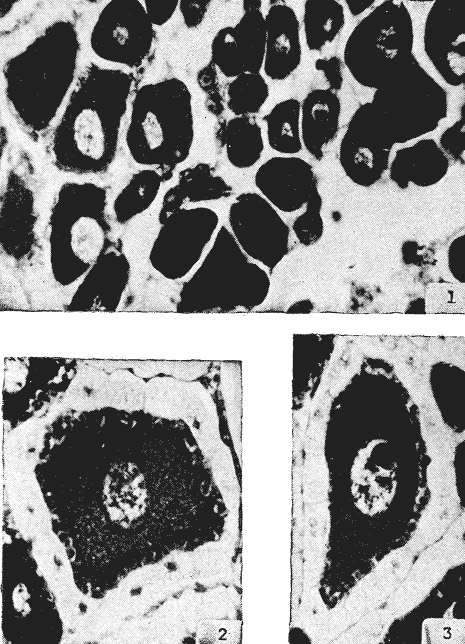 Fig. 1. (1) Ovocites dans différents états de maturation. (2)Ovocite mûr. On observe trés bien les couches folliculaires. La couche folliculaíre interne avec un grand nombre de cellules et la couche folliculaire externa avec des cellules dont les noyau est central et son citoplasma aérolaire. (3)Ovocite mûr. Noyau avec son grand nucléole et chromatine granulaire. Cytoplasma granulaire dense. Couche folliculaire interna et couche folliculaire externe. 250 x. Les ovocites I et II se colorent fortement par la hématoxiline, et se différencient par leur petite taille, ainsi que par l´apparition en quelques seconds de granulations cyto plasma tiques, équivalentes a celles décrites par Harvey (1927), Mancuso (1965), Kessel (1967). La taille des cellules, dans le cas d'ovocites type I, varie entre 10 et 30 microns, présentant son noyau chromatine granuleux dispersé et atteignot une taille de 15 mícrons avec une nucléole de 5,50 microns. L'ovocite type II montre una taille de 30 à 50 microns, son noyau attignont 25 microns et son nucléole 8,25 microns, montrant cette coloration violette ou orange. Celui du type III se caractérise par une diminution de la basophilie par rapport aux précédents, tout ceci dû à la progressive affinité par les colorants lumiére verte S. F. ou Eosine, selon la méthode utilisée. Dans cet ovocite, la taille de la cellule varie entre 50 et 80 microns, noyau (30 microns) et nucléole (11 microns). A la fin de la croissance, on arrivé à la formation de l'oeuf typique de Ciona. L'ovule se caractérise par de nombreusse granulations et marques acidophiles dans son cytoplasme, ainse que par l'apparition d' un chorion (membrane de l'oeuf) . A l'exterieur des chorion, il y a plusieurs couches de cellules intiment unies, dont l'ensemble peut derniére couche apparaissent des cellules de plus grande taille, polyédriques avec un citoplasme vacuolisé et un noyau central ou légèrement paracentral, qui constituent la couche des follicules externe, atteignont dans la majeure partie des cas 10 microns d'épaisseur. 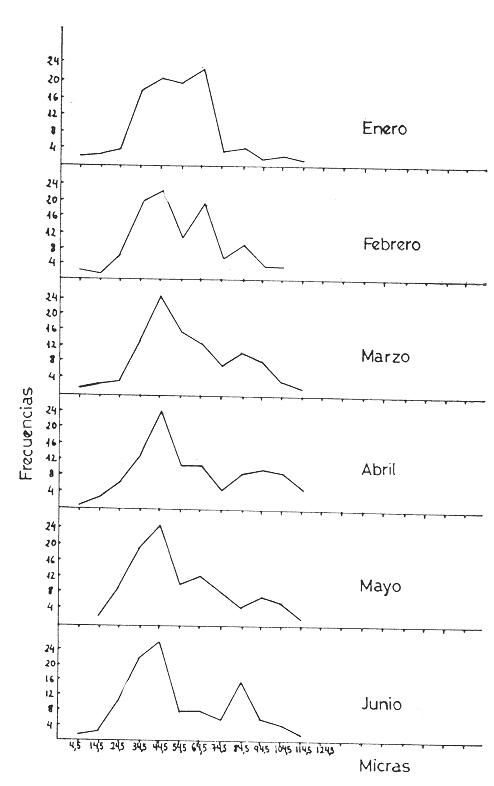 Fig. 2 et 3. Represéntation graphíque des valeurs obtenus dans la tableau 4 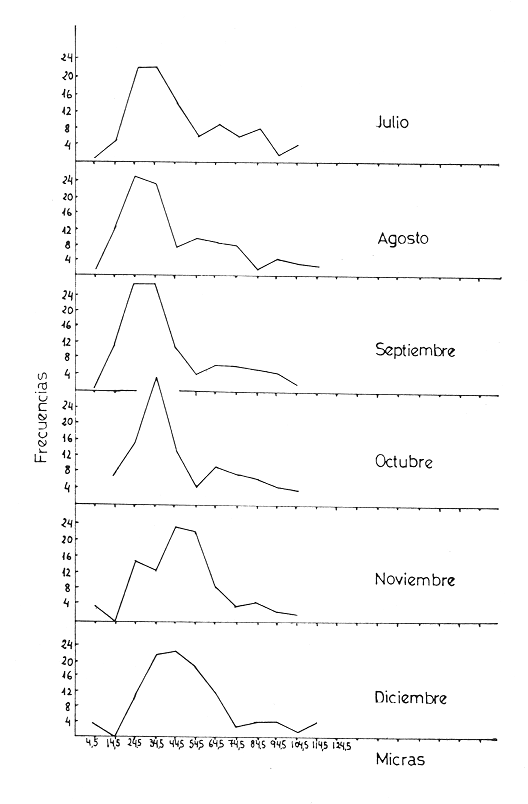 Un ovule totalement mûr apparaitrait avec de nombreuses déformations cytoplasmatiques vers le chorion et d'une taille de 80 à 120 microns dont le noyau et le nucléole présentent une taille de 50 et de 11 microns respectivement. Les couches folliculaires que apparaissent avec l'Hématoxiline-Eosine est de couleur rose et avec le V.O.F., l'externe est de couleur verte, elles ont été l'objet d'une étude, pour de nombreux auteurs: Huus (1941), Mancuso (1965) et Kessel (1967) sans arriver à un accord en ce que concerne son origine et sa fonction, motifs de travaux qui sont actuellement en cours. 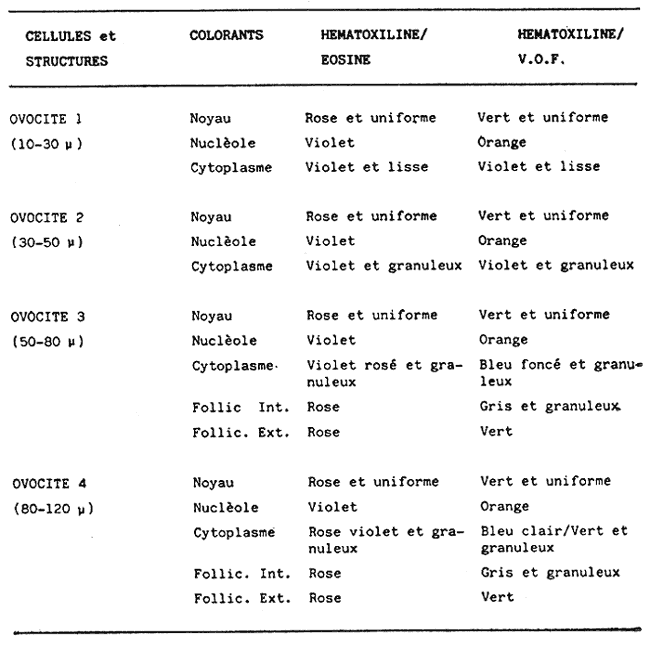 TABLEAU 2 CARACTÉRES MORPHOLOGIQUES DES OVOCITES DANS DIFFÉRENTES PHASES DE MATURATION, FIXÉS EN BOUIN ET COLORÉS AVEC HEMATOXILINE EOSINE ET HÉMATOXILINE-V.O.F., CYTOPLAS = CYTOPLASME, FOLLIC. INT. = FOLLICULAIRE INTERNE, FOLLIC. EXT. = FOLLICULAIRE EXTERNE 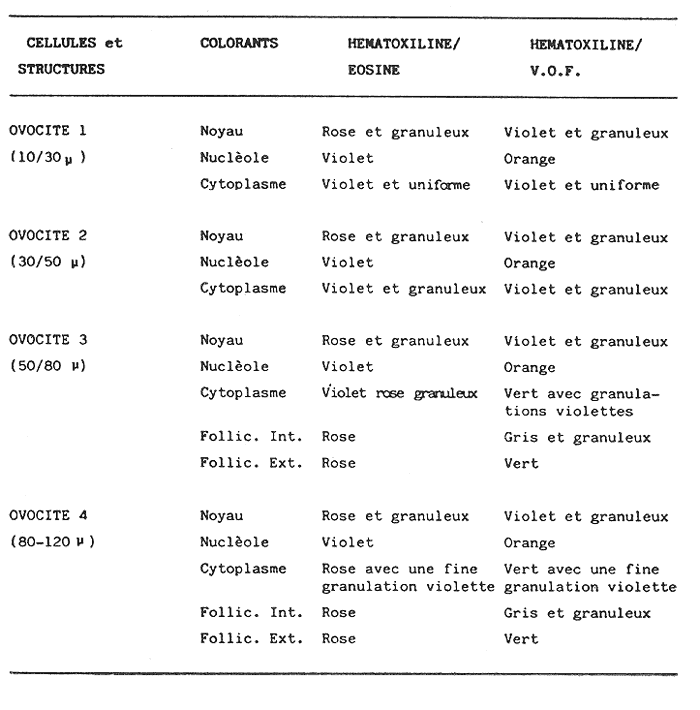 TABLEU 3 CARACTÉRES MORPHOLOGIQUES DES OVOCITES EN DIFFÉRENTES PHASES DE MATURATION, FIXÉS EN BAKER ET COLORÉS AVEC HÉMATOXILINE-EOSINE ET HEMATOXILINE V.O.F. CITOPLAS. = CYTOPLAS ME, FOLLIC. INT. = FOLLICULAIRE INTERNE, FOLIC, EXT. = FOLLICULAIRE EXTERNE. Le tableau 4 montre les variations de taille et les fréquences avec lequelles apparaissent les différentes cellules germinales, la Figure 2 et 3, nous donne les représentation graphique de ces valeurs. Le tableau 5 nous dit le pourcentage annuel de ces cellules et la Figure 4, le pourcentage d'ovules trouvés tout au long des mois de l'année.  TABLEAU 4 FRÉQUENCE ANNUELLE DE TAILLES DURANT L'OVOGÉNESE  TABLEAU 5 VARIATION MENSUELLE EN POUCENTAGE DES OVOCITES DURANT LE CYCLE ANNUEL En tenant compte des observations des résultats morphologiques et des paramétres physicochimiques obtenus, nous décrirons le cycle reproducteur de cette espéce avec les caractéres suivants: microscopiquement, au cours des mois de Janvier, Février, Mars et Avril, il existe una prédominance d'ovocites du type II, III et IV, en maintenant les pourcentages d'oogones et d'ovocites de type I plus bas. Durant cette période, au mois d'Avril, on trouve la plus grande quantité d'ovules. Macroscopiquement, la gonade apparait avec une coloration jaunâtre dont la consistence se fait progressivement. Cela correspondrait à la phase de croissance et de maduration de la gonade. 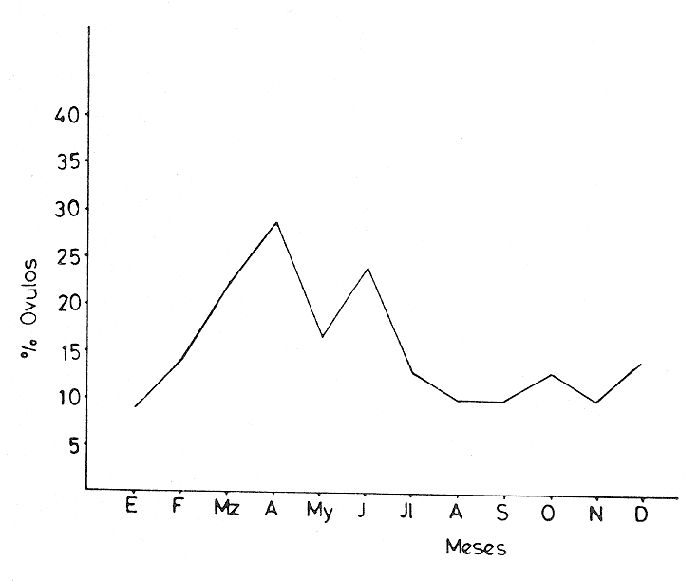 Fig. 4. Represéntation graphique de le pourcentage annuel d'ovules trouvés tout au long des mois de l'anée. En Mai, il se produit une petite pose, de la part de la majorité des animaux de la population étudiée. En juin, l'áspect histologique observé au mois d'Avril se rétablit; on y trouve une augmentation d'ovules par rapport au mois précedent. Les spécimens sont préparés pour la pose continué de lété (grande pose) ce qui pourrait etre en relations avec l'existence d'une plus grande luminosité et une température plus réguliére à 21ºC, selon les observations de Dybern (1965). Pendant les mois de Juillet, Aout et Septembre, les gonades sont abondantes en ovocites de type I, cadre histologique qui n'a pas été manifesté antérleurement. A cette époque, on a l'habitude d'observer une désorganisation de I'óvaire, caractérisée par la presence de cellules sanguines avec une activité phagocytare et distribuées par les follicules. De la même manière, il est facile d'observer la présence d'ovules qui arrivent à voir jusqu' à 140 microns, affichant un noyau de plus de 50 mícrons et un nucléole atteignant 13 microns; ce seraient les ovocites et les ovules résiduels probablemente déjà hydratés. Ce tableau correspondrait à la période de pose. Macroscopiquement, on observe que la gonade perd sa consistence. Au mois d'Octobre, on observe une aumentation d'ovocites du type II avec diminution des ovocites du type I. On considére une phase préparatoire pour une petit pose, qui a lieu aux mois de Novembre et Décembre, et qui est assez comparable à celle observée au mois de Mai. La phase finale des poses se manifieste comme un état de nécrobiose, caractérisé par la présence dans les follicules d'une grande quantité de cellules sanguines (phagocytose et baisse de la fièvre), qui procédent du tissu conjonctif environnant, qui son les responsables de la destruction des ovocites résiduels. Ces états contienent un cadre histologique dénommé postpose/ dégeneration. Tout de suite aprés, les animaux commecent un nouveau cycle avec la récupération de la gonade, processus que se dissimule avec celui d'une nouvelle croissance et maturation. Quant à la dépendence de ce cycle par rapport aux conditions expérimentales, nous avons cru convenable de faire le commentaire suivant: les valeurs physico-chimiques de l'eau du réservoir d'expérimentation no subissent pas de variations importantes au cours des mois étudies. Cependant, au cours du mois de Mai, on observe une légère augmentation de la concentration d'oxygène, qui n'a pas de relation avec la pose des spécimens comme on a pu observe au cours des mois de juillet, Aout et Septembre. La concentration de Nitrites montre une certaine diminution durant les mois de pose; on observe au contraire une légère augmentation au cours des mois d'Avril e Decembre. Les valeurs monyennes des indices gonosomiques, réunis au Tableau 6, restent uniformes durant le processus d'ovogénèses, ce qui fait penser á une relation directe entre le poids de l'animal el la poids de la gonade. 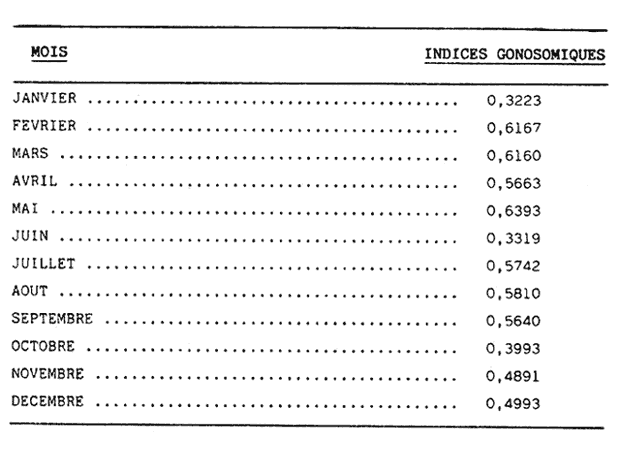 TABLEAU 6 VALEURS MONYENNES DES INDICES GONOSOMIQUES DISCUSSIONA l'aide des résultats de notre travail, on peut apprécier la présence constante de tous les types d'ovocites décrit au cours de chaque mois de l'année. Escalera Liaciet al. (1977), dans la mer de Piccolo (Taranto), décrit en période hivernale l'absence d'ovocites intermédiaries. Ces différences peuvent étre dues aux conditions expérimentales de notre travail. Dans la mer du Piccolo, les oscillations de température (été-hiver) furent trés marqués, pas comme dans notre réservoir expérimental qui furent entre 18ºC et 23ºC. Le même auteur décrit l'existence d'un porcentage plus éleve d'ovules au cours du mois de Septembre, alors que cette même situation se produit au mois d'Avril pour nous. Par rapport á l'époque d'activité reproductrice Orton (1920) à Plymouth, confirme que c'est Poursuivi pendant une période trés ample, que va d'Avril à Novembre, alors que Millar (1952), à Millport la décrit de Mai à juin. Pour sa part, Relini (1964) à Génes l'établit de Janvier à juin. Dans un travail posterieur Montanari et Relini (1970) communiquent l'ampliation de cette période à toute l'annés, Escaleraet al. (1977) que durant la période estivale il y a una plus grande quantité d'ovules mûres. Aussi nos résultats ne sont d'accord avec aucun des précédents, si nous trouvons une similitude majeure auec les recherches de Montari et Relini cédents, si nous trouvons une similitude majeure avec les recherches de Montanari et Relini (1970), due sans doute aux conditions d'ambiance dans lesquelles se déroule son travail. Dans notre étude, nous trouvons une correlation entre les petites variations des caractéristiques physicochimiques de l'eau des réservoirs d'expérimentation et l'évolution dy cycle sexuel deCiona. En réalité, les variationes des paramétres de l'eau son négligeables, étant donné qu'il existait un controle pour maintenir un flux continu d'eau dans le résorvoirs. Pour terminer, nous voulons faire ressortir que les résultats par rapport á Findice gonosomique, sont en accord avec ceux obtenus par Millar (1952), qui a observé une augmentation progresive du poids de Fanimal au cours des mois qui, selon notre étude, correspondent à la maturation. Actuellement nous continuons ces travaux dans les conditions expérimentales citées, pour voir le comportement de l'ovogénèse face aux contaminants, motif pour lequel nous avons réalisé ces investigations préalables dans les réservoirs expérimentaux pour avoir une standardistion. AgradecimientosRECONNAISSANTJe sus trés reconnaissant au Professeur Dr. D. M. Gutiérrez pour toute s'aide et colaboration sans laquelle n'auvrait été possible la realization de cé travaille. LITERATURABARRINGYON, E. J., In: Metamorphosis. Metamorphosis in Lower chor dates.Appleton Century Crofts.New York:1968223-270. BERRIL, N. J., J. Mar. biol. Ass. U. K., The development and growth of Ciona1947.616-625 p.26 DYBERN, B. I., Oikos, The life cycle of Ciona intestinalis (L.) tipica in relation to environmental temperature.1965.109-131.16 ESCALERA, L., A. TURSI & SCISCIOLI, Memoria di Biologia Marina e di Oceanografie, Relazione fra insediamento e riproduzione de Ciona intestinalis (L.).1977.61-75.8(5/ 6): GODEAUX, J., Tuniciers: Embriologie, Histologie et Morphologie (1958-1961) Fortschr Zool.,1963.333-394.16 GUTIÉRREZ, M., Inv. Pesq., Coloración Histológica para ovarios de peces, crustáceos y moluscos.1967.265-276.31(2) HARVEY, L. A., The history of citoplasmic inclusion of the egg of Ciona intestinalis (L.) during ovogenesis and fertilization.Proc. Roy Soc. London B1927.136-162.101: HUSS, J., Effects of physical factors on the spawning in ascidians.Auh. Nor. Vidensk. Akad. Oslo Mat. Naturvidensk. KI.,1941.2-12.8(1-13/9): KESSEL, R. G., The origin and fate of secretion in the follicle cells of tunicates. Z. Zellforsch.,1967.21-30.76 LAMBERT, C. C. et C. L. BRANDT, Biol. Bull., The effect of light on the spawning of Ciona.1967.222-228.132 MANCUSO, V., Acta Embriol. Mowphol. Exp., An electron microscope study of the test cells and follicle cells of Ciona intestinalis (L.) during oogenesis.1965.239-266.8 MILLAR, R. H., Jour. Mar. Biol. Ass. U. K., The annual groeth and reproductive cycle in four ascidians.1952.41-61.31 MILLAR, R. H., The biology of ascidians.Avd. mar Biol.,1971.145-152.11 MONTANARI, M. et G. RELINI, Publ. Staz. Zool. Nap.,Fouling di zone inquinate. Osservazioni nel porto di Genova Idroidi e Ascidiacei. suppl. 38.1970. ORTON, J. H., J. Mar. Biol. Ass. U. K., Sea temperature, breedíng, and distribution in marine animals.1920.339-36612 PERES, J. N., Recherches sur le cycle sexual de Ciona intestinalis.Arch. Anat. Micros-Morphol. Exp.,1952.153-183.41 PERES, J. M., Considerations sur la fonctionnement ovarien chez Ciona intestinalis (L.) Arch. Anat. Microsc-Morphol. Exp.,1953.58-78.43 RELINI, G., Andamento staglionale degli organismi sessili nel porto di Genova. Arch. Ocean Limn., XIII,1964.2 SABBADIN, A., II ciclo biologico di Ciona intestinalis (L.)Arch. Oceanog. Limn.,1957.1-27.17 WITTINGHAM, D. G., Biol. Bull., Light. induction of shedding of gametes in Ciona intestinalis and Mogula manhattensis.1967.292-298.132 WHITTAKER, J. R., Segregation during ascidians embryogenesis of egg cytoplasmic information for tissue-specific enzyme development.Proc. Nat. Acad. Sci.,1973.2096-2100.7088
|

