|
CULTIVO EN CONDICIONES CONTROLADAS DE MONOCHRYSIS
LUTHERI Y SKELETONEMA COSTATUM CON EXTRACTOS DE MACROFITAS MARINAS
(FITOPLANCTON)
Trabajo recibido el 1 de marzo de 1983 y aceptado para su
publicación el 18 de agosto de
1983.
JESÚS PANIAGUA M.
L. FERNANDO BÜCKLE R.
Centro de Investigación Científica y
Educación Superior de Ensenada (C.I.C.E.S.E.). Apdo. Postal 2732,
Ensenada, Baja California
(México).
Se experimentó el cultivo de fitoplancton marino bajo condiciones
controladas utilizando extractos líquidos de las
macrofitasMacrocystis pyrifera y Zostera marina como medio
de cultivo.
Las especies de fitoplancton cultivadas fueron
el flagelado Monochrysis lutheri y la
diatomeaSkeletonema costatum. Para extraer los nutrientes de
las macrofitas se diseñó un biodigestor recirculador impulsado
por aire en el cual los productos complejos contenidos en las macroalgas se
desdoblaron por acción bacteriana y eventualmente por la
recirculación vía oxidativa. Los resultados indicaron que los
nutrientes de las macrofitas pueden mantener el crecimiento de un 71.0%
deM. lutheri y de un 79.0% de S.
costatumcomparado con el medio de cultivo de Matthiessen y Toner
(1966), adoptado en esta investigación como
control.
Assays
to obtain an inexpensive media to culture phytoplankton under controlled
conditions were performed using liquid seaweeds extracts. The phytoplankton
species cultivated were the ChrysophyteMonochrysis
lutheriand the BacyllariophyteSkeletonema
costatum.
To extract the nutrients from the
macrophytes, a biodigester was designed in which the complex products contained
in the macrophytes were broken down by the bacteria and eventually by the
recirculation via oxidative process. The results indicated that the nutrients
contained in the macrophytes were sufficient to support a growth up to 71.0%
inMonochrysis lutheri and 79.0% inSkeletonema
costatum, when compared to the control media used (Matthiessen and
Toner,
1966).
El cultivo de moluscos filtroalimentadores requiere de grandes cantidades de fitoplancton para la alimentación de los reproductores y de los diferentes estadios larvales. Por lo general el fitoplancton que se cultiva para estos propósitos se produce enriqueciendo el agua de mar con nutrientes puros, lo que resulta a veces antieconómico debido a la incidencia que tiene en el valor final de los moluscos comerciales. Una manera de disminuir el costo de producción es explorar y diseñar medios de cultivos de fitoplancton utilizando recursos naturales abundantes en la región como por ejemplo, las macroalgas, que ya han sido usadas como fertilizantes agrícolas ya sea enterrando plantas enteras o en forma de extractos líquidos. Los extractos de las algas pueden elaborarse por hidrólisis alcalina a presión de vapor (Booth, 1969). En este proceso las macrofitas marinas se reducen a una forma líquida en la cual se mantienen los elementos traza en solución sin precipitarse, por las propiedades quelantes de los almidones y carbohidratos que pueden estar combinados con Fe, Co, Mn, Zn y otros elementos traza, formando asociaciones orgánicas fuertes (Stephenson, 1974). El extracto de macrofitas estimula el crecimiento y la actividad metabólica de las plantas debido a la presencia de auxinas y gibberelinas, hormonas promotoras y reguladoras del crecimeinto de células vegetales respectivamente. El contenido químico de los extractos de macroalgas (NO3, PO4, SiO3 Cu, Zn, Co, Mn, vitaminas B1 yB12, quelantes orgánicos, auxinas, gibberelinas, aminoácidos, elementos traza y otros compuestos comparados con los medios químicos de cultivo de Matthiessen y Toner (1966) y de Guillard (1973), son cualitativamente similares en varios compuestos, lo que los hace una fuente potencial de nutrientes para el cultivo de fitoplancton. De la Cruz y Alfonso (1975) prepararon un medio de cultivo para microalgas en base a harina de pescado y girasol, levadura de cerveza, nitrato de amonio y superfosfato simple. Granados y Bückle (1983) han investigado la utilización de extractos de excretas de vaca y de gallina (obtenidos en un biodigestor de recirculación aerobia) como una fuente de nutrimentos para cultivar fitoplancton. MATERIALES Y MÉTODOSPara esta investigación se escogieron los pastos marinos y macroalgas abundantes en la región, que de acuerdo a la bibliografía contuvieran la mayoría de los nutrientes que requiere el fitoplancton para su crecimiento (Stephenson, 1974). Las plantas elegidas fueronMacrocystis pyrifera y Zostera marina a las cuales previamente se les hizo un análisis de humedad, ceniza, grasas y proteínas basándose en los métodos oficiales del A.O.A.C. (Horwitz, 1975). Con la finalidad de extraer los nutrimentos de las plantas se diseñó un biodigestor que consistió en un estanque plástico semicónico de 100 l de capacidad pintado exteriormente de color negro para captar la energía solar e indirectamente fomentar el desarrollo bacteriano. En el interior de los estanques se colocaron desde la mitad hasta el fondo tres capas de guijarros y conchas quebradas de moluscos cernidas por mallas de 4, 25 y 60 mm de abertura aproximadamente. Los guijarros tuvieron esencialmente la función de un filtro y a la vez sirvió también como sustrato para las bacterias (Fig. 1-a) . El estanque se perforó en el fondo donde se instaló un tubo de P.V.C. de media pulgada que se prolongó por medio de conexiones a una unión 'T'. A la unión 'T' se le conectó una llave de paso (Fig. 1-b) en su parte inferior para tomar las muestras y la superior se modificó para inyectar aire (burbujeador) (Fig. 1c) y recircular el líquido del biodigestor. En el interior de este diseño se suspendió un recipiente profusamente perforado, en el cual se colocaron las macrofitas (Fig. 1-e) . De esta forma el líquido impulsado por el burbujeador era esparcido en la superficie del interior del balde bañando constantemente su contenido. 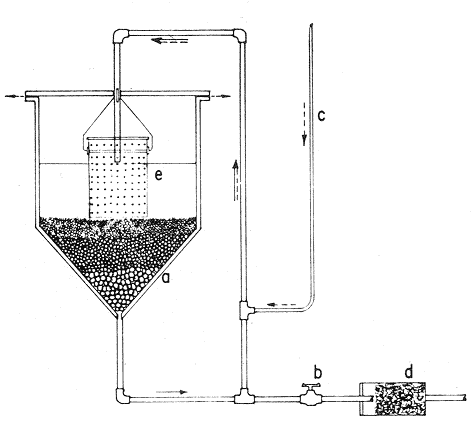 Fig. 1. Esquema del biodigestor. a, canto rodado b, llave de paso, c. aire, d. filtro, e, recipiente perforado. Las flechas indican la dirección de los fluidos: líquido ··· aire ---. Las macrofitas se molieron previamente con agua en una licuadora. El caldo de algas, junto con las partículas no molidas se vaciaron en el recipiente ubicado dentro del biodigestor. El biodigestor se llenó con 30 1 de agua destilada. Las partículas no molidas se lavaban cada vez en el líquido algal circulaba produciendo la desintegración de los fragmentos (Fig. 1) . El biodigestor se mantuvo a la intemperie. La temperatura, del líquido, recirculado durante el día, fluctuó entre 19 y 21°C. No fue posible estudiar la sucesión de las poblaciones de bacterias. Para determinar el tiempo óptimo de tratamiento de las macrofitas y seleccionar el momento de la más alta concentración de nutrientes, se muestrearon del biodigestor cada dos días, 2 l de extracto durante 30 días. La muestra obtenida se esterilizaba a 15 lb/pulg.² y 121ºC. Seguidamente se tomaba una submuestra de 200 ml para el análisis de nutrientes, los que se fijaban con HgCl. Posteriormente las submuestras se analizaron en un espectrofotómetro Hach modelo DREL 2 para conocer el contenido de NO3, PO4, NH4. En una segunda submuestra se analizaban los elementos traza Fe y Mn. El extracto remanente se congeló para la elaboración del medio de cultivo. El criterio para elegir de los extractos remanentes, los nutrientes necesarios para preparar el medio de cultivo, fue el de considerar aquellos días en que el biodigestor produjo el máximo de nitratos. Por el hecho de desconocer la eficiencia de estos medios de cultivo (con el máximo de nitratos) fue necesario explorar primero y empíricamente, la cantidad óptima de fertilizante requerido para reproducir las microalgas. El extracto de M. pyrifera y Z. marina se experimentó separadamente en matraces Fernbach (1,000 ml) a los cuales se agregó 5, 10, 15, 25, 30, 35, 40, 45, 50 ml/l. Los matraces fueron esterilizados e inoculados conM. lutheri y S. costatum. Los cultivos se mantuvieron en condiciones constantes de luz y temperatura. La cantidad óptima de extracto de macrofitas se determinó visualmente comparando el crecimiento en los matraces experimentales, con los controles preparados en base a la fórmula propuesta por Matthiessen y Toner (1966). Para la preparación del medio de cultivo se mezclaron las cantidades óptimas de los extractos detectadas en el experimento precedente y se prepararon 5 matraces réplica con 50 ml de agua de mar cada uno adjunto a un Fernbach control. El pH de cada matraz se midió con un potenciómetro Photovolt. Se agregó HCl a cada medio con el fin de ajustar el pH al rango (7.4 a 8.2) del fitoplancton. La salinidad se midió con un salinómetro refractómetro marca A.O. Goldberg. Todos los medios de cultivo se esterilizaron a 121ºC y 15 lb/pulg.² de presión durante 30 minutos. Después de 24 horas los matraces se inocularon cada uno con M. lutherioS. costatum, cepas del laboratorio del National Marine Fisheries Service, de la Jolla California U. S. A. Los matraces inoculados se mantuvieron en un cuarto de cultivo a una temperatura de 20 ± 2ºC. La temperatura del cuarto se controló con un aparato de aire acondicionado marca White-Westinghouse. La luz se proporcionó con lámparas fluorescentes tipo luz fría. A este nivel. no se incluyó aireación ya que basta la agitación manual diaria, para que ocurra la difusión completa de los nutrientes y evitar la decantación de los cultivos. La reproducción de las células se estimó diariamente controlando 5 submuestras en una cámara de Neubauer de 0.1 mm de profundidad. Esta metodología se aplicó a nivel de 1,000 y 16,000 ml variando sólo la cantidad de extracto añadido, salvo que a nivel de Carboy (16,000 m1) se inyectó aire. De los diferentes volúmenes de cultivo se graficaron sus densidades promedio de crecimiento y se compararon con los controles. También se estimaron los valores poblacionales de las microalgas tales como: constante de crecimiento (u), tiempo de duplicación (T. D.), divisiones celulares (D.), producción diaria (P. D.) y variación porcentual (V. P.) (De la Cruz y Alfonso, 1975). Para comparar la significancia del crecimiento celular entre ambos medios de cultivo., se aplicó la prueba estadística de Student (Snedecor y Cochran, 1980) considerando sólo la fase exponencial (Monod, 1949). No se contrastó la fase de retardo ni la de reposo por que para el aprovechamiento del fitoplancton no son tan importantes. RESULTADOSEl análisis químico proximal de las macrofitas se muestran en la Tabla 1. El contenido de carbohidratos no se determinó. 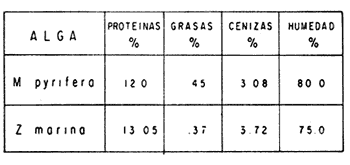 TABLA 1 PORCENTAJE DE PROTEÍNAS, GRASAS, CENIZAS Y HUMEDAD DE M. PYRIFERA Y Z. MARINA La variación temporal de los nutrimentos analizados se presentan en las figuras 2, 3 y 4. Los extractos de macroalgas con la concentración más alta de nitratos fueron aquellos que se obtuvieron al decimosexto y vigésimo día de tratamiento. Estos se mezclaron constituyendo el nuevo medio de cultivo. Se necesitó una relación de 4:5 deM. pyrifera a Z. marina con una relación de 1:9 de agua de mar a extractos. El análisis de la mezcla de los nutrientes del medio orgánico de cultivo se compara en la Tabla 2 con el medio químico de Matthiesen y Toner (1966). 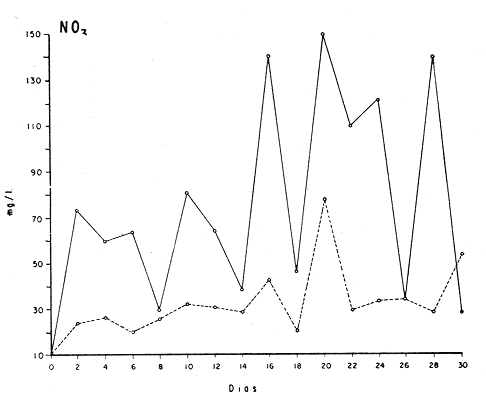 Fig. 2. Variación temporal de la concentración de nitratos en los extractos de M. pyrifera - - - y de Z. marina - - -. 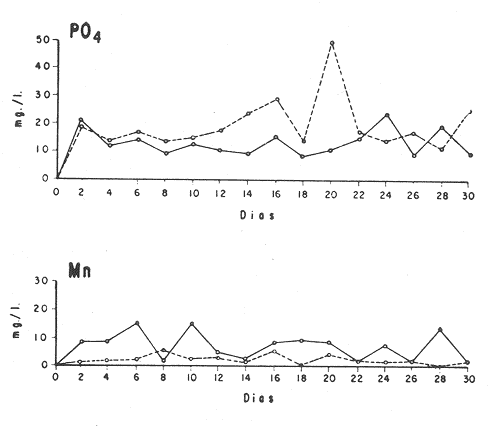 Fig. 3. Oscilación temporal del contenido de tostases y de manganeso en el extracto preparado en base a M. pyrifera --- y Z. marina ---. 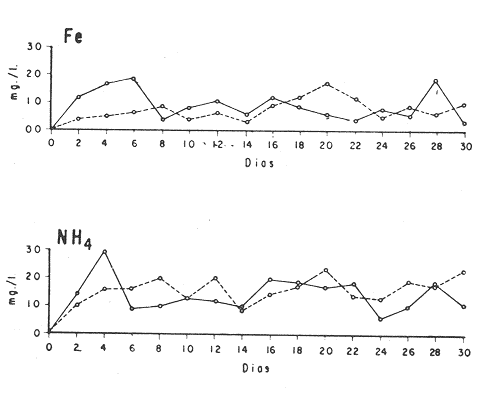 Fig. 4. Contenido de fierro y amonio en los extractos de M. pyrifera --- y de Z. marina. 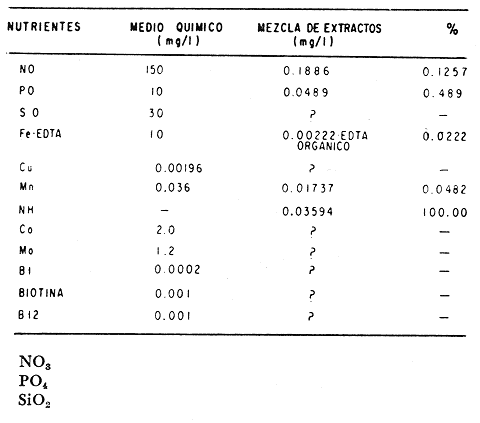 TABLA 2 COMPARACIÓN DE LA CONCENTRACIÓN DE LOS NUTRIENTES DEL MEDIO CONTROL CON LA MEZCLA DE EXTRACTOS DE MACROFITAS. % = PORCENTAJE DE NUTRIENTES DE LA MEZCLA EN RELACIÓN AL MEDIO CONTROL A continuación se describe por separado el efecto del medio orgánico algal y químico en M. lutheri y S. costatum. Se experimentó el crecimiento deMonochrysis lutheri en 50 ml de medio de cultivo diseñado. Sus valores poblacionales se indican en la Tabla 3. En la figura 5 se transfieren las densidades controladas en los cultivos. Se observa en el medio experimentado una fase de retardo que se inicia con una concentración de 2.5 X 105 cels/ml prolongada hasta el segundo día, a partir del cual comienza la fase exponencial alcanzando 18.06 X 105 cels/ml. En el séptimo día de cultivo baja a densidades de 15.25 X 105 cels/ml mientras el control denota una concentración de 21.50 X 105 cels/ml. El análisis estadístico no indicó una diferencia significativa entre el medio control y experimental (Tabla 9). El cultivo con agua de mar pura no sobrepasó una densidad de 5 X 105 cels/ml. Los valores poblacionales de las citadas microalgas en 1,000 ml se muestran en la Tabla 4. Las densidades controladas durante diez días están graficadas en la figura 6. Los cultivos con el medio orgánico y químico se iniciaron con 1.80 X 105 cels/ml denotándose prácticamente la ausencia de la fase de retardo.M, lutheri creció aceleradamente hasta el séptimo día alcanzando una densidad de 20.04 X 10 5 cels/m1 en el medio en base a macrofitas y 29.50 X 10 5 cels/m1 en el control. Estadísticamente los cultivos no tienen una diferencia significativa (Tabla 9). 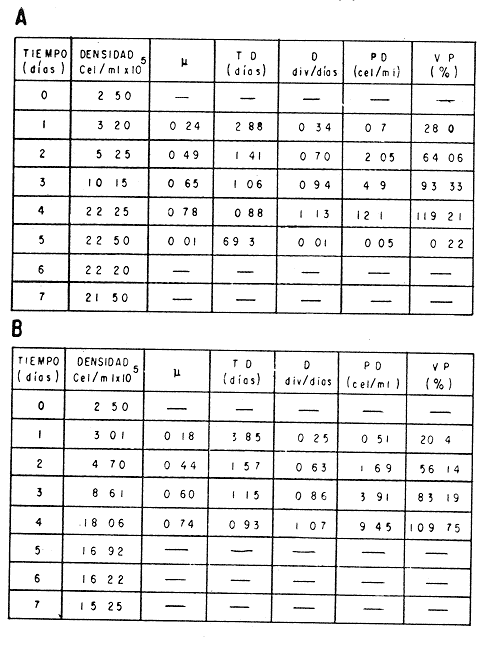 TABLA 3 VALORES POBLACIONALES DE MONOCHRYSIS LUTHERI CULTIVADA EN 50 ML, DE MEDIO QUÍMICO CONTROL (A) Y EN EL MEDIO EN BASE A MACROFITAS (B) 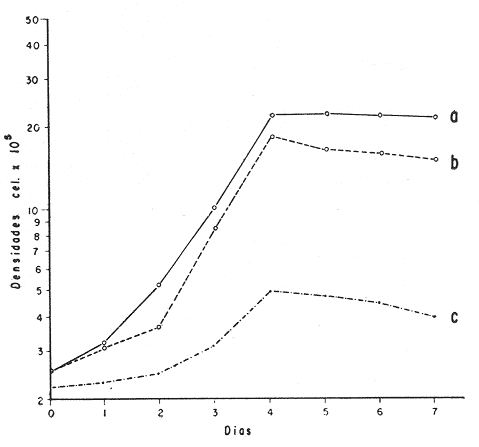 Fig. 5. Curvas de crecimiento de Monochrysis lutheri en 50 ml de medio químico (a) medio de cultivo en base a macrofitas (b) y agua de mar pura (c). 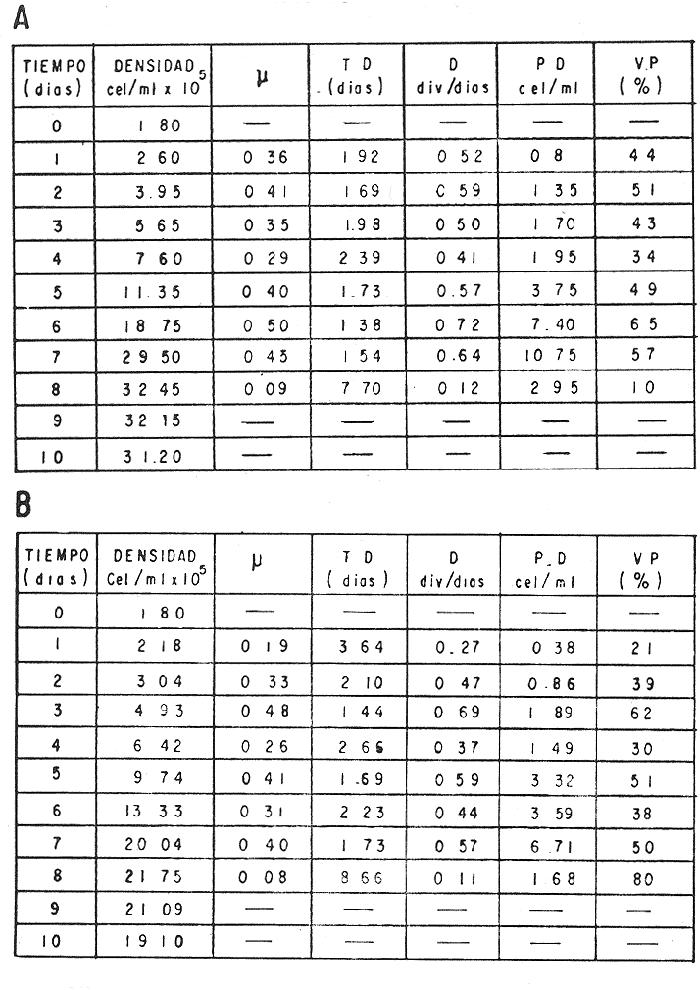 TABLA 4 VALORES POBLACIONALES DE MONOCHRYSIS LUTHERI CULTIVADA EN 1000 ML, DE MEDIO QUIMICO CONTROL (A) Y CON EL MISMO VOLUMEN PERO CON EXTRACTOS DE MACROFITAS (B) 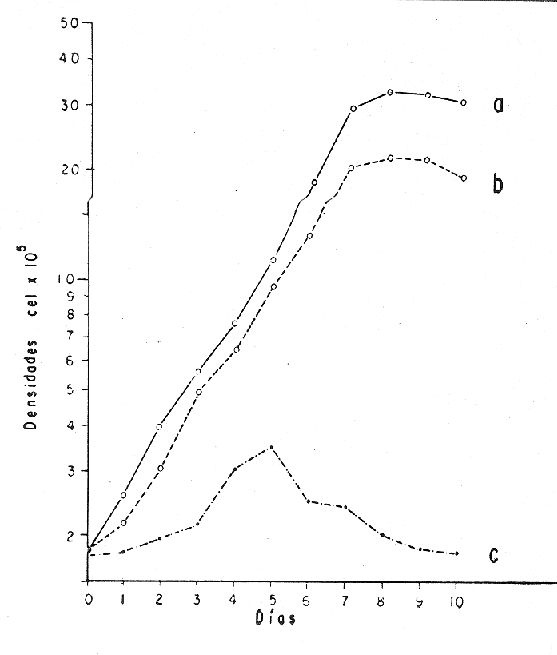 Fig. 6. Curvas de crecimiento de Monochrysis lutheri controladas en 1,000 ml de medio químico control (a) medio orgánico algal (b) y agua de mar sin enriquecer (c). El cultivo de M. lutheri hecho con agua de mar no sobrepasa las 3.5 X 10 5 cels/ml. Los valores poblacionales del crecimiento de este flagelado en 16,000 m1 cultivado con el medio control y con el extracto de macrofitas se indican en la Tabla 5. Las curvas respectivas de crecimiento se observan en la figura 7. La inoculación en los medios de cultivo se hizo con 1.1 X 10 5 cels/ml. La fase exponencial en estas curvas se inicia al segundo día, alcanzando al octavo su máxima expresión con 48.07 X 10 5 cels/ml en el medio experimentado y 71.0 X 10 5 cels/ml en el control. El análisis estadístico estableció que no había una diferencia significativa entre los dos medios de cultivo (Tabla 9). 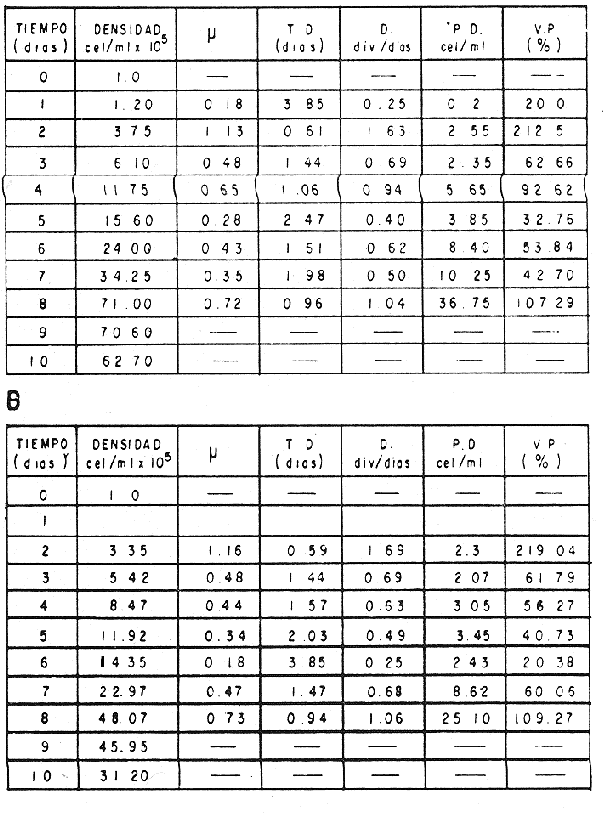 TABLA 5 VALORES POBLACIONALES DE MONOCHRYSIS LUTHERI CULTIVADA EN 16,000 ML, DE MEDIO QUIMICO CONTROL (A) Y TAMBIÉN CON EXTRACTOS DE MACROALGAS (B) 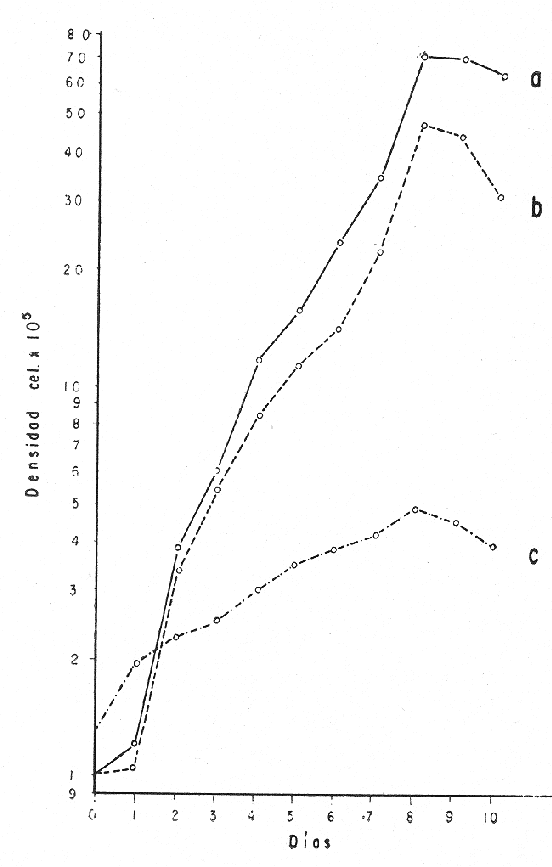 Fig. 7. Curvas de crecimiento de Monochrysis lutheri cultivada en 16,000 ml de medio químico control (a) con extracto de macrofitas (b) y con agua de mar pura (c). El muestreo de los cultivos deSkeletonema costatum en 50 m1 utilizando el medio en base a macrofitas y el control dieron los parámetros poblacionales presentados en la Tabla 6. Las curvas de crecimiento hechas en base a las densidades poblacionales se presentan en la figura 8. La curva correspondiente al medio de cultivo orgánico se inició con un inóculo de 2.60 X 10 5 cels/ml. La fase de inducción es similar al control, hasta iniciar al segundo día la fase exponencial que alcanza al cuarto día una densidad de 16.96 X 10 5 y en el control 17.45 X 10 5 cels/ml. El análisis estadístico no reveló una diferencia significativa en el crecimiento de S. costatum ya sea empleando el medio orgánico o químico (Tabla 9). 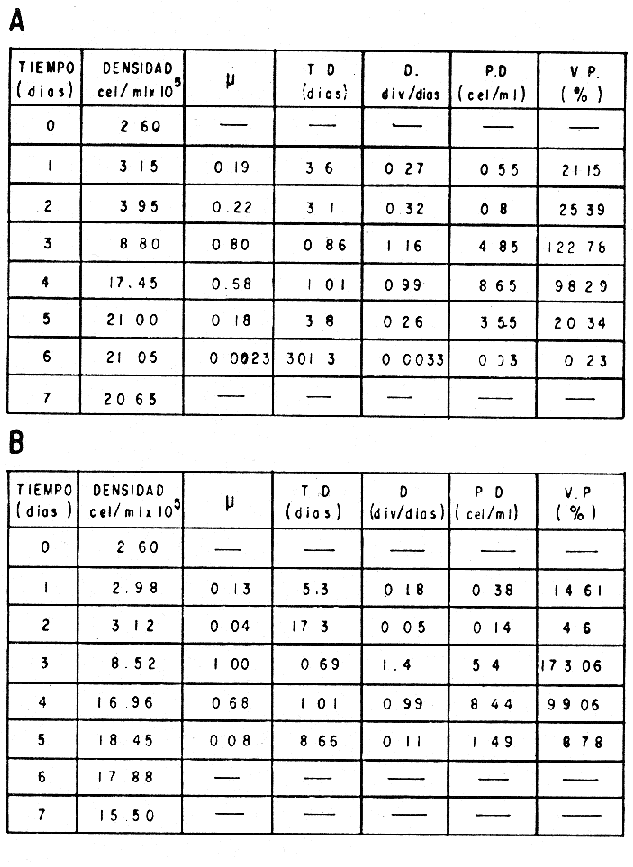 TABLA 6 VALORES POBLACIONALES DE SKELETONEMA COSTATUM CULTIVADA EN 50 MI, DE MEDIO QUIMICO CONTROL (A) Y EN IGUAL VOLUMEN CON FERTILIZANTES EN BASE A MACROFITAS (B) 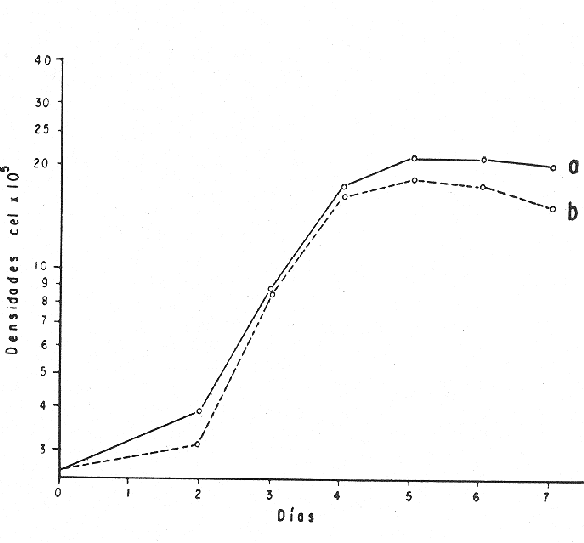 Fig. 8. Curvas de crecimiento de Skeletonema costatum cultivada en 50 ml de medio químico control (a) y con el medio orgánico algal (b). Para estudiar el efecto de los medios de cultivo en 1,000 ml los matraces fueron inoculados con 1.45 X 105 células de S. costatum. Los valores poblacionales calculados en base a las densidades diarias se reportan en la Tabla 7. La figura 9 refleja el crecimiento de la cepa que tuvo una inducción de veinticuatro horas y una fase exponencial de seis días de duración. Al séptimo día, los cultivos se asemejaban bastante, alcanzando el medio orgánico una densidad de 19.42 X 105 y el control 26.75 X 105 cels/ml. La Tabla 9 indicó que la diferencia entre los cultivos no fue significativa. El cultivo de S. costatumen 16,000 ml tampoco reveló una diferencia significativa al utilizar el medio en base a macrofitas al contrastarlo con el control (Tabla 9). 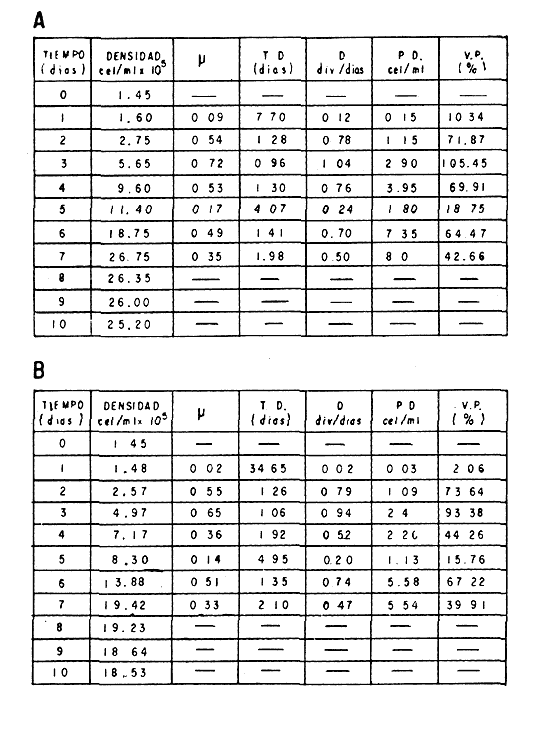 TABLA 7 VALORES POBLACIONALES DE SKELETONEMA COSTATUM CONTROLADOS EN CULTIVOS CON 1,000 ML DE MEDIO QUIMICO (A) Y CON EL MISMO VOLUMEN UTILIZANDO EXTRACTOS DE MACROFITAS (B) 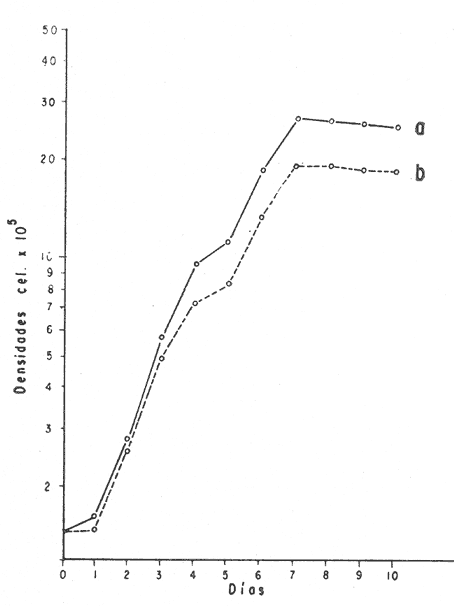 Fig. 9. Curvas de crecimiento de Skeletonema costatum cultivada en 1,000 ml de medio químico (a) y con extractos de macroalgas (b). 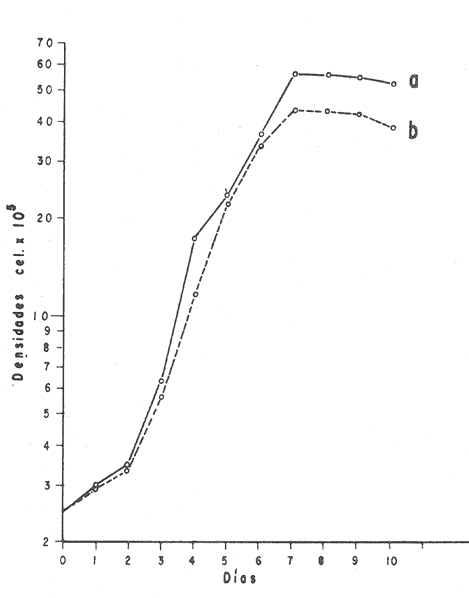 Fig. 10. Curvas de crecimiento de Skeletonema costatum en 16,000 ml de medio químico (a) y con el medio orgánico algal (b). 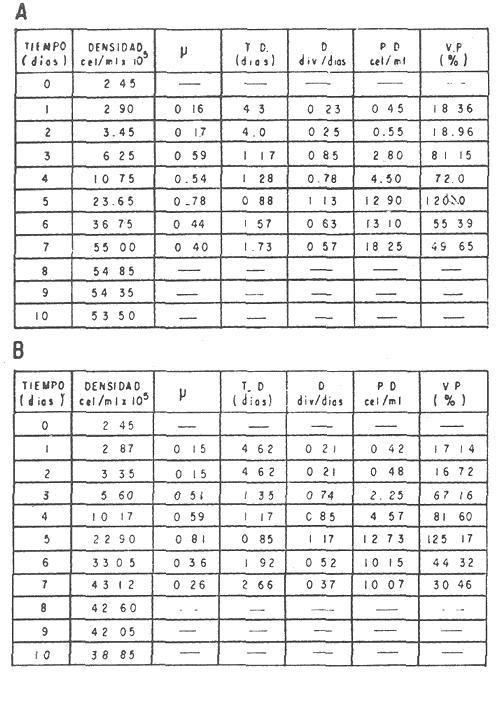 TABLA 8 VALORES POBLACIONALES DE SKELETONEMA COSTATUM CULTIVADA EN 16,000 ML DE MEDIO QUÍMICO (A) VALORES POBLACIONALES Y CON EL EXTRACTO ORGÁNICO DE MACROFITAS (B) Los valores poblacionales se indican en la Tabla 8. El inóculo se inició con 2.45 X 105 células y tuvo una fase de retardo de dos días, manteniendo en la fase exponencial una fuerte similitud, para alcanzar al séptimo día 43.12 X 105 cels / ml en el medio orgánico y 55.00 X 105 en el medio químico control (Fig. 10).  TABLA 9 (A) - COMPARACIÓN DEL CRECIMIENTO DE LAS MICROALGAS CULTIVADAS EN UN MEDIO EN BASE A EXTRACTOS DE MACROFITAS, Y EL MEDIO QUIMICO CONTROL (= 100%). (B) - CONTRASTACIÓN ESTADÍSTICA DE LAS PENDIENTES DE LA FASE EXPONENCIAL DE LAS CURVAS DE CRECIMIENTO El porcentaje de crecimiento sostenido por el medio orgánico para M. lutheri y S. costatum, considerando al medio químico control como el 100%, revela que en los diferentes volúmenes el medio experimentado impulsa alrededor del 71% del flagelado y aproximadamente el 79% de la diatomea (Tabla 9). DISCUSIÓNLos análisis químicos proximales hechos enZostera marina y en Macrocystis pyrifera indicaron que la primera contiene más proteínas. Z. marinaabsorbe por las hojas y las raíces nitrógeno y fosfatos del agua intersticial del sedimento (McRoy y Barsdate, 1970). Thayeret al. (1977) encontraron un 11.56% de proteínas paraZ. marina. Stephenson (1974), reportó un valor de 13% de proteínas para pastos en general, lo que concuerda con el valor encontrado (13.05%) en esta investigación. Las diferencias en el contenido de proteínas puede deberse a las variaciones estacionales, ya que el máximo ocurre durante otoño e invierno antes del florecimiento del pasto (Thayer, 1977). Burrel y Schubel (1975), sugieren que las diferencias estarían originadas en parte al crecimiento microbial sobre las hojas deZ. marina. Stephenson, (1974) informa para M. pyrifera un 7.0% de proteínas sin especificar la estación del año. Mateus et al.(1976) comunica un 14.6% de proteína en enero de 1974 en muestras colectadas en Baja California. El 12% de proteínas encontrado en esta investigación puede atribuirse a la variación estacional de la composición química de las algas (nuestros ejemplares también se colectaron en Baja California pero en septiembre). El contenido de grasas en M. pyrifera fue de 0.45 % a diferencia de los valores encontrados en otras fechas por Mateus et al. (1976) quienes reportan un 0.6% El valor de 0.37% de grasas detectado en Z. marina difiere del indicado por Stephenson (1974), que generaliza para los pastos un 2.3%. Las diferencias descritas pueden ser debido a las condiciones particulares del nicho de Z. marina para cada región en particular, como también al estado fisiológico del alga en el momento de la colecta y análisis. La descomposición en las plantas marinas sigue dos vías, una mecánica y una bioquímica, ambas presentes en el método del biodigestor. Newell, citado por Fenchel (1973), mostró que las hojas de las plantas se descomponen mejor maceradas, al aumentar la superficie de acción para las bacterias. Para que estas últimas actúen, se requiere oxígeno, lo cual fue comprobado en los experimentos de Fenchel (1973). El aire inyectado al biodigestor cumplió esta función. Al analizar el contenido de nutrientes de los extractos, se obtuvo al decimosexto y vigésimo día la mayor concentración de nitratos, tanto en el pasto como en el alga (Fig. 2).M. Pyrifera libera más nitratos que el pasto marino. La concentración de amonio en M. pyrifera fue también más alta que en Z. marina(Fig. 4). Las variaciones temporales en la concentración de amonio y nitratos no representan el fenómeno típico descrito por King (en Smith y Chanley, 1975) y Spotte (1979) en sistemas de recirculación de agua de mar, donde la descomposición del amonio es secundada por los nitritos para terminar en nitratos. La concentración de los fosfatos en el extracto de Z. marina fue más alta que en M. pyrifera(Fig. 3). Esto ya ha sido observado por otros autores como Booth. (1969), quien postula que M. pyrifera es una fuente pobre de fosfatos.Z. marina se ha reportado como abundante en fosfatos porque son plantas exuberantes en los sedimentos de cuerpos de aguas protegidas de donde capta los nutrientes por las hojas y las raíces (McRoy et al., 1972). Los únicos elementos traza analizados en los extractos fueron manganeso y hierro totales. El hecho de que sólo se hayan determinado estos elementos no implica que sean los únicos ya que Black y Mitchell (1952), encontraron 18 elementos traza enM. Pyrifera, entre los cuales sobresalen As, Co, Cu, Mn, Zn, Ni, Ca, Mo y Fe. Por otra parte Burrel y Schubel (1975) analizaron 10 elementos traza en Z. marinaentre otros Cd, Cu, Zn, Fe, Mn, Ni y Co. Stephenson (1974), afirma que las plantas marinas contienen todos los nutrientes mayores y menores que requieren los vegetales en general para crecer, además de las vitaminas, auxinas y gibberelinas. Las concentraciones y disponibilidad de estos nutrientes y sustancias promotoras del crecimiento, dependen de las variaciones en la composición química de las algas y pastos marinos, como también de la especie, estadio de crecimiento, tiempo de colecta y localidad, además de la forma de tratamiento o procesamiento de los productos. Como se observa en las figuras 2, 3 y 4 existen fluctuaciones en lo que se refiere a la concentración de nutrientes durante el tratamiento en el biodigestor. Aunque los extractos se muestrearon a la misma hora (9:00 A.M.) se estima que los cambios diurnos y nocturnos influenciaron en las concentraciones de los nutrientes por las variaciones de temperatura, pH y por ende sobre las poblaciones bacterianas. Al analizar la mezcla de los extractos del pasto y del alga marina de los días 16 y 20 de procesamiento en el biodigestor, se estableció una concentración de 0.1886 mg/1 de nitratos lo que representa un 0.1275% con respecto al medio químico control (Tabla 2). Este último tiene en su fórmula nitrato aislado químicamente, mientras que en el medio orgánico de cultivo el nitrato está combinado con una gama de otros compuestos que no fue posible identificar en esta investigación. El fitoplancton requiere como materia prima para el anabolismo de proteínas y formación de protoplasma celular, nitrógeno inorgánico, usualmente en forma de nitratos. Al disminuir la concentración de éstos en un cultivo de microalgas por debajo de 1 mg/l se produce una reducción en la tasa fotosintética repercutiendo directamente en el crecimiento celular (Zgurovskaya y Kustenko, 1968). Estos autores realizaron ensayos en S. costatum determinando el máximo crecimiento con concentraciones de 0.1 de nitrato y 0.01 mg/l de amonio. El medio orgánico algal utilizado, contuvo 0.03594 mg/l de amonio. El medio control no tiene amonio. En el cultivo de microalgas, la presencia del amonio tiene ciertas ventajas sobre el nitrato por ser un elemento disponible incluido en la síntesis protéica sin reducción preliminar, para lo cual el alga no requiere un gasto energético extra (Zgurovskaya y Kustenko, 1968). Una de las ventajas al usar estos dos compuestos nitrogenados es el de mantener el pH dentro de un valor constante por varias semanas. Esto se debe al buffer fisiológico que se crea en el ajuste del radio iónico NO3/NH4 de acuerdo con la posibilidad de las células de absorber los dos iones (o combinaciones químicas entre ellos) (Trelease y Trelease, 1933 citado por Pratt y Fong, 1940). El pH es influenciado por la disponibilidad de iones de amonio y nitratos. Al asimilarse el amonio baja el pH del medio (pH 2.5-3) y al asimilarse nitrato, el pH del medio se incrementa hasta 7.0 (Pratt y Fong, 1940, citado por Ketchum, 1954). La concentración de fosfatos en el medio orgánico algal contuvo 0.0489 mg/l lo que representa un 0.489%, comparado con el aporte de 10 mg/l del medio control (= 100%) (Tabla 2). Aunque este es otro de los nutrientes limitantes del crecimiento algal, ya que se considera la fuente de energía de los procesos metabólicos, su deficiencia en los cultivos ocasiona según Chu (1943) entre otras cosas, la decoloración de las microalgas. Esto no sucedió en las especies de algas estudiadas en este trabajo. Tanto altas como bajas concentraciones de fosfatos inhiben el crecimiento del fitoplancton. Gardinier (1941) citado por Chu (1943), mostró que el crecimiento de Diatomeas cultivadas cesa, al decrecer el nivel de fosfatos a cantidades mínimas, aparentemente por la reducción de la concentración de fosfatos y sílice. Se observó que la concentración de hierro en el medio orgánico algal fue de 0.0022 mg/1 (Tabla 2). Este metal es esencial para la síntesis del protoplasma por ser el constituyente de varias enzimas y transportadores que operan en el mecanismo de la respiración celular, como por ejemplo, en el pigmento respiratorio citocromo (McElroy y Nason, 1953). Uno de los efectos que causa la deficiencia de hierro es la disminución de la tasa fotosintética. Concentraciones superiores a 2 mg/l, inhiben el crecimiento de las microalgas y un valor de 0.04 mg/l se reporta como óptimo para crecimiento del fitoplancton (Ketchum, 1954). En el medio orgánico algal el contenido de manganeso fue de 0.01737 mg/l (Tabla 2) lo que representa un 0.0482%, comparado con el control. El manganeso interviene en la síntesis de clorofila y es el activador de sistemas enzimáticos tales como las dehidrogenasas y carboxilasas, necesarias para la fotosíntesis. La deficiencia del manganeso puede producir clorosis y los excesos son tóxicos para el fitoplancton (Somers y Sive, 1942, citado por Martin et al., 1971). Se considera que la cantidad de manganeso encontrada en esta investigación está dentro del rango que requiere el fitoplancton para un buen crecimiento. Aunque aquí se discuten sólo los nutrientes y los elementos traza analizados, es indudable que el medio de cultivo orgánico en base a macrofitas contiene la mayoría y posiblemente más constituyentes que el medio químico control. Probablemente, durante el proceso de la reproducción de las microalgas, las proteínas, como una fuente de nitrógeno orgánico disuelto (Fisher y Cowdell, 1982), grasas e hidratos de carbono, son una fuente potencial para la generación de otras reacciones bioquímicas que el fitoplancton aprovecha eficientemente. Las investigaciones al respecto se encuentran en progreso. Por las ventajas de manejo y costo del cultivo del fitoplancton con el medio diseñado se estima que tendrá un impacto sobre el valor de los organismos cultivados. AgradecimientosLos autores expresan su reconocimiento al Instituto de Investigaciones Oceanológicas (I I O) y a la Escuela Superior de Ciencias Marinas (E S C M) de la Universidad Autónoma de Baja California (U A B C) , por las facilidades de trabajo otorgadas. A la Secretaría de Educación Pública (SEP) como a la Organización de los Estados Americanos (OEA) agradecemos el financiemiento de esta investigación. LITERATURABLACK, W. A. y R. L. MITCHELL,Trace elements in the common brown algae and in sea water. J. Mar. Biol. Ass. U. K.,1952.575-584.30 BURRELL, D. C. y J. R. SCHUBEL, Seagrass Ecosistem Oceanography. Ed. Chesapeake Bay Institute.Johns Hopkins University,Baltimore, Maryland.1975. BOOTH, E., The manufacture and properties of liquid seaweeds extracts.Proc. Intl. Seaweed Symp, 6th.Santiago de CompostelaSpain1969655-662. CHU, S. P., J. Ecol., The influence of the mineral composition of the mediura on the growth of planktonic algae.1943.284-325.30 DE LA CRUZ, S. A. y E. ALFONSO,CienciasCultivo masivo de algas planctónicas mediante fertilización.Serie : 8Cuba.1975.1-25. FENCHEL, T., Aspects of the decomposition of seagrasses.Institute of ecology, University of Aarhus,Denmark.1973. FISHER, N. S. y R. A. COWEDELL,Growth of marine planktonic diatoms on inorganic and organic nitrogen.Mar. Biol.,1982.147-155.72 GRANADOS, C. y L. F. BUCKLE,Cultivo de las microalgas Monochrysis lutheri y Skeletonema costatum con nutrientes producidos por estiércoles digeridos. (En revisión).1983. GUILLARD, R. L., Culture of phytoplankton for feeding marine invertebrates. Woods Hole, Oceanography Institution,Massachussets.1973. HORWITZ, J. Library of Congress, Washington D. C.,Official methods of analysis of the Association of Official Analytical Chemist.1975.1094 p. KETCHUM, B. H., An. Rev. Pl. physiol., Mineral nutrition of phytoplankton.1954.55-74.5 MARTIN, D. F., M. T. DOIG y H. PIERCE, Distribution of naturally occurring chelators (humic acids) and selected trace metals in some west coast Florida streams. Univ. South Florida Prof. Pap. Ser.,1971.1-4712 MATEUS, H., J. REGENSTEIN y R. BAKER, Botánica Marina,The aminoacid composition of the marine brown algae Ma-crocystis pyrifera from Baja California, México.1976.155-159.19 MATTHIESSEN y TONER, Possible methods of improving the shellfish Industry of Martha's Vineyard, Duke's Country, Mar. Res. Found. Mas. : IV + 138Massachusetts,1966. McELROY, W. D. y A. NASON, Annu. Rev. pl. physiol.Mechanisms of action of micro nutrients elements in enzime systems.1953.1-30. McRoy, C. P. y R. BARSDATE, Limnol. Oceanogr.,Phosphate absortion in eelgrass.1970.6-13.15 McRoy, C. P., R. BARSDATE Y M. NABERT, Limnol. Oceanogr.,Phosphorus cycling in a eelgrass (Zostera marina) ecosystem.1972.58-67.17(1): MONOD, J., Ann. Rev. Microbiol., The growth of bacterial cultures.1949.371-394.3 PRATT, R. y J. FONG, Jour. of Botany., Studies on Chlorella vulgaris. III. Growth of Chlorella and changes in the hídrogen ion and amonium ion concentration in solutions containing nitrate and amonium nitrogen. Amer.1940.735-774.27 SMITH, W. L. y M. H. CHANLEY, Culture of Marine Invertebrate Animals.Plenum Press, New York,1975.338 p. SNEDECOR, G. W. y W. G. COCHRAN, Métodos EStadisticos.C.E.C.S.A.México,1980703 P. SPOTTE, S., Fish and Invertebrate Culture; Water Management in Closed Systems.Wiley-lnterscience,1979.179 p. STEPHENSON, W. A., With a Preface and updating by E. Booth. Conservation gardening and farmíng series.Seaweed Agriculture and Horticulture.U.S.A.1974. THAYER, G., W. D. ENGEL Y M. W. LACROIX, J. Exp. Mar. Biol. Ecol., Seasonal distribution and changes in the nutritive quality of living, dead and detrital fractions of Zostera marina.1977.109-127.30 ZGUROVSKAYA, L. N. y N. G. KUSTENKO, Oceanology,Effects of different concentrations of nitrite nitrogen of photosynthesis, pigment accumulation and cell division in Skeletonema costatum (Grev.), Chaetoceros sp. and Prorocentrum micans.1968.90-98.8(6):
|

