|
LA RELACIÓN CLOROFILA a: ATP EN LAGUNAS
COSTERAS TROPICALES
Trabajo recibido el 1 de febrero de 1983 y aceptado
para su publicación el 20 de abril de
1983.
ROBERTO LUIS ESCALONA
Instituto de Ciencias del Mar y Limnolo
gía, Universidad Nacional Autónoma de México, Apdo. Postal
811, Mazatlán, 82000, Sin., México. Contribución 359 del
Instituto de Ciencias del Mar y Limnología,
UNAM.
Se
investigó la posibilidad de usar la relación Clorofila
a: ATP como indicadora de limitación de la producción
primaria por disponibilidad de nutrientes en lagunas de la costa del Pacifico
tropical mexicano. Los resultados de este trabajo indican dificultades
potenciales en esta aplicación ya que no son consistentes con la
observación hecha por algunos investigadores en cultivos
monoespecíficos de que las algas microscópicas deficientes en
nitrógeno se caracterizan por una relación
Clorofilaa: ATP decreciente. Sin embargo, la buena
correlación observada entre ambos parámetros en las lagunas
estudiadas hace recomendable su medición simultánea cuando se
trata de estimar la biomasa fitoplanctónica y microbiana en estos
ecosistemas.
The
purpose of this work was to investigate the possibility of using the
chlorophylla: ATP ratio as an indicator of nutrient
limitation of primary production in tropical lagoons of the mexican Pacific
coast. The results indicate potential problems with such the observation made
on monoespecific cultures by other workers that nitrogen-deficient marine algae
are characterized by a decreasing chlorophylla: ATP ratio.
Nevertheless, the good correlation found between these two parameters in the
lagoons studied indicates the convenience of measuring both simultaneously when
an estimation of phytoplankton and microbial biomass in these ecosystems is
needed.
Las lagunas costeras tropicales son ecosistemas caracterizados en su mayoría por una productividad elevada (Mee, 1978), llegando a tener muchas de ellas importancia pesquera comercial. De ahí la necesidad de realizar en ellas estudios de producción primaria, la cual constituye la base de la cadena trófica. En este tipo de estudios es deseable contar con una estimación de la biomasa fitoplanctónica presente expresada como carbono celular. La medición directa de este parámetro presenta serias dificultades aun en aguas oceánicas por la interferencia de zooplancton y del material orgánico no vivo (Banse, 1977). El problema es más agudo en las lagunas costeras debido a la gran cantidad de detritus orgánico suspendido, por lo que la estimación de biomasa se hace por mediciones de la concentración de Clorofilaa o por conteo celular, aunque la laboriosidad de este último método limita considerablemente su uso cuando se realizan muestreos intensivos. Un procedimiento que puede ser alternativo o complementario fue desarrollado por Holm-Hansen y Booth (1966) y consiste en medir la concentración de trifosfato de adenosina (ATP) en el material suspendido. Este compuesto se encuentra en todas las células vivas y desaparece inmediatamente después de su muerte. La técnica es relativamente sencilla, pero es necesario tener en cuenta que la concentración de ATP sólo será una medida de la biomasa fítoplanctónica en sistemas donde existan niveles insignificantes de microheterótrofos. La utilidad tanto de la Clorofila a como del ATP como indicadores de la biomasa de fitoplancton requiere además de la condición de que la relación entre estos parámetros y el carbono celular sea relativamente constante y uniforme en las algas microscópicas marinas. Para la Clorofila a, sin embargo, se han reportado valores de esta relación en el rango de 0.04 a 0.004 (Parsons, 1975), y aunque Holm-Hansen (1970), estudiando cultivos de 30 diferentes especies de algas unicelulares tanto marinas como de agua dulce, encontró una relación ATP: C bastante uniforme (0.0035 durante la fase de crecimiento exponencial), otras investigaciones han reportado variaciones de más de un orden de magnitud dependiendo del estado fisiológico del fitoplancton (Cavari, 1976; Sakshaug y Holm-Hansen, 1977). En un intento por reducir el error en que se incurre debido a estas variaciones, algunos investigadores han realizado experimentos (casi siempre con cultivos) para dilucidar la forma como cambian las razones Clorofila a: C y ATP: C con diferentes condiciones de crecimiento (ver por ejemplo, Hunter y Laws, 1981). Un hecho que es aparente en estos estudios y en muchos otros donde se miden simultáneamente Clorofilaa y ATP (Stricklandet al. 1969; Holm-Hansen, 1969; Eppley et al. 1971; Eppley y Renger, 1974; Paerl et al.1975; Perry, 1976 y Eppley et al.1977), pero que en casi ninguno de ellos es discutido, es que la relación Clorofilaa: ATP presenta un patrón de comportamiento bien definido en relación a la tasa de crecimiento del fitoplancton y al factor limitante que controla dicha tasa. Usando los resultados que se presentan en los trabajos citados, puede calcularse que en condiciones de saturación de luz y nutrientes la razón Clorofilaa: ATP se encuentra generalmente dentro del rango de 3 a 6. Cuando existe deficiencia de nitrógeno, esta razón disminuye (valores entre 0.5 y 3), mientras que en condiciones de deficiencia de fósforo o de luz la relación aumenta (valores superiores a 6). Otro aspecto digno de mención es que mientras que las relaciones Clorofila a:C y ATP: C muestran variaciones considerables a lo largo de un ciclo diurno, la razón Clorofila a: ATP prácticamente no varía (datos de Hunter y Laws, 1981). En el presente trabajo se investiga el comportamiento de esta relación en las aguas de lagunas costeras tropicales; examinando también, por medio de regresiones lineales de datos en rangos muy amplios de niveles de biomasa fitoplanctónica, la posibilidad de usar indistinta o complementariamente a la Clorofila a y al ATP como base para estimar dicha biomasa. ÁREA DE ESTUDIOEl presente estudio se realizó en las aguas de tres lagunas costeras cercanas al puerto de Mazatlán, Sin. Éstas son el estero de Urías, la laguna del Sábalo y el estero El Verde Camacho. Las dos primeras se localizan en los extremos sur y norte respectivamente del puerto mencionado, mientras que el estero El Verde está situado aproximadamente 30 Km al norte, sobre el Trópico de Cáncer (Fig. 1) . El estero de Urías tiene comunicación libre y permanente con el mar, por lo, que su hidroquímica está influenciada hasta cierto punto por el régimen de marcas. Cuenta con aportes muy reducidos de agua dulce, pero recibe una cantidad relativamente alta de desechos domésticos. El estero principal tiene una longitud aproximada de 17 km y una anchura media de 650 m. Existen además varios kilómetros de esteros secundarios de anchura inferior a 50 m. La parte más cercana a la boca (primeros 3 Km) es utilizada como puerto de altura; la parte media (entre 3 y 7 Km de la boca) es la que recibe las principales descargas domésticas e industriales, además del efluente de dos plantas termoeléctricas. Aquí se encuentra también la flota camaronera del puerto. Los restantes 10 Km, y los esteros secundarios, están bordeados por manglar. La laguna del Sábalo de forma irregular, tiene un área de aproximadamente 3.5 Km². Está bordeada en su mayor parte manglar y su profundidad media es inferior a 1 metro, por lo que al final de la época de secas (marzo-junio) grandes extensiones del fondo de la laguna quedan expuestas al aire. Su comunicación con el mar es intermitente, y la construcción de un boulevard ha restringido aún más el intercambio de agua entre el océano y el cuerpo principal de la laguna, que también recibe descargas no cuantificadas de aguas negras. 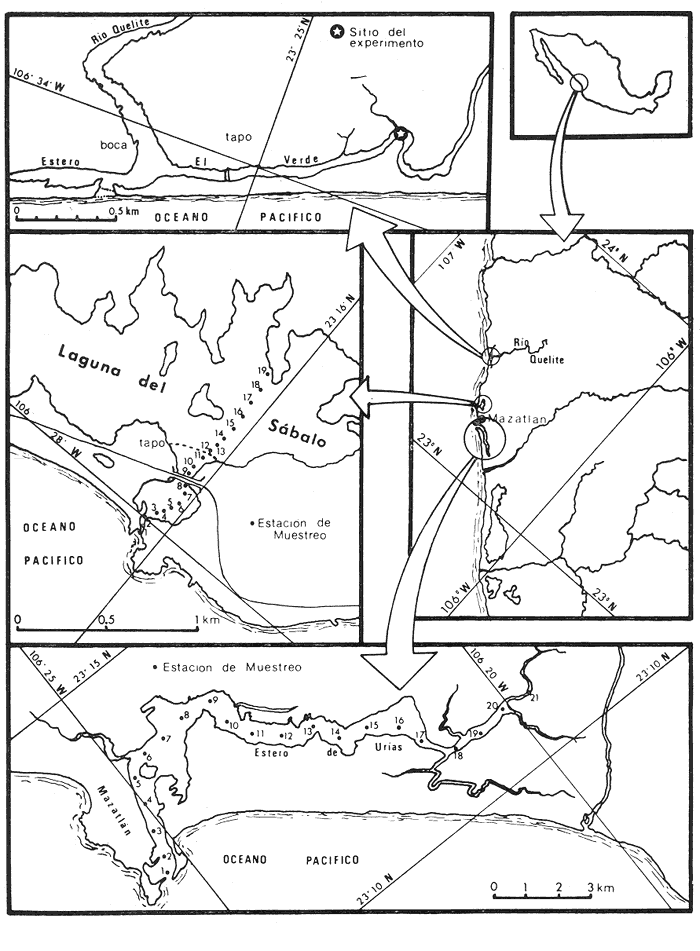 Fig. 1. Áreas de estudio. La hidroquímica y características generales del estero El Verde han sido descritas por Galindo (1981). Se trata de un cuerpo de agua salobre de aproximadamente 7 Km de largo por 70 m de ancho, con poca influencia humana. Durante la época de lluvias recibe las aguas del Río Quelite, el cual abre también la barra arenosa que separa al estero y el océano durante el resto del año. Su profundidad promedio es de 1.7 m. MATERIAL Y MÉTODOSEn todos los casos se tomaron muestras únicamente de agua superficial. En el estero de Urías se muestreó a todo lo largo del estero a intervalos de 1 Km. En la laguna del Sábalo, debido a la poca accesibilidad de gran parte de su extensión, sólo se muestreó a lo largo de un transecto aproximadamente perpendicular a la costa de 1.5 Km de longitud, comenzando en la boca de la laguna y llegando hasta la orilla opuesta. En el estero El Verde se instalaron tres bolsas de plástico de fondo cuadrado hechas con vinilo transparente flexible del tipo "Cristalex" de 0.8 mm de grueso sellado por medio de calor. Las bolsas tienen una altura de 1.7 metros y un área seccional de 1 m². Un flotador hecho con tubería de PVC de 10 cm de diámetro sostiene el borde superior de cada bolsa evitando el intercambio de agua con el resto de la laguna. Las bolsas se llenaron con agua superficial del estero, sin filtrado alguno. A dos de las bolsas se les agregó una disolución de KNO3, en cantidad suficiente para dar una concentración final de 10 a 20 mg at N-NO-3/m3 respectivamente. Se muestreó cada bolsa por duplicado dos veces diarias, al atardecer y al amanecer, del 10 al 14 de septiembre de 1981. En el estero de Urías se realizó un muestreo en la época de secas (mayo 6, 1982) y otro en la de lluvias (septiembre 7, 1982), ambos con la marea alta. De manera similar, en la laguna del Sábalo se realizaron muestreos el 13 de abril (con la laguna aislada del mar) y el 5 de octubre (con comunicación entre el mar y la laguna). Las muestras para análisis de Clorofila a y ATP se filtraron entre 1 y 4 horas después de ser tomadas, prosiguiendo inmediatamente con el resto del análisis. Las muestras para nutrientes se filtraron a través de filtros Whatman GF/C de fibra de vidrio en el momento de ser tomadas, se les agregó una gota de cloroformo como conservador, y se congelaron, efectuando el análisis a más tardar dos días después del muestreo. Para todos los análisis se siguieron los métodos recomendados en Strickland y Parsons (1972) con las siguientes modificaciones: Se prescindió de la suspensión de carbonato de magnesio en el filtrado de las muestras para clorofila (Holm-Hansen y Riemann, 1978); para el análisis de ATP, el preparado de luciferina-luciferasa se hidrató con agua destilada en vez de, tris 0.02 M, y se dejó reposar 2 horas, repartiendo a continuación en cada vial solamente 0.1 ml de este preparado y usando 0.5 ml de extracto de muestra. Pruebas previas demostraron que esta combinación da resultados satisfactorios y se obtiene un ahorro importante de preparado de enzima. Se utilizó un fotómetro integrador SAI Modelo 3000 (SAI Technology Co., San Diego, Calif. E.U.A|12 3) en la modalidad de integración. Para el análisis de amonio, se usó una cantidad diez veces menor a la recomendada de todos los reactivos, con lo que se logró obtener un blanco bajo y reproducible. El análisis de clorofilas incluyó la medición de feopigmentos, que en ningún caso constituyeron una fracción importante de los pigmentos totales. RESULTADOS Y DISCUSIÓNLos resultados del experimento de enriquecimiento con nitratos efectuado en las bolsas de plástico instaladas en el estero El Verde están resumidos en las figuras 2 a 4. Las variaciones en la concentración de amonio, nitritos y fosfatos no se han incluido por ser poco importantes: La concentración de amonio fluctúa entre 0.3 mg at/m³ y cantidades no detectables, y la de nitritos entre 0.08 y 0.27 mg at/m³ . La concentración de ortofosfato disuelto en la bolsa no enriquecida es de 15.2 ± 0.3 mg at P/m³. En las bolsas enriquecidas disminuye apreciablemente durante el experimento, pero nunca es menor de 11.3 mg at P/m³. El exceso de fósforo inorgánico presente asegura que la producción primaria no está siendo limitada por este nutriente, y es igualmente improbable que la luz sea un factor limitante importante en este sistema. La limitación por nitrógeno se hace evidente al observar el incremento inmediato de la biomasa fitoplanctónica en las bolsas enriquecidas con nitratos (Figs. 3 y 4). Inicialmente, la relación Clorofilaa: ATP en las tres bolsas (5.37 ± 0.96) es similar a la encontrada en cultivos de algas marinas que crecen en condiciones de saturación de luz y nutrientes (ver, por ejemplo Strickland, 1969 y Hunter y Laws, 1981). Sin embargo, 24 horas después de iniciado el experimento, cuando en las bolsas enriquecidas se ha alcanzado el máximo de Clorofila a, la relación había aumentado a 8.77 ± 1.21 en las tres bolsas, valor que es característico de cultivos cuyo crecimiento está limitado por la disponibilidad de fósforo. 84 horas después de iniciado el experimento, cuando se realizó el último muestreo, los niveles de Clorofila a y ATP habían decaído notablemente en las tres bolsas (presumiblemente por deficiencia de nitrógeno), pero la relación Clorofilaa: ATP se había elevado a 10.27 en la bolsa que no recibió enriquecimiento; a 14.39 en la bolsa enriquecida con 10 mg at N-NO -3/m³ y a 33.29 en la enriquecida con 20 mg at N-NO -3/m³, valor este último que se ha observado solamente en cultivos con extrema deficiencia de fósforo. 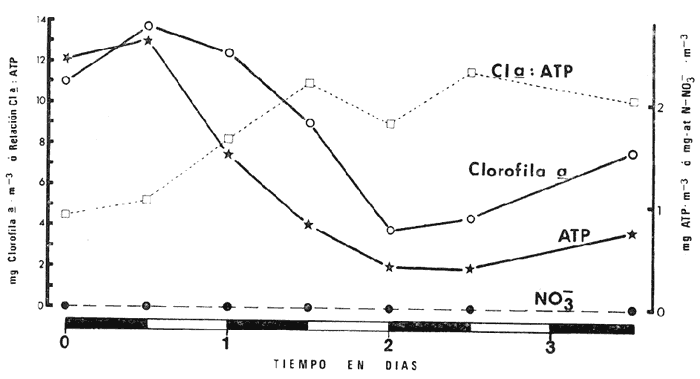 Fig. 2. Experimento de enriquecimiento con nitratos en el estero El Verde: bolsa no enriquecida. 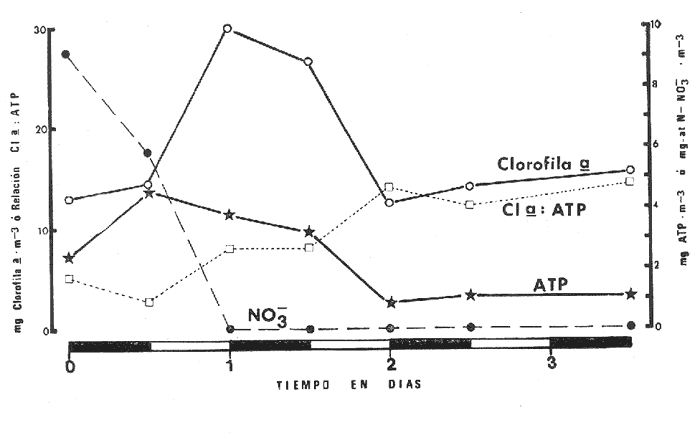 Fig. 3. Experimento de enriquecimiento con nitratos en el estero El Verde: bolsa enriquecida con aproximadamente 10 mg at. N-NO3 -/m³. 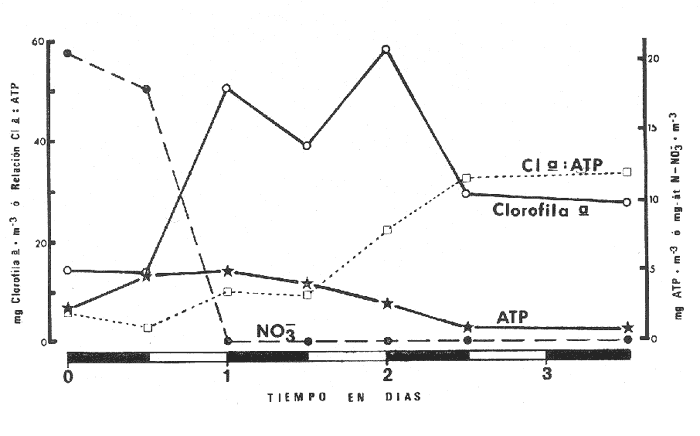 Fig. 4. Experimento de enriquecimiento con nitratos en el estero El Verde: bolsa enriquecida con aproximadamente 20 mg at N-NO3 -/m³ Estos resultados contrastan marcadamente con los de pruebas similares realizadas en cultivos deSkeletonema costatum y Monochrysis lutheri que fueron enriquecidos con 30 mg at N-NO3-/ m³ en presencia de exceso de ortofosfato (Sakshaug y Holm-Hansen, 1977). Desde el inicio de dichas pruebas hasta alcanzarse el máximo de Clorofila a (de 18 a 36 horas después), la razón Clorofila a: ATP se mantuvo constante o presentó un ligero decremento. A continuación, y de una manera similar a lo observado en el presente trabajo, los niveles de Clorofila a y ATP bajaron al agotarse el nitrógeno disponible, pero la razón Clorofila a: ATP disminuyó rápidamente hasta el 23% (S. costatum) y el 40% (M. lutheri) del valor inicial. Es posible que el comportamiento diametralmente opuesto de la relación Clorofilaa: ATP observado en las aguas del estero El Verde se deba, al menos en parte, al hecho de que los cultivos estuvieron sometidos a iluminación continua. Otras explicaciones posibles pero poco probables de dicho comportamiento serían la falta en el medio de algún factor nutritivo importante para la síntesis de ATP, o un cambio radical en la composición específica de la población fitoplanctónica (lo cual no puede suceder en los cultivos), dominando especies cuya razón Clorofila a: ATP intracelular sea extraordinariamente alta. Otro aspecto notable es que en ningún caso se observa un aumento neto en la concentración de ATP durante el día. De hecho, todo el incremento detectado en las bolsas enriquecidas con nitratos ocurre dentro de las primeras 12 horas después de iniciado el experimento, o sea durante la noche, lo que pone seriamente en duda el postulado de que dicho aumento representa un incremento de la biomasa fitoplanctónica. 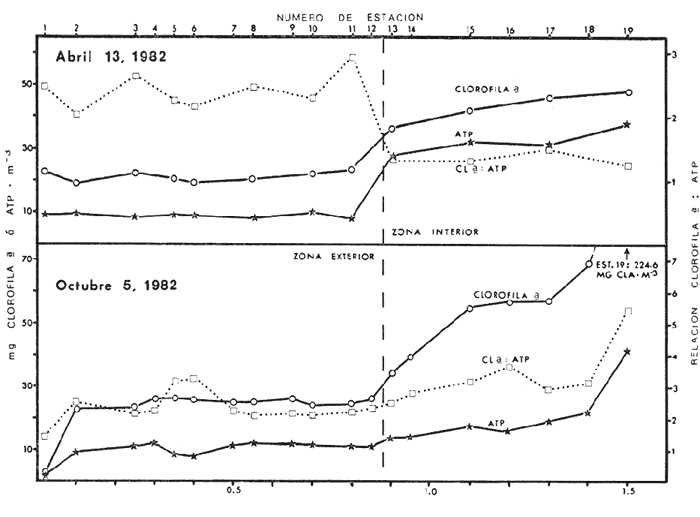 Fig. 5. Distribución de la concentración de Clorofila a y ATP en la laguna del Sábalo a lo largo del transecto muestreado. De cualquier manera, es evidente que, en este aspecto al menos, un ecosistema lagunar costero se comporta de manera muy diferente a los cultivos monoespecíficos de algas marinas, y que una limitación de la producción primaria por disponibilidad de nitrógeno no necesariamente provoca un descenso en la relación Clorofila a: ATP, sino que hasta puede tener el efecto contrario. Esto es aparente también al examinar los resultados de las mediciones realizadas en la laguna del Sábalo (Fig. 5). Esta laguna puede dividirse en dos zonas: una exterior, caracterizada por sedimentos arenosos, niveles de amonio entre 0.2 y 5 mg at N/m³ y con contacto intermitente con el mar; y una interior, caracterizada por sedimentos fangosos y niveles de amonio entre 3 y 5 mg át N/m³. La relación nitrógeno: fósforo en la fase inorgánica disuelta es siempre inferior a 5, por lo que puede descartarse una limitación de la producción primaria por el fósforo en ambas zonas. En la zona interior las concentraciones tanto de Clorofila a como de ATP son notablemente más altas que en la zona exterior, por lo que es posible que en esta última exista limitación por nitrógeno. Sin embargo, en las mediciones hechas en abril la relación Clorofila a: ATP es considerablemente más alta aquí (2.4 ± 0.3) que en la zona interior (1.3 ± 0.1). En las mediciones hechas en septiembre no ocurre lo mismo, ya que la relación mencionada es ligeramente más baja en la zona exterior (2.3 ± 0.5) que en la interior (3.4 ± 1.0). La relación Clorofila a:ATP muestra también un comportamiento un tanto inconsistente en las mediciones realizadas en el estero de Urías (Fig. 6). Es posible dividir este estero en tres zonas principales: una exterior, que recibe diariamente agua del Océano Pacífico; una media donde se concentran la mayoría de las descargas domésticas e industriales, y donde se observan los niveles más altos de amonio (2 a 12 mg at N /m³); y una interior con reducida influencia humana. De la figura es aparente que en la zona media la biomasa es mayor que en las otras dos, fenómeno que es más notable en el muestreo de mayo y que probablemente se debe al amonio procedente de las descargas del puerto (en todo el estero puede observarse un exceso de fósforo con respecto a nitrógeno en sus formas inorgánicas disueltas). Sin embargo, como puede verse en la Tabla 1, la relación Clorofila a: ATP no refleja claramente una hipotética mayor limitación por nitrógeno en las zonas exterior e interior del estero, ya que solamente en mayo, en la zona interior, puede observarse una relación Clorofila a: ATP notablemente menor que en la zona media. 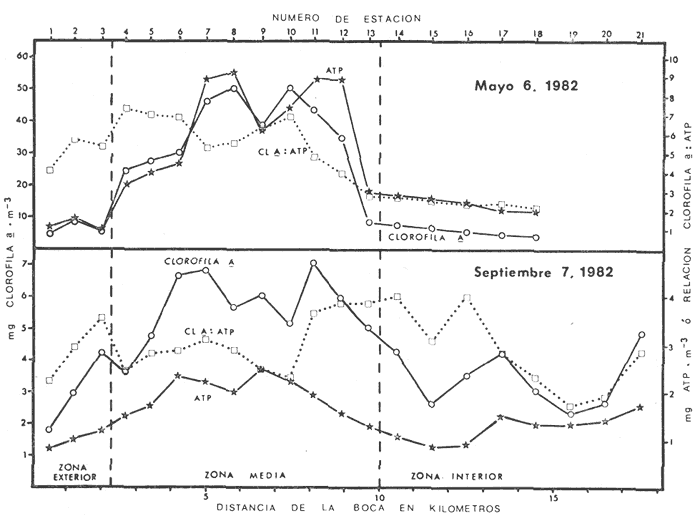 Fig. 6. Distribución de la concentración de Clorofila a y ATP a lo largo del estero de Urías. La posibilidad de usar indistintamente o en forma complementaria a la Clorofila a y al ATP como indicadores de la biomasa fitoplanctónica en lagunas costeras tropicales se ha investigado por medio de un análisis de regresión lineal de los datos de Clorofila a vs. ATP (Figs. 7 y 8, Tabla 2). En el caso ideal, se generarían siempre rectas con la misma pendiente, ordenada al origen igual a cero y coeficiente de correlación cercano a la unidad. La presencia de una cantidad apreciable de microheterótrofos suspendidos en el agua daría lugar a una ordenada al origen mayor que cero, correspondiente al ATP de origen no fitoplanctónico. En el caso del muestreo de abril en la laguna del Sábalo, la recta generada (línea A) es aparentemente un artefacto de la distribución de los datos. El bajo nivel de las aguas de la laguna en esta fecha ocasionó que las zonas exterior e interior, quedaran prácticamente incomunicadas, por lo que será más correcto considerarlas como lagunas diferentes. De hecho, un análisis microscópico de la población fitoplanctónica revela que en la zona exterior está dominada por diatomeas y dinoflageladas, mientras que en la zona interior dominan las cianofitas. 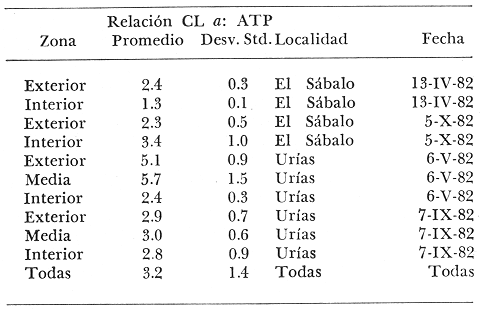 TABLA 1 RELACIÓN CLOROFILA a: ATP PROMEDIO EN LAS DIFERENTES ZONAS DE MUESTREO 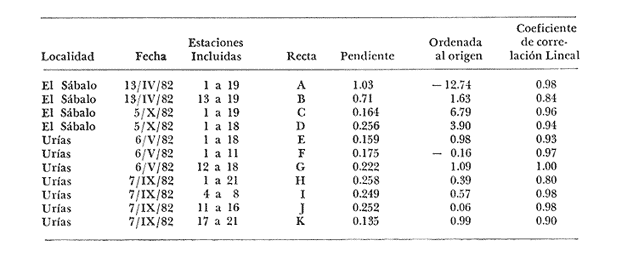 TABLA 2 CORRELACIÓN LINEAL DE LOS DATOS DE CONCENTRACIÓN DE CLOROFILA a VS. ATP. LAS RECTAS CORRESPONDIENTES ESTÁN REPRESENTADAS EN LAS FIGURAS 6 Y 7 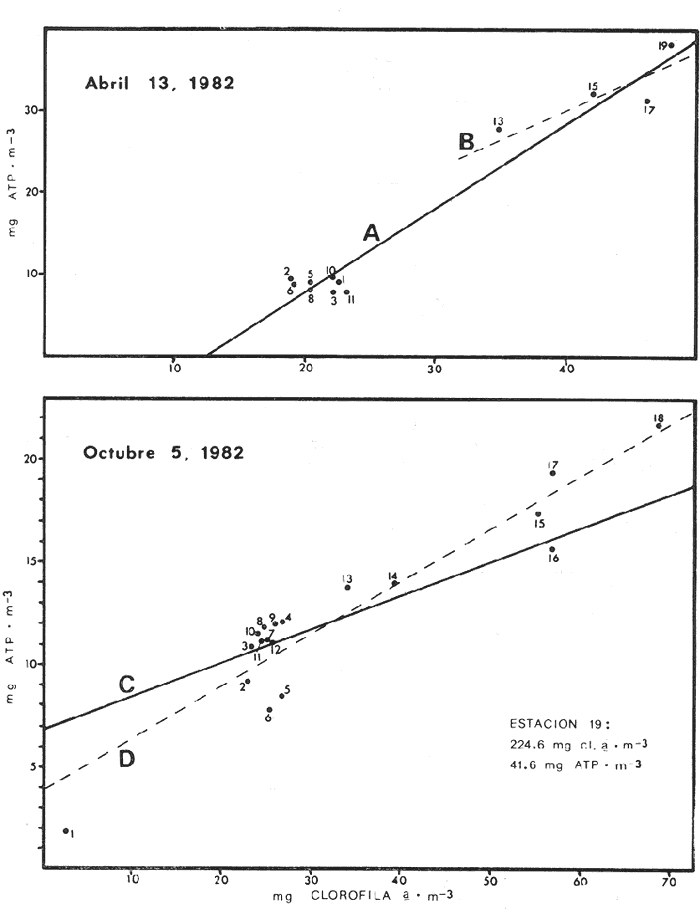 Fig. 7. Regresión lineal de los datos de Clorofila a vs. ATP en la laguna del Sábalo. Las características de las rectas están dadas en la Tabla 2. 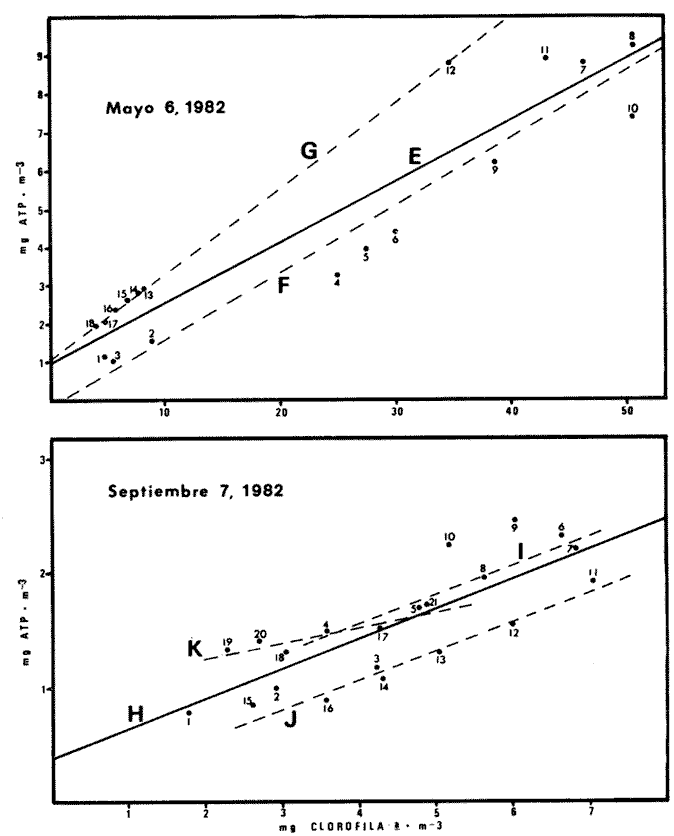 Fig. 8. Regresión lineal de los datos de Clorofila a vs. ATP en el estero de Urías. Las características de las rectas están dadas en la Tabla 2. La recta B corresponde a la zona interior, pero el bajo número de muestras hace que no sea significativa estadísticamente. En cuanto al muestreo de octubre, es aparente que la Estación 19 tiene una influencia desproporcionada sobre la regresión, por lo que se ha dibujado también la recta D con los datos de las estaciones 1 a 18. La composición de la población fitoplanctónica en esta fecha es mucho más homogénea, observándose aún mayor cantidad de cianofitas en la zona interior de la laguna. Para el estero de Urías (Fig. 8, líneas E y H) se han incluido también correlaciones de distintos grupos de muestras. Esta división en grupos refleja a grandes rasgos las variaciones en la composición de la población fitoplanctónica (Cortés y Pastén, 1928). En mayo, Skeletonema costatum y Prorocentrum veloi dominan en las Estaciones 1 a 3, mientras que de la 4 a la 11 se observa una preponderancia de fitoflageladas (línea F) . De la Estación 12 en adelante hay un dominio marcado de especies pertenecientes a los géneros Nitzschia y Chaetoceros(línea G). En septiembre la diatomeaNitzschia closterium domina ampliamente desde la Estación 1 a la 16 (líneas I y J), pero de la Estación 17 en adelante comienzan a dominar las fitofiageladas (línea K). Por otro lado, un examen de las ordenadas al origen de las rectas D, F, G, I, J y K nos proporciona información interesante sobre el nivel de microheterótrofos presentes en una población dada. Conclusiones1. Al parecer, no es factible la aplicación directa al ambiente costero lagunar de las conclusiones respecto al comportamiento de la relación Clorofilaa: ATP derivadas de estudios en cultivos monoespecíficos de algas marinas. Sin embargo, es aparente que dicha relación está ligada directamente con el estado nutricional del fitoplancton, por lo que sigue vigente la posibilidad de utilizarla en estudios de crecimiento y limitación en lagunas costeras. 2. Las correlaciones de los datos de concentración de clorofilaa vs. ATP en las lagunas estudiadas son bastante aceptables. Sin embargo, es aparente que no se puede utilizar al ATP en sustitución de la clorofila a como indicador de biomasa fitoplanctónica cuando no se trata de una misma población o cuando existen niveles apreciables de microheterótrofos. Por otro lado, la medición simultánea de ambos parámetros ofrece información importante sobre la distribución de las poblaciones, los niveles de microheterótrofos y posiblemente sobre el estado nutricional del fitoplancton, lo que la hace altamente recomendable. AgradecimientosEl autor agradece a Laurence Mee la revisión y corrección del manuscrito. LITERATURABANSE, K., Mar. Biol., Determining the carbon-to-chlorophyll ratio of natural phytoplankton1977.199-212.41: CAVARI, B., Limnol. Oceanogr., ATP in Lake Kinneret: Indicator of microbial biomass or of phosphorus deficiency?1976.231-236.(2):21 CORTÉS, R. y N. PASTÉN, Rev. Lat. Microbiol.Composición, abundancia y distribución del fitoplancton del estero de Urías,Sin., México.1982.24(2).I. Periodo Primaveral (1980) EPPLEY, R. W., A. F. CARLUCCI, 0. HOLM-HANSEN, D. KIEFER, J. J. MCCARTHY, E. VENRICK Y P. M. WILLIAMS, Limnol. Oceanogr.,Phytoplankton growth and composition in shipboard cultures supplied with nitrate, aminonium or urea as the nitrogen source.1971.741-751.165 EPPLEY, R. W., W. G. HARRISON, S. W. CHISHOLM y E. STEWART,Particulate organic matter in surface waters off Southern California and its relationship to phytoplankton.J. Mar. Res.1977.671-695.354 EPPLEY, R. W. y E. H. RENGER, J. Phycol.Nitrogen assimilation of an oceanic diatom in nitrogen limited continuous culture.1974.15-23.101 GALINDO, J. G., Tesis de Maestría en Ciencias, Univ. Nal. Autón. México. Estudio preliminar sobre la productividad primaria y la dinámica de los nutrientes en el estero El Verde, Mazatlán, Sin., México.1981. HOLM-HANSEN, O., Limnol. Oceanogr., Determination of microbial biomass in ocean profiles.1969.740-747.145 ---,Plant & Cell Physiol., ATP levels in algae cells as influenced by environmental conditions.1970.689-700.11: HOLM-HANSEN, O. y C. R. BOOTH,Limnol. Oceanogr., The measurement of adenosine triphosphate in the ocean and its ecological significance.1966510-519.114 HOLM-HANSEN, O. y B. RIEMANN, OikosChlorophyll a determination: improvements in methodology.1978.438-447.303 HUNTER, B. L. y E. A. LAWS, Limnol. Oceanogr.,ATP and chIorophylla as estimators of phytoplankton carbon biomass.1981.944-956.265 MEE, L. D., Chemical Oceanography, 7,Coastal lagoons. In: Riley, J. P. y R. Chester (Eds.) Academic Press.2nd. ed.Londres:1978.441-486. PAERL, H. W., R. C. RICHARDS, R. L. LEONARD Y C. R. GOLDMAN, Limnol. Oceanogr., Seasonal nitrate cycling as evidence for complete vertical mixing in Lake Tahoe, California Nevada.1975.1-8.201 PARSONS, T. R., Chemical Oceanography 7. Particulate Organic Carbon in the Sea. In: Riley, J. P. y G. Skirrow (Eds.) Academic Press,Londres:1975.365-385. PERRY, M. J., Limnol. Oceanogr.Phosphate utilization by an oceanic diatom in phosphorus-limited chemostat culture and in the oligotrophic waters of the central North Pacific.1976.88-109.211 SAKSHAUG, E. y O. HOLM-HANSEN, J. exp. Mar. Biol. Ecol.,Chemical composition of Skaletonema costatum (Grev.) Cleve and Pavlova (Monochrysis) lutheri (Droop) Green as a function of nitrate, phosphate- and iron-limited growth.1977.1-34.29 STRICKLAND, J. D. H., O. HOLM-HANSEN, R. W. EPPLEY y R. J. LINN, Limnol. Oceanogr.,The use of a deep tank in plankton ecology. I. Studies of the growth and composition of phytoplankton crops at low nutrient levels.1969.23-34.141 STRICKLAND, J. D. H. y T. PARSONS, A practical Handbook of Seawater Analysis, Fisheries Research Board of Canada.2nd ed.Ottawa1972.310 p.
|

