|
COMPOSICIÓN Y ABUNDANCIA DE LOS
COPÉPODOS PLANCTÓNICOS DE LA BAHÍA DE MAZATLÁN,
SIN, MÉXICO (1979-1980)
Trabajo presentado en el VI Congreso
Nacional de Zoología Mazatlán, Sinaloa, México. Recibido
el 12 de enero de 1983 y aceptado para su publicación el 18 de agosto de
1983.
JOSÉ N. ÁLVAREZ-CADENA
Universidad Nacional
Autónoma de México, Instituto de Ciencias del Mar y
Limnología. Estación Mazatlán. Apartado Postal 811,
Mazatlán, Sinaloa. Contribución 357 del Instituto de Ciencias del
Mar y Limnología,
UNAM.
El
presente estudio contiene la información referente a la fauna de
copépodos encontrados durante los muestreos de plancton que se
realizaron en el periodo considerado desde septiembre de 1979 a agosto de 1980.
Se registraron 20 familias, 32 géneros y 55 especies. La máxima
densidad de organismos se presentó durante el verano, y la más
alta diversidad en el invierno. En el otoño, la abundancia fue
mínima así como también el número de
especies.Acartia lilljeborgiiGiesbrecht, fue el
copépodo más representativo del área, se encontró
en la totalidad de las muestras y fue el más abundante. Acartia
tonsaDana, se observó como la segunda especie más
numerosa, la cual aunada con la primera y las formas juveniles, representaron
más del 75% del total de los
copépodos.
Palabras clave: Copépodos,
Composición y abundancia, Mazatlán, Sinaloa,
México.
This
paper contains the information about the fauna of copepods from the zooplankton
samples taked every month since september 1979 to august 1980. 20 families, 32
genera and 55 species were found. The maximum density of copepods was during
the summer and the highest number of species in the winter. The lowest number
of species and density was recorded in the fall.Acartia
lilljerborgiiGiesbrecht, was the most conspicuos copepod of the area,
it was the most abundant and appeared in all the samples.Acaria
tonsaDana, was the second one in abundance, which together
withA. lilljeborgii and the juveniles, represented more than
75% of the copepods. Key words: Copepods, composition and abundance,
Mazatlán, Sinaloa,
México.
Como parte de los estudios realizados por el personal de la Estación Mazatlán del ICML de la UNAM, en el proyecto "Estudio integral de la Bahía de Mazatlán", se realizaron muestreos de plancton, para efecto de aportar información sobre esta importante comunidad. Así por ejemplo Cortés y Rojas (1981), llevaron a cabo el estudio de la variación de las comunidades fitoplanctónicas, mientras que Maldonado et al(1980), independientemente de este proyecto efectuaron estudios de zooplancton, comparando los resultados del puerto, estero de Urías y la Bahía misma. Los copépodos dada su gran importancia como grupo zoológico y debido a que usualmente son muy abundantes dentro del plancton, han sido objeto de numerosos estudios, habiéndose elaborado intensivas y extensivas monografías, destacándose entre ellas las elaboradas por Giesbrecht (1892), Rose (1933), Owre y Foyo (1967) y Wilson (1932 y 1950), sin embargo los estudios respecto de este grupo han sido más bien escasos en el Golfo de California, excepto por algunos trabajos realizados por Zamora-Sánchez (1974), Turcott (1976), Fleminger (1964a y 1975), Fleminger y Hulseman (1974), Manrique (1977) y más recientemente una revisión de la literatura acerca del plancton del Golfo de California por Brinton et al(en prensa). ÁREA DE ESTUDIOLa Bahía de Mazatlán, se encuentra localizada en el sur del estado de Sinaloa (Fig. 1) , entre los 23º15' y 23º11' de latitud norte y los 106º29' y 106º25' de longitud oeste, y con una longitud de costa de 13.5 Km aproximadamente. La temperatura media anual del aire fue de 23.9ºC durante 1979 con una máxima de 34.8ºC y una mínima de 8.6º; mientras que durante 1980, la temperatura media anual fue de 24.6ºC con una máxima de 34.3ºC y una mínima de 10.5ºC, SARH (1979 y 1980). El clima de la región de acuerdo al sistema de Köppen, modificado por García (1964), es cálido subhúmedo con lluvias en verano del tipo AWo (w) (e). No se observan claramente las estaciones del año, sino más bien dos épocas bien marcadas, la temporada de lluvias que abarca de julio a octubre y otra de precipitación pluvial mínima, que comprende de noviembre a junio. MATERIAL Y MÉTODOSSe establecieron dos estaciones de muestreo (Fig. 1), en donde se efectuaron arrastres de superficie mediante dos redes cónicas de 0.65 m de diámetro por 2.75 m de longitud, una de ellas con 0.5 mm de malla y cuyo contenido fue utilizado para la identificación de los organismos y la otra de 0.24 mm de malla y cuyo material colectado se utilizó para la determinación de biomasa. Ambas redes estuvieron equipadas con medidores de flujo General Oceanic, para las estimaciones de volumen filtrado. Las muestras fueron fijadas con una solución de Formaldehído al 4%, de acuerdo con las recomendaciones hechas por Griffiths et al (1976), agregando Carbonato de Litio como agente tampón. Simultáneas a las colectas se hicieron determinaciones de salinidad mediante un salinómetro de inducción, así como de temperatura con un termómetro de inmersión con graduación de 0. 1 de grado. El análisis de las muestras se desarrolló por alícuotas, excepto en las menores de 5 ml, en cuyo caso se hizo el análisis de la muestra total. Las submuestras estuvieron comprendidas entre los 10 y 5 cc, y fueron obtenidas mediante el uso de un separador de muestras tipo Folsom de dos vías. Para efecto de que la mayoría de las especies quedaran debidamente registradas, después de la observación de las submuestras se hizo una revisión de la muestra total para reportar a aquellas especies escasas o no cuantificadas en la alícuota. Las estimaciones de biomas se efectuaron por los métodos de sedimentación y desplazamiento (volumétricos), peso húmedo y peso seco (gravimétricos), pero dada la similitud en el comportamiento de las gráficas, en este trabajo se incluye únicamente las de peso seco (Fig. 4). Estas determinaciones se realizaron según indicaciones de Beers (1976), para material planctónico preservado en soluciones acuosas. En el texto se hace mención de términos como número, cantidad y abundancia, con ello se quiere significar en realidad densidad, es decir organismos. /M³ , asimismo es necesario aclarar que las caracterizaciones de las especies en cuanto a su zoogeografía o ecología, fueron tomados de Brinton et al. (en prensa) excepto cuando esto se indique de otra forma. 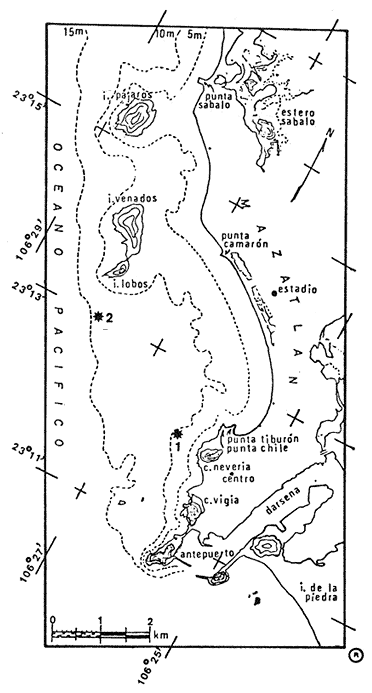 Fig. 1. Área de estudio, con la localización de los lugares de colecta. RESULTADOS
HIDROLOGÍALa temperatura del agua fluctuó entre aproximadamente 31.7º y 20.5º es decir una variación de 11.2ºC en la estación 1 para la estación 2 la máxima fue de 31.6ºC y la mínima de 20.0ºC y una variación de 11.6ºC. Las temperaturas máximas se registraron durante el verano y principios de otoño, encontrándose los valores máximos durante el mes de septiembre. Las temperaturas más bajas se detectaron en invierno, a excepción de dos marcados descensos durante abril y mayo, lo cual es probablemente debido a la ocurrencia en el área de muestreo de masas de agua oceánicas más frías. El patrón de comportamiento en cuanto a este factor fue similar en ambas estaciones, observándose además que las diferencias entre las mediciones de superficie y 5 metros fue no significativa (Fig. 2). La salinidad (Fig. 3), presentó una fluctuación de 2.20%o entre los valores máximo y mínimo para la estación 1 mientras que para la estación 2 este valor fue de 2.21%o La mayor variación para este parámetro se presentó a finales de verano y principios de otoño, lo cual coincide con la época de pronunciadas precipitaciones pluviales y máximas temperaturas. BIOMASA ZOOPLANCTÓNICALa variación en cuanto a las estimaciones de biomasa fue de 1.94 g, encontrándose que los valores mínimos correspondieron a la primavera-verano, otoño registró un aumento en estos valor es, mientras que el invierno fue la época de mayor biomasa (Fig. 4). 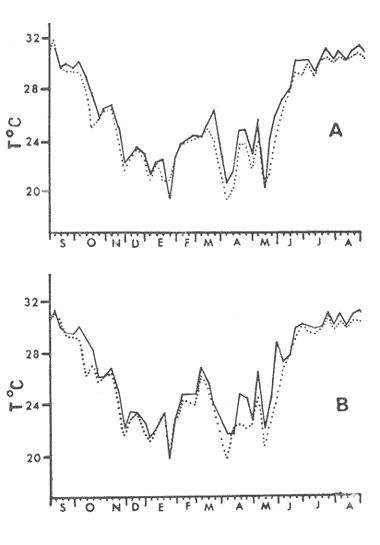 Figs. 2A y B. Temperatura registrada durante el periodo de estudio en las Estaciones 1 (A) y 2 (B), de superficie ( - ) y 5 metros (- - -). 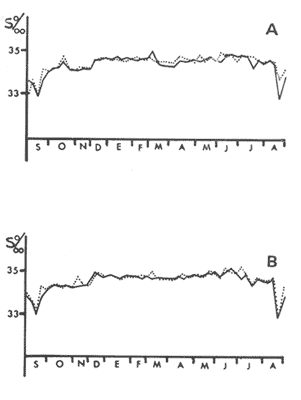 Figs. 3A y B. Salinidad registrada durante el ciclo anual, en las Estaciones 1 (A) y 2 (B), de superficie (-) y 5 metros (- - -). 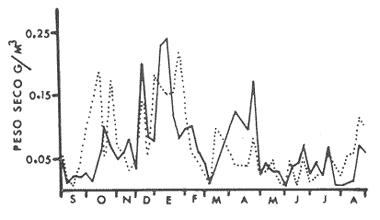 Fig. 4. Biomasa registrada en las Estaciones 1 (-) y 2(---) durante el ciclo anual. DENSIDAD DE COPÉPODOSEl análisis en el tiempo de las curvas de abundancia de los copépodos de la bahía de Mazatlán, muestra tres máximos, que corresponden a invierno, primavera y verano, en ambas estaciones (Fig. 5). En cuanto al otoño la densidad de las poblaciones fue menor en comparación con las otras tres estaciones del año, lo cual fue común en ambos puntos de muestreo. Marzo y noviembre fueron los meses de menor abundancia, pero en la estación 2 se registró además un marcado descenso en el mes de mayo. Los meses con la mayor densidad de organismos fueron abril y junio para ambas estaciones. La mayor abundancia durante el periodo de muestreo fue para la estación 2, en una proporción de aproximadamente 3:1 y fue también en donde se colectaron el mayor número de especies. Es importante señalar que la abundancia total anual de los copépodos es similar a aquella del géneroAcartia, pues los acartidos representaron más del 75% en ambos puntos de colecta. 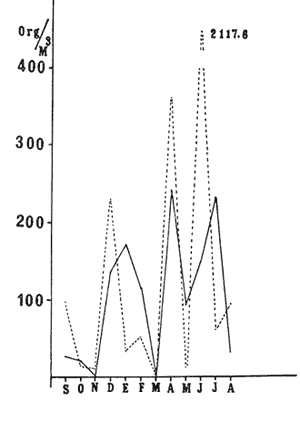 Fig. 5. Abundancia anual de los copépodos en las Estaciones 1 (-) y 2 ( --- ). COMPOSICIÓN DE LOS COPÉPODOSSe encontraron 20 familias, 32 géneros y 55 especies (Tablas 1 y 2). La época en que se presentó la mayor cantidad de especies fue la de invierno (Fig. 7 y Tablas 1 y 2), en donde se registraron 49 especies o sea el 89%, mientras que durante el verano el número de especies colectadas fue del 50%, pero la cantidad de organismos aumentó considerablemente. El otoño fue la época en que menor número de especies y menor abundancia de ejemplares presentó, por lo cual este periodo es considerado como una etapa de transición entre la abundancia numérica del verano y la abundante cantidad específica del invierno. LISTA TAXONÓMICA DE ESPECIESLa ordenación taxonómica del grupo, sigue el criterio de Waterman y Chace (1960), para los taxones superiores al de familia, por lo cual el ordenamiento sistemático quedaría integrado de la siguiente manera: Phyllum Arthropoda Clase Crustácea Orden Calanoida Orden Cyclopoida Orden Harpacticoida Orden Monstrilloida Orden Calanoida
Familia Acartiidae
GéneroAcartiaDana, 1845 Fue el género más abundante de los copépodos y estuvo representado por tres especies: Acartia lilljeborgii,Giesbrecht, 1889 A. tonsa Dana, 1848 y A. danaeGiesbrecht, 1889. Acartia lilljeborgiiGiesbrecht, 1889 Fue la especie más representativa del género, además de ser la más abundante no solamente en cuanto al género mismo, sino del total de los copépodos. Su mayor número fue durante el verano, pero en la primavera e invierno también se detectaron abundantemente (Tablas 1 y 2, Fig. 6A y B). Manrique (1978), reporta a esta especie como la más abundante durante el periodo de verano, mientras que Turcott (1976), la encontró como la más abundante en el otoño; por su parte Fleminger (1964 y 1967), sitúa a esta especie como dentro de aquellas que presentan afinidad por aguas tropicales no endémicas del Pacífico oriental; Escudero-Díaz (1975), la reporta como la más numerosa durante el mes de enero, pero fuertemente menos abundante durante los meses de mayo y agosto. Acartia tonsaDana, 1848 Fue la segunda especie más abundante de los copépodos en las colectas. Su mayor densidad se encontró a mediados de primavera, aun cuando fue registrada prácticamente a través de todo el año, excepto durante el otoño en la estación 1 y el mes de septiembre en la estación 2. Zamora-Sánchez (1974), Turcott (1976), Escudero-Díaz (1975) y Sánchez-Osuna (1980), han discutido ampliamente su calidad como una especie euriterma y eurihalina, señalándole además como una especie dominante en aguas estuarinas. Costera, templada-tropical. Acartia danaeGiesbrecht, 1889 Estuvo presente únicamente durante el invierno, en donde se registraron tan sólo dos especímenes, uno en cada estación, lo cual concuerda con su afinidad por aguas oceánicas y tropicales. 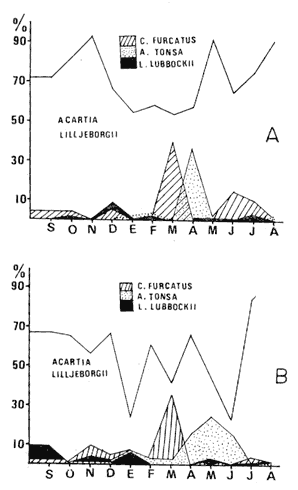 Figs. 6A y B. Porcentaje de cuatro de las especies más representativas en el área de estudio. Estación 1 (A) y 2 (B). 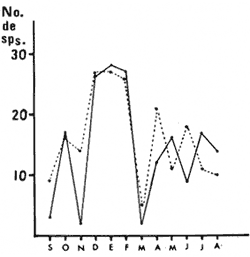 Fig. 7. Curva del número de especies encontradas durante el periodo de muestreo. Estación 1 (-) y Estación 2 (- - -).
Tabla 1 Tabla 2 Familia Eucalanidae
GéneroEucalanus Éste fue uno de los géneros más frecuentes en el área, y estuvo representado por cinco especies:Eucalanus pileatusGiesbrecht 1888, E. crassus Giesbrecht 1888, E.subcrassusgiesbrecht, 1888,E. subtenuis Giesbrecht, 1888 y E.attenuatus (Dana, 1852). Eucalanus pileatusGiesbrecht, 1888 Fue el más típico representante de la familia, y cuya mayor abundancia se encontró durante invierno. Aun cuando en general la especie fue más bien escasa en cuanto a número, se observó que las formas juveniles fueron más abundantes que los adultos. Sánchez-Osuna (1980), hace mención de un Eucalanus sp., siendo muy probable se trate de esta especie, dados sus hábitos costeros y tropicales. Eucalanus crassusGiesbrecht, 1888 Esta especie presentó su mayor abundancia durante el invierno, siendo en general más bien escasa. Fleminger (en Brinton et al en prensa), la reporta como neritica y de aguas tropicales. Eucalanus subtenuisGiesbrecht, 1888 Se presentó únicamente durante el mes de diciembre y solamente en la estación 2. Neritica, ecuatorial Eucalanus subtenuisGiesbrecht 1888 Se registró únicamente en la estación 1 durante los meses de diciembre y febrero. Oceánica, ecuatorial. Eucalanus attenuatus (Dana, 1852) La presencia de esta especie estuvo limitada a los periodos de invierno y primavera. Manrique (1978), reporta a este Eucalanido abundantemente durante el otoño, mientras que Turcott (1976), lo encontró más bien escaso. Oceánica, ecuatorial. GéneroRhincalanusDana, 1852
Rhincalanus nasutusGiesbrecht, 1888 Fue el único representante en cuanto a este género y en abundancia muy baja, su presencia fue registrada únicamente para la estación 2. Manrique (1978), la encontró como la especie dominante durante el mes de febrero. Neritica, ecuatorial. Familia Pontellidae
GéneroLabidoceraLubbock, 1853 Éste fue uno de los géneros mayormente representativos del área, así como también uno de los más numerosos. Labidocera lubbocki (Giesbrecht, 1892), L.johnsoni Fleminger, 1964 y L.acuta (Dana, 1849), fueron las especies que lo constituyeron. Labidocera lubbocki(Giesbrecht, 1892) Se presentó con sus máximos de abundancia durante el invierno y verano en la estación 1 e invierno y primavera en la estación 2. Fleminger (1975), establece dos poblaciones en cuanto a este Labidocero, una especie a, refiriéndose a la que vive más cerca de la costa y otra b, la cual es de aguas más oceánicas. Labidocera johnsoniFleminger, 1964 Este pontelido, fue encontrado más abundantemente durante la primavera. Fleminger (1964a) , reporta que usualmente es colectado junto con L. lubbocki en el área de Mazatlán y con L.trispinosa Esterly en las bahías al sur de punta Eugenia. Endémica, costera de aguas templadas. Labidocera acuta(Dana, 1849) Fue el más abundante de los labidoceros y de la familia en sí, debido a su alta proporción de captura durante el invierno y verano. Escudero-Díaz (1975), la reporta como abundante durante el mes de enero y en mínimas cantidades durante el mes de agosto. En cuanto a los especímenes colectados en este estudio se observó que los ejemplares juveniles fueron más abundantes que los adultos. Neritica ecuatorial. GéneroPontellopsisBradyi, 1883
Pontellopsis lubbocki(Giesbrecht, 1892) El registro de los ejemplares de esta especie estuvo limitado prácticamente al periodo invernal, aun cuando también fue encontrada en el mes de noviembre. Endémica del Golfo de California, nerítica, ecuatorial. GéneroPontellinaDana, 1853
Pontellina Plumata (Dana, 1849) Fue la única especie representante del género, la cual fue registrada únicamente en el mes de enero y sólo en la estación 2. Fleminger et al (1974) establecen que se trata de un copépodo ampliamente distribuido en latitudes subtropicales, así como su condición circumglobal y su abundancia en los lugares de frecuentes surgencias. Familia Calanidae
GéneroCalanusLeach, 1816
Calanus pacificusBrodskii, 1948 Fue la única especie encontrada dentro de este género y fue registrada tan sólo durante los meses de abril y mayo y solamente en la estación 2. Fleminger en Brinton et al(en prensa) , comenta su afinidad por las temperaturas de invierno y primavera, haciendo notar que durante el verano desciende a profundidades de 200 a 300 metros, las cuales son característicamente más pobres en oxígeno. Nerítica, templada. GéneroUndinulaScott, 1909
Undinula vulgaris (Dana, 1849) Fue la mejor representada dentro de este género, sus cantidades fueron máximas durante el periodo invernal. Nerítica, tropical. Undinula darwinii(Lubbock, 1860) Al igual que la especie anterior se encontró más abundante durante el invierno. En la estación 1 fue detectada únicamente durante los meses de diciembre y enero, mientras que en la estación 2 se encontró además en el mes de noviembre. Oceánica, tropical. GéneroNannocalanusSars, 1925
Nannocalnusminor (Claus, 1863) Única especie encontrada en cuanto a este género y cuya mayor abundancia se encontró durante el invierno. Oceánica, tropical. GéneroMesocalanusBradford y Jillet, 1972
Mesocalanus tenuicornis(Dana, 1849) Se registró en una sola ocasión, para cada una de las estaciones, durante los meses de octubre y noviembre en cantidades mínimas. Oceánica, templada. GéneroCanthocalanusA. Scott, 1909
Canthocalanus pauper(Giesbrecht, 1888) Es de los copépodos mejor representados, tanto en número como en frecuencia, y se observó que su máxima abundancia es para las épocas de invierno y verano. Costera, tropical. Familia Paracalanidae
GéneroParacalanusBoeck, 1864
Paracalanus parvus(Claus, 1863) Este Paracalanido se encontró solamente en dos ocasiones, una vez en cada estación, siendo notablemente abundante en la estación 2, lo cual le significó ocupar el tercer lugar en abundancia en ese punto de muestreo. Costera, templada, tropical. GéneroAcrocalanusGiesbrecht, 1888
Acrocalanus longicornis Giesbrecht, 1888 Este copépodo fue el único representante del género, siendo durante el invierno cuando se le encontró más abundantemente. Nerítica, tropical. GéneroCalocalanusGiesbrecht, 1888
Calocalanus Pavo (Dana, 1852) Al igual que en las especies anteriores, fue la única especie del género, siendo su abundancia más bien baja. Oceánica, tropical. Familia Euchaetidae
GéneroEuchaetaPhilippi, 1843 El géneroEuchaeta, estuvo confinado únicamente al periodo de invierno, su abundancia fue similarmente baja en ambas estaciones, al igual que su frecuencia de aparición. Euchaeta wolfendiniScott, 1909 Se presentó en dos ocasiones en la estación 1 y una sola vez en la estación 2, y como, se mencionó anteriormente, estuvo restringida al periodo de invierno. Costera, ecuatorial. Euchaeta rimanaBradford, 1974 Se registró únicamente en la estación 2 y en bajo número. Oceánica, tropical. Familia Centropagidae
GéneroCentropagesKroyer, 1848
Centropages furcatus(Dana, 1852) Se encontró como el Centropagido más abundante en relación a este género, siendo además uno de los copépodos más representativos del lugar, ya que ocupó el 3o. y 4o. lugar en las estaciones 1 y 2 respectivamente en cuanto a número. Nerítica, tropical. Centropages gracilis (Dana, 1849) A diferencia del Centropagido anterior, fue mucho más escaso, así como también disminuyó notablemente su frecuencia de aparición, ya que solamente se le capturó en dos ocasiones en la estación 2 y en tres en la estación 1. Oceánica, tropical. Familia Pseudodiaptomidae
GéneroPseudodiaptomusGiesbrecht y Schmeil, 1898
Pseudodiaptomus wrightiJohnson, 1964 La especie aquí reportada dentro de este género es la única que fue encontrada. Su mayor abundancia se encontró para la temporada invernal. Turcott (1976), reporta en su trabajo aPseudodiaptomus sp., siendo muy probable se trate de esta especie. Estuarina, costera, endémica. Familia Temoridae
GéneroTemoraBaird, 1850
Temora discaudata Giesbrecht, 1892 Los Temoridos estuvieron representados por esta única especie; su registro nos indica que su abundancia fue relativamente baja, lo cual concuerda con lo encontrado por Manrique (1970), ya que su reporte señala tina alta frecuencia de aparición, pero baja abundancia. Nerítica, tropical. Familia Pseudocalanidae
GéneroClausocanalusGiesbrecht, 1888
Clausocanalus farraniSewell, 1929 Dos especies se encontraron para este género, ambas se presentaron en una sola ocasión y únicamente en la estación 2. Oceánica, tropical. Clausocanalus furcatus(Bradyi, 1883) Al igual que el copépodo anterior, se le encontró una sola vez, por lo cual a ambas especies se les considera como no típicas del área. Oceánica, tropical. Familia Lucicutiidae
GéneroLucicutiaGiesbrecht, 1898
Lucicutia flavicornis(Claus, 1863) Los Lucicutidos estuvieron representados por un único ejemplar, así como por esta única especie, la cual fue encontrada en la estación 2, durante el mes de abril. Oceánica, tropical. Familia Candaciidae
GéneroCandaciaDana, 1846 El género Candacia,estuvo constituido por 4 especies, de las cuales únicamente C.catulapresentó una relativamente alta frecuencia, las tres restantes tuvieron baja frecuencia y abundancia. Candacia catula(Giesbrecht, 1889) A esta especie le correspondió el mayor registro tanto en abundancia como en frecuencia de captura, para el área de muestreo. Nerítica, ecuatorial. Candacia bippinata (Giesbrecht, 1889) Se encontró tan sólo en el mes de enero y únicamente en la estación 2. Nerítica, templada. Candacia truncata(Dana, 1849) Se registró durante el mes de diciembre en la estación 2 y en el mes de enero en la estación 1, es decir estuvo circunscrita al periodo invernal. Nerítica, ecuatorial. Candacia curta(Dana, 1849) Este Candacido se encontró en número mínimo, durante el mes de enero, en la estación 2. Nerítica, tropical. Orden Cyclopoida
Familia Corycaeidae
GéneroCorycaeusDana, 1845 Este género estuvo representado por seis especies,Corycaeus speciosus,C.ovalis,C.clausi,C.dubiusy C.anglicus. Su mayor abundancia se encontró para la temporada invernal, aun cuando no dejaron de presentarse durante la primavera y verano, siendo notablemente escasos durante el otoño. Corycaeus speciosus (Dana, 1852) Fue el Coriceido que más frecuentemente se encontró en las colectas, su máxima abundancia se registró para el invierno, y fue el segundo en importancia en cuanto a este renglón, solamente después de C.anglicus.Rose (1933), la reporta como habitante de aguas tropicales y templadas. Corycaeus ovalisClaus, 1863 Se presentó en dos únicas ocasiones en cada estación, con relativamente bajas abundancias. Tropical (Rose, 1933). Corycaeus obtusus,Dana 1849 Se le registró principalmente, en las colectas de invierno y primavera, siendo más numerosa en la estación 2, particularmente durante el mes de diciembre. Corycaeus clausi Dahl, 1894b Registrado en una ocasión en la estación 1 y dos en la estación 2, con bajos números en cuanto a abundancia. Tropical, templada (Rose, 1933) . Corycaeus dubiusFarran, 1911 Encontrado una sola vez en cada estación en cantidades mínimas. Corycaeus anglicus Lubbock, 1855 Este Coriceido al igual que el anterior se presentó una sola vez en cada estación, excepto que C.anglicus se encontró abundantemente en la estación 2, lo que le significó ser la especie más abundante de los Coriceidos. GéneroFarranula Wilson,1932a
Farranula carinata (Giesbrecht, 1891a) Esta fue la única especie encontrada dentro del género de los coriceidos. Su presencia estuvo limitada a la estación 2, en donde se registró en dos ocasiones, una en enero y otra en junio, siendo en esta última en donde se encontró más numerosa. Oceánica, tropical (Rose, 1933). Familia Sapphirinidae
GéneroSapphirinaThompson, 1829 El género de los Safirinidos estuvo prácticamente restringido a la época invernal, excepto por un reporte durante el otoño. La frecuencia así como la abundancia fueron bajas, pese a lo cual fueron los mejor representados en relación a los otros dos géneros, Copilia y Saphirella. Sapphirina gemmaDana, 1849 Se presentó una sola vez en la estación 1 y en dos ocasiones en la estación número 2, con bajos conteos en cuanto a su abundancia. Sapphirina opalina Dana, 1849 Se registró únicamente en la estación 1 en dos ocasiones y al igual que la especie anterior en muy bajos números. Tropical, templada (Rose, 1933). Sapphirina nigromaculata Claus, 1863 Fue la más abundante dentro de este género, así como también la que más frecuentemente se registró en el área. Tropical, templada (Rose, 1933). GéneroCopiliaDana, 1849
Copilia mirabilis Dana, 1849 Fue la especie encontrada en el área de estudio, siendo además la que mayor abundancia presentó dentro de la familia de los safirinidos. Su presencia fue principalmente detectada durante el invierno. GéneroSaphirellaT. Scott, 1849 En cuanto a estos copépodos aun cuando no fue posible concretar la identificación específica, se creyó conveniente reportar cuando menos el género para efecto de estudios posteriores. Se encontraron dos especímenes durante el mes de diciembre en la estación 1. Familia Oithonidae
GéneroOithonaBaird, 1843
Oithona plumiferaBaird, 1843 Fue la especie que más frecuentemente se capturó en el área respecto de los oitonidos, presentando su mayor abundancia durante el invierno, aun cuando no dejó de aparecer prácticamente durante todo el año. Oithona nanaGiesbrecht, 1892 Fue la especie más abundante del género, debido a una gran abundancia durante el mes de junio obtenida en la estación 2. Familia Oncaeidae
GéneroOncaeaPhilippi, 1843
Oncaea mediaGiesbrecht, 1891 Un único espécimen se colectó, siendo obtenido en el mes de mayo. Orden Harpacticoida
Familia Ectinosomidae
GéneroMicrosetellaBradyi y Robertson, 1853
Microsetella rosea Dana, 1852 Fue registrada únicamente en una ocasión en la estación 1 durante el mes de mayo, mientras que en la estación 2 se le capturó durante los meses de abril y octubre en cantidades mínimas. Familia Tachydiidae
GéneroEuterpinaNorman, 1903
Euterpina acutifrons Dana, 1852 Reportada en una ocasión en la estación 1 y en dos en la estación 2. Orden Monstrilloida
Familia Monstrillidae
GéneroCymbasomaJ. C. Thompson, 1888
Cymbasoma longispinosum Bourne, 1890 Este Monstriloide fue el único reportado para el área de estudio, el cual es ejemplar único, siendo colectado en la estación 1 durante el mes de febrero. DISCUSIÓNLos copépodos planctónicos de los esteros y aguas costeras, comparten el hecho de ocupar una área de transición entre el agua dulce y las aguas oceánicas, lo cual hace que debido a las rigurosas demandas de estos medioambientes existan pocas especies que se adapten a estas condiciones cambiantes, además de las presiones por factores abióticos, los copépodos que habitan estos lugares están sometidos a fuertes presiones bióticas, Fleminger (1975). Por lo tanto no es sorprendente que en este estudio se hayan encontrado tan sólo aproximadamente el 42% de las especies reportadas por Brinton et al (en prensa). Este fenómeno es aún más acentuado a medida que se adentra en los medios estuarinos. Margalef (1967), menciona que la diversidad en las lagunas costeras es muy baja y que en la mayoría de los casos son una o pocas las especies quienes presentan una fuerte dominancia sobre las demás. Escudero-Díaz (1970), por ejemplo encontró 20 especies del grupo copépoda, mientras que Turcott (1976), registró 15, lo cual es equivalente al 16%, y 11% respectivamente del número de especies reportadas para el Golfo de California por los autores mencionados anteriormente. En relación con el número de organismos, se encontró que la abundancia anual promedio fue de 180 copépodos por metro cúbico, cantidad mucho menor que cualquiera de los registros efectuados por Turcott (1976). La mayor abundancia se encontró durante el verano, época en que se encontraron las temperaturas máximas y las mayores precipitaciones pluviales, así como también se observó un marcado decremento en los valores de biomasa. Este fenómeno ha sido ampliamente discutido, diciéndose que la temperatura tiene un efecto general sobre los seres vivos, de tal forma que se tiende a incrementar la aptitud para reproducirse, pero representando una baja en los valores de biomasa. Siefken (1968) encontró que el peso y talla de un copépodo del géneroDiaptomusdisminuían durante el verano y lo contrario sucedía durante la primavera. El mismo autor dedujo que para efectos de aclimatación es necesario estabilizar los requerimientos energéticos a altas temperaturas, utilizando para ello carbohidratos, lípidos y demás materias de reserva. Por otro lado y en cuanto a la caracterización de la fauna copepodológica del lugar, la Bahía de Mazatlán está eminentemente constituida por especies neríticas costeras continentales que habitan en el Golfo de California, presentando además afinidad con las aguas ecuatoriales, que en base a lo reportado por Grice (1966), esta afinidad es de aproximadamente del 22%. ConclusionesCONCLUSIONES1.Acartia lilljeborgiiGiesbrecht es la especie dominante, se presentó durante todo el año y en todos los muestreos, siendo además la más abundante. Acartia tonsa Dana fue la segunda especie más abundante. Los Acartiidae constituyeron más del 75% del total de los copépodos. 2. En base a las especies registradas, la Bahía de Mazatlán se ve influenciada por aguas oceánicas principalmente en invierno-primavera y por aguas estuarinas esencialmente verano-otoño. 3. El mayor número de especies registradas fue durante el invierno, así también durante esta época se registró la mayor biomasa y una relativamente baja abundancia. 4. El verano fue la época de menor biomasa, con un aumento considerable en la abundancia, y una cantidad relativamente baja en el número de especies. 5. La época de otoño debido a su muy baja abundancia y relativamente bajo número de especies, es considerada como una etapa de transición entre el abundante verano y el alto número de especies del invierno. AgradecimientosAGRADECIMIENTOSEl autor desea hacer patente su reconocimiento al personal del Marine Biological Association, of the United Kingdom, en particular a J. H. Wickstead, por su asesoría y al personal de la biblioteca por todas las facilidades otorgadas. Así también a Abraham Fleminger, quien amablemente identificó algunas de las especies aquí reportadas. A Roberto Cortés Altamirano y Michel Hendrickx por la revisión del manuscrito y a Arturo Núñez Pasten su valiosa colaboración en las recolectas y procesado del material. A la memoria de Ma. Eugenia Zamora Sánchez, compañera y amiga, que falleciera en el desarrollo de sus actividades académicas en la Laguna de Tamiahua, Veracruz, el 23 de octubre de 1982. LITERATURABRINTON, E., D. SIEGEL-CAUSEY y A. FLEMINGER Proceedings of the Six Symposia, IV The Gulf of California. UNAM. (En prensa). R review of plankton studies in the Gulf of California. In: Ayala-Castañares, A., F. Phleger, R. Schwartzlose and A. Laguarda Figueras (Eds.).UNAM BEERS, J. R.,Determination of zooplankton biomass In: Zooplankton Fixation and Preservation.UNESCO press:1976.35-74. CORTÉS, A. R. y S. ROJAS-TREJO In: VII Simposio latinoamericano sobre Oceanografía Biológica. 15-16 de noviembre. 1981, Acapulco, Gro. México. (En prensa). Variación estacional de las comunidades fitoplanctónicas de la Bahía de Mazatlán, Sin., México. ESCUDERO-DÍAZ, M., Tesis profesionalEstudio del zooplancton de la laguna del mar muerto, Oaxaca-Chiapas Fac. Ciencias, Univ. Nal. Autón, México,1975.49 p. FLEMINGER, A. Calif. Coop. Oceanogr. Fish. Invest.,Distributional atlas of calanoid copepods in the California current region. Part I.1964a.1-12, 313 mapas.2 ---,Pilot Register Zool., Card 3A, B, Labidocera johnsoni, species nov. Crustacea: Pontellidae.1964b.2995-2999. ---,Distributional atlas of calanoid copepods in the California current region.,Calif. Coop. Oceanogr. Fish. Invest. Part II.1967.213 mapas.7 ---,Estuarine Research. Chemistry, Biology and the estuarine System.Geographical distribution and morphological divergence in American coastal-zone planktonic copepods of the genus Labidocera. In: Cronin, E. R. (Ed).Academic Press.Nueva York,1975.392-419.1: FLEMINGER A. y K. HULSEMAN,Fis. Bull.Systematics and distribution of four sibling species comprising the genus Pontellina Dana (Copepoda, Calanoida).1974.63-120.721 GARCÍA, E.,Modificaciones al Sistema de Clasificación Climática de Koppen (para adaptarlo a las condiciones de la República Mexicana).Univ. Nal. Autón. de México,1973.246 p. GIESBRECHT, W., Fauna u Flora Golf. Neapel.,Systematik und faunistik der pelagischen copepoden des Golfes von Neapel und der angrenzenden meerabschnitte.1892.1-831.19 GRICE, G., U. S. Fish and Wildl. Serv. Fish. Bull.Calanoid copepods from equatorial waters of the Pacific Ocean.1961.171-246.18661 GRIFFITHS, F. B., A. FLEMINGER, B. KIMOR y M. VANNUCCI, In: Zooplankton Fixation and Preservation.Shipboard and curating technniques.UNESCO press:1976.17-31. MALDONADO, A. S., A. ORTIZ, J. A. RAMÍREZ, J. L. MASTACHI Y J. M. PONCE DE LEÓN. Tesis profesional.Medición de algunos parámetros físico-químicos y biológicos del canal de navegación y áreas adyacentes a Mazatlán, Sinaloa, México. Escuela de Ciencias del Mar. Univ. Autón. de Sinaloa,1980.82 p. 21 tablas, 22 figs. MANRIQUE, F., In: Proc. Symp. on warm water Zooplankton, Dona Paula, Goa, India. Seasonal variation of zooplankton in the Gulf of California.UNESCO/NIO Spec. Publ.,1978.242-249.14-19 oct. 1976. MARGALEF, R., In: Ecologia Marina.El ecosistema. Fundación la Salle (Ed) :1967.452-562. OWRE, H. B. y M. FOYO, Publications of the institute of marine science, University of Miami, Florida. Copepods of the Florida Current. Fauna Caribaea No. 1, Crustacea Part 1, Copepoda.1967.1-1237. ROSE, M., Copepodes Pelagiques. Faune de France.Office Central Faunistique.Paris,1933.1-374.26 SÁNCHEZ-OSUNA, L., Tesis profesional Variaciones estacionales del zooplancton en el estero El Verde, Sinaloa, México, con especial referencia a los Copepoda calanoides y Cladocera. CICIMAR, I.P.N.,1980.549 p. 15 tablas, 12 figs. SARH,Boletín climatológico anual especial para agricultura.Dirección General del Servicio Meteorológico Nacional,1979.1-38.517 ---,Boletín climatológico anual especial para agricultura.Dirección General del Servicio Meteorológico Nacional,1980.1-40.617 SIEFKEN, M., Comp. Bioch. Phis., Seasonal variation in metabolism and organic nutrients in Pseudodiaptomus sp. (Crustacea: Copepoda).1968.591-609.24 TURCOTT, V., Rev. Lat. Amer. Microbiol.Plancton de las lagunas costeras IV. Variación estacional de los copépodos en la laguna de Yavaros, Son., México.1976.159-165.18(1969-1970) WATERMAN, T. H. y CHACE, F. A., The Physiology of Crustacea I.General crustacean biology.In: Waterman, T. H. (Ed).Academic press Inc. Nueva York:1960.1-33. WILSON, C. B., Bull. U. S. Natn. Mus., The copepods of the Woods Hole region, Massachusets.1932.1-635.158 ---,Bull. U. S. Natn. Mus., Copepods gathered by The United States Fisheries steamer Albatross, from 1887 to 1909, chiefly in the Pacific ocean.1950.141-441, 561 figs.10014 ZAMORA-SÁNCHEZ, M. E., Tesis profesional, Fac. Ciencias. Univ. Nal. Autón, México. Estudio de las especies del género Acartia (Copepoda: Acartiidae) de la zona estuárica de Agiabampo, Sonora: Taxonomia, distribución y notas ecológicas.1974.57 p., 2 mapas, 15 figs.
|

