|
CULTIVO
DE LAS MICROALGAS MONOCHRYSIS LUTHERI Y SKELETONEMA COSTATUM CON NUTRIENTES
PRODUCIDOS POR ESTILRCOLES DIGERIDOS
Trabajo recibido el 28 de abril de
1983 y aceptado para su publicación el 18 de agosto de 1983.
CARLOS GRANADOS MACHUCA,
L. FERNANDO BÜCKLE RAMíREZ
Centro de
Investigación Científica y de Educación Superior de
Ensenada (CICESE) Apdo. Postal 2732, Ensenada, Baja California
(México).
Se
propone un método nuevo para obtener nutrientes y cultivar microalgas
marinas en base en la descomposición líquida acróbica de
estiércoles de vaca y de gallina en un biodigestor de circuito cerrado.
El crecimiento deMonochrysis lutheri y Skeletonema
costatumen volúmenes de 1 a 16 litros no fue
significativamente diferente a un método químico tradicional
empleado como control. Esta técnica no es onerosa, de fácil
realización y con características particularmente adecuadas para
países en vías de
desarrollo.
A
new method was developed to obtain nutrients from the aerobic liquid
decomposition of cow and chicken manure in a closed system biodigestor for
culturing marine microalgae.Monochrysis lutheri and Sheletonema
costatumgrowth, in volumes of 1 and 16 liters, was not significantly
different to that in a conventional chemical medium used as control. In
addition, the described technique is unexpensive and simple to perform,
characteristics particularly suitables for developing
countries.
En la Aquacultura el grupo de animales que contribuye más al aporte de proteína, es el de los Moluscos, cuya semilla es obtenida artificialmente en laboratorios, o en criaderos de cultivo. Este hecho ha permitido que la producción de alimentos de origen marino se haya ido incrementando, fomentando a la vez el establecimiento de nuevos laboratorios o granjas criaderos para el cultivo y producción de semilla de invertebrados marinos de valor comercial. El cultivo de filtroalimentadores marinos bajo condiciones controladas, requiere como fuente primaria de alimento, grandes cantidades de organismos fi toplanc tónicos para acondicionar a los progenitores y alimentar a los diferentes estadios larvales de desarrollo (Loosanoff y Davis, 1963; Walne, 1964). La forma de cultivo de fitoplancton más usual es aquella en la cual una disolución acuosa de volumen limitado, conteniendo los nutrientes orgánicos e inorgánicos necesarios, es inoculada con un número relativamente pequeño de células y expuesta a condiciones favorables de luz y temperatura (Fogg, 1965). Asi el agua de mar enriquecida, es la base para la preparación de muchos medios de cultivos de microalgas marinas, empezando con las fórmulas más sencillas basadas en la de Miquel (1892), hasta las mezclas actuales más complejas (Guillard, 1973; Provasoli, 1957). Independientemente de la efectividad de los medios de cultivo, uno de los aspectos que requiere la atención sobre todo de los cultivadores de animales filtroalimentadores de paises en vías de desarrollo, es una producción económica y masiva de fitoplancton, ya que por lo general, los medios tradicionales de cultivo de fitoplancton se hacen con reactivos especiales que se obtienen de las casas comerciales a precios muy elevados. Consecuentemente cultivar fitoplancton con estos medios resulta oneroso, ocasionando que los organismos alimentados con este fitoplancton, lleguen con un alto costo al mercado. La utilización de un medio de cultivo basado en nutrientes originados con estiércoles de vaca y gallina, tratados en un biodigestor apropiado, no se ha utilizado hasta el momento y no se ha encontrado en la literatura ninguna investigación en curso que tenga este sentido. Este trabajo da cuenta de las primeras experiencias de laboratorio con extractos digeridos de estiércoles y su efecto en el cultivo de fitoplancton. MATERIALES Y MÉTODOSPara la preparación de un medio de cultivo económico se eligió el estiércol de vaca y de gallina. Se recolectaron 20 kilogramos de cada uno, considerando el tiempo de defecación. En esta forma y en el caso del estiércol de vaca, se estableció una diferencia entre el estiércol fresco (recién defecado) y el estiércol descompuesto que se encuentra tirado en los corrales. De cada muestra de 20 kilogramos se tomaron tres submuestras de seis gramos cada una con el fin de analizar en la primera la humedad y las cenizas; en la segunda las proteínas y en la tercera los lípidos. Con la finalidad de oxidar los estiércoles, se diseñaron tres biodigestores que consistían en un estanque plástico de 100 Its. de capacidad; pintados exteriormente de color negro, para captar la energía solar e indirectamente fomentar el desarrollo bacteriano y acelerar la conversión de los compuestos complejos del estiércol en unidades sencillas. En el interior de los estanques se colocaron desde la mitad hasta el fondo tres capas de guijarros y conchas quebradas de moluscos cernidas por mallas de 4; 25 y 60 mm de abertura aproximadamente. Los guijarros tuvieron esencialmente la función de un filtro y a la vez sirvió también como sustrato para las bacterias (Fig. 1-a) . El estanque (Biodigestor) , se perforó en el fondo donde se instaló un tubo de PVC de media pulgada que se prolongó por medio de conexiones a una unión "T". A la unión "T" se le conectó una llave de paso (Fig. 1-b) en su parte inferior para tomar las muestras y la superior se modificó para inyectar aire (burbujeador) (fig. 1-c) y recircular el líquido del biodigestor. En el interior del biodigestor se suspendió un balde profusamente perforado, en el cual se colocó el estiércol (fig. 1-e). De esta forma el liquido impulsado por el burbujeador era esparcido en la superficie del interior del balde bañando constantemente su contenido. Los biodigestores se mantuvieron a la intemperie. 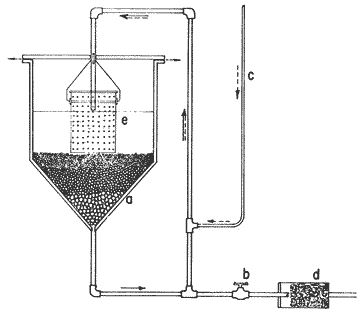 Fig. 1 Esquema del biodigestor. a, canto rodado; b, llave de paso; c, aire; d, filtro; e, recipiente perforado. Las flechas indican la dirección de los fluidos; líquidos->aires ---> Los tres biodigestores fueron cargados con 5 kg de estiércol de vaca (fresco; descompuesto) y de gallina respectivamente a los cuales se les agregó 35 lts. de agua destilada, cantidad suficiente para producir la recirculación del liquido. Con el fin de limpiar las muestras que se tomaban del líquido recirculado, se diseñó un filtro sencillo, consistente en un tubo de acrílico de una pulgada y media de diámetro, relleno con algodón plástico (fig. 1-d). En este filtro se retenían los fragmentos que pudiera contener la muestra y que habían pasado por el filtro de guijarros. La velocidad de recirculación de los biodigestores fue de dos litros por minuto y la temperatura fluctuó entre 21,8° y 24° C. El pH en el extracto de estiércol de gallina se mantuvo entre 7,7 y 8,6. El extracto de estiércol descompuesto fluctuó entre pH 7,9 y 8,3 y del estiércol fresco varió entre 7,5 y 8,5. El muestreo fue de dos litros de liquido recirculado; operación que se repitió cada dos días. De los dos litros se submuestrearon 200 ml., con el fin de analizar posteriormente los nutrientes. Las submuestras fueron fijadas con tres gotas de HgCL y conservadas en un congelador. El extracto remanente se esterilizó en un autoclave (15 lb/cm² y 121°C) a pH bajo (4,5-5,0) con el fin de excluir las bacterias y conservar las vitaminas. Después de la esterilización, el líquido se almacenó en un recipiente plástico y se congeló para usarlo posteriormente en la preparación del medio de cultivo. Terminado el proceso de muestreo (veinteavo día) se procedió a descongelar las muestras para analizar en un Espectrofotómetro (Hach DR El/2) el contenido de NO3, NH4, Fe, Si, Cu y Mn. Con la concentración de los nutrientes determinada, se investigó la cantidad óptima de cada extracto, necesaria para la elaboración del medio de cultivo tomando como criterio aquellos días en que se encontraron las máximas concentraciones de macronutrientes como nitratos y fosfatos. Los ensayos previos se hicieron probando el efecto de los extractos separadamente cultivando Monochrysis lutheri y Skeletonema costatum. De cada extracto se añadieron diferentes cantidades (5, 10, 20, 40 nil.) a cinco matraces (1000 nil.) y ajustando su pH a 7.5 se esterilizaron para su posterior inoculación con densidades iguales de microalgas. También se preparó un Fernbach control con el medio de Matthiessen y Toner (1966). El crecimiento en los diferentes matraces se estimó visualmente y se compararon cuantitativamente (cels/nil) al séptimo día con el control. Todos los. experimentos se mantuvieron en un cuarto de cultivo a una temperatura de 20-22°C. estimada con un termómetro de máxima y mínima. Para cultivar M. lutheri se iluminó con 1,500 pie candela y S. costatum con 150 pie candela de una fuente de lámparas fluorescentes tipo luz fría. Los cultivos no se enriquecieron con CO2 . La densidad de los cultivos se determinó con una cámara de Neubauer de 0.1 mm de profundidad. Después de identificar el volumen óptimo de extracto (40 ml) de cada uno de los estiércoles separadamente y que produjo la mejor eficiencia de crecimiento, se procedió a preparar un nuevo experimento con cada uno de los estiércoles separadamente, utilizando 40 m1 para cada uno de los cinco Fernbach réplicas y un con trol con agua de mar pura. Todos los Fernbach fueron inoculados y aforados a un litro. Se siguió la misma metodología para el mantenimiento de los cultivos de M. lutheri en condiciones constantes de pH, T°C y S%o. En esta serie de experimentos se calculó con cuatro submuestras de cada frasco de cultivo un promedio de las densidades diarias de células, durante siete días, siguiendo los lineamientos descritos por Matthiessen y TonerOP. cit. Después de establecer la eficiencia de crecimiento con cada uno de los estiércoles se procedió a preparar un nuevo experimento donde los estiércoles se mezclaron (extracto de gallina + fresco y descompuesto de vaca), bajo los criterios de el máximo crecimiento observado en el experimento precedente y el volumen apropiado establecido previamente. Así se preparó una mezcla en las proporciones 5:2:1 respectivamente, completando 40 ml de medio para cinco réplicas. Todos los Fernbach fueron inoculados y aforados a un litro. Se siguió la misma metodología de cultivo descrita. Al determinar que la mezcla de estiércoles superaba los cultivos hechos con los estiércoles separadamente, se procedió a repetir el experimento con M. lutheri y S. costatum utilizando ahora el medio químico de Matthiessen y Toner (1966) como control de crecimiento. Posteriormente los ensayos se repitieron pero a nivel de Carboy (16 lts.) con las mismas microalgas, para lo cual se prepararon dos réplicas y un control. En los experimentos de 1,000 y 16,000 ml., se calcularon las densidades diarias de células (cels/ml) ; se graficaron las curvas promedio de crecimiento que se compararon con las curvas de crecimiento control. El crecimiento se evaluó utilizando los parámetros poblacionales propuestos por De la Cruz (1975). La información se analizó con estadígrafos de covarianza y regresiones de orden dos (Snedecor y Cochran, 1980). RESULTADOSLos estiércoles fueron analizados para conocer la cantidad inicial de grasas, proteínas, humedad y cenizas (Tabla 1) . El estiércol de gallina tiene más proteínas y grasas, lo que posiblemente se deba a la alimentación balanceada que se le administra al receptor. El contenido de proteínas en el estiércol descompuesto de vaca fue mayor que en el estiércol fresco, probablemente por el efecto de las condiciones ambientales en las que se encuentran (Hansenet al., 1976). El contenido de grasas fue similar en ambos estiércoles. 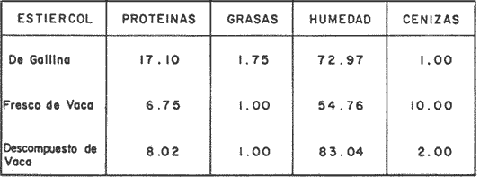 TABLA 1 CONTENIDO DE PROTEÍNAS GRASAS, HUMEDAD Y CENIZAS DE LOS ESTIÉRCOLES DE GALLINA Y DE VACA. TODOS LOS VALORES ESTÁN DADOS EN PORCENTAJES El análisis de la variación temporal de los nutrientes contenidos en el liquido digerido del estiércol de vaca fresco y descompuesto como también del estiércol de gallina se muestran en las figuras 2 a 7 y sus respectivas ecuaciones de segundo orden en la Tabla 2. Los nutrientes analizados en el estiércol de vaca fresco (Figs. 2 y 3) tienden a aumentar entre el cuarto y doceavo día del proceso, disminuyendo claramente alrededor del vigésimo día. Por el contrario en el estiércol de vaca descompuesto (Figs. 4 y 5) los nutrientes disminuyen en el transcurso de la digestión. Particularmente el Silicio es el único elemento que aumenta. En el estiércol de gallina (Figs. 6 y 7) la óxido-reducción del biodigestor acelera la formación de NO3, .4 y en cambio los otros nutrientes analizados se mantienen relativamente estables o disminuyen como sucede en el estiércol de vaca. 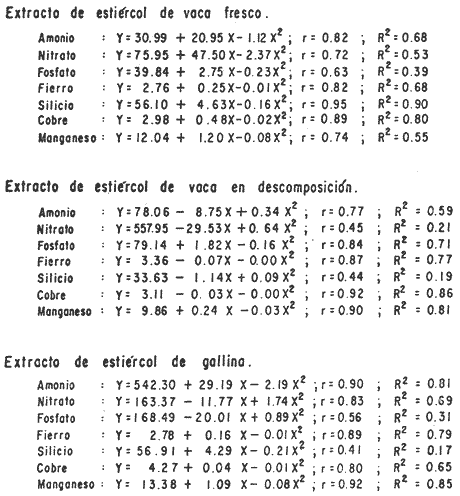 TABLA 2 ECUACIONES DE SEGUNDO ORDEN QUE DESCRIBEN LA VARIACIÓN DEL AMONIO, NITRATOS, FOSFATOS FIERRO. SILICATOS COBRE Y MAGNESO EN LOS ESTRACTOS DE LOS ESTIERCOLES DE VACA FRESCO Y DESCOMPUESTO COMO TAMBIÉN DEL ESTIERCOL DE GALLINA r= COEFICIENTE DE CORRELACIÓN R²=BONDAD DE AJUSTE 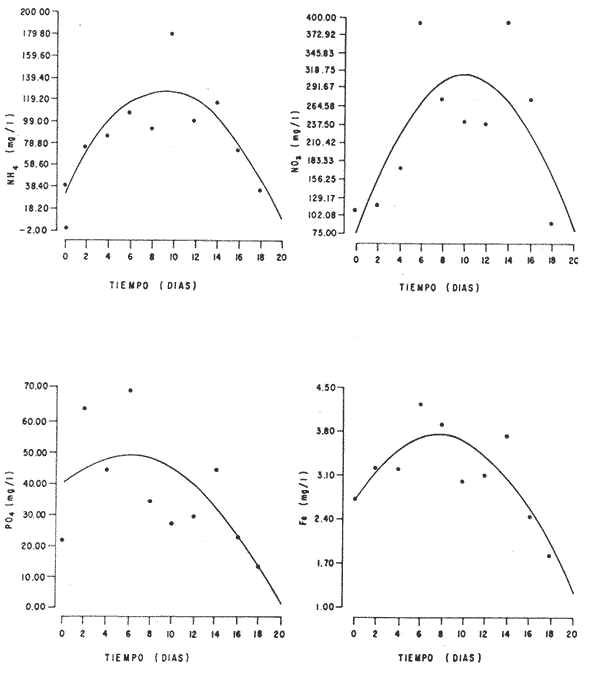 Fig. 2. Variación temporal de la concentración de amonio, nitratos, fosfatos y fierro en el extracto del estiércol de vaca fresco. Las ecuaciones de segundo orden correspondientes se ilustran en la Tabla 2. 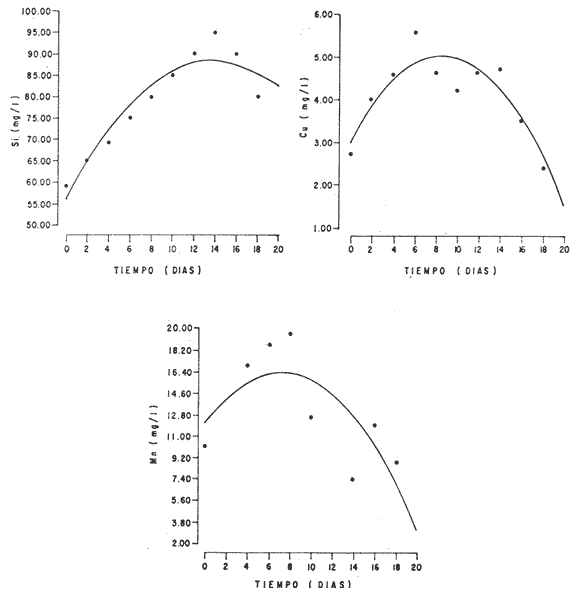 Fig. 3. Contenido de silicio, cobre y manganeso del extracto de estiércol fresco de vaca. Las ecuaciones de segundo orden demuestran en la Tabla 2. 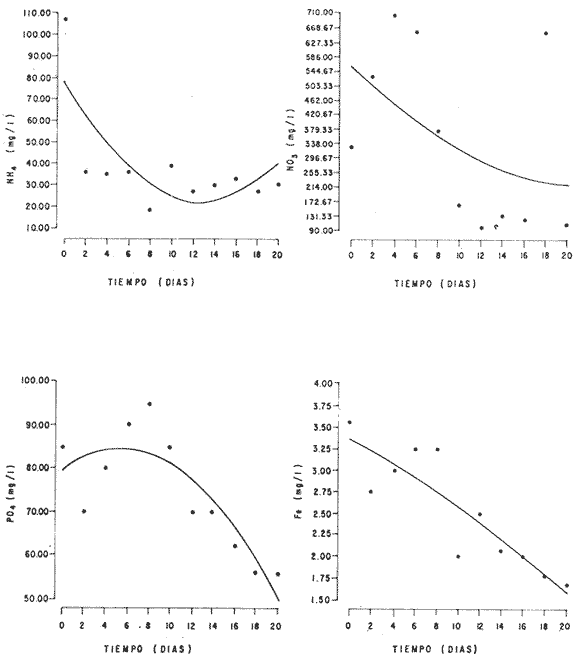 Fig. 4. Variación de la concentración de amonio, nitratos, fosfatos y fierro en el extracto preparado en base a estiércol de vaca en descomposición. Las ecuaciones correspondientes se indican en la Tabla 2. 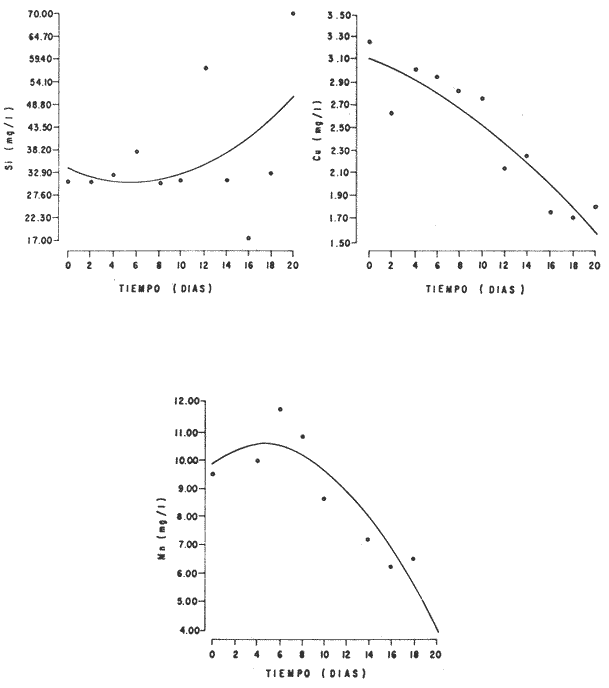 Fig. 5. Contenido de silicio, cobre y manganeso del extracto de estiércol de vaca en descomposición obtenido en un biodigestor. Las ecuaciones explicativas se encuentran en la Tabla 2. 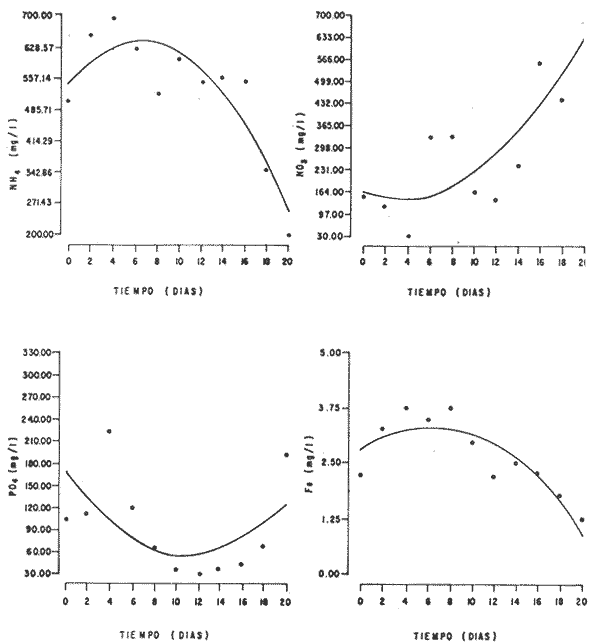 Fig. 6. Oscilación temporal de la concentración de amonio, nitratos, fósfatos y fierro en el extracto preparado con estiércol de gallina. Las ecuaciones de segundo grado se presentan en la Tabla 2. 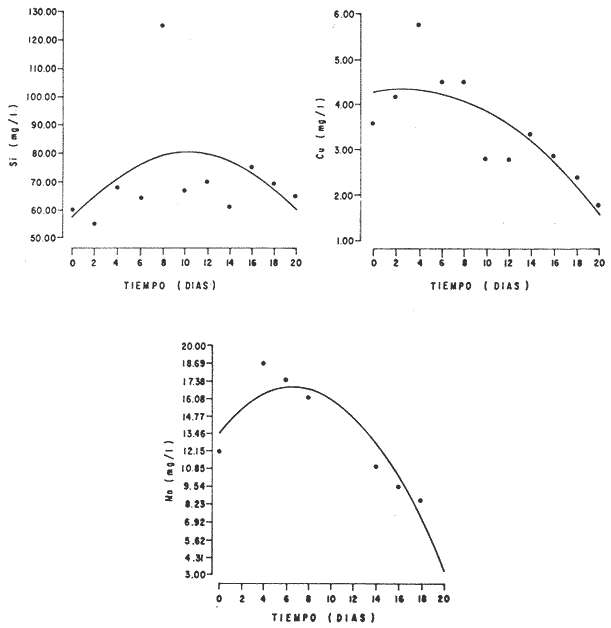 Fig. 7. Contenido del silicío, cobre y manganeso del extracto preparado con estiércol de gallina. La ecuaciones de segundo grado se muestran en la tabla 2. La primera exploración que se hizo para conocer el volumen de extracto necesario para cultivar las microalgas, dio como resultado que cuarenta mililitros permitían un desarrollo aceptable de M. lutheri y S. costatum al compararlo con los controles al séptimo día de cultivo. Con la evidencia de que los extractos servían para cultivar microalgas se inició el primer experimento con M. lutheri ensayando los estiércoles separadamente y controlando las densidades diarias. Hasta el tercer día se observó un crecimiento relativamente parejo después del cual, el extracto de estiércol de gallina (Fig. 8-d) supera (séptimo día) en densidad al estiércol fresco y descompuesto de vaca (Fig. 8-b y c). El cultivo con agua de mar exenta de nutrientes alcanzó al séptimo día una densidad de 3.22 X 105cels/m.1 (Fig. 8-a). El siguiente experimento donde los estiércoles fueron mezclados proporcionalmente en base a los rendimientos obtenidos anteriormente, se alcanzó al séptimo día una densidad promedio de 44.9 X 105cels/mI. (Fig. 8-e). 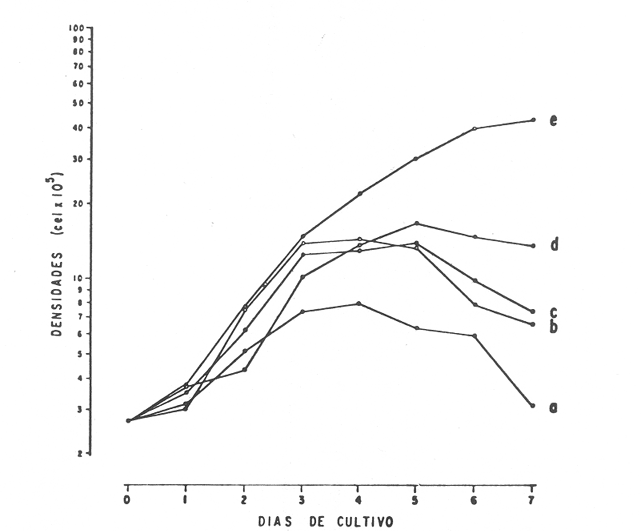 Fig.8. Curvas de crecimiento de Monochrysis lutheri (1000 ml). a- cultivo con agua de mar pura; b-cultivo con extracto de estiércol descompuesto de vaca; c- cultivo con extracto de estiércol fresco de vaca; d- cultivo con extracto de estiércol de gallina, e- cultivo con una mezcla de estiércoles. Conociendo el efecto positivo de la mezcla de estiércoles, se procedió a hacer una comparación química cuantitativa de ésta con el medio químico, encontrándose que la concentración de los nutrientes de la mezcla de los estiércoles era de alrededor de un 99% más baja que el medio de cultivo de Matthiessen y Toner (1966). El NH 4 4 que contiene la mezcla de estiércoles no se encuentra presente en el medio de control (Tabla 3). Los resultados de la variación de los parámetros poblacionales registrados en los volúmenes de cultivo de 1,000 y 16,000 ml, ya sea empleando la mezcla de estiércoles o el medio control y su efecto en el desarrollo de ,Monochrysis lutheri o Skeletonema costatum, se muestran en las figuras 9, 10, 11 y 12. Los valores poblacionales respectivos se presentan en las Tablas 4, 5, 6 y 7. Debido a que de la densidad calculada en cada cultivo se derivan todos los parámetros poblacionales estudiados, sólo se contrastaron estadísticamente las pendientes de las curvas de crecimiento de las algas del medio control con las algas cultivadas con el medio basado en la mezcla de los estiércoles. La comparación de las líneas de regresión por covarianza indica que no existe una diferencia significativa al cultivar las microalgas con las soluciones utilizadas (Tabla 8). 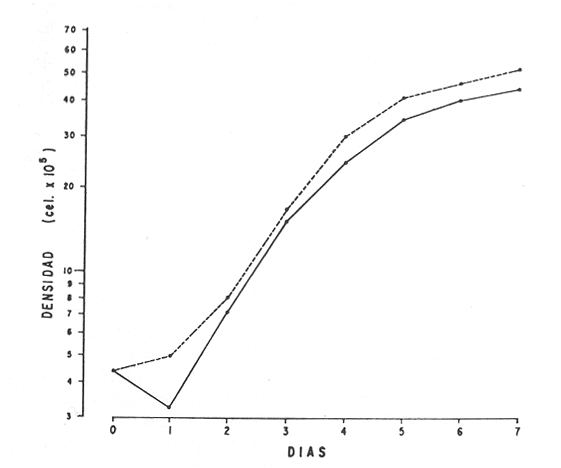 Fig. 9. Curva de crecimiento de Monochrysis lutheri. Cultivada en recipientes de 1000 ml. La línea continua representa al medio de cultivo hecho con una mezcla de extractos de estiércoles. La línea cortada es el control. 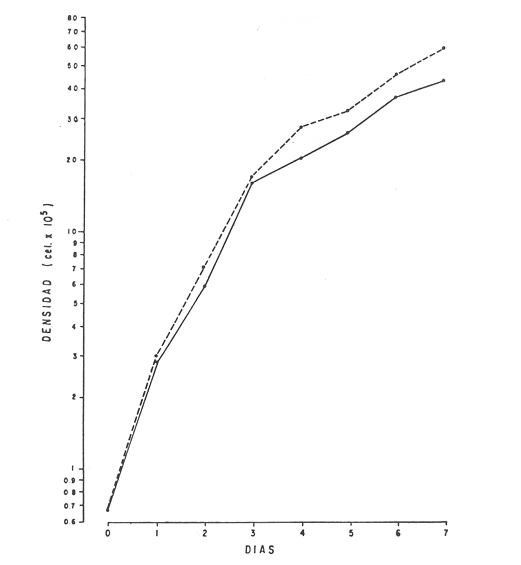 Fig. 10. Curva decrecimiento de Monochrysis lutheri cultivada en 16 000 ml. La línea continua representa el efecto quetuvo el medio de cultivo preparado con una mezcla de extractos de estiercoles. La línea cortada es el control. DISCUSIÓNEn los análisis químicos proximales de los estiércoles utilizados en esta investigación (Tabla 1), se analizaron las cantidades de grasas, proteínas, humedad y cenizas. El contenido de grasas y proteínas es muy variable, dependiendo de la especie, edad, alimentación de los animales (Papadakis, 1976; Hansenet al., 1976), como también del tiempo de haber sido defecado, puesto que al ser desalojado y tener contacto con el ambiente, el proceso bacteriano aumenta la degradación de estos compuestos, así por ejemplo, la excreta de rumiante ya incluye inicialmente de 2% a un 9% de bacterias aerábicas (Miner, 1971 en Hansen et al. op. cit.). Aunque las concentraciones de proteínas y grasas no pueden considerarse en esta investigación como abundantes o limitadas, ellas aportan parte del requerimiento nutricional de las microalgas como fuente de nitrógeno (Provasofi y McLaughlin, 1963). Para el tratamiento de los estiércoles se construyó un biodigestor (Fig. 1) , que en su interior tenia guijarros y conchas quebradas de moluscos que sirvieron de sustrato fijador de las bacterias que procesan los estiércoles. En el biodigestor, las excretas en forma de pasta fueron sometidas a un método liquido aerobio donde los elementos nutritivos se generaron conforme el estiércol era degradado por las bacterias. Como los registros de las variables fisicoquímicas se llevaron a cabo a una misma hora (10.00 A.M.), sin considerarse los cambios nocturnos, sería adecuado determinar con precisión el efecto de la variación térmica en los procesos de degradación de los estiércoles en los biodigestores. Al respecto tenemos en proceso algunas investigaciones. 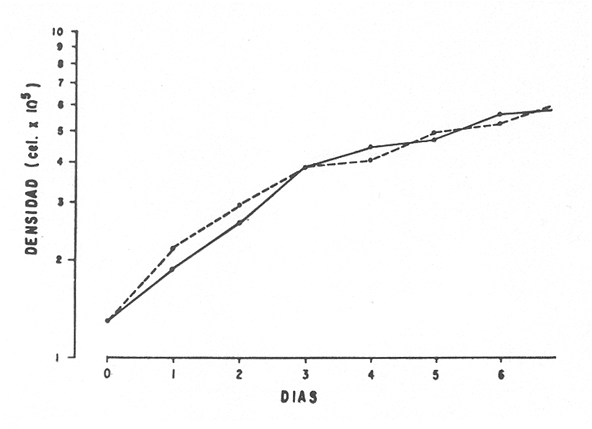 Fig. 11. Curva de crecimiento de Skeletonema costatum cultivada en recipientes de 1000 mL. La línea continua indica el efecto que tuvo el medio de cultivo preparado con una mezcla de estiércoles. La línea cortada es el control. 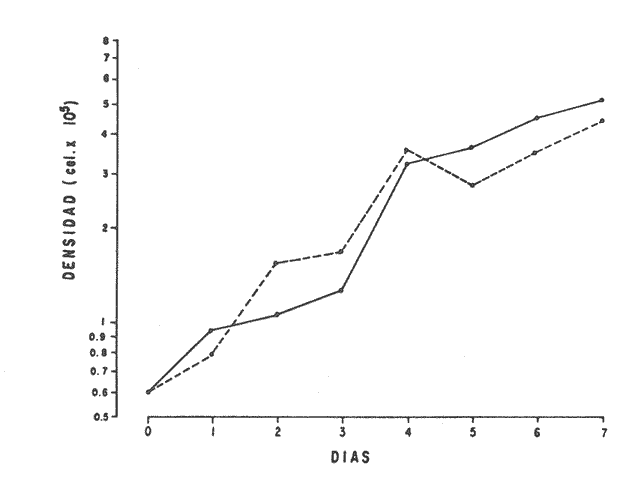 Fig. 12. Curva de crecimiento de Skeletonema costatum cultivada en 16 000 ml. La línea continua refiere el cultivo hecho con un medio basado en una mezcla de estiércoles. La línea cortada es el control. La descomposición de la materia prima proporciona varias fuentes de nitrógeno, entre las que se encuentran el Amoniaco, Amonio, Nitritos y Nitratos (Spotte, 1979). Este proceso se lleva a cabo principalmente por la actividad de las bacterias nitríficantes quimioautráficas. Algunas de éstas oxidan los iones amonio en presencia de agua a nitritos y otras oxidan los nitritos y nitratos, obteniéndose un producto rico en sales asimilables para las microalgas (Moore, 1970). 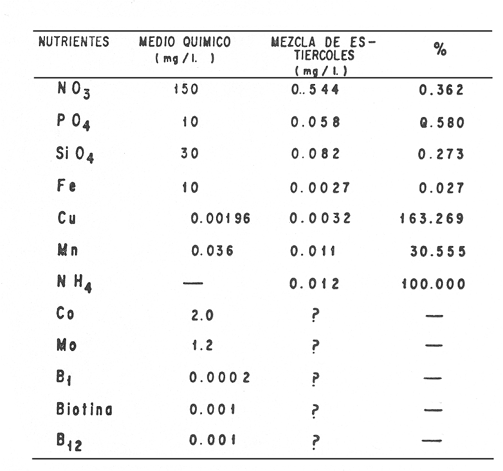 TABLA 3 COMPARACIÓN DEL A CONCENTRACIÓN DE LOS NUTRIENTES DEL MEDIO CONTROL CON LA MEZCLA DE ESTIÉRCOLES % = PORCENTAJE DE NUTRIENTES DE LA MEZCLA DE ESTIÉRCOLES EN RELACIÓN AL MEDIO CONTROL Como cada proceso de degradación tiene una bacteria especifica que oxida a un ión particular, el alto contenido de amonio presente en los análisis (Fig. 6) probablemente se deba a la poca cantidad de bacterias nitrificantes (Spotte, 1979) que oxidan este ión, repercutiendo al final del proceso en la concentración de nitratos En los análisis de amonio del medio de cultivo experimentado, se encontró una concentración de 0.012 mg/1 siendo éste el 100% con respecto al medio control (Tabla 3). Los estudios realizados por Treboux (1904); Prindsheim (1912); Schreiber (1927) y Brasurd y Foyn (1930), así como los de Allison (1931); Miller (1933); mencionados por Chu, (1943), demuestran que el amonio puede ser utilizado en forma similar al nitrato y que algunas veces las microalgas crecen mejor en su presencia. El amonio como fuente de nitrógeno de muchas algas, ha sido estudiado también por Guillard (1963); Eppley y Roger (1970), quienes indican que la utilización de este compuesto no es tan fácil como la de los nitratos. Dugdale (1976) demuestra que el amonio en ausencia de luz puede ser mejor aprovechado que el nitrato. En base a los resultados de esta investigación se estima que el amonio no tuvo ningún efecto negativo sobre la asimilación del nitrato, ni tampoco inhibió el crecimiento de las microalgas, lo que concuerda con lo encontrado por Bienfang y Harrison (1973), mencionados por Caperon y Ziemann (1976), aunque Blasco y Conway (1982) demuestran el efecto inhibidor del amonio en poblaciones naturales de fitoplancton. 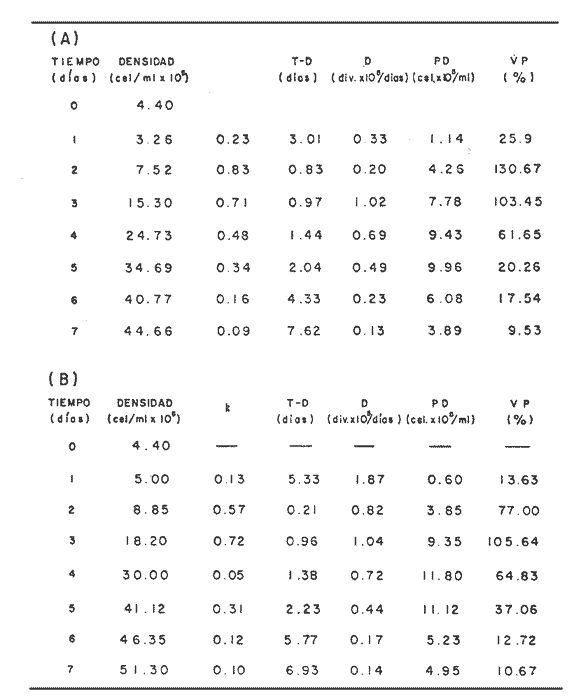 TABLA 4 VALORES POBLACIONALES DE MONOCHRYSIS LUTHERI CULTIVADA EN 1 000 ML. DE MEDIO EN BASE A UNA MEZCLA DE ESTIÉRCOLES (A) Y CONTROL (B) La concentración de los nitratos en la mezcla de estiércoles podría clasificarse como deficiente, ya que comparado con el medio control (150 mg/1) contiene sólo 0.544 mg/l. Esta pequeña cantidad en el cultivo de fitoplancton, podría repercutir directamente en la clorofila y en las enzimas fotosintéticas, limitando el crecimiento (Curtis Davis, en Kinne, 1976). Sin embargo, a pesar de ocasionar tales efectos, Barker (1935), Provasofl y McLaughlin (1963), demostraron que algunas especies de fitoplancton crecen en concentraciones tan bajas como 0.001 mg/l. Según esto la cantidad de nitratos producidos en un biodigestor y en las condiciones descritas parece ser suficiente. En el estiércol de gallina se encontraron altas concentraciones de fosfatos en comparación con el de vaca (Fig. 6) debido probablemente a que el animal recibe una dieta con gran contenido de fosfatos en condiciones fáciles de digerir. Las vacas que no tienen una alimentación balanceada, cubren sus necesidades de fósforo con fosfolípidos, ácidos nucléicos y proteínas del alimento. El estiércol descompuesto de vaca contiene más fosfatos que el estiércol fresco, presumiblemente debido a las condiciones en que se encuentra la excreta en el suelo del establo, donde se podría retener el compuesto por filtración y decantación. El contenido de fosfatos en el medio de cultivo investigado (Tabla 3) fue de 0.058 mg/1 y 10.0 mg/1 en el medio control. Chu (1943), establece que la deficiencia de fósforo en un microcultivo ocasiona una decoloración de la microalga. Esto no sucedió en las microalgas con el medio de cultivo investigado. 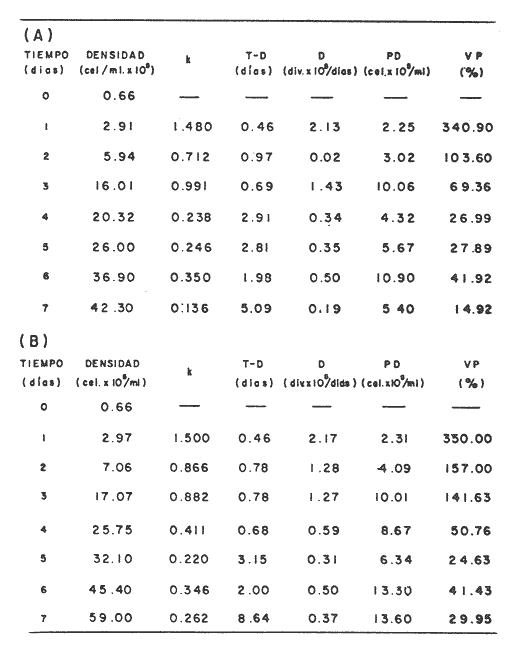 TABLA 5 VALORES POBLACIONALES DEL CULTIVO DE MONOCHRYSIS LUTHERI CON UN MEDIO EN BASE A UNA MEZCLA DE ESTIÉRCOLES (A) Y EL CONTROL (B) En las concentraciones de silicatos el valor máximo encontrado fue en el estiércol de gallina, que se detectó al octavo día (Fig. 7). En el estiércol fresco de vaca hubo un aumento estable debido posiblemente a que en la formación de los silicatos, las bacterias descomponedoras actuaron en forma continua sobre las valvas quebradas de moluscos. El estiércol descompuesto de vaca tuvo los valores más bajos de silicatos probablemente debido al largo tiempo de permanencia en el medio natural (Fig. 5). Las diferencias en las cantidades de silicatos en los extractos de estiércoles se originan en el biodigestor aparentemente por el tipo de bacteria original que traen las heces fecales y el efecto de las condiciones experimentales. Aunque en el medio en base a la mezcla de estiércoles sólo habían 0.082 mg/1 de silicatos (30.0 mg/1 en el medio control) no se observó limitaciones en el crecimiento deS. costatum y tampoco se detectaron aglomeraciones ni deformaciones celulares. 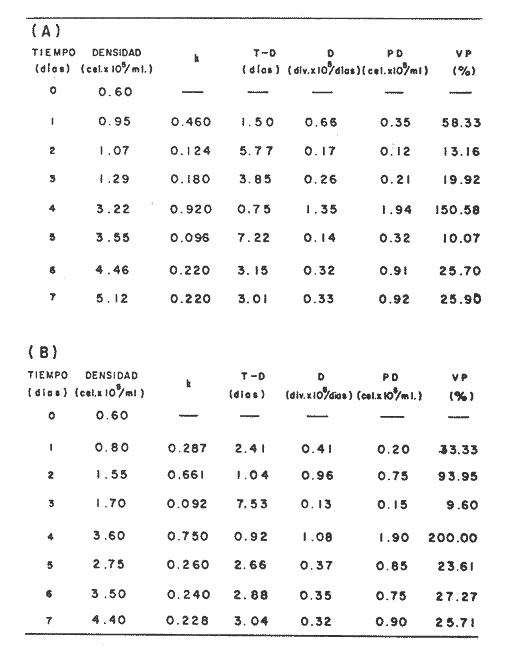 TABLA 6 VALORES POBLACIONALES DEL CULTIVO DE SKELOTONEMA COSTATUM CULTIVADA EN 1 000 ML DE MEDIO EN BASE A UNA MEZCLA DE ESTIÉRCOLES (A) Y CONTROL (B) La concentración de fierro en el medio de cultivo experimentado (Tabla 3) fue de 0.0027 mg/1 (10 mg/1 en el control). La baja cantidad de este elemento en el medio de cultivo en base a estiércoles pudo afectar el proceso enzimático de las microalgas ya que está asociado a numerosas enzimas (Catalazas, citocromos y otras), como también en la producción de pigmentos (Graam, 1933). Sin embargo, se estima que la baja concentración del fierro no afectó a los cultivos, porque el crecimiento de las algas fue satisfactorio. En la mezcla de estiércoles el cobre se encontraba en una concentración de 0.0032 mg/1 (0.0019 mg/1 en el control) (Tabla 3). Además de ser igualmente importante como otros micronutrientes, porque participa como los demás elementos trazas a nivel molecular como cofactores de enzimas o bien como componentes estructurales de ellas, interviene también en la activación de la enzima aldolasa (Bard y Gunsalus, 1950 mencionados por McEIroy y Nason, 1953). Los resultados indican que el contenido de cobre del medio en base a estiércoles digeridos es más alto que el control y no afectó el crecimiento. 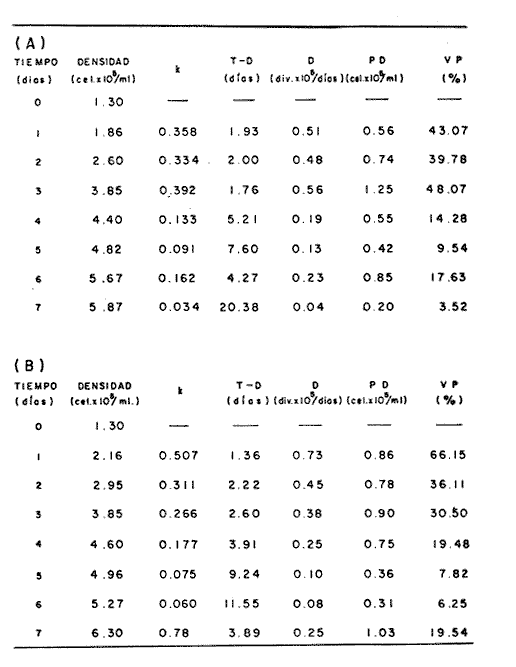 TABLA 7 VALORES POBLACIONALES DEL CULTIVO DE SKELETONEMA COSTATUM CON UN MEDIO EN BASE A UNA MEZCLA DE ESTIÉRCOLES (A) Y EL CONTROL (B) 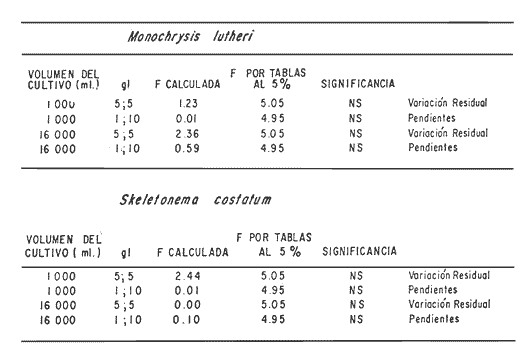 TABLA 8 CONSTRASTACIÓN ESTADÍSTICA DE LAS PENDIENTES DE PRODUCCIÓN (k) DE LAS ALGAS MONOCHRYSIS LUTHERI Y SKELETONEMA COSTATUM CULTIVADAS EN DIFERENTES VOLÚMENES (1 000; 16 000 ML.) DONDE SE UTILIZO LA MEZCLA DE ESTIÉRCOLES Y CONTROLES. El manganeso en el medio de cultivo experimental tenía 0.011 mg/1 (0,0036 mg/1 en el control). Es importante como formador estructural de algunas enzímas entre las que se encuentra la fosfoglucomutasa (McEIroy y Nason,op. cit.) . Este elemento no fue limitante en los cultivos que se hicieron. Al no existir un elemento quelante en el medio estudiado se habría producido la precipitación parcial o total de los metales trazas, en los cultivos de microalgas, limitando el crecimiento y tamaño de la población (Spencer, 1975). Por los resultados obtenidos, se puede suponer que el medio experimental tiene propiedades quelantes. Todos los cultivos llevados a cabo, ya sea con el medio en base a estiércoles como con el medio control, fueron sometidos a las mismas condiciones controladas de luz y temperatura. El medio control tiene en su composición una solución Buffer, para evitar fluctuaciones grandes del pH. En el medio experimental, no hay una solución Buffer, sin embargo, en el transcurso de la investigación, los cultivos no presentaron fluctuaciones marcadas en esta variable, a pesar de que éstos se iniciaron con una concentración de amonio de 0.012 mg/1 que podría haber acidificado el cultivo. Con los resultados obtenidos se estima la presencia de una solución Buffer. Otras investigaciones realizadas por Trelease y Trelease, 1933 y 1935 (mencionado por Pratt y Fong, 1940), demostraron que una clase de sistema Buffer fisiológico puede formarse en la solución por un ajuste apropiado en el radio iónico NO3/NH4. Esto pudo haber ocurrido en el medio en base a estiércoles. En el transcurso de siete días de cultivo, el pH del medio experimental varió de 7.5 a 8.0 y el control de 7.5 a 8.5. A pesar de que las concentraciones de los compuestos químicos analizados son cuantitativamente diferentes en los medios contrastados, el crecimiento de las dos especies de fitoplancton (Figs. 10, 11, 12 y 13) es aceptable. Por la baja concentración de nutrientes que tiene la solución de estiércoles, parte del crecimiento en los cultivos debe ser atribuido a la participación de compuestos orgánicos tales como aminoácidos, carbohidratos, lípidos y proteínas que Provasoli y McLaughlin (1963) indican ser utilizados por las algas como fuente de nutrientes. Hellebust (1965), demuestra que durante el crecimiento de las poblaciones algales éstas excretan péptidos, aminoácidos y otros compuestos orgánicos. Estos compuestos bien pudieron ser reutilizados por el alga en presencia de algunos componentes del medio investigado ya que comparativamente, en el devenir de los cultivos se pudo observar en el control la formación de aglomeraciones celulares. El buen crecimiento observado con el medio de estiércoles también pudo ser ocasionado por una buena adaptación inicial de las células a la asimilación de los compuestos orgánicos presentes, de tal manera que en el transcurso del crecimiento no faltaron elementos nutritivos y es probable que las algas adaptadas a tales condiciones les fuera más fácil hacer uso de sus compuestos catabólicos. Durante esta investigación no se hicieron análisis de la presencia de vitaminas en el medio experimental. Droop 1961 (en Fogg 1965), indica que el 70% de las microalgas requieren de la vitamina B12. Sin embargo, investigaciones realizadas por Loche y Thexton, 1951 (en Kinne, 1976) han demostrado en análisis de suelos, que la vitamina B12 es sintetizada por el 70% de las bacterias presentes. Por otra parte, Carlucci y Bowes (1970) han comprobado que S. costatumrequiere de la vitamina B12 y que esta alga produce tanto Tiamina y Biotina en presencia de una concentración inicial de 2 a 12 ng/1 de B12. Además se observó que el radio de producción de esta vitamina es más rápida que la utilización de ellas. También se señaló por Johnston (1936), que mientrasS. costatum esté libre de bacterias crece pobremente en muestras de agua de mar enriquecida con nitratos, silicatos, fosfatos y metales trazas con quelante, no así si en el mismo medio se encuentran presentes las bacterias. Es posible que las condiciones mencionadas anteriormente puedan encontrarse en el medio experimental de cultivo ya que en la digestión de los estiércoles hay bacterias. Los estudios realizados por Barker y Sweeney (mencionados por Provasoli et al., 1957), establecen que durante el tratamiento bacteriano de cualquier producto o agua, las bacterias proporcionan durante su crecimiento sustancias metabólicas que pueden ser factores de crecimiento para el cultivo de fitoplancton. Las curvas de crecimiento de algas cultivadas con el medio experimental y químico control fueron contrastadas con el test de covarianza, el cual indicó que no hubo diferencia significativa en las pendientes de todos los cultivos comparados (Tabla 8). Con las precedentes consideraciones y los resultados obtenidos en esta investigación se puede afirmar que los extractos de estiércoles producidos en biodigestores son una fuente rica de nutrientes para cultivar microalgas. Con un sistema de tratamiento que sea más efectivo, se podrían obtener concentraciones más altas de compuestos nutritivos para el crecimiento de fitoplancton. Como el costo de producción del medio de cultivo investigado es muy bajo se espera repercutir en el costo de producción de Bivalvos de importancia comercial y filtroalimentadores en general. Las investigaciones para el perfeccionamiento de este método se encuentran en progreso. AgradecimientosLos autores expresan su reconocimiento al señor Daniel Loya Salinas quien llevó a cabo el procesamiento de parte de la información en la P.R.I.M.E. 400. LITERATURABARKER, G. I., The culture and physiology of the marine dinoflagellates. Arch. Microbiol.,1935.157-181.6: BLASCO, D. H. L. CONWAY, Effect of ammonium on the regulation of nitrate assimilation in natural phytoplankton populations.J. Exp. Mar. Biol. Ecol.,1982.157-168.61: CARLUCCI, A. F. M. P. BOWES., Production of vitamin B12, Thiamine, and Biotin by phytoplankton. J. Phycol.,1970.351-357.6: CAPERON, J. D. A. ZIEMMAN, Sinergistic effects of nitrate and ammonium ion on the growth and uptake kinetics of Monochrysis lutheri in continuos culture. Mar. Biol.,1976.73-84.36: CHU, S. P., The influence on the mineral composition of the medium on the growth of planktonic algac. J. Ecol.,1943.109-148.31(2): DE LA CRUZ, S. A. E. ALFONSO,Ciencias,Cultivo masivo de algag plantónicas marinas mediante fertilización.1975.1-25.Serie 8,(17): DUGDALE, R. C., The ecology of the sea, W. B.Nutrient cycles. In: Cushing, D. H. y J. J. Walsh, (Eds.) Saunders Co.Filadelfia,1976.141-172 p. EPPLEY, R. W. J. N. ROGER, Inorganic nitrogen assimilation of Ditylum brightwellei, a marine plankton diatom. J. Phycol.,1970.344-351.6: FOGG, G. E., Algal cultures and phytoplankton ecology.University of Wisconsin Press.Londres,1965.175 p. GUILLARD, R. L., Symposium on Marine Microbiology.Organic sources of nitrogen for marine centric diatom. In: Oppenheimer C. H. (Ed.)Springfield,1963.93-104 p.I11., GuILLARD, R. L., Culture of Marine Invetebrate Animals. Culture of phytoplankton for feeding marine invertebrates. In: Smith, W. L. y M. H. Chanley (Eds.) Plenum Press. 29-60.Nueva York,1973. GRAAM, H. H., Bulletin, Studies on the biology and chemistry of the Gulf of Main. II. Distribution of the phytoplankton in August. Biol.1963.159-181.64: HANSEN, R. J. HARPER M. L. STONE G. M. WARD R. A. KiDD, Manure harvesting practices: effects on waste characteristics and runoff. Environmental Protection Technology Series.EPA/2-76-292,1976.1-104. HELLEBUST, J. A., Excretion of some organic compounds by marine phytoplankton. Woods Hole, Oceanographic Institution Massachusetts,1965.192-206.10(2): JOHNSTON, R., General Features. Seawater, the natural medium of phytoplankton. I. J. Alar. Biol. Ass U. K.,1936.247-456.43: KINNE, 0., Marine ecology,Wiley-Interscience.Londres,1976.578 p.3(1) LOOSANOFF, V. L. H. C. DAVIS, Advances in marine biology, Rearing of bivalve mollusks.1963.55-69.1: MATTHIESSEN, G. C. R. C. TONER, Possible methods of improving the shelIfish Industry of Martha's Vineyard, Duke's Country,Res. Found. Mass., IV + 138.Massachusetts, Mar.1966. McELROY, W. D. A. NANON, Mechanisms of action of micronutrients elements in enzime systems. Ann. Rev. Plant. Physiol.,1953.1-30. MIQUEL, P., De la Culture artificielle des diatornées. C. R. Acad. Sci.,Paris,1892.780.94: MOORE, J. A., Biología.Ed. Continental, S. A.,México, D. F.,1970.942 P. PAPADAKIS, J., Fertilizantes. Ed. Albatros.Argentina,1976.64 p PRATT, R. J. FONG, Studies on ChIorella vulgaris. III. Growth of ChIorella and changes in the hidrogenion and amoniumíon concentration in solutions containing nitrate and amonium nitrogen. Amer. Jour. of Botany,1940.73-742.27: PROVASOLI, L. J. J. J. McLAUGHLIN M. R. DROOP, The development of artificial media for marine algae.Arch. Microbiol.,1957.392-428.25: PROVASOLI, L. J. J. McLAUGHLIN, Limited heterotrophy of some photosynthetic dinoflagellate. Symp. on Marine Microbiol.,1963.105-113. SNEDECOR, G. W. COCHRAN., Métodos estadisticos.Compañía Editorial Continental.México,1980.703 p. SPENCER, C. P., Utilization of trace elements by marine unicelular algae. J. Mar. Biol. Ass. U. K.,1957.265-290.33: SPOTTE, S., Fish and Invertebrate Culture.Water Management in Closed Systems.Wiley-Interscience Publication.Nueva York,1979.179. WALNE, P. R., The culture of marine bivalve larvac. In:Physiology of Mollusca.Wilbury, K. M. y C. M. Yonge. (Eds.) Academic Press. Nueva York1964.206 p. L FOGG.
|

