|
CONSIDERACIONES BIOECOLÓGICAS DURANTE EL
CRECIMIENTO DE PHYCIS BLENNOIDES (BRUNNICH, 1768), EN EL MEDITERRÁNEO
OCCIDENTAL (PISCES: GADIDAE)
Trabajo recibido el 7 de diciembre de 1982 y
aceptado para su publicación el 15 de noviembre de
1983.
M. GALLARDO-CABELLO
Universidad Nacional Autónoma de
México, Instituto de Ciencias del Mar y
Limnología.
A. GUAL-FRAU
Instituto de Investigaciones Pesqueras,
Barcelona, España. Contribución 351 del Instituto de Ciencias del
Mar y Limnología,
UNAM.
En
el presente trabajo, se analizan las características del crecimiento
dePhycis blennoidesen el Mediterráneo Occidental, de
acuerdo a los distintos grupos de edad, periodicidad estacional, madurez
gonádica, alimentación y acumulación de sustancias de
reserva.
La proporción de sexos encontrada es de un
macho por cada hembra y la época de desove ocurre durante los meses de
julio y agosto. Los machos alcanzan su madurez sexual entre los 2 y 3
años, mientras que las hembras maduran a los 3 años. Existe una
estrecha relación entre la variedad de tallas en los diferentes grupos
de edad y el índice de diversidad de la dieta, ambos índices
alcanzan sus máximos valores durante las edades de 0 a 2 años y
en primavera. La acumulación de ácidos grasos en el hígado
aumenta proporcionalmente con respecto a la edad y es máxima durante la
primavera y el otoño. En el verano y a partir de los 3 años,
existe una marcada relación entre el consumo de grasas hepáticas
y el
desove.
This
paper deals data about, growth, gonadic development, spawning, feeding and
fattening for greater forkbeard (Phycis blennoides) in the
western Mediterranean Sea. Sex proportion is, one male for each female.
Spawning occurs mainly during July and August. Sexual maturity is reached
between 2 and 3 years for males, and 3 years for females. The increase in the
diet diversity index with respect to length variety for cach age group was
observed, both index reach their maximum values during spring for 0 and 2 age
groups. Fattening increases with age, reaching its maximum values during spring
and autumn. Fat acumulation is minimum during summer for sexual mature
individuals, existing a great relation between spawning and fat
consumption.
En el presente trabajo se realiza un análisis sobre las características del crecimiento de cada uno de los periodos del ciclo de vida dePhycis blennoidesen el Mediterráneo Occidental, en relación al patrón estacional, discutiendo rasgos de éste con respecto a la diversidad de la dieta, disponibilidad del alimento, competencia, fac tor de condición, índice de replección gástrica, desarrollo gonádico y acumulación de ácidos grasos. Aportándose por primera vez, datos sobre la época de desove, características morfométricas de las gónadas y proporción de machos y hembras de esta especie. MATERIAL Y MÉTODOSLos datos biológicos fueron obtenidos de un total de 5,397 ejemplares dePhycis blennoides (brótola) procedentes de los muestreos biológicos y de la captura comercial. De septiembre de 1976 a septiembre de 1978. Los ejemplares se obtuvieron frente a las costas de Cataluña (Mediterráneo Occidental) entre Blanes y Vilanova i la Geltrú en profundidades que oscilan entre 150 y 650 m. Los muestreos de la captura comercial se efectuaron varias veces a la semana y una vez al mes se realizó un muestreo biológico efectuando arrastres a distintas profundidades: el primero entre 150 y 300 m, el segundo entre 300 y 400 m y el tercero entre 400 y 600 m, utilizando para ello una red comercial (bou) con un copo de 35 mm y un sobrecopo de 10 mm de abertura de malla. Estos muestreos además de proporcionar gran cantidad de material de estudio, aportaron información de la fauna de acompañamiento Los ejemplares fueron separados de acuerdo con las profundidades con que fueron capturados y conservados en una cámara frigorífica a una temperatura de -10ºC. Los lotes de peces fueron estudiados en las 24 horas siguientes, de cada uno de ellos se consignaron en las hojas de muestreo los siguientes datos: fecha de la captura, caladero, profundidad y peso y número de la captura total, así como una serie de características morfométricas, ponderales y biológicas que se detallan a continuación. Cuando la captura era muy abundante se escogió una muestra al azar, en otras ocasiones en que el número de ejemplares fue menos numeroso se estudió la totalidad de la captura. Para obtener las mediciones se utilizó un ictiómetro IIP, colocándose el ejemplar sobre el costado derecho para determinar su longitud total, mientras que para obtener los pesos se recurrió a una balanza marca "Mobba" y a otra eléctrica marca "Kern". Para mediciones de mayor precisión se empleó un "pie de rey" marca "Sibur". Los datos obtenidos fueron los siguientes: 1) Longitud total: se midió al centímetro más próximo, desde la punta del hocico hasta el extremo final de la aleta caudal. 2) Peso: se determinó el peso total y desviscerado de cada ejemplar, con aproximación al gramo. 3) Sexo y estado de madurez gonádica: efectuándose un corte longitudinal desde el orificio anal hasta los arcos branquiales y separando las vísceras, quedan al descubierto las gónadas, pudiéndose determinar "in visu'' el sexo y el estado sexual del individuo. La escala utilizada para determinar la madurez sexual se explica en la sección correspondiente. También se obtuvo el peso de las gónadas con aproximación al gramo. 4) Estados de replección gástrica: los estómagos se clasificaron empleando cuatro criterios arbitrarios: (I) vacío; (II) con contenido estomacal poco abundante; (III) cuando este era muy abundante y (IV) estómagos avaginados. El coeficiente de replección gástrica se obtuvo dividiendo el número total de estómagos llenos entre el número total de estómagos, exceptuando los evaginados. 5) Peso del hígado. Para una estimación de la grasa adicional, se obtuvo el peso de este órgano para cada uno de los ejemplares con aproximación al gramo. RESULTADOS Y DISCUSIÓN
DESOVE
Características de las gónadas de Phycis blennoides De 1 170 ejemplares pertenecientes a tallas de 110 a 490 mm de longitud total, 480 fueron identificados como machos, 479 como hembras y 211 cuyo sexo no pudo ser determinado y que correspondían a individuos jóvenes en estadio virgen. La proporción de sexos encontrada es de un macho por una hembra (Tabla l). En la brótola,Phycis blennoides, las gónadas pueden ser diferenciadas sexualmente "a simple vista", cuando los ejemplares han alcanzado entre 160 y 170 mm de longitud total. Antes de esta talla las gónadas muestran un aspecto muy similar. 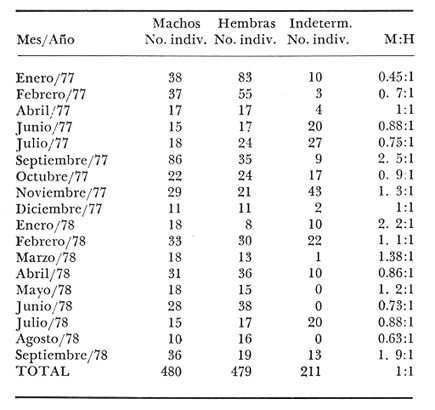 TABLA 1 PROPORCIÓN DE SEXOS Como en la mayoría de los peces los ovarios son de mayor tamaño que los testículos, cuando están maduros llegan a medir 65 mm y pesar 12 g en ejemplares de 280 mm de longitud total (Tabla 2). Mientras que los testículos de un macho maduro de esta misma talla miden 45 mm de largo y pesan 6 g. 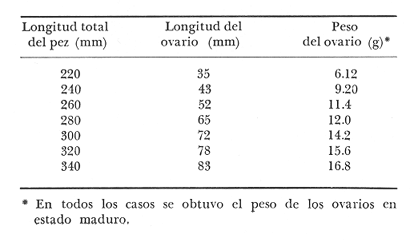 TABLA 2 RELACIÓN PESO LONGITUD DEL OVARIO DERECHO DE PHYCIS BLENNOIDES PARA CLASES DE TALLAS DE 220 A 340 MM DE LONGITUD TOTAL Generalmente el ovario derecho es unos milímetros mayor que el izquierdo. En los testículos no se observan diferencias en el tamaño de los mismos. Los ovarios son cilíndricos y cuando están maduros presentan un color grisáceo. La apariencia morfológica de éstos no representa diferencias apreciables con respecto a otros Gádidos (Vladykov, 1972). Los testículos son alargados y presentan un aspecto foliforme. Están divididos en pocos lóbulos de gran tamaño. VIadykov (op. cit.) establece 6 tipos de testículos entre los Gádidos en base a la cantidad y complejidad de los lóbulos que los forman, asociando estas características con el habitat (aguas dulces o marinas) temperatura y los requerimientos del desove. Llegando a la conclusión de que la estructura de los testículos es más compleja en los Gádidos que habitan en aguas marinas de temperaturas bajas, como son: Melanogrammus aeglefinus y Gadus morhua que en las especies de agua dulce o de habitat marino pero de temperatura templada como son: Lota lota, Urophycis chuss, Merluccius billinearisy otras especies más. Con respecto a las observaciones podemos decir que Phycis blennoides ocupa una posición intermedia entre los géneros Lota y Urophycis en base a las características morfológicas de estos órganos. La madurez sexual es alcanzada por los machos a una talla de 180 a 200 mm de longitud total. Como consecuencia de este fenómeno el crecimiento de los machos se detiene a una edad más temprana que en las hembras, GallardoCabello (1979). De lo que podemos concluir, que posiblemente los machos emplean una mayor cantidad de energía en la producción de los productos sexuales alcanzando más rápido una talla cercana a Loo. Mientras que las hembras de la misma edad emplean la mayor parte de la energía en el crecimiento, alcanzando una talla y longevidad mayor. Fenómeno común en los miembros de la familia Gadidae (Hickling, 1933; Nelson, y Larkins, 1970; Botha, 1971; Alvariño y Rodríguez, 1955 y Wheeler, 1969). Ciclo de madurez gonádica Homans y VIadykov, (1954); y Powles, (1958) reconocen seis estadios de madurez gonádica en los miembros de la familia Gadidae. En los estadios I y II las gónadas están poco desarrolladas y no muestran características morfológicas que nos permitan establecer una clara diferenciación entre estas dos fases. Los cuatro estadios de madurez gonádica restantes han sido tomados de Homans y VIadykov (op. cit.) como una definición general de los mismos, ya que las características de las gónadas varían considerablemente entre los diferentes géneros de Gádidos. Estadio 3. Apariencia de las gónadas. Inicio de la maduración. Las gónadas comienzan a desarrollarse activamente presentando pocos vasos sanguíneos. Testículos blanquecinos. Estadio 4. Profreza. Las gónadas están desarrolladas pudiéndose apreciar los vasos sanguíneos con claridad. Testículos blancos con brillo ligeramente nacarado. Estadio 5. Freza. Las gónadas están maduras de consistencia dura y firme. Ovarios con numerosos óvulos de los que algunos comienzan a hacerse translúcidos. Testículos de color blanco. Los vasos sanguíneos no son notables. Estadio 6. Periodo de postfreza. Las gónadas son fláccidas, con vasos sanguíneos prominentes sobre la superficie de los mismos. A menudo es difícil asignar a las gónadas un estadio de madurez determinado por lo que se han unido los estadios I y II formando el estadio II y los estadios IV y V formando el IV. De tal manera hemos considerado: I y II. II Reposo (utilizando también para designar a los individuos vírgenes) III. III Inicio de la maduración IV y V. IV Freza VI. V Postfreza En la figura 1 y en la Tabla 3 se muestran los porcentajes mensuales del número de machos y hembras en los distintos estadios de madurez gonádica. 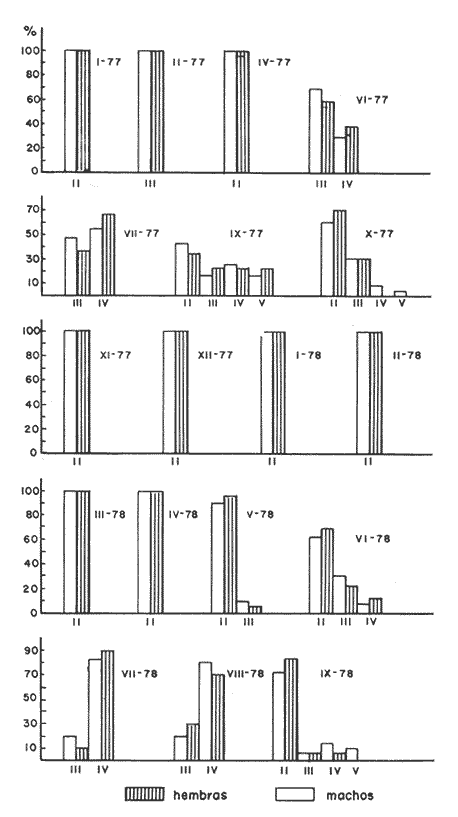 Fig. 1. Porcentajes mensuales de machos y hembras en los distintos estados de madurez gonádica. El estado de reposo se inicia durante el mes de noviembre prolongándose hasta el mes de abril. La maduración comienza durante los meses de mayo y parte de junio, es lenta al principio comenzando a acelerarse al acercarse la freza. De tal manera, que en pocos meses las gónadas están dispuestas para el desove que se inicia a finales del mes de junio, continuándose durante julio y agosto para finalizar en septiembre. La época de postfreza se presenta durante los meses de septiembre y octubre, siendo bastante rápida la recuperación de las gónadas. 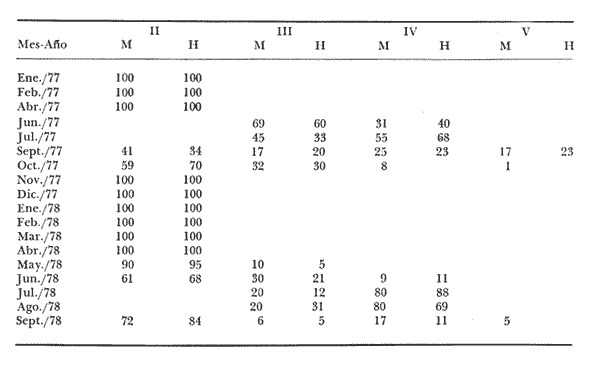 TABLA 3 PORCENTAJES MENSUALES DE MACHOS Y HEMBRAS EN LOS DISTINTOS ESTADIOS DE MADUREZ GONÁDICA En resumen, la puesta de la brótola se realiza principalmente durante los meses de julio y agosto. ALIMENTACIÓN Y DESARROLLO
Régimen alimenticio y su variación con respecto a la edad Los datos reales para el análisis del contenido estomacal de los ejemplares estudiados en el presente trabajo fueron proporcionados por E. Macpherson. La dieta presenta variaciones importantes a través de las tallas y edades escogidas. Durante las primeras etapas, edades 0 a 1 años, la dieta de Phycis blennoides está constituida principalmente por decápodos: Alpheus glaber, Calocaris mecandreae, Processa mediterranea y Goneplax rhomboides. Otros grupos presentan un elevado coeficiente de ocurrencia aunque su porcentaje en peso es bajo, como son: Isopoda (fam. Munnopsidae),Amphypoda, Polychaeta (fam. Aphroditidae) y Mysidacea (Pseudomma sp.) Peces comoAntonogadus megalokynodon y Lesueurigobius friesii, presentan un bajo coeficiente de ocurrencia. En los siguientes grupos de edad, 2 a 4 años, la base principal de la dieta siguen siendo los decápodos, aumentando la importancia de Al pheus glaber, Processa medíteranea, Goneplax rhomboides, Solenocera membranacea y Processa canaliculata. Disminuye el índice de ocurrencia de los Munnopsidae y aumenta el de los Cirolanidae con respecto a las edades anteriores, aunque el porcentaje en peso de ambas presas es bajo. El índice de ocurrencia de los Amphypoda, Mysidacea y Polychaeta decrece considerablemente en relación a los grupos anteriores. Los valores de los peces aumentan, principalmente:Antonogadus megalokynodon y Lesueurogobius friessii. Los juveniles de Phycis blennoides, aparecen en la dieta de estos ejemplares aunque los índices de frecuencia y porcentaje no son muy altos. En las edades superiores, 5 a 7 años, se observa que aumenta la importancia de Calocaris mecandreae, Goneplax rhomboides, Processa mediterranea y Pasiphaea multidentata, alcanzando sus mayores valores en estas edades. Dismi nuye la importancia deAlpheus glaber en relación a los grupos anteriores. Aumenta el coeficiente de ocurrencia de otras presas aunque su porcentaje es bajo, como ocurre conPontocaris lacazeii, ChIorotocus crassicornis, Medaeus couchi, Aristias neglectus, Cirolanidae, Aphroditidae y Amphypoda. La importancia de los peces en la dieta es mayor, principalmente, paraAntonogadus megalokynodon, Phycis blennoides y Engraulis encrasicholus. Para el análisis de las relaciones existentes entre la alimentación y el crecimiento del pez durante las diversas etapas de su desarrollo se ha obtenido el índice del factor de condición. El factor de condición fue expresado matemáticamente por Fulton (1902) de la siguiente manera: K=( P/L³) X 100 donde P, es el peso del pez, y L la longitud. Por medio de este coeficiente es posible definir los cambios de condición de los peces en relación a la edad, sexo y ciclo estacional y puede emplearse como un índice de productividad de las masas de agua (NikoIsky, 1963). En el cálculo del índice de condición propuesto por Fulton se emplea el peso total del pez, lo que puede producir ciertas desviaciones de los resultados deseados debido al peso de las gónadas y del estómago. Por lo que Clark (1928) sugirió el cálculo del factor de condición a partir del peso desviscerado. Algunos autores consideran que este método excluye también las grasas acumuladas en algunos órganos, las cuales están estrechamente relacionadas con la condición del pez y que son significativamente importantes en el estudio de la nutrición, siendo lo mejor el empleo de ambas técnicas. En las tablas 4, 5 y 6, se muestran los valores del factor de condición, calculados por los métodos de Fulton y Clark, en relación a las clases de tallas y grupos de edad. Ambos métodos resultaron adecuados, observándose que las proporciones que guardan los valores entre si para cada grupo de edad son muy similares, 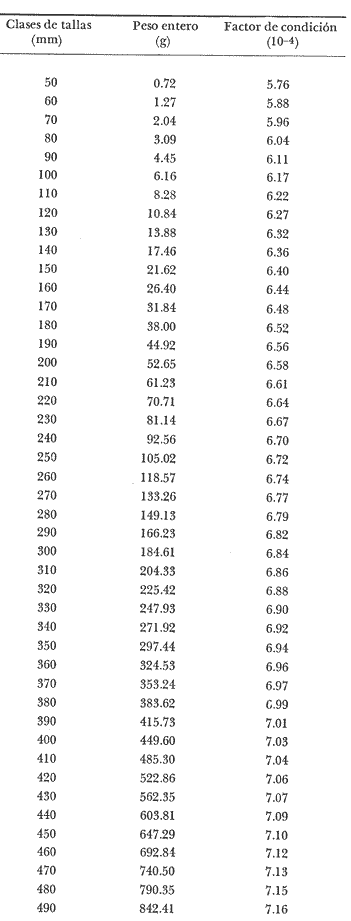 TABLA 4 RELACIÓN PESO-LONGITUD- FACTOR DECONDICIÓN 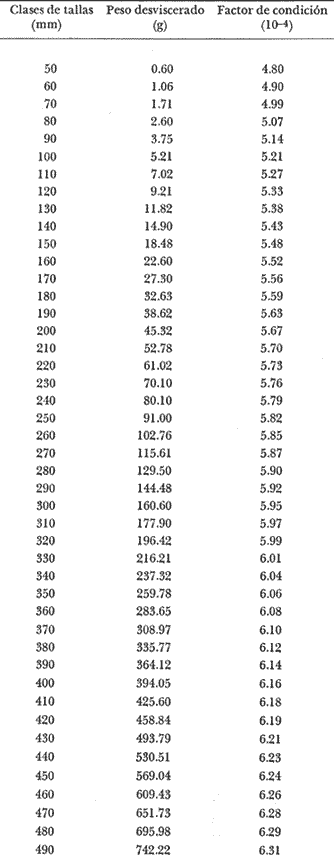 TABLA 5 RELACIÓN LONGITUD - PESO DESVISCERADO-FACTOR DE CONDICIÓN. (INDICE DE CLARK) 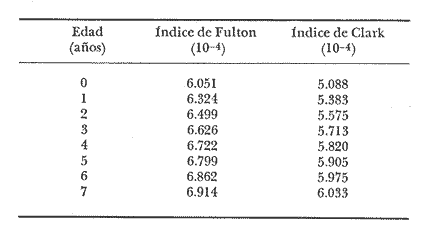 TABLA 6 RELACIÓN EDAD-FACTOR DE CONDICIÓN 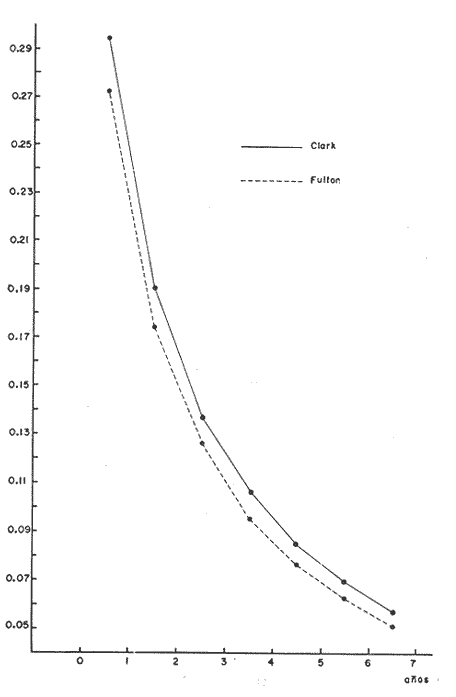 Fig. 2. Relación edad-factor de condición. En la tabla 6 y en la figura 2 se observa que el incremento del valor del factor de condición disminuye a través de la edad. De lo que puede concluirse que el crecimiento de Phycis blennoides durante las primeras fases de su desarrollo, es un crecimiento rápido en longitud con lo cual posiblemente evite una mayor depredación por parte de otras especies de mayor talla y le dé una mayor capacidad de competencia intraespecífica e interespecífica. En la mayoría de los peces durante las primeras etapas del desarrollo y antes de alcanzar la madurez, la mayor parte del alimento ingerido es empleado en la síntesis de proteínas para el crecimiento. Durante este periodo los peces estan más estrechamente relacionados con la abundancia del alimento que en etapas posteriores, debido a una mayor demanda energética para el crecimiento. Variaciones estaciones en la composición de la dieta. Durante el ciclo estacional y a través de los grupos de edad, se observan algunas diferencias importantes en la variedad del régimen alimenticio dePhycis blennoides. Para un análisis más detallado de este fenómeno se obtuvo el índice de diversidad de la dieta por edades y estaciones, aplicando la fórmula de Levins (1968) la cual viene expresada por la siguiente ecuación: B=1/σPi² donde σPi² es la sumatoria de los cuadrados de la frecuencia relativa de las especies. A continuación (Tabla 7), se muestran los resultados obtenidos para las frecuencias relativas en número (Bn) y peso (Bp). El índice de diversidad en numero de componentes de la dieta alcanza sus mayores valores durante la primavera, debida a la presencia de algunas especies que no se presentan durante las otras estaciones, como es el caso de especies de Amphypoda, Copépoda, Eufausiácea, Isopoda y Mysidacea, que son consumidos principalmente por los juveniles de brótola, que en esta época se incorporan al área de pesca. Aunque el porcentaje en peso de estas presas, es bajo, se presentan con frecuencia en el contenido estomacal. La aparición de juveniles dePhycis blennoides en el contenido estomacal de los adultos, ocurre durante este periodo en que los individuos pequeños que se han reclutado al área, cuentan con ocho meses de edad y son más fácilmente depredados por los adultos. Durante el verano, el índice de diversidad disminuye, los índices de frecuencia de ocurrencia y porcentaje aumentan paraPasiphaea sivado y P. multidentata., coincidiendo con la éPoca de mayor abundancia de estos decápodos, señalada por Franqueville (1971). Aumenta la importancia deGoneplax rhomboides con respecto a la estación anterior. El índice de diversidad aumenta durante el otoño con respecto a la estación anterior. Los individuos de 2 a 4 años muestran una dieta más variada que los otros grupos de edad, tanto en número de especies como en porcentaje. En las tallas 60-250 mm, aumenta la importancia deAlpheus glaber, Processa mediterranea, Solenocera membranacea y Macropipus depurator, para los decapodos; y Deltentosteus cuadrimaculatus, Engraulis encrasicholus y Lesueurogobius friesiipara los peces.  TABLA 7 VALORES DEL ÍNDICE DE DIVERSIDAD EN NÚMERO (Bn) Y PESO (Bp) DE LA DIETA DE PHYCIS BLENOIDES En el invierno disminuye el índice de diversidad. En los ejemplares de 60 a 250 mm, aumenta la importancia de Calocaris mecandreae, y Alpheus glaber. En las tallas superiores la dieta está constituida principalmente por Calocaris mecandreae, Processa mediterranea y Goneplax rhomboides. Los peces sólo aparecen en los ejemplares de 160-250 mm. Los periodos de mas activa alimentación corresponden a la primavera y al otoño, época en que el índice de diversidad es mayor con respecto a las demás estaciones. En la Tabla 8 y en la figura 3, se muestran los valores del factor de condición e índice de repleción gástrica.  TABLA 8 FACTOR DE CONDICIÓN E ÍNDICES DE REPLECCIÓN Y DIVERSIDAD POR ESTACIONES Durante la primavera, se alimenta más activamente presenta una dieta más variada y es durante este periodo cuando el crecimiento es más intenso, como puede verse en la figura 3. En el verano la dieta es menos variada y el indice del factor de condición decrece, lo cual está asociado en los individuos adultos a la época de desove en que el desgaste corporal es muy grande y su peso disminuye considerablemente. En el otoño, se presenta un segundo periodo de activa alimentación durante el cual aumentan los índices de diversidad, condición y replección gastrica. El peso de los individuos se incrementa y constituye una epoca de recuperación para la población frezante. Esta época podría relacionarse con una mayor disponibilidad de alimento debido a la ruptura de la termoclina y el consecuente aumento de la productividad en el mar (Margalef, 1967). Durante el invierno los valores descienden en relación a los meses anteriores, posiblemente por un decrecimiento de la productividad asociado a cambios en el fotoperiodo y otros parámetros abióticos. 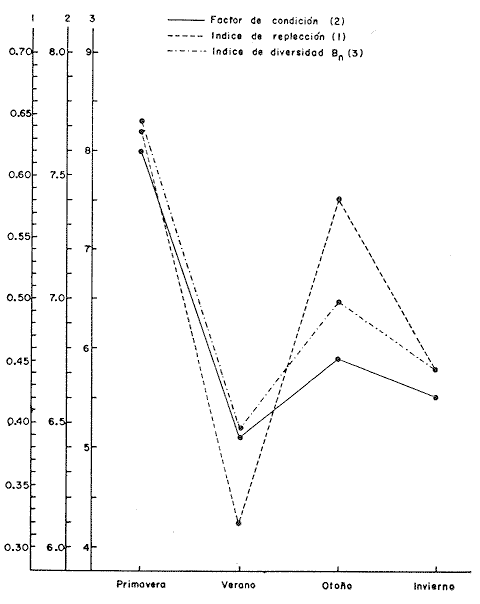 Fig. 3. Relación factor de condición e indices de replección gástrica y diversidad por estaciones. Durante la primavera, los juveniles de Phycis blennoidesmuestran un elevado índice de diversidad en la dieta alimenticia. Esta tendencia hacia una mayor eurifagia durante las primeras fases del desarollo, provee de una máxima utilización de la comida disponible, la cual se empleará en un rápido crecimiento que disminuirá el efecto de los depredadores y les proporcionará una mayor capacidad en las relaciones de competencia con otras especies. Por otra parte, en los mares templados, las variaciones de los factores abióticos y los descensos en la producción conducen a una escasez del alimento durante ciertas epocas del año, por lo que la adaptadon a un rango de alimento restringido puede ser una causa de una mayor mortalidad en los peces jóvenes. Una adaptación importante es la variedad de tallas en individuos de una misma edad, lo que incrementa la diversidad de la dieta, cuando la disponibilidad del alimento decrece. Las hembras pueden llegar a depositar huevos de diferente tamaño, o bien en diferentes periodos de la estación de freza cuando el alimento escasea. De esta manera, los juveniles que eclosionan antes se alimentan de un tipo de organismos y los que eclosionan después de otro tipo de alimento. En la Tabla 9 se presenta el rango de variabilidad de tallas para cada edad, expresado como la desviación standard (Gallardo-Cabello, 1979) y el índice de diversidad de la dieta, obtenido por medio de la aplicación de la ecuación de Levins (1968). 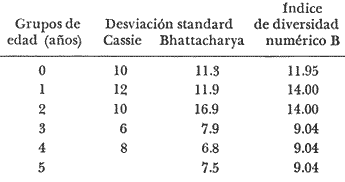 TABLA 9 RELACIÓN ENTRE EL RANGO DE TALLAS Y EL ÍNDICE DE DIVERSIDAD Como puede observarse, existe una estrecha relación entre la variedad de tallas en los gru pos de edad y el índice de diversidad. Las diferencias en la velocidad del crecimiento de unos individuos con respecto a otros es importante porque proporciona un amplio rango de variación en la dieta. También es importante señalar, que las diferencias en el crecimiento de los individuos de un grupo de edad determinado, pueden ser debidas a la disponibilidad del alimento. La abundancia del alimento provoca menores variaciones en la dieta de los individuos de una población. Cuando éste escasea, el rango de alimento se vuelve mas amplio y los individuos adultos llegan a depredar sus propias crías, fenómeno que se presenta en la brótola. Acumulación de ácidos grasos en el hígado. La acumulación de ácidos grasos en diferentes organos constituye un factor importante en el estudio de la nutrición de los peces a través de su ciclo de vida. Los lípidos que están formados principalmente por ácidos grasos no saturados, son empleados en los gastos metabólicos diarios. Mientras que las grasas constituidas principalmente por ácidos grasos saturados, son depositados, formando un material de reserva. El método más exacto para determinar el contenido graso, es el análisis químico, pero también pueden emplearse técnicas más simples. Las grandes cantidades de ácidos grasos que se acumulan durante el periodo alimenticio, puede expresarse como el porcentaje en peso del órgano que contiene la grasa con respecto al peso total del pez. Los cambios de este coeficiente reflejan las variaciones del contenido total de grasas acumuladas por el pez. En los miembros de la familia Gadidae, los ácidos grasos saturados se acumulan principalmente en el hígado, cabeza y una pequefia cantidad en el músculo, siendo difícil encontrarlos alrededor del intestino (Nikolsky, 1963). En el estudio de la acumulacion de ácidos grasos hepáticos enPhycis blennoides se determinó el peso del hígado de 2 000 ejemplares correspondientes a tallas de 80 a 490 mm de longitud total, a traves de un ciclo anual. Se calcularon los pesos medios del hígado para cada clase de tallas y se obtuvo la relación alométrica entre estas dos series de datos, por medio del método de minimos cuadrados. La fórmula de regresión encontrada es la siguiente: 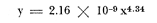 donde y representa el peso del hígado y x la longitud del pez. El índice de correlación es de 0.93. En la Tabla 10, aparecen los resultados obtenidos. La relación logarítmica entre la talla y el peso del hígado, se muestra en la figura 4. La relación es rectilinea con una extraordinaria pendiente, las ligeras inflexiones que pueden apreciarse tanto pueden ser debidas a fenómenos alometricos como a desviaciones en las estimaciones de los parámetros, por lo que no es posible hablar de fenómenos alométricos evidentes.  TABLA 10 RELACIÓN LONGITUD TOTAL DEL PEZ-PESO DEL HÍGADO El valor del índice alometrico, k = 4.34, muestra una fuerte tendencia hacia una alometría positiva, lo cual indica, como se confirmará a continuación, un incremento en el desarrollo del hígado a través del ciclo de vida de la brótola asociado a la primera puesta. Existen grandes variaciones en el contenido de ácidos grasos en el hígado, que dependen de la edad y de los cambios estacionales. Estos últimos estrechamente relacionados con el ciclo alimenticio y el periodo reproductor. En la tabla 11, se muestran las distribuciones de los pesos de los hígados, como porcentajes del peso total del pez en relación a la edad y al ciclo estacional. 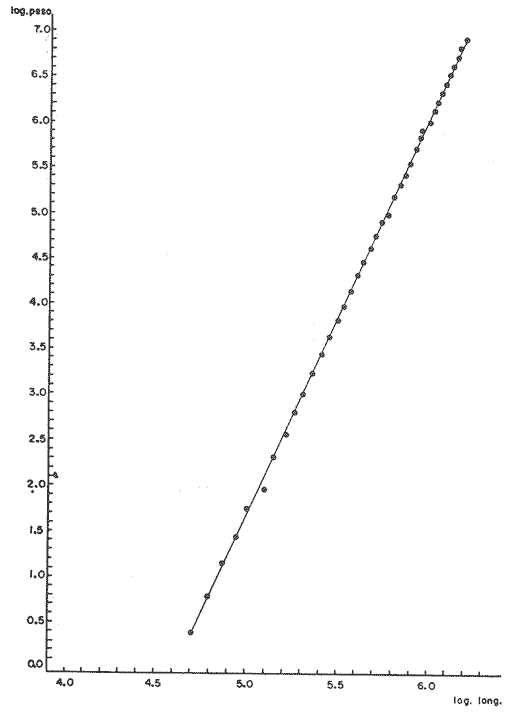 Fig. 4. Relación logaritmo del peso del hígado y de la longitud del pez Durante el verano y a partir de los tres afios, edad media en que la brótola efectúa su primera puesta, se observa una marcada relación entre el consumo de la reserva de grasas hepáticas y el desove, de tal manera que, a medida que tiene lugar la freza existe un desgaste de los acidos grasos acumulados, al finalizar esta época se observa una reposición de las reservas relacionada con un periodo de activa alimentación que tiene lugar durante el otoño. La alimentación decrece durante el invierno, por lo que el contenido graso disminuye, como se observa en la mayoría de los grupos de edad. Finalmente, la reserva hepática en grasas es máxima durante la primavera, coincidiendo con el periodo de máxima alimentación. 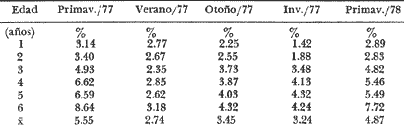 TABLA 11 RELACIÓN EDAD-PESO DEL HÍGADO POR ESTACIONES Los peces jóvenes (edades 1 a 2 aflos) no presentan cambios estacionales tan marcados en comparación con los adultos debido a su inmadurez sexual. Sin embargo, se observa una disminución en el contenido graso a partir de finales de la primavera, lo cual puede estar relacionado con una disminución del alimento, o con un ritmo metabólico característico de esta especie. Con el objeto de analizar las relaciones existentes entre el índice de reservas grasas, con respecto al crecimiento lineal, desarrollo gonádico e índice de nutricion, a través de los grupos de edad se ha elaborado la Tabla 12 y la figura 5. Puede observarse, que durante el desarrollo de las primeras etapas (edades 0 a 3 años) la tasa de crecimiento lineal alcanza sus mayores valores, asociado con una mayor alimentación, las gónadas inician su diferenciación y desarrollo, y comienza la reserva de ácidos grasos en el hígado. De lo que se concluye que en los individuos jóvenes, la mayor parte del alimento ingerido se emplea en la formación de proteínas y por consecuencia en el crecimiento en longitud. 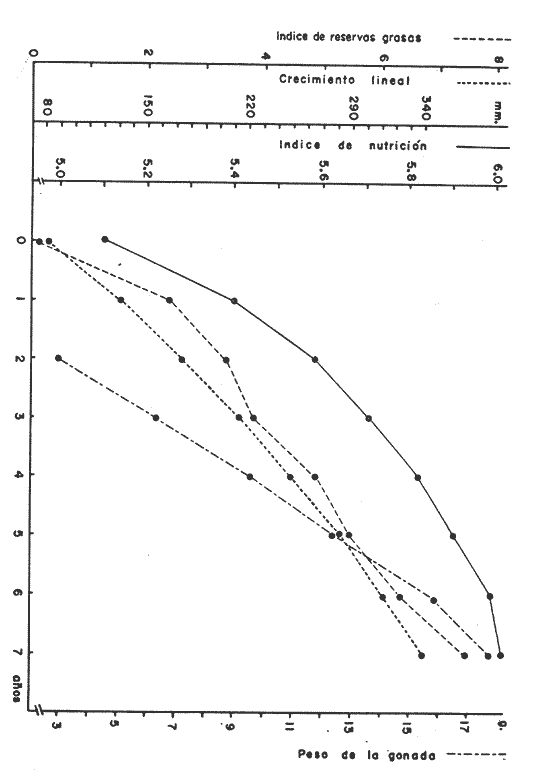 Fig. 5 Relación edad, índice de reservas grasas, crecimiento y desarrollo gonádico. 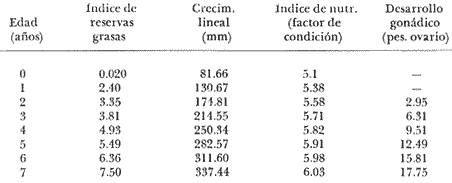 TABLA 12 En los adultos, el crecimiento lineal decrece y el alimento es empleado para el desarrollo y la maduración gonadicas, el crecimiento en peso y sustancias de reserva para el desove. ConclusionesLa proporción de sexos encontrada es de un macho Por una hembra. La época de desove es en julio y agosto. Los machos alcanzan la madurez sexual entre las tallas 180 y 200 mm de longitud total (entre 2 y 3 años) . Mientras que las hembras maduran entre los 220 y 230 mm de longitud total (a los 3 años) . El crecimiento lineal es mayor durante la primavera y el otoño, época en que esta especie se alimenta más intensamente. El periodo de mayor crecimiento lineal ocurre durante las edades de 0 a 3 años, antes de la madurez sexual. El incremento del valor del factor de condición disminuye a través de la edad. El crecimiento de esta especie durante las primeras fases de su desarrollo es un crecimiento rápido en longitud. A través de los grupos de edad, esta especie presenta diferencias importantes en la variedad del régimen alimenticio durante el ciclo estacional. El índice de diversidad en número de componentes de la dieta es mayor durante la primavera que en el resto del año, debido a la presencia de algunas especies que no se presentan durante las demás estaciones y que son consumidos principalmente por los juveniles de brótola, que en dicha época se incorporan al área de pesca. Los periodos de más activa alimentación coinciden con las épocas en que es mayor el índice de diversidad de la dieta. La aparición de juveniles de brótola en el contenido estomacal de los adultos, ocurre durante la primavera, periodo en el cual los individuos pequeños se incorporan al área de pesca. Existe una estrecha relación entre la variedad de tallas en los diferentes grupos de edad y el índice de diversidad de la dieta. Estos dos índices alcanzan sus máximos valores durante las edades de 0 a 2 años. La acumulación de ácidos grasos en el hígado aumenta proporcionalmente con respecto a la edad. La reserva hepática en grasas es máxima durante la primavera y el otoño, coincidiendo con los periodos de máxima alimentación. Durante el verano y a partir de los tres años, edad media en que la brótola,efectúa su primera puesta, existe una marcada relación entre el consumo de grasas hepáticas y el desove. Conforme tiene lugar la freza existe un desgaste de los ácidos grasos acumulados. AgradecimientosA Ramón Margalef, catedrático de Ecología de la Universidad Central de Barcelona, por la revisión del presente trabajo. A Enrique Macpherson y a Conchita Allué, miembros del gru po de Recursos del Instituto de Investigaciones Pesqueras de Barcelona, por su cooperación en la realización del mismo. A Alfredo Laguarda Figueras, por su apoyo y estímulo para la publicación del presente trabajo. LITERATURAALVARIÑO, A.O. RODRIGUEZ, La merluza, el bacalao y especies afines.Publ. Inst. Esp. Ocean.,1975.125-1271: . BOTHA, L., Growth and otolith morphology of the Cape hakes. Merluccius capensis y M. paradoxus.Investl. Rep. Div. Sea Fish. S. Aft.,1971.1-32.97: CLARK, F., Bull., The weigth-length relationship of the Californian sardine (Sardina coerulea) at San Pedro.Fish. U. S.,1928.22-44.12: FRANQUEVILLE, C., Tethys, Macroplancton profond (Invertebres) de la Mediterrane Nord-Occidentale.1971.11-56.3(1): FULTON, T., Rate of growth of sea-fishes.Sci. Invest. Fish. Div. Scot. Rept.,1902.1-22.20: GALLARDO-CABELLO, M., Tesis doctoral Caracteristicas biol6gicas de Phycis blennoides (Brunnich, 1768) con especial referencia a algunas modificaciones debidas al efecto de la explotación pesquera.Universidad Central de Barcelona,España.1979.420 p. HICKLING, C. F., The natural history of the hake. Part 4.Age determination and the growth rate. Fishery Invest. Lond. Ser. 2,1933.1-120.13:(2): HOMANS, R. E. S. V. D. VLADYKOV, Relation between feeding and the sexual cycle of the haddock. J. Fish. Res. Bd.Canada,1954.535-542.11: LEVINS, R., Eevolution in Changing Environments.The theory of the niche: 39-66 In:Robert H. Macarthur (Ed.)Princeton University Press.1968.120 p. MARGALEF, R. J. CASTELLVI, Fitoplancton y producción primaria de la costa catalana,Inv. Pesq.,1967.491-50231(3):de julio de 1966 a julio de 1967.. NELSON, M. 0. H. A. LARKINS, A synopsis,Distribution and biology of the Pacific hake:Circ. Fish. Widl./Serv., Wash.,1970.23-33.332: NIKOLSKY, G. V., Biological basis of mathematical simulation of fish population dynamics. Vopr. Ikhtiol.,1963.1-29.3(4): POWLES, P. M., Studies of reproduction and feeding of Atlantic cod (Gadus callarias) in the southwestern Gulf of St. Lawrence.J. Fish. Res. Bd.Canada,1958.1383-1402.15: VLADYKOV, V. D., Morphological Differences in Male Gonads among nine genera of Gadidae (Pisces). J. Fish. Res. Bd.Canada,1972.1709-1716.29(12): WHEELER, A., The Fishes of the Brittish Isles and N. W.Mighigan State Univ. Press.Europa.1969.613 p.
|

