|
ECOLOGÍA, BIOLOGÍA Y DINÁMICA
DE LAS POBLACIONES DE BAIRDIELLA CHRYSOURA EN LA LAGUNA DE TÉRMINOS, SUR
DEL GOLFO DE MÉXICO. (PISCES: SCIAENIDAE)
Trabajo presentado en
"The Fourth Congress of European Ichthyologist" septiembre 20-24 de 1982,
Hamburgo, Alemania Federal. Recibido el 15 de agosto de 1983 y aceptado para su
publicación el 8 de noviembre de
1983.
PIERRE CHAVANCE
Station Marine d'Endoume, Marseille,
France.
DOMINGO FLORES HERNÁNDEZ, ALEJANDRO YÁÑEZ-ARANCIBIA, FELIPE AMEZCUA LINARES
Universidad Nacional Autónoma de
México, Instituto de Ciencias del Mar y Limnología, Laboratorio
de Ictiología y Ecología Estuarina. Contribución 302 del
Instituto de Ciencias del Mar y Limnología, UNAM, Proyecto UNAM-CONACYT,
QCMACFR-001698.
La
corvinaBairdiella chrysoura es una especie típica
estuarina que se encuentra todo el año dentro de la Laguna de
Términos. El 50% de los especímenes se capturaron en un rango de
salinidad de 10 a 30 ppm. Importantes fluctuaciones en la abundancia son
causadas por los movimientos reproductores de los adultos hacia los sistemas
fluvio-lagunares de enero a mayo durante la época de secas y por el
reclutamiento de los juveniles que arriban a la laguna de julio a octubre en la
época de lluvias. La corvina es carnívora y se alimenta
principalmente de peces juveniles y crustáceos. La maduración
sexual se lleva a cabo de noviembre a julio, pero es más intensa de
febrero a abril. Las hembras representan aproximadamente el 67% de la
población adulta, pero la proporción sexual varía a lo
largo del año y según la talla sugiriendo que las migraciones
reproductoras hacia los sistemas fluvio-lagunares afectan ambos sexos. La
primera madurez ocurre cuando los peces alcanzan entre 100 y 104 mm de longitud
patrón, que corresponde a 5 meses de edad. La fecundidad individual
absoluta está relacionada a la longitud patrón (mm) por la
ecuación: F = 4.29 X
lO-4LP3.8. Del estudio de
crecimiento por distribución de frecuencias de talla mensualmente y por
marcas de crecimiento diario en otolitos se obtuvieron los valores de las
constantes del modelo de crecimiento de von Bertalanffy las cuales son: K =
0.26, Loo = 163 mm y to = 1.02
por mes. La corvina tiene una longevidad de 13 meses. La curva de captura
indica una alta mortalidad para especímenes entre 6 y 11 meses de edad,
Z = 1.89 (mes), pero ésta puede estar sobrestimada ya que las
migraciones fuera del área de muestreo afectan notablemente la
composición de la captura. Las estimaciones del número de peces y
de biomasa en la Laguna de Términos fueron de 23 x
106 y 500 toneladas métricas
respectivamente.
The
silver perchBairdiella chrysoura is a typical estuarine
species which can be found all-year-round in Terminos Lagoon. Fifty percent of
the specimen were captured with the salinity range of 10 to 30 ppt. Important
fluctuations in the abundance are caused by the reproductive movements of the
adults towards the fluvio-lagoon systems from january to May, during the dry
season and by the recruitment of the young that arrive at the lagoon from july
to October during the any season. The silver perch is carnivorous and it feed
principally on young fishes and crustaceans. Its sexual maturity is completed
from November to july, but is more intense from February to April. The females
represent approximately 67% of the adult population, but the sexual proportion
varies during the season of the year, depending on the size suggesting that the
reproductive migrations towards the fluvio-lagoon systems affect both sexes.
The first maduration occurs when the fishes reach the size of 100 to 104 mm SL,
which corresponds to 5 months of age. The fertile individual absolute is
related to the standard lenght (mm) by the equation: F + 4.29 X
10-4SL3.8. From the study
of growth per distribution of frequencies of monthly size and for daily growth
marks in otoliths, constant values have been obtained of the growth models of
von Bertalanffy which are: K = 0.26, Loo = 163 mm and
to = 1.02 per month. The silver perch has a maximum age
of 13 months. The capture curve indicates a high mortality for species between
6 to 11 months of age, Z = 1.89 (month) , but it can now be overestimated that
the migrations outside the sampling area notably affect the composition of the
capture. The number estimates of fishes and the biomass in Terminos Lagoon were
23 X 106 and 500 metric tons
respectively.
Los ecosistemas lagunares tropicales se caracterizan por poseer una alta complejidad de habitat, con altos índices de diversidad biológica y productividad. Debido a estos factores, la comprensión de dichos ecosistemas requiere de estudios multidisciplinarios que deben ser integrativos para su mejor conocimiento, manejo y uso racional. Se sabe que éstas áreas son utilizadas por especies tanto marinas como salobres en alguna etapa de su vida y con diferentes necesidades. Muchas de estas especies, constituyen un recurso potencial o en explotación. México cuenta con una extensa superficie de ambientes lagunares estuarinos, de los cuales 12 555 km² son lagunas costeras. La Laguna de Términos en el estado de Campeche, es la de mayor volumen en la república y se encuentra en una zona de intensa actividad pesquera e industrial, lo cual la coloca en una situación prioritaria en cuanto a necesidades de evaluación ecológica de sus recursos. Las comunidades de peces en el ecosistema juegan un papel ecológico muy importante en la transformación, intercambio, almacenamiento y regulación energética (Yáñez-Arancibia y Nugent, 1977). Además constituyen una fuente de alimentación humana muy grande. Esto parece ser de relevancia particular en la Laguna de Términos, por cuanto el análisis ecológico del sistema, ha permitido precisar diferentes habitat en la Laguna de Términos, donde las relaciones ecológicas interhabitat están reguladas por las poblaciones de peces. Las especies dominantes de vertebrados e in vertebrados son claves para el entendimiento más profundo de la ecología lagunar. Algunas de éstas han adoptado diversas estrategias a las que deben su éxito en la utilización de los habitat lagunares. Para tener un conocimiento más analítico de la ecología de las comunidades de peces, así como una mejor evaluación del potencial pesquero y sus mecanismos de producción, se requiere conocer los diferentes aspectos biológicos de especies dominantes que pueden ser de importancia ecológica y/o económica. OBJETIVOSLa corvinaBairdiella chrysoura por su amplia distribución y frecuencia, así como valores de biomasa, es una de las especies críticas del área y representa un recurso pesquero potencial; haciéndose necesario profundizar el conocimiento de su biología y dinámica poblacional por lo que se plantean los siguientes objetivos: 1. Caracterizar la distribución y abundancia de la especie durante un ciclo anual en la Laguna de Términos. 2. Determinar la distribución y abundancia en relación a los parámetros abióticos. 3. Determinación del espectro trófico con base a su alimentación y hábitos alimenticios. 4. Análisis de la reproducción con base a varios aspectos como: época de reproducción, talla de primera madurez, proporción de sexos, dinámica del desove y fecundidad. 5. Obtener la ecuación de la relación talla/peso y determinar los cambios en la condición de la población. 6. Determinar edad y crecimiento y obtener las constantes del modelo de von Bertalanffy. 7. Calcular la mortalidad de la población. ANTECEDENTESDiferentes publicaciones sobre estudios ecológicos de peces de la Laguna de Términos reportan aBairdiella chrysouracomo componente de la comunidad para diferentes habitat del área. Es conveniente mencionar a Bravo-Núñez y Yáñez-Arancibia (1979) que caracterizan el habitat y la comunidad de peces en la Boca de Puerto Real; Amezcua Linares y Yáñez-Arancibia (1980) estudiaron las interacciones del habitat y la comunidad de peces de los sistemas fluviolagunares; Vargas Maldonadoet al. (1981) analizan la ecología de las comunidades nectónicas asociadas a manglar y pastos marinos; otros aspectos fueron estudiados por Yáñez-Arancibia et al. (1980) quienes integran una discusión ecológica de la laguna y la influencia de las comunidades de peces en el ecosistema; Yáñez-Arancibiaet al. (1981) categorizan preliminarmente a la especie como consumidor de segundo y tercer orden; Yáñez-Arancibia et al. (1982a) la señalan como una especie dominante en el ecosistema global de la Laguna de Términos. Estos trabajos han permitido establecer la ecología funcional del sistema a nivel de comunidades de peces, resaltando que las especies dominantes son la clave para conocer más analíticamente la ecología de cada habitat y del ecosistema en general, puesto que son los principales reguladores de los cambios energéticos del ecosistema. No obstante que B. chrysouratiene un lugar preponderante no ha sido estudiada en los ecosistemas costeros del Golfo de México. Los trabajos efectuados sobre la familia Sciaenidae son muy numerosos y variados, ya que la mayoría de sus integrantes además de ser ecológicamente importantes, constituyen un gran recurso económico. Como ejemplo de esto, se puede mencionar a las especies Cynoscion nebulosus, C. regalis, C. nothus, C. arenarius, Menticirrhus saxatilis., Micropogonias undulatus, M. furnieri, y otros, razón por la que estas especies son estudiadas intensamente en las costas del Océano Atlántico. B. chrysoura, sin embargo, ha sido reportada frecuentemente en diversos trabajos donde además de los antes mencionados para la Laguna de Términos cabe citar a Reséndez (1970), Chávez (1972), Sánchez (1977) y Barba Torres y Sánchez Robles (1981) quienes la señalan como componente comunitario en las costas mexicanas del Golfo de México; Chávez además hace indicaciones acerca de la época de reproducción. Otros autores como Subrahmanyam y Drake (1975), Livingstonet al. (1978), Weinstein (1979) y Subrahmanyam y Coultas (1980) se refieren a B. chrysouracomo componente comunitario para diferentes estuarios de los Estados Unidos. Johnson (1978) determina varios aspectos de la reproducción de la especie y señala diversas referencias que tratan sobre el mismo tema para diferentes estuarios en la costa del Océano Atlántico y Golfo de México de los Estados Unidos. La alimentación y relaciones tróficas han sido estudiadas por Darnell (1958), Levine (1977-78), ambos en el lago Pontchartrain, Louisiana, E.U.A., Odum y Heald (1972) en Everglades, Florida, E.U.A., Carr y Adams (1973) en Crystal River, Florida y Sheridan y Livingston (1979) en el estuario de Apalachicola, Florida, Yáñez-Arancibiaet al.(1982b) en comunidades deThalassiaen Puerto Real., Laguna de Términos. En otros trabajos se han estudiado grupos de Sciaenidae desde un punto de vista biológico más amplio. Tales son las contribuciones de Springer y Woodburn (1960) que estudiaron la ecología, reproducción y alimentación de los peces de la bahía de Tampa, Florida, Chao y Musick (1977) que estudiaron el desarrollo, hábitos alimenticios y morfología funcional de juveniles en York River, Virginia, E.U.A. Muchas referencias más acerca de la ecología y aspectos biológicos de la familia en general y de B. chrysouraespecíficamente, pueden encontrarse en estos trabajos y otras referencias en ellos citadas. Del análisis de esta literatura se refuerza la importancia biológica, ecológica y económica de la familia en los ecosistemas costeros, así como se hace evidente los pocos estudios biológicos que hay de B. chrysoura en la Laguna de Términos. ÁREA DE ESTUDIOLa Laguna de Términos se localiza en el sur del Golfo de México, frente a la Sonda de Campeche (Fig. l). Es un área somera, con una profundidad promedio de 3.5 m y ± 1567 km² de superficie. El clima es tropical húmedo con rangos de precipitación anual de 1 100 a 2 000 mm. El rango de mareas fluctúa entre 0.5 y 0.7 m. Se comunica al mar por medio de dos bocas: la de Puerto Real al oriente y la de El Carmen al occidente. El sur de la laguna recibe la descarga de varios ríos y arroyos, siendo los más importantes por su volumen los ríos Palizada, Chumpam y Candelaria. Existe un flujo neto de agua hacia el oeste, causado por los vientos predominantes del este, la corriente litoral y la descarga de los ríos. Por este patrón de circulación se presenta un gradiente semipermanente de salinidad, turbidez, niveles de nutrientes, tipos de sedimentos, asociaciones de foraminíferos y de macrobentos, y migraciones de peces y camarones.  Fig. 1. Localización de la Laguna de Términos, Camp. Se señalan los rasgos geográficos y toponímicos principales. La ubicación de los diferentes hábitat ecológicos. Se destaca la dirección del flujo neto de las aguas y la zona de pastos marinos que indican áreas de alta influencia marina. Se muestran los cuatro sistemas fluvio-lagunares asociados a la laguna (tomado de Yáñez-Arancibia et al. 1980). Los números indican las estaciones de colecta de parámetros ambientales y comunidades de peces. Hay tres épocas climático-meteorológicas: la época de lluvias de junio a septiembre, la época de "nortes" o tormentas de invierno de octubre a enero y la época de secas de febrero a mayo. Las cuales determinan las condiciones hidrológicas del ecosistema y la distribución de las comunidades (Yáñez-Arancibiaet al. 1980 y 1983). Existe una gran diversidad de ambientes estuarinos (subsistemas o habitat) en la laguna, incluyendo pantanos de manglar salobre y de baja salinidad, pastos marinos, pastos de pantanos, áreas de alta sedimentación, arrecifes de ostión y la cuenca central salobre. Se presentan dos fuentes de sedimentos en la laguna: sedimentos terrígenos acarreados por la descarga de los ríos y sedimentos calcáreos provenientes de las playas del este de la laguna (Phleger y Ayala-Castañares, 1971). Predomina la influencia marina al norte y noreste de la laguna. La química de los nutrientes en la laguna está determinada por la circulación, flujo de los ríos y la biología del estuario. La salinidad y el aporte fluvial son los principales factores que controlan el fósforo y las formas oxidadas del nitrógeno inorgánico durante la estación de lluvias. Durante la época de secas la concentración de compuestos inorgánicos parece estar correlacionada con las condiciones locales como la turbulencia, tipo de sedimentos, tasa reductora y actividad biológica (Yáñez-Arancibia et al. 1980). Tanto la productividad de los manglares como del fitoplancton son mayores en las áreas de influencia fluvial. La, sobresaturación de oxígeno en algunas áreas durante la época de lluvias también indica una producción neta. Comunidades béntica definidas se restringen a los diferentes habitat de la laguna y están controladas por la salinidad, aporte fluvial, turbidez y tipo de sedimentos (Day y Yáñez-Arancibia, 1982). El análisis de la afinidad de las poblaciones de peces muestra un alto grado de significancia estadística relacionado con los habitat dentro de la laguna. Hay un patrón de migraciones y/o colonización en la boca de Puerto Real extendiéndose posteriormente al interior lagunar. MATERIALES Y MÉTODOS
ACTIVIDADES DE CAMPOSe hicieron colectas mensuales de febrero de 1980 a abril de 1981, cubriendo una red de 18 estaciones distribuidas en toda la laguna (Fig. l). Las colectas de peces se efectuaron a bordo de una lancha con motor fuera de borda, con una red de arrastre de prueba camaronera de 5 m de largo, 2.5 m de abertura de trabajo, 3/4" de luz de malla, en lances de 12 minutos a una velocidad de 2 a 2.5 nudos, cubriendo un área de 2000 m² utilizada por Loeschet al.1976, quien calculó una eficiencia de captura de 25% paraMicropogon undulatus, 6% paraLeiostomus xanthurusy de 33 a 50% para Penaeus aztecus. Estimándose en este trabajo una eficiencia de captura de 20% paraB. chrysoura. En cada estación se hicieron mediciones de temperatura, salinidad, transparencia, profundidad; y observaciones de vegetación sumergida y circundante, macrofauna bentónica, sustrato y condiciones climáticas prevalecientes. Simultáneamente, se realizaron muestreos de ictioplancton. Los datos de los parámetros ambientales, aparecen reportados por Yáñez-Arancibia et al.(1983). En cada estación los individuos de B. chrysoura fueron separados del resto de la colecta y colocados en bolsas con su respectiva etiqueta y refrigerados en una hielera para ser transportados al laboratorio, donde eran congelados. Algunos organismos se midieron y se les extrajeron los estómagos in situ, los cuales se fijaron inmediatamente con formol al 10% neutralizado con borato de sodio, se etiquetaron y colocaron en frascos para analizar el contenido estomacal posteriormente. MATERIAL DE ESTUDIOMás de los 15 cruceros realizados, se obtuvieron un total de 1 182 ejemplares de B. chrysoura(Fig. 2), con un rango de 27 a 153 mm de longitud patrón. ACTIVIDADES DE LABORATORIOLa identificación de la especie fue determinada por los métodos convencionales y el empleo de literatura básica, principalmente los trabajos de Jordan y Evermann (1896-1900) y de Fischer (1978). Los peces fueron descongelados con agua corriente, se midió su longitud patrón y total con una precisión de 1 mm con un ictiómetro convencional. Se obtuvieron sus pesos total y vacío (sin vísceras) con una balanza granataria con precisión de 0.1 g (en lo subsiguiente cuando aparezcan valores de longitud o peso y no se especifiquen, deberán tomarse como longitud patrón y peso vacío según sea el caso). Se extrajeron los otolitos (sagittae) haciendo un corte transversal entre el cráneo y la primera vértebra, sacando los otolitos con unas pinzas de punta fina. Simultáneamente se hicieron muestras de las escamas del lado derecho, levantando la aleta pectoral, lugar en el que se encuentran las escamas más desarrolladas. Hecho esto, se colocaron junto con los otolitos en un sobre con los datos del pez. Sólo se consideraron 4 muestras de escamas y otolitos para cada clase de talla de 10 mm cada mes. Se hicieron observaciones del estado del pez como acumulación de tejido adiposo y presencia de parásitos. Fueron calculados parámetros poblacionales como densidad, biomasa y longitud promedio, para el área de la laguna en cada mes y para cada estación en el total de capturas. Según las expresiones: D = N/A; (1) donde: D = la densidad en individuos por m²; N = número de individuos y A área muestreada. B = P/A; (2) donde: B = biomasa en g m-²; P= peso total y A = área muestreada. 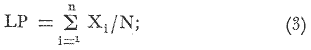 donde: LP = longitud patrón promedio; Xi= sumatoria de las longitudes y N = número de individuos.  Fig. 2. Ejemplar de Bairdiella chrysoura (Lacépéde). Laguna de Términos, Campeche. Colección Ictiológica ICML-PF 0,001787/ ALIMENTACIÓN Y HÁBITOS ALIMENTICIOSFueron examinados los estómagos de 34 ejemplares entre 35 y 146 mm de longitud, pertenecientes a dos épocas climáticas: 15 de ellos corresponden a la época de lluvias (octubre) capturados en el área de Puerto Real y Bajos de Sabancuy; y 19 a la época de secas (febrero) capturados sobre pradera deThalassia testudinumfrente a la Boca de Estero Pargo. El contenido estomacal fue analizado con la ayuda de un microscopio estereoscópico, identificando cada grupo alimenticio hasta el nivel taxonómico que fue posible. Se eligieron los métodos de frecuencia, numérico, gravimétrico (en peso seco), el índice de importancia relativa de Pinkas et al. (197 1) , así como el índice de importancia relativa de Yáñez-Arancibiaet al.(1976). Para obtener el peso seco del contenido estomacal, después de la identificación y separación de los grupos alimenticios, cada grupo se envolvió en papel aluminio debidamente etiquetado, se pusieron en un horno a 95°C durante 24 horas según Windell y Bowen (1978). Se dejaron enfriar y se pesaron en una balanza analítica con una precisión de 1.0 X 10-4 g. El análisis de frecuencia es la primera parte del análisis numérico. Se obtuvo el porcentaje de estómagos en el cual uno o más grupos tróficos estuvo presente. F = ne/Ne (100) ...... (4) donde: F = frecuencia (%) de aparición de un tipo de alimento; ne = número de estómagos con un tipo de alimento: y Ne = número de estómagos no vacíos examinados. De esta manera se estimó la proporción de la población que prefiere un tipo de alimento dado y es referido como frecuencia de ocurrencia. En el análisis numérico, el número de elementos de un tipo de alimento particular de todos los estómagos en que se encontró, es expresado como un porcentaje de la suma de los elementos de todos los grupos tróficos, para estimar la abundancia relativa de aquel grupo trófico en la alimentación. Esto es conocido como la composición porcentual por número, expresado por la fórmula: N = nee/Nee (100); .......(5) donde: N = porcentaje numérico de un grupo trófico dado, nee = suma de los elementos de este grupo en todos los estómagos; y Nee = suma de los elementos de los grupos tróficos en todos los estómagos. Los datos del análisis gravimétrico son expresados para cada categoría alimenticia o grupo taxonómico como el porcentaje del peso total del contenido estomacal de todos los estómagos analizados, de esta manera se tiene: G = pe/Pe (100); ........ (6) donde: G= porcentaje en peso de un grupo de alimento particular; pe = suma del peso de este grupo en todos los estómagos; y Pe = suma del peso del contenido estomacal de todos los estómagos. Los análisis anteriores permiten describir la alimentación, establecer comparaciones de la alimentación de diferentes grupos de peces y comparar el significado energético y/o nutricional de la alimentación o sus componentes. Ahora bien, la comparación de las dietas, se hace sobre la base de las abundancias relativas de los diferentes grupos tróficos. El análisis numérico puede ser una buena forma de establecer abundancias relativas, ya que requiere del menor tiempo y equipo, pero tiene el inconveniente de ser inadecuado cuando un componente significativo de la dieta no ocurre en unidades discretas de tamaño. Por lo que debe complementarse con análisis gravimétricos o volumétricos. También proporciona poca información sobre el valor nutricional de la dieta, otorgándole el mismo valor por ejemplo, a un copépodo que a una jaiba, por lo que sus datos en caso de que la dieta sea muy variada, carecen de sígnificatividad energética o nutricional. El análisis gravimétrico por peso seco, es la mejor cuantificación de la dieta, ya que al ser eliminada el agua de los tejidos, permite evaluar solamente la biomasa seca que tiene un valor nutricional potencial, Windell y Bowen (1978). El índice de importancia relativa (IRI) de Pinkas et al.(1971) consiste en la combinación de las relaciones obtenidas por los métodos volumétrico, numérico y de frecuencia. En el presente trabajo, se utilizó el método gravimétrico en lugar del volumétrico. El cálculo del índice se realiza sumando el porcentaje numérico y el gravimétrico de un grupo trófico y multiplicarlo luego por su frecuencia, según la fórmula: IRI = F (N + G);................. (8) cuyos símbolos ya han sido explicados antes. El índice de importancia relativa de Yáñez-Arancibiaet al. (1976), permite la cuantificación de la importancia relativa de determinado grupo trófico dentro de la alimentación de cada especie. Relaciona la frecuencia y el volumen del alimento siendo los parámetros más importantes en la alimentación de los peces. En este caso también se utilizó el porcentaje gravimétrico en lugar del volumétrico, de acuerdo a la ecuación: IR = F (G) (100-1);.................. (9) donde: IIR = índice de importancia relativa y los otros parámetros ya han sido explicados antes. Se descarta el parámetro numérico para evitar incurrir en errores de interpretación energética. La combinación del índice de importancia relativa con la frecuencia y el peso en una gráfica (Fig. 7), permite la representación del espectro trófico combinado el cual queda delimitado por el porcentaje gravimétrico y el de frecuencia y evaluados por el índice de importancia relativa en relación a tres cuadrantes: Cuadrante I. (ABCD)Zona de grupos tróficos circunstanciales o accidentales. Está definido por el rango combinado de frecuencia y peso de 0 a 20% que representa grupos de baja importancia; y para el índice de importancia relativa se define el rango de 0 a 10% que son grupos de importancia relativa baja. Cuadrante II. (DEFG)Zona que define los grupos tróficos secundarios, presentando un rango combinado de peso y frecuencia de 20 a 40% que representa grupos tróficos de importancia secundaria y un rango para el índice de importancia relativa de 10 a 40% siendo grupos de importancia relativa secundaria. Cuadrante III. (HIJK)Zona de grupos preferenciales siendo determinados por un rango combinado de peso y frecuencia de 40 a 100% que define grupos tróficos de importancia alta y el rango del índice de importancia relativa de 40 a 100%, que representa a los grupos de importancia relativa alta. El índice de cantidad de alimento ingerido empleado por Aoyama (1956), Yáñez-Arancibia et al. (1976) y Lara Domínguez et al. (1981), expresan el peso del alimento en el estómago del pez con la fórmula: Ica = PCE/PV;.................. (10) donde: Ica = índice de cantidad de alimento ingerido; PCE = peso del contenido estomacal; y PV = peso vacío del pez. En este trabajo también se analiza el contenido estomacal y la relación gravimétrica en función de la talla. DETERMINACIÓN DE SEXO Y MADUREZ GONÁDICAComo no existe dimorfismo sexual en la especie, para determinar el sexo, fue necesario disectar la gónada y observarla al microscopio y discernir el sexo por la presencia o ausencia de huevos. El estado de madurez gonádica de las hembras se determinó según la escala de Hilge (1977) (Tabla 1). ÉPOCA DE REPRODUCCIÓNSe estimó como aquella donde se obtuvo el mayor porcentaje de hembras maduras (fases II, III y IV) con respecto al total de hembras capturadas, calculado mensualmente.  TABLA 1 ESCAL DE MADUREZ GONÁDICA DE HILGE (1977) TALLA DE PRIMERA MADUREZSe tomó como la talla a la que el 50% de las hembras están maduras en plena época de reproducción. PROPORCIÓN DE SEXOSSe calculó por medio de la relación: (masculino)/(masculino)+(femenino) (11) . Calculándose estacionalmente y por talla, siendo evaluados después por pruebas de chicuadrada (X²). DINÁMICA DEL DESOVESe estudió sobre gónadas de 14 hembras maduras fijadas en Gilson cuya fórmula se tomó de Bagenal y Braum (1978). Las gónadas fijadas se agitaron para facilitar la fijación y separación del estroma de la gónada; se dejó reposar durante varios días. Después los ovocitos fueron lavados con agua y se depositaron en un matraz aforado a 300 ml con agua; se tomaron alícuotas de 1 ml con la pipeta de Stempel. Se midieron y contaron los ovocitos con la ayuda de un microscopio estereoscópico y una caja de petri con marcas en enrejado, haciendo corresponder el número de ovocitos con tados, al volumen total de 300 ml según el método volumétrico usado por Mackay y Mann (1969) y Bagenal y Braum (1978). Los ovocitos fueron ordenados en clases de 20 micras de diámetro, organizados después en histogramas de frecuencias, esto con el fin de determinar la talla de ovocitos en maduración y el número de posibles desoves indicado por el número de modas (Vazzoler, 1970). FECUNDIDADSe estimó por el método volumétrico, arriba mencionado del que se tomó el conteo final como el promedio de tres alícuotas. La fecundidad se calculó como el número de ovocitos que se encontraban en maduración y la fecundidad relativa como el número de ovocitos madurando por gramo de peso total del pez. Se calcularon regresiones entre la fecundidad absoluta contra la longitud (patrón y total) y contra el peso (vacío y total) , para encontrar el factor que explique mejor el comportamiento de la fecundidad. RELACIÓN TALLA/PESOEsta relación es expresada matemáticamente como una función potencial del peso (g) contra la longitud (mm) según la ecuación: P = aLb; (12) transformada logarítmicamente da un modelo lineal del tipo: Loge P = Loge a + b Loge L; .......(13) donde: P = peso (g) ; L = longitud (mm); a = ordenada al origen; b = pendiente; y Loge= logaritmo natural. Este tipo de relación condensa una gran información biológica como el crecimiento alométrico, cambios alimenticios y madurez gonádica, que afectan en conjunto al estado fisiológico del pez (Ricker, 1975). Con el fin de encontrar correlaciones entre diversos aspectos biológicos fueron calculadas regresiones predictivas con diversas variantes de la relación talla/peso, las cuales se muestran en la tabla 2.  TABLA 2 VARIANTES DE LA RELACIÓN TALLA-PESO X Variante calculada. * LP = longitud patrón y PV = peso vacío. ** LP = longitud patrón y PT = peso total. Este tipo de funciones permitió analizar el crecimiento estacionalmente a través del coeficiente de alometría (b) y la condición promedio de la población por medio del factor de condición promedio (a). Tales parámetros fueron obtenidos de la relación talla/peso. Por el volumen tan grande de datos se requirió del uso de programas de computación por lo que se utilizaron los subprogramas "Frequency, Crosstabs, Regression, Scatergram y Aggregate" del paquete S.P.S.S. (Statistical Packa ge for the Social Science, versión 7) (Nie et al. 1975) en una computadora Burroughs 6700. FACTOR DE CONDICIÓNLa condición del pez es un reflejo de su estado fisiológico, resultado de las actividades biológicas de la especie tales como reproducción, alimentación, acumulación de energía y otros que en última instancia son reflejo de las condiciones ecológicas. Para estudiar la condición del pez, se calcularon varios factores de condición. El factor de condición promedio se tomó como la ordenada al origen de la relación talla/peso; y se comparó con el crecimiento alométrico. El factor de condición relativo, se calculó según la fórmula de Fulton (Ricker, 1975) para el total de la captura de cada mes y para cada grupo de talla de toda la colecta. De acuerdo a la expresión matemática: K1= 105PV/ LP³; y Ko=105PT/ LP³; .........(14) donde: K= al coeficiente de condición; PV = al peso vacío; LP = longitud patrón; PT = peso total. Se calculó también el factor de condición de Le Cren (1951) cuya expresión matemática es: KN1=105PV/ b1LPa¹; y KN2=105PT / b2LPa²; ................(15) donde: KN = coeficiente de condición; b1 = factor de condición promedio para LP; b2 = factor de condición promedio para PT; al = coeficiente de alometría (PV); a2 = coeficiente de alometría (PT) ; PV y PT ya han sido descritos antes. Como los cuatro índices mostraron el mismo comportamiento, se eligieron para explicar las fluctuaciones de la condición de la población a los factores K1 y K2 Otra medida de la condición del pez, es el coeficiente del peso visceral, calculado a partir de K1 y K2: 1-(K1 / K2) =1-( (105PV / L³) / (105PT/ L³) )= 1- ( (PT-V)/ PT) = V / PT; ............(16) donde: V = peso de las visceras; los otros parámetros ya han sido definidos anteriormente. Este índice, fue calculado para la captura total de cada mes y para cada clase de talla de la población total. Otra información complementaria acerca de la condición del pez se obtuvo calculando el porcentaje de los individuos con acumulación de tejido adiposo mensualmente. EDAD Y CRECIMIENTOLa determinación de edad es una importante herramienta en biología pesquera. Datos de edad en conjunción con los de peso y longitud, pueden proporcionar información sobre la composición de la población, edad a la que ocurre la madurez, longevidad, mortalidad y producción. En la actualidad existen métodos muy precisos para estimar la edad de muchos peces de climas fríos y templados; sin embargo, es necesario desarrollar y perfeccionar técnicas que sean aplicables a peces de áreas tropicales. Los métodos usados con mayor frecuencia son el conteo e interpretación de zonas de crecimiento que aparecen sobre las partes duras de los peces (otolitos, escamas, espinas, radios, vértebras) . Se sabe que estas marcas son formadas anualmente y se nombran marcas anuales, anillos anuales oannuli;éstas se forman en periodos de crecimiento rápido y crecimiento lento, lo que origina la formación de una banda oscura y otra clara que en conjunto constituyen un annuluso marca anual, que son el reflejo de cambios ambientales y/o internos que pueden presentarse con una periodicidad bien definida. En general, esto sucede en áreas templadas o frías en donde existen épocas climáticas bien definidas, con evidentes diferencias de temperatura; correspondiendo el periodo de invierno al de crecimiento lento y en ocasiones casi nulo y la época calurosa corresponde al crecimiento rápido. Otro método muy utilizado es el de Petersen (Ricker, 1975). Basado en que la especie se reproduce anualmente y la progenie tiene una tasa de crecimiento uniforme; en este caso, una distribución de frecuencias de tallas de la población, exhibirá una moda para cada clase anual o grupo de edad. Para lo cual, se requieren de medidas de longitud de una gran cantidad de peces y que exista poco traslapamiento en los tamaños de peces de grupos de edad adyacentes. Usualmente, estos requerimientos se encuentran sólo en los grupos de edad más jóvenes de la población. Obviamente este método presenta algunas objeciones en su aplicación para ecosistemas tropicales. Los métodos practicados exitosamente en peces de áreas templadas o frías, presentan algunos problemas al ser aplicados a peces tropicales, lo cual complica la determinación de edad de tales organismos, ya que las marcas de crecimiento no tienen un patrón necesariamente anual y pueden estar asociadas a factores como la estación de secas, cambios en la disponibilidad de alimento, densidad poblacional, pérdida de condición, época de reproducción, competencia y otros (Bagenal y Tesch, 1978). En ecosistemas tropicales, la época de crecimiento de los peces es continua, los ciclos de vida son cortos y la época de reproducción no es muy marcada en la mayoría de las especies; por lo que la periodicidad de las marcas en las partes duras es difícil de discernir y aún más de atribuir a algún factor. Sabiendo las dificultades que implica la determinación de edad en peces tropicales, fueron ensayados varios métodos para determinar la edad de B. chrysoura. El método de Petersen ya mencionado, consistió en analizar el desplazamiento de modas de clases de talla cada 10 mm, a partir de histogramas de frecuencia de tallas mensuales, obteniéndose así, el ritmo de crecimiento mensual, más no la edad de los peces. La lectura de marcas de crecimiento sobre escamas o escalimetría, para lo cual, las escamas obtenidas de cada pez, eran lavadas con agua y frotadas a mano para limpiarlas de restos de materia orgánica o sedimentos; se dejaban secar y 5 o 6 escamas de un mismo organismo eran montadas presionándolas entre dos portaobjetos unidos con cinta adhesiva. Fueron montadas es camas de 20 organismos cuyo análisis al microscopio, mostró solamente un patrón decirculi, no presentando otro tipo de marcas, por lo que no fue posible obtener información sobre la edad por esta técnica y no se prosiguieron más observaciones. La lectura de marcas diarias parece un método más eficaz para discernir el crecimiento de estos peces. Pannella (1974), describió un patrón de marcas diarias de crecimiento en otolitos de peces tropicales, las cuales estaban constituidas por un par de bandas adyacentes, una clara y una oscura de aproximadamente 10 micras de grosor. Esta técnica, parece solucionar en gran parte los problemas de determinación de edad acusados por otras técnicas, lo que hace de ésta una herramienta muy útil para determinar la edad de peces tropicales. Para la determinación de edad de B. chrysoura, los otolitos eran quebrados a mano horizontalmente; es decir, en el sentido antero-posterior del pez, justo al nivel del surco que presenta en tal posición el otolito (sagittae). Posteriormente eran montados en portaobjetos con bálsamo de Canadá uniéndolos por la superficie fracturada; y se pulían con abrasivo carborundum No. 400 y agua contra la superficie de un cristal hasta encontrar el núcleo (zona de crecimiento que corresponde a la depositación de CaCO3 durante la etapa larvaria) ; después se sumergía en HC1 (1 %) durante 50 o 60 segundos para limpiar los residuos de CaCO3 y después se lavaron con agua, se le colocó un cubreobjetos. La misma operación se hizo con el otro lado del otolito. Se realizaron 5 lecturas independientes de cada otolito, desde el núcleo hacia la periferia en la zona de mayor crecimiento, el conteo definitivo se tomó como el promedio de los 5, descartándose aquellas lecturas cuyas variaciones eran mayores al 10%. Los datos de edad y crecimiento, aunque en sí mismos representan un aspecto descriptivo muy interesante, biológicamente hablando., sobre todo cuando se compara con otras especies. Sin embargo, la relevancia de estos estudios radica en su utilidad en el análisis del rendimiento de las poblaciones; es decir, en el aumento en peso o en longitud por unidad de tiempo, y en su aplicación en la evaluación de pesquerías que se basa en la comparación del peso ganado por la población debido al crecimiento y el perdido por mortalidad (Gulland, 1971). De esta manera, el crecimiento entendido como el aumento en longitud o en peso por unidad de tiempo, adquiere mayor rigor al ser definido en un lenguaje matemático. Son muy numerosos los trabajos que proponen algún modelo matemático de crecimiento (Gulland, 1971; Ricker, 1975; Weatherly, 1972; Bagenal, 1978); sin embargo, ninguno de los modelos propuestos describe el crecimiento de los peces durante toda su vida, en la cual pueden variar enormemente las condiciones, repercutiendo en el desarrollo de la población. Gulland (1971) propuso una serie de requisitos que deben tener dichos modelos, los cuales se pueden resumir como sigue: a) Debe obtenerse de la fórmula el tamaño en longitud o en peso para una edad determinada; b) Los resultados teóricos deben estar de acuerdo a las tallas y pesos observados en peces de ciertas edades; c) La expresión matemática debe ser incorporada fácilmente a expresiones de rendimiento; d) Que involucre a un número pequeño de constantes y que éstas tengan un significado biológico; e) Que la extrapolación a edades mayores a las utilizadas para su ajuste no lleve a resultados poco razonables. El modelo más utilizado en biología pesquera es el propuesto por von Bertalanffy, debido a que cumple con los requisitos arriba mencionados y su expresión matemática es: Lt = Loo (1 - e-k(t - to) ); ...... (17) la cual requiere para su cálculo 3 constantes: Loo que es la longitud máxima o infinito que puede alcanzar la especie, matemáticamente es la asíntota de la curva; K, es la tasa a la cual la curva de crecimiento se acerca a su valor asintótico; toes el tiempo hipotético al cual la longitud es cero, si el crecimiento siempre sigue según la expresión anterior. De esta manera, se observa que son requeridos datos de edad y longitud para adaptar los tres parámetros de la ecuación. En la obtención de tales parámetros pueden ser utilizados varios ajustes gráficos. Loo y K, pueden ser obtenidos por el método de FordWalford (Ricker, 1975; Dickie, 1978), graficando Lt+1 contra Lt; esta recta de mediciones de longitud a intervalos de tiempo sucesivos, se cruzará al graficarse, con la bisectriz (recta cuya pendiente es 1 y parte del origen) en el punto en que Lt+1 es igual a Lt y representa el valor asintótico o infinito de la longitud. La pendiente de la recta es e-K y la ordenada al origen es Lo. (1 K); obteniéndose la ecuación: Lt+1 = Loo(1 - K) + KLt;............... (18) la obtención del parámetro Loopuede hacerse gráficamente u obtenerse analíticamente a partir de las ecuaciones de la recta Lt+1/Lt y la ecuación de la bisectriz representadas por las expresiones: y = mx + b;...................... (19) y y´ = x;........................... (20) respectivamente; sabiendo que Loo, se obtiene en el punto en que x = y, se sustituye el valor de x de la ecuación (20) en la (19) quedando: y = my' + b; ....................(21) despejando se obtiene el valor asintótico representado por: y = b / (1 - m) ..................(22) El método de Petersen (Ricker, 1975) aportó los valores para graficar y calcular la recta de Ford-Walford (Ricker, 1975) del cual se obtuvieron los parámetros Loo y K describiendo así el crecimiento mensual. El método de Beverton (Dickie, 1976) evalúa los parámetros de la ecuación de von Bertalanffy para ser adaptados a un grupo de datos, estimando la Loo. más adecuado (el cual puede ser obtenido preliminarmente por la gráfica de Ford-Walford) y lo usa en una expresión logarítmica rearreglada de la ecuación de van Bertalanffy, quedando: Loge(Loo- Lt) = (LogeLoo) - Kto - Kt; .............(23) que describe el comportamiento de la gráfica de Loge (LooLt) contra t (edad en días) ; obteniéndose una recta cuyos cambios o desviaciones se reflejan en el coeficiente de correlación, de tal manera que la mejor correlación, reveló la Loomás adecuado a los datos; en consecuencia, simultáneamente se obtiene la K óptima como la pendiente de la recta dada por LogeK. El parámetro to se obtuvo despejándolo de la ecuación de BevertGn, quedando: to=t+1 / KLoge(Loo-Lt/Loo); .................. (24) donde: t= edad; Lt =: longitud a la edad t; los otros parámetros ya han sido definidos anteriormente. Adicionalmente se adaptó un modelo lineal de crecimiento a los datos de longitud en función de la edad en días; expresada por la ecuación: Lt = at + b;...................... (25) donde: a = razón de crecimiento; t = edad en días; b = ordenada al origen y Lt, ya fue definida antes. Se calculó el modelo de crecimiento en peso de von Bertalanffy utilizando la siguiente expresión: Wt = Woo (1 - e-k(t-to))3; .............................(26) donde: Wt = peso del pez a la edad t; Woo = peso asintótico, calculado de la relación talla/peso, a partir de Loo; 3 es el coeficiente de alometría; los otros parámetros ya han sido definidos antes. Los resultados de la estimación mensual del crecimiento obtenidos por los métodos de Petersen y Ford-Walford, fueron comparados con los de la estimación diaria de los otolitos y los métodos de Beverton y von Bertalanffy, por medio de las constantes Loo y K. MORTALIDADLa mortalidad o decremento del número de individuos por unidad de tiempo, puede deberse a varias causas, por ejemplo: explotación comercial, depredación, enfermedades, senilidad y otros, cada una de las cuales tiene su propio índice de estimación. En la práctica se consideran solamente dos tipos: la causada por pesca y la mortalidad natural que incluye a la depredación, enfermedades y senilidad, cada una de las cuales puede ser expresada por su propia tasa instantánea y la suma de éstas es la tasa instantánea de mortalidad total. De manera general estaría expresada por: Z = F + M;............................ (27) donde: Z = coeficiente instantáneo de inortalidad total; F = coeficiente instantáneo de mortalidad por pesca; M = coeficiente instantáneo de mortalidad natural. Como B. chrysourano está sujeta a presiones de explotación, la mortalidad total puede ser referida a la mortalidad natural únicamente. Si la mortalidad total (Z) es constante, entonces se puede dar el número de individuos que corresponden a una clase de edad en un instante cualquiera t, después de haber estado sujeta a la mortalidad según la fórmula: Nt = Noe-zt; ........(28) de igual manera puede expresarse la mortalidad por talla: NL = No e-ZL; .............(29) donde: N = número de individuos a la edad t, o a la talla L; No = número de individuos a la edad o a la talla cero; t, L y Z ya han sido definidos antes. Se obtuvo (Z) por talla graficando Loge N/L según la curva de captura (Gulland, 1971; Ricker, 1975). Se adaptó un modelo exponencial a la parte en que declinó LogeN obteniéndose Z como la pendiente de la recta cuya fórmula expresada linealmente es: LogeNL = LogeNo - ZL; ...............(30) y su forma exponencial está dada por: NL = Noe-ZL,......................(29) Para obtener la mortalidad por edad, se procedió de igual manera que para la mortalidad por talla, para lo que se utilizó el modelo de von Bertalanffy en la obtención de la edad. Quedando expresada por las fórmulas: LogeNt= Loge No. - Zt; .....................(31) y Nt= Noe-Zt;........... (28) que representan los modelos lineal y exponencial respectivamente. Otra manera de calcular Z en edad es utilizada cuando el crecimiento de la especie es lineal o casi lineal; entonces Z en edad puede obtenerse a partir de Z en talla, multiplicando ésta por la tasa de crecimiento del modelo lineal; así, se tiene que: z (talla) x a = Z (edad); ......................... (32) según Gulland (1971). EDAD CRÍTICALa edad crítica, se obtuvo, multiplicando el crecimiento en peso de la curva de von Bertalanffy y la mortalidad en meses a determinados intervalos de tiempo, obteniéndose una gráfica cuya cima o valor máximo, representa el momento o la edad a la cual el pez ha alcanzado o está cercano a su crecimiento asintótico, pero la mortalidad sigue actuando, por lo que se está perdiendo biomasa y entonces es la edad a la cual debe ser capturado. Estimaciones de la abundancia fueron hechas multiplicando los promedios de biomasa y densidad por el área de la laguna. Se calculó una regresión de la altura del pez contra su longitud, comparándose después con la luz de malla de la red para conocer que talla mínima capturaba eficientemente la red. Una regresión de la longitud total contra la longitud patrón se hizo para hacer equivalentes los resultados para la longitud total. RESULTADOS Y DISCUSIÓNDISTRIBUCIÓN TEMPORALLa corvina Bairdiella chrysourase encuentra todo el año en la Laguna de Términos, pero muestra fluctuaciones en densidad, biomasa y longitud patrón promedio (Fig. 3, Tabla 3). La densidad varió de 8.2 X 10-4indi. m-² en febrero y mayo de 1980, a 56.7 X 10-4indi. m-² en diciembre de 1980, con un promedio de 29.9 X 10-4 indi. m-². Tiende a subir de febrero a diciembre de 1980, pero se observan pulsos de abundancia en abril y agosto; de enero a marzo de 1981 desciende y en abril de 1981 se repite el pulso registrado el año anterior, mostrando lo que parece ser una tendencia periódica de este parámetro. La biomasa varió de 1.89 X 10-2 g m-² en mayo de 1980, a 16.67 X 10-² g m-² en diciembre del mismo año; con un promedio de 6.15 X 10-2 g m-². a Observándose un ascenso de febrero a diciembre, periodo en el cual se registran pulsos de abundancia en abril y en agosto; de enero a marzo de 1981, hay un descenso, pero en abril se repite el pulso observado el año pasado. Los valores de longitud patrón promedio, oscilaron entre 86 mm en julio y en agosto de 1980, a 114 mm en marzo de 1981, con un promedio de 100 mm. Presentándose los valores más bajos de julio a octubre de 1981 y se ven correlacionados con altos valores en el número de individuos juveniles. Un ascenso se observa en noviembre y diciembre, meses en los que también se capturó un número elevado de individuos adultos, acompañado de un ascenso en biomasa y densidad. En enero de 1981 se registra un arribo de juveniles; además la biomasa y la densidad desciende debido a que la captura de adultos bajó. En febrero y marzo la longitud promedio aumenta, presentándose valores de biomasa y densidad bajos, por lo que se infiere que los individuos capturados son adultos y poco numerosos. 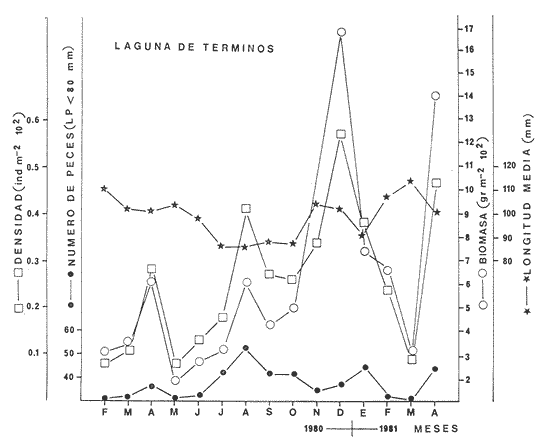 Fig. 3. Comportamiento estacional de la densidad, biomasa longitud patrón promedio y número de individuos juveniles, (LP<80mm) de B. chrysoura en la Laguna de Términos de febrero de 1980 a abril de 1981.  TABLA 3 PROMEDIOS MENSUALES DE DENSIDAD Y BIOMASA DE B. CHRYSOURA CAPTURADOS EN LA LAGUNA DE TÉRMINOS DE FEBREODE 1980 A ABRIL DE 1981. Se capturaron individuos juveniles durante todo el año, pero se presentaron 4 pulsos de abundancia en abril de 1980 y de 1981, en agosto de 1980 y enero de 1981 (Fig. 3). El reclutamiento en abril de 1980, provoca aumentos en la biomasa y en la densidad, por lo que la población se ve muy afectada por el reclutamiento. La época de reclutamiento es muy marcada de julio a octubre, con una pulso de abundancia en agosto, Amezcua Linares y Yáñez-Arancibia (1980) capturaron individuos deB. chrysoura en los sistemas fluvio-lagunares de Candelaria-Panlau y de Pom-Atasta principalmente, en épocas en que las salinidades eran mayor a 5 ppm y menores a 25 ppm, por lo que se piensa que esta especie realiza migraciones estacionales hacia estos lugares, donde lleva a cabo parte de su ciclo de vida. Algunos investigadores, trabajando en otras latitudes han encontrado también que esta especie realiza migraciones río arriba en algún momento de su vida. Chao y Musick (1977) señalan que capturaron adultos de esta especie en marzo y abril; y juveniles de julio a agosto, en York River, Virginia; y que estos últimos, dejan el río en diciembre. En este estudio, se observa un pulso de abundancia en diciembre de 1980, que podría ser originado por la llegada a la laguna de individuos procedentes de los sistemas fluvio-lagunares; y el descenso de abundancia tan drástica en enero, febrero y marzo, representaría la entrada deB. chrysoura con fines reproductores a los sistemas mencionados antes. Parece ser que esta especie, no realiza migraciones en gran escala hacia la plataforma continental adyacente; Yáñez-Arancibia et al. (1982a) en 6 cruceros efectuados en dicha zona, entre 1978 y 1982; sólo reportan un individuo de esta especie. De esta manera, la tendencia general está representada por la incursión de los adultos hacia los sistemas fluviolagunares en enero, febrero y marzo. En noviembre y diciembre la tendencía es salir hacia la laguna; encontrándose toda la población dentro de la laguna en este momento. Los juveniles van de los sistemas fluviolagunares a la laguna de abril a octubre. DISTRIBUCIÓN ESPACIALB. chrysoura se distribuye en todos los subsistemas de la Laguna de Términos; encontrándose en mayor abundancia hacia la costa este, en las estaciones 10, 15 y 16. Desde donde se localiza un gradiente de abundancia hacia las bocas de Puerto Real y del Carmen (Fig. 4). La zona de abundancia en general está comprendida entre las estaciones 10, 11, 14, 15, 16, 17 y 18. De las cuales se destacan la 11, 14, 15 y 17, cuyos valores de longitud promedio oscilaron entre 91 y 110 mm, con coeficiente de variación de 16 a 19% y la frecuencia de aparición de 39 a 71 %. Otro grupo es el que forman las estaciones 10 y 16, que se caracterizan por tener valores de LP promedio de 92 a 94 mm, con un coeficiente de variación de 24 a 25% y una frecuencia de aparición entre 63 y 67%. La estación 18, cuyo valor de longitud promedio es de 103 mm, presentó un coeficiente de variación de 30% y una frecuencia de aparición de 27% (Fig. 4). 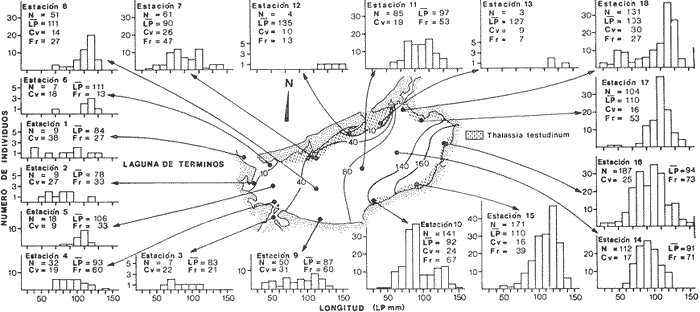 Fig. 4. Distribución geográfica de B.chrysura, mostrando la composición de la captura para cada estación durante el periodo de muestreo e isolíneas de abundancia numérica. N = número de peces, LP = longitud patrón promedio, Cv = coeficiente de variación y Fr = frecuencia. Debido a que el rango de longitud registrado por las capturas fue muy restringido, no se observa un patrón de distribución de tallas muy claro; sin embargo, los juveniles se capturaron principalmente en la zona de abundancia. Tallas medianas se encuentran principalmente en las estaciones 9, 11, 14 y 17, pero se distribuyen en todos los habitat de la laguna. Las estaciones 12 y 13 se caracterizaron por presentar altos valores de longitud exclusivamente. De esta manera, se observa que la abundancia y estructura de la población temporal y espacialmente están muy afectadas por el reclutamiento y las migraciones fuera de la laguna. CORRELACIÓN DE ABUNDANCIA CON LOS PARÁMETROS AMBIENTALESLa especie se capturó en un rango de transparencia de 10 a 100%, temperaturas entre 20 y 31.5°C, mostrando una mayor correlación con la salinidad cuyos valores oscilaron de 0 a 36 ppm. Capturándose el 50.7% entre salinidades de 15 a 25 ppm y el 98.9% de los individuos se capturó en salinidades entre 10 y 35 ppm, lo cual indica que ésta especie habita en condiciones estuarias preferencialmente (Fig. 5). ALIMENTACION Y HÁBITOS ALIMENTICIOSAnálisis de frecuencia del alimento (época de secas) . En esta época los valores de frecuencia de aparición fueron muy altos para peces (45%), decápodos (55%) y tanaidáceos (60%). (Fig. 6, Tabla 4). Análisis numérico (secas). Por número, los tanaidáceos constituyeron el 92.2%, los peces el 4.1% y los decápodos el 3.1%, entre otros grupos de la figura 6, tabla 4. Análisis gravimétrico (secas). Por peso seco, los peces formaron el 86.6%, los decápodos el 5.0% y los tanaidáceos el 3.2%, entre otros grupos de menor importancia Fig. 6, Tabla 4).  Fig. 5. Porcentaje de captura de B. chrysoura según la salinidad (ppm), mostrando la captura acumulatíva en relación al mismo parámetro. 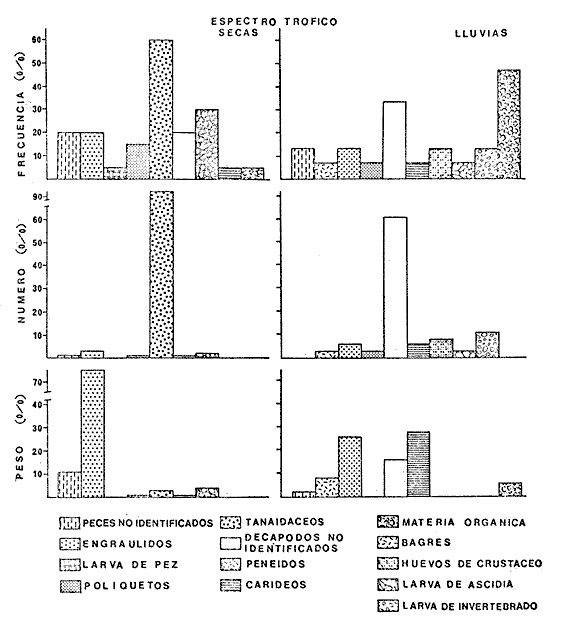 Fig. 6. Espectro trófico de B. chrysoura en dos épocas climáticas (secas y lluvias) por los métodos de frecuencia, numérico y gavimétrico. Índice de importancia relativa IRI = F(N + G) (secas). Se observó que los grupos alimenticios más importantes (en orden decreciente) fueron: tanaidáceos, engráulidos, peces no identificados, peneidos. Siendo de menor importancia: decápodos no identificados, poliquetos, materia orgánica, larvas de peces y carideos (Tabla 4). Índice de importancia relativa IIR = F (G)/ 100 y análisis combinado (secas) . De acuerdo a los datos de la figura 7 y la tabla 4, se observó que el alimento preferencial lo constituyeron los engráulidos y los tanaidáceos; el alimento secundario lo formaron los peneidos, peces no identificados y decápodos no identificados; el alimento circunstancial lo formaron los poliquetos y otros grupos tróficos. Relación gravimétrica (secas). La relación gravimétrica no presentó un patrón de comportamiento definido, permaneciendo casi constante el índice ICA (cantidad de alimento ingerido) con respecto al peso del pez (Fig. 8). 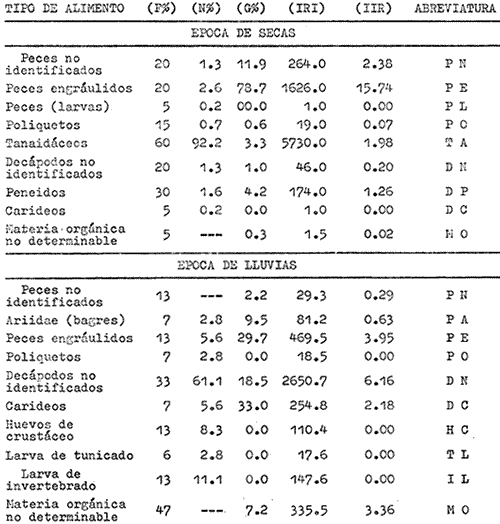 TABLA 4 ESPECTRO TRÓFICO DE B. CHYSOURA EN DOS ÉPOCAS CLIMÁTICAS: (ARRIBA) SECAS Y (ABAJO) LLUVIAS. SE MUESTRAN LOS RESULTADOS DE LOS MÉTODOS UTILIZADOS. F = FRECUENCIA, N= NUMÉRICO, G = GRAVIMÉTRICO, IRI= ÍNDICE DE IMPORTANCIA RELATIVA = F (N+G) IIR = ÍNDICE DE IMPORTANCIA RELATIVA = FG (100- ¹) Análisis de frecuencia de alimento (lluvias). La materia orgánica se encontró en el 47% de los estómagos analizados, los decápodos en el 39.9% y los peces en el 33.2%, entre otros grupos de menor importancia (Fig. 6, Tabla 4). Análisis numérico (lluvias). Por número los decápodos en grupo formaron el 66.7%, y los peces en grupo el 8.4%, siendo los más importantes entre otros grupos (Fig. 6, Tabla 4). Análisis gravimétrico (lluvias). Por peso seco, el grupo de los peces representó el 52% y los decápodos el 44.5%; además de otros grupos de menor importancia (Fig. 6). Índice de importancia relativa IRI = (N + G) (lluvias). Los grupos alimenticios más importantes (en orden decreciente) fueron los decápodos, los engráulidos, la materia orgánica, los carideos, larvas de invertebrados y los huevos de crustáceos. Otros grupos de menor importancia estuvieron formados por peces Ariidae,peces no identificados, poliquetos y larvas de tunicados (Tabla 4). 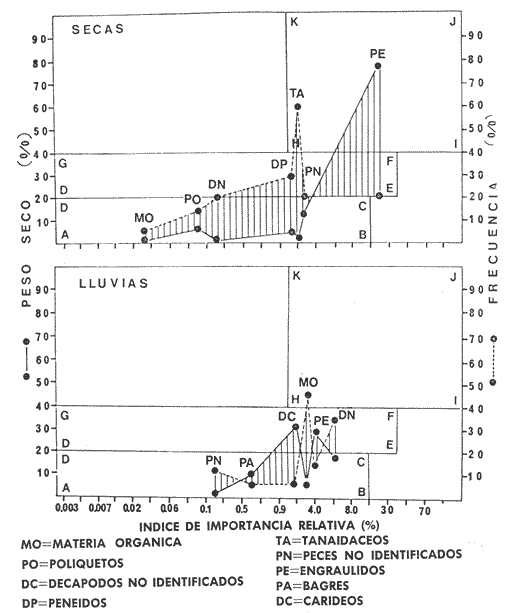 Fig. 7. Análisis del espectro trófico combinado por medio de los métodos de frecuencia, gravimétrico y el índice de importancia relativa de Yáñez-Arancibia et al. (1976) graficado en escala logarítmica. Se muestra el análisis para dos épocas climáticas: secas (arriba) y lluvias (abajo). Índice de importancia relativa IIR = F (G) /100 y análisis combinado (lluvias). Según los resultados de la figura 7 y tabla 4, el alimento preferencial estuvo representado por materia orgánica no determinable; el alimento secundario lo formaron los decápodos, los carideos y los engráulidos; el alimento circunstancial lo integraron los peces no identificados, los Ariidae y otros grupos de menor importancia. Relación gravimétrica (lluvias). La relación gravimétrica parece incrementarse conforme aumenta el peso (Fig. 8). Análisis alimenticio por talla. La alimentación consistió de crustáceos (tanaidáceos y decápodos) en los individuos juveniles, y peces y decápodos en los adultos (Tabla 5). 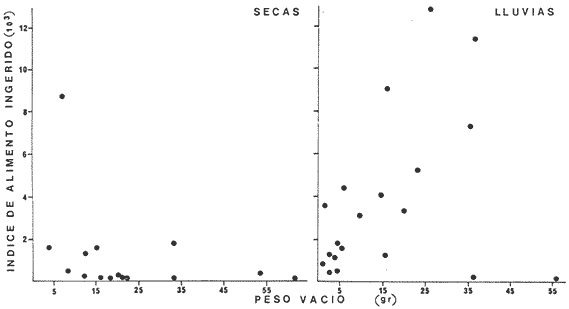 Fig. 8. Dispersión gravimétrica del alimento en relación al peso de B. chrysoura en la época de secas (izquierda) y en la época de lluvias (derecha). En general la alimentación de B. chrysouraestuvo constituida por dos grupos tróficos principales; los crustáceos y los peces; además de un grupo misceláneo dominado por larvas de invertebrados y poliquetos. Los reportes bibliográficos acerca de la alímentación deB. chrysoura son abundantes, pero dentro de los más importantes se pueden mencionar a Darnell (1958) en el Lago Pontchartrain, La., quien señala que esta especie se alímenta de un grupo heterogéneo de crustáceos, el cual subdividió en crustáceos pequeños y peneidos y palemónidos; y otro grupo de material misceláneo en el cual figuran también los peces. Springer y Woodburn (1960) en Tampa Bay, Fla., señalan que la alimentación de la especie estuvo constituida de copépodos durante las primeras etapas y conforme aumenta en talla, se alimentó* de crustáceos más grandes y peces. Odum y Heald (1972) en estudios realizados en North River, Fla., señalan que en etapa larvaria la especie se alimenta de copépodos y larvas de peces en igual proporción, predominando en frecuencia las larvas de Menidia berillina, la alimentación de los adultos estuvo constituida por misidáceos y Anchoa mitchilli. Carr y Adams (1973) estudiando en Crystal River, Fla., encontraron que los juveniles (< 40 mm), se alimentaron en su mayoría de copépodos y confor me crecían se alimentaban más de Neomysis americanus, anfípodos y otros crustáceos más grandes, los peces llegan a ser el alimento más importante para los especímenes mayores de 70 mm de longitud. Chao y Musick (1977), en especímenes de York River, Virginia, señalan que éstos se alimentan principalmente de peces y macrozooplancton, Anchoa mitchilli y Neomysis americanus respectivamente. Levine (1978), en el Lago Pontchartrain, La., encontró que el 97.81% del alimento de B. chrysoura lo constituían crustáceos; de éstos el 93.83%, lo formaba Mysidopsis almyra y el restoCorophium spp, Gammarus macromucronatus e isópodos. Se observaron poliquetos nereidos y larvas de dípteros. No se encontraron restos de peces. El análisis de los resultados, comparados con los dato de la bibliografía, hace resaltar la importancia alimenticia que representan los crustáceos para B. chrysoura;aunque dentro de este grupo haya una alta diversidad de organismos. Asimismo, los peces registran en este estudio un alto porcentaje del alimento de la especie. Otros autores destacan también la importancia de los peces como componente alimenticio para B. chrysoura, excepto Levine (1978), quien no encontró rastros de peces en los especímenes que estudió. Por otro lado, solamente Darnell (1958), encontró pequeñas cantidades de vegetales, que es muy probable que fuera ingerido accidentalmente. Otro grupo de menor importancia lo constituyeron poliquetos, larvas de invertebrados y materia orgánica no determinable. 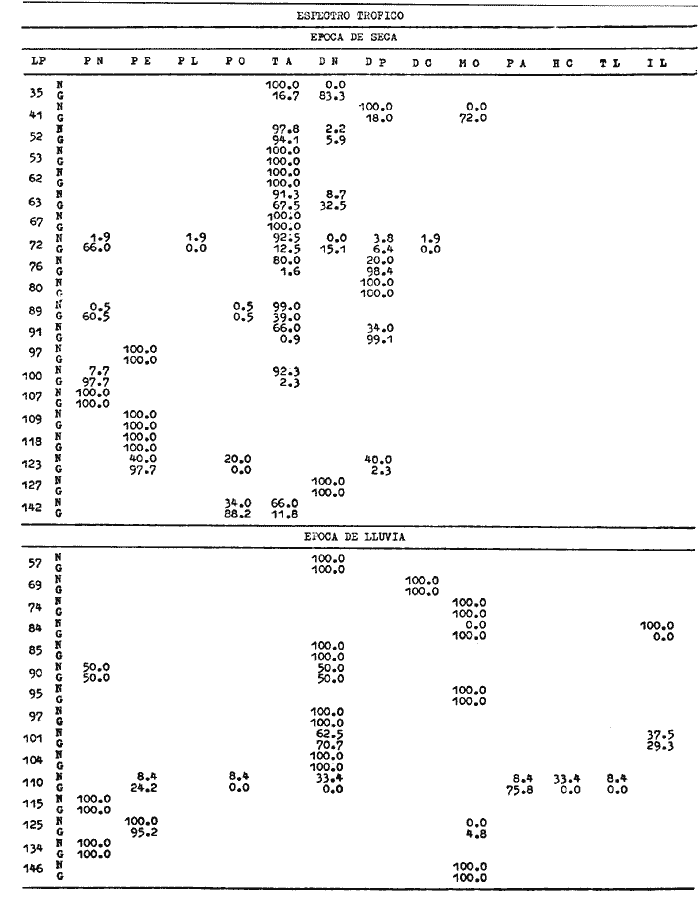 TABLA 5 ANALISIS DEL CONTENIDO ESTOMACAL EN RELACION LA TALLA (MM). SE MUESTRAN LOS PORCENTAJES EN NÚMERO (N) Y PESO SECO (G) DEL ALIMENTO DE DOS EPOCAS CLIMATICAS: SECA (ARRIBA) Y LLUVIA (ABAJO). LP = LONGITUD PATRÓN, PN = PECES NO IDENTIFICADOS, PE,= ENGRAULIDOS, PL = LARVA DE PES, PO = POLIQUETOS, TA = TANADICEOS, DN = DACAPODOS NO IDENTIFICADOS, DP= PENEIDOS. DC = CARIDEOS, MO = MATERÍA ORGANICA NO DETERMINABLE, PA = BAGRES, HC = HUEVOS DE CRUSTACEO, TL = LARVA DE TUNICADO, IL = LARVA DE INVERTEBRADO. El análisis de la alimentación por talla, mostró que los juveniles se alimentaron de tanaidáceos y decápodos; mientras que los adultos, se alimentaron principalmente de peces y decápodos. Springer y Woodburn (1960) reportan que la alimentación varía de copépodos en los juveniles a crustáceos más grandes y peces en los adultos. Odum y Heald (1972) señalan que las larvas deB. chrysoura, se alimentan de copépodos y larvas de peces por partes iguales; mientras que los adultos se alimentan de peces (Anchoa mitchilli) y misidáceos. Carr y Adams (1973), encontraron que los especímenes más pequeños (<40 mm) se alimentaron principalmente de copépodos y conforme aumentaron de talla se alimentaron deNeomysis americanus, anfípodos y crustáceos más grandes, pero los peces fueron el alimento más importante para los especimenes mayores de 70 mm de longitud. Como se observa en los resultados de este estudio y los datos de la literatura, existe un notable cambio en la alimentación conforme aumenta la talla. Esto puede deberse al cambio de hábitos desde larvas planctónicas, por lo que predominan en su alimentación copépodos y larvas de peces (Springer y Woodburn, 1960; Odum y Heald, 1972; y Carr y Adams, 1973), en cambio, los juveniles pueden desplazarse al fondo y alimentarse de organismos bentónicos como tanaidáceos, anfípodos y crustáceos; cuando tienen mayor talla, pueden variar su espectro trófico, alimentándose en mayor proporción de crustáceos como peneidos y carideos de organismos nectónicos (peces pequeños). Los análisis estacionales (lluvias y secas) se realizaron en especímenes de diferentes regiones, por lo que las diferencias encontradas pueden atribuirse a este hecho. Se sabe que los hábitos alimenticios de los peces cambian con la edad, la localidad dentro del estuario, la época del año y la disponibilidad de alimento (Yáñez-Arancibia y Nugent, 1977). Sin embargo, los crustáceos y los peces fueron los grupos predominantes tanto en frecuencia como en peso. Los tanaidáceos tienen un gran porcentaje en la época de secas y no aparece en la de lluvias, pero esta diferencia puede deberse a la diferencia de localidad. Por otro lado, esto refleja la característica oportunista de B. chrysouraalimentándo se según la disponibilidad de alimento (Chao y Musick, 1977). La relación gravimétrica reflejó también la diferencia de la disponibilidad de alimento de cada localidad más que el cambio de época climática. En resumen, se establece queB. chrysoura es un consumidor de tercer orden, que preda sobre decápodos y peces principalmente, excluyendo los vegetales de su dieta. Existe un cambio alimenticio en relación a la talla, predominando crustáceos pequeños (decápodos y tanaidáceos) en los juveniles; y peces y decápodos de mayor tamaño en los adultos. Esta especie se alimenta oportunísticamente en la etapa adulta, dependiendo de la disponibilidad de alimento de la localidad. ÉPOCA DE REPRODUCCIÓNEl porcentaje de hembras maduras es muy alto de febrero (80%) a abril (73%) de 1980, decreciendo paulatinamente hasta julio. Este porcentaje es nulo de agosto a octubre. En noviembre el porcentaje de hembras maduras comienza a incrementarse, volviendo a alcanzar valores máximos de febrero (68%) y a abril (85%) de 1981 (Fig. 9). Estos valores indican que la mayor parte de las hembras alcanzaron su madurez de febrero a abril de 1980, empezando en este momento su reproducción, que se extiende hasta julio del mismo año. Otro periodo de maduración y de reproducción se observa en noviembre, incrementándose hasta culminar nuevamente de febrero a abril de 1981. Proyectos sobre investigaciones ictioplanctónicas simultáneas a este estudio, desarrolladas por el Instituto de Ciencias del Mar y Limnología (UNAM) encontraron huevos de B. chrysoura de mayo a octubre de 1980 y de enero a abril de 1981. Mostrando un pulso de abundancia en julio de 1980 en la región nororiental de la laguna (comunicación personal de Arturo Sánchez Iturbe y César Flores Coto). La presencia de huevos se traslapa con los periodos de reproducción antes descritos, también en los meses en que el porcentaje de hembras maduras es casi nula (agosto a octubre). Flores Coto y Alvarez Cadena (1980), encontraron esta especie en la comunidad ictioplanctónica de la laguna solamente en primavera y verano. Estas informaciones en conjunción con este estudio, conducen a establecer que la especie está en maduración durante todo el año, con un periodo de mayor intensidad de febrero a abril. Por otro lado, hembras maduras (fase III) fueron colectadas en abril de 1980 y de 1981 y hembras desovadas (fase IV) se colectaron en abril de 1980 y de 1981, pero en un número muy pequeño, lo cual significa que el desove es realizado fuera de la laguna por la mayor parte de la población. Amezcua Linares y Yáñez-Arancibia (1980), encontraron adultos y juveniles en los sistemas fluvio-lagunares, lo cual refuerza la proposición de que la especie se reproduce en estas áreas. Odum y Heald (1972), encontraron larvas de B. chrysoura en la parte baja y la boca de North River, en gran abundancia durante el periodo que predominaban condiciones marinas, entre abril y septiembre.  Fig. 9. Epoca de reproducción. Porcentajes mensuales de hembras maduras (fases II, III y IV) y de hembras inmaduras (fase 1) de la corvina B. chrysoura. 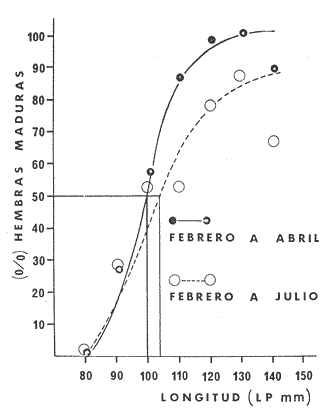 Fig. 10. Longitud de B. chrysoura a la priemra madurez, de la proporción de hembras madurando durante dos periodos de repropdución (febrero de 1980 a abril de 1980 y febrero de 1980 a julio de 1980)en relación ala talla. Barba Torres y Sánchez Robles (1981) reportan a B. chrysouraen estado larvario solamente en primavera y verano para la Laguna de Tamiahua, Ver., siendo éste el único reporte existente para otras lagunas del país en este aspecto. Johnson (1978) resumiendo los trabajos de varios autores, refiere que la época de desove en las costas de los Estados Unidos, se realiza en Nueva jersey de junio a agosto con un pulso en junio; en la Bahía de Delaware, se efectúa de junio a julio con un máximo en junio; en la Bahía de Chesapeake, Virginia, se lleva a cabo de mayo a julio; en Carolina del Norte se realiza de abril a junio; para los estados del Golfo de México como Florida, Louisiana y Texas, la reproducción se realiza de mayo a septiembre. Sin embargo, en Everglades, Fla., que es la región más tropical de las citadas, se lleva a cabo durante todo el año con un pulso de intensidad en enero y febrero. En general, laépoca de reproducción según la información anterior, se realiza en primavera y verano principalmente en los meses de mayo a julio en periodos de duración variable entre dos y cinco meses, excepto en Everglades, en donde B. chrysoura mostró un comportamiento semejante al de la Laguna de Términos de este estudio. TALLA DE PRIMERA MADUREZLa talla de primera madurez osciló entre 100 y 104 mm. de longitud (Fig. 10) antes del primer año de edad (5 meses). la hembra madura más pequeña, midió 86 mm. de longitud. Johnson (1978) reporta que algunos maduran al segundo año, pero la mayoría lo hacen al tercero a tallas de 130 y 140 a 150 y 210 mm. Los datos contrastan con los de este estudio, ya que en ecosistemas tropicales el crecimiento es más rápido y los ciclos de vida son cortos. PROPORCIÓN DE SEXOSEl análisis de proporción de sexos (femenino/ femenino + masculino) de la población, se basó en 745 individuos. Calculada para clases de talla cada 10 mm, la cual varió de 60% para 110 mm a 89% para 140 mm de longitud. Tal proporción tiende a descender a partir de los 80 mm de longitud hasta su valor mínimo en 110 a 120 mm, incrementándose hasta su valor máximo a 140 mm (Fig. 11). Pruebas de X² indicaron que el 78%, es decir una proporción de 3.5:1 es la mejor estimación de la proporción de sexos por talla (Tabla 6). Los valores de X² a 110 y 120 mm tienen desviaciones significativas a 78% hacia valores inferiores. Esto se explica porque a esta talla las hembras ya han madurado y gran parte de la población sale a los sistemas fluvio-lagunares a reproducirse. 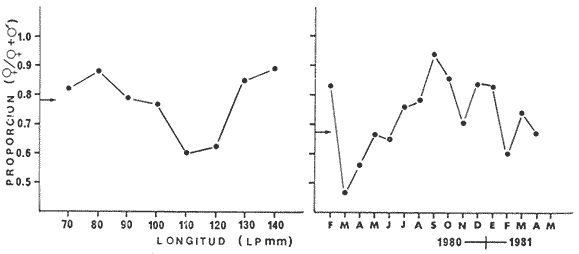 Fig. 11. Comportamiento de la proporción de sexos en relación a la talla (izquierda) y estacionalmente (derecha). Las flechas indican la mejor proporción evaluada por pruebas de x².  Fig. 12. Fecundidad y dinámica del desove. Los histogramas muestran los ovocitos en reposo y los ovocitos madurando que van a ser desovados. Las modas muestran el número de posibles desoyes para cada individuo. LP = longitud patrón, PT peso total y F = fecundidad. El análisis estacional de la proporción de sexos reveló una variación de 47%, en marzo a 87% en septiembre de 1980. Se observó que la proporción de sexos tiende a incrementarse desde marzo de 1980, hasta su valor máximo en septiembre de 1980; a partir de cuando la tendencia se invirtió para alcanzar valores más bajos en febrero de 1981 (Fig. 11, Tabla 7). Pruebas de X² efectuadas mensualmente, indicaron que 67 %, es decir, una proporción de 2: 1 fue la mejor estimación estacional de este parámetro. Los periodos de incremento y decremento antes descritos, se traslapan con periodos de reproducción y maduración respectivamente, concordando los valores más bajos (febrero a abril) con la época de mayor actividad reproductora. Los meses de septiembre de 1980 a enero de 1981, excepto noviembre, mostraron desviaciones significativas de 67%, correspondiendo esto a un tiempo previo a una época de reproducción, por lo que la población no ha realizado migraciones a otras áreas.  TABLA 6 NÚMERO DE HEMBRAS Y MACHOS COLECTADOS EN CADA CLASE DE TALLA Y VALORES DE CHI- CUADRADA PARA PROPORCIONES DE 3:1 Y 3.5:1 (femenino /femenino+ masculino)  TABLA 7 NÚMERO DE HEMBRAS Y MACHOS COLECTADOS DURANTE EL PERIODO DEC MUESTREO Y VALORES DE CHI-CUADRADA PARA PROPORCIONES DE 1.5:1 Y 2.1:1 (femenino /femenino+ masculino) Las hembras realizan migraciones en mayor escala que los machos, por eso es que se observan estos cambios en la proporción de sexos tanto por talla como estacionalmente, mostrándose además un claro predominio de las hembras. FECUNDIDADHistogramas de frecuencia de talla de ovocitos, muestran varios grupos. Se destaca uno de ellos que tiene una moda a 90 micras y se separa claramente de los demás a 110 micras. Este grupo está considerado como la reserva de la gónada. A partir de 120 micras hasta 590, se encuentra el grupo de ovocitos que está madurando para ser desovados en el siguiente periodo de reproducción (Fig. 12). Lo que indica que la dinámica del desove puede llevarse a cabo por partes, es decir, que pueden haber varios desoves parciales en un periodo de reproducción más o menos largo. Se observaron varias modas de las cuales son más conspicuas la que se forma a 250 micras y otra a 350 micras de diámetro. Vazzoler (1970) encontró el mismo fenómeno enMicropogon furnieri; Bagenal (1978) señala la existencia del mismo fenómeno en otras especies de peces, siendo más notable en especies tropicales. 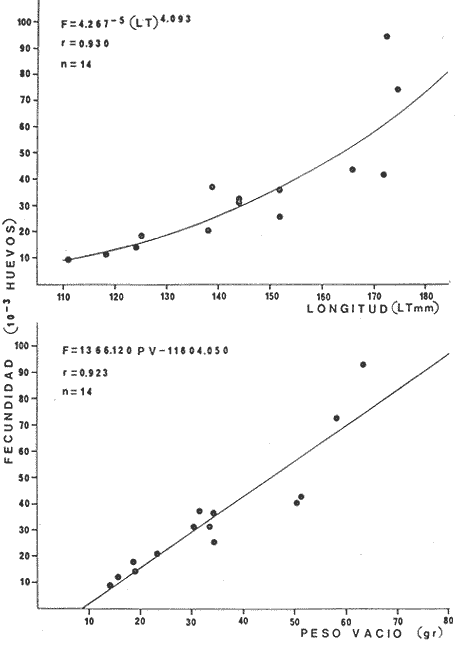 Fig. 13. Fecundidad en relación a la longitud total y su ecuación potencial (arriba). Fecundidad en relación al peso vacío y su ecuación lineal (abajo). F = fecundidad, r = coeficiente de correlación y N = número de individuos. El mayor diámetro de ovocitos encontrado fue de 590 micras (en la gónada), johnson (1978) reporta un rango de talla de 660 a 880 micras para huevos desovados; denotándose una gran diferencia, lo que indica que los individuos analizados, no se encontraban en plena madurez gonádica, que puede ser explicado por las migraciones que realiza la especie para desovar en otras áreas, disminuyendo su capturabilidad en la zona de muestreo. 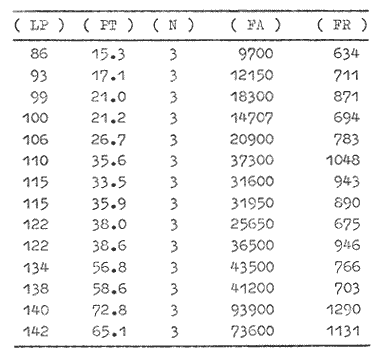 TABLA 8 VALORES DE FECUNDIDAD ABSOLUTA (FA) Y FECUNDIDAD RELATIVA (FR) EN RELACIÓN A LA LONGITUD PATRÓN (LP) Y AL PESOTOTAL (PT), OBTENIDOS DEL PROMEDIO DE TRES ALÍCUOTAS. N= NÚMERO DE ALÍCUOTAS. Los valores de fecundidad oscilaron de 9 700 a 93 900 ovocitos para peces de 86 a 142 mm de longitud respectivamente, con un promedio de 35 068 ovocitos. La fecundidad relativa varió de 634 a 1131 ovocitos/g y un promedio de 863 ovocitos/g (Tabla 8). johnson (1978), reporta una fecundidad de 52 000 ovocitos para individuos de 140 mm de longitud; en éste estudio, se calcularon 62 000 ovocitos para peces de la misma longitud. Regresiones de fecundidad en función de la longitud (total y patrón), mostraron relaciones potenciales, cuyas ecuaciones fueron: F = 4.267X 10-5 (LT ) 4.093, r = 0.930; y F = 4.291 X 10-4(LP)3.802r = 930, respectivamente (Figs. 13 y 14). Regresiones de fecundidad en función del peso (vacío y total), estuvieron relacionadas linealmente, según las ecuaciones: F =1366.120 (PV)-11604, r = 0.923; y F = 1189 (PT) -10470.405, r = 0.927, respectivamente.  Fig. 14. Fecundidad en relación a la longitud patrón y su ecuación potemcial (arriba). Fecundidad en relación al peso total y su ecuación lineal. F,r y N ya fueron definidos antes. Donde F= .0004291 (LP) ^3.802. 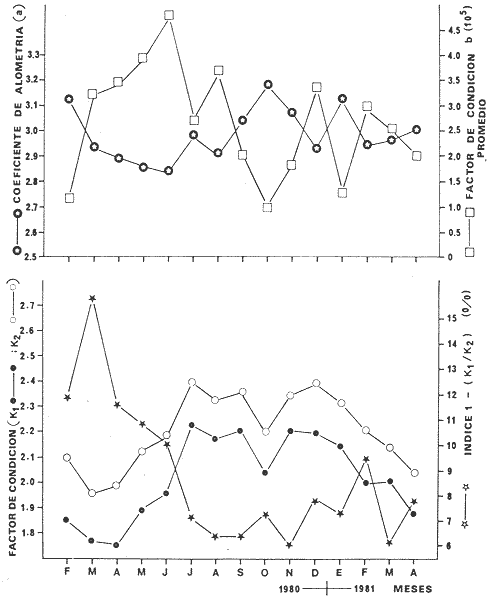 Fig. 15. Comportamiento estacional del coeficiente de alometría y el factor de condición promedio (arriba). Coeficiente de condición relativa e índice visceral (abajo). Los coeficientes de correlación de las relaciones anteriores, mostraron altos valores; sin embargo, la longitud (total y patrón) están más asociados con el comportamiento de la fecundidad. Haynes y Gray (1980), encontraron también que la longitud era el mejor parámetro para predecir el comportamiento de la fecundidad deMicropogonias undulatus. Resumiendo los aspectos reproductivos de la especie, se puede establecer que la reproducción se realiza de noviembre a julio con una época de mayor intensidad de febrero a abril. A una longitud entre 100 y 104 mm, el 50% de las hembras maduraron. La proporción de sexos estuvo desequilibrado hacia las hembras tanto estacionalmente (2:1) como por talla (3.5:1). Las hembras fueron más abundantes en la época de menor actividad reproductora y menos abundantes a partir de la talla de primera madurez. Lo cual indica que las hembras maduras realizan migraciones en la época de reproducción fuera del área de muestreo. La estimación de la fecundidad relativa fue de 863 ovocitos/g. La longitud (total y patrón) fue el mejor predictor de la fecundidad. La especie migra fuera de la laguna en la época de reproducción. RELACIONA TALLA/PESO Y FACTOR DE CONDICIÓNLa regresión predictiva de la relación talla/ peso está expresada por la ecuación: P = 2.51 X 10-5L2.971 con un coeficiente de correlación r= 0.98874 para peso total. Para peso vacío P= 2.25 X 10-5L2.977, r = 0.98739. Ambas relaciones para la población total. Las regresiones predictivas (para peso vacío) siguientes: P = 2.84 X 10-5L2.927, r = 0.98087 y P = 8.55 X 10-6 L3.179 , r = 0.94979, corresponden a hembras y machos respectivamente. Los resultados de las regresiones predictivas de la relación LP/PV (dada por la ecuación 12) mensuales, donde (a) es el coeficiente de alometría y (b) es el factor de condición promedio se resumen en la Tabla 9. 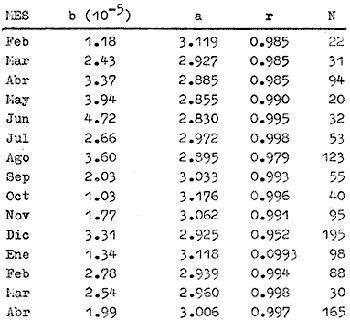 TABLA 9 CONSTANTES DE LA RELACIÓN TALLA/PESO P= b L^a) DURANTE EL PERIODO DE MUESTREO. p = PESO VACÍO, L = LONGITUD PATRÓN,b=FACTOR DE CONDICIÓN PROMEDIO,a = COEFICIENTE DE ALOMETRÍA, r= COEFICIENTE DE CORRELACIÓN Y N = NÚMERO DE INDIVIDUOS El coeficiente de alometría (a) varió de 2.83022 en junio de 1980 a 3.17609 en octubre de 1980 con un promedio de 2.980, manteniéndose en valores muy cercanos a 3 (Fig. 15, Tabla 9). Se observa un decremento en el coeficiente (a) de febrero de 1980 hasta junio de 1980, a partir de entonces se comienza a incrementar llegando a su valor máximo en octubre de 1980. Desde este mes hasta abril de 1981 no se observa un patrón definido, pero la tendencia general va en decremento. El factor de condición promedio (b) varió de 4.72 X 10-5 en junio de 1980 a 1.03 X 10-5 en octubre de 1980, con un promedio de 2.25 X 10-5 . Los valores tienden a incrementarse desde febrero de 1980 a junio de 1980 a partir de cuando empiezan a descender hasta alcanzar su valor mínimo en octubre de 1980 y posteriormente se observa un patrón poco claro de noviembre de 1980 a abril de 1981 (Fig. 15, Tabla 9). El factor de condición relativo K1, mostró oscilaciones desde 1.76 en abril de 1980 a 2.23 en julio de 1980, con un promedio de 2.02. K2 fluctuó entre 1.96 en marzo de 1980 a 2.40 en julio de 1980, con un promedio de 2.21. El comportamiento general de los dos parámetros es similar, observándose los valores más bajos de febrero de 1980 a abril de 1980, a partir de mayo se incrementan los valores hasta julio de 1980 permaneciendo altos hasta diciembre de 1980, en enero comienzan a descender hasta abril de 1981 (Fig. 15, Tabla 9). El índice del peso visceral, osciló desde 0.16 en marzo de 1980 a 0.06 en noviembre de 1980, con un promedio de 0.085. Sus variaciones fueron inversos a los coeficientes K1 y K2 (Fig. 15). El análisis de los coeficientes de condición relativa por clase de talla, registran valores de K1. entre 1.83 para 30 mm a 2.16 para 150 mm de longitud, con un promedio de 2.03. Para K2 se observaron valores de 2.06 para 30 mm a 2.32 para 150 mm de longitud, con un promedio de 2.21. Los dos parámetros variaron de manera semejante, observándose valores bajos para las tallas pequeñas, pero tendiendo a mejorar su condición hasta los 70 mm, a partir de los 80 mm de longitud la condición de la población desciende hasta los 130 mm, posteriormente se vuelve a incrementar hasta los 150 mm de longitud (Fig. 16). 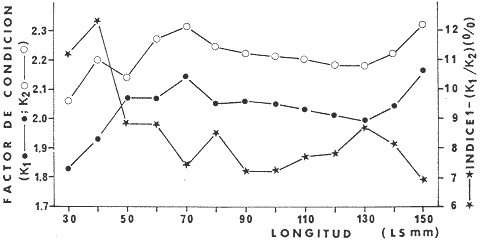 Fig. 16. Relación del factor de condición relativa y del índice del peso visceral respecto a la longitud del pez. El índice del peso vísceral presenta valores altos en las clases de talla pequeñas, tendiendo a decrecer hasta los 100 mm. Entre 100 y 110 mm de longitud el índice se incrementa hasta los 130 mm, para después descender hasta los 150 mm (Fig. 16). El estado de engorda de la población presenta un pulso muy marcado, registrándose valores bajos en agosto de 1980 (3%), incrementándose hasta noviembre de 1980 (71%), a partir de donde decrece hasta alcanzar su valor mínimo (2%) en abril de 1981 (Fig. 17). Los parámetros antes descritos coeficiente de alometría (a), el coeficiente de condición promedio (b), el factor de condición K1, y K2 y el porcentaje de individuos con acumulación de tejido adiposo muestran variaciones que se correlacionan con los eventos de la reproducción, por lo que pueden ser discutidos conjuntamente con base a éstos. 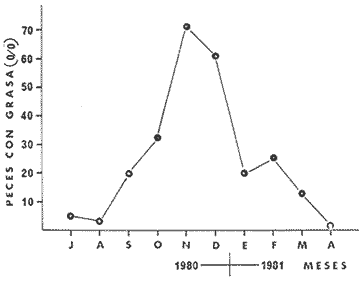 Fig. 17. Variación estacional de la acumulación de tejido adiposo por los individuos de la población de junio de 1980 a abril de 1981. El coeficiente de condición promedio (b) presentó valores altos durante la época de reproducción, descendiendo conforme finalizaba la época de desove (julio a octubre de 1980) y se incrementó a partir de noviembre de 1980 conforme progresaba el siguiente periodo de reproducción. Esta relación indica que existe una fuerte influencia del estado gonádico y de los coeficientes de condición promedio y el de alometría, que oscila inversamente al anterior. El factor de condición relativo (K1, y K2) y el índice del peso visceral, presentan variaciones estacionales marcadas, las cuales, se encuentran influenciadas por cambios en el desarrollo ontogenético y revelan estar asociadas a los fenómenos biológicos del desove y primera madurez. El factor de condición relativo presentó valores bajos en el periodo de mayor actividad reproductora (febrero a abril), decreciendo conforme transcurrió ésta y observándose valores altos de julio a diciembre de 1980, que representa el periodo de menor actividad reproductora, para decrecer en enero de 1981 y registrar valores bajos nuevamente de febrero a abril de 1981. Esto indica que los individuos maduros tienen menor condición que los inmaduros, lo cual es explicable si se toma en cuenta que el factor de condición por talla calculado con la fórmula K = 105/L3, cuyo exponente es 3, representa mejor la condición de los adultos, subestimando la de los juveniles. Por otro lado, el índice de peso visceral se comportó inversamente al factor de condición relativo, presentando valores altos en la época de mayor actividad reproductora (febrero de 1980 a abril de 1980), decreciendo después hasta mostrar valores bajos en la época de cese reproductor (julio de 1980 a octubre de 1980), e incrementándose conforme empieza la siguiente época reproductora de noviembre de 1980 a abril de 1981, indicando que los cambios de peso visceral fueron ocasionados principalmente por la maduración gonádica en un ciclo reproductor completo. El factor de condición relativa y el índice del peso visceral por talla observaron un comportamiento inverso. El aumento en condición de los juveniles hasta los 70 mm de longitud, decrece posteriormente hasta los 90 mm, existiendo un decremento más notable a partir de los 100 mm, hasta 130 mm de longitud, desde donde se incrementa nuevamente. El índice de peso visceral presenta valores altos para los juveniles, decreciendo hasta los 90 mm de talla, presentando una clara tendencia a aumentar a partir de 100 a 110 mm, coincidiendo esto con la talla de primera madurez, por lo que se infiere que este aumento se debe al incremento en peso de las gónadas que empiezan a madurar. A partir de 130 mm, la tendencia es a decrecer indicando probablemente el desove; sin embargo, se tienen pocos datos de 140 a 150 mm de longitud. El porcentaje de individuos con grasa, presenta un aumento desde julio de 1980 hasta noviembre y diciembre de 1980, cuando se presenta un pulso justo antes de un periodo de reproducción; posteriormente descienden y presentan valores bajos en la época de reproducción de febrero a marzo de 1981. Esto indica por una parte que la grasa es utilizada para madurar y por otra parte, la podrían utilizar también para migrar a las áreas de desove aledañas a la laguna. En general, la evolución del ciclo reproductor afecta a los parámetros antes analizados, ya que todos de alguna manera reflejan el estado y evolución de la maduración gonádica. El coeficiente de alometría y el factor de condición relativa, mostraron una correlación inversa al ciclo reproductor de B. chrysoura. El factor de condición promedio y el índice del peso visceral se correlacionaron directamente con el ciclo reproductor a lo largo del periodo de estudio. El factor de condición relativa y el índice del peso visceral se correlacionaron inversa y directamente con la madurez gonádica según la talla, mostrando cambios notables entre 110 y 110 mm de longitud, que corresponden a la talla de primera madurez. EDAD Y CRECIMIENTOSe observa el crecimiento de una generación desde mayo de 1980 hasta enero de 1981, alcanzando una longitud de 135 a 140 mm. Otra cohorte, se aprecia claramente de febrero de 1980 a julio de 1980, alcanzando entre 120 y 125 mm de talla. Asimismo, se observa la llegada de reclutas de febrero a abril de 1981 (Fig. 18). Del desplazamiento de modas mensualmente, se calculó un crecimiento promedio de 9 mm. El método de Petersen aplicado a poblaciones de peces tropicales, presenta algunas objeciones ya que los fenómenos reproductivos no son marcadamente estacionales, incorporándose reclutas a la población incesantemente. Esto dificulta la determinación de edad. Sin embargo, este método en conjunción con el de Ford-Walford, permitió calcular la tasa de crecimiento mensual, así como, el valor asintótico de la longitud, cuyos valores fueron K = 0.123469 y Loo = 163 mm respectivamente. El análisis al microscopio de preparaciones de otolitos, reveló que éstos presentan un patrón regular de microincrementos formados por 2 bandas concéntricas alternándose una oscura y una clara de aproximadamente 10 micras de espesor en conjunto (Pannella, 1974). Estos microincrementos mostraron una relación directa con el aumento en longitud (Fig. 19). El resultado de ensayar el método de Beverton para varios valores de Loo indicó que el mejor adaptado a los datos correspondió a 163 mm, r = 0.9024 y una constante de crecimiento K = 0.00837 en días (Fig. 19). Es importante señalar que el valor de Loo obtenido con datos de crecimiento mensual por los métodos de Petersen y Ford-Walford y el obtenido con los datos de crecimiento diario fue el mismo, apoyando de ésta manera la determinación de edad a partir de marcas de crecimiento diario; por otro lado la tasa de crecimiento mensual K = 0. 12013 y la de crecimiento diario K = 0.00837 no son equivalentes, ya que K = 0.00837 X 30.5 días = 0.25529, siendo mayor la tasa de crecimiento diario, probablemente por la existencia de crecimiento diferencial, ya que los datos mensuales provienen de individuos de todas las localidad,es de la laguna y de todas las épocas, mientras que el crecimiento diario se estimó de individuos capturados dentro del área más propicia a la especie (Bajos de Sabancuy y zonas aledafias) y durante la época de secas (abril), cuando las condiciones son más estables en la laguna.  Fig. 18. Comportamiento estacional de las clases de talla modales. Cada barra está dada por un par de clases modales, el punto es la parte media de cada barra Los puntos aislados representan clases modales únicas (arriba). Gráfica de Ford-Walford. La flecha señala la longitud infinito (Loo) obtenida de datos de crecimiento mensual. 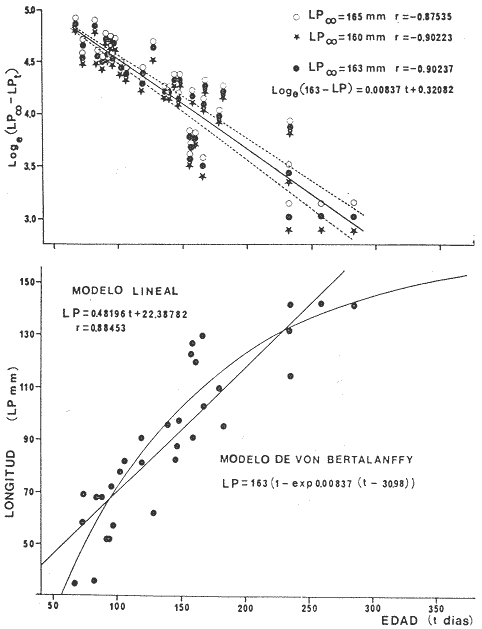 Fig. 19. Crecimiento de B. chrysoura de marcas de crecimiento diario en otolitos. La mejor estimación de la longitud asintótica por el método de Beverton (arriba). Modelo de crecimiento de von Bertalanffy adaptado a los datos, así como un modelo de crecimiento lineal (abajo). A partir de los datos de edad y longitud se calculó el modelo de crecimiento en longitud de von Bertalanffy. Las constantes Loo, K y to, se obtuvieron del método de Beverton, definiendo el crecimiento de la especie por la siguiente expresión: Lt = 163 (1 - e-0.001337 (t30.98)) Un modelo lineal se calculó para los mismos datos, definiendo el crecimiento diario por la siguiente expresión: Lt = 0.48196 (t) + 22.38782, r = 0.88453. De la ecuación de von Bertalanffy por talla, se calculó el crecimiento en peso, expresado por la expresión matemática: Wt = Woo (1- e-K (t-t') )³, donde Woo = peso asintótico, obtenido de la relación talla/peso, cuando la longitud es infinita, correspondiendo a 94 g. Obteniendose entonces la ecuación: Wt = 94 (1 - e-0.00837(t-30.98) )³ . Se estimó la longevidad de B. chrysoura como el 95% del tiempo en que alcanza la longitud infinito, correspondiendo este valor a 13 meses. Lo que indica que ésta es una especie de crecimiento rápido y ciclo de vida corto. Aunque podría suceder que los valores de crecimiento y longevidad presenten cierto sesgo, ya que la especie realiza migraciones hacia los sistemas fluvio-lagunares, en donde podrían encontrarse tallas mayores. Resumiendo los aspectos de crecimiento, se puede decir que la estimación de crecimiento mensual y de crecimiento por día fueron complementarias; permitiendo establecer que la determinación de edad por medio de marcas díarias en otolitos, es un método eficaz. Las estimaciones de crecimiento así como la longevidad se ven afectadas por las migraciones de los individuos maduros hacia los sistemas fluvio-lagunares 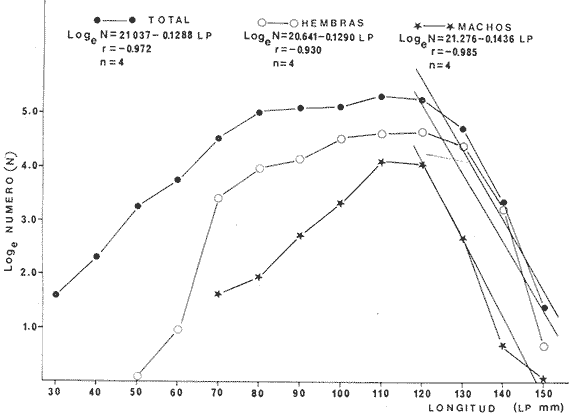 Fig. 20. Curva de captura y modelo exponencial de mortalidad por talla, adaptados a la población total (hembras más machos), a las hembras y a los machos. MORTALIDADDe la curva de captura se observó que B. chrysoura se capturó eficientemente hasta los 110 mm de longitud. También se calculó el coeficien te instantáneo de mortalidad natural, Z = 0.1288 que corresponde a 12.10% de mortalidad por milímetro de crecimiento, expresada por la ecuación: LogeN = 21.137-0.1288 LP, r = -0.972, para la población total; Z = -0.1290, corresponde a una mortalidad de 12.10%, por milímetro, expresada en la ecuación: LogeN = 20.641 g - 0.1290 LP, con r = -0.930, para las hembras; y Z= 0.1436, que corresponde a una mortalidad de 13.38 por ciento por milímetro de crecimiento, expresada por la ecuación: LogeN = 21.276 - 0.1436 LP, r = -0.985 para los machos (Fig. 20). El coeficiente instantáneo de mortalidad natural por edad, está dado por las ecuaciones: LogeN = 9.754 0.025t, r = -0.0984, Z = 0.025, que es igual a 2.47% de mortalidad por día para la población total; LogeN = 9.113-0.024t, r = -0.952, Z= 0.024, correspondiendo a 2.37% de mortalidad por día para las hembras; y LogeN = 8.919 - 0.028t, r = -0.962, Z = 0.028, que corresponde a una mortalidad de 2.76% por día para los machos. Es necesario señalar que la talla a la que se captura eficientemente la especie en la laguna representa a individuos que están en maduración, siendo mal capturados los especímenes en reproducción fuera del área de muestreo. La regresión entre la altura y la longitud del pez, comparada con la luz de malla del equipo de pesca, reveló que la red era capaz de capturar eficientemente especímenes desde los 62 mm de longitud (Fig. 21). Esto indica que los juveniles se encuentran fuera de la laguna, en las áreas de reproducción, desde donde se dirigen a la laguna después de los 62 mm de talla. El coeficiente instantáneo de mortalidad natural por edad, con respecto al de talla, está subestimado, debido a que al calcular la edad a partir de la longitud con el modelo de von Bertalanffy, los intervalos de tiempo en que se incrementa una unidad de longitud o clase de talla varía aumentando conforme el crecimiento se acerca a su valor asintótico.  Fig. 21. Relación de la altura y la longitud de Bairdiella chrysoura comparado con la luz de malla de la red (±20mm), para estimar la talla mínima que cpatura la red señalada por la flecha. A = altura, LS=longitud estándar o patrón, r= coeficiente dce correlación y N = número de individuos. La mejor estimación del coeficiente Z en edad se obtuvo del coeficiente Z de la población total en milímetros, por la tasa de crecimiento lineal (a); como no hay diferencia notable entre la mortalidad total, la de hembras y la de machos, se utilizó el coeficiente total. Teniéndose entonces: Z = 0.129; a= 0.482, 0.129 X 0.482= 0.0622 = Z por dia, que corresponde a 6.03% de mortalidad por día; el equivalente en mes y año está dado por: 0.0622 X 30.5 = 1.8964 = Z por mes 0.0622 X 365 = 22.6950 = Z por año. EDAD CRÍTICALa curva de crecimiento en peso de von Bertalanffy, observa un desarrollo normal, en contraste con la curva del número de individuos, la que muestra una caída desde los primeros meses. La curva del producto del peso y el número de individuos o biomasa, alcanza el valor máximo o edad crítica a los 4 meses, registrando un decaimiento muy rápido cuando el crecimiento aún continúa (Fig. 22).  Fig. 22. Edad crítica dada por la cima de la curva de biomasa a la edad t en meses. Se muestran la curva de crecimiento de von Bertalanffy y la evolución de un grupo de 1000 individuos (Z obtenida de la curva de captura) hasta los 13 meses de edad. Este fenómeno se explica por el hecho de que los individuos en reproducción salen de la laguna y penetran a los sistemas fluvio-lagunares, lo que provoca una mortalidad alta; asimismo, la edad crítica se ve afectada por la alta mortalidad. EVALUACIÓN DE BIOMASAEl número de individuos estimado del producto de la densidad promedio por el área de la laguna tomando en cuenta que el equipo de pesca tiene un 20% de eficiencia en la captura de la especie, fue del orden de 23 X 106 individuos que produjeron una biomasa de 500 toneladas métricas. En resumenBairdiella chrysoura se capturó eficientemente a los 110 mm de talla, debido a que los individuos salen hacia los sistemas fluvio-lagunares a reproducirse y los juveniles llegan a la laguna después de los 62 mm de longitud, por lo que la mortalidad está sobreestimada, repercutiendo inversamente en la edad crítica y en la evaluación de biomasa. Conclusiones1. La corvinaBairdiella chrysoura es una especie típicamente estuarina. Desarrolla todo su ciclo de vida en el ambiente de la Laguna de Términos, adaptándose a los cambios climáticos de la zona. 2. Se encuentra en todos los habitat de la Laguna de Términos, pero en mayor abundancia en el área nor-oriental de la laguna (desde Bajos de Sabancuy hasta Chumpam-Balchacah y la parte oriental de la cuenca central) en salinidades entre 10 y 35 ppm. Hallán dose representadas todas las etapas de desarrollo de la especie. 3. Es un consumidor de tercer orden que preda sobre decápodos y peces principalmente, excluye de su dieta a los vegetales. Existe un cambio de alimentación a 72 mm de longitud. Predominando decápodos más grandes y peces en los adultos (después de los 72 mm de talla). Se alimenta oportunísticamente dependiendo de la disponibilidad de alimento. 4. La reproducción la realiza durante 9 meses (de noviembre a julio) con un pulso de intensidad de febrero a abril. Madura entre 100 y 104 mm de longitud a 5 meses de edad Las hembras representan el 67% de la población adulta, las cuales se encontró tienen una fecundidad promedio de 35068 que es más elevada comparándola con la de la misma especie en otras latitudes. 5. La condición de la población varía con los cambios en la dinámica reproductora. Almacena energía en forma de tejido adiposo que utiliza para madurar las gónadas y/o migrar a las áreas de desove. 6. El crecimiento es muy rápido y el ciclo de vida es corto. Siendo la longevidad de 13 meses y las constantes de la ecuación de crecimiento de von Bertalanffy: Loo = 163 mm, K = 0.26 y to = 1.02 por mes. 7. Los fenómenos biológicos y dinámicos de B. chrysoura están fuertemente afectados por el reclutamiento y por migraciones de adultos en la época de reproducción. 8. El coeficiente instantáneo de mortalidad (Z = 1.89 mes) y la biomasa (B = 6.15 X 10-2 g m-²) son altas, viéndose afectadas directa e inversamente por las migraciones respectivamente, mientras que la biomasa refleja claramente la influencia del reclutamiento. AgradecimientosAl Consejo Nacional de Ciencia y Tecnología (CONACYT), el apoyo institucional y económico para la realización de estos estudios a través del Proyecto QCMACFR-001698 del Convenio UNAM-CONACYT. Al Instituto de Ciencias del Mar y Limnologia, el apoyo institucional y económico, las facilidades de equipo y materiales y los laboratorios e instalaciones en Ciudad del Carmen. Al personal administrativo y académico de la Estación "El Carmen" su colaboración en actividades de campo. A los colegas Alfredo Laguarda Figueras, Antonio García Cubas, César Flores Coto y Luis R. Segura, por la lectura del manuscrito y sugerencias. A Julia Ramos Miranda, Arturo Sánchez Iturbe, Eduardo Sainz Hernández y Ana Laura Lara-Domínguez, su colaboración técnica y ayuda de campo y laboratorio para el desarrollo del trabajo. LITERATURAAMEZCUA LINARES, F. A. YÁREZ-ARANCIBIA,An. Centro Cienc. del Mar y Limnol. Univ. Nal. Autón. México,Ecología de los sistemas fluvio-lagunares asociados a la Laguna de Términos. El habitat y estructura de las comunidades de peces.1980.69-118.7(1): AOYAMA, T., ln: Japanese Materials.Concerning the survey of food habits specially the survey of food habits of benthos fishes wich were caught at Yellow Sea and East China Sea.1956. BAGENAL, T. B., Ecology of Freshwater Fish Production.Aspects of fish fecundity. In:Gerking, S. D. (Ed.)Blackell Scientific Publications, :Oxford1978.75-101. BAGENAL, T. B. E. BRAUM, Eggs and early life history. In: Bagenal, T. B. (Ed.) Methods for Assessment of Fish Production in Freshwaters BlackWeIl Scientific Publications, :Oxford1978.165-201. BAGENAL, T. B. F. W. TESCH, Methods for Assessment of Fish Production in Freshwaters. Age and growth. In: Bagenal, T. B. (Ed.)Blackwell Scientific Publications,Oxford:1978101-130.. BARBA TORRES, J. F. J. SÁNCHEZ ROBLES,Tesis profesional Abundancia, distribución y estructura de la comunidad ictioplanctónica, en la Laguna de Tamiahua, Veracruz, a través de un ciclo anual.Fac. Ciencias Univ. Nal. Autón. México,1981.57 p. BRAVO-NUÑEZ, E. A. YÁÑEZ-ARANCIBIA, An. Centro Cienc. del Mar y Limnol. Univ. Nal. Autón. México,Ecología de la Boca Puerto Real, Laguna de Términos. I. Descripción del área y análisis estructural de las comunidades de peces.1979.125-182.6(1): CARR, W. E C. A. ADAMS, Food habits of juvenile marine fishes occupying seagrass beds in the estuarine zone near Crystal River, Fla. Trans. Am. Fish. Soc.,1973.511-540.102(3): CHAO, L. N. J. A. Musick, Fish. Bull., Life history, feeding habits, and functional morphology of juvenile sciaenid fishes in the York River estuary,Virginia.1977.657-702.75(4): CHÁVEZ, E. A.,Mem. IV Congr. Nac. Ocean. Notas acerca de la ictiofauna del estuario del río Tuxpam y sus relaciones con la temperatura y salinidad. (México) :1972.171-175. DARNELL, R. M., Food habits of fishes and larger invertebrates of Lake Pontchartrain, an estuarine community. Publ. Inst. Mar. Sci. Tex.,1958.353-416.5: DAY, JR. J. W. A YÁÑEZ-ARANCIBIA,Ciencia Interamericana,Coastal lagoons and estuaries, ecosystem approach.1982.11-26.22(1-2): DICKIE, L. M., Methods for Assessment of Fish Production in Freshwaters. Mathematical models of growth. In: Bagenal, T. B. (Ed.)Blackwell Scientific Publicatíons,Oxford:1978.130-136. FISCHER, W. (Ed.)., FAO Species Identification Sheets for Fishery Purpouses. Western Central Atlantic (Fishing area 31) FAO, .Roma,1978.2 FLORES COTO, C. J. ÁLVAREZ CADENA,An. Centro Cienc. del Mar y Limnol. Univ. Nal. Autón. México,Estudios preliminares de distribución y abundancia del ictioplancton en la Laguna de Términos, Campeche.1980.67-78.7(2): GULLAND, J. A., Manual de Métodos para la Evaluación de las Poblaciones de Peces. Ed. Acribia,Publicación FAO.España,1971.164 p. ---,Manual of Methods for Fisheries Resource Survey and Appraisal. Part 5-Objetives and basic methods.FAO.Roma,1975.29 p. HAYNES, J. M. R. H. GRAY, Fish. Bull.,Maturity, spawning, and fecundity of atlantic croacker, Micropogonias undulatus, occurring north of Cape Hatteras, North Carolina.1980.190-195.78(1): HILGE, V., On the determination of the stages of gonad ripeness in female bony fishes. Sonderdruck aus Bd.,1977.149-155.25: JOHNSON, D. G., Development of Fishes of the Mid-atlantic Bight.An Atlas of Egg Larval and juvenile stages,1978.172-179.IV: JORDAN, D. S. B. W. EVERMANN,Bull.The fishes of north and middle America.U. S. Nat. Mus.,1896-1900.1-3313.2(47): LARA-DOMÍNGUEZ, A. L. A. YÁÑEZ-ARANCIBIA F. AMEZCUA LINARES,An. Inst. Cienc. del Mar y Limnol.Biología y ecología del bagre Arius melanopus Günther, en la Laguna de Términos, sur del Golfo de México. Univ. Nal. Autón. México.,1981.267-3048(1): . LE CREN, E. D., The length-weight relationship and seasonal cycle in the perch (Perca fluviatilis) . J. Anim. Ecol.,1951.201-219.20: LEVINE, S. J., Gut contents of forty-one Lake Pontchartrain fish species. (Mimeografiado).1977-78. LIVINGSTON, R. J. N. P. THOMPSON D. A. METTER, Long term variation of organo chIorine residues and assemblages of epibenthic organism in a shallow north Florida estuary.Mar. Biol.,1978.355-372.46: LOESCH., H. J. BisHop A. CROWE R. KucKy P. WAGNER, Tecnique for estimating traw1 efficiency in catching brown shrimp (Penaeus aztecus), atlantic croacker (Micropogon undulatus) and spot (Leiostomus xanthurus).Gulf Res. Rep.,1976.29-33.5(2): MACKAY, I. K. H. MANN, Fecundity of two cyprinid fishes in the river Thames, Reading, J. Fish. Res. Bd. Canada,England.1969.2795-2805.26: NIE, N. H. C. H. HULL J. G. JENKINSK. STEINBRENNER D. H. BENT, Statistical Package for the Social Science McGraw-Hill Co.,N. Y.1975.675 p. ODUM, "VV. E. E. J. HEALD, Trophic analysis of an estuarine mangrove community. In: Estuarine Research. Chemistry, Biology and The Estuarine System.Cronin, E. L. (Ed.) Academic Press Inc.,N. Y.,1972.265-286.1: PANNELLA, G., Otolith growth patterns: an aid in age determination in temperate and tropical fishes. In: Bagenal,T. B. (Ed.) Agein of Fish. Unwin Brothers Limited:1974.25-39 PHLEGER, F. B. A. AYALA-CASTAÑARES,Bull.,Processes and history of Terminos Lagoon, México. Am. Assoc. Petrol. Geol.1971.2130-2140.55(2): PINKAS, L. M. S. OLIP14ANT I. L. IVERSON, Bull., Food habits of albacore, blue fin tuna and bonito in California waters.Dept. Fish and Game Cal. Fish.1971.1-105.152: RESÉNDEZ, M. A., Estudio de los peces de la Laguna de Tamiahua, Veracruz, México. An. Inst. Biol. Univ. Nal. Autón México Ser. Cienc. del Mar y Limnol.,1970.79-146.4(1): RICKER, W. E., Bull. Computation and interpretation of biological statistics of fish population.Fish. Res. Bd. Can.,1975.1-382.191: SÁNCHEZ, C. J., Contribución al conocimiento de la ictiofauna de la Laguna de Mandinga y sus pesquerías. Informe del trabajo de integración de conocimientos que como uno de los requisitos para optar al título de biólogo.E.N.C.B. IPN,1977.35 p. SHERIDAN, P. F. R. J. LIVINGSTON,Cyclic trophic relationships of fishes in an unpolled, river-domínated estuary in north Florida. In:Ecological Processes in Coastal and Marine Systems. Livingston, R. J. (Ed.) Mar. Sci. Plenum Press,N. Y.,1979.143-161.10: SPRINGER, J. G. T. WOODBURN, An ecological study of the fishes of Tampa Bay area, Fla. St. Bd. Prof. Pap. Serv.,1960.1-104.1: SUBRAHMANYAM, C. B. C. L. COULTAS,Bull.Studies on the animal communities in two north Florida salt marshes. Part III: Seasonal fluctuations of fish and macroinvertebrates.Mar. Sci.,1980.790-818.80(4): SUBRAHMANYAM, C. B. S. H. DRAKE,Bull.Studies on the animal communities in two north Florida salt marshes. Part L Fish communities. Mar. Sci.,1975.445-465.25(4) : VARGAS MALDONADO L., A. YÁÑEZ-ARANCIBIAF. AMEZCUA LINARES, An. Inst. Cienc. del Mar y Limnol.Ecologia y estructura de las comunidades de peces en áreas de Rhizophora mangle y Thalassia testudimun de la Isla del Carmen, Laguna de Términos, sur del Golfo de México. Univ. Nal. Autón. México.1981.241-266.8(1): VAZZOLER, A. E. A., Micropogon furnieri: fecundidade e tipo de desova.Bolm. Inst. Oceanogr.S. Paulo,1970.27-32.18(1): WEATHERLY, A. H., Growth and Ecology of Fish Populations.Academic Press,Londres,1972.293 p. WEINSTEIN, M. P., Fish. Bull. Shallow marsh habitats as pri mary nurseries for fishes and shellfish, Cape Fear River, North Carolina.1979.339-357.77(2): WINDELL, J. T. S. H. BOWEN, Methods for study of diets based on analysis of stomach contents. ln:Methods for Assessment of Fish Production in Freshwaters Blackwell Scientific Publications, Bagenal, T. B. (Ed.)Oxford:1978.219-226. YÁNEZ-ARANCIBIA, A. R. S. NUGENT, An. Centro Cienc. del Mar y Lminol. El papel ecológico de los peces en estuarios y lagunas costeras. Univ. Nal. Autón. México,1977.107-114.4(1): YÁÑEZ-ARANCIBIA, A. J. W. DAY, Ecological characterization of Terminos Lagoon a tropical lagoon-estuarine system in the Southern Gulf of México ln:, Coastal Lagoon. Oceanologica Acta. Vol. Spec., Lasserre, P. y H. Postma (Eds.)1982.p. 431-440., 462 p.5 (4) : YÁÑEZ-ARANCIBIA A. J. CURIEL-GÓMEZ V. LEYTON,An. Centro. Cienc. del Mar y Limnol. Univ. Nal. Autón. México,Prospección biológica ecológica del bagre Galeichthys caerulescens (Gunther) en el sistema lagunar costero de Guerrero, México. (Pisces: Ariidae).1976.125-180.3(1): YÁÑEZ-ARANCIBIA, A. F. AMEZCUA LINARES J. W. DAY, JR.,Fish community structure and function in Terminos Lagoon, a tropical estuary in the Southern Gulf of México. In:Kennedy, V.(Ed.) Estuarine Perspectives. Academic Press., N. Y.1980.465-482. YÁÑEZ-ARANCIBIA A. A. L. LARA-DOMíNGUEZ P. CHAVANCE D. FLORES HERNÁNDEZ, An. Inst. Cienc. del Mar y Limnol. Environmental behavior of Términos Lagoon ecological system, Campeche, México.Univ. Nal. Autón. México,1983.137-17610(1): YÁÑEZ-ARANCIBIA, A. A. L. LARA-DOMINGUEZ P. SÁNCHEZ-GIL I. VARGAS MALDONADO P. CHAVANCE F. AMEZCUA LINARES A. AGUIRRE LEÓN Sr. DÍAZ RUIZ In: Coastal Lagoons. Ecosystem dynamics and nichthemeral and seasonal programming of fish community structure in a tropical estuarine inlet, México, Lasserre, P. y H. Postma (Eds.) Oceanologica Acta.1982b.431-440., 462 p.5Vol. Spec., (4): YÁÑEZ-ARANCIBIA, A. A. L. LARA-DOMINGUEZ P. SÁNCHEZ-GIL I. VARGAS MALDONADO MA. DE LA C. GARCíA ABAD H. ÁLVAREZ GUILLÉN M. TAPIA GARCíA D. FLORES HERNÁNDEZ F. AMEZCUA LINARES, Ecology and evaluation of fish community in the Campeche Sound and Terminos Lagoon: estuary-shelf interactions in the Southern Gulf of México.Atlantica Rio Grande,1982a.130.5(4): YÁÑEZ-ARANCIBIA, A. A. L. LARA-DOMíNGUEZ P. SÁNCHEZ-GIL I. VARGAS MALDONADO P. CHAVANCE H. ÁLVAREZ GUILLEN F. AMEZCUA LINARES MA. DI, LA C. GARCíA ABAD D. FLORES HERNÁNDEZ M. ÁLVAREZ RUBIOM. TAPIA GARCíA S. DÍAZ RUÍZ A. AGUIRRE LEÓN J. L. ROJAS GALAVIZ, Las comunidades de peces y el habitat de la Laguna de Términos y de la Sonda de Campeche durante los cruceros de febrero de 1980 a abril de 19.81: Comparación y caracterización de las interacciones laguna-sonda. In: Proyecto de Investigación: "Análisis Comparativo de las Poblaciones de Peces de la Sonda de Campeche y de la Laguna de Términos, antes y después del Derrame Petrolero del Pozo IxtocI".(Tercer informe) PCEESC/ UNAM/ICML (TI),1981.466 p., 337 tablas, 49 Figs.
|

