|
ASPECTOS
REPRODUCTIVOS DEI, "CAMARÓN PRIETO" MACROBRACHIUM ACANTHURUS (WIEGMAN,
1836) EN LA CUENCA DEL RIO GONZÁLEZ, TABASCO, MÉXICO (CRUSTACEA:
DECAPODA: PALAEMONIDAE)
Trabajo presentado en el VII Simposio
Latinoamericano Sobre Oceanografía Biológica, Acapulco, Gro.,
México, noviembre 1981. Recibido el 23 de febrero de 1983 y aceptado
para su publicación el 23 de noviembre de
1983.
ANDRÉS ARTURO GRANADOS BERBER
Instituto de Biología de la Universidad
"Juárez" Autónoma de Tabasco. Apartado Postal 298. Villahermosa,
Tabasco.
El "camarón
prieto"Macrobrachium acanthuruses una especie de gran importancia
económica en el estado de Tabasco, debido a su trascendencia
como recurso y a sus perspectivas de cultivo. El presente trabajo tiene
como objetivo conocer los aspectos reproductivos de esta especie. Se
analizan los resultados de un muestreo de "camarón prieto" obtenidos
durante los meses de marzo de 1980 hasta febrero de 1981, en tres zonas:
1) Laguna de Santa Anita; 2) El Canal; 3) Río González.
Las colectas fueron nocturnas, realizándose con el arte de pesca
llamada "nasa", en 14 estaciones de muestreo. Antes de cada colecta
se tomaron los siguientes parámetros físico-químicos:
temperatura del agua, oxígeno disuelto y salinidad. Las hembras
de M. acanthurus alcanzan la madurez sexual a los 40 mm. de longitud
total. Las hembras ovígeras de longitud total de la clase 70-75
mm. producen alrededor de 5,500 huevecillos. Se determinan los periodos
reproductivos para cada una de las zonas, asi como las relaciones existentes
entre el porcentaje de hembras ovígeras y los parámetros
físico-químicos. The "dark shrimp"Macrobrachium
acanthurus is a species of great enconomic relevance in the state
of Tabasco. Due to its potentiality as a resource and also to the perspective
of farming it. The objective of the present research is knowing the
reproductive aspects of this species. Through the months of March 1980
to February 1981, the fishing. Results were analysed in three zones:
1) Laguna de Santa Anita; 2) EI Canal; 3) Rio Gonzáles. The collection
was done at night by the fishing procedure known as "nasa" in 14 different
recollecting stations. Before each collection the physical and chemical
parameteres were first determined: water temperature, oxigen in water,
and salinity. The female M. acanthurusreach their sexual maturity
at the length of 40 mm. The group formed by the ones having a length
of 70-75 mm. produced about 5,500 eggs. The reproductive periods for
each zone were determined as well as the relationship between the percentage
of females with eggs and the physical and chemical parameters.
El "camarón prieto"Macrobrachium acanthuruses una de las especies de la fauna acuática comercialmente importante en el estado de Tabasco. En la cuenca del Río González la captura del "camarón prieto" constituye una de las bases de la actividad pesquera, ya que es una especie que tiene pesca continua durante todo el año, aunado al hecho que Tabasco cuenta con una gran extensión de areas lacustres y representa una zona de recursos pesqueros potencialmente alta, se hace necesario conocer especialmente los aspectos reproductivos de esta especie, por su potencialidad como recurso y por sus perspectivas de cultivo. Entre los aspectos más importantes en la reproducción de una especie están la madurez sexual, fecundidad y el periodo de reproducción (Margalef, 1974; Weinborn, 1977; Roman, 1979). ANTECEDENTESEn la literatura, existe gran cantidad de información sobre taxonomía del generoMacrobrachium y en menor número acerca de su biología, ecología y pesquería. En Latinoamérica, los trabajos son muy numerosos y entre los más importantes se encuentra el de Holthuis (1952), quien llevó a cabo una revisión de los Palemónidos de América con las especies descritas hasta esa fecha. Mercado (1959), propuso un proyecto para una estación rústica dedicada al cultivo de langostinos. Rodríguez de la Cruz (1965, 1968) realizó estudios sobre el conocimiento de los Palemónidos de México. Ling (1967) llevo a cabo importantes estudios sobre la Biología y Cultivo deM. rosenbergii. Carrillo (1967) describió detalladamente la morfología externa de M. acanthurus. Choudhury (1970, 1972) realizó en Jamaica estudios de interés sobre la crianza en laboratorio de M. acanthurus. Roman (1976) desarrolló un estudio sobre la biología de M. tenellum en algunas lagunas de Guerrero, Mexico. Cabrera (1977) desarrolló un estudio sobre la biología y cultivo de M. acanthurusen el Bajo Papaloapan, Veracruz. Guzmán y Kensler (1977) realizaron estudios de varias especies del géneroMacrobrachiumy sobre sus posibilidades de cultivo en, la cuenca baja del río Balsas, Michoacán, Guerrero, Mexico. González (1979) observó la reproducción del "chacal"M. tenellum en las lagunas de Tres Palos y Mitla, Guerrero, México. Granados (1980) estudió la biología y aspectos poblacionales del langostino del ríoMacrobrachium americanum en algunas áreas de los estados de Michoacán y Guerrero, México. ÁREA DE ESTUDIOEl área de estudio se encuentra localizada en la boca de Chiltepec situada al noroeste de la ciudad de Villahermosa, entre los meridianos 92°50´ y 93°05´ de longitud Oeste y los paralelos 18°15´ y 18°30´ de latitud Norte. El Río González se comunica con el mar por boca de Chiltepec situada al noroeste de la Laguna de Santa Anita. (Fig. 1). El clima del area corresponde, siguiendo el sistema Köppen modificado por Garcia (Garcia, 1973), al tropical de tierras bajas en Monson (Am (f)W" (i') g) que es característico de los lugares cálido-húmedos situados al sur del trópico de Cáncer. Con una temperatura anual media de 26.7ºC y una precipitación anual media de 1969.9 mm. La temperatura media mensual mínima de 21ºC ocurre en diciembre o en enero. Por otro lado, los nortes son la principal causa de las modificaciones del clima de Tabasco y son responsables de todas las temperaturas mínimas del invierno, con variaciones entre los 12 y 15ºC. Las mareas por lo general son irregulares, con un máximo de 70 cm en las sicigias; durante la época de lluvias las mareas son más fuertes por lo general sólo se presenta una marea en las 24 horas. El principal río, que descarga sus aguas al Río González, es el Carrizal que a su vez tiene su origen en el río Mazcalapa y más arriba con la Presa de Malpaso; hacia la parte norte de Villahermosa, el Río González tiene comunicación con el mar y hacia el este de la desembocadura del río al mar tiene comunicación con la Laguna de Santa Anita. 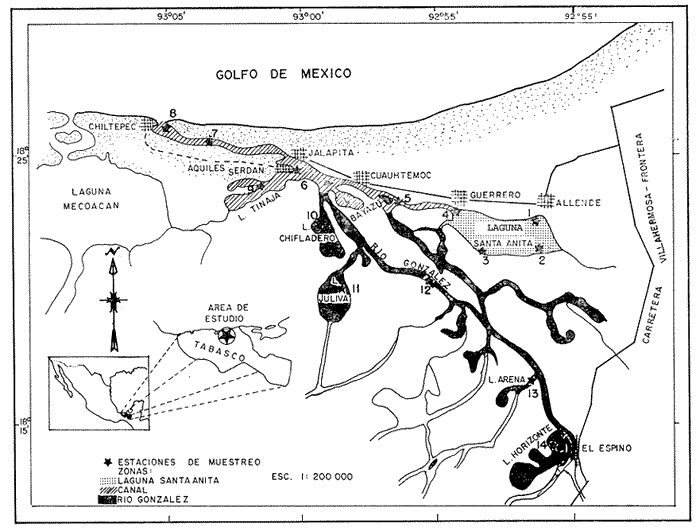 Fig. 1. Localización del área de estudio, zonas y estaciones de colecta. MATERIAL Y MÉTODOSEl material biológico utilizado, se obtuvo de las capturas realizadas en la cuencia del Río González. Las estaciones de captura aparecen marcadas en la figura 1. El muestreo del "camarón prieto" se efectuó en el arte de pesca llamado "nasa" construidos con hilo de seda multifilamentado (No. 3) de 2.5 cm. de luz de malla (de nudo a nudo), arillo de fierro de 70 cm. de diámetro. A bordo de una lancha con motor fuera de borda. Se utilizaron 20 nasas en cada una de las estaciones, se colocaron al anochecer y con una duración de 30 minutos antes de recogerlas. A una profundidad de 1 m a 2 m dependiendo de la estación de colecta y la zona. Se realizaron colectas nocturnas en el area de estudio durante un ciclo anual que comprendió de marzo de 1980 a febrero de 1981, repartidas como sigue: 1980 en marzo, abril, junio, agosto, octubre y diciembre y 1981 en enero y febrero. Se establecieron un total de 14 estaciones, como se aprecia en la figura 1; dado que la cuenca del Río González esta compuesta de varios tipos de sistemas acuícolas como son: río, arroyo y laguna, se consideró pertinente dividirla en tres zonas, también su fácil localización y acceso; la primera zona corresponde a la Laguna de Santa Anita; la segunda el Canal y la tercera al Río González. Antes de las colectas se registraron los siguientes parámetros físico-químicos del agua: temperatura, salinidad y oxígeno del fondo. La temperatura fue medida con un termómetro de cubeta de -20 a 150 °C; la salinidad por el método de Mohr, con nitrato de plata; el oxígeno disuelto se cuantificó por medio del método químico Winkler con modificación de azida de sodio. Una vez realizadas las capturas del "camarón", se etiquetaron incluyendo todos los datos de la colecta, se colocaron en bolsas de plástico, utilizando para su fijación formol al 10% neutralizándolo con borato de sodio, trasladándolas posteriormente al laboratorio para su análisis. En el laboratorio cada muestra se lavó con agua corriente para eliminar el exceso del fijador y se tomaron los datos biométricos, como se aprecian en la figura 2. Se determinaron el sexo y el estadio sexual; esto último siguiendo lo establecido por Guzmán (1976). Se seleccionaron 15 hembras ovígeras de la clase 70-75 mm de longitud total (por ser la clase más abundante), con la finalidad de registrar el número de huevecillos promedio de esta especie. Esto se hizo de manera directa, por medio de conteo manual con auxilio de un microscopio de disección. Posteriormente, por zona y fecha se procedió a contar el numero de machos y hembras para obtener el porcentaje relativo de sexos; las hembras se procesaron de forma independiente, contando el número de hembras de cada estadio de madurez sexual, conociendo el porcentaje relativo. Se obtuvo la secuencia reproductiva mediante gráficas por zona y fecha de los porcentajes relativos por estadio de madurez sexual; así como el periodo de desove. Se estableció la relación que guardan los distintos parámetros ambientales, con el porcentaje de hembras ovígeras. 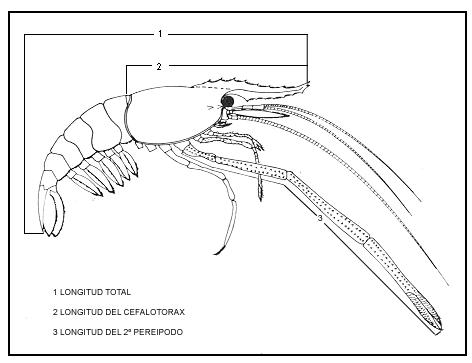 Fig. 2. Esquema de M. acanthurus que muestra las medidas tomadas. Vista lateral. RESULTADOS Y DISCUSIÓNLos organismos colectados y estudiados provienen de las estaciones muestreadas e indicadas en la figura 1. Se analizaron 2261 organismos, correspondientes a la especieMacrobrachium acanthurusidentificados de acuerdo al criterio de Holthuis (1959). TAXONOMÍAEl "camarón prieto" pertenece al PhylumARTHROPODA Clase CRUSTACEA Orden DECAPODA Familia PALAEMONIDAE Género MACROBRACHIUM Especie acanthurus DIMORFISMO SEXUALGeneralmente en los decapodos al igual que los camarones o langostinos del género Macrobrachium, existe una diferenciación sexual la cual hace posible distinguir al macho de la hembra, sobre todo cuando se trata de organismos adultos. En el "camarón prieto"M. acanthurus el macho es considerablemente más grande y robusto que la hembra. El segundo par de pereiópodos (patas) es más largo y robusto en el macho que en la hembra. Existe una pequeña estructura filiforme denominada appendix masculino también llamado estilamblis en los peneidos (Boschi,et al., 1962) , sobre el inicio o base del endopodito del segundo par de pleópodos del macho. La abertura sexual llamada gonoporo, es una estructura globular, en el macho se encuentra en la base del quinto par de pereiópodos, a diferencia de la hembra que lo presenta en la base del tercer par de pereiópodos. Las hembras presentan una cámara espaciosa incubadora, como la llama Ling (1969), formada por la prolongación de las pleuras abdominales. ESCALA DE MADUREZ SEXUALEn todo estudio de la reproducción es importante determinar los distintos estadios de madurez sexual de las hembras (presencia o ausencia de huevos), por lo cual es necesario el uso de escalas de madurez, en este trabajo se ha utilizado la propuesta por Guzmán (1976), paraMacrobrachium tenellum, la cual se basa fundamentalmente en características sexuales secundarias. Tomando en cuenta de que Holthuis (1952), señala que esta especie esta estrechamente relacionada conMacrobrachium acanthurus. Estadio I o juvenil:está representado por organismos indiferenciados, los pleópodos carecen de vellosidades y el ovario no es conspicuo. Estadio II o pre-Ovígeras: representado por hembras que están en proceso de maduración, las cuales presentan las pleuras pigmentadas y el ovario conspicuo. Estadio III u Ovígeras: representada por hembras que portan huevecillos en la parte ventral del abdomen, pleuras pigmentadas y los pleópodos con vellosidades características donde se adhieren los huevecillos. Este estadio presenta varios subestadios: Subestadio 1:las hembras presentan huevecillos de color verde oscuro, aparentemente recién desovadas. La hembra está recién mudada o con poco tiempo después de la muda, el tegumento no es muy rígido. Ovario no conspicuo. Subestadio 2: las hembras presentan huevecillos que gradualmente pierden el color verde y después pasan a etapas de color amarillo verdoso manteniendo este color intermedio. Ovario no conspicuo. Subestadio 3: las hembras presentan huevecillos de color amarillo. Ovario no conspicuo. Subestadio 4:las hembras presentan huevecillos oculados, notándose a simple vista o a poco aumento del microscopio en este subestadio se inicia el crecimiento y aumento de color de ovario. Subestadio 5: las hembras tienen muy pocos huevecillos y están en etapa de eclosión de las larvas, el ovario se presenta más desarrollado que en el subestadio 4. Estadio IV o post-ovígeras:representado por hembras que no tienen huevecillos, las pleuras se presentan pigmentadas, los pleópodos tienen vellosidades muy visibles, el ovario aparentemente recuperado. Esta escala de madurez coincide con lo encontrado en este trabajo. En el transcurso del estudio se observó que existe una relación directa entre el estadio sexual de las hembras y la longitud total, o sea, a medida que aumenta la longitud total avanza la madurez sexual de las hembras. MADUREZ SEXUALLa madurez sexual es un carácter de gran importancia para la regulación de las pesquerías dio se observó que existe una relación directa nuridos o langostas, los penéidos o camarones y los palemónidos o langostinos. El tamaño de hembras ovígeras fue de 43 a 114 mm de longitud total para la Laguna de Santa Anita; de 40 a 96 mm para el Canal y de 52 a 106 mm para el Río González. Con un promedio, para el área de estudio, de 45 mm de longitud total. Como se puede observar, para el área de estudio, las hembras deM. acanthurus llegan a la fase ovígera a los 40 mm de longitud total. En el estudio realizado por Martínez (1975), en la Ciénaga de "El Totumo"., Colombia, reporta hembras ovígeras entre 65-80 mm de L.T. Cabrera et al. (1976) hicieron un estudio en las lagunas del Bajo Papaloapan, Veracruz, en el cual señalan que hembras de 20-40 mm de L.T. ya participan en la reproducción. El hecho de que las hembras alcancen la madurez sexual a los 40 o 20 mm de L.T. se debe muy posiblemente a las condiciones medio ambientales de las zonas estudiadas. APAREAMIENTO Y FERTILIZACIÓNSe colectaron organismos vivos para observar este aspecto. Se colocaron dos hembras y un macho en un acuario de 50 X 30 X 20 cm, los resultados fueron los siguientes. El aparcamiento por parte de la hembra está precedida por una muda, la cual Choudhury (1972) denomina muda preapareamiento, durante 4 a 5 horas después de la muda y antes del aparcamiento existe un prolongado cortejo; después el macho voltea a la hembra con ayuda de su segundo par de pereiópodos y la sujeta de manera que queden juntas las bases de las coxas de los pereiópodos, entonces el macho deposita una pequeña masa gelatinosa de color blanquizco llamada espermatoforo, en la parte media ventral del cefalotórax de la hembra, entre las coxas. Poco después la hembra desova y esta con ayuda de los pereiópodos rompe el espermatoforo, al paso de los huevecillos por éste son fertilizados. Posteriormente la hembra acomoda los huevecillos en la cámara incubadora que esta bajo el abdomen, como la llama Ling (1969), formada por la prolongación de las pleuras abdominales. El proceso de aparcamiento es muy similar al descrito por Ling (1967) para M. rosenbergii, con la única diferencia que el cortejo es más largo en M. acanthurus si hay más de un macho en el acuario la hembra copula con el mas fuerte y grande, manteniéndose a distancia de los otros machos. Después de la cópula el macho y la hembra permanecen un tiempo juntos hasta que a la hembra se le endurece el exoesqueleto y esta capacitada para defenderse por sí misma (Choudhury, 1972). FECUNDIDADLa fecundidad entendida como el numero de huevos producidos en una época reproductiva, refleja la capacidad potencial de reproducción de una hembra de langostino. (González, 1979; Granados, 1980.) Fujimura (1966) reporta hembras deM. rosenbergii de nueve centímetros de largo y dieciocho gramos de peso, con 15,000 huevecillos; Ling (1969) reporta para la misma especie que hembras maduras de dieciocho centímetros de largo y con un peso de ochenta gramos produce alrededor de 60,000 huevecillos; Rodríguez de la Cruz (1968) indica, paraM. americanumque el número de huevecillos oscila entre 200,000 y 500,000, dependiendo del tamaño. Roman (1974) menciona que hembras de M. tenellum de siete a ocho centímetros producen entre 700 a 6 000 huevecillos, además considera que el número de huevecillos de esta especie no esta en relación con la longitud total de las hembras por la amplia variación encontrada. Negrete (1977) menciona que paraM. tenellum, existe una alta correlación entre el número de huevos y el peso total de las hembras. Martínez (1975) reporta un número aproximado de huevecillos de 150,000 a 250,000, en hembras de M. acanthurus, en Colombia, pero no menciona las longitudes. Cabrera (1980) reporta hembras de M. acanthurusde siete centímetros promedio, llevan en el abdomen unos 6,000 huevecillos. En este estudio se encontró que para hembras ovígeras de M. acanthurus de 70-75 mm de longitud total, tienen un promedio de 5,500 huevecillos. Concuerda con los datos de Cabrera (1980), quien reporta que cada hembra de talla promedio de 70 mm lleva en el abdomen unos 6 000 huevecillos que se transforman en larvas en 32 a 42 días después del desove. En M. rosenbergii, uno de los langostinos de gran tamaño registrado y mejor estudiado, las larvas eclosionan después de 19 días de incubación (Bardach et al., 1972) ; de acuerdo con el trabajo realizado por el Dr. Ling (1967), todas las especies de importancia comercial en México (M. carcinus., M. acanthurus, M. americanum y M. tenellum) tienen cierto paralelismo en el desarrollo morfológico dentro del huevo. Los huevos deM. acanthurus son de forma ovoide, midiendo aproximadamente de 0.5 mm a 0.7 mm de diámetro mayor. Sus colores, dependen del avance de madurez del embrión; que van de verde, amarillo canario, anaranjado, hasta color ámbar oscuro siendo ya visible los ojos del embrión. Se observó también que los huevecillos están unidos por medio de finos ligamentos. Estos huevecillos quedan adheridos por medio de vellosidades, tanto del huevo como del pleópodo y son fijadas mediante una sustancia secretada por las glándulas de cemento. (Rodríguez de la Cruz, 1965.) COMPOSICIÓN SEXUAL DE LA POBLACIÓN
Laguna Santa Anita Del total de 852 ejemplares capturados el 56.5% correspondió a machos y el 43.5% a hembras. En esta zona en el mes de octubre/8O, se encontraron exclusivamente machos. En los meses de marzo/8O y diciembre/80 , el porcentaje de hembras (53.8% y 57.2%, respectivamente) es mayor al de los machos (46.2%, y 42.8%). Las capturas mensuales indicaron un predominio de machos sobre hembras, obteniéndose la proporción de 1: 1.6 de hembras por macho (Tabla 1, Fig. 3). Canal De 938 ejemplares capturados el 61.4% correspondió a machos y el 38.6% a hembras. En esta zona en el mes de febrero/81, el porcentaje de machos (78.8%) es mayor al de las hembras (21.2%. En el mes de junio/80 las hembras presentan un mayor porcentaje (68.7%) que los machos (31.3%).. Las capturas mensuales indicaron un dominio de machos sobre hembras. Con una proporción de 1: 1.6 a favor de los machos. (Tabla 2 y Fig. 3) Río González De los 471 ejemplares capturados en esta zona, el 88.5% correspondió a machos y el 11.5% a hembras. En los meses de abril/80 y febrero/81, el porcentaje de machos (96.0% y 96.4% respectivamente es mayor al de las hembras (4% y 3.6% respectivamente). En general, se observó un dominio de machos sobre hembras con una proporción de 1:7.7 de macho. (Tabla 3 y Fig. 3) 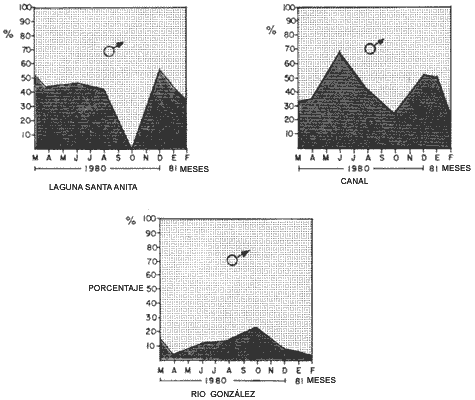 Fig. 3 Composición sexual de la población por zonas. COMPOSICIÓN DE LA POBLACIÓN DE HEMBRAS OVIGERAS
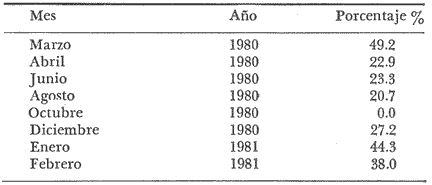 LAGUNA SANTA ANITA 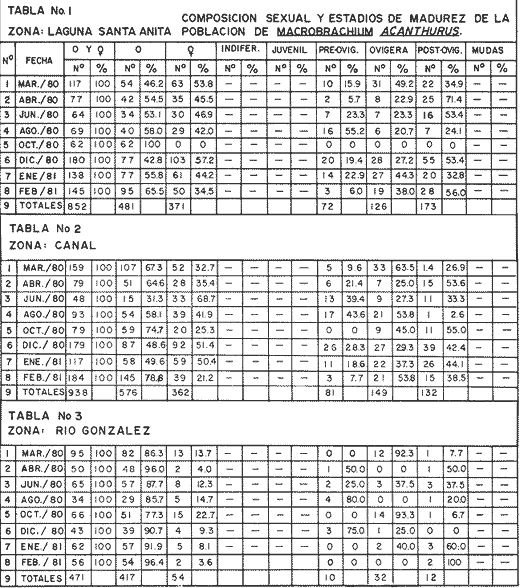 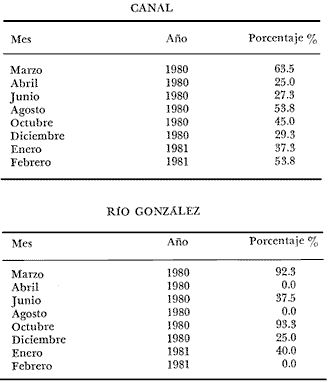 En general para el área de estudio, del total de 2 261 organismos capturados de M. acanthurus, los machos dominan completamente sobre las hembras, de este total el 65.2% corresponde a machos y el 34.8% a hembras con una proporción de casi 2 machos por 1 hembra. Lo cual es muy diferente con lo que reporta Cabrera et al. (1976) para esta misma especie en las lagunas del Bajo Papaloapan en Veracruz, al obtener una proporción de sexos a favor de las hembras de 2. l. Esto se puede atribuir, a que en la medida que aumenta el grado de proceso reproductivo en las poblaciones de M. acanthurus son mayores las proporciones de machos. En los meses donde los porcentajes de hembras ovígeras son bajos es debido probablemente a las migraciones que realizan a otras áreas, con condiciones favorables para su desarrollo y alimentación. Como se puede apreciar en la mayor parte del año se colectaron hembras ovígeras. El porcentaje más alto fue de 49.2%, en el mes de marzo/80. Tabla 1. En esta zona se capturaron en todo el año hembras ovígeras, el porcentaje más alto es de 63.5% en el mes de marzo y en el mes de agosto con un 53.8%. Tabla 2. En esta zona no siempre se capturaron hembras ovígeras en el curso del año colectado. Se presentan 2 porcentajes alto (92.3% y 93.3%) en los meses de marzo /80 y octubre/80. Tabla 3. En toda el área de estudio el mayor porcentaje de hembras ovígeras (48.5%) corresponde a la zona del Canal. El menor (10.4%) en la zona del Río González. Longitud total. Las figuras 4, 5 y 6 ilustran el comportamiento de la población de hembras ovígeras en base al total de muestreos realizados. Para la Laguna de Santa Anita las frecuencias mas altas de hembras ovígeras fueron entre las clases de 55-60 a 75-80 mm de L.T. encontrándose la mayor concentración en la clase 70-75 mm de L.T. (Fig. 4). Para la zona del Canal se presentaron las frecuencias más altas en las clases de 50-55 mm a 80-85 mm de L.T., encontrándose la mayor concentración en la clase 60-65 mm de L.T. (Fig. 5). Para la zona del Río González las frecuencias mas altas de hembras ovígeras fueron entre las clases de 65-70 mm a 110- 115 mm de L.T., la mayor concentración en la clase de 90-100 mm de L.T., (Fig. 5). Estas diferencias son debidas probablemente a los cambios ecológicos que sufre el río (Ringuelet, 1962), a diferencia de una laguna que es un ecosistema, relativamente mas estable que el de los ríos. PERIODOS REPRODUCTIVOS DE LAS HEMBRAS DE M. ACANTHURUS
Laguna Santa Anita En esta zona un periodo de reproducción se encuentra del mes de marzo/80 al mes de abril/80 y otro periodo de reproducción se encuentra del mes de diciembre/80 a febrero/81. (Fig. 7-A) Canal En esta zona se ve claramente que todo el año las hembras se están reproduciendo; pero el mayor desove se presenta en el mes de marzo/80 (Fig. 7-B) se observa un solo periodo reproductivo. 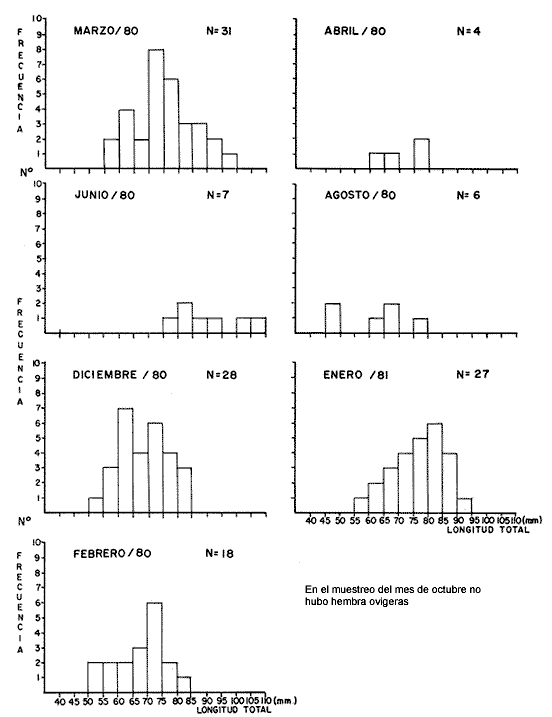 Fig. 4. Histogramas mensuales de longitud total (mm), de hembras ovígeras en la zona de la laguna de Santa Anita. 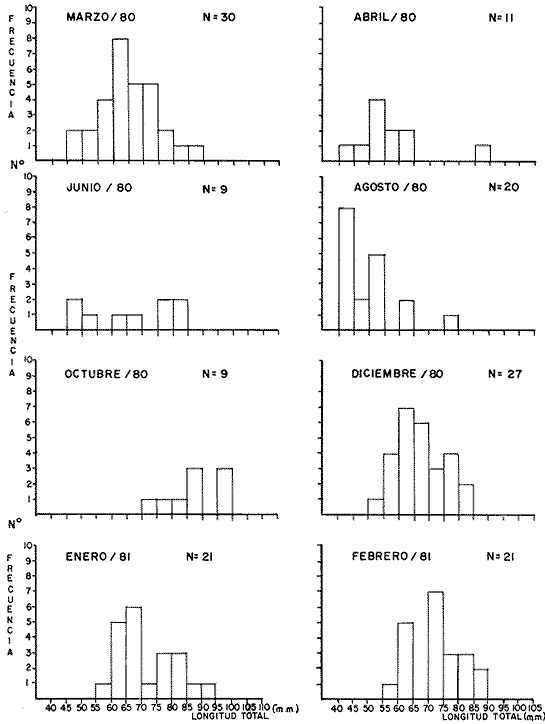 Fig. 5. Histogramas mensuales de longitud total (mm) de hembras ovígeras, en la zona del canal. 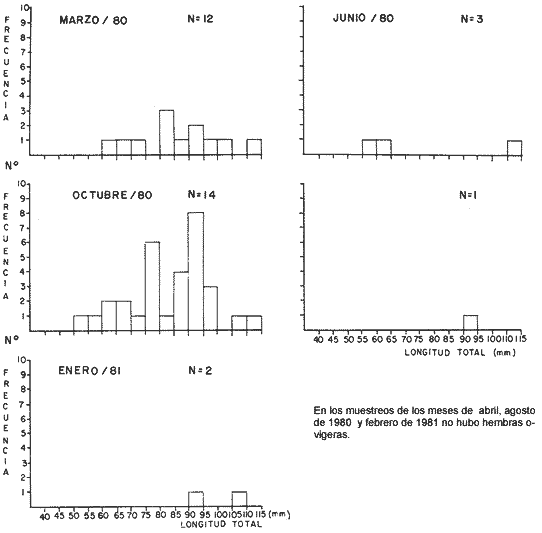 Fig. 6. Histogramas mensuales de longitud total (mm) de hembras ovígeras, en la zona del Río González. Río González En esta zona durante el ciclo anual, se presentaron 3 periodos reproductivos uno en marzo/80 disminuyendo en abril, el segundo en julio/80 disminuyendo en agosto/80 y en octubre se tiene el último y principal periodo de las hembras, extendiéndose hasta el mes de enero/81. (Fig. 7C). Este periodo reproductivo es diferente, respecto a las otras zonas. Esto se debe probablemente a los cambios medio ambientales de los ecosistemas. SECUENCIA REPRODUCTIVA DE LAS HEMBRAS
Laguna Santa Anita En esta zona en el mes de marzo, cuando la población de hembras ovígeras alcanzan el más alto porcentaje, las hembras pre-ovígeras presentan un porcentaje bajo. Al siguiente mes disminuye el porcentaje de hembras ovígeras y preovígeras, aumentando considerablemente el porcentaje de hembras post-ovígeras. Posteriormente en los meses de julio/80 y agosto/80 disminuye el porcentaje de hembras ovígeras y post-ovigeras, aumentando el de las hembras pre-ovígeras. En el mes de octubre/80 no se encontraron hembras en ningún estadio. Para diciembre/80 la población de hembras post-ovígeras aumentan e iniciándose otro periodo reproductivo, teniendo en el mes de enero y febrero un alto porcentaje de hembras ovígeras. (Fig. 7-A) Canal En esta zona en el mes de marzo/80 cuando se encuentra el máximo porcentaje de hembras ovígeras el porcentaje de hembras pre-ovígeras y post-ovígeras es muy bajo. En el siguiente mes (abril /80), disminuye el porcentaje de hembras ovígeras aumentando la población de hembras post-ovígeras y pre-ovígeras, aumentando bastante el porcentaje de hembras ovígeras. Posteriormente en el mes de octubre/80 las hembras pre-ovígeras disminuyen considerablemente, reflejándose en el mes de enero el aumento de la población de hembras ovígeras. (Fig. 7-B) Río González En el mes de marzo/80, se observa uno de los periodos reproductivos de M. acanthurus en esta zona, presentando un alto porcentaje de hembras ovígeras. En el siguiente mes decaen completamente las hembras ovígeras aumentando el porcentaje de hembras pre-ovígeras y post-ovígeras. En el mes de julio se presenta otro periodo reproductivo con un porcentaje mayor al de las hembras pre y post-ovígeras;" pero en el mes de abril vuelven a decaer completamente las hembras ovígeras aumentando y presentando el más alto porcentaje de hembras pre-ovígeras. En el mes de octubre / 80 se presenta el más alto porcentaje de hembras ovígeras, disminuyendo para el mes de enero/81 y finalizando así el periodo reproductivo en el mes de febrero/81. (Fig. 7-C) La presencia de hembras post-ovígeras presupone que se reproducen varias veces en un ciclo anual. Las tres zonas estudiadas, presentan diferentes secuencias reproductivas, coincidiendo en tiempo, la secuencia de las hembras a los distintos estadios de madurez sexual, lo cual se debe muy posiblemente a que se trata de diferentes sistemas cuyos factores medio ambientales actúan de manera particular sobre las poblaciones de los camarones. Desove Con base en los resultados obtenidos de la secuencia reproductiva deM. acanthurus, de muestran que las poblaciones muestreadas en el área de estudio, presentan de dos a tres periodos de desove. En la zona de la Laguna de Santa Anita en los meses de marzo/80, abril/80, julio/80 hasta agosto/80 presenta un periodo de desove y en los meses de diciembre/80, enero/81, y febrero/81 se presenta otro periodo de desove, en total esta zona presenta 2 periodos de desove. En la zona del Canal presenta dos periodos de desove uno en el mes de marzo/80 y otro en el mes de agosto/80. Se hace notar que en esta zona siempre se encuentra poblaciones de hembras ovígeras lo que sugiere que siempre las hembras están desovando en todo el ciclo anual. En la zona del Río González presenta 3 periodos de desove. Uno en el mes de marzo/80; otro en el mes de julio /80 y el tercero y máximo periodo de desove en el mes de octubre/80 suavizándose y terminando en el mes de febrero/81. Estas diferencias se deben muy posiblemente a que se tratan de diferentes sistemas acuáticos o a errores de muestreo. 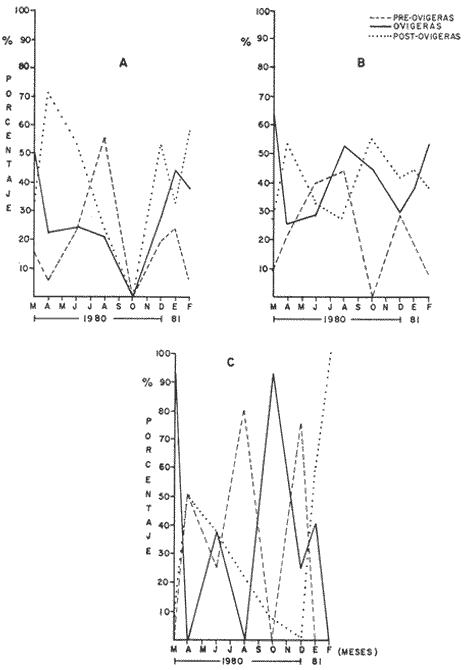 Fig. 7. Composición de la población de hembras por estadio sexual y zonas. a) Laguna Santa Anita, b) Canal, y c) Río González. PARÁMETROS AMBIENTALES QUE INFLUYEN CON EL CICLO REPRODUCTORHasta la fecha no se tienen estudios que permitan conocer a fondo aquellos parámetros ambientales que influyen en el ciclo reproductor del camarón "prieto"M. acanthurus por lo tanto se analizaron: la temperatura del agua; oxígeno disuelto, salinidad y precipitación fluvial, ya que la temperatura en los trópicos determina que los organismos habiten en los sistemas cercanos a los niveles máximos de tolerancia termica por lo que cualquier alteración de las condiciones normales reducen la capacidad de los organismos para resistir las circunstancias adversas (Kinne, 1970.) En la Laguna de Santa Anita encontramos temperatura desde 24.9°C en el mes de diciembre hasta 32°C en el mes de agosto. En el río la temperatura mínima fue de 23°C en el mes de diciembre y la máxima con 32.7°C en el mes de agosto. La mayor variación de la temperatura se registra en el Río González. Estas variaciones son debidas también a los factores abióticos de la región y entre ellos el más importante son los "resumos" que además está relacionada con la profundidad y el intercambio del agua. El oxígeno, como factor químico, es hoy importante para los organismos en las áreas acuaticas (Hunter, 1970) . No presenta cambios bruscos en el transcurso del año. El mínimo valor promedio de 2.14 m1/1 de oxígeno fue en el mes de junio/80, en la zona del Río González y el máximo valor promedio fue de 6.75 m1/1 de oxígeno, en el mes de diciembre/80, en la Laguna de Santa Anita. La salinidad es un factor muy importante para completar el ciclo de vida de los langostinos ya que estudios como los de Ling (1961), Lewis et al. (1966), Choudhury (1970, 1972), tienden a demostrar que el desarrollo de los estados larvales del géneroMacrobrachium requieren de agua salobre. Panikkar (1967) menciona que es notable el hecho de que hay una estrecha relación entre la fisiología osmótica de los camarones y su posible uso en cultivo, porque esto último indudablemente esta basado en especies que tienen una amplia tolerancia de la temperatura y a variaciones en salinidad. En los últimos 18 años las condiciones de la cuenca del Río González han sido muy modificadas, principalmente por la creación de la presa de Malpaso. En 1976 West y colaboradores reportaron salinidades de 0.3 a 27% y ahora en este estudio se encontraron salinidades de 0.4 y 0.27%, denotando que el agua es completamente dulce. La precipitación como régimen local de lluvias y el agua de la cuenca superior determinan la existencia del recurso acuático en el área de estudio. La época de mayor precipitación está entre los meses de septiembre y octubre. La profundidad es otro factor que interviene en la distribución de esta especie. M. acanthurus tiene preferencia por lugares someros, tanto en las lagunas como en los ríos. La Laguna de Santa Anita tiene un promedio de 2 metros de profundidad y el Río González tiene una profundidad de 4 m. Los "resumos" son avenidas de los ríos Mezcalapa, Carrizal y Río González; con estos resumos el agua viene turbia y con una gran cantidad de material terrígeno y ramas. Anteriormente los resumos formaban parte de un ciclo anual lo que traía consigo material nutritivo para la zona baja de la cuenca. Ahora con la creación de una presa (Netzahualcóyotl) este ciclo de resumos se ha roto. En la cuenca del Río González los resumos son constantes y dependen principalmente cuando la presa abre sus demacías (ocasionando muchas veces la pérdida de artes de pesca, en especial los clarines y nasas con las que se pesca el "camarón prieto"). También se producen inundaciones constantes, durante las cuales este camarón penetra a los pantanos y se hace difícil su captura. Por otro lado se ha observado que cuando el "camarón prieto" entra a los pantanos crece rápidamente y esto se debe muy posiblemente a las buenas condiciones nutritivas existentes en este ecosistema (Gaudet, 1979). Laguna de Santa Anita El porcentaje más alto de hembras ovigeras se presentó en el mes de marzo/80 con un 49.20 %, el cual corresponde a una temperatura de 30°C, con 3.97 m1 / /1 de oxígeno 0.08% de salinidad y 51.4 mm de precipitación fluvial. (Fig. 8-A, C, E y G) todas las variables presentan una relación lineal negativa. La temperatura presenta un índice de correlación de r = -0.28, que se considera baja. El oxígeno presenta una correlación alta con un índice de r = -0.85. La salinidad también presenta una correlación alta con un índice de r = -0.70. La precipitación presenta un índice de r = -0.77 con una correlación alta. Se ajustaron a una recta y se obtuvieron las ecuaciones que describen el comportamiento de estas 4 variables (Fig. 8-B, D, F y H) . Los parámetros físico-químicos que guardan cierta correlación con el cielo reproductor de M. acanthurus son el oxígeno y la precipitación pluvial. Canal En esta zona los porcentajes más altos de hembras ovígeras se presentaron en los meses de marzo/80, agosto/80 y febrero/81, con el 63.5%, 53.8%, y 53.8%, respectivamente. A los cuales le corresponde una temperatura de 26.5°C 31.6°C y 27.5°C, con 5.42 m1/1, 6.38 ml/l y 5.52ml/1 de oxigeno, 0.07 o/oo, 0.09 o/oo y 0.08 o/oo de salinidad y 51.4 mm, 91.7 mm y 100.8 mm de precipitación pluvial. (Fig. 9-A, C, E y G). La temperatura y el oxígeno guardan una relación lineal positiva, con una correlación baja de r = .12 y r = .14 respectivamente. Se ajustaron las rectas y se obtuvieron las ecuaciones que describen el comportamiento de estas variables (Fig. 11-B y D). La salinidad no presentó ningún cambio importante ya que sus valores se mantienen de .07 o/oo a .27 o/oo. La precipitación tiene un índice de r = -0.23 con una correlación baja y una relación lineal negativa; la ecuación que describe a esta recta se observa en la figura 9-H. Como se puede observar en esta zona ningún factor guarda una relación directa con el ciclo reproductor de la especie, lo que muy probablemente puede estar influenciado por la combinación de varios parámetros físico-químicos. Río González En los meses de marzo/80 y octubre/80 se obtuvieron los máximos porcentajes de hembras ovígeras (92.3% y 93.3% respectivamente) a los cuales les corresponde temperatura de 30°C y 24°C, 3.78 ml/l y 4.80 ml/l de oxígeno, .67% y .08 % de salinidad, 51.4 mm y 628.6 mm de precipitación pluvial, respectivamente para cada mes. La temperatura guarda una relación lineal positiva con el porcentaje de hembras ovígeras, con una correlación alta, con un índice de r =---.75(Fig. 10-B). El oxígeno tiene una correlación baja (r =---.33) con el porcentaje de hembras ovígeras observándose una relación lineal negativa (Fig. 10-D). La salinidad no presenta cambios drásticos, encontrándose cantidades muy pequeñas de minerales de .04% a .09% (Fig. 10-F). En esta zona, el porcentaje más alto de las hembras ovígeras (93.3%), coincide con el máximo valor de precipitación (628.6 mm) en el mes de octubre, con un índice de r = 0.53 y una relación lineal positiva. (Fig. 10-H). Se ajustaron las rectas por regresión lineal, de cada uno de los parámetros con el porcentaje de hembras ovígeras y se obtuvieron las ecuaciones que describen el comportamiento de cada par de variables. (Fig. 10-B, D, F y H). Las relaciones entre el porcentaje de hembras ovígeras y los factores físico-químicos, fueron significativos con la temperatura y con la precipitación pluvial. En general, para las tres zonas, los valores de salinidad encontrados fueron muy bajos (de 0.4°/oo a 0.27°/oo), los cuales de acuerdo con la clasificación de Ruggero (1960) es agua dulce. Conclusiones1.M. Acanthurus se encuentra ampliamente distribuido en el área de estudio; desde la ranchería El Espino, Laguna de Santa Anita y El Canal hasta antes de llegar a Chiltepec. 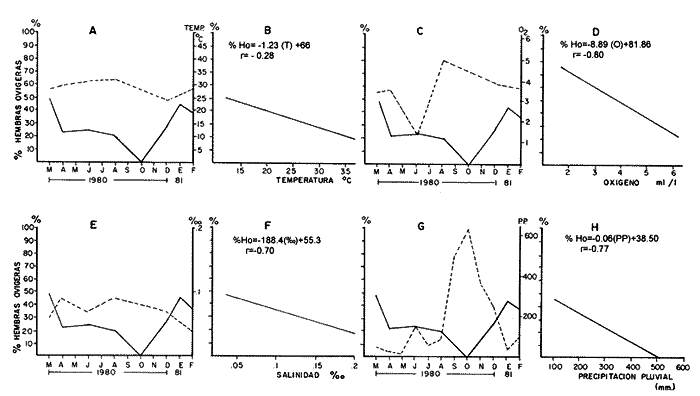 Fig. 8 Zona de la laguna de Santa Anita. Representación gráfica del porcentaje de hembras ovígeras con : a) Temperaturas; c) Oxígeno disuelto; e) Salinidad; g) Precipitación pluvial. b,d,f y h ) Regresiones de temperatura, oxógenmo disuelto, salinidad y precipitación pluvial con el porcentaje de hembras ovígeras, respectivamente, 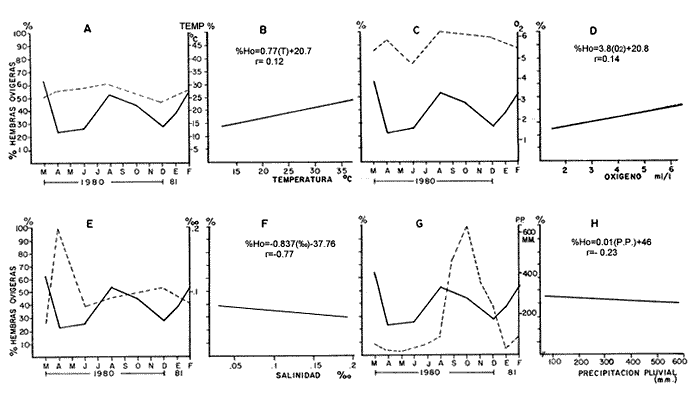 Fig. 9. Zona del Canal. Representación gráfica del porcentaje de hembras ovígeras con: a) Temperatura; c) Oxígeno disuelto; e) Salinidad y g) Precipitación pluvial. b, d, f y h) Regresiones de temperatura, oxígeno disuelto, salinidad y precipitación pluvial con el porcentaje de hembras ovígeras, respectivamente. 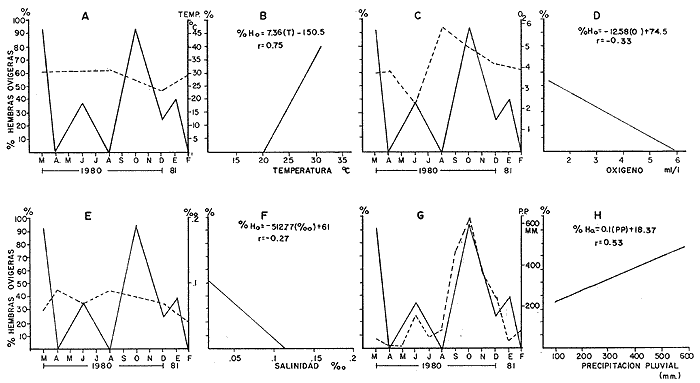 Fig. 10. Zona del Río González. Representación gráfica del porcentaje de hembras ovígeras con: a) Temperatura; c) Oxígeno disuelto; e) Salinidad y g) Precipitación pluvial. b, d, f y h) Regresiones de temperatura, oxígeno disuelto, salinidad y precipitación pluvial con el porcentaje de hembras ovígeras, respectivamente. 2. En base de los resultados obtenidos se aprecia que la proporción de sexos está siempre a favor de los machos, 2 a 1. 3. Las hembras ovígeras de M. acanthurus se encuentran a partir de tallas de 43 mm de longitud total en la Laguna de Santa Anita, 40 mm de longitud total en el Canal y 53 mm de longitud total en el Río González, con un promedio general de 45 mm de longitud total. 4. Las hembras ovígeras dentro del rango 70-75 mm de longitud total, portan en su abdomen un número promedio de huevecillos de 4 400, con fluctuaciones de 3 700 a 7 500 huevecillos, lo cual permite observar la fecundidad de la especie. 5. Los huevos de M. acanthurusson de forma ovoide, midiendo aproximadamente entre 0.5 mm y 0.7 mm de diámetro mayor. 6. En la Laguna de Santa Anita y El Canal, se reporta la presencia de hembras ovígeras durante todo el año. No siendo así para la zona del Río González. (Marzo, junio, octubre y diciembre de 1980 y en enero de 1981 se colectaron.) 7. Respecto a los periodos reproductivos, en la Laguna de Santa Anita se presentan dos etapas reproductivas una que va del mes de marzo/80, al mes de abril/80 y el segundo entre los meses de diciembre/80 y febrero/81. Presentando dos grandes desove3 en los meses de marzo/80 y enero/81. En la zona de El Canal presenta un solo periodo reproductivo con un gran desove en el mes de marzo/80 y en el Río González se presentaron 3 temporadas reproductivas, con dos grandes desoves uno en marzo/80 y otro en octubre/80. 8. En lo que se refiere a los parámetros físico-quimicos que tienen cierta relación con el ciclo reproductor de M. acanthurus se observó que: En la Laguna de Santa Anita existe una cierta relación entre el oxígeno y la precipitación pluvial con el porcentaje de las hembras ovígeras. En el Canal no se encontró ninguna relación. En el Río González existe una estrecha relación con la temperatura del agua y la precipitación con el porcentaje de hembras ovígeras. AgradecimientosEl autor expresa su agradecimiento a las siguientes personas: Martín López H., por la ayuda prestada para la obtención de los parámetros físico-químicos, a Manuel Guzmán por la orientación y revisión del trabajo, a José Luis Galaviz R. por sus comentarios y revisión del manuscrito, a Raymundo Hernández M. por la revisión del trabajo, a Reyna Lour des Fócil M. por sus comentarios y apoyo, a Nahum Muñiz Ch. por su colaboración en el procesamiento de las muestras y a Graciela Centeno de la C. por la transcripción del trabajo. LITERATURAARANA M. F., Mem. 2o. Simp. Latinoam. de Acuacult.Datos sobre el cultivo del "Langostino Asiático" Macrobrachium rosenbergii (De Man) en México.Depto. Pesca. México1980.619-640.1:Nov. 13-17 BARDACH, J. E. J. H. RYTHER 0. W. McLANEYAquaculture. The Farming and Husbandry of Freshwater and Marine Organisms John Wiley and Sons.Inc. New York: .1972.612-632. BOSCHIE. E. V. ANGELESCUDescripción de la morfología externa e interna del langostino con algunas aplicaciones de índole taxonómica y biológica. Bol. Inst. Biol. Marina. Mar del Plata,1962.5-68.1: CABRERA., C. M., Tesis Prof. Experimentación y cultivo del camarón prieto o langostino manos de carrizo Macrobrachium acanthurus, en la Estación de Acuacultura Laguna de los Amates, Tlacotalpan, Ver.Fac. Cienc. Univ. Nal. Auton. México,1976.74 P. CABRERA, C. M. L. N. ORTEGA-GARCÍA I. AGUIRRE Mem. Simp. Pesq. Aguas Cont.Contribución al estudio poblacional del camarón prieto o langostino "manos de carrizo" Macrobrachium acanthurus en aguas y lagunas del Bajo Papaloapan.Inst. Nac. Pesca México.1976.133-160. CABRERA, C. M., Mem. 2o. Simp. Latinoam. de Acuacult. Método para el cultivo comercialmente rentable del camarón prieto o manos de carrizo Macrobrachium acanthurus (Wiegman, 1836).Depto. Pesca, México.1980.663-718.1:Nov. 13-17. CARRILLO, V. F. Morfología de Macrobrachium acanthurus (Weigman) en el estado de Veracruz, FAO Fish. Rep.,México.1967.415-425.2(57):. CASTRO, C. El camarón del Norte Cryphiops caementarius (Molina). Est. Oceanol.Chile,1966.11-19.2: CHOUDHURY, P. C., Crustaceana,Complete larval development of the palaemonid shrimp Macrobrachium acanthurus (Weigman, 1836) reared in the laboratory.1970.113-132.18(2): Crustaceana,Laboratory rearing of larvae of tlie palaemonid shrimp Macrobrachium acanthurus (Weigman, 1836)1972.113-12621(2) : DOBKIN, S. Nac. Consul. Pesca.Manual de métodos para el estudio de larvas y primeras post-larvas de camarones y gambas. Inst. Nac. Inv. Biol. Pesqueras, Com. Serie Divulgación,México,1970.72 p.Tomo 4. Crustaceana,A. Contribution to knowledge of the larval development of Macrobrachium acanthurus (Weigman, 1836) (Decapoda: Palaemonidae)1971.7-294.21(3) FUJIMURA, T. Notes on the development of a practical mass culturing technique of the giant prawn Macrobrachium rosenbergii. Indo Pacific Fisheries Council. FAO Regional Office for Asia and the Far East, l2th Sección Honolulu IPPFC/ CGG/WP47.1966.3 p. 2-17 Oct. 1966. GARCÍA, E., Modificaciones al sistema de clasificación climática de Koppen,Inst. de Geografía. UNAM,1973.246 p. GAUDET, J. J. Seasonal change in nutrients in a tropical swamp: North swamp, lake Naivasha,Kenya. Ecol.1979.953-981.67: GONZÁLEZ, G L. D.,Tesis Prof. Estudio sobre la reproducción del "chacal" Macrobrachium tenellum (Smith, 1871) Crustacea: Palaemonidae en las lagunas de Tres Palos y Mitla,Fac. Cienc. Univ. Nal. Autón. México,Gro. México.1979.145 p. GRANADOS, B. A. A., Tesis Prof.Biología y aspectos poblacionales del "langostino de río" Macrobrachium americanum (Bate, 1868) (Decapoda: Palaemonidae) en algunas áreas de los estados de Mich. y Gro. Fac. Cienc. Univ. Nal. Autón. México,México.1980.120 p. GUZMÁN, A. M., . Informe I y II del Proyecto y Biología, Ecologia y Pesquería de los Langostinos del género Macrobrachium en México.Biología, ecología y pesca del langostino Macrobrachium tenellum, en las lagunas costeras de Guerrero, México Centro Cienc. del Mar y Limnol. Univ. Nal. Autón. México,1976.70 p. (mimeogr.). GUZMÁN, A. M. C. KENSLER Informe del proyecto "Biología, Ecología y Pesquería de los langostinos del género Macrobrachium en México".Posibilidades de cultivo del langostino Macrobrachium, en el área de la ciudad de Lázaro Cárdenas. Mich. y zona de influencia.Centro Cienc. del Mar y Limnol. Univ. Nal. Autón. México.1977.19 p. (Mimeogr.) . GUZMÁN, A. M. C. KENSLER Informe del "Biología, Ecología y Pesquería de los Langostinos del género Macrobrachium en México". Los langostinos del género Macrobrachium en México.Centro Cienc. del Mar y Limnol. Univ. Nal. Autón. México,1978a.112 p. (Mimeogr.). HOLTHUIS, L. B., A general revision of the palaemonidae (Crustacea: Decapoda: Natantia) of the Americas. II the subfamily Palaemoninae. Allan Hancock Found. Pub. Occ. Pap.,1952.396 p.12: HUNTER, R. W. D., Acuatic Productivity.MacMillan Publishing Co., Inc.1970.273 KINNE, O. Altirine Ecology,Environment factors, Wiley interscience, Edit.: Marine EcologyLondon,1970.681 p. Vol. I. LEWIS, J. B. J. WARD A. MCIVERCrustaceana, The breeding cycle, growth and food of the fresh water shrimp Macrobrachíum carcinus (Linnaus) .1966.48-52.1(10) : LING, S. W., A. B. 0. MERICAN Notes on the life and habits of the adults and larvae stages of Macrobrachium rosenbergiiFish. Counc. Proc..,1961.55-61.9(2) : LING, S. W., Tlie general biology and development of Macrobrachium rosenbergii (DeMan) FAO Fish. Repts.,1967.589-606.57(3) -,Methods of rearing and culturing Macrobrachium rosenbergii (De Man) FAOFish. Report.,1969.607-61957(3): LÓPEZ, M. R., Tipos de vegetación y su distribución en el Estado de Tabasco y Norte de Chiapas. Colección Cuad. Univers. serie Agronomía.Univ. Autón. Chapingo,1980.123 p.11, MARGALEF, R., Ecología. Ed. Omega, S. A.Barcelona.1974.951 p. MARTÍNEZ, S. L.,Biología del "camarón de agua dulce", Macrobrachium acanthurus (Weigman, 1836) (Crustacea: Palaemonidae) de la ciénega de "El totumo" y su cultivo experimental en estanque. Divulgación Pesquera.Bogotá, Colombia.1975.73 p.IX(1), MERCADO, P., Proyecto para una estación rústica dedicada al cultivo de los langostinos. Bol. Piscic.Rural Sría. de Industria y Comercio. México.1959.6-9.9(5-6): NEGRETE, A. R. Tesis Prof. Fecundidad en el Langostino Macrobrachium tenellum (Smith, 1871) (Decapoda: Palaemonidae) en la Laguna de Tres Palos, Guerrero, México.Fac. Cienc. Univ. Nal. Autón. México,1977.70 p. NEW, M. B., El potencial del cultivo de Macrobrachium en Latinoamérica. Manuscrito del ler Simp. de la Asoc. Latinoam. de Acuicul.Maracay. Venezuela.1977.14 p. ODUM, B. P.Fundamentals of Ecology. Saunders.Eds. Philadelphia.1972.574 p. PANIKKAR,Comportamiento osmótico de camarones y langostinos en relación a su biología y cultivo.FAO Fish Rep.,1967.527-538.57(2): RINGUELET, A. R., Ecología Acuática Continental.Pub. Eudeba.Buenos Aires.1962.137 p RODRÍGUEZ DE LA C. M. C., II Palaemonidos del Atlántico y Vertiente Oriental de México con descripción de dos especies nuevas. An. Inst. Nac. Inv. Biol. Pesq.,1965.71-112.1: III Palaemonidos del Golfo de California con notas sobre la biología de Macrobrachium americanum. FAO. Fish. Rep.,1968,373-380.2(57): ROMAN, C. R., An. Centro Cienc. del Mar y Limnol. Univ. Nal. Autón. México, Contribución al conocimiento de la biología y ecología de Macrobrachium tenellum (Smith) (Crustáceo, decapoda, palaemonidae).1979,137-159.6(2): WEINBORN, J. A., An. Centro Cienc. del Mar y Limnol. Univ. Nal. Autón. México, Estudio preliminar de la biología, ecología y semicultivo de los Palinúridos de Zihuatanejo, Gro., México. Panulirus gracilis Street y Panulirus inflatus (Bouvier).1977.27-77.4(1): WEST, R. C. N. P. psuty y B. G. THomLas tierras bajas de Tabasco.Ediciones del Gobierno del Estado de Tabasco.México,1976.199 p.
|

