|
DESCRIPCIÓN DEL HUEVO Y EL DESARROLLO LARVARIO DE MEMBRAS
VAGRANS (GOODE Y BEAN) CON NOTAS SOBRE SU ÉPOCA DE, DESOVE EN LA LAGUNA
DE TAMIAHUA, VERACRUZ. (PISCES: ATHERINIDAE)
Trabajo recibido el 15 de
noviembre de 1982 y aceptado para su publicación el 21 de enero de 1983.
CÉSAR FLORES-COTO
Universidad Nacional Autónoma de México, Instituto
de Ciencias del Mar y Limnología. Contribución 327 del Instituto
de Ciencias del Mar y Limnología, UNAM.
El objetivo
del presente trabajo es la descripción del huevo y estadios larvarios de
Membras vagrans (Goode y Bean, 1879), para lo que se
utilizó material procedente de la Laguna de Tamiahua, Veracruz. El huevo
es de forma casi esférica con su diámetro mayor de 0.94 mm. La
talla de eclosión se estimó entre 3.0 y 3.5 mm. La flexión
del urostilo fue entre 5.0 y 5.5 mm. Alrededor de los 6.5 mm se inicia la
definición de los radios de las aletas, anal, caudal y segunda dorsal y
aparecen los primordios de la primera dorsal; las aletas pélvicas se
inician hasta los 7 mm y la lepidosis a los 13 mm. Las larvas de M.
vagrans se pueden distinguir de otras especies ya descritas de la
misma familia, primero por la presencia de un cromatóforo grande,
situado en la parte media dorsal de la cabeza, el que conforme se desarrolla
adquiere forma triangular lobulada, y dos más pequeños anteriores
al primero; y segundo o porque la aparición de las aletas es más
temprana que en las otras especies. Se encontró que la Laguna de
Tamiahua es una área de reproducción donde el desove se produce
todo el año pero básicamente en verano-otoño, con un
carácter bimodal de la población larvaria y juvenil.
The goal of the present study is a description of the egg and larval stages of
Membras vagrans (Goode and Bean, 1879); material from
Tamiahua Lagoon (State of Veracruz, México) was utilized. The egg is of
an almost spherical form, its major diameter being over 0.94 mm. The hatch size
was estimated between 3.0 and 3.5 mm, whil5t flection of the urostyle was
between 5.0 and 5.5 mm. At around 6.5 mm radius of anal, caudal and the second
dorsal fin appear and primordia of the second dorsal show up. Not until
reaching a size of 7 mm form the pelvic fins and at 13 mm scalation starts to
form. Larvae of M. vagrans can be easily distinguished from
other already described species of the same family, basically due to 1) its
large chromotophore situated at the medium dorsal part of the head; this cell,
according to its devolpment changes to a triangular lobular form. This species
has a well two chromatophores anterior to the first one. 2) - Fins appear much
earlier than in other species. It has been found that Tamiahua Lagoon is a
reproduction area where spawning occurs around the year but principally during
surmner-fall with a bimodal character of the larval and juvenile
population.
Durante el desarrollo de una serie de estudios tendientes a conocer las poblaciones ictioplanctónicas de varias lagunas costeras del Golfo de México, ha sido frecuente la imposibilidad de identificar muchos de los huevos y larvas hallados, consecuencia de la falta de trabajos que aborden la descripción de especies, que si bien no son exclusivas, si son comunes en nuestras aguas lagunares y costeras. Aunque de muchas especies han sido descritos sus huevos y larvas, la sobreposición de caracteres merísticos, morfométricos y pigmentarios no permite una clara separación de sus primeras etapas. Por lo anterior y habiendo encontrado material suficiente durante las colectas efectuadas en la Laguna de Tamiahua, Veracruz, se vio la conveniencia de abocarse a la descripción de Membras vagrans (Goode y Bean, 1879), objetivo primario del presente trabajo, así como señalar algunos datos sobre su distribución y época de desove en la mencionada laguna. ANTECEDENTESLa familia Atherinidae está constituida por especies, en su mayoría de aguas tropicales, tanto dulceacuícolas como marinas; muchas con importancia económica, particularmente las de agua dulce como Chirostoma estor Jordan 1879 del Lago de Pátzcuaro, mejor conocida como pescado blanco de Pátzcuaro (Rosas, 1970) y otras con las que también se practica la aterinicultura (Chirinos y Chuman, 1964) razón por la que ya están bien conocidos sus huevos y larvas. Cuatro especies de Atherinidae han sido reportadas para el Golfo de México, Menidia beryllina (Cope), Membras martinica (Valenciennes), Membras vagrans (Goode y Bean) y Menidia collei Hubbs, todas ellas sin importancia económica, no obstante de las dos primeras ya han sido descritos sus huevos y larvas (Martin y Drewry, 1978; Wang, 1974, Wang y Kernehan, 1979), faltando las de las otras dos especies las cuales son endémicas del Golfo de México (Castro-Aguirre, 1978). Membras vagrans (Goode y Bean, 1879), cuya distribución geográfica descrita, va desde Florida (E.U.A.) hasta Veracruz (México), tiene entre sus características generales la presencia de una banda plateada a lo largo de la línea media lateral del cuerpo, desde la base de las aletas pectorales, hasta la base de la caudal, así como la presencia de dos aletas dorsales, la primera de las cuales está formada por un reducido número de espinas suaves. Características del género son la presencia de escamas crenadas que le dan una sensación rugosa al tacto, así como grandes escamas deciduas a lo largo de las bases de las aletas anal y dorsal. Como características específicas se pueden mencionar los números de los radios y espinas de las aletas mencionadas; D, III-VI, 1-6-7; A, 1-14-18; Escamas 43-48 (Castro-Aguirre, 1978). MATERIAL Y MÉTODOSEl material empleado en el desarrollo del presente trabajo provino de una serie de 4 colectas trimestrales, pretendiendo abarcar un ciclo anual en una red de 25 estaciones de muestreo en la Laguna de Tamiahua, Veracruz (Tabla l). Las muestras fueron fijadas en una solución de formalina al 4% neutralizada con borato de sodio, para su posterior procesamiento en el laboratorio. Muchos de los especímenes estuvieron deteriorados, por lo que se seleccionaron una secuencia de ellos desde la talla de eclosión hasta 22 mm aproximadamente. De cada uno de los especímenes se tomaron los conteos de radios y espinas de las aletas dorsal y anal, descartando las otras que no tienen variación respecto a especies con las que pudieran sobreponerse. De igual manera se obtuvieron medidas de la longitud patrón, longitud al ano, longitud a la segunda dorsal y longitud a la anal, que se definen en seguida, descartando otras de poco o ningún significado para el objetivo del presente trabajo (Tabla 2).  TABLA 1 RELACIÓN DE LARVAS Y JUVENILES DE MEMBRAS VAGRANS CAPTURADOS DURANTE CUATRO PERÍODOS DE MUESTREO; EXPRESADOS COMO ORG/100 m3, PARA CADA ESTACIÓN DE COLECTA. Longiutd patrón (LP). Distancia desde la parte más anterior de la nariz, hasta la punta del urostilo o parte más posterior del complejo hipural. Longitud del ano (LA). Distancia desde la punta de la nariz en dirección paralela al eje del cuerpo, hasta el nivel posterior del ano. Longitud cefálica (LC). Distancia desde la punta de la nariz hasta el extremo posterior del opérculo, o parte anterior de la base de las aletas pectorales cuando el opérculo no fue visible. Longitud a la segunda aleta dorsal (Ld). Distancia desde la punta de la nariz en dirección paralela al eje del cuerpo, hasta el nacimiento de la espina de la segunda aleta dorsal. Longitud a la aleta anal (La). Distancia desde la punta de la nariz en dirección paralela al eje del cuerpo, hasta el nacimiento de la espina de la aleta anal. RESULTADOS Y DISCUSIÓN
DESCRIPCIÓN DEL DESARROLLO
HuevoEl huevo tiene una forma casi esférica con un eje mayor de 0.94 mm y uno menor de 0.90 mm, con pequeño espacio perivitelino. El corion está ornamentado con pequeñas puntuaciones (Fig. l). Presenta un par de filamentos adhesivos que nacen casi juntos y cuya longitud no pudo determinarse por estar enredados en algas filamentosas, puede estimarse sin embargo una longitud aproximada de tres a cuatro veces el diámetro del huevo. Tiene tres glóbulos de grasa cuyo diámetro varía entre 0.16 y 0.24 mm, los cuales están rodeados de un número no determinado de otros de pequeño tamaño. 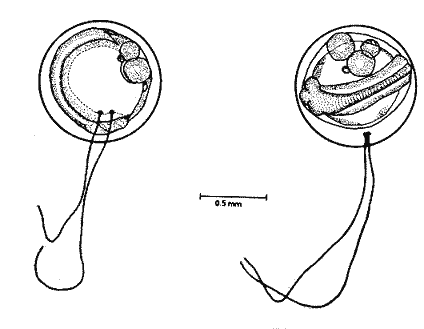 Fig. 1 Huevo de Membras vagrans (092 mm de diámetro). 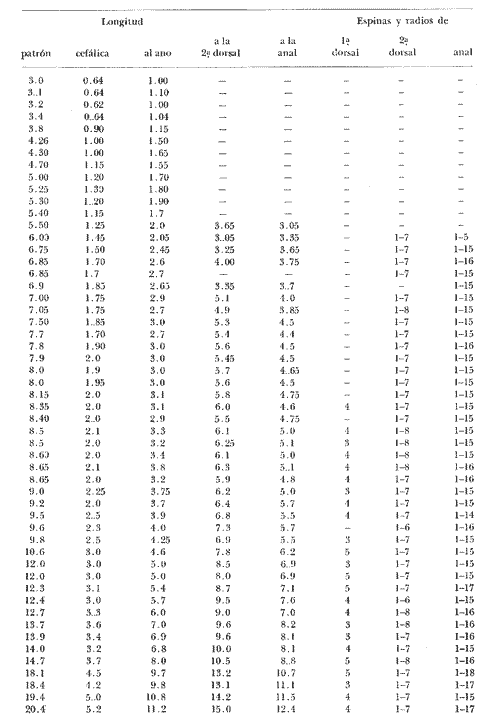 TABLA 2 RELACIÓN DE CARACTERÍSTICAS MERISTICAS Y MORFOMÉTRICAS PARA UNA SECUENCIA DE ORGANISMOS DE MEMBRAS VAGRANS, DESDE LA TALLA DE ECLOSIÓN HASTA 20mm. LarvasAunque el material para el presente trabajo proviene de colectas periódicas y no de un cultivo, lo cual permitiría determinar precisamente la talla de eclosión, puede sin embargo considerarse que ésta es, alrededor de 3 mm, basándose tanto en el material aquí descrito como en antecedentes bibliográficos que refieren tallas de eclosión similares para especies cercanas, tales como Membras martinica (Wang, 1974). Para el objetivo del presente trabajo, se consideran las tallas de 3 a 3.5 mm como larvas recién eclosionadas. Durante esta etapa la forma del cuerpo es alargada con la cabeza redondeada, ojos grandes que ocupan aproximadamente 47% de la cabeza. El intestino termina muy anteriormente, cerca de 1/3 de la longitud patrón. La aleta primordial es notable alrededor del cuerpo, las aletas pectorales ya están presentes y en avanzado estado de desarrollo. Los glóbulos de grasa han coalesido en uno solo y junto con el resto del saco vitelino están casi absorbidas en esta etapa (Figs. 2 y 3). El esquema aquí descrito puede aplicarse a varias especies de la familia, no así la pigmentación que es más específica. Presentan un melanóforo estrellado en la parte media dorsal de la cabeza y dos más pequeños, anteriores al primero. En la mayor parte de la porción dorsal del tracto digestivo se presentan una serie de malanóforos estrellados, formando como una gran mancha, y en la región ventral y anterior la pigmentación es a veces difusa y otras parece una clara mancha. Pequeños puntos de pigmentos pueden o no estar presentes sobre la porción media lateral del cuerpo, a nivel de la columna vertebral. 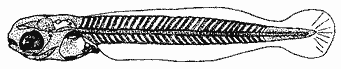 Fig. 2. Larva recién eclosionada, sin pigmentos en la porción media lateral del cuerpo (3.2 mm de LP) 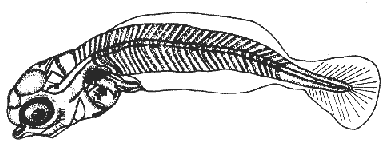 Fig. 3. Larva recién eclosionada con pigmentos en la porción media lateral del cuerpo (3.15 mm de LP). Los organismos de 3.5 a 4.5 mm conservan la forma del cuerpo y su principal variación además del incremento de talla está en el patrón de pigmentación. Los pigmentos de la línea lateral se hacen muy aparentes constituyéndose en las siguientes etapas en una linea discontinua, desde el nivel del ano hasta 3/4 partes del cuerpo. El pigmento estrellado de la cabeza se modifica tendiendo a una forma triangular con un vértice mayor dirigido hacia atrás y los otros dos hacia los lados. En algunos un pequeño pigmento aparece en la línea media dorsal a nivel de las aletas pectorales. Alrededor de los 5 mm el cambio más notorio es la flexión del urostilo, lo cual termina cerca de los 5.5 mm. Durante este período se van haciendo aparentes las bases de las aletas anal y segunda dorsal, en tanto la aleta primordial tiende a desaparecer (Fig. 4). Los hechos más notables del desarrollo en una siguiente etapa (- 6.5 mm) son, respecto a su morfología, la definición de los radios de las aletas anal, caudal y segunda dorsal, así como el inicio de la primera dorsal, y en cuanto a su pigmentación, la aparición de una serie de pigmentos cercanamente pareados a lo largo de la línea media ventral, excepto en la región ocupada por la aleta anal. 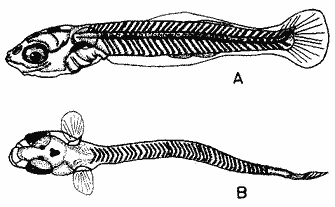 Fig 4. Larva de 5.25 mm de LP, en etapa de Elección del urostilo A.-Vista lateral, B.-Vista dorsal. El melanóforo grande de la porción media dorsal de la cabeza conserva su configuración triangular, pero los vértices no son agudos, sino en forma de lóbulos, siendo el posterior el de mayor tamaño. El pigmento de la línea dorsal a nivel de las aletas pectorales se hace más aparente. Aparecen también nuevos pigmentos, unos en la parte anterodorsal de las fosetas nasales y del hocico, así como en la línea media dorsal, en la porción entre la segunda dorsal y la caudal. Alrededor de los 7.0-7.5 mm se hace más notoria la primera aleta dorsal, se inicia la formación de las pélvicas y los demás cambios son básicamente pigmentarios; así, se presenta un nuevo pigmento justo antes de la segunda dorsal, varios en la región lateral de la cabeza y en la porción distal de las bases de los radios de la aleta anal (Fig. 5). A partir de esta etapa hasta cerca de los 13 mm cuando inicia la escamación, no hay cambios notables en la morfología de las larvas, excepto el mayor desarrollo de las aletas en general y las pélvicas en particular. La primera aleta dorsal tiene ya sus radios completos alrededor de los 8.5 mm (Fig. 6). En cuanto a la pigmentación se refiere, se mantiene el patrón descrito al que únicamente hay que agregar la aparición de unos cuantos puntos de pigmento en la región media dorsal anterior del cuerpo y otros en los radios de la aleta caudal. 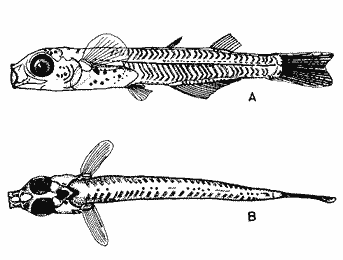 Fig. 5. Larva de 7.75 mm de LP, mostrando su típico patrón de pigmentación y el inicio de las aletas pélvicas a nivel del ano. A-Vista lateral, B.-Vista dorsal. 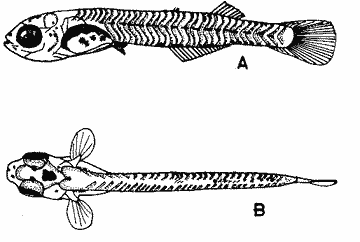 Fig. 6. Larva de 12.86 mm de LP, mostrando sus radios y espinas completos. Inicio de escamación. A.-Vista lateral, B.-Vista dorsal. A partir de los 13-14 mm de longitud patrón se desarrolla la escamación, convirtiéndose las larvas en pequeños juveniles cuya pigmentación va incrementándose paulatinamente, tanto sobre el tracto digestivo como sobre los lados del cuerpo hasta alcanzar a formar la característica banda plateada lateral de los representantes de esta familia; el resto de la pigmentación sufre aumentos poco apreciables (Fig. 7). 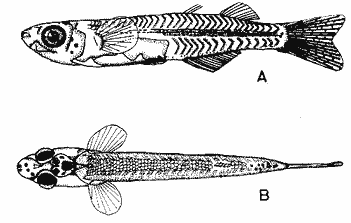 Fig. 7. Larva de 18.9 mm de LP, donde se aprecia la posición anterior de las aletas pélvicas respecto al ano, A.-Vista lateral, B.-Vista dorsal. Un hecho que no es definible para una etapa determinada, es la posición relativa que guardan algunas estructuras durante el desarrollo larvario, así cuando las aletas pélvicas aparecen (~ 7.07.5 mm), lo hacen justo a nivel del ano, pero conforme las larvas crecen se va creando un espacio entre ambas estructuras, de manera que en los juveniles el ano llega finalmente a estar más cerca del origen de la aleta anal que de la base de las pélvicas. En apoyo a la descripción hasta aquí hecha, se realizó un análisis de regresión linear para las longitudes cefálica (LC), al ano (LA), a la segunda aleta dorsal (Ld) y a la anal (La), en relación a la longitud patrón (LP) cuyos resultados se muestran en la tabla 3 y de donde dos aspectos deben ser mencionados: El primero es que las longitudes al ano y a la aleta anal tienen un crecimiento isométrico, como puede deducirse al comparar los valores de sus pendientes 0.596 y 0.617 respectivamente, las cuales no difieren a un nivel de confianza de 95%. El segundo aspecto es que aunque los valores de la ordenada al origen sean significativamente distintos de cero, son suficientemente pequeños para poder utilizar los valores de las pendientes, como una representación aproximada del porcentaje de las longitudes mencionadas, respecto a la longitud patrón, la cual sería: longitud cefálica 25.7%, longitud al ano59.6%, longitud a la segunda aleta dorsal 76.8% y longitud a la anal 61.7%.  TABLA 3 VALORES ESTADÍSTICOS OBTENIDOS, DEL ANÁLISIS DE REGRESIÓN LINEAL POR EL MÉTODO DE MÍNIMOS CUADRADOS, PARA CUATRO SERIES DE PARES DE DATOS QUE RELACIONAN LAS LONGITUDES CEFÁLICAS (LC), AL ANO (LA), A LA SEGUNDA ALETA DORSAL (Ld) Y A LA ANAL (La), CON LA LONGITUD PATRÓN (** = VALORES SIGNIFICATIVAMENTE DISTINTOS DE CERO A UN NIVEL DE CONFIANZA DE 99%) Comparación con otras especiesDe las especies de la familia Atherinidae reportadas para el Golfo de México, de dos han sido descritos sus huevos y etapas larvarias; y sus características generales son muy similares, lo que hace difícil su separación específica (Hildebran, 1922, Martín y Drewry, 1978). Wang (1974), señala una serie de caracteres que sirven para distinguir entre M. martinica, M. beryllina y M. menidia, así que aquí se indicaran aquellos caracteres que permitan distinguir a la especie aquí descrita. Referente al huevo la principal diferencia de Membras vagrans es que tiene el corión esculpido, en tanto en las otras es liso. La talla de eclosión es similar (- 3 mm) a la de M. martinica pero menor que las otra dos. La forma general del cuerpo es muy similar a las demás especies mencionadas, no sólo durante la etapa de eclosión sino durante todo su desarrollo, pero no así el patrón de pigmentación; la diferencia fundamental estriba en la presencia de un melanóforo estrellado de gran tamaño en la porción media dorsal de la cabeza y un par de pequeños melanóforos anterioresa aquel. Después de la etapa de eclosión y en la medida que el melanóforo adquiere forma triangular con sus vértices lobulados, éste constituirá una buena guía de diferencia con las otras especies, hasta alcanzar 13-14 mm donde los números específicos de radios y espinas permiten su mejor identificación. La etapa de aparición de las aletas, es a más temprana edad en M. vagrans particularmente respecto a las especies de Menidia, donde la segunda dorsal aparece alrededor de los 7 mm y la primera dorsal 10 mm. En M. martinica la segunda dorsal aparece a 9 mm y la primera cerca de los 11 mm, en cambio en M. vagrans la segunda dorsal se inicia antes de los 6 mm y en algunos especímenes a esta talla pueden contarse los radios, la primera dorsal aparece alrededor de los 8 mm (Tabla 2). Distribución y época de desoveEl material utilizado para el presente trabajo proviene como ha sido mencionado de la Laguna de Tamiahua (Fig. 8) situada en la porción norte del Estado de Veracruz y sobre cuyas características puede acudirse a los trabajos de Ayala-Castañares, et al. (1969), Reséndez (1970), entre otros. En virtud del poco conocimiento que se tiene de la biología de M. vagrans resulta conveniente hacer algunos señalamientos respecto a su distribución y época de desove en la mencionada laguna. Como puede deducirse los resultados de los cuatro períodos de muestreo mostrados en la tabla 1, esta especie desova todo el año aunque escasamente en invierno y primavera, en tanto en verano-otoño presenta su máximo. Gunter (1945) señala haber encontrado en algunas bahías de Texas, hembras y machos maduros en los meses de marzo y abril únicamente, lo que puede atribuirse a que de sus áreas de muestreo excluyó zonas de rocas y bancos ostrícolas, lo que es justamente la característica de la mayor parte de la Laguna de Tamiahua; un gran banco ostrícola. Para la especie cercana M. martinica Martín y Drewry (1978), señalan como áreas de desove justo fuera de la zona de rompiente sobre playas arenosas, encontrando hembras maduras en marzo, agosto y septiembre en las costas del Golfo de México. Sin embargo, la distribución espacial de las larvas y juveniles en la Laguna de Tamiahua, mostró una mayor abundancia en el cuerpo principal de ésta, en tanto en los canales y puntos de muestreo cercanos a las bocas la presencia de M. vagrans fue escasa o nula. Por lo anterior se puede entender que la laguna es una área de desove y crianza. El hecho de haber encontrado un solo huevecillo en las colectas de plancton resultó obviamente una situación fortuita, ya que ellos no son planctónicos sino se adhieren al substrato. Su identidad específica puede entenderse por el hecho de ser M. vagrans la única especie de Atherinidae presente en esta laguna. En la figura 9 donde los especímenes se han ordenado por tallas para cada una de las cuatro estaciones, puede apreciarse que en el verano no se obtuvieron juveniles, sólo larvas, cuya moda está alrededor 8 mm; en el otoño aparece una moda alrededor de 5 mm y gran cantidad de juveniles que pueden interpretarse como resultado del desove del verano. Como las muestras sólo fueron trimestrales, no puede definirse una etapa de máximo desove, sin embargo por lo antes expuesto, es probable que no exista un solo pico de máximo, sino varios a través del verano-otoño. El señalamiento de más de un pico de desove a través del período verano-otoño parece confirmarse con la información de Gunter (1945) que señala un carácter bimodal en la población de las bahías de Texas, igual carácter es señalado para la población del Golfo de M. martinica por Martín y Drewry (1978). Las relaciones de los períodos de desove (mínimo, invierno-primavera y máximo, verano-otoño) con la temperatura no son claras, pues mientras en el verano, se tuvieron altas temperaturas que variaron de 30.1 a 32.9°C similar a la primavera, en el otoño la variación fue de 16.2 a 18.4°C similar a la de invierno. Puede señalarse sin embargo la correspondencia del inicio de la época de máximo desove y la de mayor temperatura del año, el verano. La salinidad parece guardar una mayor relación con las épocas de desove, pues justamente invierno-primavera fueron épocas de menor salinidad (20 a 33%) y escaso desove, en tanto verano-otoño que fueron las de mayores salinidades (25 a 36%) lo fueron también de máximo desove. La época de mayor desove definida como aquí se ha hecho, no puede atribuirse estrictamente a la influencia de la salinidad, seguramente una serie de otros factores intervienen; valgan entonces las presentes líneas para señalar los rangos de salinidad y temperatura en que se presentó dicho máximo. 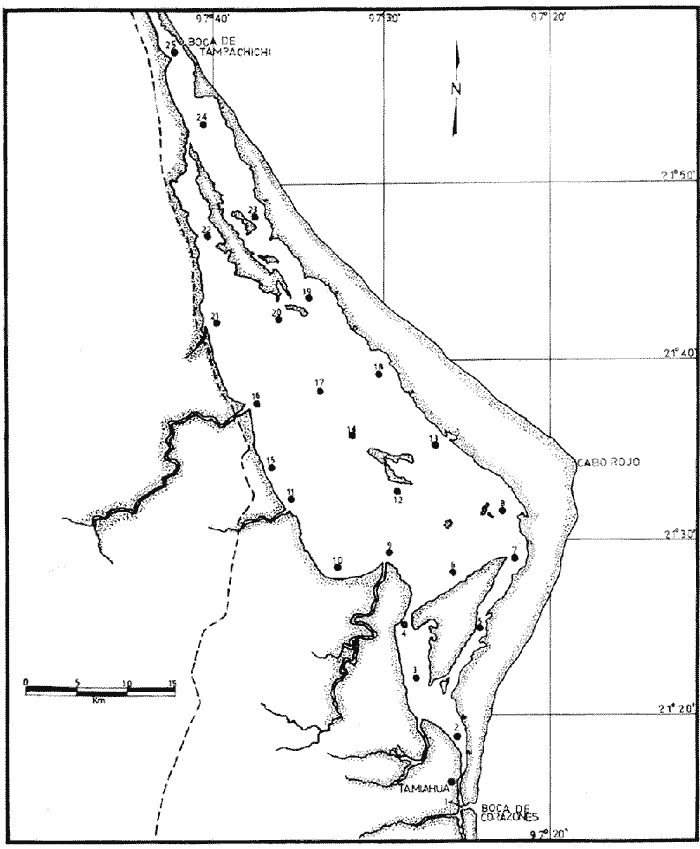 Fig. 8. Área de estudio Laguna de Tamiahua, Ver., y ubicación de estaciones de muestreo. 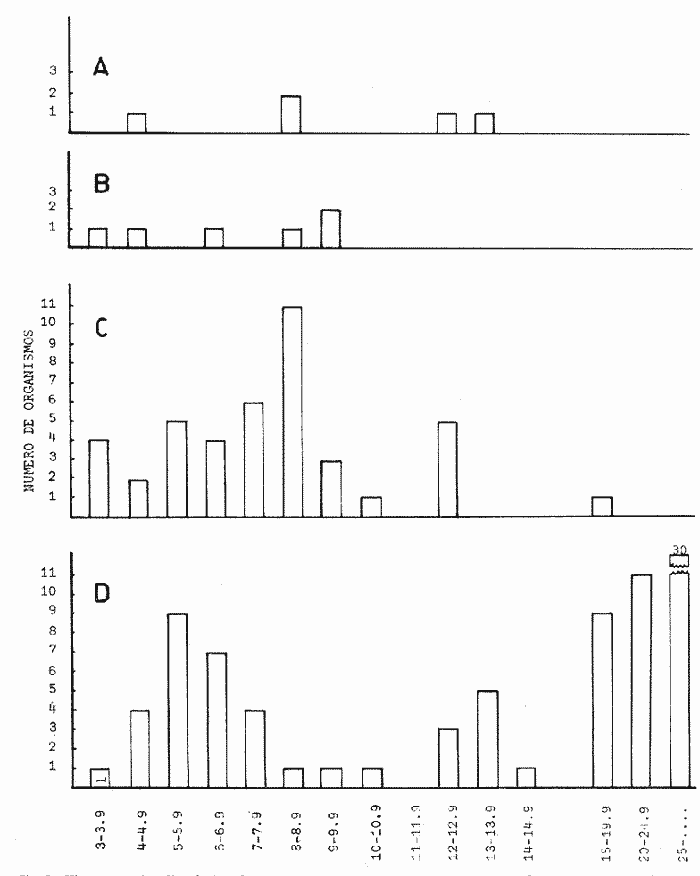 Fig. 9 Histogramas de tallas de Membras vagrans para cada uno de los cuatro períodos de muestreo: A, invierno, B, primavera C, verano; D, otoño. AgradecimientosSe agradece a Guadalupe Palomino por su asesoría estadística, a Pierre Chavance por su lectura crítica del manuscrito, y valiosas sugerencias, a Rosa María Sánchez y Enriqueta García por el trabajo mecanográfico, a Faustino Zavala por su ayuda en los dibujos y a Alejandro Yáñez por su asesoría editorial y apoyo en la presentación de éste, entre otros trabajos. LITERATURAAYALA-CASTAÑARES, A., R. CRUZ, A. GARCíA-CUBAS, Jr. L. R. SEGURA Lagunas Costeras un Simposio. Mem. Simp. Inter. Lagunas Costeras. Síntesis de los conocimientos sobre la Geología Marina de la Laguna de Tamiahua, Veracruz, México. Ayala-Castañares A. y F. B. Phleger UNAM-UNESCO 1969 39-48 Nov. 20-8, 1967 CASTRO-AGUIRRE, J. L. Catálogo sistemático de los peces marinos que penetran a las aguas continentales de México con aspectos zoogeográficos y ecológicos. Inst. Nal. de Pesca. Ser. Cient. 1978 298 p. (19) CHIRINOS, V. A. E. CHUMAN Notas sobre el desarrollo de huevos y larvas del pejerrey Odontesthes (Austromenidia) regia regia (Humboldt). Bol. Inst. Mar. Perú 1964 1-31 1 (1) GUNTER, G. Studies on Marine Fishes of Texas. Pub. Inst. Mar. Sci. Univ. Tex 1945 1-190 1 (1) HILDEBRAN, S. F. Notes on habits and development of eggs and larvae of the silverside Mendia mendia and Menidia beryllina. U.S. Bur. Fish. Bull. 1922 113-120 38 MARTIN, F. D. G. E. DREWRY Development of fishes of the Mid-Atlantic Bight, an Atlas of egg, larval and juvenile stages. Fish and Wildlife Service U.S. Department of the Interior. Biol. Serv. Prog. 1978 416 p. 6 RESÉNDEZ, M. A. Estudio de los peces de la Laguna de Tamiahua, Veracruz, México. An. Inst. Biol. Univ. Nal. Autón. México. Ser. Cienc. del Mar y Limnol. 1970 79-146 41 (1) ROSAS, M. Pescado blanco (Chirostoma estor) su fomento y cultivo en México. Instituto Nacional de Investigaciones Biológico Pesqueras. Dirección General de Pesca e Industrias Conexas. Secretaría de Industria y Comercio. Serie Divulgación Instructivo 1970 80 p. 2 WANG, J. C. S. Manual for identification of early developmental stages of fishes of the Potomac River Stuary. Atherinidae-Silverside páginas 143-151. Lippson, Alice J. y R. Lynn Moran. Md. Dept. Nat. Resour. Power Plant Siting Program. 1974 282 p. PPSP-MP13 WANG, J. C. S. R. J. KERNEHAN Fishes of the Delawere Estuaries guide to the early life histories. Ecological Analysits, INC., Communications Department. 1979 410 p.
|

