|
DINÁMICA AMBIENTAL DE LA BOCA DE
ESTERO PARGO Y ESTRUCTURA DE SUS COMUNIDADES DE PECES EN CAMBIOS ESTACIONALES Y
CICLOS DE 24 HORAS (LAGUNA DE TÉRMINOS, SUR DEL GOLFO DE MÉXICO)
Trabajo recibido el 15 de junio de 1982 y aceptado para su
publicación el 22 de noviembre de 1982.
ALEJANDRO YÁÑEZ-ARANCIBIA
ANA LAURA LARA-DOMÍNGUEZ
Universidad Nacional Autónoma de México, Instituto
de Ciencias del Mar y Limnología, Laboratorio de Ictiología y
Ecología Estuarina. Contribución 324 del Instituto de Ciencias
del Mar y Limnología, UNAM. Proyecto UNAM-PEMEX/PCEESC y Proyecto
UNAM-CONACYT, PCMABEU 005322.
El estudio de un ciclo
anual reveló que la Boca de Estero Pargo (ambiente de Thalassia
testudinum) es utilizado por una variedad de peces juveniles y
adultos los cuales migran desde el mar y los sistemas fluviales a la Laguna de
Términos. Esta es una área de crianza, reproducción y
alimentación. En este ecosistema no contaminado, fueron capturados 14
266 peces, que representan 77 especies de 30 familias en 90 colectas con red de
arrastre entre febrero de 1981 y enero de 1982. El 95% de las mediciones de
salinidad y temperatura fluctuaron de 20.61 a 28.41 ppm y de 27.43 a
29.64°C respectivamente; las transparencias medidas durante el ciclo,
siempre fueron del 100%.
Las variaciones diurnas y
estacionales de los distintos índices de diversidad -densidad, biomasa
(de 0.433 a 3.428 g m-2), frecuencia y abundancia
numérica (de 809 a 4717 indiv.) estuvieron relacionados
estadísticamente a los cambios de salinidad, temperatura y
períodos de luz. Las variaciones nictemerales en densidad y biomasa,
están relacionadas al comportamiento trófico específico
(hábitos alimenticios diurnos y nocturnos) los cuales influyen en la
capturabilidad, así corroborado por el análisis de "cluster".
Estos parámetros ecológicos de la comunidad de peces, permanecen
altos, reflejando una sucesión diurna en los cambios nictemerales y
estacionales que exhiben ciertas agrupaciones de especies, lo cual indica que
algunos grupos son influenciados más por los períodos de luz que
por el estado de la marea.
Los componentes comunitarios y
los consumidores en diferentes categorías tróficas fueron
cuantificados estacionalmente. Los visitantes ocasionales (53%) y los
consumidores de segundo orden (51%) dominaron a través de todo el
año. Fueron cuantitativamente importantes 14 especies en términos
de frecuencia, biomasa y abundancia numérica; representadas por las
familias de Pornadasyidae, Gerreidae, Sparidae, Sciaenidae, Engraulidae,
Tetraodontidae, Lutjanidae, Ariidae, Batrachoididae y Diodontidac.
A
one year study revealed that the Estero Pargo Inlet (Thalassia
testudinum environment) is utilized by a variety of immature and
adult fish which immigrate from the sea and fluvial system to the Terminos
Lagoon. This is a nursery, reproductive and feeding area. In this unpolluted
ecosystem, 14266 fish representing 77 species 30 families were captured in 90
trawl collections between February, 1981, and January, 1982. Ninety five
percent of the salinity and temperature measurements ranged from 20.61 to 28.41
ppt and 27.43 to 29.64°C respectively; transparency measurement was
always 100%.
Diurnal (24-h) and seasonal variations of
several diversity indices density, -biomass, frequency and numerical abundance-
were statistically related to changes in salinity, temperature and light
periods. Nichthemeral variations in density and biomass are probably related to
specific trophic behavior (night or day feeding) which influences catchability,
as was corroborated by cluster analysis. These ecological parameters of the
fish community remained high, reflecting a daily and seasonal succession of
dominant fish species. The similarity in nichthemeral and seasonal changes
exhibited by certain assemblages of species indicates that some dominant groups
are influenced more by light period than by tidal stage.
Community inhabitants and consumer of different trophic categories
were seasonally quantified. Occasional visitor (53%) and second-order consumers
(51%) were dominant throughout the entire year. 14 species were quantitatively
important in terms of frequency biomass and numerical abundance; the families
represented were Pomadasyilae, Gerreidae, Sparidae, Sciaenidae, Engrulidae,
Tetraodontidae, Lutjanidae, Ariidae, Batrachoididae and Diodontidae.
Los pastos marinos constituyen una comunidad particular de aguas someras en ecosistemas estuarinos y marino-costeros (Phillips, 1969). Se han enfocado numerosas investigaciones al estudio de pastos marinos. Los primeros estudios se refieren a estructura vegetativa o función (como producción primaria) de una especie en particular. Tan sólo en la última década ha existido un interés substancial sobre el entendimiento del patrón de flujo de energía y los mecanismos interactivos que controlan las propiedades del sistema y sus mecanismos de producción. Entre los atributos más importantes de las praderas de Thalassia testudinum es que constituyen áreas de crianza, alta diversidad y densidad de peces e invertebrados, así como también funcionan como áreas de alimentación para la macrofauna en general, como estabilizadores de sedimento y en general como un hábitat complejo (Hoese y jones, 1963; Fergusson-Wood et al., 1969; Carr y Adams, 1973; Adams, 1976a, 1976b, 1977; Mc Roy y Helfferich, 1977; Thorhaug y Roessler, 1977; Weinstein y Heck, 1979; Yáñez-Arancibia et al., 1980a; Heck y Orth, 1980; YáfiezArancibia, 198la; Vargas Maldonado et al., 1981). La mayoría de los trabajos sobre pastos marinos se han enfocado a las dos especies más comunes: Zostera marina (pastos templados) y Thalassia testudinum (pastos tropicales) . La producción anual es extremadamente alta y fluctúa desde casi 500 gC/M2. año en zonas templadas a 1000 gC/m2. año en el trópico (Thayer et al., 1975; Penhale, 1977; Jones, 1968; Mc Roy y Mc Millan, 1977; Mc Roy y HeIfferich, 1977; Zieman y Wetzel, 1980). Las praderas de pastos están ampliamente distribuidas en todo el mundo y tienen una contribución substancial a la productividad mundial costera total (Mc Roy y Mc Millan, 1977). La producción primaría en comunidades de pastos marinos es aportada por varios componentes: pastos marinos, macro y micro-algas bénticas, algas epifíticas y fitoplancton. Jones (1968) y Penhale (1977) determinaron que del 18-20% de la productividad es aportada por epífitas asociadas a los pastos marinos. A pesar de la gran velocidad de producción de los pastos marinos se conocen pocos heterótrofos que utilicen directamente tejido macrofito (Zieman et al., 1979; Fenchel, 1977). Una trama trófica de pastoreo, se sostiene predominantemente por fitoplancton, epífitas y micro-algas bénticas. El mayor porcentaje de carbono fijado, fluye a través de una trama trófica basada en detritus, y dominada por el suministro de plantas vasculares (Thayer et al., 1975). La utilización de materia particulada muerta proveniente de pastos marinos, es un proceso complejo que involucra una diversidad de organismos, con interrelaciones tróficas complicadas. Las bacterias y hongos son los decomponedores primarios. El proceso total de descomposición afecta los ciclos minerales y el ambiente químico de todo el sistema de pastos (Fenchel, 1977; Mann, 1972). Aunque abundan los estudios faunísticos, existen pocos que se refieran cuantitativamente a la trama trófica y dinámica más allá del es labón del detritus (Kikuchi y Peres, 1977) Thayer et al. (1975) proponen un modele conceptual de flujo de energía en un sistema templado de pastos marinos. Característicamen te, estos sistemas tienen una alta densidad de organismos ahí residentes, y en concomitancia una alta tasa de producción secundaria. Contituyen una importante área de crianza y alimentación para muchas especies de necton marino (Yáñez-Arancibia et al., 1980a). Las altas tasas de producción se atribuyen a una alta velocidad de producción de detritus y al sustrato mismo de pastos marinos. El sustrato de pastos marinos, es importante como un refugio para organismos como estabilizador de sedimentos y en la creación de microhabitats (Thayer et al., 1975; Kikuchi y Peres, 1977). Hay indicadores recientes de que existe un transporte, considerable de pastos marinos fuera de la costa, donde constituyen alimento para organismos tanto de superficie como bentónicos. Existen complejas e importantes interacciones entre disponibilidad de nutrientes y producción primaria. Las limitaciones a la productividad han recibido una gran atención en investigación, atribuyéndose a nutrientes y parámetros ambientales relacionados con temperatura, salinidad y luz (Penhale, 1977). La dinámica de nutrientes en las praderas y la nutrición mineral de estos vegetales han recibido muy poca atención. Las áreas de pastos marinos de la Laguna de Términos constituyen un subsistema ecológico particular de ella, ecológicamente estable pero frágil, y con numerosas fronteras con otros subsistemas ecológicos vecinos (Yáñez-Arancibia et al., 1983). El área de Estero Pargo es una de las áreas representativas de este subsistema que es uno de los primeros en ser colonizados por la fauna que inmigra desde el mar. El intercambio de organismos vivos entre este subsistema, el resto de la Laguna de Términos, y la Sonda de Campeche, esta relacionado a los procesos físicos y a las actividades reproductivas y de comportamiento de las especies. Los peces juveniles y adultos se distribuyen en las praderas de Thalassia testudinum por su propia capacidad de energía y muestran regularidad en sus patrones estacionales de migracion. OBJETIVOSPara llegar a integrar adecuadamente la estructura y función de las comunidades de peces, y la dinámica del ambiente, detallando los patrones de comportamiento y los procesos que controlan la producción y el intercambio de organismos, se requiere profundizar en áreas críticas, para lo cual se plantean los siguientes objetivos: - Análisis cuantitativo de las características ambientales de la Boca de Estero Pargo. - Caracterización de la estructura de la comunidad de peces (en un ciclo anual), en términos de composición de especies, diversidad, distrihución y abundancia, en la Boca de Estero Pargo. ÁREA DE ESTUDIOEstero Pargo forma parte del Subsistema o Grupo I de la Laguna de Términos, definido por Yáñez-Arancibia et al. (1983). Detalles descriptivos y analíticos de Estero Pargo se encuentran en los trabajos de Ley-Lou. (1979), Yáñez-Aranciba et al. (1980a, 198la), Yáñez-Arancibia y Day (1982) y Vargas Maldonado et al. (1981). Se localiza entre los meridianos 91°44'31" y 91°46'54" de LO y los paralelos l8°38'22" y 18°40'27" de LN (Fig. I). Se sitúa en la porción suroeste de la Isla del Carmen, cerca de Cd. del Carmen. Su orientación es oblicua en el sentido NE-SO. Su longitud es aproximadamente de 5,300 m con un ancho variable entre 14 m (parte media) y 251 m (extremo interno). Se comunica con la Laguna de Términos con una boca de 25 m de ancho. La profundidad promedio es de 2 m. El sustrato es predominantemente lodo y arena de transición con gran cantidad de detrirus orgánico aportado principalmente por los bosques de manglar que circundan sus orillas (Rhizophora mangle y Avicenia germinans), los cuales ademas aportan grandes cantidades de "taninos" provocando un color café-rojizo a las aguas del estero y consiguientemente poca transparencia hacia el interior. En la zona de la boca predominan arenas de transición con 40 a 50% de CaC03. 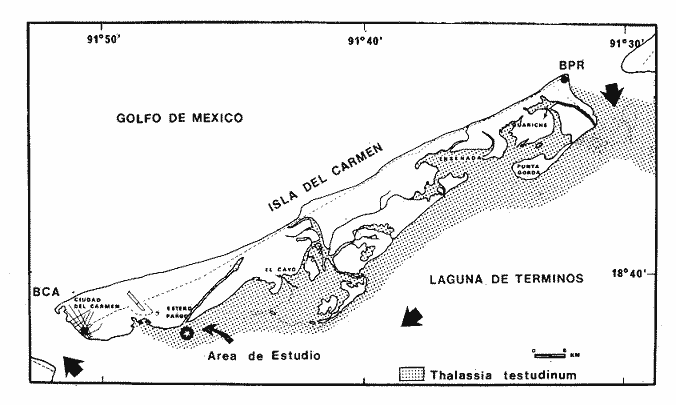 Fig. 1. Área de estudio en la Laguna de Términos. Localización de la zona de muestreos en Estero Pargo. Las flechas indican el sentido de las corrientes prevalecientes. BPR= Bo ca de Puerto Real, BCA = Boca del Carmen. No existe ninguna cuenca hidrográfica en la Isla del Carmen de manera que el aporte de agua dulce a Estero Pargo ocurre sólo en la época de lluvias. Cerca de la boca y en la boca misma se establecen parches de Thalassia testudinum (Fig. 1). Las referencias arriba mencionadas establecen que la salinidad varía entre 26 y 43 ppm, y la temperatura entre 23 y 32°C y la transparencia presenta valores promedios de 80% en la zona de la boca. Por su localización tropical, la Laguna de Términos, no presenta una fuerte variación estacional. Sin embargo, Yáñez-Arancibia y Day (1982) sugieren tres períodos climáticos en relación a la precipitación, frecuencia de vientos y temperatura del aire. Estas épocas son: época de secas, de febrero a mayo; época de lluvias persistentes en la tarde y noche durante los meses de junio a octubre; y la época de nortes con lluvias ocasionales de noviembre a febrero. MATERIAL Y MÉTODOS
ACTIVIDAD DE CAMPOSe realizaron 90 colectas de peces durante los meses de febrero, marzo, mayo, julio, septiembre, noviembre de 1981 y enero de 1982. Para cada mes se efectuaron arrastres en un ciclo de 24 horas en intervalos de dos horas cada uno. Para el mes de febrero se realizaron arrastres dobles a partir de las 06:00 hasta las 20:00 hrs., de una duración de 10 minutos cada uno. Se utilizó una red de arrastre de prueba camaronera de 2.5 m de abertura de trabajo y luz de malla de 3/4". En los meses restantes, los arrastres fueron individuales y de 12 minutos cada uno, utilizando una red con las mismas dimensiones que la anterior pero de luz de malla de 1/2". ACTIVIDADES DE LABORATORIOLas características descriptivas del procesamiento de la ictiofauna en el laboratorio, así como lo referente a componentes comunitarios, posición trófica, análisis estadístico de las comunidades de peces ("Cluster Analysis", Davies, 1971), talla promedio de las poblaciones e índices ecológicos, han sido ampliamente explicados por Yáñez-Arancibia et al. (1982 y 1983). COLECCIÓN DE PECESEn la Boca de Estero Pargo se capturaron 14,266 ejemplares de peces, que representan 30 familias y 70 especies, a lo largo del ciclo nictemeral estacional entre febrero de 1981 a enero de 1982. Estas especies, junto con las reportadas por Vargas Maldonado et al. (1981), hacen un registro total de 77 especies de peces, de las cuales 7 especies no son tratadas cuantitativamente en el presente trabajo y sólo se señala su registro. RESULTADOS Y DISCUSIÓN
CARACTERIZACIÓN AMBIENTAL DE LA BOCA DE ESTERO PARGO
Comportamiento nictemeral (ciclos de 24 horas)Las variaciones de los parametros ambientales, tales como salinidad y temperatura, registrados durante los ciclos nictemerales son las siguientes: en febrero la salinidad fluctuó de 23 a 25 ppm y la temperatura de 22 a 27°C (Tabla 1). Para el mes de marzo la salinidad varió de 24.5 a 26.4 ppm y la temperatura de 28 a 30°C (Tabla 2). En mayo los valores de salinidad registrados fueron de 35 a 36 ppm y de temperatura de 29 a 30.5oC (Tabla 3). Para el mes de julio la salinidad varió entre 27 y 31.5 ppm y la temperatura de 29 a 30.5°C (Tabla 4). Septiembre registró valores de salinidad de 18 a 26 ppm y de temperatura de 29.5 a 31.5°C (Tabla 5). En noviembre la salinidad fluctuó entre 10 a 16 ppm y la temperatura de 28 a 29°C (Tabla 6). Para enero se registraron valores de salinidad entre 19.6 a 26.4 ppm y de temperatura de 26.3 a 28°C (Tabla 7). Para los meses de febrero, marzo, julio y septiembre los valores de salinidad más bajos se registraron durante las horas, de la noche, de las 18:00 a las 06:00; y los más altos en las horas de mayor insolación, de 12:00 a 16:00 horas (Fig. 2). En mayo la salinidad permaneció casi constante y para los meses, de noviembre y enero no presentaron un patrón definido que se relacione con las horas del día, ya que se registraron las máximas salinidades durante las horas sin luz y esto es quizas debido a una onda de marea (Fig. 2). La temperatura mostró un patrón similar al anterior, ya que en todos los meses se registraron los valores más bajos durante las horas sin luz y las primeras horas del día (de 24:00 10:00). Los valores más altos de temperatura se presentaron entre las horas de mayor insolación y las primeras horas de la noche (12:00 20:00) (Fig. 2). Comportamiento estacionalPara el ciclo anual los valores de salinidad promedio fluctuaron entre 13.79 ppm en noviembre, a 35.83 ppm en mayo. Se observa un aumento en la época de secas desde febrero hasta mayo donde alcanza su maximo valor; durante la época de lluvias (julio-octubre) la salinidad comienza a descender hasta alcanzar su mínimo valor en noviembre; demostrándose un patrón estacional para este parámetro (Fig. 3). Las temperaturas promedio registradas, a lo largo del año oscilaron de 24.87 a 30.30°C en los meses de febrero y septiembre respectivamente, lo cual muestra que las variaciones son muy pequeñas. Sin embargo, existe un patrón estacional registrándose el mínimo valor en invierno y el máximo en verano (Fig. 3). 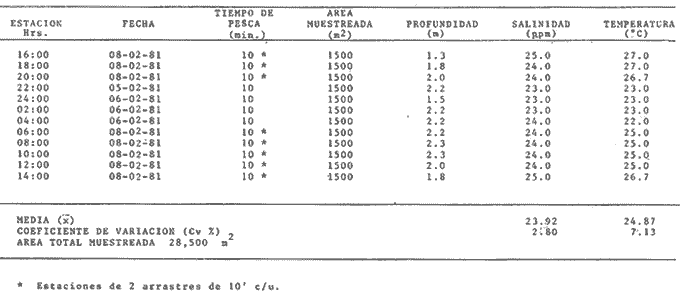 TABLA 1 PARÁMETROS AMBIENTALES EN ESTERO PARGO. FEBRERO 1981 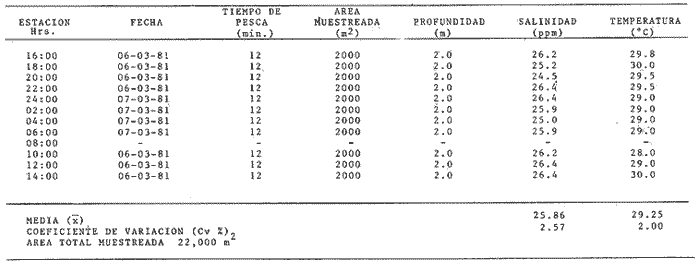 TABLA 2 PARÁMETROS AMBIENTALES EN ESTERO PARGO. MAR.ZO 1981 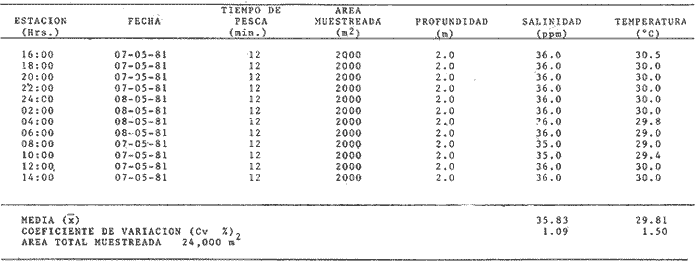 TABLA 3 PARÁMETROS AMBIENTALES EN ESTERO PARGO. MAYO 1981 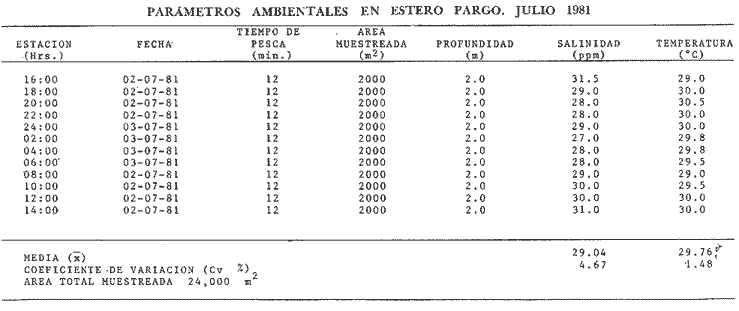 TABLA 4 PARÁMETROS AMBIENTALES EN ESTERO PARGO. JULIO 1981 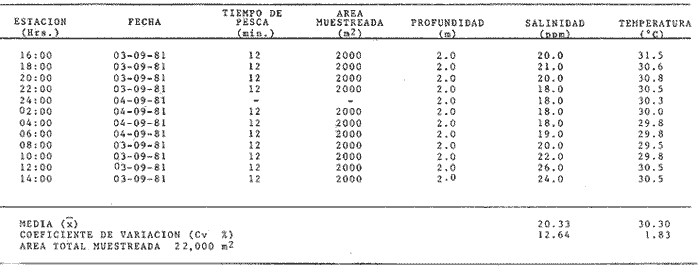 TABLA 5 PARÁMETROS AMBIENTALES EN ESTERO PARGO. SEPTIEMBRE 1981 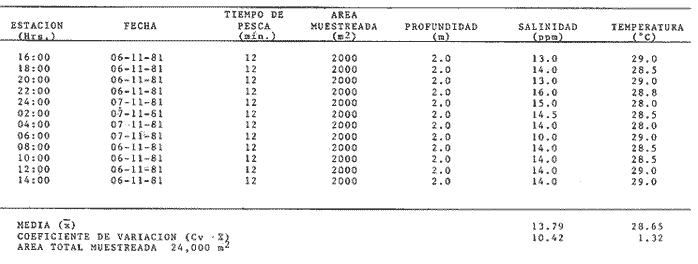 TABLA 6 PARÁMETROS AMBIENTALES EN ESTERO PARGO. NOVIEMBRE 1981 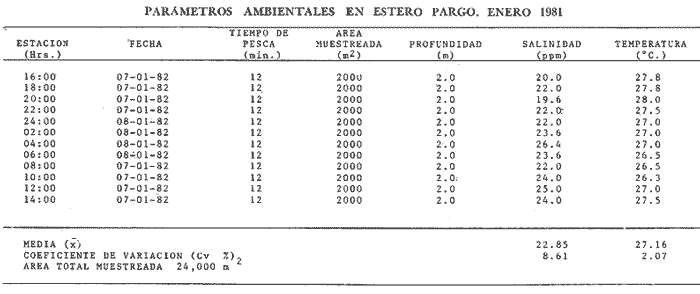 TABLA 7 PARÁMETROS AMBIENTALES EN ESTERO PARGO. ENERO 1981 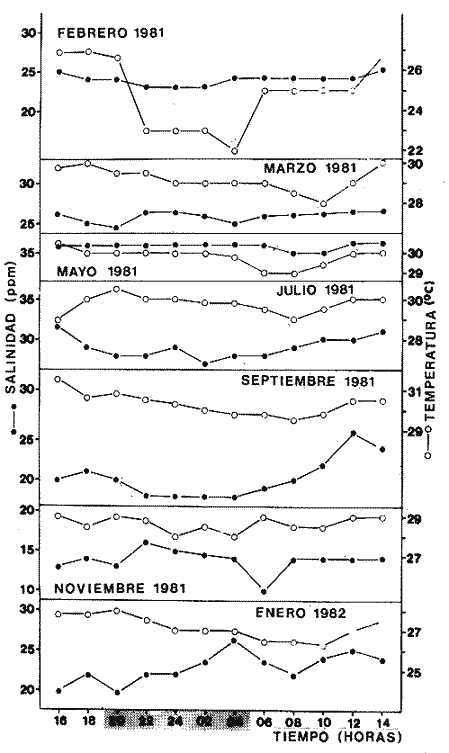 Fig. 2. Variación nictemeral (ciclos de 24 horas) de la temperatura y la salinidad en cada uno de los meses de colecta en Estero Pargo. El patrón estacional de salinidad con el de temperatura se encuentran defazados en dos meses. Las variaciones de los valores de salinidad a traves de un ciclo nictimeral (Fig. 2), tal vez obedezcan a fenómenos meteorológicos y climáticos propios de la época del año en el área. Sin embargo, la variación de la salinidad, a lo largo del año muestra claramente un patrón estacional (Fig. 3) con los valores más elevados en época de secas y bajos en lluvias y nortes. Cuando la salinidad es elevada, los valores de la desviación estándar son pequeños aumentando conforme la salinidad disminuye (Fig. 3). La temperatura, contrariamente a la salinidad, presenta variaciones nictemerales muy marcadas, alcanzando sus valores mínimos al amanecer y máximos en, y, después del medio día de acuerdo a los períodos de oscuridad e insolación respectivamente (Fig. 2). No obstante las variaciones estacionales, de la temperatura, son pequeñas permaneciendo casi constantes a lo largo del año, ya que los valores de la desviación estándar son pequeños. Sin embargo, se observa un patrón estacional con sus valores máximo y mínimo en verano e invierno respectivamente (Fig. 3). CARACTERIZACIÓN DE LAS POBLACIONES Y LA COMUNIDAD DE PECES DE ESTERO PARGO
Parámetros ecológicos estacionales de la comunidadLas tablas 8 a 14, concentran los valores de los parámetros ecológicos analizados, y las figuras 4 a 10 ilustran lo más trascendente de estos parámetros. Los pulsos tienen un patrón muy similar en cada uno de los meses, y ese comportamiento esta influido por algunas especies en particular, las cuales influyen de manera preponderante en el aumento de la diversidad numérica (H'n) y diversidad por peso (H'w).
TABLA 8 TABLA 9 TABLA 10 TABLA 11 TABLA 12 TABLA 13 TABLA 14 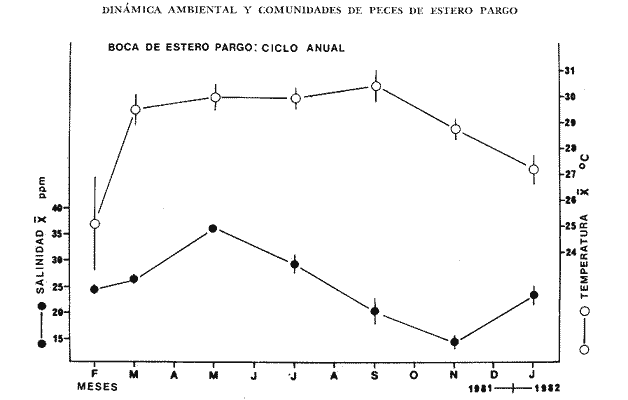 Fig. 3. Variación estaional de la temperatura y la salinidad en Estero Pargo, durante el ciclo anual 1981-1982. Se grafican promedios y desviaciones estándar por mes. Los valores más altos de temperatura se presentan de marzo a septiembre; el valor minimo en febrero . La salinidad es maxima en mayo y minima en noviembre. En términos generales, la biomasa y la talla promedio de la comunidad (g ind-1) van muy relacionados en sus máximos y mínimos, para todos los meses. Sin embargo, existen algunas excepciones como el mes de noviembre (Fig. 8) en la que son inversas, siendo mínima la biomasa, esto se debe a las especies Eucinostomus gula y Anchoa mitchilli mitchilli que dominaron con altos valores numéricos pero presentan baja biomasa. Los índices de diversidad estimados, tienen fluctuaciones estrechas. Cuando sus valores son mínimos, se debe a la presencia de especies dominantes, ya sea por número (disminuye H'n) o por peso (disminuye H'w). Este caso se presentó en todos y cada uno de los meses de muestreo. El caso inverso al ya mencionado, es decir cuando son máximos los valores de H'n y H'w, se presenta cuando las especies están homogeneamente distribuidas por peso y/o número. En cada situación además de incrementarse la diversidad aumenta el componente de equitabilidad (J'). En general la heterogeneidad de especies (H'n), la biomasa (g m-²) y la riqueza de especies (D) mostraron valores máximos en horas oscuras. Sin embargo al hacer una prueba estadística no se encontraron diferencias significativas para horas claras y oscuras en cuanto a los parámetros ya mencionados. La riqueza de especies (D) y la heterogeneidad (H'n) se relacionan directamente en términos generales. El componente que predomina en la diversidad es la distribución por peso y por número dentro de las especies, no así por el número de especies. Este hecho es muy característico en áreas lagunares costeras donde existen altos niveles de dominancia y bajos números de especies. De aquí que la diversidad esté regulada por el componente de equitatividad mas que por la riqueza. Las variaciones espaciales y temporales, de estos componentes determinan variaciones en su importancia relativa (Kricher, 1972). 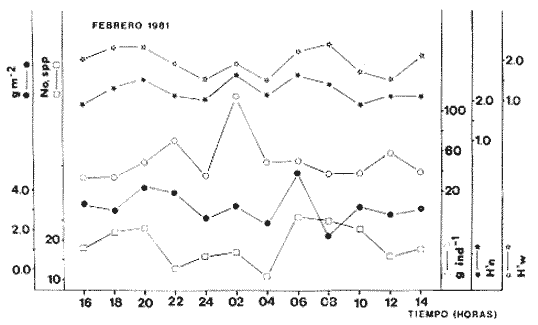 Fig. 4. Variación nictemeral de los parámetros de la comunidad de peces para el mes de febrero de 1981 en Esteri Pargo. Biomesa (g m-2), número de especies (N° spp), talla prom,edio de las poblaciones (g indiv-1), diversidad numérica (H'n)y diversidad en peso. 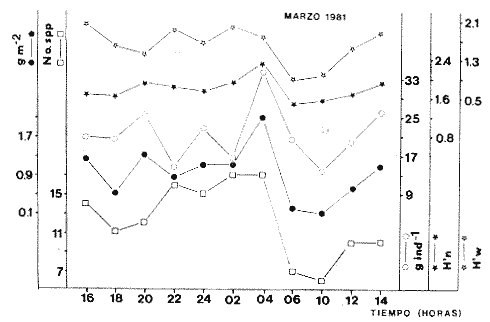 Fig. 5. Variación nictemeral de los párametro de comunidad de pece para el mes de marzo de 1981 en Estero Pargo. Biomesa de las poblaciones (g indiv-1), diversidad numérica (H'n) y diversidad en peso (H'w). 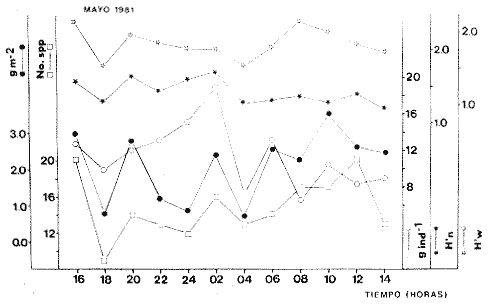 Fig. 6. Variación nictemeral de los parámetros de la comunidad de peces para el mes de mayo de 1981 en Estero Pargo. Biomasa (g m-2), número de especies (N° spp), talla promedio de las poblaciones (g indiv-1), diversidad numérica (H'n) y diversidad en peso (H'w). 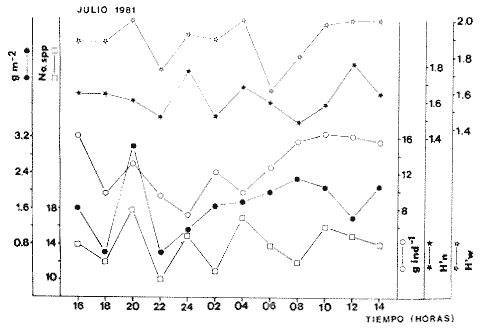 Fig. 7. Variación nictemeral de los parámetros de la comunidad de peces para el mes de julio de 1981 en Estero Pargo. Biomasa (g m-2), número de especies (N° spp), talla promedio de las poblaciones (g indiv-1), diversidad númerica (H'n) y diversidad en peso (H'w). 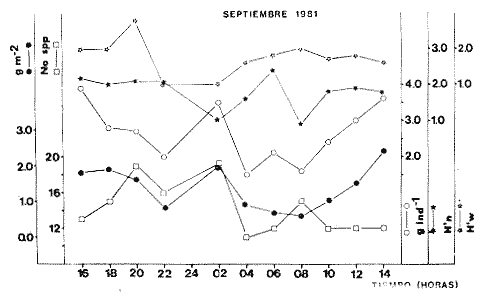 Fig. 8. Variación nictemeral de los parámetros de la comunidad de peces para el mes de septiembre de 1981 en Estero Pargo. Biomasa (g m-2), número de especies (N°spp), talla promedio de las poblaciones (g indiv-1), diversidad numérica (H'n) y diversidad en peso H'w). 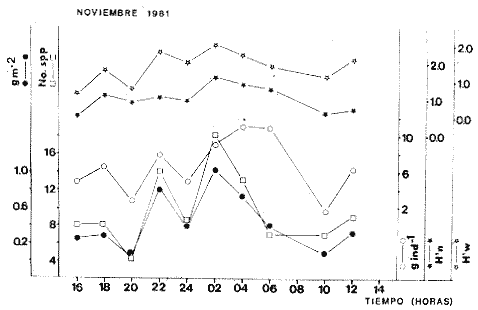 Fig. 9. Variación nictemeral de los parámetros de la comunidad de peces para el mes de noviembre de 1981 en Estero Pargo. Biomasa (g m-2), número de especies (N°spp), talla promedio de las poblaciones (g indiv-1), diversidad numérica (H'n) y diversidad en peso H'w). En relación al ciclo anual para parametros de la comunidad (Fig. 11), la biomasa presenta su máximo en febrero, coincidiendo con el máximo en el número de especies visitantes ocasionales. Sin embargo, este aumento en biomasa está más influenciado por las especies dominantes Opsanus beta y Sphoeroides testudineus, que por la presencia de especies visitantes ocasionales. El número de especies tiene considerables variaciones estacionales (Fig. 11) con un mínimo en el mes de noviembre, que corresponde a la época de nortes. En este mes se presentó la menor similitud con otras épocas climaticas en cuanto a especies. El parecido tan bajo que presenta se debe a un gran porcentaje de especíes visitantes ocasionales (81%). Al finalizar la epoca de nortes y principiar la época seca existe un incremento en el número de especies, esto también sucede en lluvias. 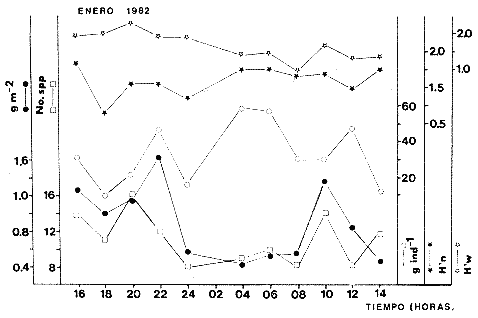 Fig. 10 Variación nictemeral de los parámetros de la comunidad de peces para el mes de enero de 1982 en Estero Pargo. Biomasa (g m-2), número de especies (N° spp), talla promedio de las poblaciones (g indiv-1), diversidad numérica (H'n) y diversidad en peso.  Fig. 11. Variación estacional de los parámetros ecológicos de la comunidad de peces en Estero Pargo durante el ciclo anual 1981-19-82. Biomasa (g m-2), número de especies (N°spp), talla promedio de las poblaciones (g indiv-1), diversidad numérica (H'n) y diversidad en peso H'w. Febrero, 1981. Los valores maximos del índice de heterogeneidad numérica y biomasa fueron de 2.6 y 4.8 g M-2 a las 16: 00 hrs. Los mínimos fueron 1.9 (16:00 hrs.) y 1.7 g m--2 (14:00 hrs.) (Fig. 4). Las especies dominantes numéricamente, y que causan disminución en la diversidad son para este mes: Archosargus rhomboidalis y Eucinostomus gula. Por su biomasa dominaron Opsanus beta y Sphoeroides testudineus (Tabla 8). Marzo 1981. Se presentaron valores maximos de 2.36 (Hn) y 2.14 (g m-2) a Ias 04:00 hrs. Los valores mínimos son de 1.49 (H'n) a las 06: 00 hrs. y de 0. 15 (g m-2) a las 10:00 hrs. (Fig. 5). Las especies dominantes numéricamente fueron Orthopristis chrysopterus y Eucinostomus gula. Por su biomasa dominaron Opsanus beta y Chilomycterus schoepfi (Tabla 9). Mayo 1981. Los valores mínimos de diversidad (H'n) y biomasa (g m-²) fueron de 1.19 (14:00 hrs.) y de 0.68 (04:00 hrs.). Los valores máximos fueron de 1.69 (02:00 hrs.) y de 3.52 (10:00 hrs.) para diversidad y biomasa respectivamente (Fig. 6). Las especies dominantes por su número fueron Orthopristis chrysopterus y Archosargus rhomboidalis. Especies que dominaron por su biomasa para este mes fueron Orthopristis chrvsopterus y Sphoeroides testudineus (Tabla 10). Julio 1981. La diversidad (H'n) tuvo un máximo de 1.81 a las 12:00 hrs. y un mínimo de 1.48 a las 08:00 hrs. La biomasa presentó un maximo de 3.06 g m-2 a las 20:00 hrs. y un mínimo de 0.62 g m-2 a las 18:00 (Fig. 7). Las especies dominantes numéricamente en este mes fueron: Orthopristis chrysopterus y Eucinostomus gula. Por su biomasa dominaron la comunidad Orthopristis chrysopterus y Sphoeroides testudineus (Tabla 11). Septiembre 1981. La diversidad y la biomasa presentaron sus valores máximos a las 06:00 hrs. y 14:00 hrs., con 2.47 y 2.38 g m-² respectivamente. Los valores mínimos para estos dos parámetros son de 0.93 y 0.63 g m-2 a las 08:00 hrs. (Fig. 8). Archosargus rhomboidalis y Orthopristis chrysopterus fueron las especies mejor representadas numéricamente, causando una disminución en el índice de heterogeneidad numérica. Dominaron por su biomasa Archosaiaus rhomboidalis y Sphoeroides testudineus(Tabla 12). Noviembre 1981. Las horas sin luz presentaron los valores más altos de diversidad y biomasa con 1.59 (02:00 hrs.) y 0.81 g m-2 (22:00 hrs.) Los valores mínimos son de 0.53 (16:00 hrs.) para H'n y de 0.36 a m-² (20:00 hrs.) para biomasa (Fig. 9). Dominaron a la comunidad por su abundancia numérica las especies: Eucinostomus gula y Anchoa mitchilli mitchilli. Por su biomasa, Eucinostomus gula y Archosargus rhomboidalis dominaron a la comunidad (Tabla 13). Enero 1982. Este mes presenta los valores mínimos de H'n y biomasa en horas oscuras con 0.78 (18:00 hrs.) y 0.45 g m-² (04:00 hrs.). Los máximos valores registrados para los parámetros ya mencionados fueron de 2.17 (16:00 hrs.) y 1.62 g m-² (22:00 hrs.) (Fig. 10). Para este mes Anchoa mitchilli mitchilli y Eucinostomus gula dominaron por su número. Por su biomasa dominaron Archosargus rhomboidalis Sphoeroides testudineus (Tabla 14). Variación nictemeral de la comunidadFebrero 1981. Se registraron 48 especies de peces. El dendrograma de afinidad entre horas de muestreo (extremo derecho), muestra un grupo A formado por 16 especies (33%), de las cuales Eucinostomus gula, Bairdiella chrysoura, Opsanus beta y Cynoscion nebulosus estan presentes durante todo el ciclo nictemeral, a la vez que son las especies mejor representadas por frecuencia. Las 12 especies restantes se encuentran durante casi todas las horas del día y su frecuencia y abundancia numérica es variable (Fig. 12). La especie más abundante numéricamente fue Archosargus rhomboidalis. Este primer conjunto de especies son consideradas como dominantes por el comportamiento que presentan, sin embargo, tan sólo 11 especies de las 16 agrupadas son consideradas como residentes permanentes. Un grupo B formado por 32 especies contiene aquellas que se comportan como visitantes cíclicos u ocasionales; dentro de las primeras se agrupan 10 de ellas, comenzando con Diapterus rhombeus hasta Anchoa mitchilli mitchilli; en el segundo caso se agrupan desde Lutjanus synagris hasta Aluterus scripta. Dentro de este último conjunto de poblaciones existen aquellas que aparecen sólo durante horas oscuras del día como Arius melanopus, o aquellas que se presentan variablemente de día o de noche. El mayor número de especies se registró a las 06:00 hrs. El dendrograma que muestra la afinidad entre especies (angulo superior izquierdo) no refleja un claro agrupamiento entre horas claras y oscuras. Sin embargo, las horas que se agrupan comparten similar número de especies (Tabla 8). Marzo 1981. Se registraron 33 especies de peces. El dendrograma de afinidad entre horas de muestreo (extremo derecho) muestra un grupo A formado por 7 especies (21%), de las cuales Orthopristis chrysopterus, Eucinostomus gula y Chilomycterus schoepfi estan presentes durante todo el ciclo nictemeral, a la vez que son las especies mejor representadas por frecuencia. La especie más abundante numéricamente fue Orthopristis chysopterus. Las 4 especies restantes se encuentran durante casi todas las horas del día, y su frecuencia y abundancia numérica es variable (Fig. 13). Este primer conjunto de especies son dominantes por el comportamiento que presentan, y consideradas como residentes permanentes de la localidad en este mes. Un grupo B formado por 20 especies comprende aquéllas que se comportan como visitantes ocasionales, comenzando con Cynoscion nebulosus hasta Anchoa mitchilli mitchilli. Dentro de este extenso grupo de poblaciones se denota que la mayoría de ellas presenta un comportamiento preferentemente nocturno entre las 20:00 y las 04:00 hrs. Otras especies se presentan variablemente de día o de noche y definen un grupo comprendido entre Sphoeroides testudineus y Opsanus beta, considerandoseles como visitantes cíclicos por su frecuencia y abundancia numérica. El dendrograma que muestra la afinidad entre especies (ángulo superior izquierdo), no refleja un claro agrupamiento entre horas claras y oscuras. Sin embargo, las horas que se agrupan comparten similar número de especies (Tabla 9). 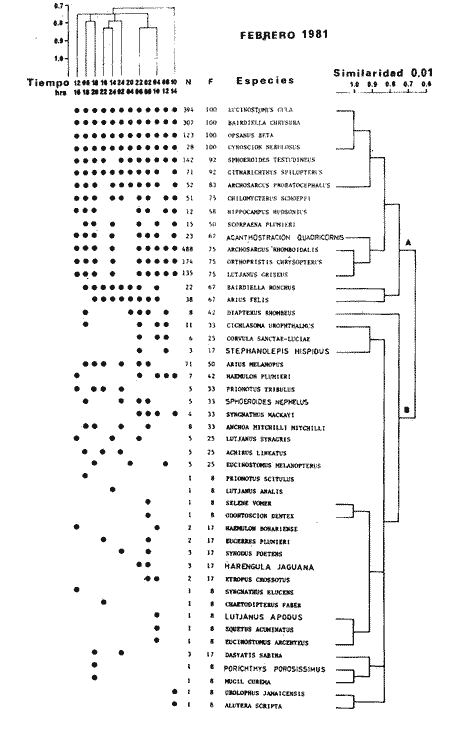 Fig. 12. Dendrogramas de similaridad ecológica en el mes de febrero de 1981 en Estero Pargo. El dendrograma superior izquierdo muestra la agrupación de estaciones, en un ciclo de 24 horas, por afinidad de especies de peces. El dendrograma en la mayor muestra los grupos de especies de peces afines ecológicamente. El proceso de ambos análisis se basa en la presencia/ausencia de las especies. Los puntos negros repesentan la distribución en el ciclo de 24 horas y se indica además la abundancia numérica (N) y su frecuencia (F). Los Grupos A y B son explicados en el texto. 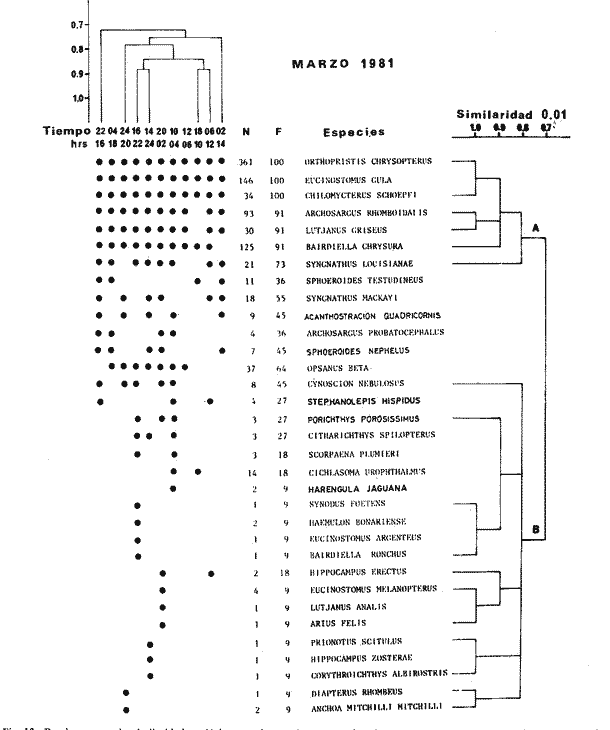 Fig. 13. dendrogramas dde similaridad ecólofica en el mes de marzo de 1981 en Estero Pargo. El dendrograma superior izquierdo muestra la agrupación de estaciones, en un ciclo de 24 horas, por la afinidad de especies de peces. El dendrograma mayor muesta los grupos de especies de peces afines ecológicamente. El proceso en ambos annálisis se basa en la presencia/ausencia de las especies. Los puntos negros representan la distribución en el ciclo de 24 horas y se indica además la abundancia numérica (N) de las especies y su frecuencia (F). Los Grupós A y B son explicados en el texto. Mayo 1981. Se registraron 31 especies de peces. El dendrograma de afinidad entre horas de muestreo (extremo derecho) muestra un grupo A formado por 7 especies (21%), de las cuales Orthopristis chrysopterus, Archosargus rhomboidalis, Bairdiella chrysoura, Eucinostomus gula, Lutjanus griseus y Sphoeroides testudineus están presentes durante todo el ciclo nictemeral, a la vez que son las especies mejor representadas por frecuencia. La especie más abundante numéricamente fue Orthopristis chrysopterus. La única especie restante, Opsanus beta, se encuentra durante casi todas las horas del día con una frecuencia alta (Fig. 14). Este primer grupo, lo constituyen especies dominantes por el comportamiento que presentan y son consideradas como residentes permanentes de la localidad en este mes. Un grupo B formado por 3 especies, Hippocampus erectus, Sygnathus scovelli y Aluterus scripta se presentan sólo en la noche, y por su frecuencia son consideradas como visitantes ocasionales. El resto de las especies, 21 (64%), contiene aquéllas que se comportan como visitantes cíclicos u ocasionales; dentro de las primeras se agrupan 12 de ellas comenzando con Chilomycterus schoepfi hasta Stephanolepis hispidus incluyéndose también a Acanthostracion quadricornis y Haemulon plumieri. En el segundo caso se agrupan desde Diapterus rhombeus hasta Aluterus scripta. Dentro de este último conjunto de poblaciones predominan las especies que se presentan variablemente de día o de noche, registrándose a Corvula sanctae-luciae como especie capturada sólo durante la noche. El dendrograma que muestra afinidad entre especies (angulo superior izquierdo) no refleja un claro agrupamiento entre horas claras y oscuras. Sin embargo, las horas que se agrupan comparten similar número de especies (Tabla 10). Julio 1981. Se registraron 34 especies de peces. El dendrograma de afinidad entre horas de muestreo (extremo derecho) muestra un grupo A formado por 9 especies (26%), de las cuales, Orthopristis chrysopterus, Archosargus rhomboidalis, Sphoeroides testudineus, Eucinostomus gula y Bairdiella chrysoura están presentes durante todo el ciclo nictemeral, a la vez que son las especies mejor representadas por frecuencia. La especie más abundante numéricamente fue Orthopristis chrysopterus. Las 4 especies restantes se encuentran durante casi todas las horas del día, y su frecuencia y abundancia numérica es variable (Fig. 15). Este primer conjunto de especies son dominantes, consideradas por tanto como residentes permanentes de la localidad en este mes. Un grupo B formado por 14 especies contiene aquellas que se comportan como visitantes ocasionales, dentro de éstas se agrupan desde Chaetodipterus faber hasta Lutjanus synagris. Dentro de este conjunto de poblaciones existen aquellas que se presentan de día o de noche; comprendiéndose en las primeras a Haemulon bonariense, Hippocampus hudsonius, Sphoeroides spengleri, Synodus foetens y Lutjanus synagris, las restantes se presentan sólo de noche. Otras especies se comportan como visitantes cíclicos, dentro de éstas se agrupan 8 de ellas comenzando con Chilomycterus schoepfi hasta Lutjanus synagris, incluyéndose también a Achirus lineatus y Syngnathus louisianae, las cuales se presentan variablemente de día o de noche. El dendrograma que muestra la afinidad entre especies (ángulo superior izquierdo) no refleja un claro agrupamiento entre horas claras y oscuras. Sin embargo las horas que se agrupan comparten similar número de especies (Tabla 11). Septiembre 1981. Se registraron 37 especies de peces. El dendrograma de afinidad entre horas de muestreo (extremo derecho), muestra un grupo A formado por 9 especies (260%), de las cuales, Arius felis, Orthopristis chrysopterus, Archosargus rhomboidalis, Eucinostomus gula, Bairdiella chrysoura y Syngnathus louisianae, están presentes durante todo el ciclo nictemeral, a la vez que son las especies mejor representadas por frecuencia. La especie más abundante numéricamente fue Archosargus rhomboidalis. Las 3 especies restantes se encuentran durante casi todas las horas del día, y su frecuencia y abundancia numérica es variable (Fig. 16). Este primer conjunto de especies son dominantes, consideradas por tanto como residentes permanentes de la localidad en este mes. Un grupo B formado por 23 especies comprende aquéllas que se comportan como visitantes ocasionales, comenzando con Haemulon aurolineatum hasta Hippocampus zosterae. Dentro de este extenso grupo de poblaciones se denota que la mayoría de ellas presenta un comportamiento preferentemente nocturno entre las 20:00 y las 04:00 hrs. Sin embargo, existen especies que sólo aparecen de día como Anchoa mitchilli mitchilli, Caranx hippos, Anchoa lamprotaenia, Haemulon plumieri, Chaetodon ocellatus, Hippocampus zosterae, Prionotus carolinus, Sphoeroides nephelus y Syngnathus scovellí. Otras especies se presentan variablemente de día o de noche y están comprendidas entre Chilomycterus schoepfi y Corvula sanctae-luciae, considerándoseles como visitantes cíclicos por su frecuencia y abundancia numérica. El dendrograma que muestra la afinidad entre especies (ángulo superior izquierdo) no refleja un claro agrupamiento entre horas claras y oscuras. Sin embargo, las horas que, se agrupan comparten similar número de especies (Tabla 12). 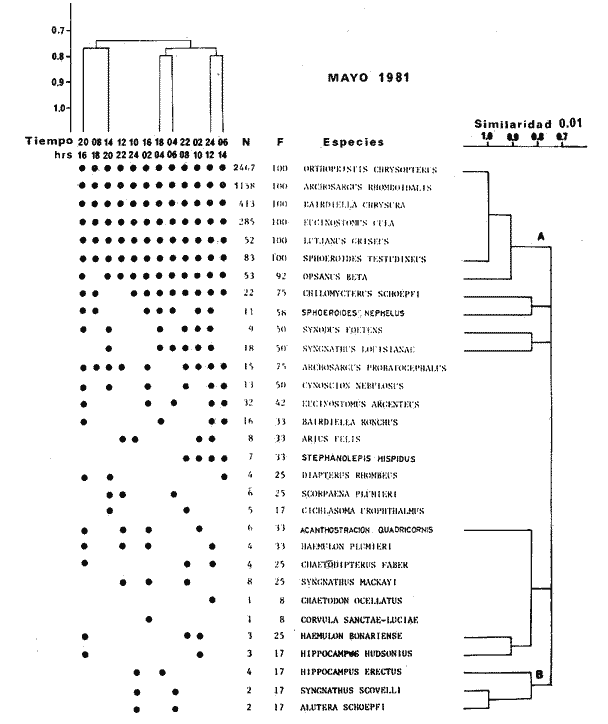 Fig. 14. Dendrograma de similaridad ecológica en el mes de mayo de 1981 en Estero PargoEl dendrograma superior izquierdo muestra la agrupación de estaciones, en un ciclo de 24 horas, por afinidad de especies de peces. El dendrograma mayor muestra los grupos de especies de peces afines ecológicamente. El proceso en ambos análisis se basa en lapresencia/ausencia de las especies. Los puntos negros representan la distribución en el ciclo de 24 horas y se indica además la abundancia numérica (N) y su frecuencia (F). Los Grupos A y B son explicados en el texto. 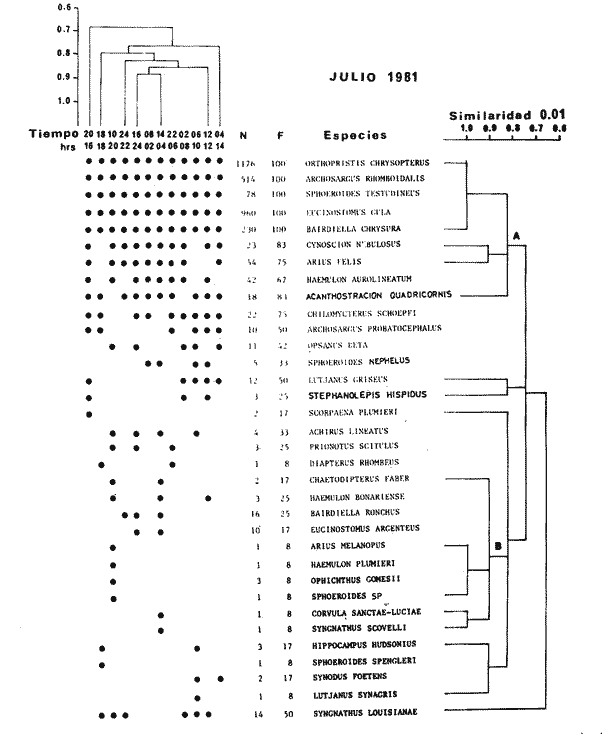 Fig. 15. Dendrogramas de similaridad ecológica en el mes de julio de 1981 en Estero Pargo. El dendrograma superior izquierdo muestra la agrupación de estaciones en un ciclo de 24 horas por la afinidad de especies de peces. El dendrograma mayor muestra los grupos de especies de peces afines ecológicamente. El proceso de ambos análisis se basa en la presencia/ausencia de las especies. Los puntos negros representan la distribución en el ciclo de 24 horas y se indica además la abundancia numérica (N) y su frecuencia (F). Los Grupos A y B son explicados en el texto.numérica (N) y su frecuencia (F). Los Grupos A y B son explicados en el texto. Noviembre 1981. Se registraron 36 especies de peces. El dendrograma de afinidad entre horas de muestreo (extremo derecho) muestra un grupo A formado por 2 especies (6%), Eucinostomus gula y Diapterus rhombeus, las cuales están presentes durante todo el ciclo nictemeral, a la vez que son las especies mejor representadas por frecuencia. La especie más abundante numéricamente fue Eucinostomus gula (Fig. 17). Este primer par de especies son dominantes, consideradas por tanto como residentes permanentes de la localidad en este mes. Otras especies se presentan variablemente de día o de noche y definen un grupo comprendido entre Archosargus rhomboidalis y Bairdiella chrysoura inclusive, considerándoseles como visitantes cíclicos por su frecuencia y abundancia numérica. Se distingue también otro grupo formado por 29 especies, comprendiendo aquellas que se comportan como visitantes ocasionales, comenzando con Anchoa hepsetus hasta Sphoeroides nephelus. Dentro de este extenso grupo de poblaciones se observa que la mayoría de ellas presenta un comportamiento preferentemente nocturno entre las 20:00 y las 04:00 hrs. Sin embargo, existen especies que sólo aparecen de día como Chloroscombrus chrysurus, Anchoa lamprotaenia. Caranx hippos, Syngnathus mackayi, Oligoplites saurus, Harengula jaguana y Sphoeroides nephelus. El dendrograma que muestra la afinidad entre especies (ángulo superior izquierdo) denota un claro agrupamiento de horas claras y oscuras reflejándose esto en el dendrograma por horas, en el que se agrupan claramente los tres tipos de especies descritas en párrafos anteriores (Tabla 13). Enero 1982. Se registraron 33 especies de peces. El dendrograma de afinidad entre horas de muestreo (extremo derecho) muestra que tan sólo una especie, Eucinostomus gula está presente durante todo el ciclo nictemeral, a la vez que es la especie mejor representada por frecuencia, es dominante y por tanto considerada como residente permanente en este mes (Fig18). Otras especies se encuentran durante casi todas las horas del día y definen un grupo comprendido entre Anchoa mitchilli mitchilli y Sphoeroides testudineus, pueden considerarse también como especies dominantes y residentes permanentes en este mes por su alta frecuencia. Las 28 especies restantes comprenden aquéllas que se comportan como visitantes cíclicos u ocasionales; dentro de las primeras pueden agruparse 8 especies comenzando con Archosargus rhomboidalis hasta Opsanus beta, incluyéndose también a Arius melanopus, Diapterus rhombeus, Lutjanus griseus, Acanthostracion quadricornis y Chaetodipterus faber. En el segundo caso pueden agruparse las 20 especies restantes. Dentro de este último y extenso grupo de poblaciones existen aquellas especies que aparecen variablemente de día o de noche, registrándose a Arius melanopus, Trichiurus lepturus, Cetengraulis edentulus y Symphurus civitatus como especies nocturnas. Sin embargo, existen especies que sólo aparecen de día como Orthopristis chrysopterus, Etropus crossotus, Hypsoblenius hentz, Syngnathus louisianae, Eucinostomus melanopterus, Anchoa lamprotaenia, Achirus lineatus, Eucinostomus argenteus, Chloroscombrus chrysurus y Dasyatis sabina. El dendrograma que muestra la afinidad entre especies (ángulo superior izquierdo), no refleja un claro agrupamiento entre horas claras y oscuras. Sin embargo, las horas que se agrupan comparten similar número de especies (Tabla 14). 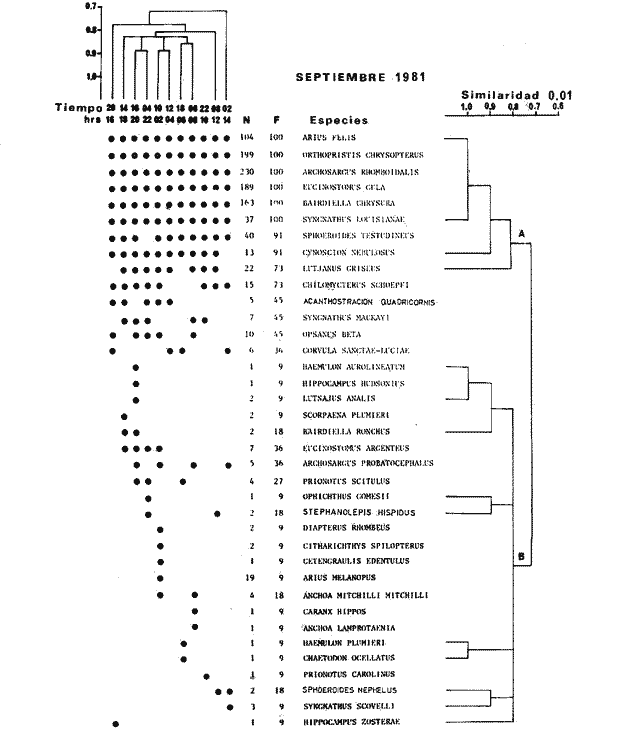 Fig. 16. Dendrogramas de similaridad ecológica en el mes de septiembre de 1981 en Estero Pargo.Fig. 16. Dendrogramas de similaridad ecológica en el mes de septiembre de 1981 en Estero Pargo. en un ciclo de 24 horas, por afinidad de especies. El proceso en ambos análisis se basa en la presencia/ausencia de las especies. Los puntos negros representan la distribución en los ciclos de 24 horas y se indica además la abundancia numérica (N) y su frecuencia (F). Los Grupos A y B son explicados en el texto. 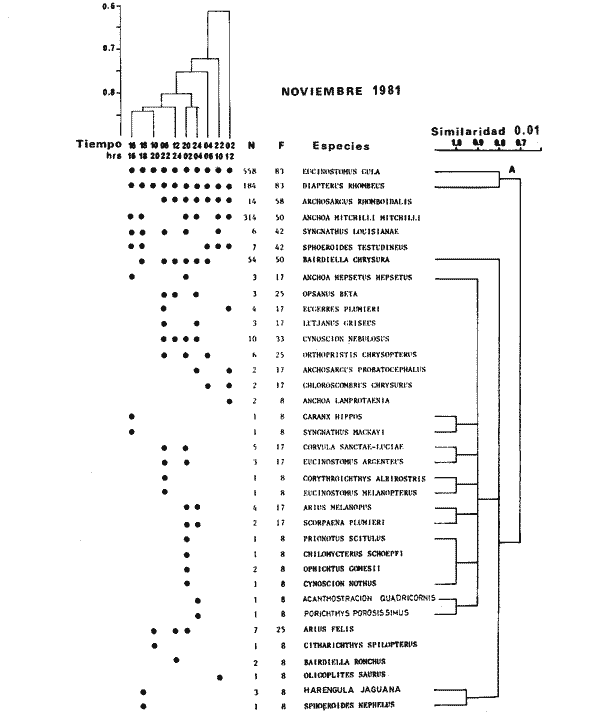 Fig. 17. Dendrogramas de similaridad ecológica en el mes de noviembre de 1981 en Estero Pargo.El dendrograma superior izquierdo muestra la agrupación de estaciones, en un ciclo de 24 horas, por la afinidad de especies de peces. El dendograma mayor muestra los grupos de especies de peces afines ecológicamente. El proceso en ambos análisis se basa en la aparencia/ausencia de la especie. Los puntos negros representan la distribución en los ciclos de 24 horas y se indica además la abundancia númerica (N) y su frecuencia (F). Los grupos A y B son explicados en el texto. 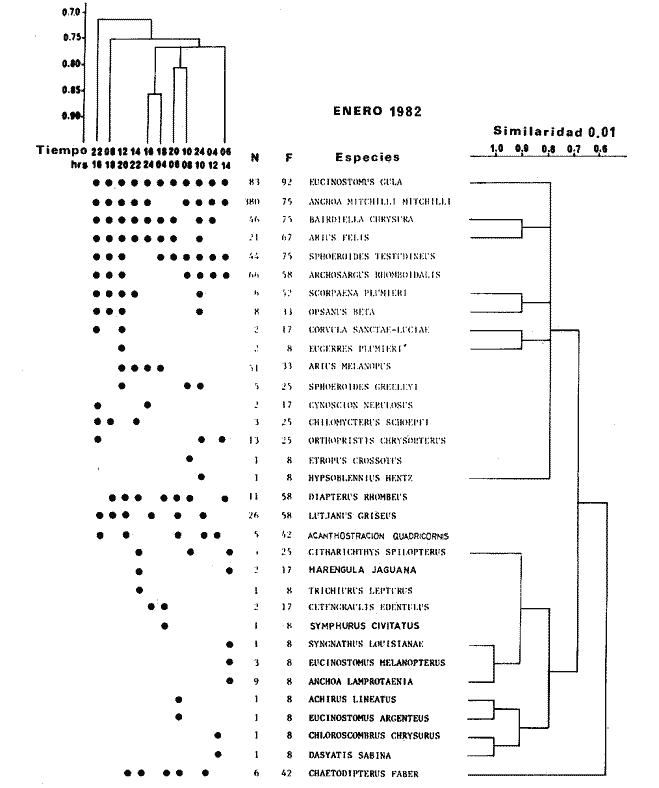 Fig. 18. dendrograma de similaridad ecológicas en el mes de enero de 1982 en Estero Pargo. El dendrograma superior izquierdo muestra la agrupación de estaciones, en el ciclo de 24 horas, opr la afinidad de especies de peces. El dendrograma mayor muestra los grupos de especies de peces afines ecológicamente El proceso en ambos análisis se basa en la presencia/ausencia de las especies. Los puntos negros representan la distribución en el ciclo de 24 horas y se indica a de más la abundancia numérica (N) y su frecuencia (F) No se registraron grupos distintivos de especies que indiquen un patrón diferente para horas diurnas y nocturnas en los dendroggramas que agrupan horas (ángulo superior izquierdo de las Figs. 12 a 18). Sin embargo, una excepción la constituye el mes de noviembre, en el cual se agrupan distintivamente las horas oscuras (Fig. 17). En este mes del total de las especies un gran porcentaje (83%) se registró de noche. En relación a los dendrogramas que agrupan a las especies según las horas a las que aparecen (Figs. 12 a 18), existen dos comportamientos en las especies; aquéllas que están presentes durante todo un ciclo nictemeral con alta frecuencia y abundancia numérica (ver grupos superiores de dendrogramas por especie de las Figs. 12 a 18). Por otro lado existen especies que aparecen indistintamente a cualquier hora del día o de la noche. Las especies que se registraron durante todo un ciclo nictemeral difieren de una época climática del año a otra y su comportamiento estacional es el siguiente: Durante la época de nortes, Diapterus rhombeus aparece en noviembre y enero (Figs. 17 y 18). En la época de secas aparecen Bairdiella chrysoura, Opsanus beta, Cynoscion nebulosus, Orthopristis chrysopterus, Chilomycterus schoepfi, Diapterus rhombeus Lutjanus griseus y Sphoeroides testudineus (Figs. 12, 13 y 14). Asimismo, en la época de lluvias se registran, Bairdiella chrysoura, Orthopristis chrysopterus, Sphoeroides testudineus, Archosargus rhomboidalis, Arius felis y Syngnathus louisianae (Figs. 15 y 16). La única especie que se presentó durante un ciclo nictemeral completo en todos y cada uno de los meses muestreados fue Eucinostomus gula. Existen casos particulares de especies registradas exclusivamente de noche como sucede con Porichthys porosissimum para los meses de febrero, marzo y noviembre (Figs. 12, 13 y 17). De la misma manera, Lutjanus analis sólo se registra en febrero, marzo y septiembre (Figs. 12, 13 y 16). Otra especie más, que se comporta de manera particular es Arius melanopus cuyos reportes fueron preferentemente de noche en los meses de enero, febrero, julio, septiembre y noviembre (Figs. 12 a 18), sin embargo aparece también de día en febrero (Fig. 12). Comunidades de peces de Estero PargoEspecies dominantes. Se capturaron un total de 14 266 ejemplares de 70 especies, de éstas, 14 (l9%) fueron dominantes en frecuencia, constituyendo el 94%, de la captura numérica y el 91 % de la captura total en peso (Tabla. 15). Además de este registro de especies dominantes, existen especies importantes, ya sea por frecuencia, número o peso, éstas son: Citharichthvs spilopterus, Acanthostracion quadricornis, Hippocampus hudsonius, Haemulon plumieri, Haemulon bonariense, Bairdiella ronchus, Scorpaena plumieri, Sphoeroides nephelus, Prionotus scitulus, Eucinostomus melanopterus, Chaetodipterus faber, Svnodus foetens, Corvula sanctae-luciae, Stephanolepis hispidus, Harengula jaguana Syngnathus mackayi, Eucinostomus argenteus y Syngnathus louisianae. Algunas de las 14 especies dominantes capturadas presentan una programación estacional y en otras no son tan evidentes sus variaciones a lo largo del año (Figs. 19 a 32). Entre las especies que presentaron un patrón estacional se encuentran: Anchoa mitchilli mitchilli (Fig. 19) y Arius melanopus (Fig. 20), las cuales no fueron capturadas al final del período de secas e inicio del período de lluvias, cuando los valores de salinidad son elevados; sin embargo, en esta misma época especies tales como: Eucinostomus gula (Fig. 24), Orthopristis chrysopterus (Fig. 26) y Archosargus rhomboidalis (Fig. 27) presentaron sus máximos valores tanto en biomasa como en densidad. Durante el período de nortes, cuando la salinidad presenta sus valores más bajos, especies como Archosargus probatocephalus (Fig. 28) no fue capturado en enero o bien se encuentran escasamente representadas como Opsanus beta (Fig. 22), Lutjanus griseus (Fig. 23), Orthopristis chrysopterus (Fig. 26), Archosargus rhomboidalis (Fig. 27) y Chilomycterus schoepfi (Fig. 32); existen especies que en esta misma época del año presentan sus valores máximos de densidad y biomasa tales como Anchoa mitchilli mitchilli (Fig. 19), Arius melanopus (Fig. 20) y Diapterus rhombeus(Fig. 25). 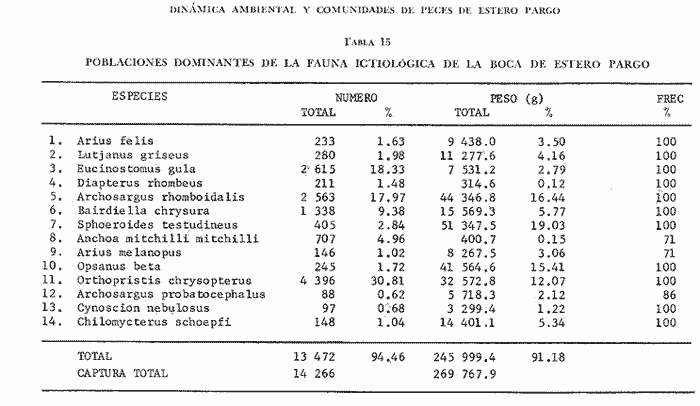 TABLA 15 POBLACIONES DOMINANTES DE LA FAUNA ICTIOLÓGICA DE LA BOCA DE ESTERO PARGO Durante el periodo de secas Lutjanus griseus (Fig. 23), Archosargus pro bato cephalus (Fig. 28) y Chilomycterus schoepfi (Fig. 22) presentaron sus máximos valores de biomasa y densidad y durante el periodo de lluvias Arius melanopus (Fig. 20) y Eucinostomus gula (Fig. 24). Tres especies, se presentan a lo largo del año sin grandes variaciones tales como Cynoscion nebulosus (Fig. 29), Bairdiella chysoura (Fig. 30) y Sphoeroides testudineus (Fig. 21). Es importante destacar, que esta zona funciona como una área de reproducción, alimentación, protección y/o crianza para algunas especies. Entre las especies que a lo largo del año presentaron pocas variaciones de talla y se registraron en estado adulto, se encuentran: Arius melanopus, Opsanus beta, Lutjanus griseus Archosargus probatocephalus y Sphoeroides testudineus, que en general, utilizan la zona como área de alimentación. Especies que se capturaron como, juveniles tales como Anchoa mitchilli mitcilli, Eucinostomus gula, Diapterus rhombeus, Orthopristis chrysopterus y Bairdiella chrysoura que utilizan el área como zona de protección y crianza. Especies que se capturaron tanto en estado adulto como en estado juvenil son: Arius felis, Archosargus rhomboidalis, Cynoscion nebulosus y Chilomycterus schoepfi, las cuales utilizan esta zona como área de reproducción y/o crianza. Estructura de la comunidadLa figura 33 muestra la distribución de los componentes comunitarios y categorías ictiotróficas. En las Tablas 8 a 14 se detalla el tipo de componente al que pertenece cada una de las especies registradas en el área de estudio. Una misma especie se puede comportar de diferente manera en los diferentes meses del año en cuanto a tipo de componente. En términos generales durante el ciclo anual predominaron los visitantes ocasionales (57%) y los consumidores de segundo orden (46%). Las categorías ictiotróficas y componentes comunitarios restantes se comportaron como sigue: consumidores de primer orden (18%), consumidores de tercer orden (36%), visitantes cíclicos (23%) y por último especies sedentarias (20%). 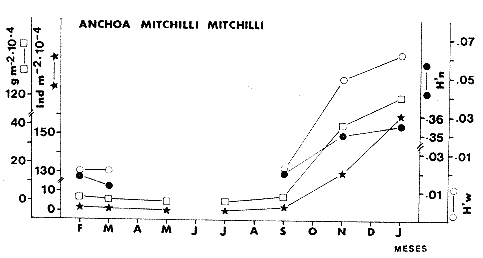 Fig. 19. Variación estacional de los parámetros ecológicos de Anchoa mitchilli mitchilli en Estero Pargo durante el ciclo anual 1981-1982. Biomasa (g m-2), densidad (indiv m-2), diversidad numérica (H'n) y diversidad en peso (H'n). 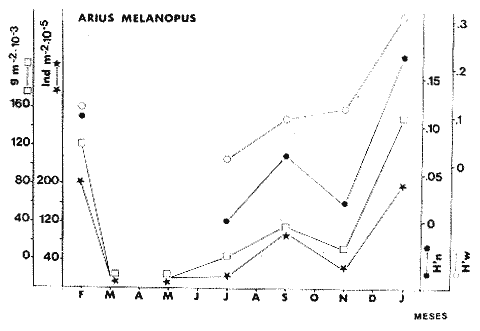 Fig. 20. Variación estacional de los parámetros ecológicos de Arius melanopus en Estero Pargo durante el ciclo anual 1981-1982. Biomasa (g m-2), densidad (indiv m-2), diversidad númerica (H'n) y diversidad en peso (H'n). 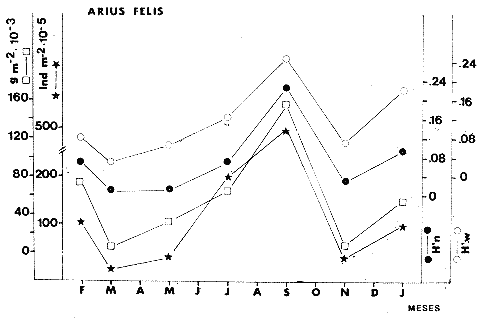 Fig. 21. Variación estacional de los parámetros ecológicos de Arius felis en Estero Pargo durante el ciclo anual 1981-1982. Biomasa (g m-2), densidad (indiv m-2, densidad númerica (H'n) y (H'w). 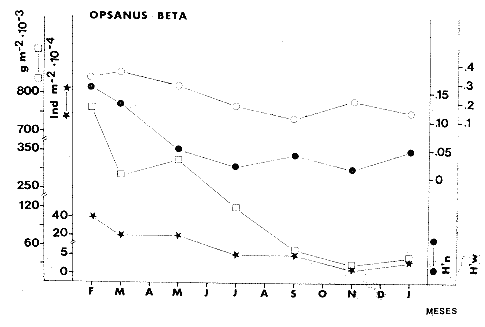 Fig. 22. Variación estacional de los parámetros ecológicos de Opsanus beta en Estero Pargo durante el ciclo anual 1981.1982. Biomasa (g m-2), densidad (indiv m-2), diversidad nrmérica (H'n) y diversidad en peso (H'n). 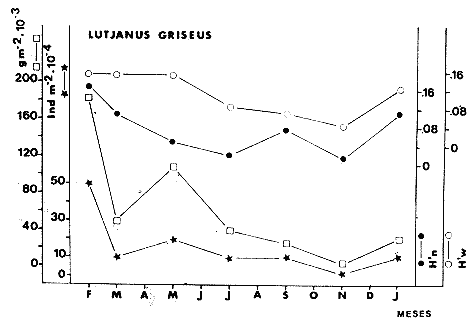 Fig. 23. Variación estacional de los párametros ecólogicos de Lutjanus griseus en Estero Pargo durante el ciclo anual 1981-1982. Biomasa (g m-2), densidad (ind m-2), diversidad númerica (H'n) y diversidad en peso (H'n). 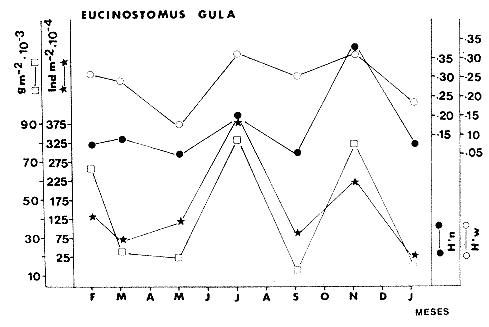 Fig. 24. Variación estacional de los parámetros ecológicos de Eucinostomus gula en Estero Pargo durante el ciclo anual 1981-1982. Biomasa (g m-2), densidad (ind m-2), diversidad numérica (H'n) y diversidad en peso (H'n). 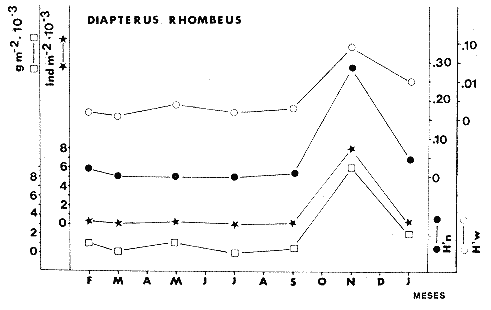 Fig. 25. Variación estacional de los parámetros ecológicos de Diapterus rhombeus en Estero Pargo durante el ciclo anual 1981-1982. Biomasa (g m-2), densidad (indiv m-2), diversidad numérica (H'n) y diversidad en peso (H'n). 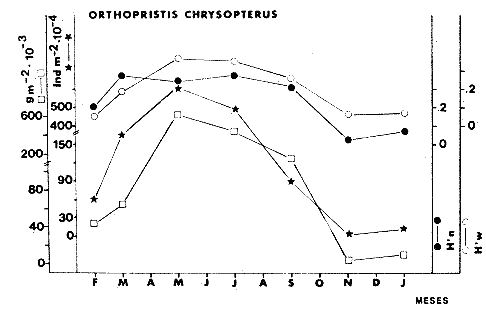 Fig. 26. Variación estacional de los parámetros ecológicos de Orthopristis chrysopterus en Estero Pargo durante el ciclo anual 1981-1982. Biomasa (g m-2), densidad (indiv m-2), diversidad numérica (H'n) y diversidad en peso (H'w). 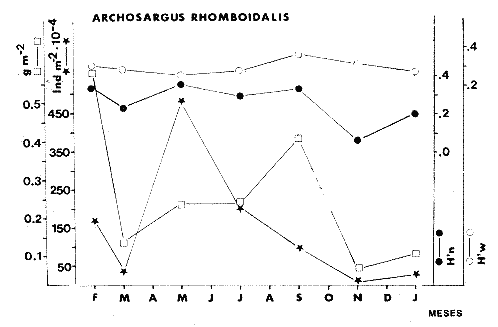 Fig. 27. Variación estacional de los parámetros ecológicos de Archosargus rhoniboidalis en Estero Pargo durante el ciclo anual 1981-1982. Biomasa (g m-2), densidad (indiv m-2), diversidad numérica (H'n) y diversidad en peso (H'w). 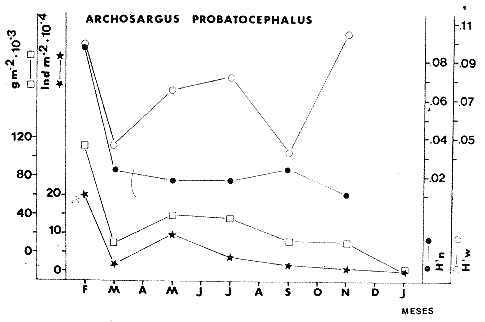 Fig. 28. Variación estacional de los parámetros ecológicos de Archosargus probatocephalus en Estero Pargo durante el ciclo anual 1981-1982. Biomasa (g m-2), densidad (indiv m-2), diversidad numérica (H'n) y diversidad en peso (H'w). 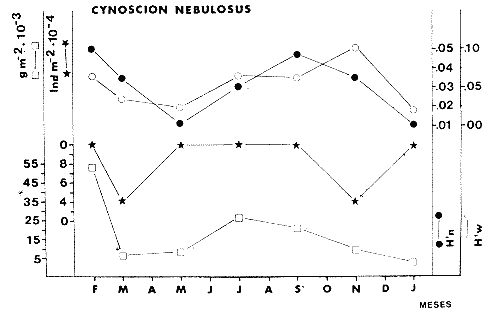 Fig. 29. Variación estacional de los parámetros ecológicos de Cynosción nebulosus en Estero Pargo durante el ciclo anual 19811982. Biomasa (g m-2), densidad (indiv m-2), diversidad numérica (H'n) y diversidad en peso (H'w) 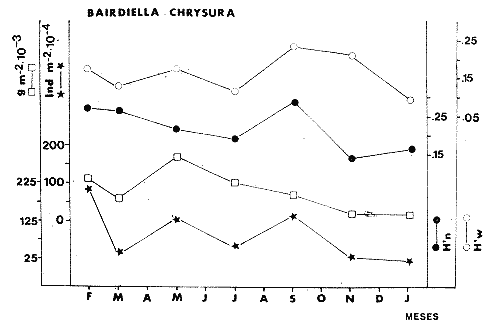 Fig. 30. Variación estacional de los parámetros escológicos de Bairdiella chrysoura en Estero Pardo durante el ciclo anual 19811982. Biomasa (g m-2), densidad (indiv m-2), diversidad numérica (H'n) y diversidad en peso (H'w). 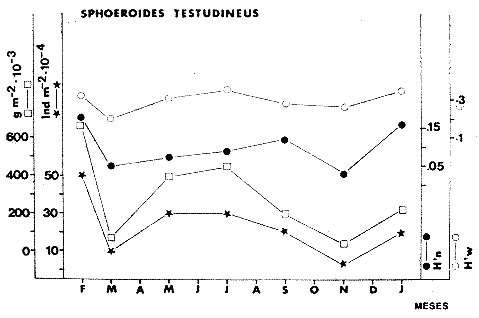 Fig. 31. Variación estacional de los parámetros ecológicos de Sphoeroides testudineus en Estero Pargo durante el ciclo anual 1981-1982. Biomasa (g m-2), densidad (indiv m-2) diversidad númerica (H'n) y diversidad en peso (H'w). 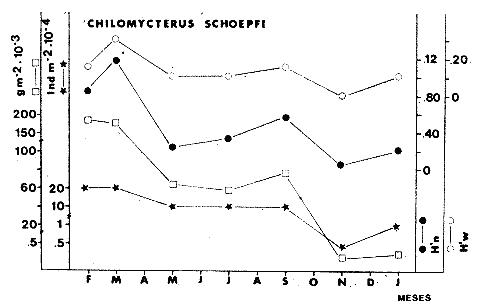 Fig. 32. Variación estacional de los parámetros ecológicos de Chiloniycterus schoepfi en Estero Pardo durante el ciclo anual 1981-1982. Biomasa (g m-2), densidad (indiv m-2), diversidad númerica (H'n) y diversidad en peso (H'w). En relación a las fluctuaciones de los componentes comunitarios y categorías ictiotróficas a lo largo del año, se encontró que sus abundancias numéricas tienen una relación muy significativa con la época del aflo (p = 0,05). De aquí que se pueda pensar que la época del año influye en la distribución de componentes de la comunidad, y por ende influye en la composición de especies. Este aspecto se vio reforzado al realizar un "cluster" por presencia/aunsencia de espicies. Para realizarlo se concidero toda la lista de especies de la localidad en el ciclo anual. Según lo resultados obtenidos por este "cluster", estacionalmente hay un cambio gradual en la composición de espesies, formándose un ciclo anul cerrado. Las épocas más parecidas entre sí son lluvias y secas; la época de nortes tiene más especies diferentes con respecto a las dos mencionadas, ya que se agrupa a niveles de similitud menores. Sin embargo, es más parecida (nortes) a la época de lluvias. Las agrupaciones tuvieron el siguiente orden: disminuye la similitud —> lluvias + secas lluvias + secas + nortes lluvias + secas + nortes + lluvias cerrándose al ciclo anual en la época de lluvias. Es importante mencionar que hay especies clave que se registran esporádicamente, un ejemplo muy claro es Cich1asoma urophthalmus (especie dominante) que sólo se registró en el ciclo anual 1976-1977 (Vargas Maldonado et al. 1981). Los visitantes ocasionales fueron numéricamente mayores que los visitantes cíclicos y las especies sedentarias (considerando el ciclo anual en su totalidad). Esta diferencia fue significativa (p = 0.01). Los visitantes ocasionales tuvieron dos máximos en su número, uno en el mes de febrero, el otro en noviembre (Fig. 33). Un mínimo en los tres componentes comunitarios se registró en el mes de mayo. Los valores máximos y mínimos, estás relacionados en algunos casos con los parámetros ambientales. Se encontró una correlación inversa entre la salinidad y la abundancia numérica de visitantes ocasionales (en el ciclo anual). Hay ejemplos claros de esto: en noviembre los visitantes ocasionales son máximos numéricamente y la salinidad es mínima. En mayo el número de visitantes ocasionales es mínimo y la salinidad es alta. Los visitantes cíclicos y residentes permanentes varían de un mes a otro ya que unas especies van sucediendo a otras, por esto la mayor parte de la comunidad es fluctuante. Sin embargo, existe un grupo de especies que se registraron todos (o bien casi todos) los meses del año. Estas especies se caracterizaron como dominantes (Tabla 15). 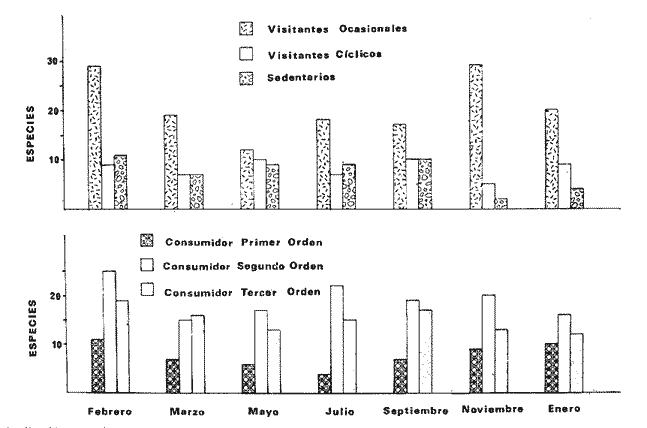 Fig. 33. Distribución estacional de los componentes comunitarios y categorías ictiotróficas de las comunidades de peces en Estero Pargo durante el ciclo anual 1981.1982. La presencia de especies dominantes en aguas estuarinas tiene antecedentes en múltiples estudios, entre ellos están: Dahlberg y Odum (1970); Turner y Johnson (1973); Yáñez-Arancibia (1978, 1981b) Weinstein y Heck (1979) y Yáfiez-Arancibia et al. (1980a). En algunos trabajos la distribución espacial y temporal de las especies se ha relacionado con efectos de salinidad (Gunter, 1961; Gunter et al., 1964). Otros autores no diciernen un patrón claro en cuanto a esta relación (Weinstein y Heck, 1979). Como ya se mencionó, en este trabajo sí existe relación entre distribución espacial de especies y salinidad. A pesar de las evidencias existentes, es difícil hablar de la salinidad como un agente causal de la distribución y abundancia de peces (Livingston, 1975). En relación al factor temperatura, en el presente estudio se detectó una correlación inversa entre este factor y la abundancia numérica de las especies visitantes cíclicas. Ogren y Brusher (1977) sugieren que los movimientos y migraciones de peces están relacionados con la profundidad y la temperatura. Según los autores mencionados para especies migratorias y algunos residentes marinos, la respuesta a la disminución de temperatura en otoño e invierno conduce a una migración hacia el mar de especies como Arius felis, Chloroscombrus chrysurus, Eucinostomus gula, Orthopristis chrysopterus y Bairdiella chrysoura. Sin embargo, en el presente estudio al disminuir la temperatura aumenta la abundancia de especies visitantes cíclicas. Conclusiones1. La salinidad no presenta un pulso nictemeral (24 hrs.) marcado como reflejo de la estabilidad del ambiente, pero es evidente un pulso estacional con los valores más bajos en noviembre (13.79 ppm) y los más altos en mayo (35.83 ppm). La temperatura sí presenta un pulso de 24-hrs notable, pero es evidente una estabilidad térmica de las aguas a lo largo del año con los valores más altos en septiembre (30.30°C) y los más bajos en febrero (24.87°C). Una elevada transparencia anual (80% promedio) y la presencia de pastos marinos, Thalassia testudinum, son también el reflejo de un subsistema ecológicamente estable pero frágil al impacto ambiental que pueda inducir el hombre. 2. En general la diversidad de especies (H'n), la biomasa (g m-2) y la riqueza de especies (D) mostraron valores máximos en horas oscuras, pero pruebas estadísticas no otorgaron diferencias significativas de estos parámetros en ciclos nictemerales (24-hrs). 3. Los parámetros ecológicos de la comunidad mostraron un máximo de biomasa (3.43 g m-2) y de especies visitantes ocasionales (24 hrs.) en febrero. El número de especies generales presenta un mínimo en el mes de noviembre (36 sp). 4. En Boca de Estero Pargo existen 77 especies, de las cuales 20%, son residentes permanentes, 23% visitantes cíclicos y 57% visitantes ocasionales. La colonización de las praderas de Thalassia testudinum por los peces está relacionada a la alimentación o a ciclos reproductivos o a protección de poblaciones juveniles. Más del 36% de las especies de peces son consumidores de segundo orden, son abundantes numéricamente, presentan alta especificidad de habitat y la mayoría de esas especies son demersales. Los consumidores de segundo orden son los más importantes para determinar características particulares de comunidades de peces (Tabla 16).
AgradecimientosEl apoyo institucional y financiero para el presente estudio fue proporcionado por el Instituto de Ciencias del Mar y Limnología, Universidad Nacional Autónoma de México (ICMLUNAM), y de la Secretaría de Marina, Secretaría de Pesca y Petróleos Mexicanos (PEMEX) a través del Programa Coordinado de Estudios Ecológicos de la Sonda de Campeche (PCEESC). Al mismo tiempo se contó con apoyo económico del Consejo Nacional de Ciencia y Tecnología (CONACYT) a través del Proyecto UNAM-CONACYT Clave PCMABEU-005322. La participación de Ramiro Román Contreras, jefe de la Estación de Investigaciones Marinas "El Carmen" del ICML, en Cd. Del Carmen, Camp., en las colectas de peces y mediciones de parámetros ambientales, fue fundamental para los estudios en la Boca de Estero Pargo. Se agradece al personal del Laboratorio de Ictiología y Ecología Estuarina del ICML, por su ayuda en el procesamiento de las colectas de peces y en la discusión e interpretación de los resultados en las distintas etapas del desarrollo del trabajo, en especial a Patricia Sánchez-Gil, Irma Vargas Maldonado, Margarito Tapia García, Ma. de la C. García Abad, Hernán Álvarez Guillén, Domingo Flores Hernández y Arturo Aguirre León. 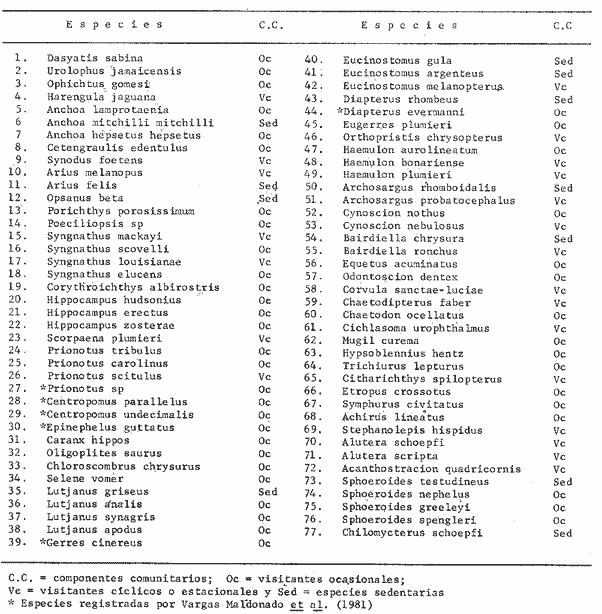 Tabla 16. FAUNA ICTIOLÓGICA D LA BOCA DE ESTERO PARGO. LITERATURAADAMS, S. M. The ecology of eelgrass Zostera marina) fish communities. II. Structural analysis. J. Exp. Mar. Biol. Ecol. 1976a 269-292 22 ADAMS, S. M. II. Structural analysis. The ecology of ee1grass (Zotera marina) fish communities. J. Exp. Mar. Biol. Ecol. 1976b 293-312 22 ADAMS, S. M. Feeding ecology of seagrass fish communities. Trans. Amer. Fish. Soc. 1977 514-520 105 CARR, W. E. S. y C. A. ADAMS Food habits of juveniles marine fishes occupying seagrass beds in the estuarine zone near Crystal River, Florida. Trans. Amer. Fish. Soc. 1973 511-540 102 DAHLBERG, D. M. y C. P. ODUM Annual cycles of species occurrence, abundance and diversity in Georgia estuarine fish populations. Amer. Midl. Natur. 1970 382-391 83 (2) DAVIES, R. G. Computer Programming in Quantitative Biology. Acadernic Press. London 1971 492 p 420-430 FERGUSON-WOOD, E. J., W. E. ODUM Y J. C. ZIEMAN, 1969. , In: (Eds.). , : . Influence of sea grasses on the productivity of coastal lagoons Ayala-Castañares, A. y F. B Phleger Lagunas Costeras, un Simposio, Mem. Simp. Intern. Lagunas Costeras. UNAM-UNESCO, México, Nov. 28-30 1967 495-502 FENCHEL, T. Aspects of the descomposition of seagrass. Mc Roy, C. y C. Helfferich Seagrass Ecosystem. Marcel Dekker, Inc. N. Y. 1977 123-135 GUNTHER, G. Some relations of estuarine organism to salinity. Limnol. Oceanogr. 1961 183-190 6 GUNTER, G., J. Y. CHRISTMAS y R. KILLEBREW Some relations of salinity to population distributions of motile estuarine organisms, with special reference to penaeid shrimps. Ecology 1964 88-97 38 HECK, Jr., K. L. y R. J. ORTH Seagrass habitats: the roles of habitat complexity, competition and predation in structuring associated fish and motile macroinvertebrate assemblages. Kennedy, V. Estuarine Perspectives. Academic Press, Inc. New York 1980 449-464 HOESE, H. D. y R. S. JONES Seasonality on large animals in a Texas turtle grass community. Publ. Inst. Mar. Sci. Univ. Texas 1963 37-48 9 JONES, J. A. Primary productivity by the tropical marine turtle grass, Thalassia testudinum and its epiphytes. Ph. D. dissertation, Univ. Miami, Coral Gables. 1968 186 p. KIKUCHI, T. y J. M. PERES Consumer ecology of seagrass beds. Mc Roy, C. y C. Helfferich Seagrass Ecosystem. Marcel Dekker, Inc. N. Y. 1977 147193 KRICHER, J. C. Bird species diversity: the effect of species richness and equitability on the diversity index. Ecology 1972 278-282 53 LEY-LOU, F. Tesis profesional. Algunos factores ecológicos abióti. cos en Estero Pargo, Campeche. México. Fac. Ciencias, Univ. Nal. Autón. México 1979 39 p. LIVINGSTON, R. J. Diurnal and seasonal fluctuation of organisms in a North Florida Estuary. Estuar. Coast. mar. Sci. 1976 373-400 4 MANN, K. H. Macrophyte production and detrirus food chains in coastal waters. Mem. Ist. Ital Idrobiol; 29 Suppl. 1972 353-383 Mc ROY, C. P. y C. HELFFERICH Seagrass Ecosystems: A Scientific Perspective. Mc ROY, C. P. y C. HELFFERICH UNESCO/ UNDP. Marcel Dekker Inc. New York 1977 313 p. Mc ROY, C. P. y C. Mc MILLAN Production ecology and physiology of seagrasses. Mc Roy, C. P. y C. Helfferich Seagrass Ecosystem: A Scientific Perspective. Marcel Dekker New York 1977 53-88 OGREN, H. L. y H. A. BRUSHER The distribution and abundance of fishes caught with a traw1 in the St. Andrew Bay System, Florida. Northeast Gulf Science 1977 83-105 1 (2) PENHALE, P. A. Macrophyte-epiphyte biomass and productivity in an eelgrass (Zostera marina L.) community. J. Exp. mar. Biol. Ecol. 1977 211-224 26 PHILLIPS, R. G. Temperate grass flats. Odum, H. T., B. J. Copeland y E. A. Mc Mahan Coastal Ecological Systems of the United States. Report of the Federal Water Pollution Control Administration, Contract RFP 1969 68-128 2 THAYER, G. W., D. A.WOLFE y R. B. WILLIAMS The impact of man on seagrass system. Am. Scientist 1975 228-296 63 THORHAUG, A. y M. ROESSLER Seagrass community dynamics in a subtropical estuarine lagoon. Aquaculture 1977 253-278 12 TURNER, W. R. y G. N. JOHNSON Distribution and relative abundance of fishes in Newport River, North Carolina. National Oceanic and Atmospheric Administration (NOAA) Technical Report NMFS SSRF 1973 1-23 666 VARGAS MALDONADO, I., A. YÁÑEZ-ARANCIBIA y F. AMEZCUA LINARES Ecología y estructura de las comunidades de peces en áreas de Rhizophora mangle y Thalassia testudinum de la Isla del Carmen, Laguna de Términos, Sur del Golfo de México. An. Inst. Cienc. del Mar y Limnol. Univ. Nal. Autón. México 1981 241-266 8 (1) WEINSTEIN, M. P. y K. L. HECK, Jr. Ichthyofauna of seagrass meadow along the Caribbean coast of Panama and in the Gulf of Mexico: Composition, structure and community ecology. Mar. Biol. 1979 97-108 50 YÁÑEZ-ARANCIBIA, A. Taxonomía, Ecología y Estructura de las Comunidades de Peces en Lagunas Costeras con Bocas Efímeras del Pacífico de México. Centro Cienc. del Mar y Limnol. Univ. Nal. Autón. México, Publ. Esp. 1978 1-306 2 YÁÑEZ-ARANCIBIA, A. Ecological studies in Puerto Real Inlet, Laguna de Términos, México: Díscussion on the trophic structure of fish communities on Thalassia testudinum banks. Proc. Sem. Duke Univ. Mar. Lab. Beaufort NC, USA, Aug. 1978, (UNESCO, IABO). UNESCO Tech. Pap. Mar. Sci. 1981a 191-232 33 YÁÑEZ-ARANCIBIA, A. The occurrence, diversity, and abundance of fishes in two tropical coastal lagoons with ephemeral inlets on the Pacific coast of Mexico. Proc. Sem. Duke Univ. Mar. Lab. Beaufort NC, USA, Aug. 1978, (UNESCO, IABO). UNESCO Tech. Pap. Mar. Sci. 1981b 233-260 33 YÁÑEZ-ARANCIBIA, A. y J. W. DAY, Jr. Ecological characterization of Terminos Lagoon, a tropical lagoon-estuarine system in the Southern Gulf of Mexico. Lasserre, P. y H. Postma Coastal Lagoons. Oceanológica Acta. Vol. Spec. 1982 431-440 5 (4) YÁÑEZ-ARANCIBIA, A., F. AMEZCUA LINARES y J. W. DAY, Jr. Fish community structure and function in Terminos Lagoon, a tropical estuary in the southern Gulf of Mexico. Kennedy, V. Estuarine Perspectives. Academic Press Inc. New York 1980a 465-482 YÁÑEZ-ARANCIBIA, A., A. L. LARA-DOMÍNGUEZ, P. SÁNCHEZ-GIL, I. VARGAS MALDONADO, P. CHAVANCE, F. AMEZCUA LINARES, A. AGUIRRE LEÓN y S. DÍAZ RUIZ Ecosystem dynamics and 'nichthemeral and seasonal programming of fish community structure in a tropical estuarine inlet, Mexico. Lasserre, P. y H. Postma Coastal Lagoons. Oceanológica Acta. Vol. Spec. 1982 417-429 5 (4) YÁÑEZ-ARANCIBIA, A., A. L. LARA-DOMÍNGUEZ, P. CHAVANCE y D. FLORES HERNÁNDEZ Environmental behavior of Terminos Lagoon ecological system Campeche, Mexico. An. Inst. Cienc. del Mar y Limnol. Univ. Nal. Autón 1983 137-176 10 (1) ZlEMAN, J. C. y R. G. WETZEL Productivity in seagrasses: Methods and rates. Phillips, D. C. y C. P. McRoy Handbook of Seagrass Biology: An Ecosystem Perspective. Garland STPM Press New York 1980 87-118 ZIEMAC, J. C., G. THAYER, M. ROBBLEE y R. ZIEMAN Production and export of seagrasses from a tropical bay. Livingston, R. J. Ecological Processes in Coastal and Marine System. Plenum Press N.Y. 1979 21-33
|

