|
ACTIVIDAD
HETEROTRÓFICA DE MICROORGANISMOS DE SEDIMENTO Y AGUA EN ISLA IONA,
COLUMBIA BRITÁNICA, CANADÁ
Trabajo recibido el 27 de abril
de 1982 y aceptado para su publicación el 11 de mayo de
1982.
JORGE A. CHOCAIR
Cosmos International Consultants, 725 Gatensbury St; Coquitlam, B.
C., Canada.
LAWRENCE J. ALBRIGHT
Simon Fraser University, Department of
Biological Sciences, Burnaby, B. C., Canada.
Muestras de
sedimentos y agua suprayacente en el área interinareal de la Isla lona,
Columbia Británica, Canadá, fueron analizadas y comparadas en
relación a sus biomasas (Unidades formadoras de colonias, CFU;
trifosfato de adenosina, ATP; y números de bacterias activas, de acuerdo
a análisis microautoradiográficos), en relación a sus
actividades heterotróficas usando glucosa, y alanina como substratos, y
en relación a la cantidad de carbón orgánico disuelto
(DOC) y carbón orgánico particular (POC) Los valores para
biomasa, potencial heterotrófico y tiempo de incorporación
(turnover time) fueron siempre mayores en el sedimento, en cambio los valores
Kt+ Sn (un valor estimativo de
constante de transporte más la concentración natural del
substrato) fueron variables. Los potenciales heterotróficos por unidad
de biomasa fueron mayores en el agua suprayacencte que en el sedimento en la
mayoría de los casos. Por lo tanto, consideramos que las bacterias
heterotróficas del sedimento por unidad de biomasa, no son tan activas,
desde el punto de vista metabólico, como aquellas en el agua
suprayacente.
Sediment and overlying water of the intertidal area of
Iona Island, British Columbia, Canada, were analyzed and compared for microbial
biomasses (Colony forming units, adenosine-5'-triphosphate levels and numbers
of active bacteria as indicated by microautoradiography), glucose and alanine
heterotrophic activities and dissolved (DOC) and particulate organic carbon
(POC). Biomasses, heterotrophic potential and turnover time values were always
greater in the sediments, whereas Kt
+Sn (an estimate of transport constant plus the natural
concentration of substrate) values were variable. Heterotrophic potentials per
unit biomass were greater in the overlying waters than in sediments in most
areas. Thus, per unit biomass the sediment heterotrophic bacteria are not as
metabolically active as those in the overlying water.
Las poblaciones microbianes en sedimentos marinos son importantes en la descomposición de materia orgánica, en varias, transfoimaciones geoquímicas, en regeneración de nutrientes y como fuente alimenticia para la fauna béntica (Johnson y Calder, 1973; Litchfield, 1973; Hodson et al., 1976). Es de especial importancia el área limítrofe entre el agua y el sedimento, considerando que esta región es un sitio de intensa actividad microbiana (Harrison et al., 1971). Una gran variedad de bacterias pueden ser aisladas en altas concentraciones (Zobell, 1938, 1946; Zobell y Anderson, 1936, Zobell y Feltham, 1942; Harrison et al., 1971). Sin embargo, pocos, han sido los intentos de determinar la actividad bacteriana in situ de este importante sector (Meyer-Reil, 1978). La importancia de los sedimentos en cl aporte de nutrimentos a la columna de acua ha sido puesto de manifiesto por varios autores (Pomeroy et al., 1972; Bodungen et al., 1975; Smetacek et al., 1976). Anteriores autores llegaron a la conclusión que una importante función de los microorganismos que habitan los sedimentos es su participación en la mineralización de la materia orgainica (Harrison et al., 1971). "Tas transformaciones, llevadas a cabo por bacterias bénticas puede ser, en algunas ocasiones, la principal fuente de nueva materia orgánica en la columna de agua" (Seki, 1968; Seki et al., 1968). Esa producción de materia orgánica está representada por una reutilización de energía almacenada, a través de procesos heterotróficos y quimosintóticos (Seki et al., 1968). "En este sentido puede ser clasificado como producción secundaria, aunque el material producido sirve como fuente alimenticia primaria, si esta consideración se hace desde el punto de vista de las relaciones troficas" (Seki et al., 1968). Las bacterias heterotróficas exhiben tres funciones en un ecosistema acuático (Hoppe, 1976) : 1. Son consumidores de materia orgánica disuelta (DOM) en el medio ambiente, resultando en una autopurificación de compuestos fotosintóticos y alóctonos; 2. Contribuyen en el reciclaje de substratos inorgánicos para los productos primarios; 3. Son productores también, en el sentido que son capaces de convertir substancias orgánicas disueltas en materia particular, y de esta manera ponerla a disposición de los primeros eslabones de la cadena alimentaria. La materia orgánica disuelta representa una fuente intermedia de carbón entre detritus y bacteria (Hall et al., 1972). De esta manera, una medida de la dinámica de su utilización deberia dar una estimación indirecta de la producción heterotrófica microbiana como también de la descomposición de los detritus (Jannasch, 1958; Hall et al., 1972). Considerando que hay muchas moléculas orgánicas complejas en el agua y en los sedimentos, a muy bajas concentraciones, a menudo es muy difícil medir el crecimiento y la actividad de microorganismos como respuesta a solutos orgánicos especlficos. Hasta ahora no existe una técnica para determinar el ritmo, de utilización de esos substratos, sin embargo, la mejor herramienta disponible para estudiar la utilización de solutos orgánicos es la técnica denominada "potencial heterotrófico", descrita originalmente por Parsons y Strickland (1962), en donde ellos estudiaron la incorporación de substratos marcados con 14C por parte de organismos planctónicos marinos y descubrieron que sus datos seguian la dinámica enzimática de Michaelis-Menten. Esta técnica ha sido adoptada por muchos investigadores como una técnica estándar para determinar la actividad heterotrófica de microorganismos en el medio acuático (Wright y Hobbie, 1965; Vaccaro y jannasch, 1966; Wood, 1970; Harrison et al., 1971; Hall et al., 1972; Azam y Holm-Hansen, 1973; Albright y Wentworth, 1973; Dietz et al., 1976; Meyer-Reil, 1978). La mayoría de las investigaciones previas han significado estudiar la actividad heterotrófica bacteriana en el medio acuático más que en los sedimentos. Sin embargo, algunos científicos (Wood, 1970; Harrison et al., 1971; Hall et al., 1972; Meyer-Reil, 1978) han utilizado la técnica del "potencial heterotrófico" para estudiar la actividad microbiana en sedimentos. Wood (1970) demostro que esta técnica funcionaba bien, cuando se la usaba en sedimentos estuarinos. Desde entonces, otros autores han utilizado esa técnica en el estudio bacteriológico de sedimentos. Harrison et al. (1971), describieron un método para determinar la mineralización en muestras de sedimentos que fueron obtenidas en Upper Klamath Lake, Oregon, USA. Hall et al. (1972), estudiaron Marion Lake, Columbia Britainica, Canadá, para determinar la importancia de las bacterias en las comunidades bénticas y los factores que afectan la asimilación de solutos orgánicos. MeyerReil (1978) midió la incorporación y la respiración bacteriana en muestras de sedimentos sacadas de playas arenosas en el mar Báltico. EI presente trabajo, compara las actividades heterotróficas de poblaciones microbianas en sedimentos y aguas suprayacentes en una zona estuarina en la isla lona, Columbia Británica, Canadá. Estas comparaciones fueron hechas sobre la base de actividad heterotrófica total para glucosa y alanina, como asimismo actividad per bacterium, lo cual fue determinado por unidades formadoras de colonias (CFU), por números de bacterias activas determinadas por medio de microautorradiografia y por la concentración de ATP como una indicación de biomasa, para determinar si el bacterioplancton es tan metabólicamente activo como las bacterias del sedimento. ÁREA DE ESTUDIOPara el presente estudio, se utilizaron muestras de sedimento y agua obtenidas de la zona intermareal de Sturgeon Banks, en la zona oeste de la isla Iona, la cual esta ubicada a 49°13´30"N, 123°13´W (Fig. 1).  Fig. 1 Zona sudoeste de la Columbia Británica. La estación estudiada corresponde a la Isla Iona, indicada en el número I. MATERIAL Y MÉTODOLas muestras de sedimentos de la zona intermareal de Sturgeon Banks, fueron colectadas usando un muestreador situado, permanentemente en esa ubicación. Este colector de sedimento consistía de una base de hierro (0.50 X 40 X 60 cm) con seis placas de Petri (15 mm estaffidar) asegurada a la base. Debido a la acción del oleaje se depositaba sedimento en forma continua en las placas. Las muestras de agua de la zona intermareal de la isla Iona fueron obtenidas manualmente, al mantener un frasco de 1 litro de volumen con la tapa en su lugar a aproximadamente 10 cm de la superficie del sedimento, donde se abría para permitir su llenado, tras lo cual se tapaba y se llevaba para su procesamiento inmediato. Temperaturas y salinidades fueron determinadas durante el tiempo de muestreo. La salinidad se determinó usando un salinómetro portátil modelo YSI 33S-C-T (Yellow Spring Instruments Co., Yellow Spring, Ohio). La determinación de la actividad heterotrófica en el agua sobrenadante fue estimada siguiendo la metodología de Dietz et al. (1976). Brevemente se procedió de la siguiente manera: Una alicuota de la muestra de agua fue aspirada en una jeringa plástica desechable (Plastipak, 10 ml). Esto fue seguido inmediatamente por la adición de un substrato marcado radioactivamente a través del orificio de la jeringa, usando una micropipeta. Duplicados y controles fueron preparados para cada experimento. Las muestras fueron incubadas a la temperatura ambiental del agua. Después de incubadas, las muestras fueron filtradas a través de filtros Millipore que hablan sido previamente humedecidos (0.22 cm de poro, 45 mm de diámetro) y finalmente enjuagados con aproximadamente 20 ml de una solución isotónica previamente enfriada a 5ºC. Después de la filtración, los filtros fueron colocados en frascos de centelleo (scintillation vials) que contenlan 15 ml de disolvente de filtros, Beckman (Beckman Filter-Solvr). Una vez que los filtros estaban parcialmente disueltos y clarificados (aproximadamente 24 h), se determinaron las correspondientes radioactividades, usando un espectrómetro Beckman LS-250 (Beckman Instruments Inc., Fullerton, California). Cuentas por minuto (cpm) fueron corregidas por el método estándar externo (external standard method) tomándose en consideración la eficiencia de la máquina y el factor "quench", como asimismo el decalmiento radioactivo (half life decay) y reportado finalmente como desintegraciones por minuto (dpm). Con el objeto de llevar a cabo el análisis de la actividad heterotrófica en sedimentos, estos fueron diluidos con agua de mar artificial estéril (Rila Marine Products, Teaneck, N. J.) en una proporción de una parte de sedimento por nueve partes de agua (V/V) seguido por el mismo tratamiento dado al agua como se describió anteriormente. Las muestras incubadas fueron filtradas a través de filtros Millipore previamente humedecidos, de 47 mm de diámetro y 0.4 um de tamaño de poro (Tipo HA). Glucosa radioactiva (D - [6 - ³H] glucosa, actividad específica de 10 Ci/mMol, Amersham/Searle Corp), así como alanina (L - [2,3 - ³H] Alanina, actividad específica de 41 Ci/mMol y 36 Ci/mMol, Amersham/Searle Corp.) fueron usadas Los compuestos marcados con tritium fueron diluidos en agua sin carbón (C free water), preparada de acuerdo al método de Strickland y Parsons (1972). Se tuvo especial cuidado de asegurar que el ritmo de utilización de los substratos tanto en el agua como en el sedimento fueran lineares con el tiempo. La respuesta de utilización de los substratos que sigue la ecuación de Michaelis-Menten es transformada en una relación linear debido a la aplicación de una ecuación modificada de Lineweater-Burke de acuerdo a la derivación de Wright y Hobbie (1965). Esta ecuación es: T/f = Kt + Sn ÷ Vmax + A ÷ Vmax en donde T es el tiempo de incubación (en horas), f es la fracción de substrato, disponible utilizado, Kt es una constante de utilización, Sn es la concentración natural del substrato y A es la concentración del substrato agregado. La utilización es medida a diferentes concentraciones de A, cada una de las cuales genera un cuociente T/f diferente y cuando este valor es graficado con A, deberá generar una linea recta. La intercepción de esta curva con la abcisa produce cl valor de - (Kt + Sn) en donde 1 /Vmax corresponde a su declive (slope). E1 tiempo de utilización total es calculado de acuerdo a (Kt + Sn) /Vmax. La utilización neta del substrato por parte de las bacterias del sedimento es rápida, por lo tanto un tiempo de incubación corto fue escogido (10 min). El tiempo de incubación para las muestras de agua fue de 60 min. Las curvas de utilización obtenidas, estaban de acuerdo con los requisitos para medir utilización usando la técnica de potencial heterotrófico, a saber: a) respuesta linear en relación al tiempo; b) ausencia de agotamiento del substrato; c) mínimos cambios de la concentración del substrato sobre el período de incubación (Meyer-Reil, 1978). Determinación de nutrientes orgánicosEl carbón orgánico disuelto (DOC) se determinó mediante el uso de un analizador de gas Beckman (Beckman Instruments, Fullerton, California), de acuerdo, a la técnica descrita por Strickland y Parsons (1972). Para determinar el carbón orgánico particular (POC) se usó un analizador Beckman CHN (Beckman Instruments, Fullerton, California). Determinación de poblaciones microbianasEl número de bacterias heterotróficas de sedimento marino y del agua suprayacente fue determinado, de acuerdo a la técnica de medio sólido, usando para tal efecto agar marino. 2216 (Difco), e incubándolas a 15°C durante 14 días. Adenosina 5´- trifosfato (ATP) presente en la muestra fue extraído y analizado de acuerdo a la técnica descrita por Holm-Hansen y Booth (1966). La técnica desarrollada por Bancroft et al. (1976), fue usada para extraer y analizar los niveles de ATP en sedimentos. La recuperación del ATP, estimada por el método interno estándar, siguiendo a Bancroft et al. (1976) fluctuó entre 64.0 y 81.5%. El número de bacterias, metabó1icamente activas (NAB) tanto en el sedimento como en el agua, fue determinado siguiendo la técnica de Hoppe (1976): 1 ml de agua o sedimento (previamente diluido de acuerdo a la descripción dad: anteriormente) fue aspirado en una jeringa desechable de 10 ml (Plastipak,10 ml) le capacidad. El material en una de estas jeringas fue inmediatamente fijado con glutaraldehido al 2%, y sirvió como control. Enseguida, se agregó el cempuesto radioactivo seleccionado (D - 6 - 3 H glucosa), actividad específica de 10 Ci/mMol, Amersham/Searle Corp.), para producir una concentración final de 1.8 X 10`1 mg/1. Después de tres horas de incubación a la temperatura in situ, se fijaron los contenidos de las restantes jeringas con la solución de glutaraldehido al 2%, y se completó el volumen de 10 ml con agua de Mar artificial estéril con un contenido de 10-6 M de glucosa. De esta manera se reduce considerablemente la adsorpción y mejora la distribución de las bacterias en el filtro (Hoppe, 1976). Las muestras fueron filtradas a través de filtros Nucleopore R (25 mm de diámetro, 0.2 mm de poro) previamente humedecidos, a una presión de vacío de 150 mm de Hg. Después de dejarlos secar al aire, los filtros fueron adheridos a portaobjetos, con cinta Scotch R engomada por ambos lados y cubiertas posteriormente con emulsión fotográfica KODAK NTB-2. Después, de secados, los portaobjetos fueron guardados a 5°C durante 10 dias en cajas plásticas negras completamente selladas. E1 paso siguiente consistió en desarrollar los autoradiogramas durante 5 min en revelador Kodak D-19, y fijado con fijador Kodak F-5 durante 5 min y finalmente lavados con agua potable durante 30 min (Baserga y Malamud, 1969). Las manchas (spots) fueron contadas usando un microscopio, de contraste de fase Zeiss (Modelo estándar WL) a una amplificación de 1250x. Los números de bacterias activamente metabólicas, (NAB per ml) fueron calculadas de acuerdo a Hoppe (1976). RESULTADOS Y DISCUSIÓNLos resultados de los números de colonias (CM = Colony forming units) se presentan en la Tabla 1. Las poblaciones bacterianas en la isla Iona, indicadas en términos de colonias (CFU), fueron siempre mayores en el sedimento que en agua suprayacente, en algunos casos con una diferencia de hasta tres órdenes de magnitud. La diferencia media entre las poblaciones bacterianas del sedimento y del agua de la isla Iona, fue de dos órdenes de magnitud en el lapso de 14 meses de muestreo. E1 valor mas alto para CFU en el agua suprayacente fue 1.1 X 10 6 y se encontró a principios de abril; el valor mais bajo fue de 1.8 X 10 4 y fue encontrado a fines de mayo, promediando 3.2 X 10 5 células por ml durante el ciclo anual. E1 valor CFU más alto en sedimentos fue también encontrado a principios de abril y fue de 1.4 X 10 9 células por ml; el valor CFU más bajo fue en noviembre con 2.9 X 10 6 células por ml, promediando 2.2 X 10 8 células por ml durante el ciclo anual. El número de bacterias (representado por CFU) en sedimentos marinos es elevado, en comparación con el número encontrado en el agua suprayacente. Drew (1912) consigna 1.6 X 10 8 bacterias por ml en el sedimento y 1.6 X 10 2 bacterias por ml en el agua a 366 m de la isla Andros, Indias Occidentales. Wood (1970) encontró un valor de 1.2 X 10 7 bacterias, por g de sedimento en octubre y 3.0 X 10 5 células por g en febrero. Dietz et al (1976), consignaron valores CFU en el agua a una profundidad de 1.0 m a 1.5 m, los cuales fluctuaban de 1.8 X 10 2 a 2.1 X 10 4 bacterias por ml en el estrecho de Georgia, Columbia Británica, Canadá. Rittenberg (1940), encontró bacterias viables en sedimentos a profundidades entre 342 y 355 cm, sin embargo, la concentración mayor ha sido encontrada en el limite sedimento agua (Lloyd, 1931; Reuszer, 1933; Zobell y Anderson, 1936; Rittenberg, 1940; Zobell y Feltham, 1942). Rittenberg (1940) tambi6n encontró que el numero, de bacterias aeróbicas en la capa superior del sedimento, es alta, comprendiendo entre 1.0, X 106 y 8.0 X 106 por g de sedimento en peso húmedo. Las mayores cantidades en el sedimento se esperaban, considerando que estas cifras están relacionadas a la concentración de materia orgánica (Reuszer, 1933; jannasch, 1969; Wood, 1970). Un camino para medir la productividad de comunidades bacterianas podría ser contar los números de células y estimar las fluctuaciones estacionales que ocurren (Hall et al., 1972). Sin embargo, esta vía no ha sido, muy exitosa, considerando que es muy difícil diferenciar detritus de las bacterias del sedimento. Por otra parte, la determinación bacteriana usando la técnica del medio sólido (placa de Petri) subestima de mancra notable los numeros bacterianos, considerando que sólo una pequeflafracción del total de células viables crecera sobre cualquier medio nutritivo, incubado a una atmósfera de presión (Hodson et al., 1976; Bancroft et al., 1976). El método de dilución por extinción que es también comfinmente usado para enumerar bacterias marinas, también es selectivo debido a la composición química del medio y debido a parámetros, fisicos tales como temperatura y presión. Además el método de dilución por extinción puede ser es, bio1óglcamente selectivo en que una forma puede fácilmente crecer sobre otra (Hamilton y Holm-Hansen, 1967). Los datos, sobre biomasas indicadas por los niveles de ATP están presentados, en la Tabla 1. Las concentraciones de ATP extraídas del sedimento de la isla Iona fueron hasta cuatro órdenes de magnitud más elevado que aquellos del agua suprayacente. La concentración media de ATP en el sedimento de isla Iona fue de 4.1 X 10-1 mgl-l (rango 2.4 - 3.1 X 10-2), y el promedio de ATP en el agua suprayacente fue de 6.3 X 10-4 mgl-l (rango 3.9 X I0-3 - 1.6 X 10-5). Karl et al. (1976), registró valores de concentraciones de ATP a diferentes profundidades en la estación Mid-Atlantic Ridge, hasta 4100 m. Las concentraciones de ATP decrecían rápidamente desde un máximo de 4100 ngl-l cerca de la superficie, a un valor de 3 ngl-l a aproximadamente 280m. Bajo 300m, la concentración de ATP se incrementaba a un máximo de 225 ng ATP1-1 a 650 m. Más abajo, la concentración de ATP decrecía gradualmente hasta un valor de 8.0 X 10-1 ngl-l a 2000m. Entre 3 y 5m sobre el fondo, la concentración de ATP fue de 3.2 ngl-l. En la estación de Abyssal Plain encontraron un patrón parecido. Los mencionados autores también observaron que la concentración de ATP en la capa superior de sedimento (0 a 2 cm) fue 3 órdenes de magnitud mayor que en el agua suprayacente. Dietz et al. (1976), proporcionan información acerca de las concentraciones: de ATP en diferentes lugares costeros de la Columbia Británica, Canadá, a una profundidad entre 1 y 1.5 m. Estas concentraciones fluctuaban desde 3.0 X 106 mgl-l a 6.9 X 10-4 mgl-l. Hodson et al. (1976), hicieron determinaciones de ATP a profundidades de 1000 y 200 m en los primeros 6 cm de sedimento en el 0céano Atlántico frente a la costa noroeste de África. Ellos encontraron que la concentración promedio en el sedimento más somero fue 545 ng ATP ml-l de sedimento Mimedo, comparado a 195 ng ATP ml-l de sedimento hulmedo en la estación más profunda. La figura 2 ilustra la relación agua suprayacente/sedimento (P:B) de los niveles de ATP. Estos fueron más elevados en las muestras de sedimento. De esta manera se indica que la biomasa microbiana del sedimento de isla Iona es mayor que la biomasa microbiana en igual volumen de agua suprayacente. ATP es característico de Mulas vivas y de soluciones provenientes de células dailadas o muertas (Lee et al., 1971; Hamilton y Holm-Hansen, 1967; Holm-Hansen y Booth, 1966). Aunque en el proceso de filtración para concentrar las células bacterianas antes de la extracción, se somete a estos microbios a tensiones que en algunas oportunidades resulta en daflo o muerte para las células, el método es útil para extraer ATP de las muestras, de agua (Griffiths et al., 1973; Dietz et al., 1976; Bancroft et al., 1976). Sin embargo, diferentes procedimientos de extracción de ATP de las muestras de sedimento han sido descritas (Lee et al., 1971a, b; Ernst y Goerke, 1974; Karl y LaRock, 1975; Hodson et al., 1976; Bancroft et al., 1976), pero los grados; de eficiencia de extracción por los diferentes métodos varían grandemente, como asimismo dicha eficiencia varia de muestra en muestra para el mismo método. Por lo tanto, es muy difícil comparar los valores obtenidos por los diferentes investigadores. 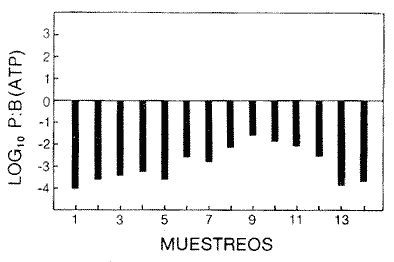 Fig. 2. Relación logarítmica para el valor ATP. Las barras deseendentes iindica valores mayores en el sedimiento. La información obtenida para los números de bacterias metabó1icamente activas se presenta en la Tabla 1. La figura 3 ilustra la relación de agua a sedimento (P:B) de los valores de NAB. Las poblaciones bacterianas, indicadas por los valores de NAB, fueron siempre mayores en el sedimento. La población bacteriana promedio indicada por los valores, NAB en el sedimento de la isla Iona fue 68 veces mayor que el valor encontrado en cl agua, lo cual representa un promedio de 2.3 X 10 8 células m l-1 en el sedimento (rango 1.2 X 10 7 - 7.3 X 10 8) y 3.4 X 10 6 células en el agua suprayacente, (rango 9.8 X 10 4 - 9.2 X 10 6). 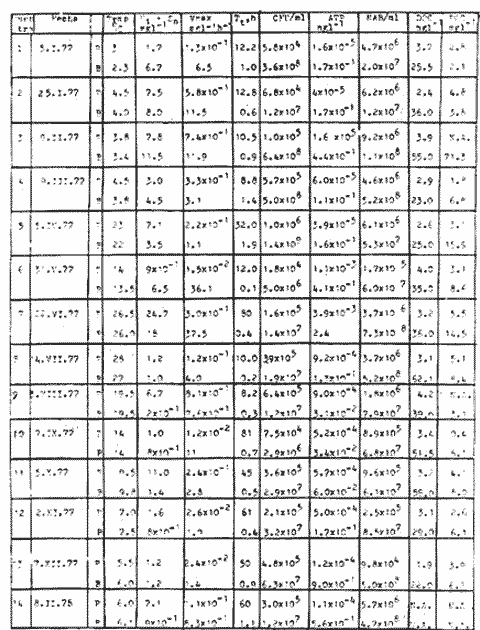 TABLA 1 BACTERIANA Y VALORES DE LA ACTIVIDAD HETEROTRÓFICA CON GLUCOSA, PARA PLANCTON (P) Y SEDIMENTO (B) EN LA ISLA IONA, COLUMBIA BRITÁNICA, CANADÁ 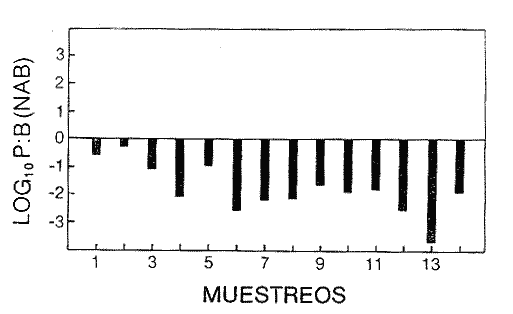 Fig. 3. Relación logaritmica para el valor NAB. Las barras decendentes indican valores mayores en el sedimento. Hoppe (1976) encontró en la Bahia Inner Kiel a l m de profundidad valores que fluctuaban entre 1.7 X 105 células activas en enero de 1975 a 1.9 X 10 6. Celulas activas ml-l en julio de 1974. Los valores CM para las mismas muestras fueron 1.0 X 10 4 y 2.3 X 10 4 células ml-l respectivamente. Muestras provenientes de la zona media de Kiel Bight a 1 m de profundidad fueron 1.2 X 106 células activas ml-l en julio de 1974 y de 5.7 X 104 células activas ml-l en enero de 1975. Para las mismas muestras, los valores fueron CFU fueron 1.5 X 10 2 y 3.3 X 10 2 respectivamente. Los resultados de Peroni y Lavarello (1975) presentan una relación comparable entre los valores de CFU y NAB en el agua de generalmente 1:1000, sin embargo, esta razón es de un área de mar abierto. No existe mucha información disponible acerca de los números de bacterias heterotróficas metabó1icamente activas, debido probablemente a que la técnica de autoradiografia como una herramienta de investigación de las actividades bacterianas, in situ es muy reciente. PRESENCIA DE NUTRIENTESLos datos obtenidos para el carbón orgánico disuelto (DOC) y para carbón orgánico particular (POC) se presenta en la Tabla 1. Los valores, de DOC fueron siempre mayores en el sedimento. El promedio de (DOC) en la isla Iona fue 11 veces mayor en el sedimento, promediando 38.3 m91-1 (rango 22 - 62. 1) en el sedimento y 3.2 mgl-l en el agua suprayacente (rango 19-4.2 mgl-'). E1 valor promedio de POC en el sedimento de isla Iona fue de 8.1 mgl-l (rango 2.1 - 15.9 mgl-l) y el promedio para el agua suprayacente fue de 3.4 mgl-l (rango 4.5 X 10-1 - 5.5 mg-l). Se han realizado muchas, investigaciones destinadas a conocer las concentraciones, de materia orgáinica en el habitat marino (Stephens et al., 1967; Vaccaro et al., 1968; Seki et al., 1968; Holm-Hansen, 1972; Holm-Hansen y Pearl, 1972; Albright y Wentworth, 1973). La concentración y distribución de estos valores ha sido en muchos casos relacionada a factores tales como profundidad, época del aflo y clase de agua. Por ejemplo, Holm-Hansen (1972) encontró que en aguas costeras de San Diego, California, el valor máximo de POC se hallaba en la zona eufótica con una pronunciada disminución debajo de ella. Dietz et al. (1976), encontraron en cl estrecho de Georgia, Columbia Británica, Canadá (a 100 de profundidad) valores de POC que fluctuaban de 1.7 X 10-1 a 4.6 X 10-1 mgl-l, mientras que para el DOC se consignaron valores que fluctuaban de 4.0 a 8.6 mgl-l. Muchos investigadores han encontrado que los números de células bacterianas tanto en el agua como en el sedimento están relacionadas a la cantidad de materia orgánica (Reuszer, 1933; Zhukova y Fedesov, 1963; jannasch, 1958; Wood, 1970); lo cual tiene una coincidencia general con los resultados del presente estudio. Seki et al. (1968), demostró que después de la adición de glucosa al sedimento se observa un crecimiento relativo en biomasa bacteriana, sin embargo, el porcentaje de carbon orgánico en el sedimento, atribuible a células bacterianas viables es pequeño, considerando que la relación de 1.0 X 107 bacteria por ml es equvialente a 1.0 X 10---3mgl-l de materia orgánica (Zobell, 1946). En aguas costeras someras, el tiempo de retención de materia orgánica en la columna de agua es corto, y esto puede significar que los sedimentos en las zonas de aguas someras tendrán un mayor flujo de material orgánico (Hartwig, 1976). En la mayoría de los sedimentos transporte por lo tanto, representa el mayor flujo de carbón orgánico, aunque hay asimismo producción de materia orgánica en el sedimento mismo, la cual. puede incluir tanto producción fotesintética como también quimotrófica, lo cual representa otra fuente de carbón orgánico, aunque esto sucede sólo en una muy limitada porción del área total de sedimento existente en el océano (Hartwig, 1976). Otras fuentes de afluencia de carbón incluye materiales, mayores que se hunden y que eventualmente alcanzan el sedimento, como también materiales que son transportados horizontalmente por corrientes, acuáticas. HETEROTROFISMOLos datos relativos a la actividad heterotrófica están presentados en las, Tablas 1 y 2. Los valores del potencial heterotrófico fueron calculados para dos diferentes substratos tritiados, glucosa y alanina. Incorporación de glucosa. E1 tiempo de incorporación (T,) de glucosa por parte de las bacterias que habitan el sedimento de isla Iona fue mayor en invierno (promedio de 1.0h) y él menor en verano (promedio de 0.4 h). El valor promedio fue de 0.7h (rango 0. 1 - 1.0 h). Wood (1970) consignó el promedio de tiempo de incorporación en sedimento de 6.0 X 10-2h, con él más lento en invierno, concordando con el resultado del presente estudio, y con una incorporación más rápida en primavera y en otofio. Hall et al. (1972), también encontraron tiempos de incorporación para glucosa, mucho más rápidos en sedimentos, que aquellos encontrados para la columna de agua por diversos, autores (Hobbie y Wright, 1965; Dietz et al., 1976; Burnison y Morita, 1974). Estos resultados han sido encontrados tanto en aguas dulces como marinas. El valor de la constante de transporte más la concentración del substrato (Kt+ Sn) fue mayor en primavera, tanto para el agua suprayacente como para el sedimento (promediando 10.9 y 9.3 mgl-l respectivamente), bastante variable durante el resto del aflo, aunque generalmente más bajo en verano (2.9 mgl-l en agua suprayacente y 6.7 X 10-1 m91-1 en sedimiento). E1 promedio del valor Kt +Sn para el agua suprayacente en la isla Iona fue de 5.8 mgl-l (rango 9 X 10-1 - 24 mgl-l). E1 promedio para sedimento en la misma ubicación fue 4.6 mgl-l (rango 2.3 X 10-1 - 18 mgl-l). Wood (1970) trabajando con glucosa en sedimentos, encontró un notable, incremento en el valor de Kt + Sn en la primavera, pero valores variables durante el resto del aflo. Hall et al. (1972) y Dietz et al. (1976) han encontrado valores de Kt + Sn variables para sedimentos, y agua suprayacente respectivamente. 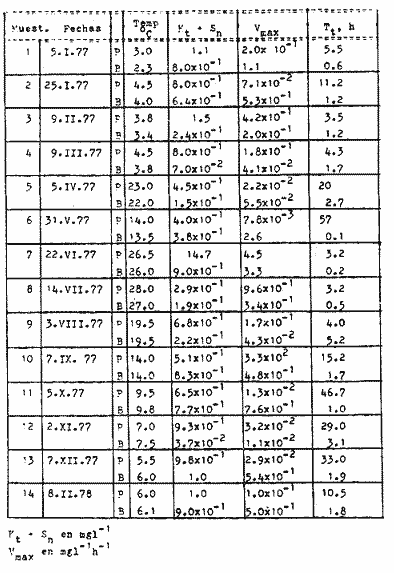 TABLA 2 VALORES DE LA ACTIVIDAD HETEROTRÓFICA CON ALANINA PARA PLANCTON (P) Y SEDIMENTO (B) EN ISLA IONA COLUMBIA BRITANICA,CANADÁ E1 promedio del valor Vmax para glucosa en el agua y en el sedimento fue de 2.6 X 10-1 mgl-l (1.2 X 10-2 - 8.1 X.10-1 mg1-1h-1-1 de rango) y 8.6 mgl-1h-1 (rango 7.6 X 10-1 - 37.5 mg1-1h-1, respectivainente. Tal como ha sido ilustrado en la figura 4, la relación P: B para el valor Vmax fue siempre favorable para las bacterias que habitan en el sedimento que aquellas del agua suprayacente. Esto fue algo esperado, considerando que el número de bacterias en los sedimentos es mayor que en el agua. El valor máximo para glucosa-Vmax en el sedimento de isla Iona fue encontrado, en la parte final de primavera y los valores menores en verano y otoño. El valor alto de Vmax en primavera puede estar relacionado a la descomposición fitoplanctónica y a la actividad bacteriana en el fondo (Wood, 1970). Seki (1968) observó una relación entre producción y mineralización en la columna de agua, mientras que la mineralización fue dominante en sedimentos. Los valores de Vmax encontrados por Meyer-Reil (1978) son variables, promediando 1.7 X 10-1 mg glucosa g-¹h-¹. Hall et al. (1972), encontró relaciones de entre 5.0 X 10-2 y 3.1 X 10-1g 14C glucosa g-1h-1 en el sedimento de un lago; Harrison et al. (1971), consignaron un valor de Vmax, de 2.4gg-1h-1 y Wood (1970) trabajando con sedimentos en suspensión obtuvo un valor Vmax promedio de 3.0 x 102 μpig g-¹h-¹. Los valores dinámicos de incorporación de alanina por parte de comunidades bacterianas del sedimento de isla Iona mostró cortos tiempos de incorporación, relativamente alta velocidad y variables resultados en la constante de transporte (Tabla 3). 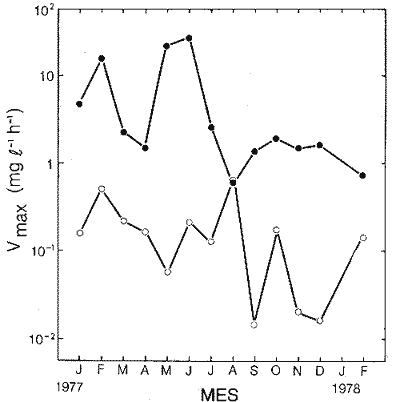 Fig. 4. Variaciones estacionales del Vax para glucosa en sedimento intermareal (circulo lleno) y en el agua suprayacente (circulo vacíos) en Isla Iona, Columbia Britanica, Canadá. 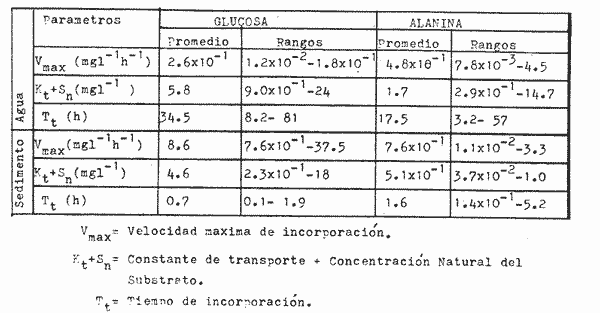 TABLA 3 VALORES PROMEDIO Y RANGO DE VALORES PARA LAS ACTIVIDADES HETEROTROFICAS CON ALANINA Y GLUCOSA EN EL AGUA SUBYACENTE Y EL SEDIMENTO DE ISLA IONA, COLUMBIA BRITÁNICA CANADÁ Se ha observado que el valor Kt + Sn es variable para diferentes ambientes usando diferentes substratos, lo cual puede ser causado por la gran diversidad de microorganismos con diferentes constantes de transporte o debido a la localizada concentración de materias en descomposición que se encuentran aportando solutos hacia el agua intersticial (Hall et al., 1972). Aunque las actividades heterotróficas totales en sedimentos fueron generalmente mayores que en aquellas del agua suprayacente, la actividad heterotrófica por unidad de biomasa (sobre la base de CFU, NAB y ATP) fue frecuentemente mayor en el agua suprayacente ya fuese usando glucosa o alanina como substratos (figuras 5 a 8). Las razones que puedan explicar las excepciones a esa tendencia, no son conocidas. 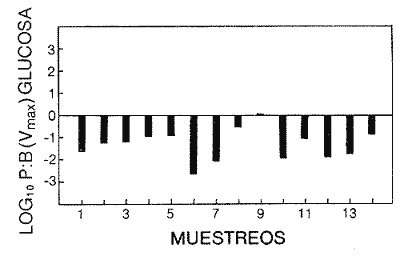 Fig. 5. Relación logaritmmica de Vmax para glucosa. Las barras deseendentes indican valores mayores en el bentos. 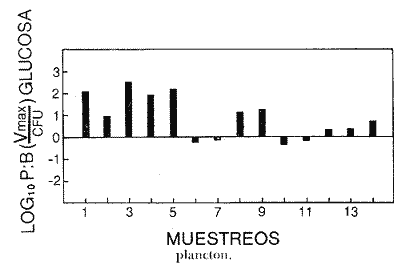 Fig. 6. Relación logaritmica de Vax/CFU para glucosa. Las barras ascendentes indica valores mayores en el. 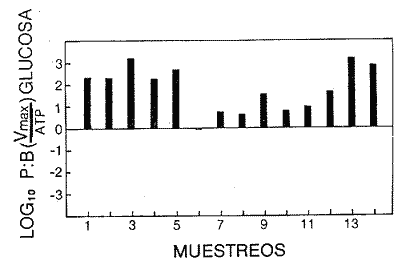 Fig. 7. Relación logaritmica de Vmax/ATP para glucosa. Las barras ascendentes indican valores mayores en el placton. 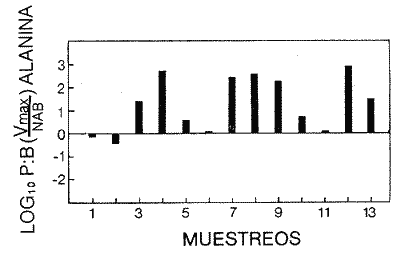 Fig. 8. Relación logaritmica de Vmax/NAB para alanina. Las barras ascendentes indican valores mayores en el placton. La microflora del sedimento de isla Iona tuvo aproximadamente 10% del potencial heterotrófico (con glucosa como substrato) del agua suprayacente sobre la base de CM; 43% sobre la base de NAB y un 50/, sobre la base de ATP; mientras que los valores para la microflora del sedimento con alanina como substrato fue 23% de la actividad heterotroffica del agua suprayacente, sobre la base de CFU; 8% sobre la base de NAB y alrededor de 1% sobre la base de ATP. El hecho que la actividad por unidad funcional es más alta en el agua, indica que cada célula del sedimento no es tan metabólicamente activa como su contraparte planctónica. Considerando que las bacterias están adaptadas para la utilización de substratos a bajas concentraciones y que tienen mecanismos de transporte específicos para substratos tales como glucosa, Hobbie (1966) ha sugerido que la actividad bacteriana podria ejercer algún tipo de control sobre la concentración de DOC en la columna de agua. Wood (1970) planteó la hipótesis que en aguas someras, en sistemas bien mezclados, la actividad de las bacterias del sedimento controlan la cantidad de DOC en la columna de agua. La reducción de la actividad en el sedimento también podría deberse a diversos factores ambientales. Las bacterias de la capa superior del sedimento, específicamente en aguas someras y bien mezcladas, como es el caso, de isla Iona, están bajo el efecto de fuertes tensiones, considerando que esta es una región intermareal, lo cual puede influir el estado metabólico de estas poblaciones. Una gran diferencia entre aguas someras y aguas profundas, es la mayor estabilidad de esta última. Los cambios ambientales en el sedimento marino, en aguas someras pueden ser drásticos con relación a factores tales como luz, temperatura y salinidad, los cuales pueden influir el estado metabólico de los microbios. Un factor adicional que podría afectar la incorporación de substratos y por lo tanto el estado metabólico podría ser la concentración de oxígeno. Sin embargo, Hall et al. (1972), midieron la incorporación de glucosa a dos concentraciones (72 y 288 Ptg/1) bajo condiciones aeróbicas (11.4 Ing 02/1) y anóxicas (0.38 mg 0,/1) y ellos encontraron que incorporación y mineralización fueron casi identicos bajo estas condiciones, indicando con esto que el oxígeno, no afectó de forma inmediata la incorporación de solutos. Sin embargo, prolongadas condiciones anóxicas podría probablemente influir las actividades heterotróficas. Otro factor que podría ayudar a explicar el hecho que las bacterias del sedimento tienen actividades heterotróficas más bajas que sus contraparte del agua suprayacente es la naturaleza física del menstruo. El ritmo de difusión de los metabolitos hacia las células y la difusión de productos de desecho desde las células en sedimentos probablemente seria menor que para aquellas en el agua. Los valores de Kt + Sn tanto para glucosa como para alanina fueron similares en el agua y en el sedimento, sin embargo los, valores de DOC en sedimentos son aproximadamente un orden de magnitud superior que en el agua suprayacente. Si estos dos compuestos, glucosa y alanina son representativos de las cantidades relativas de materia orgánica no refringente en ambos habitats, entonces el total del carbón orgánico disuelto (DOC) puede ser más resistente a la asimilación o metabolización por parte de los microorganismos en el sedimento. Dietz et al. (1976), encontraron que la actividad heterotrófica por CFU también fue mayor en el plancton, cuando esta comparacin es hecha con el neuston, debido a que el área superficial es reconocida como un medio bastante desfavorable para las bacterias debido a factores, tales como, intensa radiación solar potencial de óxido-reducción alto y tensión superficial bastante alta. "La incorporación de solutos, por parte del sistema de sedimentos en suspensión provee una información comparativa útil acerca de como diversos parámetros afectan la incorporación y las variaciones relativas en fluctuación estacional, pero la estructura física del sedimento es destruida y los valores obtenidos no pueden ser directamente aplicados a la comunidad béntica intacta" (Hall et al., 1972). 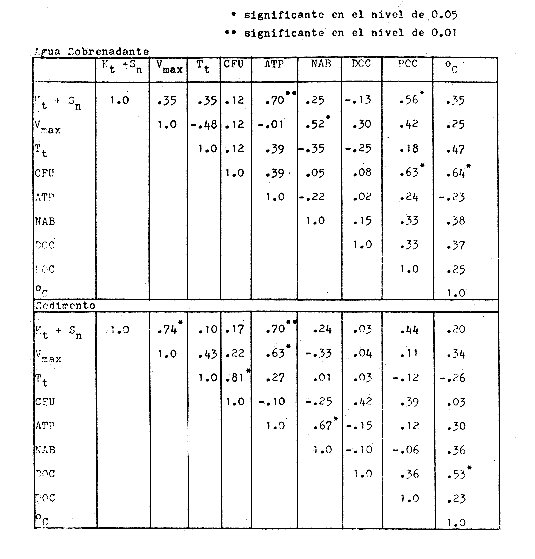 TABLA 4. COEFICIENTES DE CORRELACIÓN PARA LAS RELACIONES ENTRE LAS VARIABLES ESTUDIADAS EN EL AGUA SUPRAYACENTE Y EL SEDIMENTO DE ISLA IONA USANDO GLUCOSA COMO SUBSTRATO (VER TEXTO PARA DEFINICIONES Y ABREVIACIONES). Coeficientes de correlación (r) fueron calculados para todas las variables examinadas cuando la glucosa fue usada como substrato en el estudio de actividad heterotrófica. En la mayoría de los casos los coeficientes de correlación fueron bajos, aunque se observó una correlación significante en algunos casos. Asi por ejemplo, el valor r entre glucosa-Vmax y Kt + Sn para el sedimento de isla Iona fue .74 (Tabla 4). Existe la tendencia que el número de bacterias que metabolizan activamente la glucosa sea proporcional a Vmax y a Kt + Sn en el agua suprayacente, mientras que solo la actividad heterotrófica y la concentración de glucosa tuvieron una correlación significativa en el sedimento. Meyer-Reil (1978) también estudió fluctuaciones e interacciones de varios parámetros micriobiológicos en sedimentos y en agua suprayacente en tres lugares del mar Báltico. El encontró que había una relación significativa entre el número de células bacterianas y la concentración de glucosa y el ritmo, de incorporación tanto en el agua suprayacente como en los sedimentos. ConclusionesEste estudio ha revelado que tanto la biomasa bacteriana como los potenciales heterotróficos para glucosa y alanina son mayores en el sedimento que en el agua suprayacente. Sin embargo, cuando la comparación se hace sobre la base de unidad celular, se demuestra que las céulas bacterianas del agua suprayacente son más activas que aquellas de la capa superficial del sedimento. Esto puede ser una función de la estructura física asi como también de la cantidad de nutrientes, disponibles en los dos medios. AgradecimientosLa presente investigación fue posible gracias al financiamiento del Consejo Nacional de Investigación de Canadá. LITERATURAALBRIGHT, L. J., y J. W. WENTWORTH Use of the heterotrophic technique as a measure of eutrophication. Environ. Pollut. 1973 59-72 5 AZAM, F., y O. HOLM-HANSEN Use of tritiated substrates in the study of heterotrophy in seawater. Mar. Biol. 1973 191-196 23 BANCROFT, K., E. A. PAUL, y W. J. WIEBE The extraction and measurement of Adenosine Triphosphate from marine sediments. Limnol. Oceanogr. 1976 473-480 21 BASERGA, R., y D. MALAMUD Modern methods in experimental pathology. Autoradiography Techniques and aplications. Hoeber Medical Division, Harper & Row Publisher. Nueva York 1969 235 p. BODUNGEN, VON B., K. VON BROCKEL; V. SMETACEK y B. ZIETSCHEL Ecological studies on the plankton in Kiel Bight. I. Phytoplankton Merentutkimuslalt. Julk. (Havsforsk. Inst. Skr. Helsingf.) 1975 179-186 239 BURNISON, B. K., y R. Y. MORITA Heterotrophic potential for amino-acid uptake in a naturally eutrophic lake. Appl. Microbiol. 1974 488-495 27 DIETZ, A. S., L. J. ALBRIGHT, y T. TUOMINEM Heterotrophic activities of bacterioneuston and bacterioplankton. Can. J. Microbiol. 1976 1699-1709 22 DREW, G. H. Report of investigations on marine bacteria carried on at Andros Island. Yearbooh Carnegie Inst. Washington 1912 136-154 11 ERNST, W., y H. GOERKE Adenosin-Y-triphosphate (ATP) in Sedimenten und Nematoden der nordostatlantishen Tiefsee. Meteor Forschungerberg. Reiche D. Biol. 1974 35-42 18 GRIFFITHS, R. P., F. J. HANUS, y R. Y. MORITA Applicability of the reverse flow filter technique to marine micobial studies. Appl. Microbiol. 1973 687-691 26 HALL, K. J., P. M. KLEIBER Y I. YESAKI Detritus and its role in aquatic ecosystems. Heterotrophic uptake of organic solutes by microorganisms in the sediment. Mem. Ist. Ital. Idrobiol. 1972 441-471 29 (Suppl) HAMILTON, R. D., y O. HOLM-HANSEN Adenosine triphosphate content of marine bacteria. Limnol. Oceanogr. 1967 319-324 12 HARRISION, M. J., R. T. WRIGHT y R. Y. MORITA Method for measuring mineralization in lake sediments. Appl. Microbiol. 1971 698-702 21 HARTWIG, E. O. Nutrients cicling between the water column and a marine sediment. I. Organic carbon. Mar. Biol. 1976 285-295 34 HOBBIE, J. E. H. L. Colterman y R. S. Clyme, Chemical Environment in the Aquatic Habitat. Glucose and acetate in freshwater: Concentration and tunrover rates. Kon. Ned. Akad. Weten Amsterdam Holanda 1966 245-251 HODSON, R. E., O. HOLM-HANSEN y F. AZAM Improved methodology for ATP determination in marine environments. Mar. Biol. 1976 134-149 34 HOLM-HANSEN, O. Detritus and its role in aquatic ecosystems. The distribution and chemical comnosition of particulate material in marine and freshwaters. Mem. Ist. Ital. Idrobiol. 1972 37-51 29 Suppl. HOLM-HANSEN, O. y H. W, PEARL Detritus and its role in aquatic ecosystems. The applicability of ATP determination for estimation of microbial biomass and metabolic activity. Mem. Ist. Ital. Idrobiol. 1972 149-168 29 Suppl. HOLM-HANSEN, O. y C. R. BOOTH The measurement of adenosine triphosphate in the ocean and its ecological significance. Limnol. Oceanogr. 1966 510-519 11 HOPPE, H. G. Determination and properties of of actively metabolizing heterotrophic bacteria in the sea, investigated by means of micro-autoradiography. Mar. Biol. 1976 291-302 36 JANNASCH, H. W. Studies on planktonic bacteria by means of a direct membrane filter method. J. Gen. Microbiol. 1958 609-620 18 --, Estimations of bacterial growth rates in natural waters. J. Bacteriol. 1969 156-160 99 JOHNSON, R. W. y J. CALDER Early diagenesis of fatty acids and hydrocarbon in a salt marsh environment. Geochim. Cosmochim. Acta 1973 1943-1945 37 KARL, D. M. y P. LAROCK Adenosine triphosphate in soil and marine sediments. J. Fish. Res. Bd. Can. 1975 599-607 32 KARL, D. M., P. A. LAROCK, J. W. MORSE y W. STURGES Adenosine triphosphate in the North Atlantic Ocean and its relationship to the oxygen minimum. Deep Sea Res. 1976 81-88 23 LEE, C. C., R. R. HARRIS, J. D. H. WILLIAMs, D. E. ARMSTRONG y J. K. SYERS Adenosine triphosphate in lake sediments: I. Determination. Soil Sci. Soc. Am. Proc. 1971 a 82-86 35 ---, Adenosine triphosphate in lake sediments, 2. Origen and significance. Soil Sci. Soc. Am. Proc. 1971 b 86-91 35 LITCHFIELD, C. Interactions of amino acids and marine bacteria. L. H. Stevenson and R. R. Colwell. Estuarine microbial ecology. Columbia S. C. University of South Carolina Press 1973 145-168 LLOYD, B. Muds of the clyde area, II. Bacterial content. J. Mar. Biol. Assoc. U. K. 1931 751-765 17 MEYER-REIL, L. A. Uptake of glucose by bacteria in the sediment. Mar. Biol. 1978 293-298 41 PARSONS, T. R. y J. D. H. STRICKLAND On the production of particulate organic carbon by heterotrophic processes in the sea. Deep Sea Res. 1962 211-222 8 PERONI. C. y O. LAVARELLO Microbial activities as a function of water depth in the Ligurian sea: an autoradiographic study. Mar. Bio. 1975 37-50 30 ROMEROY, L. R., L. R. SHENTON, R. D. H. JONES Y R. J. REIMOLD Nutrient flux in estuaries. Limnol. Oceanoor. 1972 274-291 1 REUSZER, H. W. Marine bacteria and their role in the cycle of life in the sea. III, Distribution of bacteria in the ocean waters and muds about Cape Cod. Bio. Bull. 1933 480-497 65 RITRENBERG, S. C. Bacteriological analysis of some long cores of marine sediments. J. Mar. Res. 1940 191-201 3 SEKI, H. Relation between production and mineralization of organic matter in Aburatsubo Inlet. J. Fish. Res. Bd. Can. Japan 1968 625-637 25 SEKI, H., J. SKELDING y T. R. PARSONS Observations on the decomposition of a marine sediment. Limnol. Oceanogr. 1968 440-447 13 SMETACEK, V., B. VON BODUNGEN, K. VON BROCKEL y B. ZEITSCHEL The plankton tower. II. Release of nutrients from sediments due to change in the density of bottom water. Mar. Biol. 1976 373-378 34 STEPHENS, K., R. W. SHELDON y T. R. PARSONS Seasonal variations in the availibility of food for benthos in a coastal environment. Ecology 1967 852-855 48 VACCARO, R. R, S. E. HICKS, H. W. JANNASCH y F. G. CAREY The occurence and role of glucose in seawater Limnol. Oceanogr. 1968 356-366 13 VACCARO, R. F. y H. W. JANNASCH Studies on heterotrophic activity in seawater based on glucose assimilation. Limnol. Oceanogr. 1966 596-607 11 WOOD, L. W. Ph. D. Thesis The role of estuarine sediment microorganisms in the uptake of organic solutes under aerobic conditions. Dept., de Zoologia, Universidad del Estado de Carolina del Norte Estados Unidos de Norteamérica. 1970 WRIGHT, R. T. y J. E. HOBBIE The uptake of organic solutes in lake water. Limnol. Oceanogr. 1965 22-28 10 ZHUKOVA, A. L, y M. V. FEDESOV Significance of microorganisms of upper sediment layer of shallow water basin in transformation of organic matter. Carl H. Oppenheimer. Charles C. Thomas Publisher. Marine Microbiology. 1963 699-710 963 ZOBELL, C. E. Studies on the bacterial flora of marine bottom sediments. J. Petrol. 1938 10-18 8 ---, Marine Microbiology. Chronica Botanica. Waltham, Massachusetts Estados Unidos de Norteamerica 1946 240 p. ZOBELL, C. L, y D. Q. ANDERSON Vertical distribution of bacteria in marine sediments. Bull. Amer. Ass. Petrol. Geol. 1936 258-269 20 ZOBELL, C. E. y C. B. FELTHAM The bacterial flora of a marine mud flat as an ecological factor. Ecology 1942 69-78 23
|

