|
CICLO REPRODUCTIVO, PROPORCIÓN
SEXUAL Y FECUNDIDAD DEL CORAL BLANDO PLEXAURA HOMOMALLA (ESPER.) EN EL MAR
CARIBE MEXICANO. (OCTOCORALLA: PLEXAURIDAE)
Trabajo recibido el 31 de
marzo de 1981 y aceptado para su publicación el 5 de noviembre de
1981.
EDUARDO MARTIN CH.
Universidad Nacional Autónoma de México, Instituto
de Ciencias del Mar y Limnología. Contribución 286 del Instituto
de Ciencias del Mar y Limnología, UNAM.
Con el fin de
conocer la dinámica del proceso reproductivo del coral blando
Plexaura homomalla en la parte norte de la barrera arrecifal
del Mar Caribe mexicano, se estudiaron el ciclo reproductivo, la
proporción sexual y la fecundidad.
Asimismo, se
buscaron variaciones en el comportamiento reproductivo de P.
homomalla en tres localidades escogidas a lo largo de 50 km. de
barrera arrecifal, en zonas físicamente separadas entre si.
Se tomaron muestras a intervalos de 4 a 5 semanas durante 14 meses,
de 40 colonias (20 de cada sexo), las cuales fueron procesadas en el
laboratorio utilizando técnicas histológicas
ordinarias.
Se encontró que el ciclo reproductivo es
anual y presenta la época de reproducción en los meses de julio y
agosto; el periodo de formación y maduración de las
gónadas femeninas es relativamente largo (ca 18
meses) mientras que el de las gónadas masculinas es más corto (de
6 a 8 meses); se sugiere que la fecundación es externa. La madurez
sexual se alcanza entre los 4 y 11 años y no se observa un proceso de
senectud sexual en colonias mayores de 35 años.
Se
verificó que los sexos están separados y que la proporción
de éstos es 1: 1. La fecundidad de una colonia hembra promedio en edad
reproductiva se estimó en 1.97 ± 0.26 óvulos por
pólipo por ciclo reproductivo y por último, no se encontraron
diferencias significativas en el comportamiento reproductivo de las colonias de
las 3 localidades estudiadas, por lo que se consideran de una misma
población en lo que a este aspecto se refiere.
The reproductive cycle, sex ratio and fecundity of the soft coral
Plexaura homomallawere studied in the northern part of
Mexican Caribbean barrier reef. In order to find possible variations in the
reproductive behaviour of P. homomalla, 3 sampling sites
with different envorinmental conditions were selected.
Samples were taken monthly during 14 months from 40 colonies (20 each sex);
this samples were processed in the laboratory using ordinary histological
technics.
It was found that the reproductive cycle is annual
with the breeding season in july and august, the ovogenesis is relatively long
(ca 18 months) while spermatogenesis is shorter (6 to 8 months); external
fecundation is suggested. Sex maturation is reached between 4 and 11 years and
no signs of senility was observed in big colonies (older than 35 years). The
species is dioic and the sex ratio of the population is 1: 1, and fecundity of
a female colony in reproductive age was estimated at 1.97 ± 0.26 eggs/
polyp/reproductive cycle. Finally, as far as its reproductive behavior is
concerned, no significant differences were found between them, so the colonies
of the 3 zones are considered of the same population.
En los estudios sobre arrecifes coralinos, los escleractinios han sido los que mayor atención ,han recibido dejando a un lado a los alcionarios, a pesar de que estos constituyen un elemento muy conspicuo de la fauna arrecifal. Sin embargo, actualmente se ha puesto mayor interés en el estudio de estos organismos debido a su importancia dentro de la comunidad arrecifal por una parte, y por la otra, debido a la presencia de varias especies de importancia económica para el hombre dentro del grupo. En este sentido, el octocoralPlexaura homomalla (Esper.) ha recibido especial atención a raíz del descubrimiento de prostaglindinas en su coenenquima, convirtiéndose en un recurso marino de gran importancia farmacéutica. Cabe señalar que esta especie es un habitante común de las aguas someras de algunos arrecifes coralinos de la región zoogeográfica del Caribe y es relativamente abundante en la barrera arrecifal que corre a lo largo de las costas del estado de Quintana Roo (Jordán, 1978); actualmente, el Laboratorio de Ecología Costera del Centro de Ciencias del Mar y Limnología de la UNAM está realizando un estudio global acerca de la biología y dinámica poblacional de la especie en dicha zona. Así, el presente trabajo que forma parte de dicha investigación, tiene como objetivo el conocer la dinámica del proceso reproductivo de dicha especie a través del estudio de 3 aspectos que se consideran básicos para el entendimiento de este proceso, los cuales son: ciclo reproductivo, determinando la época de reproducción, la edad de maduración y senectud sexual y la sincronía en el desarrollo de las gónadas, proporción sexual y fecundidad. Asimismo, dada la distribución discontinua de P. homomalla a lo largo de la zona de estudio (Jordán, Op. Cit.), resultado de las condiciones ambientales diferentes de las zonas en donde se encuentra densamente representada, se buscó estimar las posibles diferencias que en los parámetros antes mencionados pudiera haber entre 3 secciones arrecifales con condiciones ambientales contrastantes, dentro del intervalo de tolerancia de la especie. ANTECEDENTESA pesar de la importancia de los corales dentro de la comunidad arrecifal, éstos han sido muy poco estudiados particularmente en lo que se refiere a su reproducción. Connell (1973) hace una recopilación de los trabajos sobre biología reproductiva de hexacorales como parte de una revisión general sobre los conocimientos en ecología poblacional de estos organismos. Una buena parte de estos trabajos ha sido hecha en especies del Pacífico, y están enfocados principalmente al estudio del desarrollo larval y postlarval, y a la época de mayor actividad reproductiva. En muy pocos se estudian aspectos como fecundidad y solamente Marshall y Stephenson (1933; in Connell, 1973), en la gran barrera australiana, Abe (1937) en Palao y recientemente Grigg (1976) en Hawaii, han realizado estimaciones de la edad de maduración sexual en especies de hexacorales. Por el contrario, hasta la fecha no se conoce en la literatura ningún trabajo que reúna los conocimientos en biología de la reproducción para el grupo de los octocorales y la poca información existente es en su mayoría anterior a 1970. Uno de los primeros investigadores en ocuparse de la reproducción de estos organismos es Lacaze-Duthiers (1865) quien hace una breve descripción de las glándulas genitales de diversas especies de alcionarios del Mediterráneo. Ya en el siglo XX Cary (1914), en un estudio sobre la ecología de los gorgónidos de Florida hace algunas observaciones sobre el desarrollo de gónadas, planulación e implantación de plánulas de Plexaura flexuosa. Más recientemente, Gohar (1940; Grigg, 1970) y Gohar y Roushdy (1961) estudian el desarrollo y formación de células genitales en algunas especies de la familia Xenúdae en el mar Rojo; Theodor (1967) estudia en condiciones de acuario, la planulación y comportamiento larval de Eunicella stricta; Vighi (1970), estudia el ciclo reproductor y proporción sexual de tres poblaciones deCorallium rubrum en el Mediterráneo. Así mismo, Grigg (1970), analiza varios aspectos de la biología reproductiva de dos especies de Muricea en California haciendo el primer trabajo demográfico en una especie coralina y Kinzie (1970) en Jamaica realiza estudios del ciclo reproductor y ecología larval dePseudopterogorgia bipinnata, y planulación en otros gorgonáceos como P. elizabethe, Briareum asbestinum y Muriceopsis flavida. Con respecto a Plexaura homomalla, que a pesar de la importancia que se le ha dado recientemente no constituye una excepción con respecto a otras especies de corales en relación a la poca información que se conoce de los aspectos básicos de su biología y ecología (Kinzie. 1974), el único trabajo publicado relacionado con su reproducción es el que Goldberg y Hamilton (1974) realizan en las costas de Florida, determinado únicamente el periodo reproductor de la especie. Ahora bien, es importante hacer notar que este trabajo junto con los de Kinzie (1970) y Cary (1974) son los únicos de este tipo realizados para especies del Caribe. Tenemos así, que los conocimientos sobre la biología reproductiva de P. homomalla se limitan al trabajo ya mencionado de Goldberg y Hamilton, a un estudio (no publicado aún) realizado en la costa norte de Cuba por investigadores del Instituto Oceanográfico de La Habana (Jordán, comunicación personal) y a un estudio de Bayer (1974) sobre la anatomía e histología de dicha especie en el que se incluye una revisión del desarrollo de los gónadas. ÁREA DE ESTUDIOEl presente trabajo se realizó en el extremo norte de la barrera arrecifal que se extiende a lo largo del litoral caribeño quintanarroense. La zona de estudio se localiza entre los 20°40' y los 21°02' de latitud Norte y a los 86°51' de longitud Oeste, abarcando cerca de 50 km. de barrera a lo largo de los cuales se eligieron 3 zonas de observación permanente (estaciones de muestreo) que de sur a norte corresponden a Punta Maroma, Puerto Morelos y Punta Nizuc en el límite norte de la barrera arrecifal (Fig. 1). Es importante hacer notar que entre las tres estaciones se presentan "roturas" o discontinuidades en la barrera que varían en longitud y van desde unos cuantos metros hasta varios kilómetros, lo que origina que cada estación constituya una unidad físicamente separada de las demás. De acuerdo con la división que hace Jordán (1980) del perfil arrecifal de este arrecife, cada estación comprende solamente una parte del perfil; en Nizuc y Puerto Morelos el muestreo se realizó en la zona posterior, mientras que en Punta Maroma se realizó en la zona frontal (5 m). 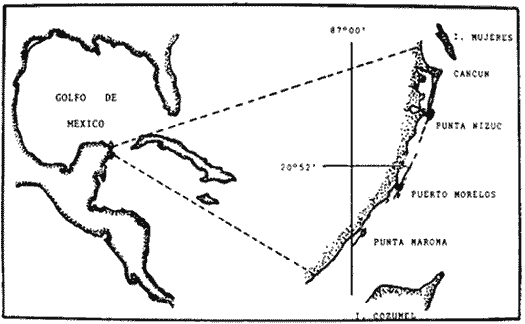 Fig. 1. Localización del área de estudio y situación geográfica de las 3 estaciones de muestreo: Punta Nizue, Puerto Morelos y Punta Maroma. MATERIAL Y MÉTODO
METODOLOGÍA Y MATERIAL DE CAMPOEl trabajo submarino se realizó con buceo libre y ocasionalmente con equipo SCUBA en los muestreos de la estación Punta Maroma. Ciclo reproductivo Se determinó a través de la observación a lo largo de 14 meses de 40 colonias sexualmente maduras de Plexaura homomalla de uno y otro sexo, las cuales fueron debidamente marcadas y localizadas. Estas colonias se repartieron en las estaciones de muestreo de la siguiente manera: Punta Maroma y Punta Nizuc, 5 colonias hembra y 5 colonias macho; y Puerto Morelos, 10 colonias hembra y 10 colonias macho. El muestreo de estas colonias se realizó a intervalos de 4 a 5 semanas durante los primeros 12 meses y cada 10 a 15 días en los 2 últimos (julio-agosto de 1980). De cada colonia se cortaron 3 extremos apicales de aproximadamente 3 cm de largo escogidos al azar y de 3 ramas diferentes, procedimiento que ha sido utilizado por Grigg (1970) y Vighi (1970) en otras especies de alcionarios. Todas las muestras se fijaron en Bouin inmediatamente después de ser tomadas, manteniéndose en éste durante un periodo de 3 a 4 días a fin de lograr la descalcificación parcial del coral. Sincronía En especies con ramificaciones laterales profusas (como es el caso deP. homomalla), la relación biomasa-superficie es mucho mayor en las ramificaciones secundarias y extremos apicales que en la región basal del tronco y dado que existe una relación directa entre la superficie y el número de pólipos, tenemos que la mayor parte de estos se encuentra en las ramas, por lo que se consideró que lo observado en los pólipos de extremos apicales es representativo de lo que sucede en toda la colonia. Sin embargo, se realizaron estimaciones para cuantificar una posible sincronía gametogénica en los pólipos de colonias de P. homomalla, considerando la distribución vertical de éstos. Edad de maduración y senectud sexual La talla en que P. homomalla alcanza la madurez sexual se determinó a través del análisis gonádico de 25 colonias de diferentes alturas cubriendo un intervalo de 7 a 50 cm de altura, muestreadas durante la época de mayor actividad reproductiva. A fin de determinar un posible proceso de senectud sexual en la especie, se observó el comportamiento reproductivo de 6 colonias de gran talla. Estas colonias -3 de cada sexo- forman parte de las 20 sometidas a observación periódica en la estación Puerto Morelos. Proporción sexual Se estimó a través del análisis gonádico de un número elevado de colonias (N = 72 en Nizuc, N = 98 en Puerto Morelos, N = 66 en Maroma) sexualmente maduras (de tamaño medio a grande, h > 50 cm) durante el mes de julio para asegurar que se encontraran en actividad reproductiva. La elección de las colonias se realizó mediante un muestreo al azar, siguiendo tres transectos imaginarios paralelos a la rompiente, de longitud y separación variable dependiendo de la estación de muestreo. De cada colonia se colectaron al azar, dos extremos apicales de aproximadamente 5 cm de largo, en ramas diferentes, los cuáles fueron sometidos al mismo tratamiento de fijación antes mencionado. Fecundidad En este trabajo, la fecundidad se refiere al nivel potencial reproductor de un pólipo de una colonia hembra (óvulos maduros por ciclo reproductivo) y se estimó en las mismas colonias y muestras en las que se siguió el cielo reproductivo. METODOLOGÍA Y MATERIAL DE LABORATORIOUna vez fijadas las muestras, se conservaron en alcohol al 70% y posteriormente fueron tratadas mediante técnicas histológicas ordinarias con el fin de obtener secciones transversales de una parte del coenénquima de la colonia (Vighi, 1970; Bayer, 1974; Grigg, 1976). De esta manera se obtuvieron cortes transversales de algunos pólipos de la colonia (Lám. 1), los cuales se observaron bajo un microscopio Swift con ocular graduado. Las secciones se prepararon con la ayuda de un microtomo Swift para inclusiones en parafina; se hicieron los cortes a un grosor de 10 micras y a varios niveles de los pólipos, habiendo preparado 4 secciones por extremo apical lo que significa un total de 12 secciones por muestra. Todas estas secciones se tiñeron con la técnica de hematoxilina-eosina. Ciclo reproductivo Se consideró el tamaño de las gónadas como un índice adecuado de la relativa madurez reproductiva de una colonia (Giese y Pearse, 1974; Grigg, 1976). Ahora bien, con el fin de obtener el crecimiento máximo promedio por mes de las gónadas, se midieron solamente las estructuras reproductoras más grandes presentes en cada muestra. A fin de estandarizar la obtención del "tamaño máximo de gónada" se midieron las 4 más grandes de cada "ramita" en las mejores secciones de las 12 obtenidas por muestra, lo que representa un total de 12 gónadas por colonia y 240 por mes (120 por cada sexo) para la estación de Puerto Morelos y 120 (60 por cada sexo) para cada una de las estaciones de Punta Nizuc y Punta Maroma. Es importante mencionar que cada sección de una "ramita" comprende alrededor de 20 pólipos, lo que representa la observación de aproximadamente 60 pólipos por colonia, para la obtención del tamaño máximo de gónada. El tamaño de las estructuras sexuales se consideró como el promedio entre el diámetro mayor y el diámetro perpendicular a éste. Asimismo, se midieron todas las gónadas presentes en 4 pólipos (escogidos al azar) por "ramita haciendo un total de 12 pólipos por colonia, en las secciones obtenidas para los meses de julio, agosto, septiembre y noviembre de 1979 y enero, marzo y mayo de 1980, con el fin de determinar en que momento se inicia y cuál es el tiempo de duración de la ovogénesis en las colonias hembra de la estación Puerto Morelos. Sincronía Se estimó el "tamaño máximo de gónada" en las secciones obtenidas de las muestras del 16 de julio de 1980, para pólipos de extremos apicales y de partes básales de las colonias en observación periódica de la estación Puerto Morelos. Edad de maduración Se prepararon secciones de las 25 colonias muestreadas determinándose para cada colonia el "tamaño máximo de gónada" de la misma manera explicada anteriormente. Proporción sexual El sexado de las colonias se hizo por observación directa de las gónadas determinándose así, la presencia de óvulos o espermarios en la muestra. Fecundidad De las secciones obtenidas de las muestras del mes de julio de 1979 se eligieron 30 pólipos al azar (10 por "ramita") por cada colonia; se cuantificó el numero de éstos que no presentaban gónadas con el fin de determinar el porcentaje de pólipos infértiles en una colonia, y por otro lado, para el caso de las colonias hembra se contó el número de gónadas maduras presentes en cada pólipo, obteniéndose de esta manera una estimación del número promedio de óvulos por pólipo antes de la fecundación. Para obtener este promedio por colonia, se cuantificó de manera indirecta el número de pólipos que posee un individuo deP. homomalla de mediana talla. RESULTADOS Y DISCUSIÓN
CONDICIÓN SEXUALEn el análisis gonádico de más de 2500 pólipos de aproximadamente 250 colonias de Plexaura homomalla, no se observó ningún caso de hermafroditismo y la observación a lo largo de 14 meses de 40 de estas colonias, no reveló cambios de la condición sexual de ninguna de ellas, lo que excluye un hermafroditismo secuencial. Estas observaciones refuerzan lo propuesto por Bayer (1974) y Goldberg y Hamilton (1974) de que esta especie es dioica, concordando con el patrón observado en otros alcionarios (Lacaze-Duthiers, 1865; Theodor, 1967; Grigg, 1970; Kinzie, 1970; Vighi, 1970). CICLO REPRODUCTIVOEn las figuras 2 a 4 se observa que el ciclo reproductivo de Plexaura homomalla es anual y asimismo se puede apreciar que no hay diferencias significativas en el curso de éste, entre las colonias de las 3 estaciones de muestreo. Esta periodicidad en el ciclo reproductivo de P. homomalla ya ha sido reportada para una población de los Cayos de Florida (Goldberg y Hamilton, 1974) y para otra población de P. homomallaforma kukenthalli de la costa norte de Cuba (jordán, comunicación personal). Sin embargo, se encontraron diferencias entre estas 3 poblaciones en relación a la época de reproducción así como en la velocidad de maduración de las gónadas. Estas diferencias se discuten más adelante. Desarrollo de las gónadas femeninas Los óvulos alcanzan su máxima talla (315 a 640µ) en el mes de agosto (Figs. 2 a 4), y para el mes de septiembre todas las gónadas mayores de 200 µ han desaparecido, lo que indica que es en este periodo cuando se lleva a cabo la reproducción y el desove. El nuevo grupo de óvulos inmaduros (apenas superiores a las 100 µ) que se hace evidente en el mes de septiembre parece originarse varios meses antes del periodo reproductivo y el hecho de que sea un grupo de tamaño definido excluye la posibilidad de que se trate exclusivamente de óvulos en reabsorción, proceso comúnmente observado poco antes, durante y poco después de la reproducción (Grigg, 1970). Este nuevo grupo de gónadas, crece a un ritmo más o menos constante durante los 8 meses siguientes al desove (Lám. 2); a partir de junio se aprecia un aumento considerable en el ritmo de crecimiento, que culmina en agosto al alcanzar la talla máxima, repitiéndose nuevamente el ciclo. 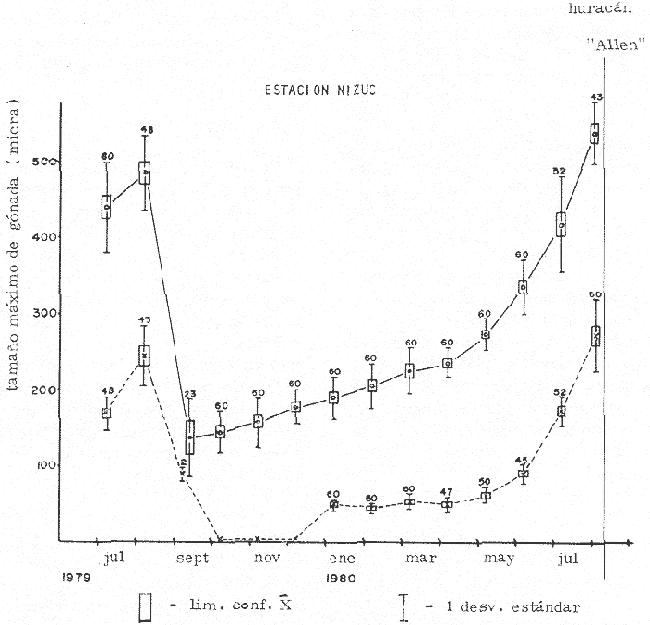 Fig. 2. Crecimiento de las gónadas (o) y (x) de las colonias en observación periódica de la estación Puerto Morelos, durante el periodo julio-1979 a julio-1980. La línea continua une las medias mensuales del tamaño máximo de los óvulos y la línea punteada une las medias mensuales del tamaño máximo de los espermarios. El número sobre cada barra representa el total de gónadas medidas por mes. 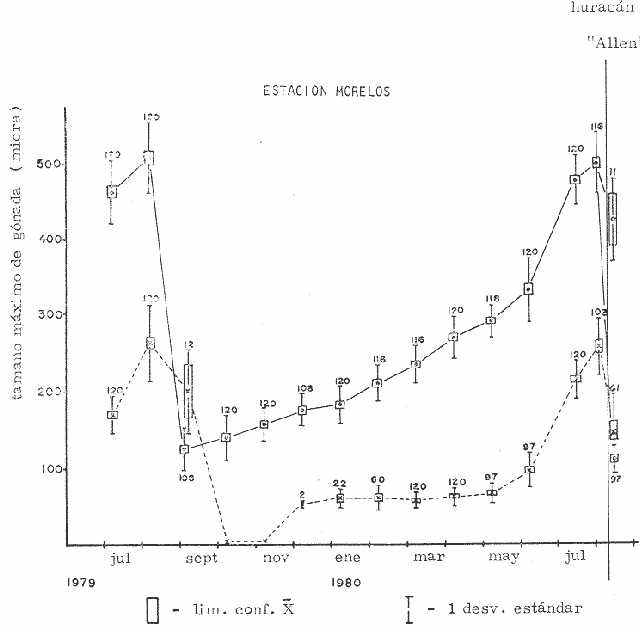 Fig. 3. Crecimiento de las gónadas (o) y (x) de las colonias en observación periódica de la estación Punta Nizuc, durante el periodo julio-1979 a julio-1980. La línea continua une las medias mensuales del tamaño máximo de los óvulos y la línea punteada une las medias mensuales del tamaño máximo de los espermarios. El número sobre cada barra representa el total de gónadas medidas por mes. El comportamiento bimodal de los histogramas de la fig. 5 (ver Fig.) confirma la coexistencia de 2 grupos diferentes de gónadas durante el periodo enero-agosto (Lám. 3) y se observa que los óvulos que se empiezan a formar en el mes de enero van a madurar hasta el próximo año lo que implica una duración del proceso de la ovogénesis de aproximadamente 18 meses. Asimismo, se aprecia durante los meses de julio, agosto, y septiembre (periodo reproductivo) que mientras el grupo de óvulos de mayor tamaño crece rápidamente, el otro de menor talla no cambia significativamente, hecho que indica un periodo de reposo (durante el mes de septiembre), típico de todo ciclo gametogénico (Giese y Pearse, 1974). 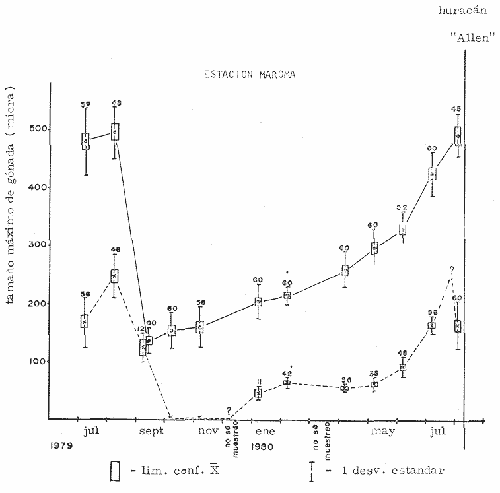 Fig. 4. Crecimiento de las gónadas (o) y (x) de las colonias en observación periódica de la estación Punta Maroma, durante el periodo julio-1979 a, julio-1980. La línea continua une las medias mensuales del tamaño máximo de los óvulos y la línea punteada une las medias mensuales del tamaño máximo de los espermarios. El número sobre cada barra representa el total de gónadas medidas por mes. Desarrollo de las gónadas masculinas Por el contrario, en las colonias macho se observa (Figs. 2 a 4) que en los meses siguientes al periodo reproductivo, desaparecen las estructuras reproductoras manteniéndose las colonias en un periodo de reposo largo (alrededor de 4 meses) que finaliza en enero, mes en el que se inicia nuevamente la producción de espermarios (Lám. 4). Se observa que la formación de éstos continúa hasta el mes de abril, tiempo durante el cual no se aprecian cambios significativos en el tamaño de las gónadas. Para el mes de junio ya es notorio que se ha iniciado el crecimiento de los espermarios que continúan aumentando de tamaño a un ritmo cada vez más acelerado, hasta alcanzar su máxima talla (100 a 405 µ) en agosto (Lám. 5); en este momento se nota un adelgazamiento de la capa de gastrodermis que rodea a los espermarios, y en algunos casos se observa una luz central hacia la cual convergen las células desde la periferia en hileras bien formadas. Según Bayer (1974) los espermatozoides se encuentran cercanos a la pared del espermario, y el adelgazamiento de ésta es un indicio de madurez y por lo tanto de la proximidad de la expulsión de los gametos (Grigg, 1970). Para el mes de septiembre (en 1979) solamente 6 de las 20 colonias macho observadas periódicamente poseen todavía algunos espermarios de menor tamaño que en el mes anterior, lo que hace suponer que se encuentran en pleno proceso de reabsorción (Bayer, 1974); de la descripción anterior se desprende que la formación y maduración de los espermarios lleva de 6 a 8 meses. 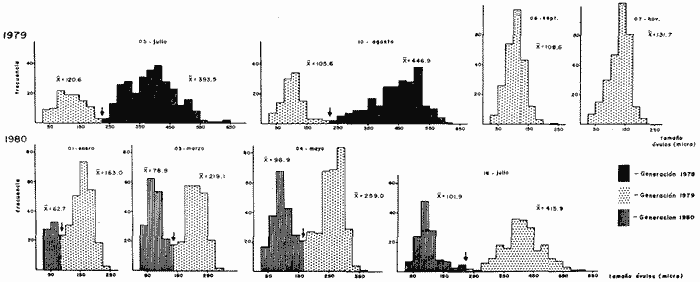 Fig. 5. Histogramas de la distribución de frecuencias del tamaño de los óvulos de 120 polipos muestreados en 10 colonias 9 (12 polipos/colonia) en observación periódica de la estación Puerto Morelos, durante el periodo julio-1979 a mayo 1980. Las flechas indican el punto en el que se separaron los dos grupos para obtener las medias de cada uno de estos. Periodo reproductivo Se encontró que el periodo reproductivo de Plexaura homomalla queda comprendido entre los meses de julio y agosto (Figs. 2 a 4) y que este periodo tiene una duración relativamente corta, extendiéndose cuando mucho por 20 a 25 días. Giese y Pearse (1974) refiriéndose al patrón observado en invertebrados marinos en general, mencionan que este periodo dura normalmente más de un mes y Grigg (1970) reporta que paraMuricea californica yM. fruticosa se extiende por varios meses. El hecho de que en P. homomallaeste evento sea relativamente corto podría indicar un desove masivo ("epidemic spawning", Thorson, 1950), en el cual alguno de los 2 sexos vierte primero los gametos al medio estimulando de manera sincrónica el desove en el otro sexo, asegurando de esta manera la fecundación del mayor número de óvulos. Este mecanismo es característico de organismos con fecundación externa, lo que sugiere que en P. homomalla la fecundación se lleva a cabo en el medio; esto estaría apoyado además por el hecho de que no se observaron ni huevos en segmentación, ni estructuras que pudieran considerarse como plánulas en ninguna sección histológica realizada a lo largo de este estudio. Esto mismo es reportado por Bayer (1974) quien hace hincapié en la ausencia de las estructuras antes mencionadas, durante la época de mayor actividad sexual de esta especie en Florida. Ahora bien, de tener P. homomalla fecundación interna, ésta tendría que estar seguida de un rápido desarrollo y expulsión de la larva, consideración que se estima poco probable (Connell, 1973), ya que a pesar del muestreo intensivo durante la época de mayor actividad reproductiva, no se observan indicios de fecundación interna. Sincronía Se consideró que de haber una asincronía en la maduración de las gónadas entre los pólipos de extremos apicales y de la región basal, ésta se vería reflejada como una diferencia entre los tamaños máximos de gónada de ambos grupos de pólipos. Las observaciones a este respecto son las siguientes: para las colonias macho no se encontraron diferencias significativas (t = 1.76, p ~ 0.10) en el tamaño máximo de gónada entre ambos grupos de pólipos. Ahora bien, con respecto a las colonias hembra se observó que en 4 de ellas no hay diferencias significativas (t = 0.41, p > 0.50; t = 0.73, p ~ 0.50; t = 1.01, p ~, 0.20; t = 0.23, p » 0.50) entre los óvulos de ambos grupos de pólipos, mientras que en 3 de ellas si las hay (t = 3.60, p ~ 0.001, t = 3.89, p ~ 0.001; t = 3.71, p < 0.001) y en otras 3 no se encontraron gónadas en los pólipos básales (hecho que se atribuye al muestreo). Dada esta variabilidad por un lado, y las pequeñas diferencias entre las medias de los tamaños máximos de gónada para ambos grupos de pólipos, no se puede asumir que exista un comportamiento distinto entre los pólipos de extremos apicales y de la región basal en relación a la maduración de los óvalos, a pesar de las diferencias estadísticas antes mencionadas. Edad de maduración y senectud sexual En la figura 6 se muestra la relación entre el tamaño máximo de gónada y la altura para 25 colonias de la estación Puerto Morelos. Como se puede apreciar, por debajo de los 25 cm la mayoría de las colonias todavía no desarrolla estructuras reproductivas observándose únicamente en 3 de ellas la presencia de gónadas que no han alcanzado aún el tamaño que para esa fecha se considera de madurez. Por arriba de los 25 cm, salvo dos colonias —una identificada como macho y la otra sexualmente indeterminada—, todas las demás han desarrollado gónadas que se consideran maduras. Es importante señalar que en una colonia hembra de 35 cm y dos colonias macho —de 26 y 18 cm— se encontraron muy pocas gónadas en unos cuantos pólipos, lo que sugiere un proceso gradual de maduración sexual de la colonia. 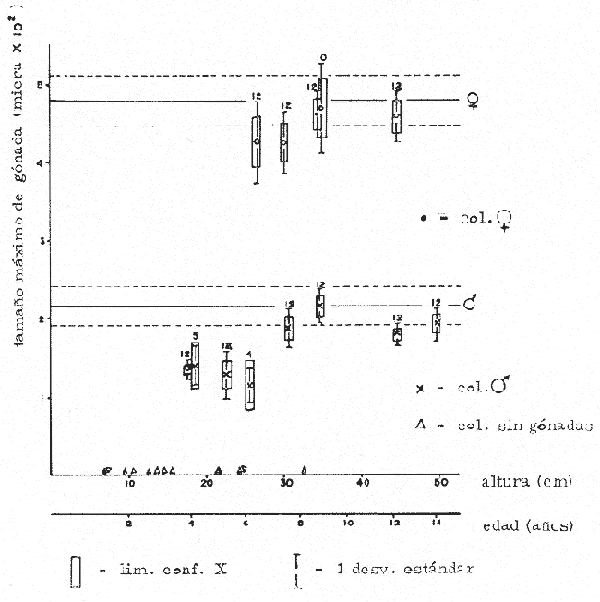 Fig. 6. Relación entre la altura y el tamaño máximo de gónada para 25 colonias de P. homomalla de la estación Puerto Morelos. Fecha del muestreo: 16 de julio de 1980. Las líneas continuas y punteadas marcan la media y la desviación estándar respectivamente del tamaño máximo de gónada obtenido en esa misma fecha para las colonias en observación periódica de la estación Puerto Morelos. El número sobre cada barra representa el total de gónadas medidas por colonia. De lo anterior se deduce que la madurez sexual en esta especie se alcanza entre los 25 y 35 cm de altura lo que representa una edad entre 4 y 11 años según Moreno et al. (1981, en revisión). Grigg (1970) reporta edades similares para Muricea fruticosa—5 años— y M. californica —10 años—, y de manera no concluyente para Corallium secundum —13 años— (Grigg, 1976); Marshall y Sephenson (1933; citado en Connell, 1973) la estiman en 8 años paraFavia doreyensis, y Abe (1937) en 10 años paraFungia actiniformis (Tabla 1). La alta tasa de mortalidad característica de los primeros años de vida de especies coralinas (Connell, 1973), sugiere que estos son críticos en la supervivencia de un individuo; durante este periodo están más expuestos a la depredación o a ser eliminados por otras especies sésiles que compiten por el sustrato. En este periodo es "muy importante" para una colonia dedicar todos sus recursos hacia el crecimiento y mantenimiento de la misma ya que en la medida que aumenta de tamaño, sus posibilidades de sobrevivencia aumentan. En el caso particular de P. homomalla, de acuerdo con Morenoet al. (1981 en revisión), se observa como es de esperarse, que entre los primeros años la tasa de crecimiento es mayor que en los años siguientes, una vez que ha alcanzado la madurez sexual. 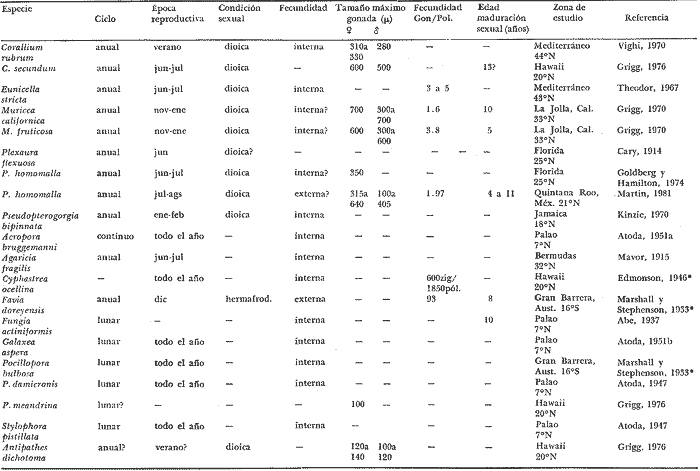 TABLA 1. CUADRO COMPARATIVO DE LA INFORMACIÓN RELACIONADA CON LA REPRODUCCIÓN (QUE SE CONOCE A LA FECHA) DE VARIAS ESPECIES DE CORALES DE DIFERENTES REGIONES. LAS REFERENCIAS CITADAS CON * FUERON TOMADAS DE CONNELL (1973) En relación a un posible proceso de senectud sexual en la especie, se consideró que este podría manifestarse de 2 formas diferentes: a) disminución en la producción de gónadas (cuantificable en las hembras) y b) cese de las actividades sexuales no produciéndose más estructuras reproductoras. En las tablas 2 y 3 se resumen los resultados de las colonias de gran talla concluyéndose lo siguiente: tanto las colonias hembra como las macho continúan sexualmente activas produciendo gónadas que se consideran maduras y en el caso de las primeras, no se aprecia un cambio significativo (t 0.37, p ~ 0.50) en la fecundidad con respecto a las colonias de mediana edad (ver más adelante), lo que sugiere que no se da un proceso de senectud sexual en la especie. Asimismo, ninguna colonia por arriba de los 35 cm de altura se encontró sexualmente indeterminada durante la época de reproducción, lo que sugiere que una vez alcanzada la madurez sexual por una colonia, ésta permanece activa reproductivamente por tiempo indeterminado. Periodicidad A partir del análisis de las gráficas de crecimiento de las gónadas masculinas y femeninas (Figs. 2 a 4) se deduce claramente la periodicidad anual del ciclo reproductivo de P. homomalla. Asimismo, se observa que la época de mayor actividad sexual ocurre durante los meses de julio y agosto. Estas observaciones difieren de lo encontrado por Goldberg y Hamilton (1974) para una población de esta misma especie en Florida (aproximadamente a 250 de lat. N, cerca ya de su límite de distribución), la cual presenta el pico de reproducción durante los meses de junio y julio, y un periodo de formación y maduración de los espermarios de sólo 4 meses, a diferencia de lo observado en la población estudiada en la que dura de 6 a 8 meses como ya se mencionó anteriormente. Estas diferencias que se observan con respecto al comportamiento reproductivo entre las 2 poblaciones se pueden interpretar como un "alargamiento" del ciclo sexual de la población estudiada por el autor, con respecto a la de Florida. En relación a los estudios realizados en Cuba se tiene poca información, pero aparentemente el comportamiento reproductivo de esa población en relación al ciclo sexual es más parecido a lo observado por el autor que a lo reportado para Florida, aunque parece ser que el ciclo es aún más largo (estacionalidad menos marcada) de lo encontrado en este estudio. Es importante señalar que los autores cubanos estudian una población de P. homomallaformakukenthalli por lo que se puede considerar como una población atípica (Jordán, comunicación personal).  TABLA 2. COMPARACIÓN ENTRE EL TAMAÑO MÁXIMO DE GÓNADA DE COLONIAS DE EDAD AVANZADA Y COLONIAS DE MEDIANA EDAD DE LA ESTACIÓN PUERTO MORELOS. FECHA DEL MUESTREO: 16 DE JULIO DE 1980 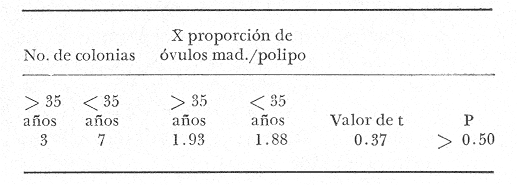 TABLA 3. COMPARACIÓN DE LA FECUNDIDAD ENTRE COLONIAS 9 DE EDAD AVANZADA Y DE MEDIANA EDAD DE LA ESTACIÓN PUERTO MORELOS. FECHA DEL MUESTREO: 16 DE JULIO DE 1979 Giese y Pearse (1974) mencionan que para especies tropicales o subtropicales marinas que se han estudiado en un amplio intervalo latitudinal, la reproducción es continua en poblaciones cercanas al ecuador, haciéndose estacional conforme se alejan del mismo, seguramente como producto de una mayor variación de los factores ambientales a latitudes más altas. Aparentemente lo que se observa en P. homomalla es un efecto latitudinal ya que la población de Florida se encuentra aproximadamente 40 más al norte que la zona de estudio del presente trabajo. Como se puede observar en la tabla 1, la mayoría de las especies que se encuentran cercanas al ecuador (7°N y 16°S) no presentan estacionalidad en sus ciclos reproductivos. Lo contrario sucede con las especies que se encuentran más alejadas de este (18° a 44°N), las cuales presentan marcados ciclos estacionales. El pico de reproducción tan marcado que presenta P. homomalla, así como el hecho de que se presente una sincronía en el inicio de la maduración de las gónadas tanto masculinas como femeninas en el mes de junio, sugiere la participación de factores proximales de control exógeno en la regulación de las actividades reproductivas de P. homomalla. Dado que no existen registros sobre el comportamiento de los parámetros ambientales para la zona de estudio, no es posible determinar que factores son los que tienen influencia en la regulación del ciclo reproductivo de esta especie. En la figura 7 se representa esquemáticamente el ciclo reproductivo propuesto para P. homomalla. PROPORCIÓN SEXUALEl sexado de 236 colonias revela una proporción sexual de la población estudiada que no se desvía significativamente de la proporción 1: 1 (X² = 0.27, p ~ 0.75), ya sea considerando a cada estación como muestras separadas, o tomando a las 3 como una sola muestra (Tabla 4). Grigg (1970) en 2 especies de Muricea, Vighi (1970) en Corallium rubrum y Ford (1964) enAnthopleura elegantissimatambién encuentran una proporción sexual de 1: 1 en las poblaciones estudiadas. FECUNDIDADComo ya se mencionó anteriormente, la fecundidad fue estimada como el número de óvulos maduros por pólipo por cielo reproductivo. Es importante señalar que se consideraron maduros todos los óvulos mayores de 250 p; esta consideración se hizo con base en los histogramas de la figura 5 en los que se observa que el grupo de óvulos de la generación 1978, desaparece totalmente en el mes de septiembre (a partir de las 250 µ) lo que indica que todas esas gónadas (o la mayoría) llegaron a madurar para ese periodo reproductivo. 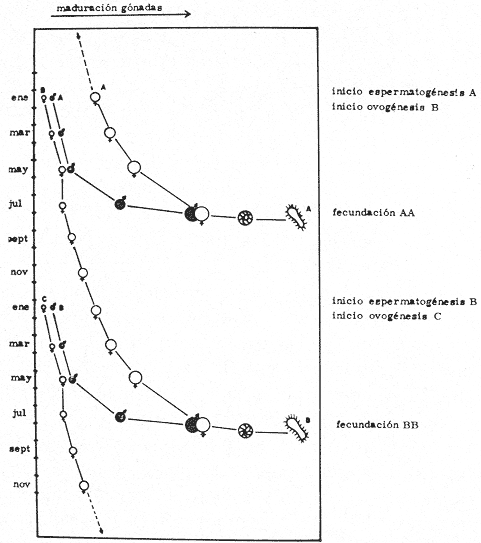 Fig. 7. Esquema del ciclo reproductivo de P. homomalla. Explicación en el texto. En la tabla 4 se muestran los resultados obtenidos para las colonias hembra de las 3 estaciones de muestreo; como se puede observar, en los 3 casos se obtiene un promedio cercano a 2 óvulos/ pólipo /ciclo, misma proporción que se obtiene si se considera a las 3 estaciones como una sola muestra, no observándose diferencias significativas al compararlas entre sí (Tabla 6). Grigg (1970) en dos especies deMuricea y Theodor (1967) en Eunicella stricta (en condiciones de acuario) encuentran proporciones similares en la producción de larvas/pólipo (Tabla 1), siendo estas las únicas estimaciones del potencial reproductor en especies de octocorales. 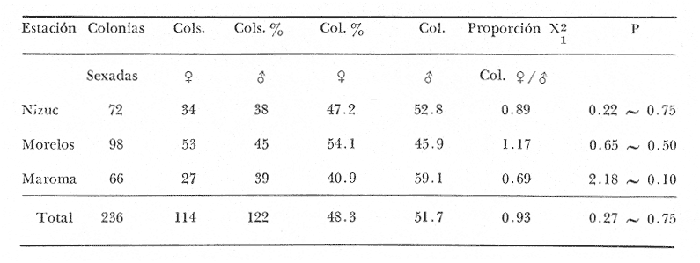 TABLA 4. PROPORCIÓN SEXUAL DE LA POBLACIÓN ESTUDIADA Para obtener una aproximación del número de óvulos maduros que produce una colonia hembra, se estimó de manera indirecta la cantidad de pólipos que tendría una colonia de mediana talla, obteniéndose un promedio de 1,042 ± 137.5 pólipos por gramo de biomasa (peso seco). Jordán (1977) reporta que una colonia de 60 a 70 cm de altura tiene un peso seco de aproximadamente 1000 gr. lo que implica que una colonia de estas características tendría entre 904.5 x 10³ y 1, 179.5 x 10³ pólipos. 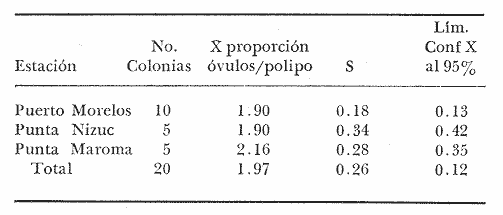 TABLA 5. COMPARACIÓN DE LA FECUNDIDAD DE LAS COLONIAS HEMBRAS DE LAS 3 ESTACIONES DE MUESTREO  TABLA 6. COMPARACIÓN DEL PROMEDIO DE ÓVULOS MADUROS POR POLIPO A PARTIR DE LOS RESULTADOS OBTENIDOS PARA LAS 3 ESTACIONES DE MUESTREO Es de esperar que la condición reproductiva de todos los pólipos de una colonia sea similar, sin embargo, Vighi (1970) reporta que durante la época de reproducción no todos los pólipos deCorallium rubrum son fértiles (estima entre 6 y 30 el porcentaje de pólipos infértiles por colonia). Con el fin de verificar si este mismo fenómeno se observa en P. homomalla se cuantificó el número de pólipos sin gónadas al momento de estimar la fecundidad, porcentaje que resultó sumamente pequeño (0.025% para colonias hembra y 0.028 para colonias macho). Por otro lado, no se puede asegurar que la presencia de estos pólipos "infértiles" no sea debido a las limitaciones de la técnica utilizada. Ahora bien, suponiendo que todo óvulo maduro es fertilizado y da origen a una plánula esto es, que la fecundidad estimada es igual a la fertilidad, una colonia de 1 kg. en peso seco podrá producir entre 1,809 x 10³ y 2,359 x 10³ larvas por año, lo que representa un potencial reproductor elevado concordando con el patrón observado en invertebrados marinos (Cole, 1954). Una mortalidad alta, debe estar compensada por una fecundidad también alta a fin de que la población se mantenga en el tiempo (Pianka, 1974). Ahora bien, aunque no hay todavía resultados definitivos acerca de las tasas de mortalidad y reclutamiento para la especie en la zona, sí se tienen resultados parciales que hacen suponer que tanto la tasa de mortalidad colonial como la tasa de reclutamiento son muy bajas (Jordán, comunicación personal). Esto sugiere que hay una mortalidad muy alta antes y/o muy poco después de la implantación de la plánula, teniendo la especie una curva de sobrevivencia del tipo III, como es característico en la mayoría de los invertebrados marinos (Krebs, 1978). Las causas de mortalidad larval de invertebrados marinos pueden ser varias y han sido revisadas por Thorson (1950) quien propone como la principal causa de mortalidad en larvas planctónicas la depredación por otros animales. Los arrecifes coralinos se caracterizan por tener gran cantidad de organismos filtradores planctófagos cuya importancia como causantes de mortalidad de larvas en el medio es obvia. Otra causa que puede ser importante en la eliminación de las plánulas de los corales son las corriente (Connell, 1973), ya que pueden acarrear fácilmente a éstas a sitios no propicios para su implantación. La mortalidad de plánulas de corales ha sido estimada en 3 especies de gorgonáceos; Theodor (1967) reporta una mortalidad larval de 0.998334 para Eunicella stricta en la costa francesa, y Grigg (1970) encuentra una mortalidad anterior a la implantación de .99999965 para Muricea californica y de .999995 paraM. fruticosa. No se tienen registros de cuanto tiempo puede llegar a vivir una larva de P. homomalla, aunque si se ha estimado para otras especies de corales. Grigg (Op. Cit.) encuentra en condiciones de acuario, que el límite superior de vida de una larva de Muricea está cerca de los 100 días. A toda (1951b) reporta que la mayoría de las larvas deGalaxea áspera se fijan al sustrato en la primera semana, tardando algunas hasta 7 semanas, mientras que las deSeriatopora histrix tardan de 1 a 4 días solamente, Kinzie (1970) estima entre 2 y 10 días el tiempo de residencia en el plancton de las plánulas de varias especies de gorgonáceos. Suponiendo que el tiempo de vida de una plánula de P. homomalla es similar al reportado para otros gorgonáceos en condiciones naturales, la potencialidad de dispersión de la especie puede ser alta si se encuentran corrientes de consideración en la zona. Conclusiones1. Plexaura homomallaes una especie dioica. 2. No se observan diferencias significativas en el comportamiento reproductivo de las colonias de las 3 estaciones de muestreo por lo que se consideran como de una misma población, en lo que a este aspecto se refiere. 3.P. homomalla es una especie iterópara con ciclo reproductivo anual, lo que concuerda con el patrón general observado para otras especies de corales, en el que conforme se alejan del ecuador (después de los 160 de latitud) se aprecia una marcada estacionalidad en el ciclo reproductor. 4. El tiempo de formación y maduración de los espermarios es de 6 a 8 meses; el de los óvulos cercano a 18 meses. 5. Tanto para colonias hembra como macho, la maduración de las gónadas es sincrónica en todos los pólipos y la condición reproductiva de éstos es la misma en toda la colonia. 6. La edad de maduración sexual se alcanza entre los 4 y 11 años (entre 25 y 35 cm de altura). 7. Colonias de más de 35 años (mayores de 90 cm de altura) continúan reproduciéndose sin presentar síntomas de senectud sexual. 8. La proporción sexual de la población estudiada es 1: 1. 9. La fecundidad de una colonia hembra promedio en edad reproductiva se estimó en 1.97: ±: 0.26 óvulos por pólipos por ciclo reproductivo, y aunque esta proporción no aumenta con la edad, si se puede considerar que el potencial reproductivo de una colonia aumenta con la edad en relación directa con el incremento del número de pólipos por año. AgradecimientosSe agradece al Dr. Eric Jordán por su desinteresada ayuda en la revisión crítica del manuscrito y sus valiosos comentarios. A los compañeros del Laboratorio de Ecología Costera del Instituto de Ciencias del Mar y Limnología de la UNAM: Amapola Otero, Juan José Espejel, Martín Merino, Oscar Moreno y Patricia Thomé por su valiosa ayuda en la obtención y procesamiento de las muestras. A Gabriela Aramoni por su colaboración en el trabajo de laboratorio y a Adrián Arredondo quien tomó las microfotografías. El presente trabajo se realizó con apoyo económico del Consejo Nacional de Ciencia y Tecnología (CONACyT) como parte del proyecto sobre "Investigaciones ecológicas y químicas para la extracción de prostaglandinas a partir de corales blandos en el Caribe Mexicano", que celebra el Instituto de Ciencias del Mar y Limnología de la UNAM con el CONACyT (PT/ DT/NAL/79/0046). LITERATURAABE, N., Palao Tropical Biol. Sta., Post-larval development of the coral Fungia actiniformis var. palawensis Doderlein.1937.73-941(1): ATODA, K. Stylophora pistillata. Sci. Rep. of the Tohoku Univ., ser 4 (Biol.)The larva and post-larval development of some reef-building corals. I. Pocillopora damicormis cespitosa (Dana), and 11.1947.24-6418: ---, Acropora bruggemanni (Brook). J. MorpholThe larva and post-larval development of reef-building corals. III. 1951a.115.89(1): ---, Galaxea aspera (Quelch). J. Morphol The larva and post-larval development of the reef-building corals. IV.1951b.17-35.89(1): BAYER, F. M., Prostaglandins from Plexaura homomalla: Ecology Utilization and Conservation of a Major Medical Marine Resource. A Symposium. Studies on the anatomy and histology of Plexaura homomalla in Florida. In: Bayer, F. M. y A. J. Weinheimer (Eds.) University of Miami PressFlorida.1974.62-100p. CARY, L. R., Pub. Carnegie Inst. Wash., Observations upon the growth-rate and ecology of gorgonians.1914.79-90.182: COLE, L. C., Quart. Rev. Biol., The population consequences of life history phenomena.1954.103-137. 29: CONNELL, J. H., Biology and Geology of Coral Reefs.Population ecology of reef-building corals. In: Jones, O. A. y R. Endean (Eds.). Biology I. Academic Press Inc., New York.1973.205-245 p. Vol. II: FORD, C. E., Pac. Sci.,Reproduction in the aggregating sea anemone Anthopleura elegantissima.1964.138-145. XVIII: GIESE, A. C., Ann. Rev. Phys. Comparative physiology: Annual reproductive tycles of marine invertebrates.1959.547-576. 21: GIESE, A. C. y J. S. PEARSEReproduction of Marine Invertebrates. Introduction: General Principles. In: Giese, A. C. y J. S. Pearse (Eds.). Academic Press Inc., New York 1974. 149 p. Vol. I. GOHAR, H. A. F. y H. M. ROUSHDYPub. Mar. Biol. Sta. Alghardaga On the embriology of the Xenfidae (Alcyonaria) (with notes on the extrusion of the larvae)1961.45-72.11: GOLDBERG, W. M., y R. D. HAMILTON Prostaglandins from Plexaura homomalla: Ecology Utilization and Conservation of a Major Medical Marine Resource. A Symposium. The sexual cycle in Plexaura homomalla. In: Bayer, F. M. y A. J. Weinheimer (Eds.). University of Miami PressFlorida.1974.62-100 p. GRIGG, R. W., Ph. D. Thesis Ecology and population dynamics of the gorgonians. Muricea californica, M. fruticosa. Univ. of California at San Diego1970. 261 p. Fishery Management of Precious and Stony Corals in Hawaii. UNIHI SEA GRANT TR1976.48 p. 77-03: JORDAN, E., Centro Cienc. del Mar y Limnol.Ecología y evaluación de Plexaura homomalla. Univ. Nal. Autón. México. Informe Técnico al Consejo Nacional de Ciencia y Tecnología.1977.53 p. ---, Tesis doctoral. Centro de Ciencias del Mar y Limnología. Arrecifes Coralinos del Noreste de la Península de Yucatán: Estructura Comunitaria, un estimador del Desarrollo Arrecifal.Univ. Nal. Autón. México.1980.118 p. JORDAN, E. y R. S. NUGENTAn. Centro Cienc. Mar. Limnol. Evaluación poblacional de Plexaura homomalla (Esper.) en la costa noreste de la Península de Yucatán (Octocorallia).Univ. Nal. Autón México1978.189-200. 5 (1): KINZIE, R. A., Ph. D. Thesis Yale Univ. The Ecology of the gorgonians (Cnidaria, Octocorallia) of Discovery bay, Jamaica 1970. 107 p. ---, Prostaglandins from Plexaura homomalla: Ecology Utilization and Conservations of a Major Medical Marine Resource. A. Symposium Plexaura homomalla: The biology and ecology of a harvestable marine resource. In: Bayer, F. M. y A. J. Weinheimer (Eds.). University of Miami Press.Florida1974. 22-38 p. KREBS, CH. J., Ecology: The Experimental Analysis of Distribution and Abundance. Harper y Row, Publ. N. Y. 1978.678 p. LACAZE-DUTHIERS, H.,Compte. Rendu del' Academie des Sciences Des sexes chez les alcyonaíres.1865.840-843.60: MAVOR, J. W., Am. Acad. Arts. Sci. Proc. On the development of the coral Agaricia fragilis (Dana).1915.485-511.51 (9): MORENO, O., M. MERINO, E. JORDANProblemática de la estimación de la edad en un organismo colonial: Plexaura homomalla (Esper.) (en revisión).1981. PIANKA, E. R.,Evolutionary Ecology.Harper and Row. Publ.New York1974. 356 p. THEODOR, J. Vie et Milleu., Contribution a l'étude des gorgones (7): Ecologie et comportement de la plánula.1967.291-301.18 (2A): THORSON G., Biol. Rev. Reproductive and larval ecology of marine bottom invertebrates.1950.1-455.25: VIGHI, M., Atti. Accad. Lincei. (ROMA) Ser.Ricerche sul ciclo reproductivo del corallo rosso (Corallium rubrum (L» del Promontorio di Portofino.19701-26.8. 10 (1):
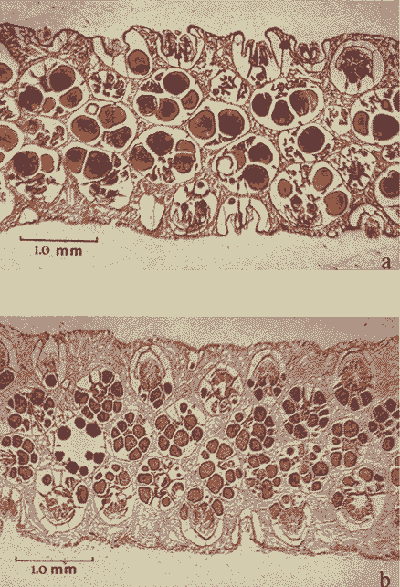 Lám. 1. Sección histológica longitudinal de un extremo apical de una colonia hembra (a) y una colonia macho (b). Se observan varios polipos en sección transversal al nivel de la cavidad gástrica en donde se encuentran las gónadas. 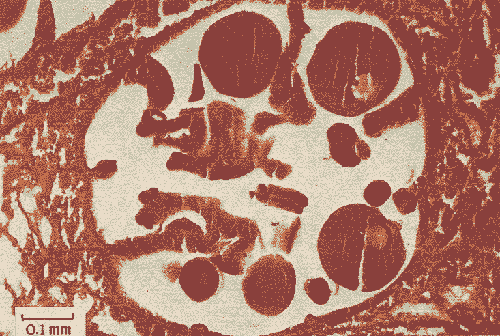 Lám. 2. Polipo de una colonia hembra en el mes de febrero. Se observa un grupo de óvulos de tamaño y medio y otro grupo de menor talla. 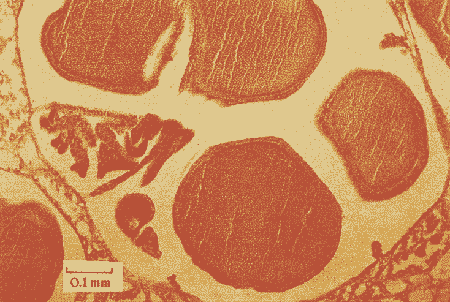 Lám. 3. Polipo de una colonia hembra en el mes de agosto. Los óvulos han alcanzado su máxima talla llenando prácticamente en su totalidad los espacios septales. En la parte inferior izquierda se observa un óvulo pequeño en el que se distingue el núcleo y nucleolo. 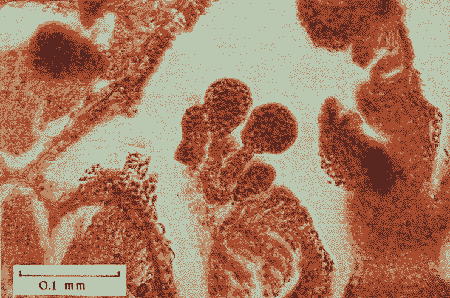 Lám. 4. Polipo de una colonia macho en el mes de febrero. Se observa el nacimiento de varios espermarios a partir de un septo. 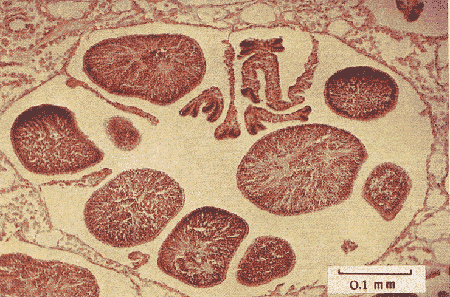 Lám. 5. Polipo de una colonia macho en el mes de agosto. Los espermarios han alcanzado una gran talla y se considera que están maduros (la capa de gastrodermis se ha adelgazado).
|

