|
ESTUDIOS SOBRE LOS CORALES ESCLERACTINIOS HERMATIPICOS DE LA COSTA
NORESTE DE LA PENÍNSULA DE YUCATÁN, MÉXICO. PARTE 1:
SINOPSIS TAXONÓMICA DE 38 ESPECIES. (CNIDARIA, ANTHOZOA,
SCLERACTINIA)
Trabajo recibido el 24 de febrero de 1981 y aceptado para su
publicación el 4 de diciembre de 1981.
LAWRENCE G. CASTAÑARES
Universidad Nacional Autónoma de México, Instituto
de Ciencias del Mar y Limnología. Apartado Postal 70-305. México
20, D. F. Contribución 284 del Instituto de Ciencias del Mar y
Limnología, UNAM.
LUIS A. SOTO
Universidad Nacional Autónoma
de México, Instituto de Ciencias del Mar y Limnología. Apartado
Postal 70-305. México 20, D. F. Contribución 284 del Instituto de
Ciencias del Mar y Limnología, UNAM.
Se presenta una sinopsis taxonómica de 38 especies de corales
escleractinos hermatípicos obtenidos durante 1976, en la costa noreste
de la Península de Yucatán. Para cada especie estudiada se
incluye una sinonimia restringida, caracteres diagnósticos,
observaciones taxonómicas y ecológicas, asi como ilustraciones de
las colonias y cálices. Se presenta un glosario de términos
empleados en la taxonomía de los corales y una tabla de la
distribución de éstos en el Mar Caribe.
A taxonomic synopsis of 38 species of scleractinian hermatypic corals
obtained in 1976 from the northeastern coast of the Yucatan Peninsula, is
provided. A restricted synonymy, diagnostic characters, taxonomical and
ecological considerations, and photographic illustrations are given for each
species. A glossary of terms used in the taxonomy of corals is offered, as well
as a table indicating the distribution of corals throughout the
Caribbean.
Los corales escleractinios se han estudiado por más de dos siglos. Desde que Linneo (1758) aplicó su sistema binominal a los corales en la décima edición de su obra "Sistema Naturae", se han descrito un total de 450 géneros que incluyen aproximadamente 2,500 especies; de éstas, 500 se encuentran actualmente en los arrecifes del Indopacífico y 68 en el Caribe. Uno de los trabajos de mayor relevancia sobre la taxonomía de corales arrecifales es el realizado por los autores Vaughan y Wells (1943) titulado: "La Revisión de los subordenes, familias y géneros del orden Scleractinia". En este trabajo se trata con detalle la ontogenia, la estructura del esqueleto del pólipo, la fisiología, la distribución tanto reciente como estratigráfica. También provee una diagnosis de todas las categorías hasta nivel genérico, señalando las especies correspondientes. El trabajo incluye magníficas ilustraciones de los corales representativos de las categorías supraespecíficas. Posteriormente, Wells (1956) en su trabajo "Scleractinia", modificó en varios aspectos la clasificación a nivel de suborden y familia, actualizando el conocimiento sobre los corales. No obstante que los corales escleractinios de Atlántico Oeste Tropical han sido objeto de estudio, aún existe controversia y confusión en cuanto a la delimitación y reconocimiento de las especies de varios géneros. Gran parte de este problema obedece a la variabilidad observada en las estructuras esqueléticas utilizadas en la taxonomía de estos celenterados, así como al difícil acceso, a la literatura correspondiente. Con el propósito de contribuir al conocimiento de los arrecifes coralinos del área del Caribe Mexicano, se ha planteado el siguiente objetivo: Proveer de un medio actualizado de identificación para los corales arrecifales del Mar Caribe mediante caracteres diagnósticos e ilustraciones fotográficas. ESTADO ACTUAL DE LA TAXONOMÍA DE LAS ESPECIES DE CORAL DEL CARIBEQuizá uno de los manuales para la identificación de los corales escleractinios del Caribe más conocidos y de mayor divulgación es el elaborado por Smith (1948), titulado: "Atlantic Reef Corals". Este manual incluye la descripción de 59 corales del Atlántico Oeste Tropical y aborda de manera general la biología y distribución de los mismos. Entre los trabajos posteriores a Smith que han contribuido a la taxonomía de los corales del Caribe, figuran el de Squires (1958) quien redescribió a 20 especies de Bimini, en las Bahamas; Almy y Carrión-Torres (1963) redescribieron 34 especies de Puerto Rico; finalmente Roos (1971) presentó una diagnosis de 34 especies de Curazao. Este último autor en su trabajo señala que la composición de las listas de especie de los corales arrecifales del Mar Caribe depende del concepto de especie de cada autor y que no se sabe con exactitud que es una especie, forma o variedad de coral, Roos también hace notar lo subjetivo de la delimitación e identificación que actualmente se practica en el estudio de los corales. Wells (1973) es el único autor que actualmente ha descrito nuevas especies y formas del Caribe. Del área de Jamaica, Wells describió las siguientes especies y formas: Madracis formosa, Agaricia grahamae, Mycetophyllia reesi, M. ferox, M. aliciae y Gardineria minnor y también las formas de Eusmilia fastigiata:fastigiata yflabellata; así como a las formas deAgaricia fragilis: fragilis y contracta. Además presenta una lista de 69 especies de corales escleractinios hermatípicos y ahermatípicos para esta localidad; ésta lista es hasta ahora la más numerosa. En 1974 y 1977 se realizaron simposios internacionales sobre arrecifes coralinos en Brisba, ne, Australia y en Miami, Florida, respectivamente. En estas reuniones se discutió lo referente a la variación de los caracteres morfológicos (Wijsman Best, 1974; Jaubert, 1977; Brakel, 1977) y la aplicación de la microscopía electrónica de barrido al reconocimiento de las especies de coral (Jell, 1974; Okentrop, 1974; Chevalier, 1974). Por otro lado, pocos han sido los intentos de la aplicación de otros procedimientos diferentes a los morfológicos que permitan delimitar a las especies de coral. Entre dichos procedimientos figuran los de carácter ecológico (Young, 1963), cariológico (Wijsman-Best, 1974) etológico (Lang, 1971; Wells, 1973). DISTRIBUCIÓN GEOGRÁFICA DE LOS CORALES ESCLERACTINIOS HERMATÍPICOS DEL ATLÁNTICO TROPICAL OCCIDENTALLa fauna de corales escleractinios hermatípicos del Atlántico Tropical Occidental se distribuye a lo largo de 250,000 km²de arrecifes, entre las latitudes 27°30' N y 11°30', en lo que corresponde a la Provincia Caribeana (Newell, 1971). La Provincia Caribeana comprende la costa sureste de los Estados Unidos, Florida, Costa Oriental de México y Centroamérica, las Islas Bahamas, las Antillas Menores y Antillas Mayores (Fig. 1). Wells (1956) indica que las especies de corales escleractinios hermatípicos son más abundantes en las Islas alejadas de los continentes y que pueden ocurrir fuera de la región del Caribe en áreas como las Bermudas (32° N), en la Costa de Brasil entre Alcántara (2°S) y Río de Janeiro (23°S), así como en el Golfo de Guinea en el Oeste de África. En las últimas tres décadas se han publicado trabajos en los que se ha abordado la fauna, la ecología y la geología de los arrecifes de la Provincia Caribeana; en base a estos trabajos, se proporciona la Tabla 1. Esta tabla comprende las especies de corales escleractinios de la región del Caribe, en relación a las localidades donde se han reconocido. Asi mismo, se indican la profundidad máxima de colecta y el número total de especies reconocidas para cada localidad. 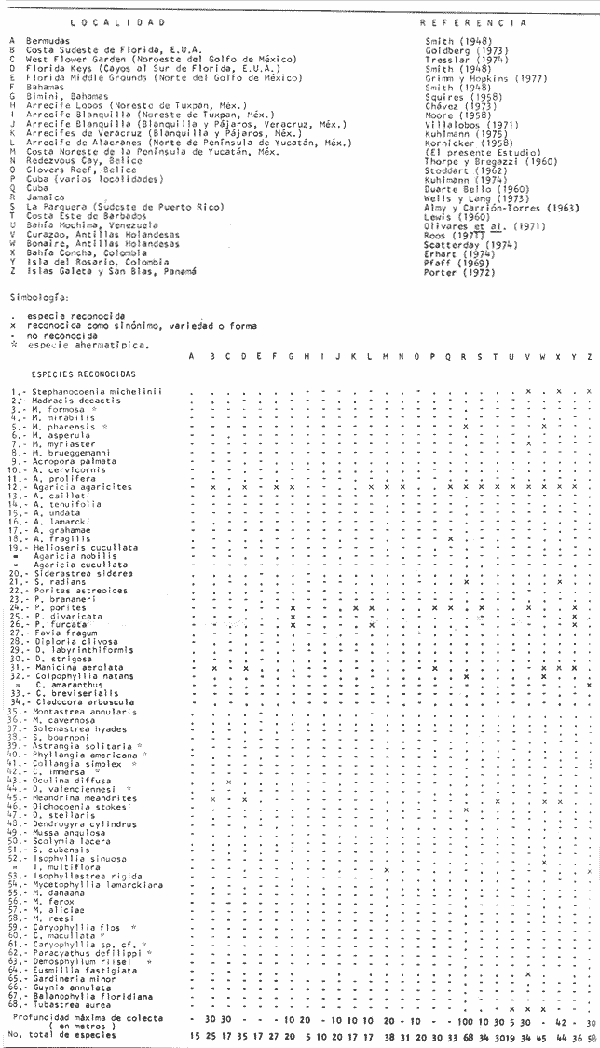 TABLA 1 LOCALIDADES DEL CARIBE DEL NORTE A SUR Y ESPECIES DE CORALES ESCLERACTINIOS RECONOCIDAS PARA CADAUNA DE ELLAS ( SE INDICA LA PROFUNDIDAD MÁXIMA DE COLECTA Y EL NÚMERO TOTAL DE ESPECIES ) 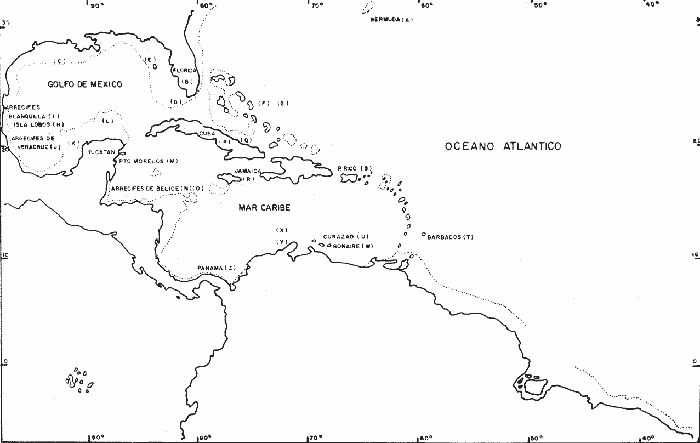 Fig. 1. Localidades donde se han reconocido corales pétreos hermatípicos en la Región del Caribe. (Ver Tabla 1). Como se puede apreciar en la tabla mencionada, la composición de la fauna de corales escleractinios hermatípicos en la región del Caribe es relativamente homogénea (Goreau, 1959; Glynn, 1973; Milliman, 1973). Según Goreau (1959), no existen diferencias regionales significativas entre las poblaciones de corales ni condiciones endémicas. En la mayoría de los arrecifes del Atlántico Tropical Occidental, los géneros mas comunes son Acropora, Montastreu, Porites, Diplora, Siderastrea y Agaricia; las especies que generalmente presentes en los arrecifes son: M. annularis, M. cavernosa P. porites, P. asteroides, A. agaricites, S. siderea., S. radians, D. clivosa, D. strigosa, Stephanocoenia micheliini y Eusmillia fastigiata. ÁREA DE ESTUDIOEl área de estudio está ubicada en la costa noreste de la Península de Yucatán en el Mar Caribe comprendida aproximadamente entre los 20°10' y 210°31' de latitud norte, y cubre una extensión aproximada de 120 km (Fig. 2). Las áreas arrecifales se encuentran situadas de norte a sur frente a Punta Nizuc, Punta Ptempich, Puerto Morelos, Punta Brava, Akumal, Tulum. Otras localidades estudiadas sin formaciones arrecifales, pero con pequeños bancos de corales fueron las caletas de Xcaret, Pamul, Yukul, Punta Tanchancte, Chemuyill y Xelha. La mayor parte de la colecta se llevó a cabo, por su accesibilidad, en el arrecife que se encuentra frente a Puerto Morelos. El arrecife de Puerto Morelos es de tipo bordeante, empieza justamente frente al puerto del mismo nombre y se prolonga hacia el norte por aproximadamente 2 km. Se encuentra sobre una terraza comprendida entre los 0 y 25 m de profundidad. En la figura 3 se presenta un perfil topográfico del arrecife de Puerto Morelos, donde se reconocen las siguientes regiones: orilla, laguna, arrecife posterior, arrecife frontal o pendiente arrecifal y plataforma arenosa. En la orilla se encuentran médanos de 4 a 6 m de altura y una playa angosta de arena calcárea; entre el nivel superior e inferior de la marca se halla un canal de aproximadamente 80 cm de profundidad, producido por el oleaje y las corrientes litorales. En seguida del límite inferior de la marea, es común observar pastizales deSyringodium sp., Halodule sp yThallassia testudinum; estos pastos cubren la mayor parte del fondo de la laguna, siendo Thallassia más abundante conforme aumenta la profundidad. Entre estas especies de fanerógamas es frecuente observar algas del géneroHalimeda, esponjas y los corales escleractinios comoManicina areolata y Porites divaricata. La laguna tiene aproximadamente 700 m de ancho con una profundidad máxima de 6m. Al sur justamente frente a la Población de Puerto Morelos, se encuentra un arrecife "parche" que abarca un área de aproximadamente 50 m de ancho por 120 m de longitud. El arrecife está formado por grandes colonias de Montastrea annularis y colonias aisladas de octocorales y otros hexacorales distribuidos sobre el fondo. Entre los octorales se encuentranBriareum asbestinum, Pseudoplexaura porosa, Eunicea mammosa, E. tourneforti, E. calyculata, Muricea atlantica, Plexaurella dichotoma, Pseudopterogorgia acerosa, P. americana, Pterogorgia anceps, P. citrina; entre los hexacorales predominan Isophyllia sinuosa, Siderastrea siderea, S. radians, Agaricia agaricites formaagaricites, Isophyllastrea rigida. La presencia de colonias de octacorales y hexacorales entre laThallassia señalan el límite entre la laguna y el arrecife posterior. Esta última zona tiene un ancho que varía entre 50 y 100 m y está comprendida entre el fondo lagunar propiamente dicho y la zona de rompiente. Cuando existe una barrera deAcropora palmata bien definida en el arrecife posterior, se distingue una zonación de octo y hexacorales. En donde no existe la barrera el arrecife posterior presenta canales de 5 a 10 m de ancho que la atraviesan perpendicularmente; es en estos canales, donde las especies presentan un desarrollo mínimo debido a las corrientes generadas por el embate de las olas. 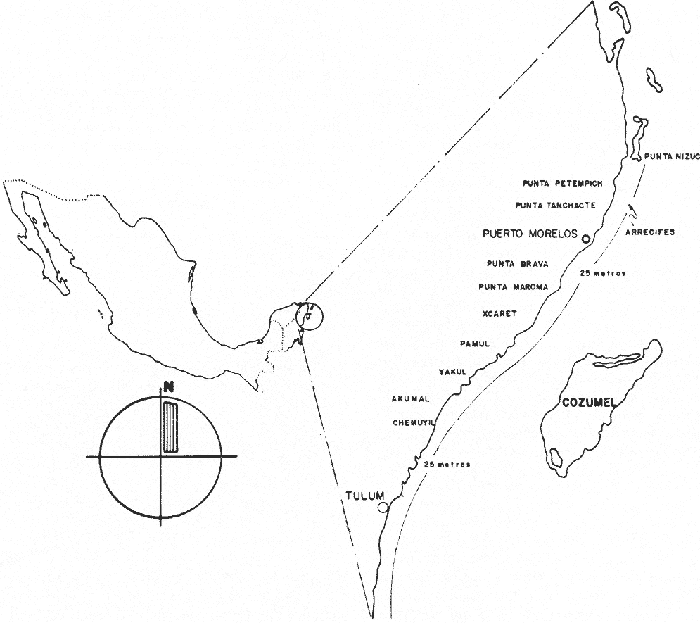 Fig. 2. Plano de localización del área estudiada.  Fig. 3. Perfil y zonación del arrecife frente a Puerto Morelos (las escalas en metros son diferentes para la laguna y la pendiente arrecifal). 1. Zona de Thalassia. 2. Arrecife "Parche". 3. Zona de Montastrea annularis. 4. Zona Mixta. S. Zona de Acropora palmata. 6, Zona de rompiente. 7. Zona de Gorgonia flabellum. 8. Zona de Hexa y Octocorales. La primera zona del arrecife posterior está determinada por la dominancia de Montastrea annularis la cual forma masas esféricas con diámetros de 1 a 2 m. En la base de éstas o sobre el fondo sólido, se encuentran otros corales escleractinios de menor tamaño tales como Isophyllia sinuosa, Eusmilia fastigiata, Isophyllastrea rigida., Siderastrea radians, S. siderea., Colpophyllia natans y Dendrogyra cylindrus; estas dos últimas especies pueden llegar a tener dimensiones tan grandes como M. annularis. Entre los octocorales predominan Plexaura homomalla y P. flexuosa. En esta zona, laThallassia es substituida, en ocasiones por algas de los géneros Halimeda,Udotea,Rhizocephalus yPenicillus en diferentes grados de asociación. Inmediatamente después de la zona de M. annularis (Fig. 3) en profundidades no mayores a 1.4 m, se presenta una zona mixta de alta diversidad de especies. Los hexacorales que desarrollan grandes masas o acumulaciones aisladas son:Diploria strigosa, Porites porites, Agaricia agaricites forma danae, A. teunifolia, Acropora cervicornis, Colpophyllia natans; otras especies que forman pequeñas colonias son: Agaricia agaricites formaagaricites, Porites astreoides, Isophyllastrea rigida, Dichocoenia stokesi, Favia fragum, Isophyllia sinuosa, Eusmilia fastigiata, S. siderea y Meandrina meandrites. Entre los octocorales se figuran:Pseudoplexaura Porosa, Plexaura homomalla, Eunicea mammosa, Muricea atlantica, Muricopsis flavida, Plexaurella dichotoma yBriaerum asbestinum. Hacia la parte exterior del arecife, se localiza una zona deAcropora palmata que desarrolla una barrera de 10 a 15 m de ancho la cual como se menciona anteriormente, está interrumpida por espacios o canales donde el desarrollo de A. palmata es menor. Después de la zona de A. palmata, se encuentra la zona de rompiente, donde la profundidad varía entre 5 m y 1 m. Esta zona es de gran turbulencia y se caracteriza por tener sobre el fondo, pedazos esparcidos de esqueleto de A. palmata; sobre dichos esqueletos se desarrollan algas calcáreas incrustantes. Ocasionalmente se pueden observar colonias de tamaño pequeño deMillepora complanata, Diploria clivosa, Gorgonia flabellum y algas de los génerosSargassum yTurbinaria. La pendiente arrecifal se caracteriza por tener una comunidad coralina abundante y diversa, pero no forma una zona de "cabezos" (Butress Zone) como la indica Goreau (1959) para algunos arrecifes de Jamaica; es decir, no se desarrolla una estructura arrecifal propiamente dicha, sino que el piso es de roca calcárea de origen anterior a la comunidad, con una pendiente suave entre 80 y 150 (jordan, comunicación personal); esté ángulo se mantiene hasta llegar a una plataforma arenosa localizada entre los 20 y 25 m de profundidad. La transición entre la roca y la arena generalmente es abrupta, se presenta un escalón de .75 a 1 m de altura. En áreas profundas de la pendiente arrecifal entre los 15 y 20 m, se observa un sistema de canales (grooves) y macisos de origen anterior (spurs), orientados perpendicularmente a la rompiente. La zonación de los organismos en la pendiente arrecifal está influenciada por la acción de las olas, la cual a su vez produce el movimiento de sedimentos. Así, entre los 4 y 8 m donde la acción de las olas es aún considerable se distingue un fondo cubierto por algas de los géneros Sargassum, Turbinaria, Padina y Helimeda. También destaca la presencia del OctoralGorgonia flavellum y ocasionamente se observan colonias de los hexacorales: A. palmata., Diplora clivosa, Siderastrea radians, que son siempre de tamaño pequeño. Aproximadamente a los 8 o 10 m de profundidad, es notable la presencia de los octocorales que forman pequeñas colonias robustas. Entre estos figuranPlexaura flexuosa, Pseudoplexaura Porosa y Eunices tourneforti. Entre los 10 y 15 m de profundidad se empieza a notar la presencia de Pseudopterogorgia americana. Pterogorgia anceps y Muricea atlantica, siendo las dos primeras entre otras 19 especies los octocorales más dominantes. Los hexacorales muestran un incremento en diversidad entre los 7 y 10 m; se distinguen principalmente aSiderastrea radians, Diploria clivosa y Porites astroides. A los 10 m se observan colonias aisladas, con dimensiones de 1 a 3 m de diámetro de M. annularis, Colpophyllia natans, M. cavernosa, así como ramas sueltas de A, cervicornis, Porites porites, P. furcata. Tambien existen colonias pequeñas con dimensiones no mayores de 50 cm de Stephanocoenia michellinii., Madracis decactis, Dichocoenia stokesi, D. stellaris, Siderastrea radians, Mycetophyllia lamarckiana, M. aliciae, M. danaana, M. ferox y Meandrina meandrites. MATERIAL Y MÉTODOSSe colectó de 3 a 5 ejemplares de cada especie o forma de crecimiento (de Colpophyia breviserialis únicamente se cuenta con fotografías tomadas in situ, Lám. 14, Figs. c y d). Este material, y fotografías a color fue depositado en la colección de corales del laboratorio de Ecología Costera del Centro de Ciencias del Mar y Limnología (CCML) de la Universidad Nacional Autónoma de México (UNAM). Las colectas en los arrecifes o caletas se efectuaron por medio de transectos perpendiculares a la rompiente, abarcándose diferentes zonas arrecifes en cada ocasión. Las colectas se llevaron a cabo hasta profundidades de 25 m mediante buceo libre y equipo autónomo de buceo. Dado que uno de los propósitos de este trabajo fue reconocer a las especies del área de estudio y proveer un medio para su identificación, es preciso mencionar que se intentó obtener una muestra representativa de 2 a 3 ejemplares de acuerdo al siguiente criterio: 1. Obtención de colonias con características típicas de la especie. 2. Obtención de colonias con formas de crecimiento descritas. 3. Obtención de colonias con formas de crecimiento no descritas en la literatura. Con el propósito de tener una referencia posterior a la colecta de la disposición del coral y as características del lugar donde se encontró, se tomaron fotografías in situempleando una cámara submarina con película negativa B/N Plus-X. Como escala se utilizó una regla de 30 cm, marcada en tramos alternos blancos y negros de 5 cm. En cada localidad estudiada se anotó la profundidad, la zonación, el tipo de fondo, características del habitat, y la abundancia relativa de acuerdo a las siguientes anotaciones: predominante, común, ocasional, raro. Una vez identificadas las especies, se fotografiaron los esqueletos con una cámara de 35 mm adaptada con un fuelle de acercamientos y con película B/N Plus-X. También se tomaron macrofotografías en detalle de los cálices por medio de un fotomicroscopio Tessovar-Zeiss. En la identificación de especies se emplearon las claves y descripciones de los siguientes autores: Verril (1902); Smith (1948); Squires (1958); Almy y Carrión Torres (1963); Ross (1971); Wells (1956-1973). La nomenclatura de las especies y formas, está basada en el último autor. Los caracteres utilizados en la diagnosis de especies son: la forma, dimensión y color del corallum; forma, disposición y dimensiones de las copas; arreglo, número y detalles estructurales de los septos, así como las características de la columnella y el coenosteum. La Fig. 4, muestra la morfoogía de un pólipo y de una copa. A continuación se presenta un glosario de los términos utilizados en la taxonomía de los corales escleractinios, de acuerdo a los siguientes autores: Hyman, 1940; Smith, 1948; Wells, 1956; Melendez, 1970. 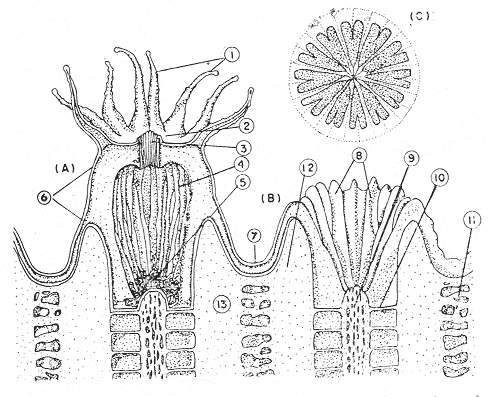 Fig. 4. Esquema de la morfología de los corales escleractinios. (A) Pólipe; (B) Copa; (C) Vista superior de una. 1. Tentáculos; 2. Disco oral; 3. Estomodeum; 4. Mesenterio; 5. Filamentos mesentéricos; 6. Columna; 7. Cenozarco; 8. Septos; 9. Columnella; 10. Disepimentos endotecales; 11. Disepimentos extratecales; 12. Pared o teca; 13. Coenosteum. Dibujo tomado del Goreau et al. (1979). Sci. Amer., 241(2). GLOSARIOAhermatípico: Organismo que no forma arrecifes. Ambulacrum: Depresión continua del coenosteum que separa las colonias de algunos corales, particularmente en los meandroides. Axia: Con referencia al eje oral-aboral. Cáliz: Superficie interna de la copa, o también a veces empleado como borde superior de la copa. Ceratoide: Copa individual de forma cónica o de cuerno. Ceriode: Corallum masivo en el cual las copas son generalmente poligonales y se encuentran íntimamente unidas por sus paredes. Cenosarco: Tejido común que conecta los pólipos de una colonia y se encuentra sobre la pared exterior de la copa y el coenosteum. Coenosteum: Depósitos (disepimentos extratecales) formados entre las copas de una colonia, fusionándolas. Conénquima: Término colectivo para el coenosteum y cenosarco. Centro: Términos que se refiere a las copas cuando éstas no están bien delimitadas. Ciclo Septal: Todos los septos que pertenecen a una etapa de la ontogenia de la copa, determinado por el orden en grupos sucesivos de: 6, 6, 12, 24, 48, septos. Colina: Borde formado por las paredes de las copas continuas (meandroides). Columnella: Estructura axial calcárea formada por modificaciones de los bordes internos de los septos. Comúnmente se proyecta al interior del cáliz para formar una protuberancia en la parte central (sinónimo: columnilla). Columnella trabecular: De apariencia esponjosa, formadas por trabéculas entrelazadas dispuestas flojamente. Columnella estiliforme: En forma de estilite, que se proyecta hacia el interior del cáliz. Columnella laminar: En forma de placa generalmente orientada en sentido paralelo al eje mayor de la copa. Copa: Exoesqueleto formado por un pólido ya sea individual o colonial (sinónimo: corallite). Coralum: Exoesqueleto de una colonia (sinónimo: coral, polípero). Costilla: Proongación del septo fuera de la copa (sinónimo: costae). Dendroide: Corallum ramificado, en el cual cada rama es formada por una copa. Diente Septal: Pequeña proyección del margen superior de un septo, formado por la extensión de las trabéculas. Disepimentos: Pequeñas placas que se depositan en la región periférica de la copa o fuera de ella. Ectodermo: Capa celular exterior de los discos oral y basal, tentáculos y columna del pólipo. Endodermo: Capa celular interior de las paredes exteriores del pólipo y que ocurre como una lámina doble en los mesenterios. Endoteca: Término colectivo para los disepimentos dentro de la pared de la copa. Epiteca: Tejido esquelético que rodea a una copa y comprende una extensión de la placa basal. Exoteca: Término colectivo para los disepimentos fuera de la pared de la copa. Extramural: Que ocurre fuera de la pared de la copa. Faceloide: Corallum con ramas paralelas, que forman masas compactas. Gemación circunmural: Tipo de gemación poliestomodeal con estomodea unidos indirectamente y arreglados alrededor de colinas discontínuas y montículos de corallum. Gemación circumoral: Tipo de gemación poliestomodeal, con estomodeos directamente unidos y arreglados concéntricamente alrededor del pólipo madre. Gemación diestomodeal: Tipo de gemación donde se desarrollan dos estomodeos dentro de un anillo tentacular, con dos parejas interstomodiales demesenterios entre el estomodeo original y los nuevos. Gemación extratentacular: Formación de nuevas copas por invaginación de la zona del cenosarco fuera del anillo de tentáculos que rodea a la boca del pólido madre. Gemación por división transversa. Formación de nuevos pólipos por separación del pólido madre en dos partes, transversalmente al eje oral-aboral. Gemación intramural: Tipo de gemación poliestomodeal con estomodeos unidos directamente o indirectamente a una sola serie lineal. Gemación intratentacular: Formación de nuevos pólipos de coral por invaginación del disco oral del pólipo madre dentro del anillo de tentáculos. Gemación poliestomodeal: Que tiene más de tres estomodeos desarrollados dentro de un anillo tentacular. Hermatípico: Organismo que forma arrecifes. Incrustante: Coral que forma delgadas capas continuas, directamente sobre el sustrato. Lóbulo paliforme: Estructuras que asemejan a los pali, pero se forman por una proyección de las trabéculas en el borde del septo, difiere del pali en no estar formado como resultado de una sustitución. Masivo: Corallum compacto, compuesto de copas dispuestas unas juntas a otras. Meandroide: Corallum caracterizado por copas continuas, a manera de meandros. Mesenterio: Lámina de tejido dispuesta radial y verticalmente dentro de la cavidad gastrovascular, unida a la superficie del disco oral y la pared de la columna del pólipo. Mesoglea: Capa media gelatinosa sin células, de las paredes y mesenterios. Monoestomodeal: Con una sola boca, a veces se refiere a pólipos solitarios. Montículo: Porción protuberante de la superficie del corallum producida por gemación circunmural. Pali: Lámina vertical o pilar desarrollada en el borde interno de ciertos entosepeta, que comprenden una parte remanente de un par de exosepta unidos en los márgenes internos. Pared: Depósitos esqueléticos que encierran a la columna del pólipo y que unen los bordes exteriores de los septos. Puede ser de tres tipos: sinapticuloteca, septoteca o parateca (sinónimos: teca, muralla). Paratheca: Pared de la copa formada por desipimentos espaciados cercanamente. Plocoides: Corallum masivo en el cual las copas tienen paredes separadas y unidas por costillas, disepimentos o coenosteum. Protoseptum: Uno de los primeros seis septos formados de una copa. Reptante: Corallum que crece conformado el fondo. Septo: Partición dispuesta radialmente en una copa y que ocurre entre los mesenterios (sinónimo: tabique). Sinaptícula: Pequeñas barras que conectan caras opuestas de septos adyacentes y que perforan los mesenterios entre ellos. Sinaptículoteca: Pared de la copa formada por anillos de sinaptícula. Trabécula: Pilares de fibras calcáreas, que comprenden un elemento esquelético de los septos y componentes relacionados.  LISTA SISTEMÁTICA DE LOS CORALES ESCLERACTINIOS DE LA COSTA NORESTE DE LA PENÍNSULA DE YUCATÁN, MÉXICO  Clase ANTHOZOA Ehrenber, 1834
Subclase Hexacoralia Haeckel, 1896
Orden Scleractinia Bourne, 1900
Suborden Astrocoeniia Vaughan y Wells, 1943
Familia Astrocoeniidae Koby, 1890
Género StephanocoeniaMilne-Edwards y Haime, 1848
Stephanocoenia michelinii Milne-Edwards y Haime, 1848 (Lám. 1, Figs. a, b) Stephanocoenia intersepta (Esper). Verrill, 1902, p. 106. Roos, 197 1, p. 5 1. Lám. 4, Fig. c, Lám. 5, Figs. a, b. Stephanocoenia micheliniiMilne-Edwards y Haime, 1848, p. 301 (descripción original).-Smith, 1948, p. 72, Lám. 2.-Squires, 1958, p. 246, Lám. 32, Figs. 1, 2 (sinonímia).Almy y Carrión-Torres, 1963, p. 144, Lám. 3, Fig. b. Diagnosis:Corallum: Ligeramente convexo, de contorno irregular. Con dimensiones generalmente menores a 30 cm. De color café con tonos claros, cálices oscuros. Copas: Poligonales, irregulares, íntimamente unidas (cerioides); en ocasiones separadas aproximadamente 2 mm (plocoides). El diámetro varía entre 1 y 3 mm. Septos: En tres ciclos (20-24 por cálice). Primarios y secundarios presentan pali y llegan a la columnella; los tercearios son más delgados y cortos. Márgenes lisos o finamente dentados; superficie lateral espinosa. Sobresalientes, forman costillas cortas solamente cuando los cálices se encuentran separados. Columnella: Estiliforme, lateralmente comprimida, con la misma altura de los pali. Habitat: Ocurre ocasionalmente en el arrecife posterior sobre restos de otros corales o en fondos rocosos. También se observó comúnmente en la pendiente arrecifal entre los 10 y 20 m de profundidad. Observaciones: Wells (1956) considera a S.intersepta como un homónimo, señalando que S.michelinii Mi1neEdwards y Haime, 1848 debe de ser el nombre válido. Sin embargo, Roos (1971); utiliza el nombre S.intersepta (Esper) indicando que éste es el correcto por prioridad. En el presente estudio se optó por emplear el nombre de S. michelinii en virtud a su ampia aplicación en la literatura sobre el tema. Familia Pocilliporidae Gray, 1842
GéneroMadracisMilne-Edwards y Haime, 1849
Madracis decactis (Lyman, 1859) (Lám. 1, Figs. c, d) Astrea decactis Lyman, 1859, p. 260 (descripción-original). Madracis decactis (Lyman). Verrill, 1902, p. 108, Lám. 4, Fig. 6 (sinónima).- Smith, 1948, p. 75, Lám. 1.Roos, 1971, p. 52, Lám. 8, Figs. a, b.- Wells, 1973, P. 19. Diagnosis:Corallum: Ramificado, ramas en forma de nódulos o clavas de 2 a 3 cm en diámetro y aproximadamente 4 cm de alto o en forma de lóbulos formados por delgadas incrustaciones de dimensiones menores a 10 cm. De color café oscuro con tonos claros de gris u ocre. Copas: Poligonales, cálices de 1 a 15 mm de diámetro. Presentan una hilera de pequeñas espinas en la unión de las paredes, las cuales varían en número y en altura. Septos: En dos ciclos (10 por cálice). Todos legan a la columnella. Sobresalientes no forman costillas. Márgenes lisos y verticales, superficie lateral espinosa. Columnella: Estiliforme y aplanada. Habitat: Se encontró ocasionalmente en un arrecife parche de la laguna a una profundidad de 4 m. Crece sobre los restos de otros corales o en fondos rocosos. También se observó distribuido comúnmente en la pendiente arrecifal, creciendo sobre el fondo, entre los 10 y 20 m de profundidad. Familia Acroporidae Verrill, 1902
GéneroAcroporaOken, 1815
Acropora cervicornis (Lamarck, 1816) (Lám. 2, Figs. a, b) Madrepora cervicornis Lamarck, 1816, p. 278-281 (descripción original) Acroopra muricata(Linné) var. cervicornis. Verrill, 1902, p. 165, Lám. 32 (sinonimia) Acropora cervicornis (Lamarck). Smith, 1948, p. 75, Lám. 2.Almy y Carrión-Torres, 1963, p. 145. Lám. 4, Fig. a-Roos, 197 1, p. 54, Lám. 9, Fig. a, Lám. 12, Fig. a. Diagnosis:Corallum: Ramificado, desarrolla ramas cilíndricas, bifurcadas que crecen horizontal y verticalmente, alcanzando en ocasiones de 2 a 3 m de largo. El diámetro fluctúa entre 1 y 10 cm, y disminuye a lo largo de las ramas. Las ramas terminan en punta. De color ocre claro, café o gris cenizo, desvanecidos hacia las puntas que son blancas. Copas: Tubulares, de tamaño variable, entre 1 y 4 mm de largo, de paredes porosas. Los cálices miden entre 1 y 1.5 mm de diámetro. El coenosteum es de apariencia esponjosa, reticular o espinosa, a veces con continuaciones de las pseudocostillas sobre su superficie. Con una sola copa guía en la punta de las ramas. Septos: En dos ciclos (12), no sobresalientes, subdesarrollados, aparecen como bordes con proyecciones de forma irregular, el septo del lado de la pared interna del cálice más desarrollado, a veces también el opuesto. Los septos de las copas guía más desarrollados. Columnella: Ausente. Habitat: Es predominante en algunas zonas entre los límites del arrecife posterior a la laguna, a una profundidad aproximadamente de 1.5 m. En ocasiones predomina en zonas someras de la laguna sobre sedimentos a una profundidad de 1 a 2 m. También se observó en la pendiente arrecifal entre los 10 y 20 m de profundidad, donde desarrolla ramas aisladas. Acropora palmata Lamarck, 1816 (Lám. 2, Figs. c, d) Madrepora palmata Lamarck, 1816, p. 278 (descripción original) Acropora muricata var. palmata (Linné). Verrill, 1902, p. 165, Lám. 32 (+ var. cervicornis, + var. polífera, + var. flabellum) (sinonímia) Acropora palmata (Lamarck). Smith, 1948, p. 75, Lám. 4.Squires, 1958, p. 246, Lám. 34, Fig. 1 (sinonimia). - Almy y Carrión-Torres, 1963, p. 146, Lám. 4, Fig. b-Roos, 1971, p. 55, Lám. 12, Fig. b. Diagnosis: Corallum: Desarrolla comúnmente frondas extendidas en sentido horizontal de tamaños variables, generalmente entre 1.5 a 1.2 m de largo y hasta 20 cm de ancho. Las frondas se originan de un tronco o bien puede desarrollarse en forma de platos semicirculares sobrepuestos, con radios que pueden llegar a ser mayores de 75 cm. Copas: Un poco más protuberantes que A. cervicornis, las copas guía se encuentran en los bordes de las ramas. Septos: Iguales a los de A. cervicornis. Columnella: Ausente. Habitat: Predomina en el área posterior a la zona de rompiente, donde forman una barrera con sus ramas orientadas generalmente en el sentido contrario al embate de las olas. También ocurre ocasionalmente en la pendiente arrecifal formando colonias aisladas, en profundidades que no rebasan los 5 m. Acropora prolifera Lamarck, 1816 (Lám 3, Figs. a, b) Madrepora prolifera Lamarck, 1816, p. 278-281 (descripción original) Acropora muricatavar.prolifera (Linné). Verrill, 1902, p. 165 (+ var. cervicornis, + var. palmata, + var. flabellum). Acropora prolífera(Lamarck). Smith, 1948, p. 74, Lám. 2, Figs. 1, 4.-Almy y Carrión-Torres, 1963, p. 146, Lám. 5, Fig. a-Roos, 1971, p. 55, Lám. 11. Diagnosis: Corallum: Desarrolla ramas cilíndricas semejante a A. cervicornis, con una tendencia a aplanarse en sentido horizontal y a fusionarse en las bifurcaciones y a lo largo de las ramas. Las ramas por lo general de 50 cm de largo, con aproximadamente de 1.5 cm de diámetro menor y 2.5 cm de diámetro mayor. De color café oscuro desvanecido hacia las puntas de las ramas, en ocasiones ocre. Copas: Con las características deA. cervicornis, con la excepción de que en los extremos de las ramas se encuentran un mayor número de copas guía, de las cuales se originan varias puntas. Septos: Igual que en A. cervicornis. Columnella: Ausentes. Habitat: Esta especie solamente se encontró próxima a la desembocadura de los ríos subterráneos en pequeñas entradas de mar, donde la profundidad no es mayor de 1 m. Familia Agaricidae Gray, 1947
GéneroAgariciaLamarck, 1801
Agaricia agaricites(Linnaeus, 1758) (Láms. 3-5) Madrepora agaricites Linnaeus, 1758, p. 795 (descripción original) Agaricia agaricites (Linnaeus). Verrill, 1902, p. 146, Lám. 26, Figs. 2, 3, Lám. 27, Figs. 1-3, 5.7 (+ var. agaricites, + var. danae, + var. gibosa, + var. pusilla, + var. teunifolia, + A. crassa, + A. purpurea) (sinonimia).- Smith, 1948, p. 74, Láms. 5-6 (+ var. crassa, + var. purpurea).- Squires, 1958, p. 247, Lám. 33, Figs. 1-2 (+ var. crassa, + var. purpurea (sinonimia).- Almy y Carrión-Torres, 1963, p. 146, Lám. 5, Fig. b, Lám. 6, Figs. a, b (+ var. crassa, + var. purpurea, + var.- Roos, 1964, pp. 8-9, Lám. 12, Fig. a (+ var. crassa, + for. agaricites, + for. purpurea).-Roos, 1971, p. 56, Lám. 14, Figs. a-b (+ var. crassa, + var. fragilis, + var. purpurea).- Wells, 1973, p. 25 (+ for. humilis, + for. purpurea, + for. agaricites, + for. carinata, + for.- danai) (claves). Diagnosis: Corallum: Presenta cinco formas: (Idenificación y nomenclatura según Wells, 1973).A. agaricites forma agaricites(Linnaeus) Desarrolla colonias submasivas, de forma generalmente gibosa, con gruesas proyecciones encorvadas, cuyas dimensiones raramente rebasan los 20 cm. Puede presentarse como pequeñas colonias incrustantes. Las copas se encuentran cubriendo toda la superficie del coralum. De color ocre claro, café oscuro o en tonos claros de gris, verde o rosa (Lám. 3, Figs. c, d).A. agaricites forma popurea(Lesueur). Desarrolla láminas semicirculares, unifaciales (con las copas en la cara superior) con radios que raramente exceden los 30 cm, extendidos a partir de un punto de fijación, gruesas, ligeramente cóncavas o convexas. Pueden encontrarse como colonias solitarias o agrupadas. Con los mismos colores de la forma agaricites (Lám. 4, Fig. a). A. agaricites forma danai Milne-Edwards y Haime. Desarrolla grupos de láminas verticales, bifaciales (con las copas en las dos caras), más o menos semicirculares, paralelas, unidas entre sí. Con radios no mayores de 15 cm. De color ocre, café o gris cenizo, desvanecidos hacia los bordes de la colonia (Lám. 4, Fig. b).A. agaricites forma carinata(Duchassaing y Michellotii). Desarrolla una lámina unifacial, a partir de la cual se originan en varios planos verticales de crecimiento, lóbulos o láminas gruesas bifaciales en forma de carina. De color ocre claro, desvanecidos hacia los bordes (Lám. 5, Fig. a). A. agaricites forma humliis Verrill. Desarrolla pequeñas láminas unifaciales, circulares, ligeramente convexas, con diámetros nunca mayores a los 8 cm. El corallum se extiende a partir de un centro de fijación directamente sobre el sustrato. De color café oscuro, las crestas de las colinas blancas (Lám. 5, Figs. b, c). Copas: Dispuestas en hileras o grupos, en valles discontinuos rodeados por colinas paralelas a los bordes de la colonia. Con 4 a 5 copas por cm los cálices miden entre 2 y 3 mm de diámetro (a excepción de la forma humilis que presenta 5 a 7 copas por cm y cálices entre 1 y 1.5 mm de diámetro). Septos: En tres ciclos (18-24 por cálice). Márgenes lisos, superficie lateral espinosa. Columnella: Papiliforme, aplanada lateralmente a veces subdesarrollada en forma de pequeños granos, lo cual aparentemente depende de la forma y estado de desarrollo de las copas. Habitat: A. agaricites forma agaricites: Se encontró comúnmente en el arrecife posterior y en la pendiente arrecifal. También se observó pero con menor frecuencia, en la zona de rompiente donde desarrolla pequeñas colonias incrustantes. A. agaricites forma purpurea: Ocurre ocasionalmente en zonas protegidas del arrecife posterior, entre las ramas deAcropora palmata y en las bases de Montastrea annularis. También se le encontró comúnmente en la pendiente arrecifal entre los 10 y 20 m de profundidad. A. agaricitesforma danai: Se distribuye comúnmente en lugares protegidos del arrecife posterior, creciendo sobre restos de A. palmata u otros corales. Es predominante en los límites del arrecife posterior con la laguna. A. agaricites formacarinata: Aparece raramente representada en el arrecife posterior y ocupa el mismo habitat que la forma danai, sin embargo, no forma grandes colonias. A. agaricitesformahumilis: se le encontró raramente en lugares poco iluminados tales como cuevas o bien, en la base de grandes formaciones deA. palmata y M. annularis. Agaricia teunifolia (Dana, 1846) (Lám. 6, Figs. a, b) Agaricia teunifolia (Dana). Wells, 1973, p. 25, Fig. 13. Diagnosis:Corallum: Desarrolla pequeñas láminas bifaciales, erectas, onduladas, dispuestas en varios planos de crecimiento, divididas por hendiduras verticales. La parte viva de la colonia no rebasa los 10 cm de altura. De color ocre o café, desvanecido hacia los bordes de las láminas. Copas: En grupos o hileras paralelos a los bordes de la colonia dentro de valles discontinuos, rodeados por colinas unas más altas que otras. Con 4 a 5 copas por cm. Septos: En tres ciclos (20-24 por cálice), con las características del género. Los primarios tan anchos como los interespacio, los terciarios menos gruesos y altos. Columnella: Papiliforme, lateralmente aplanada. Habitat: Se encontró comúnmente en el arrecife posterior, en áreas protegidas. Generalmente desarrolla grandes colonias con dimensiones entre 1 y 3 m sobre los restos pétreos de otros corales. Observaciones: A pesar de queA. teunifolia es una especie común en los arrecifes del Caribe, fue reportada en esta región hasta 1973 por Wells en la Isla de Jamaica. Esta especie tiene un cierto parecido con Agaricia agaricites forma danai, esta última pero se distingue por no tener la hendidura y las láminas onduladas. Agaricia lamarckiMilne-Edwards y Haime, 1851 (Lám. 6, Figs. c, d) Agaricia lamarcki Milne-Edwards y Haime. Wells, 1973, p. 26, Figs. 8-10 (sinonímia). Diagnosis:Corallum: Sólo se encontró un desarrollo de varias láminas pequeñas semicirculares, unifaciales con radios menores a 10 cm; identificables solo por las características de la copa. Wells (1973) en su descripción de esta especie, señala que llega a tener diámetros de alrededor de 50 cm. De color ocre con tonos de café. Copas: En hileras concéntricas a lo largo de valles continuos, limitados por colinas bajas, anchas y de crestas romas. Algunas veces las colinas son casi imperceptibles. Septos: En tres ciclos (18-24 por cálice), alternos, de diferente tamaño, más delgados que los interespacios, 8 a 10 de los más largos llegan a la columnella. La disposición superficial y poco inclinada de los septos dan una apariencia estrellada a la copa. Columnella: Papiliforme, lateralmente aplanada, mejor desarrollada que en las otras especies deAgaricia. Habitat: Se encontró únicamente en unos islotes de coral, sobre la planicie de arena frente a la pendinete arrecifal, a una profundidad de alrededor de 25 m. Agaricia fragilisDana, 1846 (Lám. 7, Figs. a, b) Agaricia fragilis Dana, 1846, p. 341 (descripción original).Verrill, 1902, p. 142, Lám. 26, Figs. la, Id (sinonimia).- Smith, 1948, p. 75.- Wells, 1973, p. 25, Fig. 6 (+ var. contracta) (claves). Diagnosis:Corallum: Láminas delgadas (más delgadas que en A. agaricites formapurpurea), generalmente semicirculares, unifaciales, se extienden a partir de un centro de fijación. Alcanzan radios de hasta 15 cm y gruesos de 2 a 3 mm. De color café claro u oscuro. Copas: Arregladas en hileras paralelas a los bordes de las colonias, en valles casi continuos limitados por colinas de la misma altura e inclinadas hacia los bordes de la colonia. Los cálices miden alrededor de 2 mm de diámetro. Septos: Delgados, en tres ciclos (18-24 por cátice). Los primarios y secundarios de igual tamaño, más delgados que los interespacios; los tercearios de menor altura. Columnella: Papiliforme, aplanada lateralmente o subdesarrollada. Habitat: Ocurre raramente en el arrecife posterior. Crece en el interior de cuevas formadas por grandes colonias de M. annularis y A. palmata. Género Helioseris(Ellis y Solander, 1786)
Helioseris cucullata (Ellis y Solander, 1786) (Lám. 7, Figs. c, d) Agaricia nobilis Verrill, 1902, p. 150.-Smith, 1948, p. 75, Lám. 7. Agaricia cucullata (Ellis y Solander).- Almy y Carrión-Torres, 1963 p. 147, Lám. 7a. Helioseris cucullata(Ellis y Solander).- Wells, 1973, p. 25, Fig. 14a, b. Diagnosis: Corallum: Desarrolla delgadas láminas unifaciales, de contorno irregular, semicircular, o circular, extendidas directamente sobre el sustrato a partir de un centro de fijación; generalmente el diámetro de las colonias no Tebasa los 20 cm. La superficie inferior de las láminas presenta estriaciones (costillas). De color café oscuro, en ocasiones los márgenes de los septos aparecen como finas líneas blancas. Copas: Los cálices son de tamaño variable, entre 2 y 5 mm de diámetro. La pared del lado externo de cada copa sobresaliente e inclinada hacia el borde de la colonia. Las copas tienden a separarse conforme aumenta la distancia al centro de fijación, formando grupos o copas solas. Septos: En tres ciclos (18-24 por cálice). Márgenes lisos, a veces con pequeñas espinas iguales a las que se encuentran en la superficie lateral. Los septos que se encuentran en la pared exterior mejor desarrollados y sobresalientes, los de la pared interior menos desarrollados y se continúan para formar costillas en los espacios comprendidos entre las copas. Columnella: Ausente (esta característica la distingue de las especies del géneroAgaricia). Habitat: Se le encontró comúnmente en regiones profundas del arrecife posterior, principalmente en el interior de cuevas poco iluminadas, formadas por grandes ramas de Acropora palmata y masas deMontastrea annularis. También se le observó comúnmente en la pendiente arrecifal entre los 10 y 20 m de profundidad, donde crece en lugares protegidos, entre formaciones de otros corales y cavidades del fondo. Familia Siderastreidae Vaughan y Wells, 1943
GéneroSiderastrea Blainville, 1830
Siderastrea radians(Pallas, 1776) (Lám. 8, Figs. a, b) Madrepora radians Pallas, 1776 (descripción original). Siderastrea radians (Pallas).- Verrill, 1902, p. 153, Lám. 30, Fig. 1 (sinosimia).Smith, 1948, p. 76, Lám. 15.Squires, 1958, p. 248, Lám. 35 y Figs. 1-4, Lám. 36, Fig. 3 (sinonimia).- Almy y Carrión-Torres, 1963, p. 148, Lám. 7, Fig. b-Roos, 1964, p. 9.-Roos, 1971, p. 62, Láms. 20, 21. Diagnosis: Corallum: Desarrolla pequeñas masas hemisféricas ligeramente convexas o incrustantes. Con dimensiones generalmente menores a los 20 cm. De color gris o café claros, con tonos de café oscuro. Copas: Poligonales, íntimamente unidas, de 5 a 6 lados (más regulares que en S. siderea). Los cálices miden entre 2 y 4 mm de diámetro y de 1.5 a 2 mm de profundidad (las copas que se encuentran en los bordes de las colonias a veces tienen cálices con dimensiones menores). Septos: En cuatro ciclos (48 a 50 por cálice), los dos primeros ciclos de igual tamaño y llegan a la columnella; los restantes de menor tamaño. Unidos por anillos concéntricos de sinaptícula. Los bordes de las copas son romos (el ángulo de los septos al unirse con los de copas anexas es mayor que en S.siderea). Columnella: Poco desarrollada, papiliforme. Habitat: Se encuentra ocasionalmente en el arrecife posterior donde crece sobre fondos rocosos. También se distribuye comúnmente en la pendiente arrecifal entre los 5 y 20 m de profundidad. Observaciones: Las especies del géneroSiderastrea son difíciles de reconocer bajo el agua. S. radians se distingue por desarrollar colonias y copas de menores dimensiones que las de S.siderastrea, y además se puede distinguir por tener los bordes romos de las copas. Siderastrea siderea (Ellis y Solander, 1786)(Lám . 8, Figs, c, d) Madrepora siderea Ellis y Solander, 1786, p. 168, Lám. 49, Fig. 2 (descripción original). Siderastrea sideera (Ellis y Solander).- Verrill, 1902, p. 151.- Smith, 1948, p. 76, Lám. 10.-Squires, 1958, p. 249, Lám. 36, Figs. 1 y 2 (sinonimia).- Almy y Carrión-Torres, 1963, p. 148, Lám. 7, Fig. c-Roos, 1971, p. 63, Lám. 13, Figs. a, b. Diagnosis:Corallum: Desarrolla masas hemisféricas con dimensiones que pueden llegar hasta 80 cm. También se puede encontrar como pequeñas masas convexa o incrustantes. De color café rojizo oscuro o café con tonos de gris o lila claros. Copas: Poligonales, de lados irregulares, íntimamente unidas por sus paredes. Miden entre 4 y 5 mm de diámetro y 3 mm de profundidad (mayores que en S.radians). Septos: En cinco ciclos (50 a 60 por cálice). Los márgenes más inclinados que en S. radians, finamente aserrados y lateralmente espinosos. Los bordes de las copas agudos (el ángulo que forman los septos al unirse con los de copas anexas es menor que en S.radians). ColumnellasPoco desarrollada papiliforme. Habitat: Se encontró comúnmente en el arrecife posterior donde desarrolla grandes colonias hemisféricas sobre el fondo rocoso, o en las praderas de Thalassia. También se observó en la pendiente arrecifal entre los 10 y 20 m de profundidad como pequeñas colonias convexas. Familia Poritidae Gray, 1842
GéneroPorites Link, 1807
Porites astreoides Lesueur, 1820 (Lám. 9, Figs. a, b) Porites astreoides Lesueur, 1820.- Verrill, 1902, p. 160, Lám. 31, Fig. 4 (sinonimia).- Smith (1948), p. 77, Lám. 19.- Squires, 1958, p. 250, Lám. 18, Fig. a, Lám. 19, Fig. a. Diagnosis: Corallum: Desarrolla generalmente masas redondas cubiertas por montículos, platos ligeramente cóncavos o pequeñas incrustaciones. Las dimensiones de las colonias no rebasan los 40 cm. De color amarillo limón o café oscuro. Copas: Cálices de forma circular de 1 mm de diámetro, poco profundos, de paredes porosas. Septos: En dos ciclos (12 por cálice), lateralmente espinosos, algunos de los septos del primer ciclo presentan pali y dos tubérculos espinosos en sus márgenes, uno en el borde del cálice y otro antes del pali. Los pali tienen aspecto de cuerpos espinosos. Columnella: Aparece como un cuerpo delgado erecto y espinoso, generalmente poco desarrollado. Habitat: Es común en el arrecife posterior, donde crece entre las praderas deThalassia o sobre fondos rocosos. Las colonias en forma de plato son menos frecuentes y se encuentran en las bases de M. annularis y A. palmata. También se distribuye en la pendiente arrecifal entre los 10 y 20 m de profundidad donde desarrolla pequeñas colonias de color café oscuro. Porites porites(Pallas, 1766) (Lám. 9, Figs. c, d) Madrepora porites Pallas, 1776, p. 324 (descripción original). Porites polymorpha Link, Verrill, 1902, p. 158, Lám. 31, Figs. 3, 3a. Porites porites (Pallas). Smith, 1948, p. 78, Láms. 13 y 14.Squires, 1958, p. 251, Lám. 38, Figs. 1-3, Lám. 39, Fig. 1 (+ var. clavaria, + var. furcata, + var. divaricata).- Roos, 1971, pp. 58-59, Lám. 16, Figs. a, b, Lám. 17, Figs. a, b (+ var. clavaria, + var. furcata, + var. divaricata). Diagnosis: Corallum. Ramificado. Puede encontrarse formando ramilletes sueltos o como grandes empalizadas (Lám. 18, Figs. a y b). Las ramas son cilíndricas, bifurcadas en varios planos, con tendencia a aplanarse en el plano de bifurcación; el diámetro varía entre 1.5 y 2.5 cm. Las ramas terminan en extremos romos o aguzados. De color café claro o gris con tonos lilas, polipos blancos. Copas: De forma circular, de aproximadamente 2 mm de diámetro, poco profundos (mayores que en las otras especies dePorites). Septos: En dos ciclos (12 por cálice). Lateralmente espinosos con dos protuberancias en sus márgenes: uno en el borde del cálice y otros antes del pali. Los del segundo ciclo se fusionan al nivel del pali con los del primer ciclo, continuándose hasta la columnella con la cual se fusionan. El primer ciclo con pali (6 en total). Columnella. Se desarrolla como un cuerpo eréctil espinoso a la misma altura que los pali, en ocasiones es poco desarrollada. Habitat: Es común en el arrecife posterior, donde desarrolla grandes acumulaciones en los límites con la zona de A. palmataTambién se encuentra en la pendiente arrecifal entre los 15 y 20 m donde desarrolla pequeños ramilletes aislados. Porites furcata (Lamarck), 1816 (Lám. 10, Figs. a, b) Porites porites var. furcata (Lamarck).- Squires 1958, p. 525, Lám. 39, Fig. 1 (sinonimia).- Almy y Carrión-Torres, 1963, p. 149, Lám. 9, Fig. b-Roos, 1971, P. 59. Porites furcata (Lamarck).- Smith, 1948, p. 78, Lám. 12. Diagnosis:Corallum Ramificado. Desarrolla pequeños ramilletes o grandes empalizadas. Las ramas están ligeramente aplanadas en el plano de bifurcación y miden entre 8 y 15 mm de diámetro (menos gruesas que las de P. Porites), frecuentemente con una terminación fiburcada. De color amarillo limón, rara vez de color café claro o gris. Copas: Circulares, entre 1.5 y 2 mm de diámetro (menores que los de P.porites). Septos. En dos ciclos (12 por cálice), porosos y espinosos. Los del primer ciclo presentan pali (generalmente entre 3 y 6). Columnella: Cuerpo eréctil espinoso, generalmente subdesarrollado. Habitat. Ocurre en el arrecife posterior, donde desarrolla pequeños ramilletes sobre el fondo rocoso entre corales de mayor tamaño. Ocasionalmente se observó formando grandes empalizadas en aguas someras de la laguna, entre los pastos deThalassia. Porites divaricataLesueur, 1820 (Lám. 10, Figs. c, d) Porites porites var. divaricata (Lesueur).- Squires, 1958, p. 252, Lám. 38, Fig. 3 (sinonimia).- Almy y Carrión-Torres, 1963, p. 149, Lám. 8, Fig. b-Roos, 1971, P. 59. Diagnosis:Corallum. Ramificado con ramas de aproximadamente 6 mm de diámetro (menor que en P.furcata), el cual es constante a lo largo de éstas. De color amarillo limón en aguas someras, ocre claro o café oscuro en aguas profundas. Copas: Con diámetros de 1 a 1.5 mm de menor tamaño que en P.furcata. Septos: Menos desarrollados que en P.furcata. Columnella: Subdesarrollada. Habitat: Se observó raramente cerca de la playa entre laThalassia formando pequeños ramilletes de dos o tres ramas, en ocasiones semicubiertas por arena. También ocurre raramente en el arrecife posterior y en la pendiente arrecifal entre los 10 y 20 m. Habitat:Se observó raramente cerca de la playa entre laThalassia formando pequeños ramilletes de dos o tres ramas, en ocasiones semicubiertas por arena. También ocurre raramente en el arrecife posterior y en la pendiente arrecifal entre los 10 y 20 m. Familia Faviidae Gregory, 1900GéneroFavia Oken, 1815
Favia fragum (Esper, 1797) (Lám. 11, Figs. a, b) Madrepora fragum Esper, 1797, p. 79, Lám. 54 (descripción original). Favia gragum (Esper). Verrill, 1902, p. 90, Lám. 13, Figs. 1-2.Smith, 1948, p. 79, Láms. 16 y 17.-Squires, 1958, p. 253, Lám. 34, Figs. 2 y 3 (sinonimia).-Almy y Carrión-Torres, 1963, p. 150, Lám. 10, Fig. c. Diagnosis: Corallum: Desarrolla pequeñas masas hemisféricas o ligeramente convexas, generalmente con dimensiones alrededor de 5 cm. De color ocre o café claro, las copas oscuras con los bordes de los cálices claros. Copas: Cálices de contorno circular, elíptico o irregular; diámetros mayores entre 5 y 6 mm, los menores entre 4 y 5 mm. En ocasiones las copas presentan dos o tres centros. Septos: En cuatro ciclos, incompletos (entre 36 y 40 por cálice). Márgenes dentados, superficie lateral espinosa. Columnella: Ancha, de apariencia esponjosa. Habitat: Se encuentran comúnmente en el arrecife posterior. Crece sobre el fondo rocoso o sobre los restos pétreos de otros corales, principalmente sobre los de A. palmata. Género Diploria Milne-Edwards y Haime, 1848
Diploria clivosa (Ellis y Solander, 1786).(Lám. 11, Figs. c, d) Madrepora clivosa Ellis y Solander, 1786, p. 163 (descripción original). Meandra clivosa (Ellis y Solander).- Verrill, 1902, p. 78. Diploria clivosa (Ellis y Solander).- Smith, 1948, p. 80, Láms. 19 y 20.-Squires, 1958, p. 253, Lám. 42, Fig. 2 (sinonimia).- Almy y Carrión-Torres, 1963, p. 151, Lám. 10, Fig. b-Roos, 1971, p. 69, Lám. 23, Fig. b. Diagnosis:Corallum: Desarrolla masas planas o ligeramente convexas, ocasionalmente de forma irregular con protuberancias; firmemente sujeto al fondo en toda la extensión de su base. Las colonias miden generalmente aproximadamente 1 m de diámetro. De color gris con tonos café y verdes u ocre claro. Copas: Meandroides. Valles interrumpidos, muy sinuosos (más que en las otras especies del género). Con dimensiones entre 3 y 4 mm de ancho menor al de otras especies del género. Septos: En dos series alternas de diferente tamaños (entre 30 y 40 por cm). Los más grandes presentan lóbulos paliformes y llegan a la columnella. Sobresalientes y continuos sobre la colina, forman un borde agudo. Lateralmente espinosos, márgenes dentados. Columnella: Bien desarrollada y continua, constituida por trabéculas retorcidas, de apariencia esponjosa, de 1 mm. de ancho. Habitat: Ocurre comúnmente en el arrecife posterior, donde crece sobre fondos rocosos. También se le observó en la pendiente arrecifal entre los 3 y 10 m de profundidad, donde la acción del oleaje sobre el fondo aún es notable. Diploria strigosa(Ellis y Solander, 1786) (Lám. 12, Figs. a, b) Madrepora cerebrum Ellis y Solander, 1786, p. 163 (descripción original). Meandra cerebrum (Ellis y Solander).- Verrill, 1902, P. 74, Lám. 10, Fig. 4, Lám. 12, Fig. 4, Lám. 14, Figs. 4 y 5. Diploria strigosa (Ellis y Solander).- Smith, 1948, p. 81, Lám. 22.Squires, 1958, p. 253, Lám. 42, Fig. 1 (sinonimia).- Almy y Carrión-Torres, 1963, p. 151, Lám. 10, Fig. b-Roos, 1964, p. 11.-Roos, 197, p. 70, Lám. 29, Figs. a, b. Diagnosis: Corallum: Desarrolla masas hemisféricas con dimensiones que generalmente no rebasan 1.5 m. De color ocre claro, café oscuro, en ocasiones los valles son verdes. Copas: Meandroides. Forman valles continuos más o menos sinuosos eventualmente interrumpidos a veces casi rectos, de 7 mm de profundidad y de 4 a 10 mm de ancho. Las colonias miden alrededor de 4.5 mm de grueso. Septos: En dos series alternas de diferente tamaño (15 a 20 por cm). Los septos de mayor tamaño presentan lóbulos paliformes y llegan a la columnella. Márgenes dentados, superficie lateral espinosa. Sobresalientes, continuo sobre la colonia. Columnella: Continua, formada por trabéculas retorcidas, de apariencia esponjosa. Habitat: Se encuentra comúnmente en el arrecife posterior, donde generalmente crece sobre el fondo rocoso. También se le observó ocasionalmente en la pendiente arrecifal como pequeñas colonias convexas. Diploria labyrinthiformis(Linnaeus, 1758) (Lám. 2, Figs. c, d) Madrepora labyrinthiformis Linnaeus, 1758, p. 794 (descripción original). Meandra labyrinthiformis (Linnaeus).- Verrill, 1902, p. 70, Lám. 10, Figs. 1 y 3. Diploria labyrinthiformis(Linnaeus).- Smith, 1948, p. 81, Lám. 21.-Almy y Carrión-Torres, 1963, p. 151, Lám. 32, Fig. a-Roos, 1964, p. 10.-Roos, 197, p. 71, Lám. 32, Figs. a, b. Diagnosis:Corallum: Desarrolla masas redondas o hemisféricas, con dimensiones generalmente menores de 1 m. De color ocre claro con tonos amarillos o café, los vales oscuros a veces verdes. Copas: Meandroides. Forman valles retorcidos, en ocasiones casi rectos en los bordes de la colonia, de 0.5 a 1 cm de ancho y 0.5 cm de profundidad. Las colinas son gruesas, entre 1.5 y 2 cm de ancho, con una ranura poco profunda (ambulacrum) de 5 a 8 mm de ancho. Este último carácter distingue a esta especie de las otras del géneroDiploria. Septos: En dos series alternas de diferente tamaño (entre 14 y 17 por cm); la serie de mayor tamaño presenta lóbulos paliformes que alcanzan la columnella (más gruesos que los de D. strigosa): Márgenes dentados los dientes de la parte superior del septo sobresalientes, dirigidos oblicuamente hacia arriba no se unen con los valles contiguos por la presencia del ambulacrum. Superficie lateral espinosa. Columnella: Tiene entre 2 y 3 mm de ancho, formada por trabéculas retorcidas, de apariencia esponjosa. Habitat: Ocurre comúnmente en la pendiente arrecifal, en profundidades mayores de 10 m. Se le encontró ocasionalmente en el arrecife "parche" de la laguna. GéneroManicina Ehrenbeg, 1834
Manicina areolata (Linnaeus, 1758) (Lám. 13, Figs. a, b) Madrepora areolata Linnaeus, 1758, p. 759 (descripción original). Meandra areolata (Linnaeus).- Verrill, 1902, p. 81, Lám. 11, Figs. 1, 2, Lám. 12, Figs. 1-3 (sinonimia). Manicina areolata(Linnaeus).- Smith, 1948, p. 83, Lám. 25, 26, 27.-Almy y Carrión-Torres, 1963, p. 152, Lám. 11, Fig. b (+ var. hispida, + var. laxifolia, + var. mayori).- Roos, 1971, p. 72, Lám. 35, Figs. a, b. Diagnosis: Corallum: Presenta dos formas: M. areolata formaareolata(Linnaeus): Desarrolla colonias de contorno ovalado y superficie convexa. En la base presenta una pequeño pie de forma cónica. El diámetro mayor no rebasa los 10 cm y el menor los 5 cm. De color ocre claro con tonos café, los valles presentan tonos verdes (Fig. a). M. areolata forma mayori(Linnaeus). Desarrolla colonias redondas casi hemisféricas, de base plana. Las dimensiones no rebasan los 15 cm. De color ocre claro a veces con tonos claros de café (Fig. b). Copas: En la forma areolata son continuas, forman un valle longitudinal del cual parten perpendicularmente ramales hacia los bordes de la colonia. Las colinas separadas y perpendiculares a los bordes de la colonia. Los valles tienen entre 12 y 24 mm de ancho (Fig.). En la formamayori las capas son meandroides. Forman valles largos y sinuosos casi completamente interconectados, miden entre 12 y 20 mm de ancho y 10 mm de profundidad (Lám. 13, Figs a, b). Septos: En dos series alternas de diferente tamaño (12 a 18 por cm). Los de mayor tamaño con un lóbulo paliforme prominente. Los márgenes con dientes delgados erectos de tamaño variable. Superficie lateral espinosa. Continuos sobre la colina, a veces separados por una ranura. Columnella: De apariencia esponjosa, continua, con 2 a 4 mm de ancho. Habitat: La formaareolata se encuentra comúnmente entre laThalassia y otro pastos marinos, cerca de la playa, hasta profundidades de 2 m. Crece sobre sedimentos, los cuales a veces cubren parcialmente al corrallum. También se le encontró ocasionalmente en la pendiente arrecifal entre los 15 y 20 m, donde crece sobre pequeños bancos de sedimentos. La formamayori se encontró raramente en el arrecife posterior, donde crece fija al fondo o a los restos pétreos de otros corales. Observaciones: La Dra. Lang (comunicación personal) recomienda que para el reconocimiento de las dos formas se adopta el criterio de incluir a las colonias fijas a un sustrato en la formamayori; sin embargo, a pesar de que esto sucede en la mayoría de los casos, en área de estudio se observaron colonias creciendo sobre sedimentos con las características de la formamayori. Género ColpohylliaMilne-Edwards y Haime,
Colpophyllia natans (Muller, 1775) (Lám. 14, Figs. a, b) Colpophyllia natans (Muller).- Smith, 1948, p. 83, Lám. 23. Almy y Carrión-Torres, 1963, p. 73, Lám. 33, Figs. a, b. Diagnosis: Corallum: Desarrolla grandes masas hemisféricas, convexas o, irregulares. Con dimensiones que generalmente no rebasan a 1.5 m. Copas: Continuas, meandroides. Forman valles interrumpidos, sinuosos o casi rectos. Los valles miden entre 15 y 20 mm de ancho. Las colonias miden de 15 a 22 mm de ancho en la base; en su parte posterior presentan una ranura que las recorre a lo largo. De color café oscuro con tonos de ocre, en ocasiones los valles son verdes. Septos: En dos series, casi del mismo tamaño (entre 8 y 9 por cm). Los márgenes se encuentran finamente dentados y la superficie lateral espinosa. Columnella: Trabecular, no muy aparente. Habitat: Se observó comúnmente en el arrecife posterior, crece junto a colonias de M. annularisen los límites con la laguna. También es común en la pendiente arrecifal, donde desarrolla grandes colonias convexas entre colonias de octocorales hexacorales en profundidades que fluctúan entre los 10 y 20 in. Para propósitos de comparación en la lámina 14 se presentan dos ilustraciones fotográficas (Figs. c, d) de la especieC. breviserialis, la cual no es incluida en este trabajo. GéneroMontastrea Blainville, 1830
Montastrea annularis (Ellis y Solander, 1786) (Lám. 15, Fig. a) Madrepora annularis Ellis y Solander, 1786, p. 169 (descripción original). Orbicella annularis (Ellis y Solander).- Verrill, 1902, p. 94, Lám. 15, Figs. 1 y 2 (sinonimia). Montastrea annularis (Ellis y Solander).- Smith, 1948, p. 85, Lám. 31.-Squires, 1958, p. 256, Lám. 40, Fig. 3 (sinonimia).Almy y Carrión-Torres, 1963, p. 154 Lám. 14, Fig. a-Roos, 1964, p. 11, Lám. 11.-Roos: 97 1, p. 65, Lám. 32, Figs. a, b. Diagnosis: Corallum: Desarrolla grandes colonias masivas, hemisféricas, cónicas o ligeramente convexas. Con dimensiones que fluctúan entre 1 a 3 m. De color gris, ocre claro, café oscuro o amarillo limón. Copas: Sobresalientes, cálices circulares. El diámetro del cáliz varía entre 2 y 3 mm. Septos: En 3 ciclos (24 por cáliz), el primer y segundo ciclo llegan a la columnella. Márgenes dentados sólo en los dos primeros ciclos; superficie lateral finamente granulada. Sobresalientes, forman costillas que se unen a las copas anexas sobre el coenosteum. Columnella: Trabecular, aparente. Habitat: Es predominante en el arrecife posterior. Su presencia caracteriza a una zona en los límites con la laguna. También se encontró comúnmente en la pendiente arrecifal donde desarrolla pequeñas colonias convexas, así como grandes colonias hemisféricas o cónicas. Montastrea cavernosa (Linnaeus, 1776) (Lám. 15, Figs. b, c) Madrepora cavernosaLinnaeus, 1776, p. 1276 (descripción original). Orbicella cavernosa (Linnaeus).- Verrill, 1902, p. 102 (sinonimia). Montastrea cavernosa(Linnaeus).- Smith, 1948, p. 86, Lám. 33.Squires, 1958, p. 255, Lám. 40, Figs. 1, 2 (sinonimia).- Almy y Carrión-Torres, 1963, p. 154, Lám. 14, Fig. b-Roos, 1964, p. 11.Roos, 1971, p. 66, Lám. 22, Fig. c, Lám. 23. Diagnosis:Corallum: Desarrolla masas redondas o cónicas, con dimensiones que no rebasan los 1.5 m. De color olivo, gris o café oscuro. Copas: Cálices circulares sobresalientes, de 5 a 6 mm de diámetro. Septos: En cuatro ciclos (generalmente con 48 septos por cálice), los tres primeros ciclos llegan a la columnella. Márgenes finamente aserrados. Sobresalientes sobre el borde del cálice; desarrollan costillas. Columnella: Trabecular, aparente. Habitat: Se observan colonias ocasionalmente en el arrecife posterior. Es común en la pendiente arrecifal, donde las colonias presentan dimensiones mayores que en el arrecife posterior. Observaciones: Se colectaron colonias con dimensiones menores a los 20 cm, los cuales presentaban cálices con diámetros mayores a lo normal. Smith (1948) redescribió aM. braziliana Verrill, indicando que difiere únicamente de M. cavernosa por tener sus cálices de mayor tamaño. Almy y Carrión-Torres (1963) también observan lo anterior y deciden en base a una comunicación personal con el Dr. Wells, reconocerla como M. cavernosa. GéneroSolenastrea Milne-Edwards y Haime, 1848
Solenastrea bournoniMilne-Edwards y Haime, 1848 (Lám. 6, Figs. a, b) Solenastrea bournoni Milne-Edwards y Haime, 1848 (descripción original).- Smith, 1948, p. 84.- Almy y Carrión-Torres, 1963, p. 154, Lám. 13, Fig. b-Roos, 1971, p. 67, Lám. 24, Fig. a, Lám. 25, Fig. b. Diagnosis:Corallum: Desarrolla colonias hemisféricas o en forma de domo. Con dimensiones que no rebasan los 40 cm. De color blanco, cálices café oscuro. Copas: Cálices circulares, a veces irregulares. Los cálices miden entre 2 y 2.5 mm de diámetro. Separados entre 1 y 2 mm. Septos: En tres ciclos (24 por cálice). Los dos primeros ciclos llegan a la columnella y presentan lóbulos paliformes; los del tercer ciclo son más cortos. Márgenes aserrados, costillas cortas; superficie lateral finamente granulada. Columnella: Aparece como un pequeño tubérculo. Habitat: Se observó raramente en la pendiente arrecifal a profundidades entre los 10 y 20 m. Solo en una ocasión se observó una colonia de 1.5 m dentro de la zona lagunar. FamiliaMeandrinidaeGray, 1847
Género Meandrina Lamarck, 1810
Meandrina meandrites (Linnaeus, 1758) Meandrina meandrites (Linnaeus), 1758. Smith, 1948, p. 89, Lám. 35.-Almy y Carrión-Torres, 1963, p. 65, Lám. 16, Fig. b-Roos, 1964, p. 12, Lám. 10, Fig. 2. - Roos, 1971, p. 76, Lám. 49, Figs. a, b. Diagnosis:Corallum: Presenta dos formas de crecimiento: M. meandrites forma meandrites: Desarrolla colonias planas o ligeramente convexas, de dimensiones menores a 1 m. De color ocre claro casi blanco, con tonos de gris y café (Lám. 16, Figs. c, d). M. meandrites forma danai: Desarrolla colonias planas o redondas, cuyas dimensiones no rebasan los 15 cm (menores que en la forma típica). De color café oscuro (Lám. 16, Figs. a, b). Copas:M. meandrites forma meandrites: En series continuas, meandroides. Valles largos no interconectados, con aproximadamente 10 mm de ancho y 8 mm de profundidad. Las colonias presentan una ranura (Lám. 16, Fig. d). M. meandrites formadanai: En series continuas meandroides. Valles interconectados, convergen radialmente al centro de la colonia o en un valle transversal. Los valles y colinas un poco más grande a los de la forma típica (Lám. 17, Fig. b). Septos: En dos series alternas de diferente tamaño (entre 6 y 8 por cm). Solo los septos de mayor tamaño llegan a la columnella. Los márgenes son lisos y la superficie lateral granulada. Sobresalientes, alternos con los valles adjuntos, con una ranura que los separa en la cresta de la colina. Columnella: Laminar y discontinua. Habitat: La forma meandrites se encuentra raramente en el arrecife posterior, pero ocurre en la pendiente arrecifal donde es más común. La forma danaise encontró igualmente en el arrecife posterior y en la pendiente arrecifal, pero con mayor frecuencia en la primera región. GéneroDichocoeniaMilne-Edwards y Haime, 1848
Dichocoenia stokesi Milne-Edwards y Haime, 1848 (Lám. 17, Figs. c, d) Dichocoenia stokesi Milne-Edwards y Haime, 1848.Smith, 1948, p. 90, Lám. 37.-Squires, 1958, p. 257, Lám. 34, Fig. 4 (sinonimia).- Almy y Carrión-Torres, 1963, p. 157, Lám. 17, Fig. a-Roos, 1964, p. 14.Roos, 1971, p. 77, Láms. 41-43. Diagnosis: Corallum: Desarrolla masas hemisféricas o convexas de dimensiones que no rebasan los 30 cm. De color ocre con tonos de café, las copas de color más oscuro. Copas: Monocéntricas o continuas. En las monocéntricas los cálices tienen forma elíptica y miden de 10 a 12 mm de largo y 3 a 5 mm de ancho. En las continuas los cálices miden hasta 10 cm de largo. Sobresalientes, separados por un coenosteum granulado. Septos: En dos series alternas de diferente tamaño (aproximadamente 10 por cm). Los de mayor tamaño llegan a la columnella y presenta lóbulos paliformes. Sobresalientes, forman costillas. Márgenes lisos, superficie lateral granulada. Columnella: Trabecular. Habitat: Se encuentra comúnmente en el arrecife posterior, donde crece sobre el fondo rocoso o sobre los restos de otros corales. También ocurre en la pendiente arrecifal hasta profundidades de 20 m. Dichocoenia stellarisMilne-Edwards y Haime, 1849 (Lám- 8, Figs. a, b) Dichocoenia stellaris Milne-Edwards y Haime-Wells, 1973, p. 45, Figs. 31, 33 (sinonimia). Diagnosis:Corallum: Desarrolla masas ligeramente convexas, de contorno circular o irregular, de diámetro menor a los 20 cm. De color ocre claro, cálices oscuros. Copas: Monocéntricas, cálices circulares, de apariencia estrellada; los cálices de mayor tamaño tienden a ser elípticos, miden hasta 12 mm de diámetro mayor. El crecimiento de la colonia es por gemación extratentacular por lo cual, en la superficie del coenosteura aparecen pequeñas copas estrelladas; este último carácter la distingue de D. stokesi, aunque presenta también en ocasiones gemación intratentacular como en esta última especie. Septos: Como en D. stokesi. Columnella: Fascicular o laminar. Habitat: Es común en la pendiente arrecifal a profundidades mayores a los 10 m. Ocupa lugares protegidos, desprovistos de sedimentos. GéneroDendrogyraEhrenberg 1834
Dendrogyra cylindrus Ehrenberg, 1834 (Lám. 18, Figs. c, d) Dendrogyra cylindrus Ehrenberg Smith, 1948, p. 90, Láms. 38, 39.-Almy y Carrión-Torres, 1963, p. 157. Lám. 17, Fig. b-Roos, 1971, p. 76, Lám. 40, Figs. a, b. Diagnosis:Corallum: Desarrolla pilares, masivos cilíndricos que termina en extremos romos, no mayores a 1 m de altura. Se originan de una base común, fija firmemente al sustrato. De color ocre oscuro o café, pólipos blancos. Copas: Continuas, forman valles continuos, angostos y sinuosos, de 3 a 4 mm de ancho y 4 a 6 mm de profundidad. Las colinas tienen entre 3 y 5 mm de gruesa. Septos: En dos series de diferente tamaño (entre 7 y 10 por cm). Los de mayor tamaño sobresalientes, miden aproximadamente 1 mm de grosor y llegan a la columnella. Márgenes lisos, arqueados en la porción superior. La superficie lateral es granulada. Columnella: Laminar discontinua con 1 mm de grosor. Habitat: Ocurre ocasionalmente en el arrecife posterior, en los límites con las praderas deThalassia. FamiliaMussidae Ortmann, 1890
GéneroMussa Oken, 1815
Mussa angulosa (Pallas, 1766) (Lám. 19, Figs. a, b) Madrepora angulosa Pallas, 1766, p. 299 (descripción original). Mussa angulosa (Pallas).- Verrill, 1902, p. 131 (sinonimia). Smith, 1948, p. 92, Láms. 41-42.- Almy y Carrión-Torres, 1963, p. 158, Lám. 18, Fig. a-Roos, 1964, p. 13, Láms. 8.- Roos, 1971, p. 79, Láms. 45, 46. Diagnosis: Corallum: Desarrolla ramas cortas divergentes, terminadas en copa. En conjunto la colonia tiene forma redonda, con dimensiones que no rebasan los 50 cm. De color verde iridiscente o café con tonos verdes y grises. Copas: De contorno elíptico o irregular; el diámetro mayor fluctúa entre 5 y 10 cm, el menor entre 4 y 6 cm. Contienen desde uno hasta cuatro centros. Septos: Entre 8 y 10 por cm de los, cuales 4 a 5 llegan a la columnella. Los márgenes presentan 9 dientes orientados oblicuamente hacia arriba; la superficie lateral espinosa. Sobresalientes, desarrollan costillas dentadas sobre la epitheca. Columnella: Trabecular, se encuentra bien desarrollada en cada centro. Habitat: Sólo en una ocasión se observó en el arrecife posterior; habita comúnmente la pendiente arrecifal entre los 10 y 20 m de profundidad, donde crece sobre fondos con poca deposición. GéneroIsophyllia Milne-Edwards y Haime, 1851
Isophyllia sinuosa(Ellis y Solander, 1776) (Lám. 19, Figs. c, d) Isophyllia dipsacea (Dana).- Verrill, 1902, p. 118 (Lám. 28, Figs. 1, 2, Lám. 17, Figs. 1-7, Lám. 19, Figs. 1, 4, 5 (sinonimia). Isophyllia fragilis(Dana).- Verrill, 902, p. 121, Lám. 17, Figs. Isophyllia multiflora Verrill, 1902, p. 125, Lára. 20, Fig. 1, Lám. 24, Fig. 1.- Smith, 1948, p. 94, Lám. 47. Almy y Carrión-Torres, 1963, p. 160, Lám. 19, Fig. b. Isophyllia sinuosa (Ellis y Solander).- Smith, 1948, p. 94, Lám. 46.-Almy y Carrión-Torres, 1963, p. 159, Lám. 20, Figs. a, b (+var. dipsacea, + var. Iragilis). Squires, 1958, p. 257, Lám. 40, Fig. 4 (sinonimia).Roos, 1971, p. 81, Lám. 40, Lám. 50. Diagnosis:Corallum: Desarrolla masas redondas entre 10 y 15 cm. Presenta variabilidad en el color; las colonias pueden ser café claro, ocre claro, gris con tonos verdes, verdes limón, café oscuro con tonos azulados. Copas: Forman valles continuos y alargados, de contorno irregular, de 3 a 6 cm de largo y 1 a 3 cm de ancho, de 2 a 4 centros. En ocasiones se encuentran copas monocéntricas de forma circular, especialmente en los bordes de la colonia o en colonias poco desarrolladas. Las colonias son altas y de bordes agudos. Septos: En dos series alternas de diferente tamaño (7 a 9 por cm). Los de mayor tamaño llegan a la columnella. Los márgenes presentan de 6 a 10 dientes los cuales se dirigen oblicuamente hacia arriba; superficie lateral espinosa. Columnella: Trabecular, bien desarrollada, de 3 a 4 mm de diámetro. Habitat: Es común en el arrecife posterior, donde crece sobre fondo rocoso o sobre los restos de A. palmata o M. annularis. GéneroIsophyllastreaMattai, 1928
Isophyllastrea rigida (Dana, 1846) (Lám. 20, Figs. a, b) Astrea rigida Dana, 1846, p. 237, Lám. 12, Figs. 8a, 8b (descripción original). Mussa rigida (Dana).- Verrill, 1902, p. 127, Lám. 25, Figs. 2, 3 (sinonimia). Isophyllastrea rigida(Dana).- Smith, 1948, p. 92, Lám. 43.Squires, 1958, p. 258 (sinonimia).- Roos, 1971, p 80, Lám. 47, Figs. a, b. Diagnosis:Corallum: Desarrolla masas hemisféricas, convexas ocasionalmente planas., con dimensiones que no rebasan los 30 cm. De color gris con tonos café, cálices oscuros en ocasiones verdes. Copas: Generalmente monocéntricas, a veces con 2 a 3 centros, de forma poligonal o irregulares. Los cálices miden de entre 1 y 1.5 cm de diámetro. Las colinas presentan una ranura dispuesta longitudinalmente. Septos: En tres ciclos de diferente tamaño (20-24 por cálice). Los septos más grandes llegan a la columnella. Los márgenes presentan de 6 a 8 dientes irregulares, dirigidos oblicuamente hacia arriba; la superficie lateral es espinosa. Columnella: Subdesarrollada, formada por unas cuantas trabéculas entrelazadas. Habitat: Se encuentra comúnmente en el arrecife posterior entre corales de mayor tamaño sobre fondo rocoso. Ocurre ocasionalmente sobre el fondo en un arrecife "parche" de la laguna. GéneroMycetophylliaMilne-Edwards y Haime, 1848
Mycetophyllia lamarckiana Milne-Edwards y Haime, 1848 (Lám. 20, Figs. c, d) Mycetophyllia lamarckiana Milne-Edwards y Haime,- Smith, 1948, p. 93, Láms. 44, 45.- Almy y Carrión-Torres, 1963, p. 158, Lám. 19, Fig. a-Roos, 1971, p. 82, Lám. 49- Wells, 1973, p. 34, Fig. 16. Diagnosis:Corallum: La superficie calcular plana, de contorno casi circular, se fijan al sustrato por medio de un pie, con diámetros que no rebasan los 20 cm. El crecimiento de la colonia es por gemación circumoral e intramural. Presenta una epiteca. De color ocre o café claros, las colinas oscuras, a veces los centros verdes. Copas: Desarrollan centros dispuestos uni o diserialmente, en valles continuos anchos y poco profundos. Los valles se encuentran radialmente dispuestos, así como las colinas que los delimitan. Las colinas generalmente ausentes del centro de las colonias, a excepción de colonias jóvenes. Los valles miden de 10 a 20 mm de ancho. Septos: En dos ciclos de igual grosor más delgados que los interespacios (10 a 15 por centro y 8 a 19 por cm a lo largo de las colinas). Los márgenes con 7 a 9 dientes, dirigidos oblicuamente hacia arriba; superficie lateral espinosa. Columnella: Ausente, los septos convergen en el centro fusionándose por medio de dos o tres láminas. Habitat: Esta especie es rara en el arrecife posterior, pero predomina en la pendiente arrecifal entre los 10 y 20 m de profundidad. Mycetophyllia aliciae Wells, 1973(Lám. 21, Figs. e, d) Mycetophyllia aliciaeWells, 1973, p. 41, Figs. 25, 26, 27, 28. Diagnosis:Corallum: La superficie calicular plana, a veces ligeramente convexa, de contorno circular e irregular, hasta 50 cm de diámetro. De color verde esmeralda, centros oscuros, septos delineados por un verde más oscuro, colinas oscuras. Copas: Forman centros dispuestos di o triserialmente, en valles continuos de 3 a 8 cm de ancho y entre 3 y 7 mm de profundidad. Las colinas se encuentran dispuestas radialmente, a veces casi imperceptibles. La reproducción es circumoral e intramural. Septos: En dos ciclos, del mismo grueso, igual o más anchos que los interespacios (10 a 15 por centro y 6 a 7 por cm a lo largo de las colinas). Los márgenes presentan dientes cortos y triangulares; superficie lateral con diminutas espinas. Columnella: Ausente. Habitat: Se observó ocasionalmente en la pendiente arrecifal a una profundidad de 20 m. Observaciones: Se distingue in situ de las otras especies del géneroMycetophyllia, por su color verde esmeralda y por la disposición di o triserial de los centros a lo largo de valles continuos. Mycetophyllia danaana Milne-Edwards y Haime, 1848(Lám. 21, Figs. a, b) Mycetophyllia danaana Milne-Edwards y Haime.- Wells, 1973, p. 36, Fig. 17. Diagnosis:Corallum: Desarrolla masas redondas o planas, de contorno irregular, con dimensiones generalmente menores a 25 cm. Coloración en tres distintas variedades: a) color ocre con tonos de café claro. b) café oscuro con tonos en amarillo y verde. c) verde oscuro con tonos en gris. El color de las colinas siempre es más acentuado. Copas: Desarrollan centros dispuestos uniserialmente, separados de 10 a 15 mm en valles continuos y profundos. Los valles miden de 10 a 20 mm de ancho y 10 a 20 de profundidad, limitados por colinas continuas. La reproducción de la colonia es por gemación circumoral intramural. Septos: En dos ciclos de igual grosor, más delgados que los interespacios (10 a 16 por centro y 10 a 12 por cm a lo largo de las colinas). Columnella: Ausente, igual que en M. lamarckiana. Habitat: Se encuentra raramente en el arrecife posterior y es común en la pendiente arrecifal más allá de los 10 m de profundidad. Mycetophyllia aliciaeWells, 1973 (Lám. 21, Figs. c, d) Mycetophyllia aliciaeWells, 1973, p. 41, Figs. 25, 26, 27, 28. Diagnosis:Corallum:La superficie calicular plana, a veces ligeramente convexa, de contorno circular e irregular, hasta 50 cm de diámetro. De color verde esmeralda, centros oscuros, septos delineados por un verde más oscuro, colinas oscuras. Copas:Forman centros dispuestos di o triserialmente, en valles contínuos de 3 a 8 cm de ancho y entre 3 y 7 mm de profundidad. Las colinas se encuentran dispuestas radialmente, a veces casi imperceptibles. La reproducción es circumoral e intramural. Septos:En dos ciclos, del mismo grueso, al igual o más anchos que los interespacios (10 a 15) por centro y 6 a 7 por cm a lo largo de las colinas). Los márgenes presentan dientes cortos y triangulares; superficie lateral con diminutas espinas. Columnella:Ausente. Habitat:Se observó ocasionalmente en la pendiente arrecifal a una profundidad de 20 m. Observaciones:Se distingue in situde las otras especies del géneroMycetophyllia, por su color verde esmeralda y por la disposición di o triserial de loss centros a lo largo de valles contínuos. Mycetophyllia ferox Wells, 1973
(Lám. 22, Fig. a) Mycetophyllia ferox Wells, 1973, p. 40, Figs. 22, 23, 24. Diagnosis:Corallum: Superficie calicular plana, de contorno irregular, con diámetros menores a 40 cm. La superficie inferior solo con trazas de una epiteca, la cual presenta costillas. De color verde olivo, con las bocas de los pólipos de color rosa u oscuro. Copas: Centros separados de 5 a 10 mm, dispuestos uniserialmente en valles discontinuos, que miden menos de 10 mm de ancho, excepto en las bifurcaciones, y de 3 a 5 mm de profundidad. Las colinas levemente sinuosas y continuas, se interconectan para formar valles discontinuos. La reproducción es aparentemente por gemación intramural con una bifurcación terminal. Septos: En dos ciclos de igual grosor, más delgados que los interespacios (16 a 20 por centro y 9 a 11 por cm a lo largo de las colinas); diez de los septos se extienden casi hasta el centro. Los márgenes con 4 a 5 dientes altos y agudos, separados 1 mm, los inferiores de mayor tamaño; superficie lateral con diminutas espinas. Habitat: Se observo raramente en la pendiente arrecifal a profundidades mayores de los 10 m, en lugares protegidos rodeados por otros corales de mayor tamaño. Observaciones: M. ferox se distingue in situ de las otras especies del género, por la presencia de colinas levemente sinuosas, de menor grosor, interconectadas, encerrando bocas de color rosado. Familia Caryophyllidae Gray, 1847
GéneroEusmiliaMilne-Edwards y Haime, 1848
Eusmilia fastigiata(Pallas, 1766) (Lám. 22, Figs. c, d) Madrepora fastigiata Pallas, 1766 (descripción original). Eusmilia áspera (Dana), 1846.- Verrill, 1902, p. 114 (sinonimia). Eusmilia fastigiata (Pallas). Smith, 1948, p. 95, Lám. 48.- Almy y Carrión-Torres, 1963, p. 160, Lám. 21, Fig. a-Roos, 1971, p. 83, Lám. 52, Figs. a, b. Diagnosis:Corallum: Ramificado, ramas bifurcadas con las copas en los extremos. Las ramas miden de 1 a 2 cm de diámetro. En conjunto forman ramilletes redondos con dimensiones que no rebasan los 40 cm. De color ocre claro con tonos de café, cálices oscuros. Copas: De forma elíptica, de 2.5 a 3.5 cm de ancho, mono a triestomodeales. Septos: En tres series alternas de diferente tamaño (15 a 18 por cm). Los de mayor tamaño (de 6 a 9 por cm) llegan a la columnella. Márgenes lisos; superficie lateral granulosa. Sobresalientes. Habitat: Se encuentran comúnmente en el límite de la laguna con el arrecife posterior. También ocurre ocasionalmente en la pendiente arrecifal, entre 8 y 20 m de profundidad. AgradecimientosEl trabajo aquí presentado fue realizado durante el estudio "Evaluación de la Población de Plexaura homomalla en Relación a su Uso Comercial, conducido por el Instituto de Ciencias del Mar y Limnología (ICML) de la Universidad Nacional Autónoma de México (UNAM), con el financiamiento aportado por el Consejo Nacional de Ciencia y Tecnología (CONACYT) durante el período comprendido entre 1976 y 1977. Los autores desean hacer patente su agradecimiento a Agustín Ayala-Castañares, ex Coordinador de la Investigación Científica de la UNAM, por su constante apoyo a través de la realización del presente trabajo. A Alfredo Laguarda Figueras, por el uso de las instalaciones del ICML. Se agradece a Juan Luis Cifuentes de la Facultad de Ciencias (UNAM) y a Santiago R. Olivier, Experto de UNESCO, sus recomendaciones con respecto a la organización del manuscrito original. Asimismo se agradece a Gerardo Green (ICML), la revisión crítica del texto. LITERATURAALMY, C. C., y C. CARRIÓN-TORRES Carib. J. Sci., Shallow-water stony corals of Puerto Rico.1963. 133-162, 1 figs., 21 láms.3 BRAKEL, W. H.,Proceedings Third International Coral Reef Symposium.Corrallite variation in Porites and the species problem. in corals. In: Taylor, D. L. (Ed.) Rosenstiel School of Atmospheric Science University of Miami1977.458-462.1 CHÁVEZ, E. A., An. Esc. Nac. Cienc. Biol. Observaciones generales sobre las comunidades del arrecife de Lobos, Ver.México1973. 13-21.20 CHEVALIER, J. P.,Proceedings of Second Coral Reef Symposium On some aspects of the microstructure of recent scleractinia. In: Camaron, A. M., et al. (Eds.) Great Barrier Reef CommitteeBrisbaneAustralia1974.345-361.2 DANA, J. D., Zoophytes. U.S. Expedition during the years1846.1838-1842. DUARTE-BELLO, P. P., Acuario Nacional Ser. Educacional Corales de los arrecifes Cubanos.1961.1-85, 74 figs. 2 DUCHASSAING, P., y MICHELOTTI J.,Mem. Reale y Accad. Sci. Torino Mémoire sur les corallaires des Antilles.1861.279-365.2 (19) EHRENBERG, C. G., Abhandl. Köngl. Preuss. Akad. Wiss. Beitrage zur physiologisehen Kenntniss der Corallenthiere im allgemeinen, und besonders des rithen Meeres, nébsteinem Versuche zur physiologischen, Systematik derselben. Berlin1834.225-380.1 1832 ELLIS, J. y D. SOLANDERSystematically arranged and described by the late Daniel Solander. The natural history of many curious and uncomon zoophytes, collected from various parts of the globe. London1786.206 p. ERHARDT, H.,Senckenbergiana biol. Liste der scleratinen Korallen der Bahía Concha bei Santa Marta, Atlantikkuste Kolumbien. 1974.399-407. 55 ESPER, E. J. C., Die PflazenthiereNürenberg1797. 169-230.3 GLYNN, P. W., Biology and Geology of Coral Reefs.Aspects of the ecology of coral reefs in the Western Atlantic Region. In: Edean, R. and O. A. Jones (Eds.) Biology. Academic Press New York1973.271-324.2 GOLDBERG , W. M., Bull. Mar. Sci., The ecology of the coral-octocoral communities of the southeast Florida coast; geomorphology, species composition, and zonation.1973.465-487.23 (23) GOREAU, T. F., Ecology The ecology of Jamaican Coral Reefs. Species composition and zonation.1959.67-90.40 (1) GOREAU, T. F. y J. W. WELLSBull. Mar. Sci., The shallow-water Scleractinia of Jamaica: Revised list of species and their vertical distribution range.1967.442-453, 3 figs., 1 tabl.17 GRIMM y S. HOPKINSProceedings Third International Coral Reef Simposium. A preliminary characterization of the octocorallian and scleractinian diversity at the Florida middle grounds. In: Taylor, D. L. (Ed.) Rosenstiel School of Atmospheric Science, University of Miami1977.136-141.1: HYMAN, L. H., The invertebrata: Protozoa Through Ctenophora. Mc Graw-HillNew York 1940.623 p. JAUBERT, J., Proceeding Thirds International Coral Reef Simposium. Light, Metabolism. and growth forms of the Hermatypic Scleractinian Coral Synaraea Convexa Verril in the Lagoon of Moorea (French Polynesia). In: Taylor, D. L. (Ed.) Rosenstiel School of Atmospheric Sciences, University of Miami 1977.484-488.1 JELL, J. S., Proceedings of the Second International Coral Reef Symposium. The microstructure of some scleractinian corals. In: Camaron, A. M., et al. (Eds.) Great Barrier Reef ConimitteeBrisbaneAustralia1974.301-319. 2 KORNICKER, L. S., K. BONET, R. CANN, C. M. HOSKIN Inst. Mar. Sci. Alacran Reef Campeche Bank, México. Publ. Univ. Texas 1958.1-22.6 KULMANN, H. D.,Proceedings of the Second International Coral Reef Symposium The coral reefs of Cuba. In: Carneron, A. M., et al. (Eds.) Great Barrier CommitteeBrisbaneAustralia1974. 69-83 p. 2 - Hydrobiol Charakterisierung der korallenriffe vor Veracruz, Mexiko. Int. Revue ges.1975.495-521.60(4) LAMARCK, J. B. P.,Histoire naturrelle des animaux sons vertébresParís1816.568 p. 2 LANG, J., Bull. Mar. Sci. Interspecific Aggression by Scleractinian Corals. 2 Why the race is not only of the swift.1973.pp. 260-279. (2)Vol. 23 LESUEUR, C. A., Mus. Hist. Nat. Paris, Mem.,Description de plusieurs animaux appartenants aux polypiers larnelliféres de M. La Chev Lamarck 1820271-298, Láms 6 LEWIS, J. B., Canadian J., The coral reefs and comunities of Barbados, W. I.1960.1133-1145.88 LINNAEUS, C., Systema Naturae Holmiae I. Editio décima. Reformata1758. 824 p. MELÉNDEZ, B.,Paleontología, Paraninfo. Madrid1970. 693 p. MILNE-EDWARD, H., y HAIMEAc. Sci. Paris Recherches sur le polypiers. Monographie des eupsammides (Extrait). 1848.538-541. 27 ---, Annls. Sci. Nat., Recherches sur le polypes 4 me Mém. Monographie des astréides Pt. 2. 1849.233-312.3(11) ---, Historie naturelle des coralliaires: (Paries)1857-60.326 p.; 633 p.; 560 p.; 34 Láms. Vol. 1, Vol. 2, Vol. 3. Atlas (1857):, (1957):, (1860):, (1857). MILLIMAN, J. D., Biology and Geology of Coral Reefs.Caribbean Coral Reefs. In: Edean, R. y O. A. Jones (Eds.) Geology. Academic Press, Inc. New York1973.1-50. 1 MOORE, A., Inst. Mar. Sci. Univ. Texas Notes on Blanquilla reef the most notherly coral formation in the western Gulf of México. Pubs.1958. 151-155.5 MÜLLER, P. S. L.,Vollständiges Natursystem Von den Corrallen. Des Ritters Carl Von Linne.1775.2 (6) NEWELL, N. D. American Museum Novitates A noutline of tropical organic reefs. 1971.1-37. 2465 ---, Scientific American The evolution of reefs.1972.54-56.226(6) OEKENTORP, K.Proceedings of the Second International Coral Reef Symposium Electron microscopic studies on skeletal structures in Coelenterata and their Systematic value. In: Cameron, A. M., et al. (Eds.) Great Barrier Reef CommitteeBrisbaneAustralia1974.351-354 2 OKEN, L., Lehrbuch der Naturgeschichte. Zoologie Leipzig1815.57-74. 1 OLIVARES, M. A., A. B. LEONARDBol. Inst. Oceanogr. Univ. Oriente Algunos corales pétreos de la Bahía de Mochima, Venezuela.1971.49-70.10(1) PALLAS, P. S.,Hagae-comitum apud Petrum van Cleef.Elenchus Zoophytorum. 1766. PFAFF, R., Inst. Colombo-Alemán Invest. Cient.,Las Scleractinia y Milleporina de las Islas del Rosario, Mitt.1969.17-24.3 PORTER, J. W., Bull. Biol. Soc. Wash.,Ecology and especies diversity of coral reefs on opposite sides of the Isthmus of Panamá.1972.89-116.2 ROOS, P. J. Studies on the fauna of Curacao an other Caribean Islands The Shallow-waters stony corals of the Netherlands Antillas.1971.1-130.37 SCATTERDAY, J. W.,Proceeding of the Second International Coral Reef Symposium.Reefs and associated coral asserablages off Bonaire, Netherlands Antiles, and their bearing on Pleistocene and Recent reef models. In: Cameron, A. M., et al. (Eds.) Great Barrier Reef CommitteeBrisbaneAustralia1974.85-106.2 SMITH, F. G. W., Atlantic reef corals. Univ. Miami Press Coral GablesFlorida1948.112 p., 41 Láms. SQUIRES, D. F., Bull. An. Mus. Nat. Hist,.Stony corals from the vicinity of Bimini, Bahamas, B. W. I. 1958.215-262, 4 figs., 2 tabs., Láms. 28-43.115 STODDART, D. R., Atoll. Res. Bull., Three Caribbean atolls.1962.1-137. 87 THORPE, J. E., y P. K. BREGAZZI General Report Experiments and observations on the corals at randezvous Cay, CEBH1960.22-28. TRESSLAR, R. C., In: Biota of the West Flower Garden Bank. Corals, T. J. Bright y L. H. Pequegnat (Eds.) Gulf Publ. Co., Houston, Texas1974.115-140. 1 VAUGHAN, T. W., y J. W. WELLS Geol. Soc. America, Spec. Paper Revision of the suborders, families, and gcenra of the Scleractinia.1943.1-363.44 VERRILL, A. E., Trans. Connectitcut Acad. Arts. Sci., Variations and nomenclature of Bermudian West Indian and Brazilian reef corals. With notes on various Indo-Pacific corals.1902.63-168.11 VILLALOBOS, A.,Symposium on Investigation and Resources of the Caribbean Sea and Adjacent Regions Estudios ecológicos en un arrecife coralino en Veracruz, México. In: UNESCO (Ed.)1971.531-545.1 WELLS, J. W., Treatise on invertebrate paleontology. The Scleractinia. Part F Coelenterata. In: Moore, R. C., (Ed.) Geological Society of America and University of Kansas Pres Lawrence, Kansas1956. 328-444. ---, Bull. Mar. Sci., New and old scleractinian corals from Jamaica.1973.16-58. 23 WIJSMAN BEST, M.,Proceedings of the Second International Coral Reef Symposium.Habitat induced modification of Reef Corals (Faviidae) and its Consequences for Taxonomy. In: Cameron, A. M. et al. (Eds.) Great Barrier Reef CommitteeBrisbaneAustralia1974.217-228.1 YOUNG, C. M., Adv. Mar. Biol., The Biology of coral reefs.1963.209-260.1 ---, Bull. Mar. Sci., The Nature of Reef Building (Hermatipic) Corals. 1973.1-15.23 (1)
 Lám. 1. Stephanocoenia michelinii Milne-Edwards y Haime: a) Colonia in situ X.21, Puerto Morelos, arrecife posterior, 2 m de profundidad; b) Cálices, X.10. Madrecis decactis (Lyman) : c) Colonia in situ X.12, en forma de nódulos, Puerto Morelos, arrecife "parche" de la Laguna, a 5 m de profundidad; d) Cálices X.10. 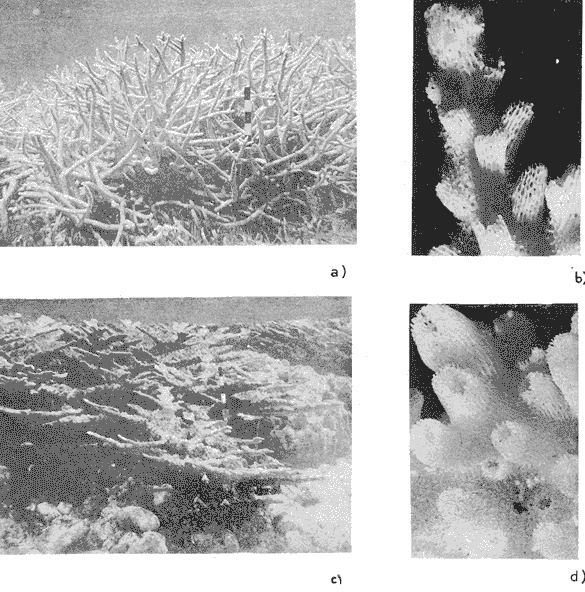 Lám. 2. Acropora cervicornis (Lamarck) : a) Colonia in silu X.06, Puerto Morelos, arrecife posterior en los limites con la laguna; b) Cálice X.10. Acropora palmata (Lamarck): c) Colonia in situ X.06, Puerto Morelos, arrecife posterior en forma de ramas horizontales; d) Cálices X.10.  Lám. 3. Acropora Prolifera (Lamarck): a) Colonia in situ X.75, Chemuyil, 1 m de profundidad; b) Corallum, X.35. Agaricia agaricites forma agaricites (Linnaeus); e) Colonia in situ X.2, Puerto Morelos, arrecife "parche" en la laguna; 3 m de profundidad; d) Cálices, X.4.  Lám. 4. Agaricia agariciles forma purpurea (Linnaeus): a) Colonia in Situ X.16, Puerto Morelos, pendiente arrecifal, 20 m de profundidad; Agaricia agaricitos forma danai (Linnaeus); b) Colonia in situ X.13, Puerto Morelos, arrecife posterior.  Lám. 5. Agaricia agaricites forma carinata (Linnaeus) : a) Colonia in situ X.2, Puerto Morelos, arrecife posterior, 1 m de profundidad Agaricia agaricites forma humilis (Linnaeus): b) Colonia in situ X. 6, Punta Nizuc, en cueva, arrecife posterior, 2 m de profundidad; c) Cálices X.4. 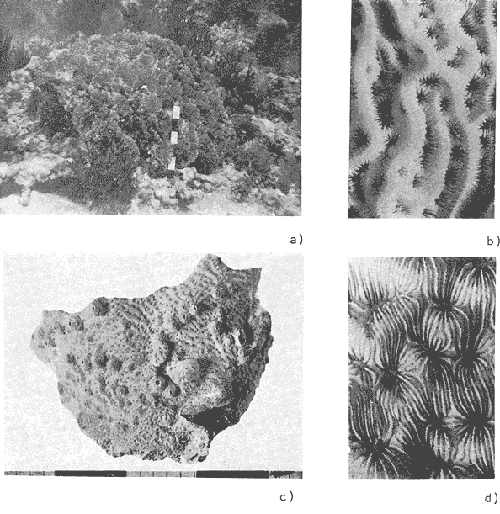 Lám. 6. Agaricia tenuifolia Dana: a) Colonia in situ X.80, Puerto Morelos, arrecife posterior, 1.5 m de profundidad; b) Cálices X.4. Agaricia lamarcki M. E. y H.; c) Corallum X.4, Punta Ptempich, pendiente arrecifal 25 m de profundidad; d) Cálices X.8. 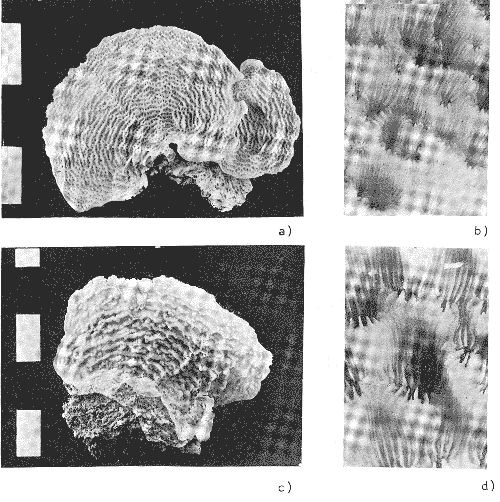 Lám. 7. Agaricia fragilis Dana: a) Corallum X.4, Puerto Morelos, arrecife posterior, 1.5 m de profundidad; b) Cálices X.4. Helioseris cucullata (Ellis y Solander) : c) Corallum X.35, Punta Maroma, arrecife posterior a 1.5 m de profundidad; d) Cálices X.4 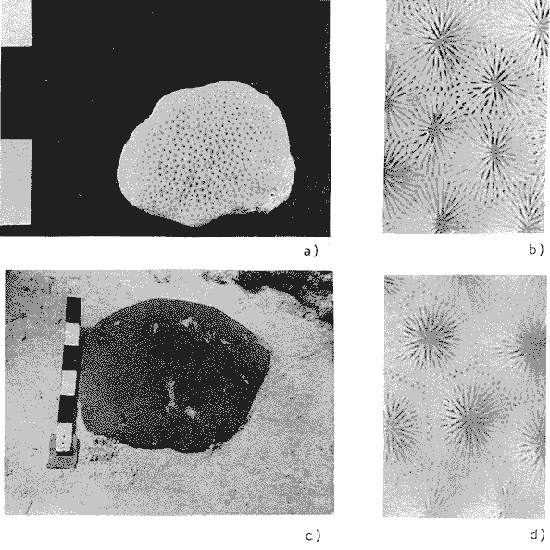 Lám. 8. Siderastrea radians (Pallas) : a) Corallum X.53, Puerto Morelos, pendiente arrecifal, a 20 m de profundidad; b) Cálices S. radians X.10. Siacrastrea siderea (Ellis y Solander); c) Colonia in situ, X.16, Puerto Morelos, arrecife "parche", 5 m de profundidad; d) Cálices X.10. 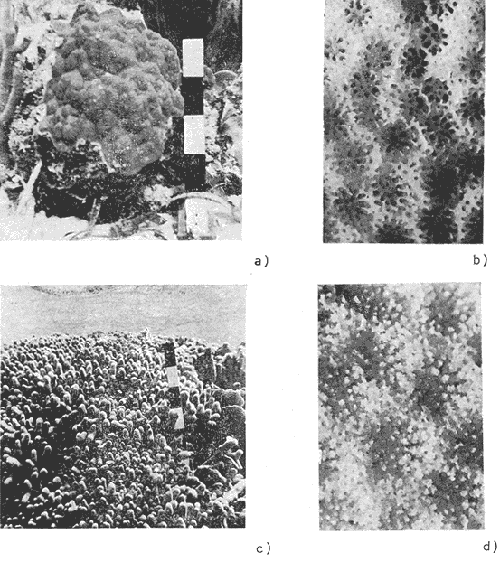 Lám. 9. Porites astreoides Lesueur: a) Colonia in situ X.26, Puerto Morelos, arrecife posterior en los límites con la laguna, 1.5 m de profundidad; b) Cálices X.10. Porites Porites (Pallas) : c) Colonias in situ, X.16, Puerto Morelos, arrecife "parche", 5 m de profundidad; d) Cálices X.10.  Lám. 10. Porites furcata (Lesueur): a) Colonia in situ X.1, Punta Maroma, laguna a 5 m de profundidad; b) Cálices X.10. Porites divaricata Lesueur; e) Corallum X.5, Puerto Morelos, pendiente arrecifal, 93 m de profundidad; d) Cálices X.10.  Lám. 11. Favia fragum (Esper): a) Corallum X.2, Punta Brava, arrecife posterior, 2 m de profundidad; b) Cálices X.10 Diploria clivosa (Ellis y Solander): c) Colonia in situ X.13, arrecife posterior, 1.5 m de profundidad; d) Cálices X.3.  Lám. 12. Diploria strigosa (Dana): a) Colonia in situ X.06, Puerto Morelos, arrecife posterior, 1.20 m de profundidad; b) Cálices X.3. Diploria labyrinthiformis (Linnaeus): c) Colonia in situ X.1, Puerto Morelos, arrecife "parche" 4 m de profundidad; d) Cálices X.1.5. 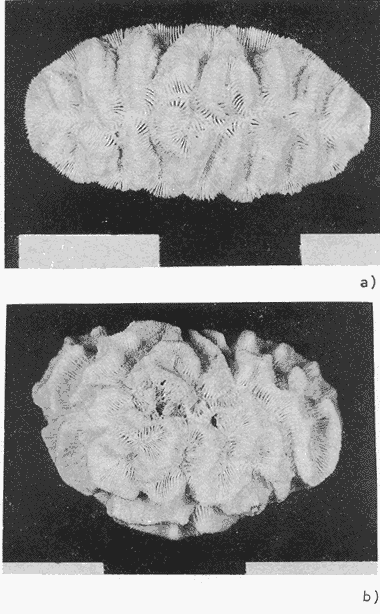 Lám. 13. Manicina areolata (Linnaeus): a) Corallum X.6, M. areolata forma areolata, Punta Maroma, pendiente arrecifal, 20 m de profundidad; b) Corallum X.6, M. areolata forma mayori Punta Nizuc, arrecife posterior, 1 m de profundidad. 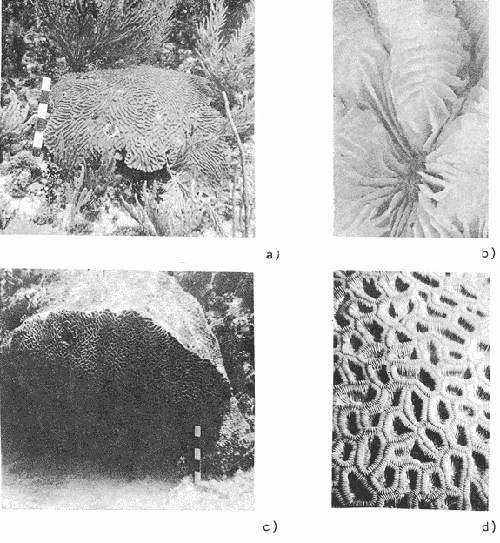 Lám. 14. Colpophyllia natans (Müller): a) Colonia in situ X.1, Punta Maroma, pendiente arrecifal, 15 m de profundidad; b) Cálices de C. natans X.2; c) Colpophyllia brevi seriallis, Milne-Edwards y Haime, Colonia in situ X.6, Punta Nizuc, arrecife posterior, 2 m de profundidad; d) Cálices de C. breviscriallis X.4.  Lám. 15. Montastrea annularis (Ellis y Solander): a) Colonia in situ X.16, Puerto Morelos, arrecife "parche", 4 m de profundidad; Montastrea cavernosa (Linnaeus): b) Colonia in situ X.1 1, Puerto Morelos, pendiente arrecifal, 15 m de profundidad; c) Cálices X.2. 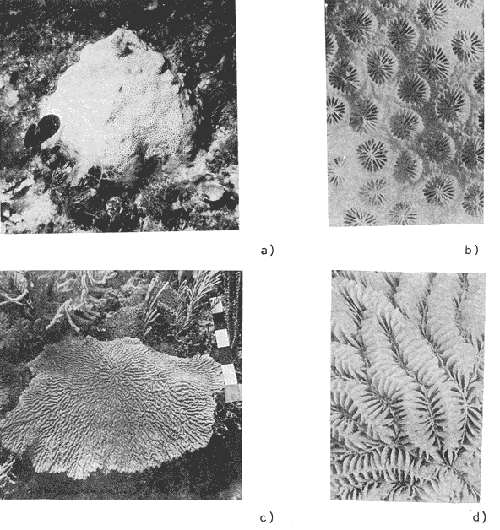 Lám. 16. Solenastrea bournoni (Milne-Edwards y Haime): a) Colonia in situ X.1, Puerto Morelos, pendiente arrecifal, 20 m de profundidad; b) Cálice X-3. Meandrina meandrites (Linnaeus): c) Colonias in situ de M. meandrina forma mendrites, Puerto Morelos pendiente arrecifal 20 m de profundidad; d) Cálices X.1.  Lám. 17. Meandrina meandrites (Linnaeus): a) Colonias in situ de M. meandrites forma danai X.15, Puerto Morelos, pendiente arrecifal, 20 m de profundidad; b) Cálices X.1. Dichocoenia stokesi Milne-Edwards y Haime: c) Colonia in situ X.25, Puerto Morelos, arrecife "parche". 4 m de profundidad; d) Cálices X.2. 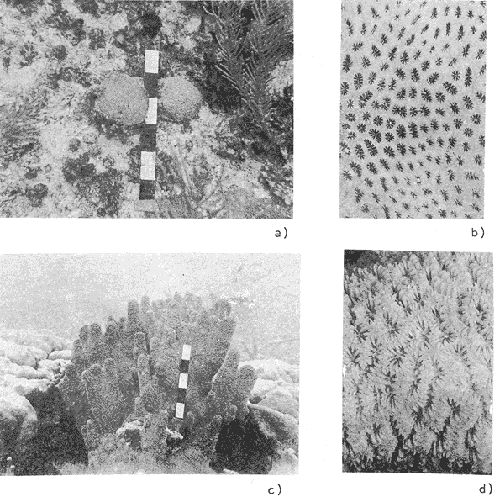 Lám. 18. Colonias in situ X.16, Puerto Morelos, pendiente arrecifal, 20 m de profundidad; lado izquierdo Dichocoenia stellaris M. E. y H., lado derecho; D. stokesi M. E. y H., b) Cálices D. stellaris X.1. Dendrogyra cylindrus Ehrenberg: c) Colonia in situ X.11, Akumal, arrecife posterior, 1.5 m de profundidad; d) Cálices X.1.2.  Lám. 19. Mussa angulosa (Pallas): a) Colonia in situ X.15, Puerto Morelos, pendiente arrecifal, 15 m de profundidad; b) Corallum X.53; c) Cálices X.1. Isophyllis sinuosa (Ellis y Solander): e) Colonia in situ X.6, Puerto Morelos, arrecifes posterior -, d) Cálices X.1.3.  Lám. 20. Isoplayllastrea rigida (Dana) : a) Colonia in situ X.2, Puerto Morelos, arrecife "parche" 4 m de profundidad; b) Cálices X.2. Mycetophyllia lamarckiana Milne-Edwards y Haime: c) Colonia in situ X.2, Punta Nizuc, arrecife posterior, 2.5 m de profundidad; d) Corallum X.53.  Lám. 21. Mycetophyllia danaana Milne-Edwards y Haime: a) Colonia in situ X.15, Punta Nizuc, 2 m de profundidad; b) Cálices X.1.5 Mycetoplayllia aliciae Wells; c) Colonia in situ X.1, Puerto Morelos, pendiente arrecifal, 20 m de profundidad; d) Cálices X.1.5.  Lám. 22. Mycetophyllia ferox Wells: a) Colonia in situ X.15, Puerto Morelos, pendiente arrecifal, 20 m de profundidad. Eusmilia fastigiata (Pallas); b) Colonia in situ X.2, arrecife "parche" Puerto Morelos, 4 me de profundidad; c) Cálices X-1.5.
|

