|
TAXONOMÍA, DIVERSIDAD,
DISTRIBUCIÓN Y ABUNDANCIA DE LOS POMADASIDOS DE LA LAGUNA DE
TÉRMINOS, CAMPECHE. (PISCES: POMADASYIDAE)
Trabajo recibido el 15
de enero de 1981 y aceptado para su publicación el 4 de mayo de
1981.
SILVIA DÍAZ RUIZ
Universidad Nacional Autónoma de
México, Instituto de Ciencias del Mar y Limnología, Laboratorio
de Ictiología y Ecología Estuarina. Contribución 283 del
Instituto de Ciencias del Mar y Limnología, UNAM.
ALEJANDRO YÁÑEZ-ARANCIBIA
Universidad Nacional
Autónoma de México, Instituto de Ciencias del Mar y
Limnología, Laboratorio de Ictiología y Ecología
Estuarina. Contribución 283 del Instituto de Ciencias del Mar y
Limnología, UNAM.
FELIPE AMEZCUA LINARES
Universidad Nacional Autónoma de
México, Instituto de Ciencias del Mar y Limnología, Laboratorio
de Ictiología y Ecología Estuarina. Contribución 283 del
Instituto de Ciencias del Mar y Limnología, UNAM.
Entre julio de 1976 y marzo de 1979 se obtuvo una importante
colección de peces de la familia Pomadasyidae en la Laguna de
Términos, Campeche. Con base en su análisis se presenta una
diagnosis taxonómica para la familia y clave artificial para determinar
los géneros y especies. Se hace una revisión taxonómica de
las mismas reforzadas con información de rangos merísticos y
morfométricos ampliados, coloración y comparación
taxonómica con especies simpátricas afines.
Seis especies existen de esta familia en el área, i.e.,
Anisotremus spleniatus, Anisotremus virginicus, Haemulon aurolineatum, Haemulon
bonariense, Haemulon plumieri y Orthopristis chrysopterus. Las dos
últimas representan más del 60% de la captura total y dominan en
biomasa.
Se discute la distribución, abundancia y
frecuencia encontrándose para cada especie alta correlación con
la salinidad, la temperatura y la turbidez durante la época de
secas.
La época del año y los distintos
habitat que existen en la Laguna de Términos, determinan la
ecología de las poblaciones de estas especies. Todas presentan patrones
de distribución y abundancia definidos en el subsistema ecológico
del interior de la Isla del Carmen, en áreas protegidas
deRhizophora mangle y Thalassia
testudinum, destacando Orthopristis chrysopterus
yHaemulon plumieri como componentes típicos de la
estructura de las comunidades ictiofaunisticas de esa zona, la primera
tolerando amplios rangos de salinidad y temperatura. Las seis especies se
consideran visitantes cíclicos y/o estacionales y utilizan el interior
de la Isla del Carmen como áreas de crianza, protección y
alimentación.
ABSTRACT
Between July, 1976, and March,
1979, an important collection of fish belonging to the Pomadasyidae family was
obtained from the Terminos Lagoon in Campeche, México. Based on analysis
of the collection, this paper presents a taxonomic diagnosis of the family and
an artificial key to determinegenus and species. It provides
a taxonomic review of these species reinforced by new meristic and morphometric
information, coloration data and taxonomic comparison with similar sympatric
species.
Six species of this family are found in the
area,i.e., Anisotremus spleniatus, Anisotremus Virginicus, Haemulon
aurolineatum, Haemulon bonariense, Haemulon plumieri
andOrthopristis chrysopterus. The latter two comprise more
than 60 per cent of the total catch and predominate in biomass.
Distribution, abundance and frequency are discussed; for each species
it is found that there is a high correlation with salinity, temperature and
turbidity during the dry season.
The time of year and the
different habitats which exist in the Terminos Lagoon determine the ecology of
the population of these species. All for them show defined distribution and
abundance patterns in the inland ecological subsystem of Carmen Island and in
protected areas ofRhizophora mangle and Thalassia
testudinum. Orthopristis
chrysopterusandHaemulon plumieri are the most
typical members of this zone's icthyofaunal communities; the former is able to
exist within a considerable range of salinity and temperature. The six species
are considered cyclical and/or seasonal visitors and use the inland area of
Carmen Island as nursery, protection and feeding
areas.
En julio de 1976 el Instituto (ex Centro) de Ciencias del Mar y Limnología, de la Universidad Nacional Autónoma de México y su Estación "El Carmen", además del Laboratorio de Ictiología y Ecología Estuarina, iniciaron diferentes investigaciones sobre la ecología y evaluación de comunidades de peces en la Laguna de Términos, Campeche, con el fin de tener una panorámica general de la ecología de la Laguna; y de la estructura y función de las comunidades, con énfasis en las especies de importancia comercial. Dado que los ecosistemas lagunares son áreas que presentan en su mayoría un potencial de recursos pesqueros de gran relevancia (Hildebrand 1969, Mc Hugh 1967, Stuardoet al. 1974, Vannucci 1969, Yáñez-Arancibia 1975), distintas pesquerías dependen de estas zonas y, por lo tanto, área y recursos, conjuntamente, son importantes en la producción de alimento (Smith et al. 1966). Al respecto y en especial los peces juegan uno de los papeles más significativos en el balance energético de estos ecosistemas (Yáñez-Arancibia y Nugent 1977). Por tal motivo, el conocimiento de la ictiología lagunar estuarina, es uno de los aspectos más trascendentes dentro de los estudios bioecológicos que permiten evaluar y discutir los recursos bióticos de un área costera. En la Laguna de Términos existen poblaciones de peces con estas características, entre ellas la familia Pomadasyidae ha sido objeto de este tipo de investigaciones, así los estudios de Bravo-Núñez y Yáñez-Arancibia (1979), Day y Yáñez-Arancibia (1978), Yáñez-Arancibia (1980), Yáñez-Arancibiaet al. (1980a,b,c), Vargas Maldonado et al. (1981), han permitido determinar que esta familia es un componente comunitario muy importante en la ecología de la Laguna de Términos, dada su diversidad, distribución, frecuencia y abundancia; sin embargo estos aspectos ecológicos no han sido evaluados en particular ni analizados en el contexto general de la ecología de las comunidades. La importancia económica que presentan algunas especies de dicha familia y que constituyen un recurso pesquero potencial, justifican la necesidad de estudios taxonómicos, biológicos y ecológicos de los pomadásidos, tanto para contribuir a la interpretación ecológica del área, como para la evaluación, administración y explotación de este importante recurso biológico-pesquero. OBJETIVOSConsiderando la introducción presentada y los antecedentes mencionados, se plantea el presente trabajo con los objetivos que a continuación se puntualizan: 1. Determinar taxonómicamente las especies de Pomadasyidae de la Laguna de Términos. 2. Confeccionar claves y diagnosis para su identificación, estructurando un catálogo descriptivo e ilustrado. 3. Caracterizar la distribución y abundancia de las especies en el área y posibles patrones de ellas. 4. Discutir para las especies estudiadas algunos aspectos de la estructura de las comunidades, tales como distribución, frecuencia y abundancia, en los periodos climáticos definidos para el área. ANTECEDENTESExisten estudios importantes que tienen relación con la ictiofauna de la Costa Atlántica y Golfo de México, sin embargo estudios que enfaticen de manera general o en particular problemas bioecológicos de la Familia Pomadasyidae no existen y los que hay, son trabajos aislados, parciales y con objetivos diferentes. Por lo mismo se desconocen también caracteres taxonómicos, biológicos y ecológicos de aquellas especies que tienen importancia económica y/o ecológica en particular. Entre los estudios taxonómicos están los de jordan y Evermann (1896), Meek e Hildebrand (1925), Ginsburg (1948), Arnov (1952), Courtenay (1961 y 1965), Cervigon (1966), Bohlke y Chaplin (1968), Randall (1967), Dahl(1972), Gallawayet al. (1972), Reséndez (1973), Perry y Perry (1974), Fischer (1977), Guitart (1977), Hoese y Moore (1977), Castro-Aguirre (1978) y Yáñez-Arancibia (1978). Estudios preliminares que tratan algunos aspectos de su biología son tan sólo unos pocos, entre los trabajos más relevantes se pueden mencionar el de Hildebrand y Cable (1930), Longley e Hildebrand (1941), Reid (1954 y 1955), Springer y Woodburn (1960), Courtenay (1961 y 1965), Cumings et al. (1966), Randall (1967 y 1968), Mc Lean y Herrkind (1971), Motchek y Silva (1975), Saksena y Richards (1975), Ogden y Ehrlich (1977) y Manooch III (1978). Por otra parte existen estudios ictiológicos especializados que tratan aspectos generales y particulares sobre la ecología de los pomadásidos en ambientes estuarinos y costeros del Golfo de México y Mar Caribe, estos se han reportado en los trabajos de Beebe y Tee-Van (1928), Longley e Hildebrand (1941), Gunter (1945), Reid (1954 y 1955), Springer y Bullis (1956), Simnions (1957), Hildebrand (1958), Springer y Woodburn (1960), Springer y Mc Erlean (1962), Tabb et al. (1962), Hoese y Jones (1963), Pagan y Austin (1967), Randall (1968), Swingle (1971), Chávez (1972), Carr y Adams (1973), Cerame-Vivas (1974), Reséndez (1971 y 1975), Subrahmanyan y Drake (1975), Smith (1976), Brook (1975 y 1977), Castro-Aguirre (1978) y Jordan et al. (1978). Publicaciones recientes sobre estudios ecológicos ictiofaunísticos en la Laguna de Términos y áreas adyacentes también incluyen en sus registros especies de pomadásidos, cabe citar los trabajos de Bravo-Núñez y Yáñez-Arancibia (1979) quienes describen la estructura de las comunidades nectónicas en la Boca de Puerto Real; Yáñez-Arancibia et al. (1980a) integran una discusión del conocimiento ecológico de la laguna y de la incidencia de la estructura y función de las comunidades de peces; Vargas Maldonado et al. (1981) describen las comunidades nectónicas en áreas de Rhizophora mangleyThalassia testudinum; finalmente Sánchez Gilet al. (1981) en un trabajo sobre la plataforma continental frente a la Laguna de Términos incluyen en sus registros especies de pomadásidos. Estos antecedentes representan un valioso marco de referencia para discutir los objetivos aquí planteados, así como también establecer la importancia que tiene esta familia de peces en los ecosistemas costeros. ÁREA DE ESTUDIOLa Laguna de Términos (Fig. 1), en el Sur del Golfo de México, es un excelente sitio para estudiar integración de procesos físicos y biológicos. No existen cambios estacionales fuertes de temperatura o luz, y el área tiene marcados gradientes físicos semipermanentes y alta diversidad de habitats estuarinos. Los vientos prevalecientes causan un flujo neto hacia dentro en la boca este (Boca del Puerto Real) y un flujo neto hacia afuera por la boca oeste (Boca del Carmen), el cual crea alta salinidad y condiciones de aguas claras en el sector oriental de la laguna. La mayor descarga de los ríos se dá dentro de la parte oeste de la laguna, creando turbidez, y aguas ricas en nutrientes con baja salinidad. Un delta interior se forma en la laguna en la boca este. La mayoría de los procesos biológicos están fuertemente influenciados por estos gradientes. Extensas praderas de pastos marinos se presentan en la parte norte y oriental de la laguna, existiendo sucesión de pastos a bosques de manglar en esa área. Extensas áreas de arrecifes de ostión se localizan en la parte oeste y sur de la laguna, cerca de las bocas de los ríos. La producción de fitoplancton, niveles de clorofila y defoliación de manglares es mayor en las áreas de influencia fluvial. Las larvas y juveniles del necton ingresan a la laguna a través de la boca del este, reflejando las corrientes prevalecientes. La máxima descarga de los ríos es en octubre, durante la cual se alcanza la más alta productividad primaria y ocurre la entrada de juveniles a la laguna. Se presentan tres periodos climáticos meteorológicos, lluvias de junio a octubre, nortes de noviembre a febrero y secas de febrero a mayo. 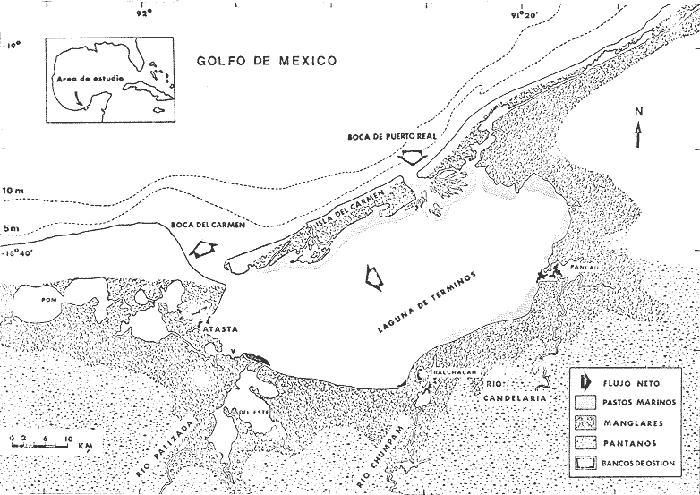 Fig. 1. Localización de la Laguna de Términos, Campeche. Se señala los rasgos geográficos y toponímicos principales y la distribución de los diferentes habitat ecológicos del sistema. Se destaca la dirección del flujo neto de las aguas y la zona de pastos marinos que indican áreas de mayor influencia marina. Se muestran los cuatro sistemas Fluvio-Lagunares principales asociados a la Laguna. (Tomada de Yáñez-Arancibia et al., 1980b). Amplios detalles de esta síntesis pueden encontrarse en los trabajos de Phleger y Ayala-Castañares (1971), Gierloff-Emden (1977), Bravo-Núñez y Yáñez-Arancibia (1979), Amezcua-Linares y Yáñez-Arancibia (1980), Vargas Maldonadoet al. (1981) y Yáñez-Arancibia y Day (1982). MATERIAL Y MÉTODOS
ACTIVIDADES DE CAMPOLas capturas de peces se efectuaron desde el mes de julio de 1976 a marzo de 1979 de la siguiente manera: Capturas en los meses de julio a diciembre de 1976; capturas en los meses de enero, marzo, mayo, agosto y septiembre de 1977; capturas del mes de marzo de 1979. La disposición de las estaciones de colecta, fue de tal manera que se caracterizan diferentes áreas de la Laguna de Términos, esto es, ambientes dulceacuícolas y de baja salinidad y ambientes marinos (Fig. 2). 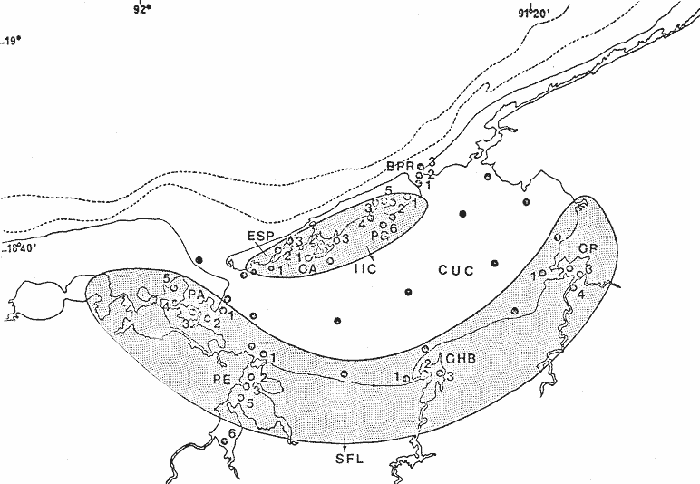 Fig. 2. Área de estudio. Localización de las zonas de muestreo. IIC = Interior de la Isla del Carmen. SFL = Sistemas Fluvio-Lagunares. CUC = Cuenca Central. Todas las capturas fueron diurnas, en profundidades que no excedieron a los 4 m. Se empleó una embarcación de fibra de vidrio de 7 m de eslora, equipada con un motor de 40 HP., el arte de pesca fue una red de arrastre de prueba camaronera de 10 m de largo y 9 m de boca (abertura de trabajo de 5 m), puertas de 0.8 por 0.5 m y luz de malla de 3/4 de pulgada. Los arrastres fueron de 15 a 30 min. de duración. En cada estación se efectuaron. mediciones de: temperatura, salinidad, oxígeno, profundidad y transparencia. También se realizaron observaciones de tipo de sustrato, vegetación sumergida y circundante, macrofauna béntica, mareas y datos climáticos. El material colectado se fijó en formalina al 10% neutralizada con borato de sodio. A los ejemplares capturados se les realizó una incisión ventral para la fijación del contenido estomacal y gónadas. MATERIAL DE ESTUDIODe los 22 cruceros realizados (173 colectas), se obtuvieron un total de 841 ejemplares, correspondientes a 6 especies de Pomadasyidae, distribuidas como se muestra en la tabla 1. De febrero a diciembre de 1980 se obtuvo una colección aún no cuantificada, que proporcionó información para la distribución de las especies en la cuenca central de la laguna. ACTIVIDADES DE LABORATORIOLos ejemplares fueron lavados, separados, reetiquetados y envasados en frascos de vidrio con alcohol metílico al 70%. 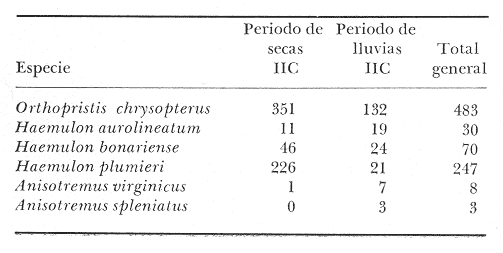 TABLA 1 RELACIÓN DEL NÚMERO DE EJEMPLARES CAPTURADOS, EPOCA CLIMÁTICA Y LOCALIDAD La posición taxonómica de las especies fue determinada por los métodos convencionales y el empleo de literatura básica, principalmente los trabajos de Jordan y Evermann (1896-1900), Meek e Hildebrand (1923-1928), Cervigon (1966), Bohlke y Chaplin (1968), Randall (1968), Dahl (1972), Gallaway et al. (1972), Perry y Perry (1974), Guitart (1977), Hoese y Moore (1977), Fischer (1978). ABUNDANCIALa abundancia fue estimada de acuerdo a: a. abundancia numérica b. biomasa (g peso húmedo m-²) La densidad y biomasa se analizan para cada estación de colecta durante las épocas de lluvias y secas. COMPONENTES COMUNITARIOSLas comunidades ictiofaunísticas están integradas por diversos componentes, los cuales se determinan en relación a su origen, frecuencia de aparición, desarrollo gonádico, hábitos alimenticios y tamaño. Las especies con frecuencia de 1-30% se consideran visitantes ocasionales o accidentales. Aquéllas con 31-70% de frecuencia,visitantes cíclicos o estacionales. Y, con una frecuencia de 71-100% como residentes o típicamente estuarinos. Estos componentes son reforzados con el criterio ecológico siguiente: las especies residentes permanentes se encuentran todo el tiempo en la laguna, pueden crecer, madurar y reproducirse dentro de la propia laguna. Los visitantes estacionales usan la laguna bajo un patrón regular, en algunas etapas de sus cielos de vida. Son comunes en este grupo aquellas especies que desovan en el mar e ingresan a la laguna como juveniles por corto tiempo y regresan al mar como preadultos y adultos. Finalmente, los visitantes ocasionales no utilizan la laguna bajo un patrón definido, a pesar de ello pueden entrar a ella solo para protegerse y/o alimentarse (Yáñez-Arancibia et al. 1980a). Los muestreos temporales, como el de este estudio, permiten detectar la frecuencia de utilización de la laguna y como en áreas tropicales los ciclos de vida son cortos, la madurez se logra entre 6 y 10 meses, por lo cual el rango considerado de frecuencia de utilización debe tener una estrecha correlación con la edad de la población. ABREVIATURAS UTILIZADAS EN TABLAS Y MAPASBPR = Boca de Puerto Real CA = Bajos del Cayo CHB = Sistema Chumpán-Balchacalí CP = Sistema Candelaria-Panlau CUC = Cuenca Central ESP = Estero Pargo IIC = Interior de la Isla del Carmen MNG = Puntilla Manigua PA = Sistema Pom-Atasta PE = Sistema Palizada del Este PG = Punta Gorda PEC = Sistema Palizada-del Este. Boca del Carmen SFL = Sistemas Fluvio-Lagunares RESULTADOS
FAMILIA POMADASYIDAE (HAEMULIDAE) LACÉPÈDE
"Roncos, Burros"Cuerpo oblongo, comprimido, más o menos alargado, dorso generalmente elevado proporcional a la talla. Cabeza grande, perfil anterior fuertemente convexo en muchas especies; boca terminal, grande o pequeña baja y más o menos horizontal, labios generalmente gruesos; hocico romo o puntiagudo. Premaxilares ligeramente protráctiles; maxilar sin hueso suplementario, cubierto en parte por el suborbitario cuyo margen no está expuesto, preorbital generalmente ancho sin barbas. Dientes puntiagudos o cónicos sin caninos; arreglados en una estrecha banda en cada mandíbula, ninguno sobre el vomer, palatinos o lengua. Preopérculo con el margen posterior suavemente cóncavo, aserrado o entero; opérculo sin espinas. Arcos branquiales 4, una gran hendidura detrás del último; pseudobranquias bien desarrolladas; branquiespinas moderadas; membranas branquiostegas 6 a 7 separadas, libres del istmo. Línea lateral bien desarrollada concurrente con la línea exterior del dorso, generalmente no se extiende sobre la aleta caudal. Escamas ctenoides pequeñas o moderadamente grandes, que cubren el cuerpo, los lados de la cabeza y a menudo las aletas. Aleta dorsal simple, continua o profundamente hendida, algunas veces dividida en dos aletas, las espinas fuertes, depresibles en un surco, 10 a 14 en número y generalmente 11 a 19 radios blandos. Caudal de emarginada a horquillada. Anal con 3 espinas fuertes, la segunda casi siempre muy prominente, 6 a 13 radios blandos. Pélvicas torácicas, con 1 espina y 5 radios blandos, con una parte escamada en la base. Pectorales grandes. Canal intestinal corto, con pocos ciegos pilóricos; vejiga gaseosa presente, generalmente simple. Las especies presentan colores brillantes que varían mucho desde colores uniformes a estriados, manchados y punteados, la coloración de los adultos y jóvenes varía grandemente. Típicos de mares cálidos tropicales y subtropicales con aproximadamente 21 géneros y 175 especies. Carnívoros, en su mayor parte habitantes de fondos coralinos o rocosos de los que son importantes predadores, como también de aguas poco profundas cerca de las costas y solamente algunos se encuentran en esteros o en fondos fangosos. El nombre común del grupo deriva del ruido que hacen cuando frotan entre sí sus dientes faríngeos. Los roncos son una familia de peces que por un lado están cercanamente relacionados con los Lutjanidae (pargos) y por otro lado con los Sparidae (sargos), así mismo algunos miembros muestran afinidades con algunos Scianidae (corvinas) y Serranidae (meros). CLAVE ARTIFICIAL PARA DETERMINAR ESPECIES DE LA FAMILIA POMADASYIDAE PRESENTES EN LAGUNA DE TÉRMINOS1. Partes blandas de la aleta dorsal y anal con escamas. Segunda espinal anal muy fuerte, mucho más grande que la tercera............ 2 1' Partes blandas de la dorsal y anal sin escamas. Segunda espina anal moderadamente fuerte, ligeramente más chica que la tercera. Ojos moderadamente pequeños 3.3 a 5.0 en la cabeza......................... Orthopristis chrysopterusGirard 2. Boca moderada o grande. Dorso poco elevado. Partes blandas de la dorsal y anal totalmente escamadas. Interior de la boca rojo, labios delgados................................ 3 2' Boca pequeña. Dorso considerablemente elevado. Partes blandas de la dorsal y anal escamadas únicamente en la base. Interior de la boca pálido, labios gruesos............... 5 3. Espinas de la aleta dorsal 12..................................... 4 3' Espinas de la aleta dorsal 13. De 12 a 14 branquiespinas sobre la rama inferior del primer arco branquial 14 o 15 radios en la alea dorsal, normalmente 9 radios en la anal.......... Haemulon aurolineatum Cuvier 4. Cuerpo con estrías amarillo-negruzcas, continuas, oblicuas y ligeramente onduladas. Escamas del cuerpo pequeñas, 44 a 48 en una serie longitudinal por encima de la línea lateral. Ojos moderadamente grandes 2.8 4.6 en la cabeza ................ Haemulon bonariense Cuvier y Valenciennes 4' Cabeza con estrías azules longitudinales que no se extienden al cuerpo. Escamas muy grandes, 46 a 53 en una serie longitudinal por encima de la línea lateral. Ojos pequeños 3.1 a 6.0 en la cabeza..................................Haemulon plumieri(Lacépède) 5. Cuerpo con bandas transversales azules y amarillas alternadas sobre los lados del cuerpo, dos bandas verticales de color negro sobre la cabeza y nuca............. Anisotremus virginicusGill 5' Cuerpo con dos estrías longitudinales de color café, una mancha en la caudal y una banda vertical negra sobre la cabeza desde el primer rayo de la dorsal a la base de la pectoral ............................... Anisotremu spleniatus(Poey) GéneroOrthopristisGirard, 1859 Orthopristis chrysopterus (Linnaeus, 1766) N.v.: "Burro"
Perca chrysoptera Linnaeus, Syst. Nat., 1766, Ed. 12: 485. Charleston, S.C. Diagnosis. Cuerpo ovalado elíptico muy comprimido, dorso algo elevado, profundidad 2.2 a 3.0 en la LP. Cabeza 2.7 a 3.1 en la LP, perfil anterior uniforme y suavemente convexo; boca moderadamente grande y oblícua, hocico algo grande y pronunciado 2.1 a 2.8 en la cabeza. Ojos moderadamente pequeños 3.3 a 5.0 en la cabeza, el espacio interorbital más bien plano 3.3 a 4.6 en la longitud cefálica, el preorbital más ancho 2.7 a 4.6 en la cabeza. Maxilar 2.5 a 3.9 en la cabeza no rebasa el margen anterior del ojo. Preopérculo muy finamente aserrado. Branquiespinas cortas 12 a 13 sobre la rama inferior del primer arco. Escamas moderadamente grandes, las series de la línea lateral oblícuas, 10 hileras entre la línea lateral y el origen de la dorsal, 55 a 60 en una serie longitudinal por encima de la línea lateral D XII o XIII, 15-16; A III, 12-13; P 15-18. Espinas dorsales pequeñas, la cuarta más larga casi tanto como el hocico 2.1 a 2.9 en la cabeza. Segunda espina anal casi o igual a la tercera 3.0 a 4.7 en la cabeza. Pectorales regulares 1.3 a 2.0 en la cabeza. Color. Dorso azul oscuro, costados y vientre plateados. Estrías anaranjado-cafés por encima de la línea lateral corren oblícuas, por debajo casi horizontales, pigmentaciones bronceadas a lo largo del cuerpo. Interior de la boca pálido. Dorsal pálida aproximadamente con tres estrías longitudinales bronceadas poco definidas, borde oscuro; caudal pálida con la base amarilla y la punta oscura; anal blanca, el borde oscuro; pectorales y pélvicas amarillas, las puntas oscuras. En fijador, cuerpo gris plateado, estrías oscuras débiles y confusas; sombra horizontal detrás del ojo; dorsal pálida, la parte blanda con tres sombras débiles oscuras, las otras aletas casi claras. Distribución. En el Atlántico desde Nueva jersey, EUA, hasta Yucatán, México, en el área de estudio: localidades ESP, CA, BPR, PG, PJ y CUC (Fig. 3). 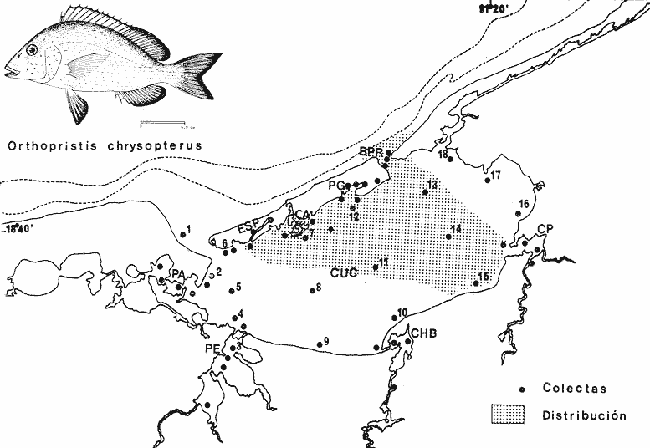 Fig. 3. Mapa de distribución de Orthopristis chrysopterus en la Laguna de Términos, en relación a las estaciones de colecta en las distintas localidades. Material examinado. 483 ejemplares de 34 a 195 mm de longitud total. Colección de referencia depositada en el Laboratorio de Ictiología y Ecología Estuarina del Inst. de Ciencias del Mar y Limnología de la Universidad Nacional Autónoma de México.Catálogo CCML-PF 0.001728/1733 (Camp.). Observaciones taxonómicas. Algunas consideraciones sobreOrthopristis chrysopterus en la costa Atlántica y el Golfo de México, han sido hechas principalmente por: Jordan y Evermann (1896), Gallaway et al. (1972), Guitart (1977), Hoese y Moore (1977), Castro-Aguirre (1978), Fischer (1978). La revisión taxonómica deOrthopristis chrysopterus hecha en el presente estudio, permite separarla con seguridad de especies afines comoO. Poeyi (Schudder) yO. ruber ( Cuvier) que muestran semejanzas morfométricas similares que podrían presentar alguna confusión con los de esa especie. Sin embargo O. poeyi presenta menor número de escamas en una serie longitudinal por arriba de la línea lateral, mientras queOrthopristis chrysopterus presenta de 55 a 60 y las escamas son mucho más pequeñas La presencia de manchas bronceadas en toda la cabeza sirve para diferenciarla de O. poeyi.O. ruber presenta caracteres que la distinguen fácilmente deO. chrysopterus, presentando de 9 a 11 radios en la anal, 52 a 55 escamas en una serie longitudinal por arriba de la línea lateral y 15 branquiespinas sobre la rama inferior del primer arco. Por otro lado, O. chrysopterus se distingue de otros géneros de pomadásidos por presentar 10 hileras de escamas por arriba de la línea lateral, mientras que las especies dePomadasys presentan de 5 a 6 hileras. En las especies deHaemulon la dorsal y anal blandas están densamente escamadas y el interior de la boca es de color rojo intenso (excepto enH. boschmae) (Metzellaar). A diferencia de las especies deAnisotremus cuyo cuerpo es corto y muy arqueado, con el hocico romo y labios gruesos, en O. chrysopterus la forma del cuerpo es ovado elíptica de tal modo que es muy alargada y el hocico es puntiagudo. Observaciones ecológicas. La distribución, abundancia numérica y biomasa de Orthopristis chrysopterus para la época de lluvias y secas se muestran en las tablas 2 y 3 respectivamente. Para ambas épocas el número de individuos y biomasa fluctuó irregularmente en las distintas localidades. Sin embargo, en los meses en los que se presentó mayor abundancia numérica fueron: el mes de mayo y septiembre de 1977, con 63 y 14 individuos durante la época de secas y lluvias respectivamente en la Boca de Puerto Real. Mientras que para el interior de la Isla del Carmen la mayor abundancia numérica correspondió a Estero Pargo con 9 individuos en el mes de octubre de 1976 en la época de lluvias. Durante la época de secas sólo se registraron 3 individuos en el mes de marzo de 1977 en Estero Pargo. No obstante la mayor abundancia numérica se presentó en el mes de marzo de 1979 con 119 individuos en Punta Gorda. Por lo que respecta a biomasa, Bravo-Núñez y Yáñez-Arancibia (1979), reportan para la estación BPR-1 un total de 0.20 gm-² y 0.21 gm-² durante la época de secas y lluvias respectivamente. Vargas Maldonado et al. (1981) reportan para el interior de la Isla del Carmen en la estación ESP-1 y ESP-2 un total de 0. 17 gm-² y 0.24 gm-² durante la época de secas y lluvias respectivamente. 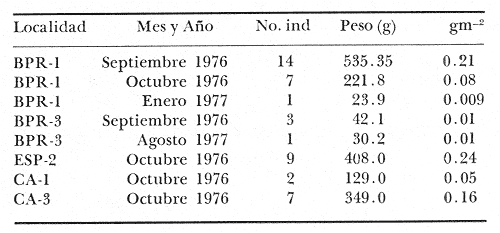 TABLA 2 ORTHOPRISTIS CHRYSOPTERUS ABUNDANCIA ESTIMADA DURANTE LA ÉPOCA DE LLUVIAS (1976-1977) EN EL ÁREA ESTUDIADA  TABLA 3 ORTHOPRISTIS CHRYSOPTERUS ABUNDANCIA ESTIMADA DURANTE LA £POCA DE SECAS (1976-1979) EN EL ÁREA ESTUDIADA Es importante destacar que Orthopristis chrysopterus es la especie mejor representada en cuanto a distribución y abundancia de todos los pomadásidos en la Laguna de Términos, distribuyendose tanto en los ambientes de mayor influencia marina así como en los de baja salinidad, tolerando amplios rangos de variación de temperatura. Esta especie constituye un recurso económico en el área. Frecuencia de la especie y utilización de la laguna. El análisis de la frecuencia hecho por algunos autores ha permitido dar diversos valores para esta especie de acuerdo a la localidad y época climática. Así, Bravo-Núñez y Yáñez-Arancibia (1979) han reportado para las estaciones BPR-1 y BPR-3 una frecuencia de 83.33% y 33.33% considerándolo como componente comunitario permanente y en tránsito respectivamente. Por otro lado Yáñez-Arancibiaet al. (1980a) consideran aOrthopristis chrysopterus como especie cíclica. De acuerdo a la categorización ictiotrófica de las especies Bravo-Núñez y Yáñez-Arancibia (1979), Yáñez-Arancibia et al. (1980a y b) y Vargas Maldonado et al. (1981) clasifican a Orthopristis chrysopterus como consumidor de segundo orden. Su alimentación se basa principalmente de pequeños organismos bentónicos entre ellos: poliquetos, anfípodos, cumáceos, tanaidáceos, pequeños decápodos, equinodermos y materia orgánica. GéneroHaemulon Cuvier, 1829Haemulon aurolineatum Cuvier, 18 N.v.: "Ronco"
Haemulon aurolineatum Cuvier, in: Cuvier y Valenciennes, Hist. Nat. Poss., 1830, 5:237 (Brasil, Santo Domingo).Diagnosis. Cuerpo elongado comprimido, dorso ligeramente elevado, profundidad 2.4 a 3.2 en la LP. Cabeza 2.4 a 3.0 en la LP, perfil anterior recto o ligeramente convexo; boca grande, ligeramente oblícua, hocico corto algo puntiagudo 2.5 a 3.1 en la cabeza. Ojos moderadamente grandes 2.9 a 4.3 en la cabeza, espacio interorbital convexo 2.8 a 4.0 en la longitud cefálica, el preorbital más angosto 3.5 a 7.0 en la cabeza. Maxilar 1.8 a 2.3 en la cabeza sobrepasando la mitad de la pupila. Preopérculo finamente aserrado. Branquiespinas cortas 12 a 14 sobre la rama inferior del primer arco. Escamas del cuerpo ligeramente pequeñas, las series sobre la línea lateral oblícuas, 7 a 8 hileras entre la línea lateral y el origen de la dorsal, 49 a 52 en una serie longitudinal por encima de la línea lateral. D XIII, 14-15; A III, 8-9; P 17-18. Espinas dorsales grandes, la cuarta más grande, igual o aproximadamente la mitad de la longitud cefálica 1.9 a 2.4. Segunda espina anal pequeña casi igual a la tercera, apenas tan larga como la longitud de la cuarta espina dorsal 2.3 a 3.1 en la cabeza. Pectorales algo cortas 1.2 a 1.6 en la cabeza. Color. Cuerpo amarillo plateado, dorso ligeramente azul con reflejos iridiscentes, costados con dos estrías amarillas longitudinales muy patentes, una desde el interorbital a la base del último radio dorsal, la otra del ojo a todo lo largo de la parte media del flanco hasta la base de la caudal, terminando en una mancha negra. Cabeza amarilla plateada por arriba, interior de la boca rojo; dorsal y caudal sombreadas, las demás aletas transparentes ligeramente amarillas. Los juveniles son olivaceo claro, las estrías son más evidentes que en los adultos. En fijador los adultos son plateado claros, las estrías de color café oscuro. Distribución. En el Atlántico desde Bahía de Chaseapeake hasta Brasil, incluyendo el Golfo de México y el Caribe. En el área de estudio: localidades BPR, PG, CA (Fig. 4). Material examinado. 30 ejemplares de 68 a 120 mm de longitud total. Colección de referencia depositada en el Laboratorio de Ictiología y Ecología Estuarina del Inst. de Ciencias del Mar y Limnología de la Universidad Nacional Autónoma de México. Catálogo CCMLPF 0.001741/1748 (Camp.). Observaciones taxonómicas. Algunas consideraciones taxonómicas sobreHaemulon aurolineatum en la costa Atlántica y el Golfo de México, han sido hechas principalmente por: Jordan y Evermann (1896), Cervigon (1966), Gallaway et al. (1972), Guitart (1977), Hoese y Moore (1977), Fischer (1978). 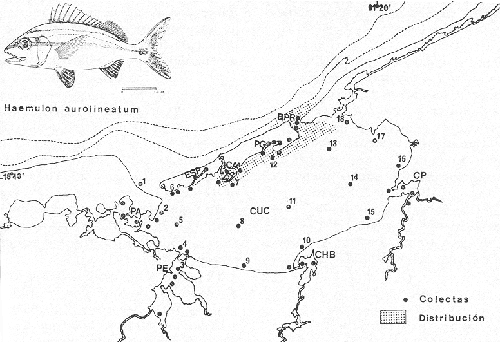 Fig. 4. Mapa de distribución de Haemulon aurolineatum en la Laguna de Términos, en relación a las estaciones de colecta en las distintas localidades. De los caracteres morfométricos tomados en cuenta para la determinación de Haemulon aurolineatum no son similares con ninguno de los de H. bonariense Cuvier yH. plumieri. (Lacépède) por lo que no existe confusión alguna para separarlos claramente. La revisión taxonómica de esta especie en este estudio, permite separar claramente a la misma. Por lo que H. aurolineatum se distingue fácilmente por presentar menor profundidad corporal, las escamas por arriba de la línea lateral son oblícuas y determinante para distinguir esta especie de las demás; solamenteH. striatum Linnaeus) y H. boschmae(Metzelaar), tienen 13 espinas pero la boca de estas especies es mucho más pequeña que en H. aurolineatum. La coloración es similar aH. striatum, sin embargo no presenta ninguna mancha oscura en la base de la caudal. Hasta hace poco tiempo se habían considerado las formas con 13 espinas dorsales, pertenecientes a otros géneros. Courtenay (1961 y 1965) ha demostrado la equivalencia de tales nombres, y los génerosBathystoma yBrachygenys serían sinónimos deHaemulon. Ginsburg (1948) dividió las especies del género Bathystoma (=Haemulon) en varias razas geográficas. Los representantes de estas especies del noroeste del Golfo algunas veces son separadas dentro de la subespecierimator (Hoese y Moore, 1977). Por otra parte Bravo-Núñez y Yáñez-Arancibia (1979) consideran a la especie Bathystoma rimator en la Laguna de Términos, pero la revisión de esos ejemplares permite establecer que se trata por sinonimia de Haemulon aurolineatum. Un estudio más detallado que constituye el análisis representativo de varias localidades dentro de su distribución geográfica, podría ayudar a aclarar algunas diferencias que merezcan ser tratadas corno razas geográficas. Por lo menos en este trabajo todos los ejemplares que han sido considerados en esta diagnosis son referidos a H. aurolineatumCuvier. Observaciones ecológicas. La distribución, abundancia numérica y biomasa deHaemulon aurolineatum se muestran en las tablas 4 y 5 para la época de lluvias y secas respectivamente. Para ambas épocas el número de individuos y de biomasa variaron irregularmente de acuerdo a la localidad. No obstante, en los meses en los que se presentó mayor abundancia numérica fueron: mes de marzo 1979 con 8 individuos en la Boca de Puerto Real y agosto de 1977 con 15 individuos en la misma localidad. Para el interior de la Isla del Carmen la mayor abundancia numérica correspondió a Bajos del Cayo con 3 individuos. 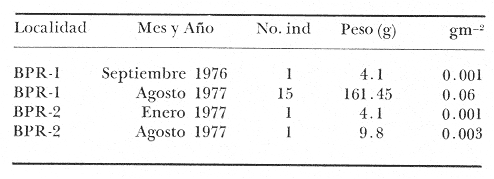 TABLA 4 HAEMULON AUROLINEATUM ABUNDANCIA ESTIMADA DURANTE LA ÉPOCA DE LLUVIAS (1976-1977) EN EL ÁREA ESTUDIADA 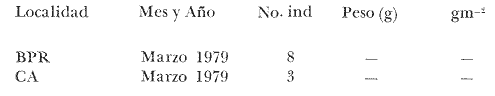 TABLA 5 HAEMULON AUROLINEATUM ABUNDANCIA ESTIMADA DURANTE LA ÉPOCA DE SECAS (1979) EN EL ÁREA ESTUDIADA Por lo que respecta a biomasa, Bravo-Núñez y Yáñez-Arancibia (1979) reportan para la época de lluvias un total de 0.06 gm-2 cuyo valor corresponde a la localidad de la Boca de Puerto Real. En la época de secas el valor de biomasa es muy pequeño para esta especie por lo que no es significativo. Es importante mencionar que Haemulon aurolineatumes la cuarta especie más abundante de los pomadásidos en la laguna. Se distribuye principalmente en zonas de mayor influencia marina del interior de la Isla del Carmen. Frecuencia de la especie y utilización de la Laguna. El análisis de frecuencia hecho por algunos autores ha permitido dar diversos valores para esta especie de acuerdo a la localidad y época climática. Así Bravo-Núñez y Yáñez-Arancibia (1979) han reportado en la Boca de Puerto Real una frecuencia de 33.33% considerando a esta especie componente comunitario en tránsito. Por otro lado Yáñez-Arancibia et al. (1980a) consideran a Haemulon aurolineatum especie visitante cíclico. De acuerdo a la categorización ictiotrófica de las especies Bravo-Núñez y Yáñez-Arancibia (1979) y Yáñez-Arancibiaet al. (1980a) clasifican aHaemulon aurolineatum como consumidor de segundo orden. Su alimentación se basa principalmente de pequeños crustáceos, tales como isópodos, anfípodos, pequeños cangrejos, larvas de camarón, además de poliquetos, gasterópodos, vegetales y materia orgánica. Haemulon bonariense Cuvier y Valenciennes, 1830 N.v.: "Ronco Prieto"
Haemulon bonariense Cuvier y Valenciennes, Hist. Nat. Poiss., 1830, 5:254, Buenos Aires. Diagnosis. Cuerpo oblongo comprimido, dorso muy elevado, profundidad 2.3 a 2.8 en la LP. Cabeza 2.4 a 2.9 en la LP, perfil anterior uniforme y suavemente convexo; boca pequeña, ligeramente oblícua, hocico puntiagudo algo grande y pronunciado 2.3 a 3.7 en la cabeza. Ojos. moderadamente grandes 2.8 a 4.6 en la cabeza, espacio interorbital plano 3.1 a 4.4 en la longitud cefálica, el preorbital más angosto 3.3 a 6.0 en la cabeza. Maxilar 2.4 a 3.1 en la cabeza sobrepasando apenas el margen anterior del ojo. Preopérculo aserrado. Branquiespinas cortas 12 a 14 sobre la rama inferior del primer arco. Escamas de tamaño regular, las series sobre la línea lateral oblícuas y onduladas, 6 a 7 hileras entre la línea lateral y el origen de la dorsal 44 a 48 en una serie longitudinal por encima de la línea lateral. D XII, 15-17; A III, 8-9; P 15-18. Espinas dorsales de tamaño regular, la tercera grande igual a la longitud del hocico en los adultos, la cuarta 2.0 a 2.6 en la cabeza. Segunda espina anal muy fuerte, más grande que la tercera casi tanto como la longitud de la cuarta espina dorsal 1.8 a 2.6 en la cabeza. Pectorales grandes 1.1 a 1.8 en la cabeza. Color. Dorso azul metálico, costados y vientre plateados. De 16 a 18 estrías amarillo-negruzcas proyectándose de la cabeza hacia atrás y arriba corriendo continuas, oblícuas y algo onduladas a través del cuerpo. Pigmentación oscura debajo del borde libre del preopérculo. Pectorales pálidas, las otras de color oscuro. Los juveniles menores de 70 mm con 3 o 4 estrías longitudinales negras, una extendiéndose desde el hocico a través del ojo a la base de la caudal terminando en una mancha negra, la cual permanece visible en especímenes por arriba de los 140 mm de longitud. En fijador, dorso gris oscuro; costados Y Vientre plateados, las estrías se presentan de café oscuro. Distribución. En el Atlántico desde las Bahamas y Cuba hasta el sur de Buenos Aires, incluyendo el Golfo de México y el Caribe. En el área de estudio: localidades ESP, CA, PJ, PG (Fig. 5). Material examinado. 70 ejemplares de 44 a 212 mm de longitud total. Colección de referencia depositada en el Laboratorio de Ictiología y Ecología Estuarina del Inst. de Ciencias del Mar y Limnología de la Universidad Nacional Autónoma de México.Catálogo CC ML-PF 0.001755/1760 (Camp.). Observaciones taxonómicas. Algunas consideraciones sobre Haemulon bonariense en la costa Atlántica y el Golfo de México han sido hechas principalmente por: Jordan y Evermann (1896), Meek e Hildebrand (1925), Cervigon (1966), Randall (1968), Dahl (1972), Perry y Perry (1974), Guitart (1977), Fischer (1978). 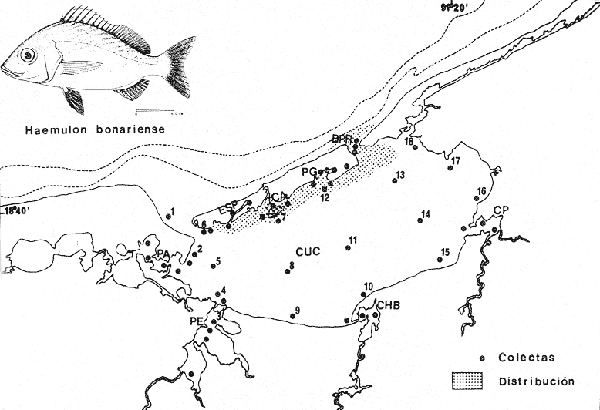 Fig. 5. Mapa de distribución de Haemulon bonariense en la Laguna de Términos, en relación a las estaciones de colecta en las distintas localidades. Los caracteres morfométricos tomados en cuenta en este estudio para diferenciar H. bonariense de H. plumieri(Lacépède) y H. aurolineatum Cuvier, permiten separar estas especies no presentándose confusión alguna en esclarecer diferencias básicas para la identificación correcta de la misma. La diferenciación se basa principalmente en la profundidad del cuerpo, longitud del hocico, longitud de los ojos, forma y ancho del interorbital, tamaño y número de escamas desde la línea lateral hasta el origen de la dorsal y en una serie longitudinal, longitud de las espinas dorsales y anales. Por consiguiente, Haemulon bonariense se separa de H. plumieri y deH. aurolineatum en la mayor elevación del dorso, la forma del cuerpo es oblonga, presentando el perfil anterior convexo (este carácter es claro en ejemplares de menos de 70 mm de longitud patrón conservándose en ejemplares de mayor talla), la boca y el maxilar son más pequeños, la dimensión relativa del ojo con respecto a la longitud cefálica es mayor, el interorbital es plano y más angosto. El número de escamas de la línea lateral al origen de la dorsal se presenta como una característica constante y sirve para diferenciarla de H. plumieri que tiene menos. El tamaño pequeño de las escamas de H. bonariense la distingue de especies similares del mismo género, todas, excepto H. flavolineatum(Desmarest),H. Plumieri y H. sciurus(Shaw) tienen más de 48 escamas en la línea lateral. H. flavolineatum se caracteriza por tener escamas grandes tanto debajo como arriba de la línea lateral. La presencia de estrías longitudinales y su coloración es punto de diferenciación seguro para poder separarla de las anteriores,H. Plumieri y H. sciurus presentan estrías azules. Las especies más semejantes aH. bonariense son H. parrai (Desmarest) yH. steindachneri (Jordan y Gilbert). En la primera las estrías no son continuas, sino que están formadas por puntos separados que corren a lo largo de las hileras de escamas. En H. steindachneri las escamas sobre los lados tienen el centro de color gris perlado formando líneas oblícuas a lo largo de las hileras de escamas y tiene una mancha negra en la base de la caudal. De las especies mencionadas, no se conoce ningún reporte previo para la Laguna de Términos, excepto H. plumieri que sí se localiza en ella; sin embargo, todas se presentan en el Golfo de México. Observaciones ecológicas. La distribución, abundancia numérica y biomasa de Haemulon bonariense para la época de lluvias y secas se muestran en las tablas 6 y 7 respectivamente. Para ambas épocas el número de individuos varió irregularmente en las distintas localidades. No obstante en los meses en los que se presentó mayor abundancia numérica fueron: en el mes de marzo de 1979 con 17 individuos en la época de secas en Bajos del Cayo, en el mes de agosto de 1977 con 12 individuos en Punta Gorda, durante la época de lluvias.  TABLA 6 HAEMULON BONARIENSE ABUNDANCIA ESTIMADA DURANTE LA ÉPOCA DE LLUVIAS (1976-1977) EN EL ÁREA ESTUDIADA 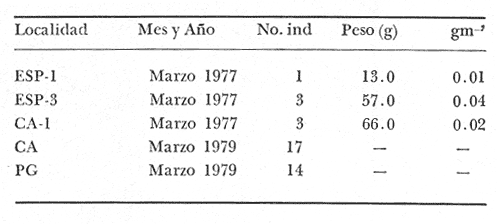 TABLA 7 HAEMULON BONARIENSE ABUNDANCIA ESTIMADA DURANTE LA ÉPOCA DE SECAS (1976-1979) EN EL ÁREA ESTUDIADA Por lo que respecta a biomasa, Yáñez-Arancibiaet al. (1980b) y Vargas Maldonado et al. (1981), reportan para Estero Pargo un total de 0.04 gm-² durante la época de secas. Para la época de lluvias no se tienen valores de biomasa. Es importante mencionar que Haemulon bonariense es la tercera especie más abundante de los pomadásidos en la laguna, distribuyéndose en el interior de la Isla del Carmen en zonas de mayor influencia marina. Frecuencia de la especie y utilización de la laguna. El análisis de frecuencia hecho por algunos autores ha permitido dar diversos valores para esta especie de acuerdo a la localidad y época climática. Yáñez-Arancibia et al. (1980a) y Vargas Maldonado et al. (1981), consideran a Haemulon bonariense como especie cíclica. De acuerdo a la categorización ictiotrófica de las especies, Yáñez-Arancibia et al. (1980a) y Vargas Maldonado et al. (1981) clasifican a Haemulon bonariense como consumidor de segundo orden. Su alimentación se basa principalmente de pequeños organismos bentónicos entre ellos: poliquetos, anfípodos, tanaidáceos, isópodos, pequeños decápodos, nemátodos, restos vegetales y materia orgánica. Haemulon plumieri(Lacépéde, 1802) N.v.: "Boquilla"
Labrus plumieriLacépéde, Hist. Nat. Poiss., 1802, 3: 480, lám. 2, fig. 2 (Martinica, basado en el dibujo de Plumier). Diagnosis. Cuerpo elongado comprimido, dorso elevado, profundidad 2.1 a 2.6 en la LP. Cabeza 2.4 a 2.8 en la LP, perfil anterior recto de la punta del hocico al frente del ojo, aquí cóncavo y desde ahí convexo al frente de la dorsal; boca grande y horizontal, hocico puntiagudo grande y pronunciado 1.9 a 2.8 en la cabeza. Ojos pequeños 3.1 a 6.0 en la cabeza, espacio interorbital convexo 2.8 a 4.0 en la longitud cefálica, el preorbital más angosto 2.4 a 6.0 en la cabeza. Maxilar 1.6 a 2.1 en la cabeza extendiéndose casi o enteramente a la mitad del ojo. Preopérculo finamente aserrado. Branquiespinas algo cortas 13 a 15 sobre la rama inferior del primer arco. Escamas del cuerpo grandes, las series sobre la línea lateral muy amplias arregladas irregularmente y en series muy oblícuas, 4 a 6 hileras entre la línea lateral y el origen de la dorsal, 46 a 53 en una serie longitudinal por encima de la línea lateral. D XII, 15-17; A III, 8-9; P 15-17. Espinas dorsales robustas, la cuarta más larga casi tan grande como el hocico 2.2 a 2.6 en la cabeza. Segunda espina anal más grande y fuerte que la tercera 2.1 a 2.8 en la cabeza, Pectorales moderadas 1.2 a 1.6 en la cabeza. Color. Cuerpo amarillo claro con reflejos plateados, estrías tenues bronceadas muy oblícuas corriendo hacia arriba y atrás. De 9 a 12 estrías longitudinales azul metálico a cada lado de la cabeza, no se extienden más allá sobre el cuerpo. Interior de la boca rojo oscuro. Dorsal espinosa transparente, borde amarillo; dorsal blanda verde-amarillento, caudal, anal y pectorales iguales; pélvicas grises pálidas con un matiz azul metálico. Los juveniles son similares a los adultos en color pero presentan dos estrías laterales oscuras y una mancha en la base de la caudal. En fijador difieren únicamente en el azul de las estrías de la cabeza y del cuerpo convirtiéndose en oscuras; aletas impares y pélvicas oscuras, pectorales transparentes. Distribución. En el Atlántico desde Cabo Hatteras hasta el sur de Brasil, incluyendo el Golfo de México y el Caribe. En el área de estudio: localidades ESP, CA, BPR, PJ, PG (Fig. 6). Material examinado. 247 ejemplares de 57 a 185 mm de longitud total. Colección de referencia depositada en el Laboratorio de Ictiología y Ecología Estuarina del Inst. de Ciencias del Mar y Limnología de la Universidad Nacional Autónoma de México.Catálogo CCML-PF 0.001749/1754 (Camp.). Observaciones taxonómicas. Algunas consideraciones sobre Haemulon plumieri en la costa Atlántica y Golfo de México han sido hechas principalmente por: Jordan y Evermann (1896), Meek e Hildebrand (1925), Cervigon (1966), Randall (1968), Dahl (1971), Guitart (1977), Hoese y Moore (1977), Castro-Aguirre (1978), Fischer (1978). En este estudio los caracteres morfométricos diagnósticos tomados en cuenta para la determinación de esta especie permiten determinarla claramente y diferenciarla de las otras especies del mismo género en el Golfo de México y Laguna de Términos. Por consiguiente Haemulon plumieri se separa por presentar una profundidad menor queH. bonariense Cuvier y mayor que H. aurolineatumCuvier. El perfil anterior es cóncavo, mientras que en las otras especies es convexo, la boca es horizontal, la dimensión relativa del ojo con respecto a la longitud cefálica es mucho mayor. 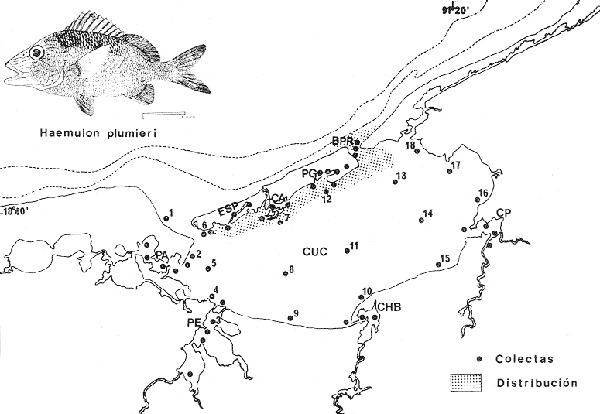 Fig. 6. Mapa de distribución de Haemulon plumieri en la Laguna de Términos, en relación a las estaciones de colecta en las distintas localidades. La coloración, número y color de las estrías longitudinales, es básica para diferenciarlas de las otras especies. Además, H. plumieri se distingue de las otras especies del mismo género por la presencia de escamas muy grandes arriba de la línea lateral. H. flavolineatum (Desmarest) tiene las escamas igualmente grandes tanto por arriba como por debajo de la línea lateral. Únicamente H. sciurtis (Shaw) muestra estrías longitudinales sobre la cabeza, pero presenta mayor número de branquiespinas sobre el primer arco (27 a 31 del arco total) y la boca más grande. Las especies mencionadas no tienen registros previos para la Laguna de Términos. Sin embargo se encuentran en el Golfo de México. Observaciones ecológicas. La distribución, abundancia numérica y biomasa de Haemulon plumieri se muestran en las tablas 8 y 9 para la época de lluvias y secas respectivamente. Para ambas épocas climáticas el número de individuos y biomasa fluctuaron irregularmente de acuerdo a la localidad. Sin embargo, los meses en los que se presentó mayor abundancia numérica fueron: marzo de 1979 con 75 y 54 individuos en Bajos del Cayo y Estero Pargo respectivamente, durante la época de secas, mes de octubre de 1976 con 11 individuos en la Boca de Puerto Real durante la época de lluvias. Por lo que respecta a biomasa Bravo-Núñez y Yáñez-Arancibia (1979) reportan para la Boca de Puerto Real durante la época lluviosa un total de 0.25 gm-². Vargas Maldonado et al. (1981) reportan para el interior de la Isla del Carmen en la estación ESP-1 y CA-2 un total de 0.04 gm-² durante la época de secas. Es importante destacar queHaemulon plumieri es la segunda especie mejor representada en cuanto a distribución y abundancia de todos los pomadásidos en la Laguna de Términos, se distribuye en áreas de salinidades marinas. Es un recurso económico en el área. Frecuencia de la especie y utilización de, la laguna. El análisis de la frecuencia hecho por algunos autores ha permitido dar diversos valores de acuerdo a la localidad y época climática. Así Bravo-Núñez y Yáñez-Arancibia (1979) han reportado para la Boca de Puerto Real una frecuencia de 83.33%, considerándolo como componente comunitario permanente en esa localidad. Yáñez-Arancibiaet al. (1980a) consideran a Haemulon plumieri especie cíclica.  TABLA 8 HAEMULON PLUMIERI ABUNDANCIA ESTIMADA DURANTE LA ÉPOCA DE LLUVIAS (1976-1977) EN EL ÁREA ESTUDIADA  TABLA 9 HAEMULON PLUMIERI ABUNDANCIA ESTIMADA DURANTE LA ÉPOCA DE SECAS (1976-1979) EN EL ÁREA ESTUDIADA De acuerdo a la categorización ictiotrófica de las especies, Bravo-Núñez y Yáñez-Arancibia (1979), Yáñez-Arancibia et al. (1980a y b) y Vargas Maldonado et al. (1981) clasifican a Haemulon plumieri como consumidor de segundo orden. Su alimentación se basa principalmente de equinodermos, poliquetos, moluscos, pequeños decápodos, peces, restos vegetales y materia orgánica. GéneroAnisotremus Gill, 1860Anisotremus virginicus(Linnaeus, 1758) N.v.: ''Posta''
Sparus virginicus Linnaeus, Syst. Nat., Ed. 10. 1758: 281 (Sudamérica). Diagnosis. Cuerpo ovado comprimido, dorso considerablemente elevado, profundidad 1.7 a 2.9 en la LP. Cabeza 2.7 a 3.2 en la LP, perfil anterior muy empinado suavemente convexo a lo largo del hocico y sobre el ojo, muy arqueado en la nuca; boca pequeña casi horizontal, hocico corto 2.4 a 3.3 en la cabeza. Ojos moderadamente grandes 2.8 a 4.4 en la cabeza, espacio interorbital convexo 2.7 a 3.5 en la longitud cefálica, el preorbital más angosto 3.7 a 4.0 en la cabeza. Maxilar 2.7 a 3.7 sobrepasando casi o igual al margen anterior del ojo. Preopérculo finamente aserrado. Branquiespinas muy cortas 13 a 15 sobre la rama inferior del primer arco. Escamas del cuerpo algo pequeñas, las series sobre la línea lateral oblícuas, 10 a 11 hileras entre la línea lateral y el origen de la dorsal 55 a 63 en una serie longitudinal por encima de la línea lateral. D XII, 16-17; A III, 9-11; P 17-18. Espinas dorsales fuertes, la tercera o cuarta aproximadamente igual al hocico y mitad del ojo, la cuarta 1.7 a 2.2 en la cabeza. Segunda espina anal notablemente más grande que la tercera, igual en longitud a la cuarta espina dorsal 1.5 a 2.0 en la cabeza. Pectorales grandes 2.7 a 3.2 en el cuerpo, 0.86 a 1.2 en la cabeza. Color. Cuerpo amarillo-verdoso en la parte superior, vientre café pálido. Dorso y costados con estrías azules y amarillas alternadas, aproximadamente de la misma anchura; una banda negra desde la nuca a través del ojo, hasta la esquina de la boca, otra del origen de la dorsal a la base de la pectoral. Cabeza y aletas amarillas. Los juveniles con cuerpo blanquecino presentan dos estrías negras longitudinales, una desde la nuca al último rayo dorsal, la otra desde el Ojo a la base de la caudal la cual presenta una mancha negra. En fijador, cuerpo gris perla pálido con aproximadamente 7 estrías longitudinales amarillo oscuras, los interespacios plateados. Todas las aletas amarillo pálido. Distribución. En el Atlántico desde Florida hasta el sur de Brasil, incluyendo el Golfo de México y el Caribe. En el área de estudio: localidades BPR (Fig. 7). Material examinado. 8 ejemplares de 73 a 286 mm de longitud total. Colección de referencia depositada en el Laboratorio de Ictiología y Ecología Estuarina del Inst. de Ciencias del Mar y Limnología de la Universidad Nacional Autónoma de México.Catálogo: CCMLPF 0.001734/1737 (Camp.). Observaciones taxonómicas. Algunas consideraciones taxonómicas sobreAnisotremus virginicus en la costa Atlántica y Golfo de México han sido hechas principalmente por: Jordan y Evermann (1896), Meek e Hildebrand (1925), Cervigon (1966), Randall (1968), Dahl (1972), Hoese y Moore (1977), Guitart (1977), Fischer (1978). La mayor parte de los caracteres morfométricos tomados para la determinación deAnisotremus virginicus muestran bastante similitud con los de A. spleniatus (Poey). Sin embargo la revisión taxonómica de A. virginicus hecha en este estudio, establece diferencias claras que permiten distinguirla correctamente.A. virginicus se separa de A. spleniatuspor presentar relativamente una mayor altura, reflejándose por la mayor elevación del dorso, la nuca la presenta marcadamente convexa, el espacio interorbital es convexo y más ancho, el número de branquiespinas es menor, las escamas son oblicuas sobre la línea lateral. En especímenes jóvenes de menos de 70 mm de longitud patrón, por su aspecto general, podrían confundirse superficialmente con A. spleniatus; sin embargo, la presencia de las dos estrías oscuras transversales en la cabeza, la hacen fácilmente separable de la otra. El patrón de coloración de A. virginicus es característica suficientemente determinante para distinguirla sin dificultad de las otras especies del mismo género. Observaciones ecológicas. Al parecer es una especie rara en la Laguna de Términos por su baja abundancia. Bravo-Núñez y Yáñez-Arancibia (1979) y Yáñez-Arancibiaet al. (1980a) sólo la han reportado para la localidad Boca de Puerto Real con 6 individuos, presentando una biomasa total de 0.22 gm-². 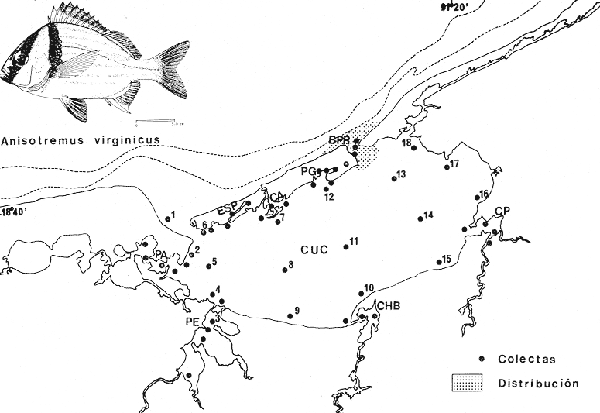 Fig. 7. Mapa de distribución de Anisotremus virginicus en la Laguna de Términos, en relación a las estaciones de colecta en las distintas localidades. Es importante destacar que Anisotremus virginicuses la quinta especie en cuanto a distribución y abundancia de los pomadásidos en la Laguna de Términos, esta especie es típica estenohalina distribuyéndose en áreas de mayor influencia marina. Frecuencia de la especie y utilización de la laguna. El análisis de frecuencia hecho por algunos autores ha permitido dar diversos valores para esta especie de acuerdo a la localidad y época climática. Bravo-Núñez y Yáñez-Arancibia (1979) han reportado en Boca de Puerto Real una frecuencia de 16.67% considerándola por lo tanto componente comunitario ocasional. Yáñez-Arancibia et al. (1980a y b) consideran a Anisotremus virginicus especie visitante cíclica. De acuerdo a la categorización ictiotrófica de las especies. Bravo-Núñez y Yáñez-Arancibia (1979) y Yáñez-Arancibia et al. (1980a) clasifican aAnisotremus virginicus como consumidor de segundo orden. Su alimentación se basa principalmente de pequeños organismos bentónicos entre ellos: isópodos, anfípodos, tanaidáceos, pequeños decápodos, poliquetos, equinodermos y materia orgánica. Anisotremus spleniatus (Poey, 1860) N.v.: "Ronco"
Pristipoma spleniatum Poey, Memorias sobre la Historia Natural de la Isla de Cuba, 1860, 2:187, Habana. Diagnosis. Cuerpo ovado comprimido, dorso muy elevado, profundidad 2.0 a 2.7 en la LP. Cabeza 2.7 a 3.2 en la LP, perfil anterior suavemente convexo a lo largo del hocico y sobre el ojo seguida de una muesca, arqueado en la nuca; boca pequeña ligeramente oblícua, hocico corto 2.8 a 4.0 en la cabeza. Ojos moderadamente grandes 3.0 a 3.6 en la cabeza, espacio interorbital plano 3.1 a 3.6 en la longitud cefálica, el preorbital más angosto 4.0 a 5.5 en la cabeza. Maxilar 2.5 a 3.1 en la cabeza no sobre el frente del ojo. Preopérculo finamente aserrado. Branquiespinas 11 a 15 sobre la rama inferior del primer arco. Escamas de tamaño pequeño, las series sobre la línea lateral paralelas con ésta, 9 a 11 hileras entre la línea lateral y el origen de la dorsal, 50 a 63 en una serie longitudinal por encima de la línea lateral. D XII, 1617; A III, 9-11; P 16-18. Espinas dorsales regulares, la cuarta 1.8 en la longitud cefálica, normalmente igual a la mitad de la cabeza. Segunda espina anal notablemente más grande que la tercera tan larga como la longitud de la cuarta espina dorsal 1.6 a 1.9 en la cabeza. Pectorales grandes 1.1 a 1.5 en la cabeza. Color. Dorso y vientre amarillo-oro, el resto del cuerpo plateado oscuro. Dos estrías cafés, una situada entre la línea lateral y el dorso, la otra desde el ojo a la caudal terminando en una mancha negra; dos estrías doradas, una a lo largo de la línea lateral y la otra a lo largo del vientre, hasta la caudal. Cabeza y nuca amarillo-oro, hocico rosado, una banda ancha vertical negra del primer rayo de la dorsal y la base de la pectoral. Aletas anaranjado brillante; dorsal espinosa y pélvicas con las membranas negruzcas. Distribución. En el Atlántico reportado únicamente para las aguas de Cuba y Sur del Golfo de México (Poey 1860 Bravo-Nuñez Yáñez-Arancibia 1979). En el área de estudio; localidades BPR, PG (Fig. 8). Material examinado. 3 ejemplares de 76 a 94 mm de longitud total. Colección de referencia depositada en el Laboratorio de Ictiología y Ecología Estuarina del Inst. de Ciencias del Mar y Limnología de la Universidad Nacional Autónoma de México.Catálogo CCML-PF 0.001738/1740 (Camp.). Observaciones taxonómicas. Algunas consideraciones taxonómicas sobreAnisotremus spleniatus en la costa Atlántica y en el Golfo de México han sido hechas principalmente por Jordan y Evermann (1896). La mayor parte de los caracteres morfométricos diagnósticos tomados para la determinación de A. spleniatus muestran bastante similitud con A. virginicus (Linnaeus). Sin embargo la revisión taxonómica de A. spleniatus en el presente estudio establece diferencias básicas para su correcta determinación. La especie spleniatus se distingue principalmente devirginicus por una profundidad corporal menor reflejándose en la menor elevación del dorso, el espacio interorbital es plano, el preorbital es mucho más angosto, el maxilar no llega al frente del ojo, las hileras de escamas sobre la línea lateral son paralelas con ésta, y el número de branquiespinas es mayor. 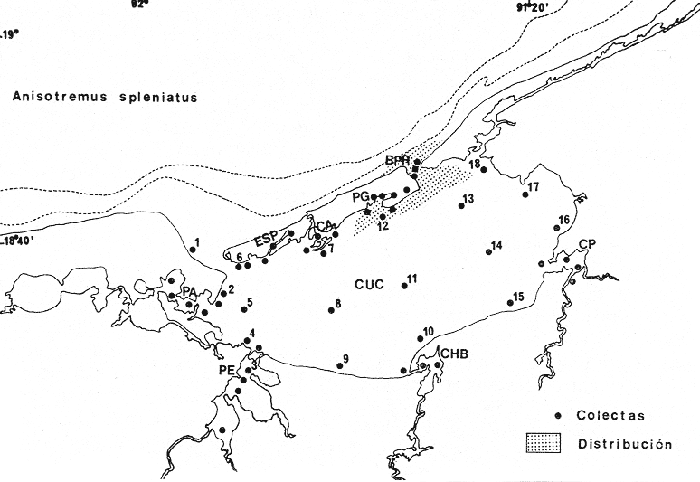 Fig. 8. Mapa de distribución de Anisotremus spleniatus en la Laguna de Términos, en relación a las estaciones de colecta en las distintas localidades. Al igual que A. virginicus la coloración deA. spleniatus es un carácter de comparación seguro para diferenciar ambas especies. A spleniatuspresenta sólo una banda ancha vertical negra, del origen de la dorsal a la base de la pectoral. Autores como Jordan y Evermann (1896), consideran el número de ciegos terminales del estómago como características importantes para determinar esta especie. Sin embargo los caracteres morfométricos externos, así como el patrón de coloración de A. spleniatus hacen más rápida su identificación. Observaciones ecológicas. Al parecerAnisotremus spleniatus es una especie rara en la Laguna de Términos por su poca frecuencia y abundancia, sólo se ha colectado 3 individuos en la Boca de Puerto Real durante la época de lluvias. No se ha vuelto a colectar y los registros de biomasa no son significativos. Esta especie ocupa el sexto lugar en cuanto a distribución y abundancia cuya distribución es en áreas de mayor influencia marina. Frecuencia de la especie y utilización de la laguna. El análisis de frecuencia hecho por algunos autores ha permitido dar diversos valores para la especie de acuerdo a la localidad y época climática. Bravo-Núñez y Yáñez-Arancibia (1979) han reportado para la Boca de Puerto Real una frecuencia de 16.67% considerándolo como un componente comunitario ocasional. Yáñez-Arancibia et al. (1980a) consideran a Anisotremus spleniatuscomo visitante cíclico. De acuerdo a la categorización ictiotrófica de las especies, Bravo-Núñez y Yáñez-Arancibia (1979) y Yáñez-Arancibiaet al. (1980a)Anisotremus spleniatus es consumidor de segundo orden. Su alimentación se basa principalmente de pequeños organismos bentónicos como poliquetos, anfípodos, tanaidáceos, isópodos, pequeños decápodos, copépodos, restos vegetales y materia orgánica. DISCUSIÓN
DISTRIBUCIÓNLo más significativo de los resultados presentados es la influencia claramente notoria de las características ambientales que prevalecen en la Laguna de Términos sobre la distribución de la Familia Pomadasyidae. De esta manera cada una de las especies, se distribuye a lo largo del interior de la Isla del Carmen, de acuerdo a un esquema, determinado por los parámetros ambientales y por los movimientos migratorios de la especie durante dos épocas climáticas presentes. Dicho esquema por especie es el siguiente: Orthopristis chrysopterus presenta una distribución semejante aHaemulon bonariense y Haemulon plumieri. Sin embargo, la primera es la única que se distribuye también en zonas de la cuenca central y zonas de influencia fluvial (Fig. 3). Es la especie mejor representada, por lo que es características del área, encontrándose en un rango de salinidad de 12 a 39 ppm, donde el valor máximo corresponde a la Boca de Puerto Real (Bravo-Núñez y Yáñez-Arancibia, 1979; Yáñez-Arancibia et al. 1980a). Habitan aguas someras entre vegetación de manglar, pastos marinos y macroalgas, asociados a sedimentos fangosos y/o arenosos. Sin embargo, su mayor abundancia es en aguas de alta transparencia (60%), sobre praderas de Thalassia testudinum. El rango de temperatura osciló entre 28 y 29°C. Esta especie ha sido reportada en la Plataforma de Campeche como componente de las ictiocomunidades por Yáñez-Arancibia et al. (1980b y c) y Sánchez Gil et al. (1981) en un rango de salinidad de 35.5 a 36 ppm y temperatura de 28 a 28.3°C asociada a sedimentos arenosos. Por otro lado Gunter (1945) captura especímenes de esta especie en salinidades superiores de 25 ppm y temperaturas de 13.7 a 33°C. Reid (1955) la reporta en salinidades de 16 a 25.1 ppm en el área de la Bahía Este de Texas con un promedio de temperatura de 25.2°C. Simmons (1957) reporta a esta especie en salinidades de 43 a 56 ppm. Springer y Woodburg (1960) reportan a Orthopristis chrysopterus en el área de la Bahía de Tampa, Florida, en un rango de salinidad de 19.1 a 35 ppm y temperaturas de 17.5 a 32.5°C. Guitart (1977) reportan a esta especie en aguas costeras de Cuba. Por otro lado Hoese y Moore (1977) la reportan en aguas adyacentes de Texas y Louisiana. Castro-Aguirre (1978) la cita para la desembocadura del Río Bravo y Laguna Madre, Tamp. Al parecer Orthopristis chrysopterus es una especie euritermohalina, como lo muestra su mapa de distribución. Haemulon plumieri se distribuye en el interior de la Isla del Carmen, habitando ambientes de manglar, pastos marinos principalmente sobre praderas deThalassia testudinum y macroalgas, asociados a fondos fangosos y arenosos en salinidades de 25 a 39 ppm, correspondiendo el primer valor a Estero Pargo (Vargas Maldonado et al. 1981) y el segundo a la Boca de Puerto Real (Bravo-Núñez y Yáñez-Arancibia 1979; Yáñez-Arancibia et al. 1980a). Típico de arrecifes coralinos y aguas someras, su mayor abundancia fue en aguas claras de alta transparencia (± 60%) y temperaturas de 25 a 29°C. Esta especie ha sido reportada por Castro-Aguirre (1978) en la desembocadura del Río Pánuco, cerca de Tampico, Tamps. Sin embargo, Springer y Woodburn (1960), mencionan a esta especie en aguas adyacentes a la Bahía de Tampa, en salinidades y temperaturas que varían de 30.8 a 32.4 ppm y 22.1 a 23°C donde es especialmente abundante en arrecifes costeros. Reséndez (1975) y Jordanet al. (1978) reportan a Haemulon plumieri en la Laguna de Bojórquez y Laguna de Nichupté, Q. Roo, en salinidades de 37.5 ppm y temperaturas de 28.1 a 31°C en aguas someras con fondos carbonatados cubiertos porThalassia testudinum. Springer y Mc Erlean (1962) la reportan para las costas del Sur de Florida en un rango de salinidad de 34.7 a 37.9 ppm y temperaturas de 27 a 33.6°C. Por otro lado Dahl (1972) reporta a Haemulon plumieri en aguas de la vertiente del Caribe en Colombia y Guitart (1977) la reporta en aguas costeras de Cuba.Haemulon Plumieri es una especie típica estenohalina, esto se destaca en su mapa de distribución (Fig. 6). Haemulon bonariense es una especie frecuente, cuya distribución es amplia y homogénea a lo largo del interior de la Isla del Carmen (Fig. 5). Habita ambientes de manglar, pastos marinos y macroalgas asociadas a sedimentos de limo, arcilla y arena muy fina en un Tango de salinidad de 23 a 28 ppm y temperatura de 24 a 28.3°C. Se le encuentra en aguas claras de transparencia de (± 60%), principalmente sobre praderas de Thalassia testudinum. Cervigon (1966) la reporta en fondos coralinos y rocosos someros. Haemulon bonariense también es reportada por Dahl (1972) en aguas del Caribe Colombiano. Perry y Perry (1974) la citan como común en aguas de la Costa Atlántica de Costa Rica y Guitart (1977) la reportan en aguas costeras de Cuba. Reséndez (1975) y Jordan et al. (1978) reportan a H. bonariense en la Laguna de Nichupté y Bojórquez, Q. Roo en aguas someras de sedimentos carbonatados cubiertos por Thalassia testudinum con salinidad de 37.5 ppm y temperaturas de 28.1 a 31°C. Haemulon aurolineatum es una especie poco frecuente en el área cuya distribución queda restringida a mayor influencia marina (Fig. 4). Habitan en ambientes de manglar, pastos marinos y macroalgas, asociados a sedimentos arenosos en salinidades de 24 a 38 ppm y temperaturas de 24 a 29°C, alta transparencia (± 60%). Especie típica marina y de hábitos gregarios es reportada en la Plataforma de Campeche como componente de las ictiocomunidades de esa área por Yáñez-Arancibiaet al. (1980b y c) y Sánchez Gil et al. (1981) en rangos de salinidad y temperatura de 35.5 a 36 ppm y 28.3°C asociados a sedimentos arenosos. Cervigon (1966) reporta aHaemulon aurolineatumcomo especie típica de fondos someros y arenosos. Guitart (1977) la cita en aguas costeras de Cuba. Dahl (1971) la reporta cerca de las rocas en aguas de poca profundidad. Finalmente Couternay y Salman (1977) la reportan en arrecifes (aprox. 25 m de profundidad), así como también en fondos rocosos o sustratos arenosos en el Oeste Central del Atlántico. Anisotremus spleniatusy Anisotremus virginicus son especies poco frecuentes que presentan patrones de distribución similares en la laguna (Figs. 7 y 8). Especies típicamente estenohalinas y de hábitos gregarios se distribuyen principalmente en áreas de mayor influencia marina. Habitan ambientes de vegetación sumergida, principalmente sobre praderas deThalassia testudinum, asociados a sedimentos arenosos y contenido de materia orgánica alto y salinidades de 29 a 38 ppm, temperaturas de 21 a 29°C alta transparencia (± 60%) (Bravo-Núñez y Yáñez-Arancibia, 1979).Anisotremus virginicusha sido reportada por Reséndez (1971) entre corales de Acropora cervicornis en rangos de salinidad y temperatura de 30 a 36 ppm y 28.5 a 29.4°C. Cervigon (1966) la reporta como característica de los fondos de coral y aisladamente en las bocas de las lagunas de los manglares. Dahl (1971) la reporta como especie comparativamente rara en la región del Caribe Colombiano. Guitart (1977) también la reporta para aguas de Cuba. Por otro lado, Randall (1967) la reporta en arrecifes coralinos de los Cayos de Florida. Hoese y Moore (1977) la reportan en aguas adyacentes de Texas y Louisiana. Por lo que respecta aAnisotremus spleniatus no se tienen registros previos de esta especie, excepto el de Jordan y Evermann (1896), que la estudian taxonómicamente, por lo que se recomienda hacer estudios sobre su distribución, biología y ecología en Costas Atlánticas y Golfo de México. Con base en este análisis, debe destacarse que los patrones de distribución de los roncos de la familia Pomadasyidae, están definidos en el subsistema ecológico del interior de la Isla del Carmen obedeciendo al marco ambiental que en esta zona prevalece, siendo notorio que la influencia de la salinidad es un factor determinante para su distribución en la laguna. No obstante, se observa que O. chrysopterus posee gran capacidad euritermohalina, por lo que la salinidad y la temperatura no son factores limitantes para su distribución, mientras que para A. spleniatus y A. virginicus la salinidad parece determinante en su distribución. Además, la utilización del interior de la Isla del Carmen es principalmente como zona de reclutamiento de juveniles que necesitan de sus áreas protegidas, ya que estas especies tienden a formar cardúmenes relacionados con la crianza y/o alimentación, por lo cual esta zona es fundamental puesto que reúne las necesidades para estas funciones. ABUNDANCIAEs importante señalar que existe un mayor número de individuos representados principalmente por juveniles para una y otra época climática, a pesar de que el área del interior de la Isla del Carmen posee características ambientales relativamente estables durante las dos épocas diferentes del año, como lo señala Vargas Maldonadoet al. (1981). Por lo que respecta a las especies dominantes, dos son las que están mejor representadas tanto en número de individuos (abundancia numérica) como por sus valores de biomasa en las distintas localidades del interior de la Isla del Carmen para la época de secas. Estas son Orthopristis chrysopterus y Haemulon plumieri que constituyen un alto porcentaje de la captura total en la Boca de Puerto Real. Orthopristis chrysopterus es la especie más abundante en el habitat del interior de la Isla del Carmen. El número de individuos y el de biomasa en las distintas localidades, fluctúa de acuerdo a la época climática. Esta especie está bien representada con una biomasa homogénea en la época de secas principalmente por tallas juveniles y algunos adultos en la época de lluvias. Bravo-Núñez y Yáñez-Arancibia (1979) y Yáñez-Arancibiaet al. (1980b y c) la consideran entre los peces dominantes de la ictiofauna de la Boca de Puerto Real. Los valores máximos de biomasa reportados para esta especie fueron de 0.20 gm² durante la época de secas en la Boca de Puerto Real y 0.24 gm-² durante la época de lluvias en Estero Pargo. Springer y Woodburn (1960) reportan esta especie poco abundante en la Bahía de Tampa, Florida. Haemulon plumieri es la segunda especie más abundante de los pomadásidos dentro de la laguna, encontrándose su mayor abundancia numérica en la Boca de Puerto Real en la época de secas, principalmente representada por tallas juveniles. Tiene poca representatividad en época de lluvias con abundancia numérica baja, pero no así en biomasa registrándose los valores más altos en la Boca de Puerto Real en la estación BPR-1 (Bravo-Núñez y Yáñez-Arancibia 1979 y Yáñez-Arancibia et al. 1980b). Los valores máximos de biomasa reportados para esta especie fueron 0.04 gm-² en la época de secas y 0.25 gm-² en la época lluviosa de la Boca de Puerto Real. Por otra parte Cervigon (1966) reporta esta especie como muy abundante en todas las costas de Margarita e islas adyacentes de Venezuela. Springer y Wooldburn (1960) la mencionan como abundante especialmente en arrecifes costeros. La tercera especie más abundante esHaemulon bonariense, encontrándose bien representada por su distribución en el interior de la Isla del Carmen. Sin embargo, sus valores de abundancia son bajos en ambas épocas climáticas. Su mayor abundancia numérica se observó durante la época de secas, representada principalmente por tallas juveniles y subadultas. Los valores máximos de biomasa reportados para esta especie fueron 0.02 gm-² en la época de secas en Bajos del Cayo. Cervigon (1966) la reporta como muy abundante en toda la zona de la Isla Margarita, Venezuela. Haemulon aurolineatumconstituye la cuarta especie de pomadásidos importante en abundancia. Se encuentra representada principalmente por tallas subadultas, su abundancia fue muy irregular en las dos épocas climáticas. Esta especie presentó mayor abundancia numérica en la época de lluvias en el mes de agosto en la Boca de Puerto Real. Para la época de secas los valores de abundancia tanto numérica como de biomasa fueron muy bajos en Boca de Puerto Real, Bajos del Cayo y Punta Gorda. Los valores máximos de biomasa reportados para esta especie fueron 0.06 gm-² en la época de lluvias. Para la época de secas no se tienen valores de biomasa. Cervigon (1966) la reporta como una especie muy abundante en los alrededores de la Isla Margarita, Venezuela. Anisotremus spleniatus yAnisotremus virginicus son especies raras y poco frecuentes en la Laguna de Términos por tal motivo los registros de abundancia numérica y biomasa son escasos, teniendo tan sólo valores de biomasa en la época de lluvias con 0.007 gm-² para A. spleniatus y de 0.22 gm-² para A. virginicus en la Boca de Puerto Real. Esta última es reportada por Randall (1967) como muy abundante en arrecifes coralinos de los Cayos de Florida y por Reséndez (1971) en el arrecife La Blanquilla, Ver., entre corales de Acropora cervicornis. FRECUENCIA DE LAS ESPECIES Y PATRÓN DE UTILIZACIÓN DE LA LAGUNALa presencia de la gran abundancia de juveniles en la época de secas, implica un reclutamiento de los mismos y el uso del interior de la Isla del Carmen como áreas de crianza, alimentación y/o protección, apoyadas por la estabilidad del sustrato, corrientes, temperatura y salinidad en esa época climática. Por lo que respecta a las especies dominantes Orthopristis chrysopterus es visitante cíclico para zonas protegidas, como lo denotan su abundancia y frecuencia, representada por tallas pequeñas y por tallas mayores en menor porcentaje sugiere una alta fecundidad y la evidencia de que utiliza el interior de la Isla del Carmen como área de alimentación y crianza. Probablemente el desove se efectúe en la línea de costa muy cerca de la laguna. Springer y Woodburn (1966) reportan para la Bahía de Tampa ejemplares de tallas pequeñas. La ausencia de individuos de tallas grandes refuerza la observación de que la especie migre para desovar en la zona nerítica y probablemente su desove sea antes de la época de secas, ya que en ésta se registraron los ejemplares más pequeños., Hildebrand y Cable (1930) sin embargo, reportan que la especie puede realizar desoves en estuarios; pero parece una observación prematura que no se ha comprobado en los años siguientes. Haemulon plumieritambién se caracterizó por su abundancia y frecuencia. Se considera como especie visitante cíclica en la época de secas. Probablemente migre a zonas neríticas donde realiza su desove al comienzo de la época de lluvias y utilice el área del interior de la Isla del Carmen como áreas de alimentación, protección y/o crianza en la época de secas. Haemulon bonariense es otra especie que utiliza zonas protegidas como áreas de alimentación y/o protección, presumiblemente en la época de secas, además por su frecuencia y abundancia se considera como especie visitante cíclica. Haemulon aurolineatum, realiza migraciones al interior de la Isla del Carmen buscando protección y/o alimento, especie poco frecuente y abundante. Se le considera visitante cíclico. Anisotremus virginicus y Anisotremus spleniatus registraron valores de abundancia numérica y biomasa no muy significativos en la captura total, debido a que estas especies están más restringidas a salinidades marinas y por lo tanto migran tan solo a zonas más interiores buscando alimento y/o protección. Ambas especies se consideran visitantes cíclicas, como lo denotan su abundancia y frecuencia. Conclusiones1. Por su diversidad, distribución y abundancia la familia Pomadasyidae está bien representada en el subsistema ecológico del interior de la Isla del Carmen. 2. Seis especies juegan un importante papel en la estructura y función de las comunidades ictiofaunísticas del área, i.e., Anisotremus spleniatus, Anisotremus virginicus, Haemulon aurolineatum, Haemulon bonariense, Haemulon plumieri yOrthopristis chrysopterus. 3. Se precisan las especies, discutiendo las diferencias y afinidades entre ellas, esto es: Orthopristis chrysopterus Girard,Haemulon aurolineatum Cuvier, Haemulon bonariense Cuvier y Valenciennes, Haemulon plumieri (Lacépéde),Anisotremus virginicus Gill y Anisotremus spleniatus(Poey). 4. Las especiesOrthopristis chrysopterus y Haemulon plumieri destacan como componentes típicos de la estructura de las comunidades del área por su distribución, frecuencia y abundancia, la primera puede tolerar rangos amplios de salinidad y temperatura, teniendo por lo tanto gran capacidad euritermohalina. 5.Haemulon aurolineatumy Haemulon bonariense, son especies cuya distribución está mejor representada en praderas de Thalassia testudinum, la segunda es más frecuente con una distribución más amplia y homogénea. 6. Anisotremus spleniatus y Anisotremus virginicus son especies cuya distribución queda restringida en áreas de mayor y persistente influencia marina. 7. La abundancia (biomasa) de las especies en orden de importancia de acuerdo a sus valores máximos es el siguiente: Haemulon plumieri : 0.25 gm-² Orthopristis chrysopterus : 0.24 gm-² Anisotremus virginicus : 0.22 gm-² Haemulon aurolineatum : 0 06 gm-² Haemulon bonariense : 0.02 gm-² Anisotremus spleniatus : 0. 007gm-² 8. Las variaciones de biomasa y abundancia numérica en ambas épocas, está dada por la presencia mayoritaria de juveniles. 9. Se establece que el subsistema ecológico del interior de la Isla del Carmen representa un área de crianza, alimentación y/o protección para las especies de pomadásidos encontrados en ella. AgradecimientosLos autores agradecen a Agustín Ayala-Castañares, José Luis Rojas Galavíz, Antonio García-Cubas y Alfredo Laguarda Figueras, la cuidadosa revisión del manuscrito y sus valiosos comentarios y sugerencias. A los compañeros del Laboratorio de Ictiología y Ecología Estuarina, especialmente a Arturo Aguirre León, Ana Laura Lara Domínguez, Patricia Sánchez-Gil y Lia Mallard Colmero por sus útiles sugerencias en la discusión de este estudio. El apoyo institucional y económico para la realización del presente trabajo fue brindado por el Instituto de Ciencias del Mar y Limnología de la Universidad Nacional Autónoma de México y parcialmente por el Programa Regional de Desarrollo Científico y Tecnológico de la Organización de los Estados Americanos (OEA) a través de su Oficina de Proyectos Especiales en Washington. LITERATURAAMEZCUA-LINARES, F. y A. YÁÑEZ-ARANCIBIAAn. Centro Cienc. del Mar y Limnología. Univ. Nal. Autón. MéxicoEcología de los sistemas fluvio-lagunares asociados a Laguna de Términos. El habitat y estructura de las comunidades de peces.1980.69-118.7 (1) ARNOV, B., Bull. Mar. Sci. Gulf Caribb., A preliminary review of the Western North Atlantic fishes of the genus Haemulon.1952.385-464.2(2) BEEBE, W. y TEE-VANZoológica The fishes of Port-AuPrince BayHaiti1928.1-279.10(1) BOHLKE, J. E. y C. G. CHAPLINFishes of the Bahamas and Adjacent Waters.Livingston Publishing, Co.,Pennsylvania1968.771 p. BRAVO-NÚÑEZ, E. y A. YÁÑEZ-ARANCIBIAAn. Centro Cienc. del Mar y Limnol. Univ. Nal. Autón. MéxicoEcología de la Boca de Puerto Real, Laguna de Términos. 1. Descripción del área y análisis estructural de las comunidades de peces.1979.125-182.6(1) BROOK, J. M., Some aspects of the trophic relationships among the higher consumers in a seagrass community (Thalassia testudinum Koning) in Card Sound, Florida, Ph. D. Dissertation, University of Miami1975.133 p. ---, Trans. Amer. Fish. Soc., Trophic relationships in a seagrass community (Thalassia testudinum), in Card Sound, Florida. Fish diets in relation to macrobenthic and cryptic faunal abundance. 1977.219-229.106 (3) CARR, W. E. S. y C. A. ADAMSTrans. Amer. Fish. Soc., Food habits of juvenile marine fishes occupying seagrass beds in the estuarine zone near Crystal river. Florida.1973.511-540.102 (3) CASTRO-AGUIRRE, J. L., Dir. Gral. Inst. Nal. Pesca, México., Ser. Cient.,Catálogo sistemático de los peces marinos que penetran a las aguas continentales de México con aspecto zoogeográficos y ecológico.;1978.1-29819 CERAME-VIVAS, M. J. Inc.,Mangroves of Puerto Rico. P. F. Z. Properties, Inc., y M. J. Cerame-Vivas, Inc., 1974. 64 p. CERVIGON, M F., Los Peces Marinos de Venezuela. Estación de Investigaciones Marinas de Margarita, Fundación La Salle de Ciencias Naturales, Caracas, Monogr.1966.1-951. 11 y 12 CHÁVEZ, E. A.,Mem. IV Congr. Nal. Ocean. Notas acerca de la ictiofauna del estuario del Río Tuxpan y sus relaciones con la temperatura y la salinidad. In: Carranza, J. (Ed.)México1972.177-199. COURTENAY, W. R., Bull. Mar. Sci. Gulf Caribb.,Western atlantic fishes of the genus Haemulon (Pomadasyidae): Systematic status and juvenile pigmentation.1961.66-149.11 (1) ---, Copeia The systematic status of Haemulon boschmae, a grunt fish from shore waters of Northcastern Soutti America. 1965.41-45.1 CUMMINGS, W. C., B. C. BRAHY y J. Y. SPIRES Bull. Mar. Sci., Sound production, schooling and feeding habits of the margate, Haemulon album Cuvier, off north Bimini, Bahamas.1966.626-640.16 (3) DAHL, G., Los Peces del Norte de Colombia.INDERENABogotá1972. 391 p. FISCHER, W. FAO Species Identification Sheets for Fishery Purposes. Western Central Atlantic (fishing area 31). FISCHER, W. (Ed.) FAORome1978.1-7. GALLAWAY, B. J., J. C. PARKER y D. MOORE Key to the Estuarine and Marine Fishes of Texas.Department of Wild life and Fisheries Sciences. Texas A & M University1972.1-162. GIERLOFF-EMDEM, H. G.,In: Orbital Remote Sensing of Coastal and Offshore Environments: A Manual of Interpretation.Laguna de Términos and Campeche Bay, Gulf of México.Berlin: 1977.78-89. GINSBURG, I.,Zoológica The species of Bathystoma (Pisces: Haemulonidae).(N.Y.)1948. 151-156. 33(3) GUITART, J. D., Sinopsis de los Peces Marinos de Cuba. Academia de Ciencias de Cuba 1977.325-608.3 GUNTER, G., Pub. Inst. Alar. Sci. Univ. Texas Studies on maríne fishes of Texas.1945.1-190.1 (1) HILDEBRAND, H. H.,Ciencia Mex., Estudios biológicos preliminares sobre la Laguna Madre de Tamaulipas.1958.151-173.17 (7-9) - Lagunas Costeras, un Simposio. Laguna Madre, Tamaulipas: Observations in the hydrography and fisheries. In: Ayala-Castañares, A. y F. B. Phleger (Eds.). Mem. Simp. Intern. Lagunas Costeras, UNAM.UNESCO1969.679-686. Nov. 28-30, 1967 HILDEBRAND, S. F. y L. E. CABLEBull. U.S. Bureau Fish., Development and life history of fourteen teleostean fishes of Beaufort.1930.383-499.46 HOESE, H. D. y R. S. JONESPubl. Inst. Mar. Sci. Univ. Texas Seasonality of larger animals in a Texas turtle grass community.1963.37-47.9 HOESE, H. D. y R. H. MOORE Fishes of the Gulf of Mexico. Texas, Louisiana and Adjacent Waters. Texas A & M University Press. College Station and London, first edition.1977.196-198. JORDAN, D. S. y B. W. EVERMANNBull. U.S. Nat. Mus.,The fishes of North and Middle America.1896-1900.1-3313, 398 lám., 958 figs.1-4(47) JORDAN, E., M. ANGOT y R. DE LA TORRE An. Centro Cienc. del Mar y Limnol. Univ. Nal. Autón. México Prospección biológica de la Laguna de Nichupté, Cancún, Q. Roo: Nota Científica.1978.179-188.5 (1) LONGLEY, W. H. y S. F. HILDEBRAND Pap. Tortugas Lab., Carnegie Inst. Wash. Publ., Systematic catalogue of the fishes of tortugas, Florida with observations on color, habits, and local distribution.1974.1-331.34 MANOOCH, III., C. S.,Nat. Mar. Fish. Serv. Atlantic Estuar. Fish. Cent.:Age, growth and mortality of the white grunt, Haemulon plumieri Lacépéde (Pisces: Pomadasyidae), from North Carolina and South Carolina. 1978.58-70. McHUGH, J. L., A Symposium on Estuarine Fisheries, Amer. Fish. Soc. Spec. Publ.,Management of estuarine fisheries. In: Smith, R. F., A. H. Swartz y W. G. Mass Mann (Eds.).1966.133-154.3 ---, Estuaries, Amer. Ass. Adv. Sci. Publ. Spec., Estuarine nekton: In: Lauff, G. H. (Ed.) 1967.581-619.83 McLEAN, R. y W. F. HERRKINDCopeia Compact schooling during mass movement by grunts.1971.328-330.2 MEEK, E. S. y S. F. HILDEBRANDField Mus. Nat. Hist. Publ., Zool. Ser., The marine fishes of Panama.1923-1928.1-1045.15 (215, 226 y 249): MOTCHEK D. A. y A. F. SILVASerie Oceanológica. Conducta Social del Género Haemulon. La Habana Cuba 1975.1-10.(27) PAGAN, F. A. y H. M. AUSTINCaribb. J. Sci., Report an a fish kill at Laguna joyuda, western Puerto Rico in the summer1967.177-193.10(3-4) PERRY, II, J. A. y S. D. PERRYLos Peces Comunes de la Costa Atlántica de Costa Rica.Universidad de Costa Rica, Fac. de Ciencias y Letras. Depto. de Biol. Ser. Cienc. Nat.1974.1-224.(7) PHLEGER, F. B. y A. AYALA-CASTAÑARES Bull. Am. Ass. Petrol. Geol., Processes and history of Terminos LagoonMéxico1971.2130-2140.55 (2) OGDEN, J. A. y P. R. EHRLICHMar. Biol., The behaviour of heterotypic resting schools of juveniles grunts. (Pomadasyidae).1977.273-280.42 RANDALL, J. E., Stud. Trop. Oceanogr., Univ. MiamiFood habits of reef fishes of the West Indies.1967.665-847.5 ---, Caribbean Reef Fishes. T. F. H. Publ. jersey CityNew Jersey1968. 318 p. REID, G. K., Bull. Mar. Sci. Gulf Caribb., An ecological study of the Gulf of Mexico fishes in the vicinity of Cedar Key, Florida.1954.1-94.4(1) ---, Texas J. Sci., A summer study of the biology and ecology of East Bay Texas.1955.316-343. 7(3) RESÉNDEZ, A.,An. Inst. Biol. Univ. Nal. Autón. México, Ser. Cienc. del Mar y Limnol., Peces colectados en el arrecife la Blanquilla, Veracruz, México.1971.7-30.42 (1) ---, Revta. Soc. Méx. Hist. Nat., Estudio de los peces de la laguna de Alvarado, Veracruz, México1973.183-281.34 ---, An. Inst. Biol. Univ. Nal. Autón. México, Ser. Zool., Lista preliminar de peces colectados en las lagunas de Nichupté y Bojórquez, Cancún, Q. Roo, México.1975.87-100.46(1) SAKSENA, V. P. y W. J. RICHARDSBull. Mar. Sci., Description of eggs and larvae of laboratory reared white grunt, Haemulon plumieri (Lacépéde) (Písces: Pomadasyidae). 1975.523-536.25(4) SÁNCHEZ GIL, P. A., YÁÑEZ-ARANCIBIA y F. AMEZCUA-LINARES An. Inst. Cienc. del Mar y Limnol. Univ. Nal. Autón. MéxicoDiversidad, distribución y abundancia de las especies y poblaciones de peces demersales de la Sonda de Campeche. (Verano, 1978).1981.209-240.8(1) S.I.C., Catálogo de Peces Marinos Mexicanos.Secretaría de Industria y Comercio, Subsecretaría de Pesca, Instituto Nacional de PescaMéxico1976. 462 p., 504 figs. SIMMONS, E. G., Publ. Inst. Mar. Sci. Univ. TexasEcological survey of the upper Laguna Madre of Texas.1957.156-200.4 (2) SMITH, G. B., Dept. Nat. Res., Mar. Res. Lab. Publ.,Ecology and distribution of eastern Gulf of Mexico reef fishes.1976.1-78.19 Amer. Fish. Soc. Spec. Publ., A Symposium on Estuarine Fisheries. SMITH R. F., A. H. SWARTZ y W. G. MASSMANN (Eds.)19661-1543 SPRINGER, S. y H. R. BULLISU.S. Fish Wildl. Ser., Spec. Sci. Rept.,Collections by the "Oregon" in the Gulf of Mexico.1956.1-134.196 SPRINGER, V. G. y A. J. Mc ERLEAN Bull. Mar. Sci. Gulf Caribb.,Seasonality of fishes on a south Florida shore.1962.39-60.12 (1) SPRINGER, V. G. y K. D. WOODBURNFla. St. Bd. Conserv. Mar. Lab., Prof. Pap., An ecological study of the fishes of the Tampa Bay area.1960.1-104.1 STUARDO, J., A. MARTÍNEZ, A. YÁÑEZ-ARANCIBIA, J. A. WEINBORN Y J. RUIZ Informe Final la. Etapa Programa Uso de la Zona Costera de Michoacán y Guerrero. Convenio Comisión del Río Balsas, S.R.H. y Centro Cienc. del Mar y Limnol. Univ. Nal. Autón. México. Contrato de Estudios No. OC-E-03-73Prospección de los recursos biológicos y pesqueros del sistema lagunar costero de Guerrero y, en parte, del litoral rocoso de Michoacán, México.1974. 500 p. SUBRAHMANYAM, C. B. y S. H. DRAKE Bull. Mar. Sci., Studies on the animal communities in two north Florida salt marshes. Part 1: Fish communities.1975.445-465.25 (4) TABB, D. C., D. L. DUBREW y R. B. MANNING Tech. Ser. Fla. St. Bd. Conserv., The ecology of northern Florida Bay and adjacent estuaries.1962.1-79.39 VANNUCCI, M., Lagunas Costeras un Simposio.What is known about production potential of coastal lagoon. In: Ayala-Castañares, A. y F. B. Phleger (Eds.). Mem. Simp. Intern. Lagunas Costeras. UNAM UNESCO1969.457-478.Nov. 28-30, 1967 VARGAS MALDONADO, L, A. YÁÑEZ-ARANCIBIA y F. AMEZCUA-LINARES An. Inst. Cienc. del Mar y Limnol. Univ. Nal. Autón. MéxicoEcología y estructura de las comunidades de peces en áreas de Rhizophora mangle y Thalassia testudinum de la Isla del Carmen, Laguna de Términos, Sur del Golfo de México.1981.241-266.8 (1) YÁÑEZ-ARANCIBIA, A., An. Centro Cienc. del Mar y Limnol. Univ. Nal. Autón. México Sobre los estudios de peces en las lagunas costeras: Nota Científica.1975.53-60.2(1) ---, Centro Cienc. del Mar y Limnol. Univ. Nal. Autón. México, Publ. Esp. Taxonomía, ecología y estructura de las comunidades de peces en lagunas costeras con bocas efímeras del Pacífico de México.1978.1-306.2 - Tech. Pap. Mar. Sci., Ecological studies in Puerto Rico inlet, Laguna de Terminos, Mexico: Discussion on the Trophic Structure of Fish Communities on Thalassia testudinum Banks. Proc. Sem. Duke Univ. Mar. Lab. Beaufort NC, USA, (UNESCO-IABO). UNESCO1981.191-232.33 Aug. 1978 YÁÑEZ-ARANCIBIA, A. y R. S. NUGENT An. Inst. Cienc. del Mar y Limnol. Univ. Nal. Autón. MéxicoEl papel ecológico de los peces en estuarios y lagunas costeras.1977.107-114.4 (1) YÁÑEZ-ARANCIBIA, A y J. W. DAY, JR., Oceanologica Acta (en prensa).Ecological characterization of Terminos Lagoon a tropical lagoon-estuarine system in the Southern Gulf of Mexico. Proc. International Symposiura on Coastal Lagoons, ISCOL-UNESCO '81. BordeauxFrance1982.sept. 7-14, 1981. YÁÑEZ-ARANCIBIA, A., F. AMEZCUA-LINARES Y J. W. DAY Estuarine Perspectives.Fish community structure and function in Terminos Lagoon, a tropical estuary in the Southern Gulf of Mexico. In: Kennedy, V. (Ed.). Academic Press Inc.,New York1980a.465-482. YÁÑEZ-ARANCIBIA, A., F. AMEZCUA-LINARES, J. L. ROJAS GALAVIZ P. SÁNCHEZ GIL, I. VARGAS MALDONADO, A. L. LARA DOMÍNGUEZ, S. DÍAZ Ruiz, A. AGUIRRE LEÓN y L. MALLARD COLMENEROIn: Proyecto de Investigación "Análisis Comparativo de las Poblaciones de Peces de la Sonda de Campeche y la Laguna de Términos antes y después del Derrame Petrolero del Pozo IXTOC-I".(Mimeogr.)Evaluación de las poblaciones de peces de importancia comercial antes del derrame petrolero del Pozo IXTOC-I.PCEESC/UNAM/ CCML (PI)1980b.57 p., 15 tablas, 25 figs. YÁÑEZ-ARANCIBIA, A., F. AMEZCUA-LINARES, J. L. ROJAS GALAVIZ, A. L. LARA DOMÍNGUEZ, P. SÁNCHEZ GIL, I. VARGAS MALDONADO, A. AGUIRRE LEÓN, S., DÍAZ Ruiz, M. ÁLVAREZ RUBIO, H. ÁLVAREZ GUILLÉN Y M. TAPIA GARCÍAIn: Proyecto de Investigación "Análisis Comparativo de las Poblaciones de Peces de la Sonda de Campeche y de la Laguna de Términos antes y después del Derrame Petrolero del Pozo IXTOC-I.(mimeogr.).Análisis preliminar de las poblaciones de peces de la Laguna de Términos y Sonda de Campeche durante las campanas de febrero a agosto de 1980. PCEE SC/UNAM/CCML, (SI)1980c.26 p., 6 tablas, 7 figs.
|

