|
TAXONOMÍA,
DIVERSIDAD, DISTRIBUCIÓN Y ABUNDANCIA DE LAS MOJARRAS DE LA LAGUNA DE
TÉRMINOS, CAMPECHE (PISCES: GERRIDAE)
Trabajo recibido el 15 de
enero de 1981 y aceptado para su publicación el 4 de mayo de
1981.
ARTURO AGUIRRE LEÓN
Universidad Nacional Autónoma de
México, Instituto de Ciencias del Mar y Limnología, Laboratorio
de Ictiología y Ecología Estuarina. Contribución 282 del
Instituto de Ciencias del Mar y Limnología,
UNAM.
ALEJANDRO YÁÑEZ-ARANCIBIA
Universidad Nacional
Autónoma de México, Instituto de Ciencias del Mar y
Limnología, Laboratorio de Ictiología y Ecología
Estuarina. Contribución 282 del Instituto de Ciencias del Mar y
Limnología, UNAM.
FELIPE AMEZCUA LINARES
Universidad Nacional Autónoma de
México, Instituto de Ciencias del Mar y Limnología, Laboratorio
de Ictiología y Ecología Estuarina. Contribución 282 del
Instituto de Ciencias del Mar y Limnología, UNAM.
Se analizaron 4741 individuos de la familia Gerridae de la Laguna de
Términos, obtenidos en 173 colectas con una red de arrastre, desde julio
de 1976 hasta marzo de 1979. Ocho especies de esta familia existen en el
área, i.e., Gerres cinereus, Eucinostomus gula, Eucinostomus
argenteus, Eucinostomus melanopterus, Diapterus rhombeus, Diapterus evermanni,
Diapterus olisthostomus y Eugerres plumieri. Eucinostomus gula
comprende el 82.9% de la captura total.
Todas
estas especies se distribuyen en los subsistemas ecológicos del interior
de la Isla del Carmen en áreas protegidas de Rhizophora
mangle yThalassia testudinum, en el sistema
oligohalino de la cuenca central de la laguna y en los sistemas
Fluvio-Lagunares asociados con arrecifes deCrassostrea
virginica. Son componentes típicos de la estructura de las
comunidades de peces de la laguna.
Se entrega una diagnosis
taxonómica para la familia, clave artificial para determinar
géneros y especies, y se hace una revisión taxonómica de
las mismas proponiendo diagnosis con la información de rangos
merísticos y morfométricos ampliados, coloración y
comparación taxonómica con especies simpátricas
afines.
Se discute la distribución, abundancia y
frecuencia de las especies. Se encuentra que los patrones ecológicos que
rigen a las poblaciones son en mayor medida, la época del año y
la localidad dentro del sistema lagunar-estuarino. Las especies mejor
representadas en abundancia numérica fueron en orden de
importancia:Eucinostomus gula, Diapterus rhombeus, Eucinostomus
argenteus y Eugerres plumieri. Además las
dos primeras son típicas por biomasa y frecuencia. Cuatro especies se
consideran visitantes ocasionales de la laguna: Gerres cinereus,
Eucinostomus melanopterus, Diapterus evermanni y Diapterus olisthostomus.
Eucinostomus argenteus, Diapterus rhombeus y Eugerres plumieri,
utilizan el estuario como área de crianza y/o alimentación.
Y,Eucinostomus gula es un residente permanente del
área.
ABSTRACT
An analysis was made of 4741 specimens of the Gerridae family
obtained from the Terminos Lagoon with a drift-net in 173 collections between
July, 1976, and March, 1979. Eight species of this family are found in the
area, i.e., Gerres cinereus, Eucinostomus gula, Eucinostomus
argenteus, Eucinostomus melanopterus, Diapterus rhombeus, Diapterus evermanni,
Diapterus olisthostomus and Eugerres plumieri. Eucinostomus gula
comprises 82.9 per cent of the total catch.
All of these
species are found in the inland ecological subsystems of Carmen Island, in
protected areas ofRhizophora mangle and Thalassia
testudinum, in the oligohaline system of the central basin of the
lagoon and in the fluvial-lagoon systems associated with Crassostrea
virginica reefs. They are typical members of the lagoon fish
community.
This paper presents a taxonomic diagnosis of the
family and an artificial key for the determination of genus and species. It
provides a taxonomic review of these species based on new meristic and
morphometric information, coloration data and taxonomic comparison with similar
sympatric species.
Species distribution, abundance and
frequency are discussed. Results indicate that the ecological patterns which
control populations are predominantly the time of year and the locality within
the lagunar-estuarine system. The best represented species in terms of
numerical abundance were shown to be, in orden of
importance:Eucinostomus gula, Diapterus rhombeus, Eucinostomus
argenteus and Eugerres plumieri. The first two are
typical in terms of biomass and frequency. Four species are considered to be
occasional visitors of the lagoon: Gerres cinereus, Eucinostomus
melanopterus, Diapterus evermanni and Diapterus
olisthostomus. Eucinostomus argenteus, Diapterus
rhombeusandEugerres plumieri use the estuary as a
nursery and/or feeding area. Eucinostomus gula is a
permanent resident of the area.
Los estudios ictiológicos en ambientes lagunares y/o estuarinos representan un tópico esencial para el entendimiento de la complejidad ambiental de estos ecosistemas. Debe por tanto, recalcarse que las lagunas costeras en su mayoría, presentan un potencial íctico de considerable magnitud (Yáñez-Arancibia, 1975a y Yáñez-Arancibia y Nugent, 1977). Necesariamente, la compresión de la dinámica ambiental de un ecosistema y de sus poblaciones de peces como recurso, involucran un conocimiento taxonómico profundo de las especies, así como de su ecología y biología. Obtener esta información es básico para evaluar y proponer un correcto uso y administración de aquellas especies de peces que actualmente se explotan y también para discutir las que representan un recurso económico potencial. Uno de estos recursos son las mojarras de la familia Gerridae de particular abundancia con importancia comercial y amplia distribución en el medio ambiente lagunar-estuarino de cualquier latitud tropical y subtropical y por lo tanto muy significativo en las lagunas costeras de México (Yáñez-Arancibia, 1978; Bravo-Núñez y Yáñez-Arancibia 1979; Yáñez-Arancibia et al. 1979; Amezcua-Linares y Yáñez-Arancibia 1980; Yáñez-Arancibia et al. 1980a y Vargas Maldonado et al. 1981). Por esta importancia el Laboratorio de Ictiología y Ecología Estuarina del Instituto de Ciencias del Mar y Limnología de la Universidad Nacional Autónoma de México, ha realizado durante varios años estudios específicos sobre esta familia en la Laguna de Términos, Campeche, como parte integral de un análisis multidisciplinario sobre sistemas y estructura de comunidades de peces con énfasis en los de interés comercial. Dentro de este enfoque, el presente estudio permite establecer un marco de referencia para investigaciones futuras sobre ecología de recursos pesqueros e impacto ambiental causado por el hombre por las propias actividades de pesca o por el avance en el desarrollo urbano e industrial. El Instituto de Ciencias del Mar y Limnología de la Universidad Nacional Autónoma de México y su Estación de Investigaciones Marinas "El Carmen", Campeche, junto con la Organización de los Estados Americanos (OEA) a través de su Programa Regional de Desarrollo Científico y Tecnológico auspiciaron económica e institucionalmente el presente trabajo. Esta investigación forma parte a su vez del Programa denominado "Recursos Bióticos en Lagunas Costeras, Manglares y Áreas Adyacentes de América Latina" (Proyectos Piloto Comparativos en el Golfo de Nicoya, Costa Rica, Bahía de Puerto Viejo, Azua, República Dominicana y Laguna de Términos, Campeche, México). OBJETIVOSEl planteamiento de la introducción y los antecedentes presentados permiten visualizar la necesidad de efectuar estudios específicos sobre las especies de la familia Gerridae, por ello se ha planteado el presente trabajo con los siguientes objetivos: 1. Realizar una revisión taxonómica de las mojarras de la Laguna de Términos. 2. Preparar una diagnosis para la familia y especies, clave artificial para su identificación, estructurando un catálogo descriptivo e ilustrativo. 3. Caracterizar la distribución de las especies en el área de la Laguna y los posibles patrones de ella. 4. Analizar la abundancia y frecuencia para las especies de acuerdo a los periodos climáticos definidos para el área. ANTECEDENTESSe ha señalado con anterioridad que las mojarras de la familia Gerridae constituyen un recurso importante dentro de la explotación comercial de peces. Destacándose también que algunas de sus especies son susceptibles de un aprovechamiento integral por presentar características apropiadas tales como su tamaño, frecuencia, abundancia y biología relacionada con ecosistemas lagunares y/o estuarinos (Yáñez-Arancibia, 1975a, 1977, 1978 y Yáñez-Arancibia et al. 1980b). Sin embargo, sobre esta familia existe muy poca investigación orientada hacia el estudio de su diversidad, distribución y abundancia. Por lo mismo se desconocen también caracteres taxonómicos, biológicos y ecológicos de aquellas especies que tienen importancia económica y/o ecológica en particular. Dicha familia, careció hasta hace algunos años de tal atención. Tal situación se ha reflejada en la limitada literatura que existe en particular sobre la familia. Entre los trabajos de índole taxonómica que se refieren a los gérridos, destacan principalmente los de: Jordan y Evermann (1896), Meek e Hildebrand (1925), Curran (1942), Darnell (1962), Cervigon (1966), Zahuranec (1967), Randall (1968), Bohlke y Chaplin (1970,) Reséndez (1970 y 1973), Dahl (1971), Gallaway et al. (1972), Amezcua-Linares (1972), Perry y Perry (1974), Hoese y Moore (1977) Guitart (1977) Fischer (1978) Yáñez-Arancibia (1978) y Castro Aguirre (1978). Estos trabajos incluyen además algunos datos acerca de su distribución, abundancia e importancia económica de las especies. Sobre la ecología de algunas especies y otras afines en ambientes lagunares estuarinos y costeros principalmente del Golfo de México y Mar Caribe se cuentan los de: Smith (1907), Beebe y Tec-Van (1928), Curran (1942), Herald y Strickland (1949), Hildebrand (1954, 1955 y 1958), Reid (1954 y 1955), Kilby (1955), Springer y Bullis (1956), Springer y Woodburn (1960), Boschung (1957a y 1957b), Zarur (1962), Darnell (1962), Springer y Mc Erlean (1962), Walker y Nelson (1964), Cervigon (1966), Randall (1968), Reséndez (1970, 1973 y 1975), W. E. Odum (1971) Swingle (1971), Chávez (1972), Odum y Heald (1972 y 1975), Carr y Adams (1973), Dayet al. (1973), Cerame-Vivas (1974), Heald et al. (1974), Brook (1975 y 1977), Subrahmanyan y Drake (1975), Chávez et al. (1976), Castro-Aguirre (1978) y Jordanet al. (1978). Finalmente, aquellos estudios específicos que versan sobre diferentes tópicos de la ecología y biología de ictiocomunidades en ambientes lagunares, estuarinos y costeros del Sur del Golfo de México y costa del Pacífico, están los de: Yáñez-Arancibia (1975a, 1977, 1978), Amezcua-Linares (1977), Bravo-Núñez y Yáñez-Arancibia (1979), Yáñez-Arancibia y Day (1982), Flores Coto y Álvarez Cadena (1980), Amezcua-Linares y Yáñez-Arancibia (1980) Yáñez-Arancibia et al. (1980a), Yáñez-Arancibia et al. (1980b), Vargas Maldonado et al. (1981), Sánchez Gilet al. (1981). Es importante destacar que en conjunto todos estos trabajos registran un total de 11 especies de mojarras para el Golfo de México, de las cuales 8 están presentes en la Laguna de Términos, y al menos 4 de ellas tienen interés económico. Asimismo en el Pacífico existen 7 especies y solo 4 son aprovechadas comercialmente. Debe señalarse que, de toda la literatura aquí analizada sólo los trabajos de Curran (1942) y Zahuranec (1967), el primero del Atlántico y el segundo del Pacífico se refieren a problemas taxonómicos particulares sobre el género Eucinostomus. De la misma manera estudios específicos en relación a estructura de comunidades y relaciones ecológicas de algunos gérridos se discuten sólo en los trabajos del Sur del Golfo de México y Pacífico. ÁREA DE ESTUDIOLa Laguna de Términos (Fig. 1), en el Sur del Golfo de México, es un excelente sitio para estudiar integración de procesos físicos y biológicos. No existen cambios estacionales fuertes de temperatura o luz, y el área tiene marcados gradientes físicos semipermanentes y alta diversidad de habitats estuarinos. Los vientos prevalecientes causan un flujo neto hacia dentro en la boca este (Boca de Puerto Real) y un flujo neto hacia afuera por la boca oeste (Boca del Carmen), el cual crea alta salinidad y condiciones de aguas claras en el sector oriental de la laguna. La mayor descarga de los ríos se da dentro de la parte oeste de la laguna, creando turbidez, y aguas ricas en nutrientes con baja salinidad. Un delta interior se forma en la laguna en la boca este. La mayoría de los procesos están fuertemente influenciados por estos gradientes. Extensas praderas de pastos marinos se presentan en la parte norte y oriental de la laguna, existiendo sucesión de pastos a bosques de manglar en esa área. Extensas áreas de arrecifes de ostión se localizan en la parte oeste y sur de la laguna, cerca de las bocas de los ríos. La producción de fitoplancton, niveles de clorofila y defoliación de manglares es mayor en las áreas de influencia fluvial. Las larvas y juveniles del necton ingresan a la laguna a través de la boca del este, reflejando las corrientes prevalecientes. La máxima descarga de los ríos es en octubre, durante la cual se alcanza la más alta productividad primaria y ocurre la entrada de juveniles a la laguna. Se presentan tres periodos climáticos meteorológicos, lluvias de junio a octubre, nortes de noviembre a febrero y secas de febrero a mayo. 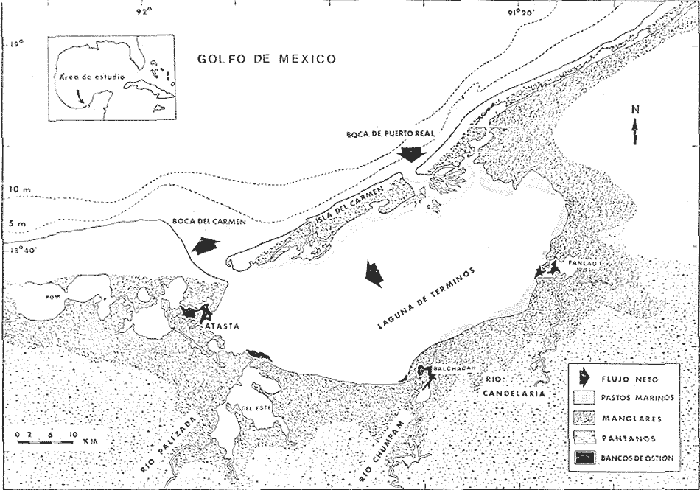 Fig. 1. Localización de la Laguna de Términos Campeche. Se señalan los rasgos geográficos y toponimicos principales y la distribución de los diferentes habitat ecológicos del sistema. Se destaca la dirección del flujo neto de las aguas y la zona de pastos marinos que indican áreas de mayor influencia marina. Se muestran los cuatro sistemas Fluvio-Lagunares principales asociados a la Laguna. (Tomada de Yáñez-Arancibia et al. 1980c). Amplios detalles de esta síntesis pueden encontrarse en los trabajos de Phleger y Ayala-Castañares (1971), Gierloff-Emden (1977), Yáñez-Arancibia y Day (1982), Bravo-Núñez y Yáñez-Arancibia (1979), Amezcua Linares y Yáñez-Arancibia (1980) y Vargas Maldonado et al. (1981). MATERIAL Y MÉTODOS
ACTIVIDADES DE CAMPOLas capturas de peces se efectuaron desde el mes de julio de 1976 a marzo de 1979 de acuerdo al siguiente esquema: – Capturas en los meses de julio a diciembre de 1976. – Capturas en los meses de enero, marzo, mayo, agosto, septiembre y octubre de 1977. – Capturas en los meses de enero, febrero, abril, junio, agosto y octubre de 1978. – Capturas del mes de marzo de 1979. La disposición de las estaciones de colecta, fue de tal forma que se caracterizaran áreas contrastantes de la Laguna de Términos, esto es, ambientes dulceacuícolas y de baja salinidad y ambientes marinos (Fig. 2). Todas las capturas fueron diurnas, en profundidades que no excedieron los cuatro metros. Se empleó una embarcación de fibra de vidrio de 7 m de eslora, equipada con un motor fuera de borda de 40 HP, el arte de pesca fue una red de prueba camaronera (chango) de 10 m de largo y 9 m de boca (abertura de trabajo de 5 m), puertas de 0.8 por 0.5 m y luz de malla de 3/4 de pulgada. Los arrastres fueron de 15 a 30 min de duración. 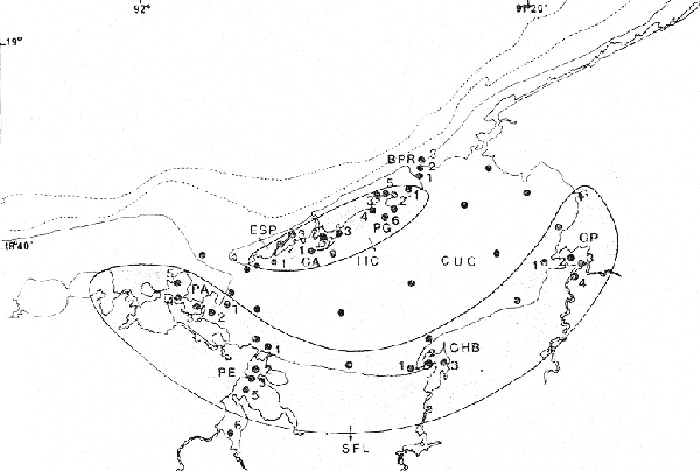 Fig. 2. Área de estudio. Localización de las zonas de muestreo. IIC = Interior de la Isla del Carmen. SFL = Sistemas Fluvio-Lagunares. CUC = Cuenca Central, En cada estación se efectuaron mediciones de: temperatura, salinidad, oxígeno, profundidad y transparencia. También se realizaron observaciones de: tipo de sustrato, vegetación sumergida y circundante, macrofauna béntica, mareas y datos climáticos. El material colectado se fijó en formalina al 10% neutralizada con borato de sodio. A los ejemplares capturados se les realizó una incisión ventral para la fijación de los órganos internos. Todo el material debidamente etiquetado y envasado fue trasladado al laboratorio para su análisis. MATERIAL DE ESTUDIODe los 22 cruceros realizados (173 colectas), se obtuvieron un total de 4741 ejemplares, correspondientes a 8 especies de gérridos, distribuidas como se muestra en la tabla 1. Mensualmente de febrero a diciembre de 1980 se obtuvo una colección aún no cuantificada que proporcionó información para la distribución de las especies en la Cuenca Central de la laguna. ACTIVIDADES DE LABORATORIOLos ejemplares fueron lavados, separados, reetiquetados y envasados en frascos de vidrio con alcohol metílico al 70%. La posición taxonómica de las especies fue determinada por los métodos convencionales y el empleo de literatura básica, principalmente los trabajos de: Jordan y Evermann (1896-1900) Meek e Hildebrand (1923-1928), Cervigon (1966), Randall (1968), Bohlke y Chaplin (1970), Reséndez (1970 y 1973), Dahl (1971), Gallawayet al. (1972), Perry y Perry (1974), Hoese y Moore (1977), Guitart (1977) y Fischer (1978). Las mediciones de longitud fueron hechas con un ictiómetro convencional de 50 cm y las de peso sobre material fijado, en una balanza Ohaus Triple Beam de 0. 1 g de precisión y 2,610 g de capacidad. ABUNDANCIALa abundancia fue estimada de acuerdo a: a. Abundancia numérica b. Biomasa (g peso húmedo m-²) La densidad y la biomasa se analizan para cada una de las estaciones de colecta durante las épocas de lluvias y secas. COMPONENTES COMUNITARIOSLas comunidades ictiofaunísticas están integradas por diversos componentes, los cuales se determinan en relación a su origen, frecuencia de aparición, desarrollo gonádico, hábitos alimenticios y tamaño. Las especies con frecuencia de 1-30% se consideranvisitantes ocasionales o accidentales. Aquellas con 31-70% de frecuencia, visitantes cíclicos o estacionales. Y con una frecuencia de 71-100% comoresidentes o típicamente estuarinas. 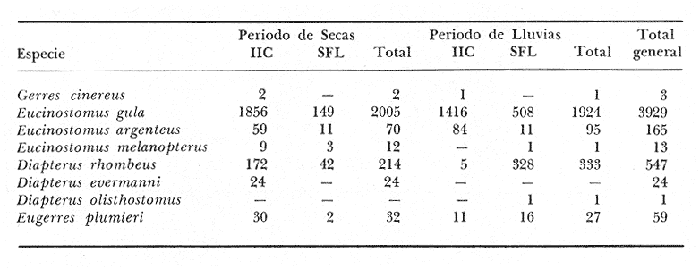 TABLA 1 RELACIÓN DEL NÙMERO DE EJEMPLARES CAPTURADOS, POR ESPECIE, ÉPOCA CLIMÁTICA Y LOCALIDAD Estos componentes se ven reforzados con el criterio ecológico siguiente: las especies residentes permanentes se encuentran todo el tiempo en la laguna, pueden crecer, madurar y reproducirse dentro de la propia laguna. Los visitantes estacionales usan la laguna bajo un patrón regular, dependiendo éste de algunas etapas de sus ciclos de vida; en este grupo son comunes aquellas especies que desovan en el mar e ingresan a la laguna como juveniles por cierto tiempo y regresan al mar como preadultos y adultos. Finalmente los visitantes ocasionales no utilizan la laguna bajo un patrón definido, a pesar de ello, pueden entrar a ella solo para protegerse y/o alimentarse (Yáñez-Arancibia et al. 1980a). Los muestreos temporales, como el de este estudio, permiten detectar la frecuencia de utilización de la laguna y como en áreas tropicales los cielos de vida son cortos, la madurez se alcanza entre 6 y 10 meses, por lo cual el rango considerado de frecuencia de utilización debe tener una estrecha relación con la edad de la población. ABREVIATURAS UTILIZADAS EN TABLAS Y GRÁFICASBPR = Boca de Puerto Real CA = Bajos del Cayo CHB = Sistema Chumpan-Balchacali CP = Sistema Candelaria-Panlau CUC = Cuenca Central ESP = Estero Pargo IIC = Interior de la Isla del Carmen MNG = Puntilla Manigua PA = Sistema Pom-Atasta PE = Sistema Palizada del Este PG = Punta Gorda PJ = Punta San Julián SFL = Sistemas Fluvio-Lagunares LP = Longitud Patrón LT = Longitud Total RESULTADOS
FAMILIA GERRIDAE CUVIER
"Mojarras"Cuerpo elongado o romboidal de profundidad variable, moderadamente comprimido, cubierto de escamas grandes ctenoides. Línea lateral continua generalmente concurrente con el dorso, terminando en la base de la aleta caudal. Rostro puntiagudo o ligeramente romo, boca extremadamente protáctil, descendente cuando está extendida; los procesos o apéndices de los premaxilares se extienden por encima de los ojos cerrando un profundo surco en la parte superior de la cabeza; perfil inferior de la cabeza cóncavo. Cabeza casi toda escamada; maxilar sin hueso suplementario; base de la mandíbula escamosa. Mandíbulas delgadas, dientes villiformes, sin incisivos ni molares, sin dientes sobre el vomer y palatinos. Pseudobranquias ocultas, membranas branquiales separadas, libres del itsmo, 6 radios branquiostegos. Branquiespinas cortas y delgadas. Nostrilos dobles. Aleta dorsal simple, continua o profundamente hendida, porciones espinosa y blanda igualmente desarrolladas, generalmente con 9 espinas y 10 radios. Aleta anal simple, 2 o 3 espinas y 7 a 10 radios. Tanto la dorsal como la anal se pliegan dentro de una vaina escamosa a lo largo de su base formando una especie de surco. Aletas pectorales grandes y puntiagudas; pélvicas moderadas, con 1 espina y 5 radios, con procesos axilares, su origen, ligeramente posterior a las pectorales. Aleta caudal profundamente ahorquillada. Vejiga gaseosa presente; ciego pilórico rudimentario. Vértebras 24 (10 + 14). Las especies pertenecientes a esta familia presentan la cabeza y el cuerpo plateados con escamas brillantes, generalmente con reflejos en el dorso que van de azul a verde o la combinación de los dos. Algunas especies exhiben barras verticales o longitudinales en los costados del cuerpo. El hocico a menudo es negruzco. Tanto las aletas pares como impares presentan puntuaciones oscuras y coloraciones que van desde diversos tonos de amarillo hasta casi oscuras o incoloras. El número de géneros aceptados hasta la fecha, varia según los autores, pero generalmente se aceptan entre cuatro y seis. Las especies que se agrupan en esta familia probablemente lleguen a cuarenta. En el Golfo de México se encuentran presentes 5 géneros y 11 especies, las cuales son:Ulaema lefroyi (Goode, 1874),Eucinostomus gula (Cuvier, 1830), Eucinostomus argenteus Baird y Girard, 1854, Eucinostomus melanopterus (Bleecker, 1863),Diapterus rhombeus(Cuvier, 1829), Diapterus evermanni Meek e Hildebrand 1925,Diapterus olisthostomus (Goode y Bean, 1882),Eugerres plumieri (Cuvier, 1830), Eugerres mexicanus(Steindachner 1863), Eugerres brasilianus (Cuvier 1830) yGerres cinereus(Walbaum. 1927). Castro-Aguirre (1978), ha señalado que existe una 1291 especie en el Golfo, se trata deEucinostomus havana(Nichols, 1912), sin embargo, no se incluye en la lista anterior por considerarse muy dudosa su presencia en aguas del Golfo de México. Esta última especie ha sido reportada únicamente para aguas de Cuba (Meek e Hildebrand 1925, Curran 1942, Bohlke y Chaplin 1970, Guitart 1977, Castro-Aguirre 1978, Fischer, 1978). Estos peces son típicos de mares tropicales y subtropicales principalmente de América. Habitan aguas costeras y someras con fondos arenosos y fangosos, penetran a lagunas, estuarios y ambientes de manglar. Se les puede encontrar también en comunidades coralinas. CLAVE ARTIFICIAL PARA DETERMINAR ESPECIES DE LA FAMILIA GERRIDAE PRESENTES EN LAGUNA DE TÉRMINOS1. Cuerpo alargado o elipsoidal; moderadamente profundo; el maxilar llega a el margen anterior de la pupila; preopérculo entero. De 6 a 8 branquiespinas bajo el primer arco........................................ 2 1' Cuerpo corto profundo y romboidal; el maxilar sobrepasa el margen anterior de la pupila; preopérculo aserrado. De 10 a 18 branquiespinas bajo el primer arco...............................................5 2. Sin barras verticales definidas sobre los costados. Excepcionalmente, los juveniles pueden presentar algunas barras oscuras de forma y número variable.............................................. 3 2' Con 7 u 8 barras verticales azuladas siempre presentes en los adultos. Surco premaxilar ancho, oval y libre de escamas, segunda espina anal muy fuerte.............................................. Gerres cinereus (Walbaum) 3. Cuerpo elíptico; profundidad menos de 2.6 veces en la LP; surco premaxilar ancho y escamado en su parte posterior................Eucinostomus gula(Cuvier) 3' Cuerpo alargado; profundidad más de 2.6 veces en la LP; surco premaxilar estrecho y libre de escamas.......... 4 4. Siete branquiespinas en la rama inferior del primer arco; dorsal espinosa con una porción parda en su extremo distal. Ojos no muy grandes, 2.0 a 3.4 en la cabeza...................................Eucinostomus argenteus Baird y Girard 4' Ocho branquiespinas en la rama inferior del primer arco; dorsal espinosa con una franja negra bien definida en su extremo distal. Ojos moderadamente grandes, 2.5 a 3.3 en la longitud cefálica .............................. Eucinostomus melanopterus(Bleeker) 5. Preorbital aserrado (entero en juveniles de menos de 90 mm de LT). Con 12 estrías longitudinales oscuras sobre los costados que siguen las hileras de las escamas, no muy evidentes en ejemplares juveniles. Segunda espina dorsal fuerte y más alta que la tercera. Anal II-II, 7-9....................Eugerres plumieri(Cuvier) 5' Preorbital entero. Sin estrías longitudinales. Segunda espina dorsal fuerte y más corta que la tercera 6 6. Anal III, 8-9. De 37 a 42 escamas por debajo de la línea lateral; 10 a 14 branquiespinas bajo el primer arco....................................Diapterus olisthostomus (Goode y Bean) 6. Anal III, 8-9. De 37 a 42 escamas por debajo de la línea lateral; 10 a 14 branquiespinas bajo el primer arco..............................................................................................Diapterus olisthostomus (Goode y Bean) 6' Anal II, 8-10. De 30 a 40 escamas por debajo de la línea lateral, segunda o tercera hilera continua hasta el extremo de la caudal...................... 7 7. Primer radio blando de la aleta anal ramificado, segunda espina notablemente más corta que la segunda dorsal. De 14 a 16 branquiespinas bajo el primer arco............................................Diapterus rhombeus (Cuvier) 7' Primer radio blando de la aleta anal no ramificado, segunda espina igual en longitud a la segunda dorsal. De 9 a 11 branquiespinas bajo el primer arco..................................Diapterus evermanniMeek e Hildebrand Género Gerres Cuvier, 1824 Gerres cinereus (Walbaum, 1792) N.v.: "Mojarra plateada", "Mojarra blanca", "Mojarra de casta" Mugil cinereus Walbaum, Artedi Genera Piscium, 1792: 228 (Bahamas). Diagnosis. Cuerpo oblongo y ligeramente comprimido, dorso moderadamente elevado, profundidad 2.1 a 2.7 en la LP. Cabeza 2.7 a 3.3 en la LP; perfil anterior uniforme y suavemente convexo; boca algo pequeña, hocico puntiagudo 2.7 a 3.7 en la cabeza; ojos moderadamente grandes 2.6 a 3.8 en la longitud cefálica y 3.0 a 3.3 en la distancia entre el origen de la anal y la base de la caudal; maxilar llegando al margen anterior de la pupila, porción expuesta triangular, ancha 4.2 a 5.0 en la cabeza y de 5.7 a 6.4 en la distancia predorsal 2.1 a 2.2 en la LP y 1.0 a 1.1 en la profundidad del cuerpo. Preopérculo y preorbital enteros. Branquiespinas pequeñas y delgadas, 6 a 8 en la rama inferior del primer arco. D IX, 10, la segunda espina no tan fuerte, más corta que la tercera, 1.5 a 2.0 en la longitud cefálica. A III, 1 7, la segunda espina fuerte, un poco más corta que la tercera y segunda dorsal, 2.1 a 3.2 en la cabeza y 3.0 a 4.7 en la distancia predorsal; base de la anal 1.8 a 2.0 en la longitud cefálica. Pectorales grandes, algo más que la cabeza, 2.7 a 3.0 en la LP, sobrepasando la vertical trazada por el ano. Pélvicas más pequeñas que la longitud cefálica, 4.0 a 4.8 en la LP, usualmente no sobrepasan la abertura anal. De 39 a 47 escamas en una serie longitudinal por debajo de la línea lateral. Caudal cubierta de pequeñas escamas. Color. Cuerpo completamente planteado con reflejos azul verdosos hacia el dorso, más claro ventralmente. Aletas pectorales claras. Aletas dorsal y caudal negruzcas. Pélvicas y anal amarillas; pélvicas con puntuaciones. Hocico negruzco. Costados del cuerpo con barras verticales azuladas o rosa pálido., presentes en todas las edades. En fijador el cuerpo se conserva plateado o ligeramente más claro con tonos cafés hacia el dorso, además pueden llegar a perderse las barras de los costados. Las aletas dorsal y caudal pueden conservarse más o menos negruzcas, las restantes se tornan más claras, sin embargo, no se pierden las puntuaciones de estas. Distribución. Ambas costas de América tropical. En el Pacífico desde Baja California, México hasta Perú incluyendo las Islas Galápagos. En el Atlántico se encuentra desde las Islas Bermudas, Cayos de Florida, Golfo de México y Mar Caribe, hasta Río de Janeiro, Brasil. En el área de estudio: localidades ESP y PG (Fig. 3). Material examinado. 3 ejemplares de 89 a 159 mm de longitud total. Colección de referencia depositada en el Laboratorio de Ictiología y Ecología Estuarina del Inst. de Ciencias del Mar y Limnología de la Universidad Nacional Autónoma de México.Catálogo CCMLPF 0.001708/1709 (Camp.). Observaciones taxonómicas. Algunas consideraciones taxonómicas sobre Gerres cinereus en la costa Atlántica de América y Golfo de México han sido hechas por: Jordan y Evermann (1896), Meek e Hildebrand (1925), Cervigon (1966), Randall (1968), Bohlke y Chaplin (1970), Dahl (1971), Gallaway, Parker y Moore (1972), Guitart (1977), Hoese y Moore (1977), Fischer (1978) y Castro Aguirre (1978). Sin embargo, ni Darnell (1962) ni Reséndez (1970 y 1973), la mencionan entre los peces de algunas lagunas costeras mexicanas del Golfo de México. Esta es la única especie del género Gerres presente en Laguna de Términos, Golfo de México y costa Atlántica de América, no obstante, también se encuentra en la costa del Pacífico de América (Jordan y Evermann, 1896, Meek e Hildebrand, 1925, Cervigon 1966, Randall 1968, Amezcua-Linares 1972, Hoese y Moore 1977, Fisher 1978, Yáñez-Arancibia 1978 y Castro-Aguirre 1978), y sus especies más afines que son: Gerres oyena(Forskal),G. oblongus Cuvier, G. limbatusCuvier,G. setifer (Hamilton) y G. abbreviatus, se encuentran en el Indo-Pacífico (Francis 1878, Job, 1940, Chacko 1949, Bapat y Bal 1952. Bassheeruddin y Nagappan Nayar 1961, Jhingran et al. 1963, Jhingran y Natayaran 1966 y Prabhakara 1968). La revisión de G. cinereushecha en el presente estudio permite separarla con seguridad. 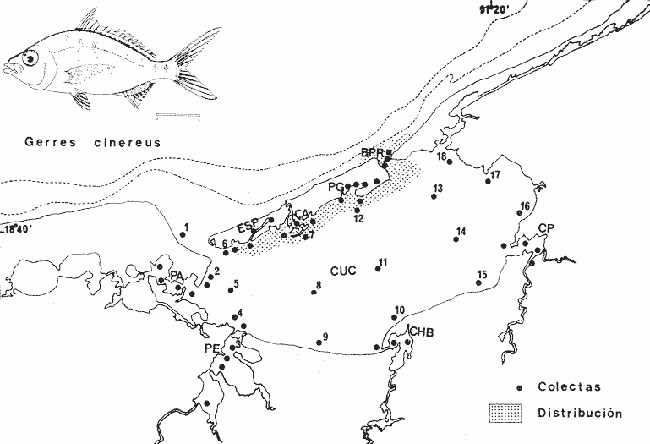 Fig. 3. Mapa de distribución de Gerres cinereus en la Laguna de Términos, en relación a la estaciones de colecta en las distintas localidades. Por consiguiente, a pesar de que no tiene especies afines en el Golfo de México para poder compararla, se distingue fácilmente por presentar sobre los costados del cuerpo 7 u 8 barras verticales azul claro o rosa pálido que están presentes en todas las edades. Los extremos de los lóbulos de la aleta caudal son oscuros y además está cubierta totalmente por pequeñas escamas. El surco premaxilar presenta forma oval o en forma de "U" y se encuentra libre de escamas. Meek e Hildebrand (1925) consideran el número de ciegos terminales del estómago como caracteres importantes para separar a G. cinereus, no obstante, la utilización de los caracteres morfológicos externos de esta especie permiten hacer una rápida identificación. Observaciones ecológicas. Distribución y abundancia. Al parecer es una especie rara en la Laguna de Términos por su baja frecuencia. Vargas Maldonado et al. (1981), sólo la han reportado para la localidad Estero Pargo con 2 individuos presentando una biomasa total de 0.02 gm-² . Es considerada por lo tanto como una especie visitante ocasional por estos autores. Además se cuenta con registro para la localidad de Punta Gorda con un individuo. Esta especie se distribuye sólo en el interior de la Isla del Carmen, en ambientes con mayor influencia marina, tolerando amplios rangos de temperatura. Esa área es un subsistema ecológico característico de Thalassia testudinum y Rhizophora mangle. Gerres cinereus ha sido mejor estudiada en el Pacífico mexicano que en el Atlántico, donde representa un recurso económico por su gran abundancia (Yañez-Arancibia, 1978). De acuerdo a la categorización ictiotrófica de las especies, Yáñez-Arancibia et al. (1980a) y Vargas Maldonado et al. (1981) clasifican a Gerres cinereus como consumidor de primer orden. Se alimenta principalmente de pequeños organismos bentónicos, entre ellos: pelecípodos, gasterópodos, poliquetos, cumáceos, tanaidáceos, anfípodos, isópodos, pequeños decápodos, vegetales y materia orgánica. GéneroEucinostomus Baird y Girard, 1854Eucinostomus gula (Cuvier, 1830) N.v.: "Mojarrita", "Mojarrita de Ley", "Mulpiche", "Española"
Gerres gula Cuvier.In: Cuvier y Valenciennes, Histoire Naturalle des Poissons, 1830, 6:464 (Martinica). Diagnosis. Cuerpo elíptico ligeramente comprimido, dorso moderadamente elevado, profundidad 2.0 a 2.6 en la LP. Cabeza 2.4 a 3.3 en la LP; perfil anterior uniforme y suavemente convexo; boca pequeña hocico puntiagudo 2.8 a 3.8 en la cabeza; ojos moderadamente grandes 2.4 a 3.7 en la longitud cefálica y 2.6 a 3.2 en la distancia entre el origen de la anal y la base de la caudal; maxilar sobrepasando ligeramente el margen anterior de la órbita; porción expuesta casi oblonga, ancha, 4.0 a 7.0 en la cabeza y 5.3 a 8.5 en la distancia predorsal; surco premaxilar ancho y atravesado por escamas en su parte superior donde se forma una pequeña foseta. Distancia predorsal 2.1 a 2.5 en la LP y 1.0 a 1.1 en la profundidad del cuerpo. Preopérculo y preorbital enteros. Branquiespinas pequeñas y delgadas, 7 en la rama inferior del primer arco. D IX, 10, la segunda espina casi igual a la tercera, 1.5 a 3.3 en la longitud cefálica. A III, 7-8, la segunda espina muy fuerte, más corta que la tercera y segunda dorsal, 2.6 a 3.6 en la cabeza y 3.1 a 4.5 en la distancia predorsal; base de la anal 1.7 a 2.3 en la longitud cefálica. Pectorales más grandes que la cabeza 2.6 a 4.3 en la LP, sobrepasando la vertical trazada por el ano. Pélvicas más pequeñas que la longitud cefálica 4.1 a 7.5 en la LP, generalmente no alcanzando la abertura anal. De 40 a 47 escamas en una serie longitudinal por debajo de la línea lateral. Color. Cuerpo uniformemente plateado con tonos más oscuros hacia el dorso y reflejos azul-verdosos, claro ventralmente. Las aletas pectorales, pélvicas y caudal claras, caudal con puntuaciones. Aleta dorsal y anal gris claro, margen superior de la dorsal espinosa negro. Los ejemplares juveniles presentan barras verticales oscuras sobre los costados que desaparecen rápidamente con la edad. En fijador pueden presentar tonalidades de café claro en el cuerpo; todas las aletas se tornan claras; sin embargo, no se pierden las puntuaciones de estas ni el margen negro de la dorsal espinosa. Distribución. En el Atlántico desde Woods Hole, Massachusetts, EUA, Golfo de México y Mar Caribe, hasta Argentina. En el área de estudio: localidades PA, PEC, CHB, CP, PJ, PG, CA, MNG, ESP y CUC (Fig. 4). Material examinado. 2349 ejemplares de 30 a 160 mm de longitud total. Colección de referencia depositada en el Laboratorio de Ictiología y Ecología Estuarina del Inst. de Ciencias del Mar y Limnología de la Universidad Nacional Autónoma de México.Catálogo CC ML-PF 0.001682/1690 (Camp.). Observaciones taxonómicas. Algunas consideraciones taxonómicas sobre Eucinostomus gulaen la costa Atlántica de América y Golfo de México han sido hechas principalmente por: Jordan y Evermann (1896), Meek e Hildebrand (1925), Curran (1942), Cervigón (1966), Jordan y Evermann (1969), Bohlke y Chaplin (1970), Dahl (1971), Gallaway, Parker y Moore (1972), Perry y Perry (1974), Hoese y Moore (1977), Guitart (1977), Fischer (1978) y Castro-Aguirre (1978). Sin embargo ni Darnell (1962), ni Reséndez (1970 y 1973), la mencionan entre los peces de algunas lagunas costeras mexicanas del Golfo de México. La mayor parte de los caracteres morfométricos tomados en cuenta para la determinación de esta especie se translapan con los deEucinostomus argenteusBaird y Girard y Eucinostomus melanopterus (Bleeker), presentándose, por lo tanto, confusión entre estas especies para separarlas claramente. La diferenciación de estas especies se basa principalmente en la profundidad del cuerpo, longitud de la cabeza, longitud y forma de las espinas anales, número de escamas en la línea lateral, número de braquiespinas. Sin embargo, la revisión taxonómica de E. gula hecha en el presente estudio permite precisar diferencias básicas para la determinación de la misma. Por consiguienteE. gula se separa de las otras dos especies por tener una profundidad corporal claramente mayor después de los 30 mm de longitud patrón, reflejándose en una notoria elevación del dorso dado que en esta especie la profundidad es alométricamente positiva al crecimiento y en ejemplares subadultos y adultos esta característica es determinante. Por el contrario enE. argenteus y E. melanopterus la profundidad es alométricamente negativa y se refleja en la poca elevación del dorso. 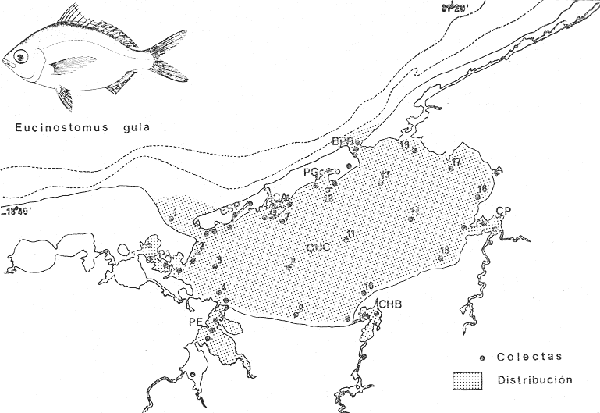 Fig. 4. Mapa de distribución de Eucinostomus gula en la Laguna de Términos, en relación a las estaciones de colecta en las distintas localidades. El perfil anterior en E. gula es uniformemente convexo desde la punta del hocico hasta el origen de la dorsal a diferencia de las otras dos especies donde el perfil más bien es tendido y casi recto. Este carácter podría no ser muy claro en ejemplares juveniles de menos de 30 mm puesto que la forma del perfil es parecida entre estas especies cuando se observa en esta talla; sin embargo, en ejemplares de mayor talla, subadultos y adultos, el perfil se muestra claramente convexo. Al igual que el perfil dorsal, el ventral también es convexo desde la boca hasta la base de la caudal. En E. argenteus y E. melanopterusla tendencia es a ser recto o aplanado. En ejemplares juveniles de las tres especies la forma del cuerpo es muy parecida y pudiese no ayudar mucho para diferenciarlas; no obstante, en subadultos y adultos deE. gula el cuerpo es claramente elíptico o ligeramente romboidal a diferencia de las otras dos especies donde es perfectamente elongado. La dimensión relativa del ojo respecto a la distancia entre el origen de la anal la base de la caudal es claramente mayor en E. gula. El surco premaxilar es notoriamente más ancho y la foseta que se encuentra por arriba de los apéndices de los premaxilares, más o menos en medio del hueso interorbital es circular, poco profunda y está circundada totalmente por escamas; por el contrario en E. argenteus yE. melanopterus este surco puede adoptar otras formas y ser más profundo. La distancia predorsal es igual o más pequeña que la profundidad del cuerpo. Las aletas pectorales son grandes y siempre rebasan la vertical trazada por el ano Pudiendo llegar hasta el origen de la anal,E. gula presenta además un margen negro bien definido en la parte superior de la dorsal espinosa. Algunos autores como Jordan y Evermann (1896), Meek e Hildebrand (1925) y Curran (1942), consideran el número de ciegos terminales del estómago, como importantes para la separación de esta especie; no obstante en el presente estudio se destaca que el análisis de algunos caracteres morfológicos externos permite identificar rápidamente a los ejemplares de esta especie. Observaciones ecológicas Distribución y abundancia. La distribución, abundancia numérica y biomasa deEucinostomus gula se muestra en las tablas 2 y 3 para las épocas de lluvias y secas respectivamente. Para ambas épocas el número de individuos y la biomasa variaron irregularmente de acuerdo a la localidad. Sin embargo los meses en los que se presentó mayor abundancia numérica fueron: octubre de 1976 con 206 individuos en Estero Pargo, marzo de 1977 con 141 individuos en Bajos del Cayo, mayo de 1977 con 113 individuos en Candelaria-Panlau y agosto de 1977 con 107 individuos también en Candelaria-Panlau. Por lo que respecta a biomasa, Bravo-Núñez y Yáñez-Arancibia (1979) reportan para las estaciones BPR-1, BPR-2 y BPR-3 en la época de lluvias valores que oscilan entre 0.001 y 0.03 gm-² con un promedio de 0.0085 gm-² Para la época seca solamente para las estaciones BPR-1 y BPR-3, se reportan valores de 0.003 a 0.022 gm-² con un promedio de 0.012 gm-² 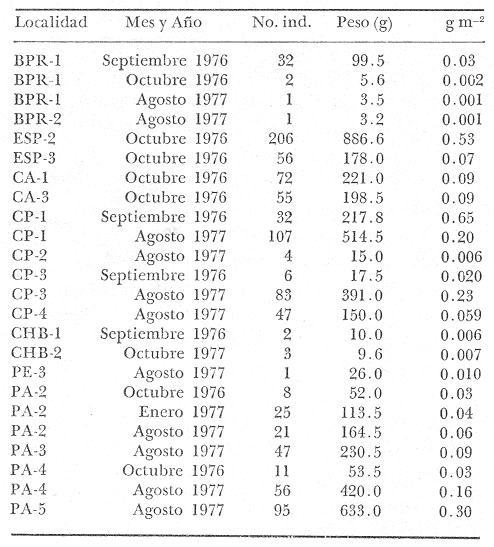 TABLA 2 EUCINOSTOMUS GULA ABUNDANCIA ESTIMADA DURANTE LA ÉPOCA DE LLUVIAS (1976-1977) EN LAS DOS ÁREAS ESTUDIADAS 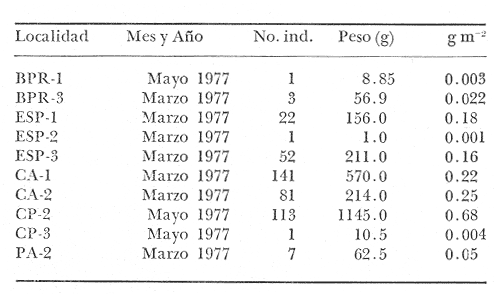 TABLA 3 EUCINOSTOMUS GULA ABUNDANCIA ESTIMADA DURANTE LA ÉPOCA DE SECAS (1976-1977) EN LAS DOS ÁREAS ESTUDIADAS Amezcua-Linares y Yáñez-Arancibia (1980), reportan para los sistemas Fluvio-Lagunares en la época lluviosa valores que oscilan entre 0.006 a 0.65 gm-² con un promedio de 0. 118 gm-². Se destaca que el máximo valor perteneció a Candelaria-Panlau con 32 individuos, y el mínimo con 4 individuos. Para la época seca se reportan valores entre 0.004 a 0.68 gm-² con un promedio de 0.244 gm-². Igualmente en esta época el valor máximo correspondió a Candelaria-Panlau con 113 individuos. Finalmente, Vargas Maldonado et al. (1981), reportan para Estero Pargo y Bajos del Cayo durante la época de lluvias valores que van de 0.07 a 0.53 gm-² El valor máximo correspondió a Estero Pargo con 206 individuos. Para la época de sequía los valores oscilaron entre 0.001 y 0.25 gm-², con un promedio de 0.162 gm-². El valor máximo corresponde en este caso a El Cayo con 81 individuos. Es importante señalar queEucinostomus gulaes la especie mejor representada en cuanto a distribución y abundancia de todas las mojarras presentes en la Laguna de Términos, distribuyéndose indistintamente en los ambientes dulceacuícolas y de mayor influencia marina, tolerando por tanto amplios rangos de variación de salinidad y de temperatura. Constituye un recurso económico potencial en el área. Frecuencia de la especie y utilización de la laguna. El análisis de la frecuencia hecho por algunos autores ha permitido dar diversos valores para esta especie de acuerdo a la localidad y época climática. Así, Bravo-Núñez y Yáñez-Arancibia (1979), han reportado para las estaciones BPR-1 un 66.67%, para la BPR-2 un 16.67% y para la BPR-3 también un 16.67%. De lo anterior se desprende que Eucinostomus gula se considera como un componente comunitario cíclico para BPR-1 y ocasional para BPR-2 y BPR-3. Amezcua-Linares y Yáñez-Arancibia (1980), reportaron para los. sistemas Fluvio-Lagunares Candelaria-Panlau, Chumpan-Balchacah, Palizada del Este y Pom-Atasta en ambas épocas climáticas una frecuencia del 77%. Se observa entonces que esta especie es residente permanente para los cuatro sistemas. Vargas Maldonado et al. (1981), reportan para el interior de la Isla del Carmen en las localidades Estero Pargo y Cayo para ambas épocas climáticas una frecuencia del 100%, por lo que también es una especie residente permanentemente para estas áreas. De acuerdo a la categorización ictiotrófica de las especies, Bravo-Núñez y Yáñez-Arancibia (1979), Amezcua-Linares y Yáñez-Arancibia (1980), Yáñez-Arancibia et al. (1980a) y Vargas Maldonado et al. (1981), clasifican a Eucinostomus gula como consumidor de primer orden. Su espectro trópico es muy amplio, alimentándose principalmente de poliquetos, copépodos, cumáceos, tanaidáceos, anfípodos, pequeños decápodos, gasterópodos, pelecípodos, isópodos, foraminíferos, vegetales y materia orgánica. Eucinostomus argenteusBaird y Girard, 1854 N.v.: "Mojarrita plateada", "Mojarra cantileña", "Mojarra charrita", "Española" Eucinostomus argenteus Baird y Girard. In: Baird y Girard, Ann. Rep. Smithsonian Inst. 1854:335 (Besseley Point, New jersey). Diagnosis. Cuerpo más bien alargado ligeramente comprimido, dorso poco elevado, profundidad 2.7 a 3.3 en la LP. Cabeza 2.6 a 3.5 en la LP; perfil anterior uniforme y casi recto; boca pequeña hocico puntiagudo 2.0 a 3.6 en la cabeza; ojos no muy grandes 2.0 a 3.4 en la longitud cefálica y 3.1 a 4.0 en la distancia entre el origen de la anal y la base de la caudal; maxilar llegando al margen anterior de la órbita, porción expuesta casi oblonga, ancha, 3.0 a 6.5 en la cabeza y 5.3 a 9.5 en la distancia predorsal; surco premaxilar estrecho y totalmente libre de escamas. Distancia predorsal 2.3 a 2.5 en la LP y 0.6 a 0.9 en la profundidad del cuerpo. Preopérculo y preorbital enteros. Branquiaespinas pequeñas y delgadas, 7 en la rama inferior del primer arco. D IX, 10, la segunda espina visiblemente más corta que la tercera, 0.8 a 2.6 en la longitud cefálica. A III, 7, la segunda espina muy fuerte, más corta que la tercera y segunda dorsal, 1.5 a 3.8 en la cabeza y 2.8 a 5.0 en la distancia predorsal; base de la anal 1.0 a 2.5 en la longitud cefálica. Pectorales más pequeñas que la cabeza, 2.5 a 4.3 en la LP, generalmente sin sobrepasar la vertical trazada por el ano. Pélvicas cortas, aproximadamente la mitad de la longitud cefálica, 5.0 a 6.8 en la LP, nunca alcanzando la abertura anal. De 43 a 48 escamas en una serie longitudinal por debajo de la línea lateral. Color. Cuerpo uniformemente plateado hacia la parte dorsal y con reflejos azul-verdosos, claro ventralmente. Las aletas pectorales, pélvicas, anal y caudal claras; caudal con puntuaciones. Aleta dorsal gris claro, más oscura hacia la parte superior de la dorsal espinosa, sin borde negro en el margen. Los ejemplares juveniles presentan barras verticales oscuras sobre los costados que desaparecen rápidamente con la edad. En, formol pueden presentar tonalidades de café claro en el cuerpo; todas las aletas se tornan claras, sin embargo, no se pierden las puntuaciones de estas ni la parte oscura de la dorsal espinosa. Distribución. En el Atlántico desde New Jersey, EUA, Golfo de México y Mar Caribe, hasta Río de Janeiro, Brasil. En el área de estudio: localidades PA, PE, CP, BPR, PJ, PG, ESP y CUC (Fig. 5). 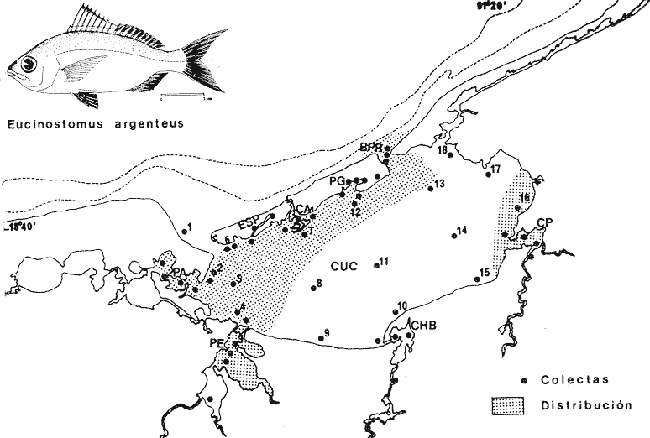 Fig. 5. Mapa de distribución de Eucinostomus argenteus en la Laguna de Términos, en relación a las estaciones de colecta en las distintas localidades. Material examinado. 165 ejemplares de 20 a 145 mm de longitud total. Colección de referencia depositada en el Laboratorio de Ictiología y Ecología Estuarina del Inst. de Ciencias del Mar y Limnología de la Universidad Nacional Autónoma de México.Catálogo CCML-PF 0.001691/1700 (Camp.). Observaciones taxonómicas. Algunas consideraciones taxonómicas sobreEucinostomus argenteus en la costa Atlántica de América y Golfo de México han sido hechas principalmente por: Curran (1942), Cervigon (1966), Randall (1968), Jordan y Evermann (1969), Bohlke y Chaplin (1970), Dahl (1971), Gallaway, Parker y Moore (1972), Hoese y Moore (1977), Fischer (1978) y Castro-Aguirre (1978). Sin embargo ni Darnell (1962) ni Reséndez (1970 y 1973) la mencionan entre los peces de algunas lagunas costeras mexicanas del Golfo de México. La mayor parte de los caracteres morfométricos tomados en cuenta para la determinación de esta especie se translapan con los deEucinostomus gula (Cuvier) yEucinostomus melanopterus (Bleeker), presentándose por lo tanto confusión entre estas especies para separarlas claramente. Sin embargo la revisión taxonómica de E. argenteus hecha en el presente estudio permite precisar diferencias básicas para la determinación correcta de la misma. Por consiguiente E. argenteus se separa de E. gula por tener una profundidad corporal claramente menor, reflejándose en la poca elevación del dorso, dado que en esa especie la profundidad es alométricamente negativa al crecimiento y siempre se conserva constante.E. melanopterus tiene aproximadamente la misma profundidad que E. argenteus por lo que se consideran otros caracteres como la coloración de la aleta dorsal para diferenciarlos entre sí. El perfil anterior deE. argenteus es uniforme y casi recto desde la punta del hocico hasta el origen de la dorsal a diferencia del de E. gula que es convexo. Este carácter podría no ser muy claro en ejemplares juveniles de menos de 30 mm de longitud patrón, puesto que la forma del perfil es parecida entre estas especies sin embargo, el perfil de E. argenteus siempre presenta esta forma y se conserva constante en ejemplares de mayor talla. El perfil ventral es similar al dorsal, generalmente recto y nunca mostrándose convexo. En ejemplares juveniles deE. argenteus la forma del cuerpo es muy parecida a la deE. gula y pudiese no ayudar mucho a diferenciar estas especies, no obstante, en subadultos y adultos de E. argenteus el cuerpo es claramente elongado. La dimensión relativa del ojo respecto a la distancia entre el origen de la anal y la base de la caudal es menor en E. argenteus. El surco premaxilar es estrecho, algunas veces en forma de "U", moderadamente profundo y libre de escamas. La distancia predorsal siempre es más grande que la profundidad del cuerpo, siendo esta característica aún más evidente en ejemplares subadultos y adultos. Las aletas pectorales no tan alargadas raramente rebasan la vertical trazada por el ano y jamás llegan al origen de la anal. La dorsal espinosa no presenta margen negro sino únicamente una porción oscura en la parte superior. Los caracteres tomados hasta ahora para diferenciar a E. argenteus presentan una marcada coincidencia con los de E. melanopterus por lo que para diferenciar estas especies se toma el número de branquiespinas de la rama inferior, siendo menor para la primera especie, así como también características de coloración de las aletas dorsales de ambas especies. Algunos autores como Curran (1942) y Picciolo (1960), consideran el número de ciegos del estómago como importantes para la separación de esta especie. Sin embargo, al igual que en E. gula la utilización de los caracteres morfológicos externos conspicuos de esta especie hacen más práctica y rápida su identificación. Observaciones ecológicas.Distribución y abundancia. La distribución, abundancia numérica y biomasa deEucinostomus argenteus se muestra en las tablas 4 y 5 para las épocas de lluvias y secas respectivamente. Para ambas épocas el número de individuos y la biomasa variaron irregularmente de acuerdo a la localidad. No obstante los meses en los que se presentó mayor abundancia numérica fueron: Septiembre y Octubre en 1976 con 30 y 24 individuos respectivamente en Boca de Puerto Real, Marzo de 1977 con 11 individuos en Estero Pargo y Mayo de 1977 con 13 individuos en Candelaria-Panlau. 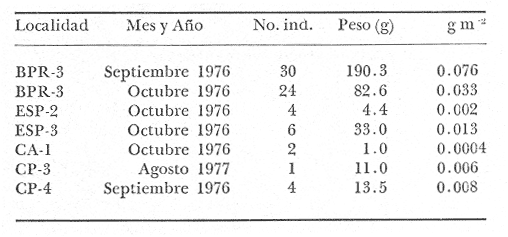 TABLA 4 EUCINOSTOMUS ARGENTEUS ABUNDANCIA ESTIMADA DURANTE LA ÉPOCA DE LLUVIAS (1976-1977) EN LAS DOS ÁREAS ESTUDIADAS 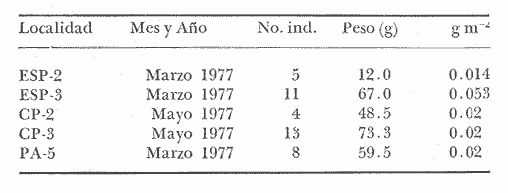 TABLA 5 EUCINOSTOMUS ARGENTEUS ABUNDANCIA ESTIMADA DURANTE LA ÉPOCA DE SECAS (1976-1977) EN LAS DOS ÁREAS ESTUDIADAS Por lo que respecta a biomasa, Bravo-Núñez y Yáñez-Arancibia (1979), reportan para la época lluviosa en la estación BPR-3 un total de 0.109 gm-². En la época seca no aparecieron ejemplares durante las colectas. Amezcua-Linares y Yáñez-Arancibia (1980), reportan para los sistemas Fluvio-Lagunares en la época de lluvias valores sólo para Candelaria-Panlau con un total de 0.014 gm-². Para la época seca se reporta un total de 0.06 gm-² correspondiendo a Candelaria-Panlau y Pom-Atasta. Finalmente Vargas Maldonadoet al. (1981), reportan para Estero Pargo y Bajos del Cayo en la época de lluvias valores que van de 0.0004 hasta 0.013 gm-² con un promedio de 0.005 gm-². Y, en la época de secas sólo para Estero Pargo un total de 0.067 gm-². Es importante destacar queEucinostomus argenteuses la tercera especie más abundante de las mojarras en la laguna. Se distribuye principalmente en la parte norte de la laguna, tolerando amplios rangos de variación de salinidad y temperatura. Frecuencia de la especie y utilización de la laguna. El análisis de la frecuencia hecho por algunos autores ha permitido dar diversos valores para esta especie de acuerdo a la localidad y época climática. Así, Bravo-Núñez y Yáñez-Arancibia (1979), han reportado solo para la estación BPR-3 un 33.33%, lo cual hace considerar aE. argenteus como un componente comunitario cíclico para esta localidad. Amezcua-Linares y Yáñez-Arancibia (1980), reportan para los sistemas Fluvio-Lagunares en ambas épocas climáticas una frecuencia total del 30.1% solo para Candelaria-Panlau y Pom-Atasta, considerándose como visitante ocasional para estas localidades. Vargas Maldonado et al. (1981), reportan a esta especie como visitante cíclico para el interior de la Isla del Carmen en Estero Pargo y el Cayo durante ambas épocas climáticas. De acuerdo alas categorías ictiotróficas, Bravo-Núñez y Yáñez-Arancibia (1979), Amezcua-Linares y Yáñez-Arancibia (1980), Yáñez-Arancibia et al. (1980a) y Vargas Maldonado et al. (1981), clasifican a Eucinostomus argenteus como consumidor de primer orden. Su espectro trópico es muy amplio y su alimentación se basa principalmente en organismos bentónicos; entre ellos: poliquetos, ostrácodos, copépodos, tanaidáceos, anfípodos, cumáceos, pequeños decápodos, foraminíferos, vegetales y materia orgánica. Eucinostomus melanopterus (Bleeker, 1853) N.v.: "Mojarra española", "Mojarrita bandera", "Mojarra trompetera"
Gerres melanopterusBleeker, Nat. Verh. Holl. Maatsch. Wetensch, 1863, 2 (18):44, lám. 8, fig. 1 (Costa de Guinea). Diagnosis. Cuerpo elongado ligeramente elíptico, no muy comprimido, dorso poco elevado, profundidad 2.6 a 3.2 en la LP. Cabeza 2.5 a 3.2 en la LP; perfil anterior suavemente convexo; boca pequeña hocico no muy puntiagudo, cónico, 2.7 a 3.3 en la cabeza; ojos moderadamente grandes 2.5 a 3.3 en la longitud cefálica y 3.5 a 4.3 en la distancia entre el origen de la anal y la base de la caudal; maxilar sobrepasando ligeramente el margen anterior de la órbita; porción expuesta casi triangular, 4.0 a 5.3 en la cabeza y 5.7 a 6.6 en la distancia predorsal; surco premaxilar grande, linear y libre de escamas. Distancia predorsal 2.2 a 2.6 en la LP y 0.9 a 1.2 en la profundidad del cuerpo. Preopérculo y preorbital enteros. Branquiespinas pequeñas y delgadas, 8 en la rama inferior del primer arco D IX, 10, la segunda espina casi igual a la tercera 1.3 a 2.2 en la longitud cefálica. A III, 7, la segunda espina fuerte, más corta que la tercera y segunda dorsal, 2.5 a 4.5 en la cabeza y 2.5 a 4.2 en la distancia predorsal; base de la anal 1.6 a 2.2 en la longitud cefálica. Pectorales poco más cortas que la cabeza, 3.4 a 4.2 en la LP sobrepasando la vertical trazada por el ano. Pélvicas más pequeñas que la longitud cefálica, 3.0 a 5.6 en la LP, sus extremos a veces alcanzan la abertura anal. De 46 a 51 escamas en una serie longitudinal por debajo de la línea lateral. Color. Cuerpo uniformemente plateado con reflejos verdosos hacia el dorso; hocico algo negruzco. Las aletas pectorales pélvicas y anal claras. Aleta caudal ligeramente oscura. La dorsal presenta una mancha negra muy bien definida en la parte superior de las primeras espinas, seguida hacia el dorso por una banda incolora o blancuzca y una base de color gris claro. En fijador pueden presentar tonalidades de café claro en el cuerpo; todas las aletas se tornan claras excepto la dorsal en la cual se conserva la coloración tricolor de la porción espinosa. Distribución. En el Atlántico desde las Islas Bermudas, Sur de Florida, EUA, Golfo de México y Mar Caribe hasta Bahía, Brasil. En el área de estudio: localidades PA, CP, PG, MNG, ESP y CUC (Fig. 6). Material examinado. 13 ejemplares de 50 a 120 mm de longitud total. Colección de referencia depositada en el Laboratorio de Ictiología y Ecología Estuarina del Inst. de Ciencias del Mar y Limnología de la Universidad Nacional Autónoma de México.Catálogo CCMLPF 001701/1707 (Camp.). 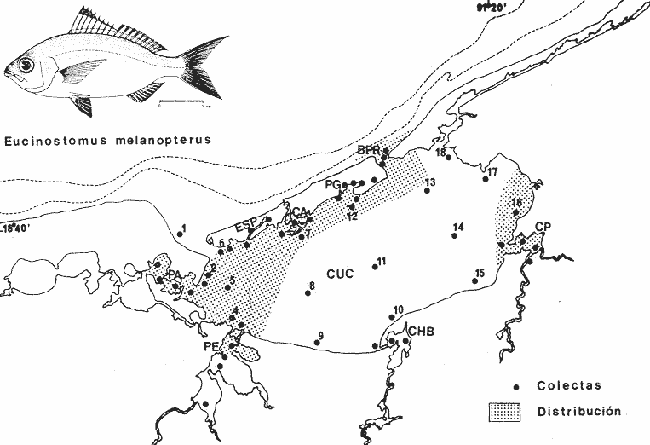 Fig. 6. Mapa de distribución de Eucinostomus melanopterus en la Laguna de Términos, en relación a las estaciones de colecta en las distintas localidades. Observaciones taxonómicas. Algunas consideraciones taxonómicas sobreEucinostomus melanopterus en la costa Atlántica de América y Golfo de México han sido hechas principalmente por: Jordan y Evermann (1896), Curran (1942), Cervigon (1966), Jordan y Evermann (1969), Reséndez (1970 y 1973), Dahl (1971), Perry y Perry (1974), Fischer (1978) y Castro Aguirre (1978). La mayor parte de los caracteres morfométricos tomados en cuenta para la determinación de esta especie se traslapan con los deEucinostomus gula (Cuvier) yEucinostomus argenteus Baird y Girard, a pesar de ello esta especie es la que presenta menos problemas para separarla claramente de las demás, ya que la dorsal espinosa muestra una mancha negra perfectamente definida en la parte superior de las primeras espinas, seguida de una banda incolora y una base de color gris claro, coloración tan peculiar que permite su identificación aún cuando las proporciones morfométricas sean similares. Si bien es cierto que la coloración de la aleta dorsal de esta especie es el punto de diferenciación más seguro, la presente revisión taxonómica revela que existen más características que deben ser tomadas en cuenta.E. argenteus es la especie que presenta la mayor coincidencia morfométrica con E. melanopterus por lo que caracteres morfométricos diagnósticos ayudan poco para poder separar estas dos especies. Por el contrario, esos caracteres son diferentes para E. gula y deben de considerarse para diferenciarlas.E. melanopteruspresenta además 8 branquiespinas en la rama inferior del primer arco a diferencia de las otras dos especies que tienen únicamente 7. Autores como Curran (1942) y Reséndez (1970 y 1973), consideran el número de ciegos del estómago como importantes para la separación de esta especie, sin embargo, en este caso la utilización de los caracteres morfológicos externos conspicuos de la misma son más prácticos. Observaciones ecológicas.
Distribución y abundancia. Al parecer es una especie poco común en la laguna por su baja frecuencia. Vargas Maldonadoet al. (1981), solo la han reportado para la localidad Estero Pargo con un valor de biomasa total de 0.00 19 gm-² Es considerada como una especie visitante ocasional por estos autores. Se cuentan con valores de abundancia numérica para otras localidades donde ha sido colectada, y son: Candelaria-Panlau con 1 individuo, Pom-Atasta con 1 individuo, La Manigua con 3 individuos y Punta Gorda con 1 individuo. Esta especie se distribuye principalmente hacia el interior de la Isla del Carmen, tolerando amplios rangos de salinidad y temperatura. Amezcua-Linares y Yáñez-Arancibia (1980), Yáñez-Arancibia et al. (1980a) y Vargas Maldonado et al. (1981), clasifican a Eucinostomus melanopterus como consumidor de primer orden. Su alimentación se basa principalmente de ostrácodos, copépodos, tanaidáceos, cumáceos, poliquetos, foramínferos, nemátodos, vegetales y materia orgánica. GéneroDiapterusRanzani, 1840 Diapterus rhombeus (Cuvier, 1829) N.v.: "Mojarra", "Patao", "Caitipa" "Boquilla", "Mojarra pinta"
Gerres rhombeus Cuvier, Le Regne Animal, 1829, 2, Ed. 2:189 (Martinica, Santo Domingo). Diagnosis. Cuerpo corto profundo y romboidal, muy comprimido, dorso muy elevado, profundidad 1.7 a 2.0 en la LP. Cabeza 2.6 a 3.2 en la LP; perfil anterior muy convexo; boca algo grande y larga, hocico romo 3.0 a 4.1 en la cabeza; ojos moderadamente grandes, 2.4 a 3.7 en la longitud cefálica y 3.1 a 4.2 en la distancia entre el origen de la anal y la base de la caudal; maxilar llegando hasta el centro del ojo, porción expuesta oblonga, ancha y alargada, 3.6 a 5.0 en la cabeza y 5.0 a 6.5 en la distancia predorsal; surco premaxilar ancho y libre de escamas. Distancia predorsal 2.0 a 2.3 en la LP y 1.0 a 1.1 en la profundidad del cuerpo. Preopérculo aserrado, preorbital entero. Branquiespinas pequeñas y delgadas, 12 a 18 (14-16) en la rama inferior del primer arco. D IX, 10, la segunda espina fuerte y alta, más corta que la tercera, 1.0 a 1.6 en la longitud cefálica. A II, 9-10, la segunda espina fuerte y larga, más corta que la segunda dorsal, 1.4 a 2.2 en la cabeza y 1.8 a 2.3 en la distancia predorsal; base de la anal 1.2 a 1.5 en la distancia predorsal; base de la anal 1.2 a 1.5 en la longitud cefálica. Pectorales ligeramente más cortas que la cabeza, 2.7 a 3.8 en la LP, sobrepasando la vertical trazada por el ano. Pélvicas más pequeñas que la longitud cefálica, 3.7 a 4.5 en, la LP, sobrepasando la abertura anal. De 35 a 41 escamas, generalmente de 38 a 40 en una serie longitudinal por debajo de la línea lateral. Segunda hilera de escamas por debajo de la línea lateral contínua hasta el extremo de la caudal. Color. Cuerpo uniformemente plateado, ligeramente más oscuro hacia el dorso y con reflejos azules. Aletas pectorales y caudal claras; caudal con puntuaciones. Aleta dorsal gris claro y con margen negro en la porción espinosa. Aletas pélvicas y anal amarillas. Los ejemplares juveniles a menudo presentan barras verticales oscuras sobre los costados que desaparecen rápidamente con la edad. En fijador pueden presentar tonalidades café claro en el cuerpo. Las aletas pélvicas y anal se tornan amarillo muy pálido, las demás aletas claras, sin embargo, no se pierde el margen negro de la dorsal espinosa ni las puntuaciones. Distribución. En el Atlántico desde el sur del Golfo de México y Mar Caribe, hasta Bahía, Brasil. En el área de estudio: localidades PA, CP, PG, CA, ESP y CUC (Fig. 7). Material examinado. 547 ejemplares de 40 a 115 mm de longitud total. Colección de referencia depositada en el Laboratorio de Ictiología y Ecología Estuarina del Inst. de Ciencias del Mar y Limnología de la Universidad Nacional Autónoma de México.Catálogo CCMLPF 01716/1720 (Camp.). Observaciones taxonómicas. Algunas consideraciones taxonómicas sobre Diapterus rhombeusen la costa Atlántica y Golfo de México han sido hechas principalmente por: Jordan y Evermann (1896), Meek e Hildebrand (1925), Cervigon (1966), Jordan y Evermann (1969), Reséndez (1970 y 1973), Dahl (1971), Perry y Perry (1974), Guitart (1977), Fischer (1978) y Castro-Aguirre (1978). 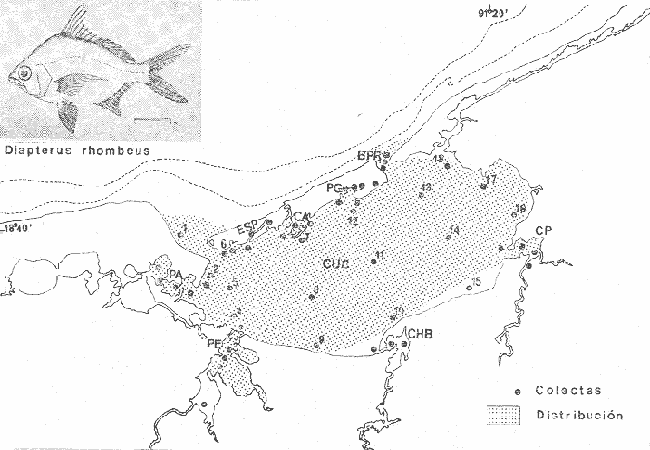 Fig. 7. Mapa de distribución de Diapterus rhombeus en la Laguna de Términos, en relación a las estaciones de colecta en las distintas localidades. La mayor parte de los caracteres morfométricos tomados en cuenta para la determinación de esta especie se translapan con los deDiapterus evermanni Meek e Hildebrand y Diapterus olisthostomus (Goode y Bean), presentándose por lo tanto confusión entre estas especies para separarlas claramente. Además la revisión taxonómica de esta especie hecha en el presente estudio revela que son pocas las diferencias morfométricas que existen para determinar correctamente la especie, por lo que caracteres morfométricos diagnósticos no son de mucha utilidad como punto de comparación. Sin embargo D. rhombeas puede separarse de D. evermanni por tener una profundidad corporal mayor.D. olisthostomus tiene una profundidad casi igual a la deD. rhombeus por lo que se consideran otros caracteres para diferenciar estas especies. D. rhombeuspresenta generalmente de 14 a 16 branquiespinas en la rama inferior del primer arco variando visiblemente en las otras especies. La aleta anal está formada por dos espinas y 9 o 10 radios, siendo esta fórmula anal diferente para D. evermanni yD. olisthostomus. El número de escamas por debajo de la línea lateral es mayor en D. rhombeus con respecto aD. evermanni., además, la segunda hilera de escamas por debajo de la línea lateral es continua hasta el extremo de la caudal. Las aletas pélvicas y anal son de color amarillo vivo a diferencia de las de D. evermanni que son completamente claras. Los caracteres para diferenciar a D. rhombeus presentan una marcada coincidencia con los de D. olisthostomus por lo que para diferenciar estas especies se considera el número de branquiespinas en la rama inferior, siendo mayor para la primera especie; así como también la fórmula de las aletas anales de ambas especies y la carencia de escamas en el surco premaxilar deD. rhombeus. Autores tales como Meek e Hildebrand (1925) y Reséndez (1970 y 1973), consideran el número de ciegos terminales del estómago como caracteres importantes para determinar esta especie, sin embargo, pese a los pocos puntos de comparación que existen para diferenciarla, la utilización de los caracteres morfológicos externos más conspicuos de esta especie permiten identificarla rápidamente. Observaciones ecológicas.Distribución y abundancia. La distribución, abundancia numérica y biomasa de Diapterus rhombeus se muestra en las tablas 6 y 7 para las épocas de lluvias y secas respectivamente. Para ambas épocas el número de individuos y la biomasa fluctuaron irregularmente de acuerdo a la localidad. Sin embargo los meses en los que se presentó mayor abundancia numérica fueron: Marzo de 1977 con 116 individuos en Estero Pargo y Agosto de 1977 con 277 individuos en Candelaria-Panlau. Por lo que respecta a biomasa, Amezcua-Linares y Yáñez-Arancibia (1980), reportan para los sistemas Fluvio-Lagunares Candelaria-Panlau y Pom-Atasta en la época lluviosa valores que van de 0.001 a 0.37 gm² con un promedio de 0.11 gm-². El máximo valor corresponde a Candelaria-Panlau con 140 individuos. Para la época de secas en los cuatro sistemas se reportan valores entre 0.001 a 0.18 gm-² con un promedio de 0.03 gm-². Igualmente en esta época el máximo valor correspondió a Candelaria-Panlau con 29 individuos. 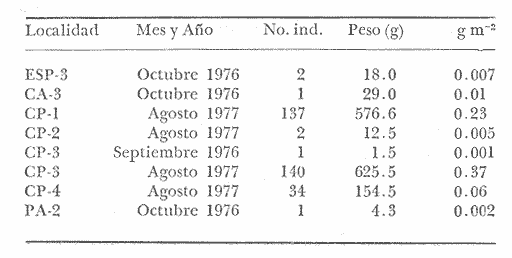 TABLA 6 DIAPTERUS RHOMBEUS ABUNDANCIA ESTIMADA DURANTE LA ÉPOCA DE LLUVIAS (1976-1977) EN LAS DOS ÁREAS ESTUDIADAS 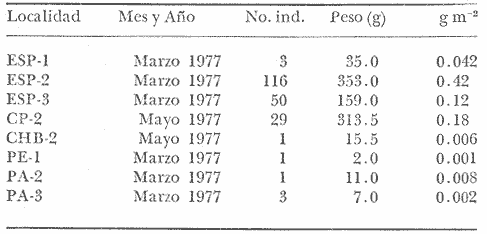 TABLA 7 DIAPTERUS RHOMBEUS ABUNDANCIA ESTIMADA DURANTE LA ÉPOCA DE SECAS (1976-1977) EN LAS DOS ÁREAS ESTUDIADAS Vargas Maldonado et al. (1981), reportan para el Interior de la Isla del Carmen durante la época lluviosa en Estero Pargo un valor de 0.007 gm-² y en Bajos del Cayo 0.01 gm-². En la época de sequía existen valores solo para Estero Pargo variando de 0.042 hasta 0.42 gm-² con un promedio de 0.19 gm-². Diapterus rhombeus es la segunda especie más abundante de las mojarras en la laguna, distribuyéndose indistintamente en ambientes de mayor influencia marina y de bajas salinidades, tolerando amplios rangos de variación de temperatura. Frecuencia de la especie y utilización de la laguna. El análisis de la frecuencia hecho por algunos autores ha permitido dar diversos valores para esta especie de acuerdo a la localidad y época climática. Amezcua-Linares y Yáñez-Arancibia (1980), reportan para los sistemas Fluvio-Lagunares Candelaria-Panlau, Chumpan-Balchacah y Pom-Atasta una frecuencia del 53.8%. La especie por lo tanto utiliza los sistemas como áreas de crianza y/o alimentación. Los mismos autores ubican aD. rhombeus como visitante ocasional para el sistema Palizada del Este; sin embargo, el comportamiento general de la especie en la laguna es de acuerdo al primer patrón. Vargas Maldonado et al. (1981), reportan para el interior de la Isla del Carmen en las localidades Estero Pargo y Bajos del Cayo durante la época seca una frecuencia del 56% por lo que la especie también utiliza esta zona de la laguna como área de crianza y/o alimentación. Se destaca que está mejor representada en esta época. De acuerdo a la categorización ictiotrófica de las especies, Amezcua-Linares y Yáñez-Arancibia (1980), Yáñez-Arancibia et al. (1980a) y Vargas Maldonado et al. (1981), clasifican a Diapterus rhombeus como consumidor de primer orden. Su espectro trópico es muy amplio, alimentándose principalmente de: poliquetos, ostrácodos, copépodos, cumáceos, tanaidáceos, anfípodos, isópodos, gasterópodos, pelecípodos, foraminíferos, vegetales y materia orgánica. Diapterus evermanniMeek e Hildebrand, 1925 N.v.: "Mojarra"
Diapterus evermanni Meek e Hildebrand, The Marine Fishes of Panama, 1925, 15(226):544, lám. 63 (Río Mindi cerca de Mindi, Bahía de Fox, Colón, Panamá). Diagnosis. Cuerpo corto profundo y romboidal, muy comprimido, dorso moderadamente elevado, profundidad 2.0 a 2.3 en la LP. Cabeza 2.1 a 2.8 en la LP; perfil anterior poco convexo; boca algo pequeña, hocico puntiagudo 3.0 a 4.8 en la cabeza; ojos moderadamente grandes 2.5 a 3.4 en la longitud cefálica y 3.0 a 3.7 en la distancia entre el origen de la anal y la base de la caudal; maxilar llegando hasta el centro del ojo, porción expuesta casi oblonga, ancha y alargada, 4.0 a 7.0 en la cabeza y de 5.0 a 6.0 en la distancia predorsal; surco premaxilar no muy ancho y libre de escamas. Distancia predorsal 2.1 a 2.5 en la LP y 1.0 a 1.1 en la profundidad del cuerpo. Preopérculo aserrado, preorbital entero. Branquiespinas pequeñas y delgadas, 9 a 11 en la rama inferior del primer arco. D IX, 10, la segunda espina fuerte y elevada, más corta que la tercera, 1. 1 a 1.6 en la longitud cefálica. A II, 8-9, la segunda espina fuerte y más larga que la base de la misma aleta, igual en longitud a la segunda dorsal, 1.2 a 1.7 en la cabeza y 1.4 a 1.7 en la distancia predorsal, primer radio blando no ramificado; base de la anal 1.3 a 1.8 en la longitud cefálica. Pectorales poco más cortas que la cabeza, 3.2 a 4.3 en la LP, sobrepasando la vertical trazada por el ano. Pélvicas más pequeñas que la longitud cefálica, 3.8 a 4.7 en la LP, sobrepasando la abertura anal. De 30 a 39 escamas en una serie longitudinal por debajo de la línea lateral. Tercera hilera de escamas por debajo de la línea lateral continua hasta el extremo de la caudal. Color. Cuerpo uniformemente plateado, ligeramente más oscuro hacia el dorso y con reflejos azules. Aletas pectorales y pélvicas claras. Aletas dorsal, anal y caudal con puntuaciones; dorsal espinosa con margen negro. Hocico algo negruzco. Los ejemplares juveniles presentan 4 o 5 barras verticales oscuras sobre los costados que se pierden rápidamente con la edad. En fijador pueden presentar tonalidades café claro en el cuerpo. Sin embargo, no se pierden las puntuaciones ni el margen negro de la dorsal espinosa. Distribución. En el Atlántico se encuentra desde el Sur del Golfo de México y Mar Caribe hasta Panamá. En el área de estudio: localidad ESP (Fig. 8). Material examinado. 24 ejemplares de 30 a 70 mm de longitud total. Colección de referencia depositada en el Laboratorio de Ictiología y Ecología Estuarina del Inst. de Ciencias del Mar y Limnología de la Universidad Nacional Autónoma de México.Catálogo CCML-PF 0.001721/1727 (Camp.). Observaciones taxonómicas. Algunas consideraciones taxonómicas sobreDiapterus evermannien la costa Atlántica de América y Golfo de México han sido hechas principalmente por: Meek e Hildebrand (1925), Cervigon (1966) y Castro-Aguirre (1978). La mayor parte de los caracteres morfométricos tomados en cuenta para la determinación de esta especie se translapan con los deDiapterus rhombeus (Cuvier) y Diapterus olisthostomus (Goode y Bean), presentándose por lo tanto confusión entre estas especies para separarlas claramente. Además la revisión de esta especie hecha en el presente estudio revela que son pocas las diferencias morfométricas que existen para determinar la especie. Sin embargo,D. evermanni puede separarse deD. rhombeus y D. olisthostomus por tener una profundidad corporal menor. 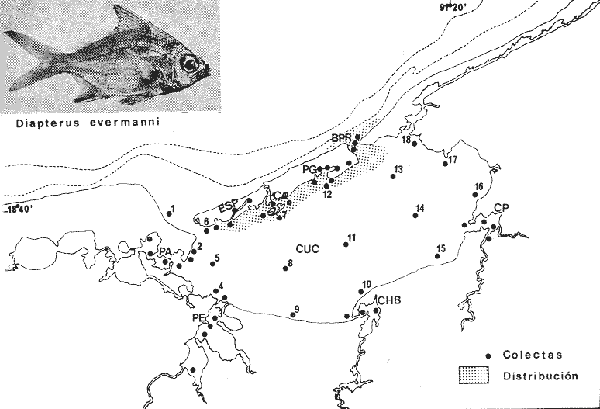 Fig. 8. Mapa de distribución de Diapterus evermanni en la Laguna de Términos, en relación a las estaciones de colecta en las distintas localidades. D. evermanni presenta de 9 a 11 branquiespinas en la rama inferior del primer arco, variando en las otras dos especies. La aleta anal está formada por dos espinas pudiendo tener de 8 a 9 radios, la segunda espina es fuerte, más larga que la base de la misma aleta, igual en longitud a la segunda dorsal y el primer radio blando no está ramificado. Estos últimos caracteres son muy claros para esta especie y no los presentan las otras por lo que es muy importante que se tomen en cuenta. El número de escamas por debajo de la línea lateral es menor en esta especie, además de que la tercera hilera de escamas por debajo de la línea lateral es continua hasta el extremo de la caudal. Las aletas pélvicas y anal de D. evermanni son de color claro a diferencia de las de D. rhombeus y D. olisthostomus que son amarillo vivo. D. evermanni es la especie que más problemas presenta para su identificación pues a menudo se confunde con D. rhombeus, no obstante, los caracteres antes mencionados son constantes desde tallas pequeñas y sirven para separar esta especie. Meek e Hildebrand (1925) consideran el número de ciegos terminales del estómago como caracteres importantes para diferenciar esta especie, sin embargo, la utilización de los caracteres morfológicos externos de la misma hacen más rápida su identificación. Observaciones ecológicas.Distribución y abundancia. Al parecer es una especie rara en la laguna por su baja frecuencia. Vargas Maldonado et al. (1981), sólo la reportan para la localidad Estero Pargo con 24 individuos, presentando un valor de biomasa de 0.05 gm-² Es considerada por lo tanto como una especie visitante ocasional. No ha sido colectada nuevamente y solo se cuenta con el registro anterior. Esta especie se distribuye sólo en el interior de la Isla del Carmen en ambientes con mayor influencia marina, tolerando amplios rangos de temperatura. De acuerdo a la categorización ictiotrófica Diapterus evermanni es clasificada como consumidor de primer orden por Yáñez-Arancibia et al. (1980a) y Vargas Maldonado et al. (1981). Al igual que otras mojarras, presenta un espectro trópico amplio, y se alimenta principalmente de organismos bentónicos; entre ellos: poliquetos, ostrácodos, copépodos, cumáceos, tanaidáceos, foraminíferos, nemátodos, vegetales y materia orgánica. Diapterus olisthostomus (Goode y Bean, 1882) N.v.: "Mojarra blanca", "Cabucha"
Gerres olisthostomus Goode y Bean, Proc. U.S. Nat. Mus., 1882, 5:423 (Indian River Fla.) Diagnosis. Cuerpo corto profundo y romboidal, comprimido, dorso muy elevado, profundidad 1.8 a 2.2 en la LP. Cabeza 2.6 a 3.2 en la LP; perfil anterior corto y muy convexo; boca algo grande, hocico no muy puntiagudo, 2.8 a 4.0 en la cabeza; ojos moderadamente grandes 2.4 a 3.7 en la longitud cefálica y 3.6 en la distancia entre el origen de la anal y la base de la caudal; maxilar sobrepasando ligeramente el margen anterior de la pupila porción expuesta oblonga, ancha y alargada, 3.7 en la cabeza y 5.2 en la distancia predorsal surco premaxilar ancho y escamado. Distancia predorsal 2.0 en la LP y 1.0 a 1.1 en la profundidad del cuerpo. Preopérculo aserrado, preorbital entero. Branquiespinas pequeñas y delgadas, 10 a 14 en la rama inferior del primer arco. D IX, 10, la segunda espina fuerte, más corta que la tercera, 1.1 a 1.3 en la longitud cefálica. A III, 8-9, la segunda espina muy fuerte, más corta que la tercera y segunda dorsal, 1.3 a 1.8 en la cabeza y 1.9 en :la distancia predorsal; base de la anal 1.4 en la longitud cefálica. Pectorales grandes, algo más que la cabeza, 3.0 en la LP, sobrepasando la vertical trazada por el ano. Pélvicas más cortas que la longitud cefálica, 3.6 en la LP, sobrepasando la abertura anal. De 37 a 42 escamas en serie longitudinal por debajo de la línea lateral. Color. Cuerpo uniformemente plateado, ligeramente más oscuro hacia el dorso con reflejos verde olivo, claro ventralmente. Aletas pectorales y caudal claras; caudal con puntuaciones. Aleta dorsal gris claro con margen negro y puntuaciones. Aletas pélvicas y anal amarillas y con puntuaciones. Los ejemplares juveniles presentan 4 o 5 barras verticales sobre los costados que desaparecen rápidamente con la edad. En fijador pueden presentar tonalidades café oscuro en el cuerpo. Las aletas pélvicas y anal se tornan amarillo pálido, las demás aletas claras, sin embargo, no se pierden las puntuaciones ni el margen negro de la dorsal espinosa. Distribución. En el Atlántico, desde el noroeste de Florida, EUA, Golfo de México y Mar Caribe, hasta Bahía en Brasil. En el área de estudio: localidad CHB (Fig. 9). Material examinado. 1 ejemplar de 105 mm de longitud total. Colección de referencia depositada en el Laboratorio de Ictiología y Ecología Estuarina del Inst. de Ciencias del Mar y Limnología de la Universidad Nacional Autónoma de México.Catálogo CCML-PF 001954 (Camp.). Observaciones taxonómicas. Algunas consideraciones taxonómicas sobreDiapterus olisthostomus en la costa Atlántica de América y Golfo de México han sido hechas principalmente por: Jordan y Evermann (1896), Meek e Hildebrand (1925), Cervigon (1966), Jordan y Evermann (1969), Reséndez (1970 y 1973), Dahl (1971), Hoese y Moore (1977), Guitart (1977), Fischer (1978) y Castro-Aguirre (1978). La mayor parte de los caracteres morfométricos tomados en cuenta para la determinación de esta especie se translapan con los deDiapterus rhombeus (Cuvier) y Diapterus evermanni Meek e Hildebrand, presentándose por lo tanto, confusión entre estas especies para separarlas claramente. Además la revisión taxonómica de D. olisthostomushecha en el presente estudio revela que son pocas las diferencias morfométricas que existen para determinar correctamente la especie. Sin embargo, D. olisthostomus puede separarse de D. rhombeus yD. evermanni por tener de 10 a 14 branquiespinas en la rama inferior del primer arco, número que varía en las otras dos especies. La profundidad en esta especie es similar a la de D. rhombeus, por lo que no se toma aquí como un carácter diferencial; no así para D. evermanni especie en la cual la profundidad es menor con respecto a las otras dos. La aleta anal deD. olisthostomus está formada por tres espinas pudiendo tener de 8 a 9 radios, esta última característica es muy importante para esta especie puesto que es la única del géneroDiapterus en el Golfo de México y Atlántico que presenta tres espinas a diferencia deD. rhombeus yD. evermanni que únicamente tienen dos. 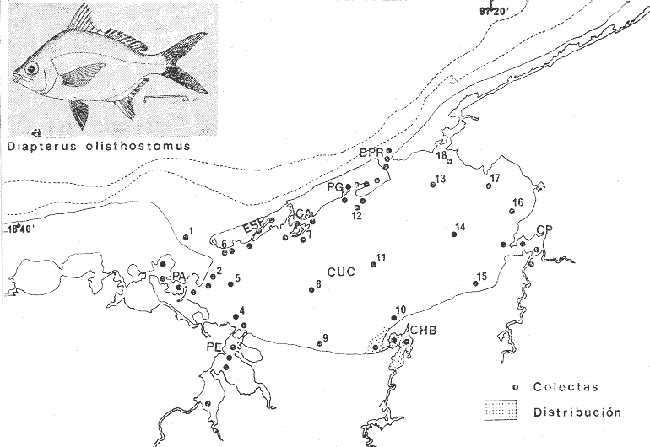 Fig. 9. Mapa de distribución de Diapterus olisthostomus en la Laguna de Términos, en relación a las estaciones de colecta en las distintas localidades. Aunque el número de escamas por debajo de la línea lateral que presenta D. olisthostomus es muy similar con el deD. rhombeus, en D. evermanni es diferente, siendo menor para esta última especie. Las aletas pélvicas y anal son de color amarillo en esta especie, igualmente paraD. rhombeus, sin embargo, en D. evermannison completamente claras. El surco premaxilar de D. olisthostomus es escamado, por el contrario, en las otras dos especies éste está totalmente libre de escamas. Autores como Jordan y Evermann (1896), Meek e Hildebrand (1925), Reséndez (1970) y Hoese y Moore (1977), consideran el número de ciegos terminales del estómago para diferenciar esta especie, no obstante los caracteres morfológicos externos de D. olisthostomus permiten identificarla rápidamente. Observaciones ecológicas. Distribución y abundancia. Al parecer Diapterus olisthostomus es una especie rara en la Laguna de Términos por su baja frecuencia. Sólo se ha colectado 1 ejemplar en el sistema Chumpan-Balchacali durante la época de lluvias. Sin embargo, ha sido reportada con mayor abundancia en la Sonda de Campeche por Yáñez-Arancibia et al. (1980c). No se ha vuelto a colectar y no se cuentan con registros de biomasa. Es considerada como visitante ocasional. Diapterus olisthostomus al igual que otras mojarras se comporta como consumidor de primer orden. Meek e Hildebrand (1925) y Fischer (1978) reportan algunos de los grupos trópicos que consume esta especie, pero no la clasifican dentro de alguna categoría ictiográfica; sin embargo, las observaciones hechas en el presente trabajo sobre esta especie permite clasificarla también como consumidor de primer orden. Su alimentación se basa principalmente en organismos bentónicos como son: poliquetos, anfípodos, cumáceos, tanaidáceos, copépodos, isópodos, pequeños decápodos, así como vegetales y materia orgánica. Género EugerresJordan y Evermann, 1927 Eugerres plumieri (Cuvier, 1830) N.v.: "Mojarra rayada", "Mojarra rayada"
Gerres plumieri Cuvier In :Cuvier y Valendennes, Histoire Naturalle des Poissons, 1830 6:452, lám. 167 (Puerto Rico, Antillas). Diagnosis. Cuerpo corto profundo y romboidal dorso muy elevado profundidad 1.8 a 2.1 en la LP. Cabeza 2.5 a 3.0 en la LP; perfil anterior convexo por encima de los nostrilos, recto encima de los ojos, muy convexo en la nuca; boca algo grande, hocico no muy puntiagudo, 3.2 a 4.3 en la cabeza; ojos grandes, 2.4 a 3.9 en la longitud cefálica y 3.1 a 4.3 en la distancia entre el origen de la anal y la base de la caudal; maxilar llegando ligeramente más allá de la vertical del margen anterior de la pupila, porción expuesta oblonga, ancha y grande, 4.1 a 6.3 en la cabeza y 5.6 a 7.6 en la distancia predorsal; surco premaxilar ancho y libre de escamas. Distancia predorsal 1.8 a 2.3 en la LP y 0.9 a 1.1 en la profundidad del cuerpo. Preopérculo y preorbital aserrados (excepto en los jóvenes, el preorbital es entero). Branquiespinas pequeñas y delgadas, 14 a 16 en la rama inferior del primer arco. D IX, 10, la segunda espina muy fuerte alta y ensanchada, más grande que la tercera, 0.9 a 1.7 en la longitud cefálica. A II-III, 7-9, la segunda espina muy fuerte larga y ensanchada, más grande que la tercera, 1.0 a 2.2 en la cabeza y 1.6 a 3.1 en la distancia predorsal; base de la anal 1.4 a 1.9 en la longitud cefálica. Pectorales casi iguales a la longitud de la cabeza, 2.5 a 3.3 en la LP, sobrepasando la vertical trazada por el ano. Pélvicas más cortas que la longitud cefálica, 3.4 a 4.5 en la LP, sobrepasando la abertura anal. De 35 a 42 escamas en una serie longitudinal por debajo de la línea lateral. Color. Cuerpo uniformemente plateado con reflejos azul verdosos hacia el dorso, claro ventralmente. Aletas pectorales casi doradas. Aleta dorsal gris claro con margen negro en la porción espinosa y con puntuaciones. Aletas pélvicas y anal amarillas con puntuaciones salpicadas. Aleta caudal negruzca y con puntuaciones. Hocico negruzco. Alrededor de 12 estrías longitudinales oscuras sobre los costados siguiendo las hileras de las escamas. En fijador el cuerpo puede mostrarse claro pero generalmente no se pierde el color plateado. Las aletas presentan tonos más pálidos de los habituales, sin embargo, no se pierden las puntuaciones de éstas, el margen negro de la dorsal espinosa ni el color negruzco del hocico. Las estrías de los costados pueden tomar tonos cafés pero siguen siendo evidentes. Distribución. En el Atlántico se encuentra desde el norte de Florida, EUA, Golfo de México y Mar Caribe, hasta Bahía, Brasil. En el área de estudio; localidades PE, CHB, PG, ESP y CUC (Fig. 10). Material examinado. 50 ejemplares de 65 a 295 mm de longitud total. Colección de referencia depositada en el Laboratorio de Ictiología y Ecología Estuarina del Instituto de Ciencias del Mar y Limnología de la Universidad Nacional Autónoma de México. Catálogo CCML-PF 001710/1715 (Camp.). Observaciones taxonómicas. Algunas consideraciones taxonómicas sobreEugerres plumieri en la costa Atlántica de América y Golfo de México han sido hechas principalmente por: Jordan y Evermann (1896), Meek e Hildebrand (1925), Cervigon (1966), Jordan y Evermann (1969), Reséndez (1970 y 1973), Dahl (1971), Guitart (1977), Fischer (1978) y Castro-Aguirre (1978). Esta es la única especie del Género Eugerres presente en la Laguna de Términos, no obstante, tiene especies afines en el Golfo de México como son Eugerres mexicanus (Steindachner). que está restringida a las aguas dulces de la vertiente del Atlántico, Cuenca del Río Coatzacoalcos y Cuenca del Río Usumacinta (Jordan y Evermann, 1896, Meek e Hildebrand 1925 y Castro-Aguirre 1978); asi como también Eugerres brasilianus (Cuvier) reportada para la parte noroccidental del Golfo de México (Meek e Hildebrand 1925, Darnell 1962 y Castro-Aguirre 1978); sin embargo, poco se conoce acerca de su presencia o ausencia de estas especies en lagunas costeras mexicanas del Golfo (Castro-Aguirre 1978). 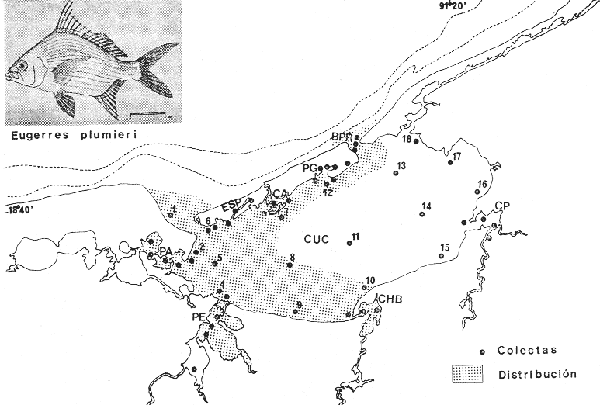 Fig. 10. Mapa de distribución de Eugerres plumieri en la Laguna de Términos, en relación a las estaciones de colecta en las distintas localidades. Tanto E. plumieri, E. mexicanus así comoE. brasilianus son muy parecidos entre sí y pueden confundirse si no se conoce bien. No obstante., la revisión taxonómica deE. plumieri hecha en el presente estudio permite separar con seguridad a la misma, por consiguiente esta especie se diferencia deE. mexicanus por tener una profundidad corporal mayor. El cuerpo de esta última especie es más alargado que el deE. Plumieri. La profundidad de E. brasilianus es similar a la de E. plumieri por lo que no se toma como un carácter diferencial. La dimensión relativa de la cabeza con respecto a la LP es mayor enE. plumieri, asimismo el número de branquiespinas del primer arco también es mayor. Tanto la segunda espina dorsal como la segunda anal de E. Plumieri son muy grandes y más largas que la tercera espina correspondiente a cada aleta, por el contrario, enE. mexicanus y E. brasilianus estas espinas generalmente tienen menos longitud y son más pequeñas con respecto a su tercera. Las aletas pectorales de E. plumieri son grandes y lo suficientemente largas para sobrepasar el origen de la aleta anal, mientras que en E. brasilianusestas aletas solamente llegan poco más allá del ano y en E. mexicanus jamás rebasan la abertura anal. El número de escamas por debajo de la línea lateral en E. mexicanus es mayor con respecto al de E. plumieriyE. brasilianus, además de que las escamas del cuerpo son pequeñas en comparación a las de estas dos últimas especies, siendo este último carácter aparentemente importante para diferenciar a E. mexicanus(Meek e Hildebrand, 1925). La coloración es muy similar en las tres especies, sin embargo, las aletas pectorales y pélvicas de E. plumieri son amarillas, siendo claras para E. mexicanus y E. brasilianus, especies en las que, las estrías longitudinales de los costados del cuerpo no son tan conspicuas como en E. plumieri. E. mexicanusasí como E. brasilianus constituyen especies muy poco estudiadas en el Golfo de México y consecuentemente poca información se tiene acerca de revisiones taxonómicas, estudios biológicos y ecológicos, asimismo de la presencia o ausencia en lagunas costeras mexicanas del Golfo. Castro-Aguirre (1978), ha señalado que es necesaria una revisión taxonómica urgente para E. mexicanus por presentar características morfológicas muy peculiares, sugiriendo que dicha revisión tal vez demuestre la necesidad de erigir un nuevo género para esta especie, asimismo, el hacerse comparaciones con otras especies afines como Eugerres awlae Schultz, de Venezuela. Sin embargo, tan necesaria revisión no solo debe de restringirse a E. mexicanussino extender a todo el géneroEugerres principalmente en la costa del Atlántico. Autores como Meek e Hildebrand (1925) y Reséndez (1970 y 1973) consideran para E. plumieri el número de ciegos terminales del estómago como caracteres importantes para su determinación, no obstante, los caracteres morfológicos externos de esta especie permiten identificarla rápidamente. Observaciones ecológicas. Distribución y abundancia. La distribución, abundancia numérica y biomasa de Eugerres plumieri se muestra en las tablas 8 y 9 para las épocas de lluvias y secas respectivamente. Para ambas épocas el número de individuos y la biomasa fluctuaron irregularmente de acuerdo a la localidad. Aun cuando se aprecia en las tablas una baja abundancia, estuvo mejor representada en los sistemas Fluvio-Lagunares.  TABLA 8 EUGERRES PLUMIERI ABUNDANCIA ESTIMADA DURANTE LA ÉPOCA DE LLUVIAS (1976-1977) EN LAS DOS ÁREAS ESTUDIADAS  TABLA 9 EUGERRES PLUMIERI ABUNDANCIA ESTIMADA DURANTE LA ÉPOCA DE SECAS (1976-1977) EN LAS DOS ÁREAS ESTUDIADAS Por lo que respecta a biomasa Amezcua-Linares y Yáñez-Arancibia (1980), reportan para la época lluviosa en los sistemas Fluvio-Lagunares Chumpan-Balchacali y Palizada-del Este una biomasa total de 0.91 gm-² con un promedio de 0.03 gm-². Para la época de sequía, sólo para Palizada-del Este un valor de 0.07 gm-². Vargas Maldonado et al. (1981), reportan para el interior de la Isla del Carmen en Estero Pargo una biomasa total de 0.90 gm-², durante la época de secas. No aparecieron ejemplares en las colectas de la época lluviosa. Es importante destacar que Eugerres plumieri es la cuarta especie de mojarra más abundante en la laguna. Se distribuye principalmente en la parte norte y este en ambientes dulceacuícolas y de mayor influencia marina, tolerando amplios rangos de variación de salinidad y temperatura. Es un recurso económico en el área. Frecuencia de la especie y utilización de la laguna. El análisis de la frecuencia hecho por algunos autores ha permitido dar diversos valores para esta especie de acuerdo a la localidad y época climática. Amezcua-Linares y Yáñez-Arancibia (1980), reportan para los sistemas Fluvio-Lagunares, Chumpan-Balchacah y Palizada-del Este en ambas épocas climáticas una frecuencia del 38.57, considerando que estos sistemas son utilizados como áreas de crianza y/o alimentación. Por su parte, Vargas Maldonadoet al. (1981), reportan a esta especie como visitante ocasional para el interior de la Isla del Carmen durante la época de secas en Estero Pargo. De acuerdo a la categorización ictiotrófica de las especies, Eugerres plumieri es considerada como consumidor de primer orden por Amezcua-Linares y Yáñez-Arancibia (1980), Yáñez-Arancibia et al. (1980a) y Vargas Maldonado et al. (1981). Su espectro trópico es muy amplio y se alimenta principalmente de: poliquetos, ostrácodos, copépodos, anfípodos, isópodos, cumáceos, pequeños decápodos, gasterópodos, pelecípodos, vegetales y materia orgánica. DISCUSIÓN
DISTRIBUCIÓNLa distribución de las especies de la familia Gerridae en la Laguna de Términos está determinada por la gran diversidad de habitat existentes. De esta manera los Gerridae se distribuyen de acuerdo al siguiente esquema correlacionados con los parámetros ambientales a lo largo de las épocas climáticas presentes: Eucinostomus gula yDiapterus rhombeus presentan patrones de distribución semejantes, aunque la primera especie es la única que abarca toda la laguna (Figs. 4 y 7). Habitan ambientes de manglar, pastos marinos y macroalgas asociados a sedimentos limosos y/o arenosos en rangos de salinidad de 2 a 39 ppm, el mínimo valor corresponde a el sistema Palizada-del Este y el máximo a Puerto Real (Bravo-Núñez y Yáñez-Arancibia, 1979 y Amezcua-Linares y Yáñez-Arancibia, 1980). Se encuentran en rangos de temperatura que van de 19 a 33°C y transparencia del 20.4 al 100%. Diversos autores han reportado a estas especies en lagunas costeras del Golfo de México y Mar Caribe. Eucinostomus gulaha sido reportada para la Laguna Madre de Tamaulipas (Hildebrand, 1958), siendo una laguna hipersalina con un promedio de 50 ppm de salinidad, Springer y Woodburn (1960), la reportan para la Bahía de Tampa, Florida, en rangos de salinidad de 3.7 a 25.1 ppm; sin embargo, fue usualmente colectada en salinidades de 24 a 32 ppm; y en rangos de temperatura de 12.8 a 32.5°C. Reid (1954), la menciona para los Cayos de Cedar, Florida, en salinidades de 9.7 a 33.8 ppm y temperaturas de 7.2 a 32.2°C. Kilby (1955), la ubica en Bayport, Florida, en salinidades de 5 a 15 ppm. Springer y Mc Earlean (1962), la colectan en los Cayos de Matecumbe, Florida, en salinidades de 34.5 a 37.9 ppm y temperaturas de 19.9 a 33.6°C. Gallawayet al. (1972), la citan para las aguas estuarinas de Texas. Castro-Aguirre (1978), sólo la reporta para la Laguna Madre de Tamaulipas, Laguna de Términos y Río Champotón en Campeche. Meek e Hildebrand (1925) Cervigon (1966), Dahl (1971) y Perry y Perry (1974) en diversos trabajos sobre la costa de Centroamérica, Venezuela y Colombia, han reportado queE. gula penetra a los ríos. Por otra parte, esta especie ha sido colectada también con frecuencia en ambientes neríticos. Springer y Bullis (1956), la mencionan para las costas de Florida, Hoese y Moore (1977), para las aguas de Texas y Louisiana, Sánchez Gil, et al. (1981) la reportan en la Sonda de Campeche. Eucinostomus gula ha sido registrada con anterioridad para la Laguna de Términos por Zarur (1962), Castro-Aguirre (1978), Bravo-Núñez y Yáñez-Arancibia (1979), Amezcua-Linares y Yáñez-Arancibia (1980), Yáñez-Arancibia et al. (1980a) y Vargas Maldonado et al. (1981). Diapterus rhombeus es reportada por Hildebrand (1958) para la Laguna Madre de Tamaulipas. Esta laguna es hipersalina con un promedio de 50 ppm de salinidad. Reséndez (1970 y 1973), la reporta en las Lagunas de Tamiahua y Alvarado, Veracruz. En la primera en aguas someras con fondos fangosos y arenosos en de 12.1 a 18.2 ppm y temperaturas de 24.5 a 27.8°C. En Alvarado se encontró en fondos fangosos con vegetación sumergida en salinidades de 0.6 a 10.6 ppm y temperaturas de 24 a 28.8°C. Chávez et al. (1976), la han reportado para las Lagunas de Mandinga, Veracruz, en salinidades menores a 2 ppm y temperaturas de 29 a 32°C. Castro Aguirre (1978), la reporta para el Río Tuxpan y Laguna de la Mancha, Veracruz, en salinidades de 18.0 a 37.1 ppm. Es citada también para aguas de Centroamérica, Colombia, Venezuela y Cuba por Meek e Hildebrand (1925), Cervigon (1966), Dahl (1971), Perry y Perry (1974) y Guítart (1977). Diapterus rhombeus es reportada por Sánchez Gil et al. (1981) para la Sonda de Campeche y con anterioridad para la Laguna de Términos por Amezcua-Linares y Yáñez-Arancibia (1980), Yáñez-Arancibia et al. (1980a) y Vargas Maldonado et al. (1981). Eucinostomus argenteus yEucinostomus melanopterus comparten distribuciones parecidas dentro de la laguna (Figs. 5 y 6). Habitan ambientes de manglar, pastos marinos y macroalgas asociados a sedimentos limosos y/o arenosos en rangos de salinidad de 2 a 33°C y transparencia del 20.4 al 80%. Entre los trabajos que se refieren a estas especies en lagunas costeras del Golfo de México y Mar Caribe se citan.los siguientes: Hildebrand (1958) reporta aEucinostomus argenteus entre los peces de la Laguna Madre de Tamaulipas. Chávez (1972), la menciona para el Río Tuxpan y Laguna de Tampamachoco, Veracruz, en salinidades de 12.8 a 37.4 ppm y temperaturas de 18.7 a 31.0°C. Castro-Aguirre (1978), la cita también para las lagunas arriba mencionadas y para la Laguna de Tamiahua en salinidades de 27.9 a 37.1 ppm. Springer y Woodburn (1960), la reportan para la Bahía de Tampa, Florida, en salinidades 3.2 a 35.1 ppm y temperaturas de 12.8 a 32.5°C. En este mismo trabajo se hace mención que Herald y Strickland (1949) citan esta especie en las aguas dulces de Homasassa Springs en los Ríos Caloosahatchee y Santa Lucía en Florida en salinidades menores a 1 ppm. Springer y Mc Erlean (1962) citan a E. argenteus en los Cayos de Matecumbe, Florida, en salinidades de 34.5 a 37.9 ppm y temperaturas de 19.9 a 33.6°C. Gallaway et al. (1972), la reportan para las aguas estuarinas de Texas y Louisiana. No obstante, es citada por Cervigon (1966) y Dahl (1971) en aguas costeras de Venezuela y Colombia. Eucinostomus argenteus ha sido reportada para la Sonda de Campeche por Sánchez-Gil et al. (1981), y registrada con anterioridad para la Laguna de Términos por Bravo-Núñez y Yáñez-Arancibia (1979) y Amezcua-Linares y Yáñez-Arancibia (1980) y Yáñez-Arancibiaet al. (1980a). Eucinostomus melanopterus es reportada por Darnell (1962), para la Laguna de Chairel en Tampico en salinidades de 1 a 4 ppm, en fondos arenosos con vegetación sumergida. Reséndez (1970, 1971 y 1973), la ubica en las Lagunas de Tamiahua, Alvarado y en el Arrecife la Blanquilla en Veracruz. En Tamiahua fue capturada en aguas someras con fondos arenosos en salinidades de 29.4 a 36.4 ppm y temperaturas de 27.7 a 30.0°C. En Alvarado se colectó en fondos fangosos con abundancia de Ruppia marítima en salinidades de 11.5 ppm y temperaturas de 27.9°C. En la Blanquilla, Reséndez destaca su presencia en la laguna arrefical de esta comunidad. Chávez et al. (1976), la menciona para las Lagunas de Mandinga, Veracruz, en salinidades de 2 ppm. Castro-Aguirre (1978), la ha citado también para Tampico, Tamps., Tuxpan, Ver., Laguna de Alvarado, Ver., y Laguna de Términos, Camp. Un importante reporte sobre esta especie es el que hace Toledo et al (1978), encontrándola en las aguas dulces del Río Uxpanapa, Ver., en el Ejido Agustín Melgar, ubicado a 85 km en línea recta hacia el sur de la Ciudad de Minatitlán, muy cerca de los límites de los Estados de Veracruz, Oaxaca y Chiapas, sin duda se comprueba la gran capacidad euritermohalina que tiene esta especie. Cervigon (1966), Dahl (1971) y Perry y Perry (1974), también la han encontrado en los ríos. Eucinostomus melanopterus ha sido colectada en la Sonda de Campeche (Yáñez-Arancibia et al. 1980b) y registrada con anterioridad para la Laguna de Términos por Castro-Aguirre (1978), Amezcua-Linares y Yáñez-Arancibia (1980), Yáñez-Arancibia et al. (1980a) y Vargas Maldonado et al. (1981). Eugerres plumieri se distribuye principalmente hacia la parte noreste de la laguna (Fig. 10). Habita ambientes de manglar y pastos marinos asociados a sedimentos limosos y/o arenosos en rangos de salinidad de 2 a 39 ppm, temperaturas de 19 a 33°C y transparencia del 20.4 al 80%. Esta especie es citada por Darnell (1962), para el área de Tampico; sin embargo, no entrega datos ambientales asociados a su colecta. Reséndez (1970 y 1973), la refiere para las Lagunas de Tamiahua y Alvarado, Ver. En Tamiahua fue capturada en fondos fangosos y vegetación de manglar, en salinidades de 12.1 a 22 ppm y temperaturas de 28 a 29.3°C. Para Alvarado se encontró en fondos fangosos en salinidades de 0. 1 a 7.2 ppm y temperaturas de 24.2 a 30.2°C. Chávez (1972), la menciona para el Río Tuxpan en salinidades de 31.2 ppm y temperaturas de 32.5°C. Castro-Aguirre (1978), ha citado aE. plumieri para Tampico, Tamps., Tuxpan, Ver., y Laguna de Términos, Camp. Por otro lado Springer y Woodburn (1960), la han encontrado en la Bahía de Tampa, Florida, en salinidades de 3.7 a 24.8 ppm y temperaturas de 21.1 a 32.5°C, asimismo la colectaron en el Río Santa Lucía en la costa este de Florida en salinidades menores de 1 ppm. Según Springer y Woodburn esta especie sólo había sido reportada por Lonnberg (1894), para Punta Gorda en las costas de Florida e Hildebrand (1958) en Bronwsvile, Texas y Laguna Madre de Tamaulipas, sin embargo estos datos son imprecisos. Por otra parte, es citada por Meek e Hildebrand (1925), Cervigon (1966), Dahl (1971) y Guitart (1977) para aguas de Panamá, Venezuela, Colombia y Cuba. Eugerres plumieri no ha sido reportada todavía para la Sonda de Campeche, sin embargo, está registrada para la Laguna de Términos por Castro-Aguirre (1978), Amezcua-Linares y Yáñez-Arancibia (1980), Yáñez-Arancibia et al. (1980a) y Vargas Maldonado et al. (1981). Diapterus evermanni yGerres cinereus se distribuyen sólo en el interior de la Isla del Carmen (Fig. 4 y 8). Habitan ambientes de manglar y pastos marinos asociados a sedimentos limosos, arenosos y arcillosos en rangos de salinidad de 21 a 26 ppm y temperaturas de 24 a 28.3°C y transparencia del 40 al 80%0. D. evermanni ha sido reportada por Chávez et al. (1976) para las Lagunas de Mandinga, Ver., en salinidades de 2 ppm. Castro-Aguirre (1978), la menciona para la Laguna de la Mancha, Ver., en salinidades de 1 ppm, destacando que entra a la desembocadura de los ríos. Yáñez-Arancibia et al. (1980a), y Vargas Maldonado et al. (1981) la incluyen dentro de los peces de la Laguna de Términos. Al parecer son los únicos registros para localidades mexicanas. Meek e Hildebrand (1925), la encuentra en aguas de Panamá y Cervigon (1966) en aguas venezolanas. De hecho la distribución de D. evermannisólo abarca de Veracruz, México, hasta Venezuela. Gerres cinereus es encontrada por Chávezet al. (1976), en las Lagunas de Mandinga, Ver., en salinidades de 2 ppm. Castro-Aguirre (1978), la ubica en Tampico, Tamps., y en la Laguna de Términos, Camp. Otros autores como Gallaway et al. (1972), la citan para las aguas estuarinas de Texas y Hoese y Moore (1977) para Texas y Louisiana. Reséndez (1975) y Jordan et al. (1978) la encuentran en las Lagunas de Nichupté y Bojórquez en el Caribe Mexicano en el Estado de Quintana Roo. Ha sido reportada también para aguas de Panamá (Meek e Hildebrand, 1925), de Venezuela (Cervigon, 1966), de Colombia (Dahl, 1971) y de Cuba (Guitart, 1977). Randall (1968) y Bohlke y Chaplin (1970) la encuentran como componente de comunidades coralinas, en el Caribe y en las Islas Bahamas respectivamente. Según Meek e Hildebrand (1925),Gerres cinereus se encuentra mejor representada en el Atlántico que en el Pacífico. No obstante, ha sido estudiada como especie importante en el Pacífico Mexicano por Berdegué (1954 y 1956), Ramírez-Hernández (1965), Ramírez-Hernández y Arvizú (1965), Ramírez-Hernández y Páez (1965), Carranza (1970), Carranza y Amezcua-Linares (1971), Amezcua-Linares (1972 y 1977), Yáñez-Arancibia (1975b) y Yáñez-Arancibia (1978). Sólo ha sido registrada con anterioridad para la Laguna de Términos por Castro-Aguirre (1978), Yáñez-Arancibia et al. (1980a) y Vargas Maldonado et al. (1981). Diapterus olisthostomus sólo se encontró en el sistema Fluvio-Lagunar Chumpan-Balchacah (Fig. 9). Habita ambientes de manglar asociados a fondos limosos y/o arcillosos en salinidades de 10 a 28 ppm, temperaturas de 24 a 31°C y transparencia del 20.4%. A pesar de haberse encontrado restringidamente en la Laguna de Términos, es sumamente importante en otras lagunas costeras del Golfo de México y a lo largo de su patrón de distribución. Hildebrand (1958), la cita en la Laguna Madre de Tamaulipas en aguas hipersalinas con un promedio de 50 ppm. Chávez (1972) y Chávez et al. (1976), la reportan para el Río Tuxpan y Lagunas de Mandinga, Ver. En Tuxpan fue colectada en salinidades de 37. a 36.7 ppm y temperaturas de 18.0 a 31.°C. En Mandinga fue encontrada en salinidades menores de 2 ppm. Reséndez (1970 y 1973) la reporta en las Lagunas de Tamiahua y Alvarado, Ver. En la primera fue colectada en aguas someras con fondos fangosos y vegetación de manglar en salinidades de 20.7 a 36.3 ppm y temperaturas de 27.4 a 29.2°C. En Alvarado, fue encontrada en fondos fangosos en salinidades de 1.2 a 19.1 ppm y temperaturas de 22.8 a 28.2°C. Castro-Aguirre (1978), la cita para la Laguna Madre de Tamaulipas, Tuxpan, Ver., y Tamiahua. Ha sido encontrada también en aguas de Texas y Louisiana (Hoese y Moore, 1972). Otros autores como Meek e Hildebrand (1925), la citan para aguas de Panamá, Cervigón (1966) en Venezuela, Dah,l (1971) en Colombia y Guitart (1977), en aguas cubanas. Yáñez-Arancibia et al. (1980c), la reportan para la Sonda de Campeche. Diapterus olisthostomuses una especie rara en la Laguna de Términos y se tienen muy pocos registros de ella para esta área. Con base en este análisis, debe destacarse que las mojarras de la familiaGerridae poseen una gran capacidad euritermohalina, como lo demuestra la discusión presentada sobre su distribución. Factores tales como la salinidad y la temperatura no son limitantes para su distribución en la laguna, la utilización de ésta es principalmente como zona de reclutamiento de juveniles, que necesitan de sus áreas protegidas para crecimiento, protección y alimentación, aún más, algunas especies comoEucinostomus gula y Diapterus rhombeusson consideradas como típicas estuarinas por su alta frecuencia a lo largo de todo el año. Otras como Eucinostomus melanopterus, Diapterus evermanni, Diapterus olisthostomus y Gerres cinereus, sólo penetran ocasionalmente a la laguna; no obstante su baja frecuencia, la utilizan con la misma finalidad como otras mojarras,Eucinostomus argenteus y Eugerres plumieri, presentan un comportamiento cíclico o estacional dependiendo de las condiciones ambientales prevalecientes en la laguna. ABUNDANCIAEucinostomus gulaes la especie más abundante de las mojarras de la laguna. No existen marcadas diferencias en sus valores de biomasa de una época climática a otra ni entre el interior de la Isla del Carmen y los sistemas Fluvio-Lagunares. Se puede decir que presenta una abundancia homogénea, representada principalmente por tallas juveniles y algunas adultas a lo largo de todo el año. Vargas Maldonado et al. (1981), la clasifican entre las especies dominantes de las ictiocomunidades de Estero Pargo y Cayo e igual comportamiento le asignan Amezcua-Linares y Yáñez-Arancibia (1980) en los Sistemas Fluvio-Lagunares. La abundancia de juveniles encontrados sugiere una alta fecundidad de esta especie, ya que como lo han hecho notar Flores-Coto y Álvarez-Cadena (1980), se registra la presencia de larvas de la especieEucinostomus sp. cerca de la Boca de Puerto Real y dentro de la propia laguna. Es muy probable que estas larvas correspondan a E. gula sugiriendo que la especie migra a desovar a la zona nerítica. Este mismo comportamiento ha sido observado por Springer y Woodburn (1960) en la Bahía de Tampa y por Springer y Mc Erlean (1962) en los Cayos de Matecumbe en Florida, donde reportan gran cantidad de juveniles. Los valores máximos de biomasa reportados para esta especie fueron de 0.68 gm-² en la época seca y 0.65 gm-² en la lluviosa, ambos valores para el sistema Candelaria-Panlau. El mínimo corresponde a Boca Puerto Real con 0.001 gm-² en la época lluviosa. Diapterus rhombeuses la segunda especie más abundante de las mojarras, encontrándose bien representada en los sistemas Fluvio-Lagunares a lo largo de todo el año, principalmente por tallas juveniles (Amezcua-Linares y Yáñez-Arancibia, 1980). A pesar de su amplia distribución no constituye un recurso económico como tal. Por otra parte también es importante en el interior de la Isla del Carmen donde se registró abundantemente durante la época de secas con tallas poco mayores. Tiene poca representatividad en la época lluviosa (Vargas Maldonado et al. 1981). Probablemente D. rhombeus migre hacia la zona nerítica donde realiza su desove al comienzo de la época de lluvias. El máximo valor de biomasa reportado para esta especie fue de 0.42 gm-² para Estero Pargo en la época de secas y los mínimos corresponden a Candelaria-Panlau y Palizada-del Este, ambas localidades con 0.001 gm-², durante las épocas de lluvias y secas respectivamente. Reséndez (1970 y 1973), reporta para las Lagunas de Tamiahua y Alvarado, Ver., una gran abundancia de esta especie; no obstante, la encuentra representada también en tallas juveniles, por lo cual su importancia económica es pequeña. La tercera especie más abundante es Eucinostomus argenteus, encontrándose representada por tallas juveniles hacia los sistemas Fluvio-Lagunares, y por tallas subadultas y algunas adultas en las localidades Estero Pargo y Bajos del Cayo; sin embargo, los valores de abundancia registrados son irregulares a la largo del año. El máximo valor de biomasa reportado para esta especie fue de 0.07 gm-² en la época de lluvias para Boca Puerto Real, y el mínimo corresponde a Bajos del Cayo en la época lluviosa con 0.0004 gm-². Chávez (1972), ha reportado queE. argenteus se encuentra bien representada en el Río Tuxpan y Laguna de Tampamachoco en Veracruz, Springer y Woodburn (1960), la citan como especie importante por su gran abundancia en la Bahía de Tampa, Florida; sin embargo, su representación es principalmente por tallas juveniles. Eugerres plumiericonstituye la cuarta especie de mojarra más abundante de la Laguna de Términos. Se encuentra representada tanto por tallas juveniles como por adultas, sin embargo su abundancia es muy irregular a lo largo del año. El máximo valor de biomasa registrado corresponde a Estero Pargo con 0.90 gm-² en la época de secas, el mínimo a Palizada-del Este con 0.07 gm-². A pesar de que, el valor máximo de biomasa que presenta E. plumieri es mayor con respecto al deEucinostomus gula, Diapterus rhombeus yEucinostomus argenteus, su abundancia numérica es mucho menor que la de estas especies, ya que de E. plumierisolo se colectaron 59 ejemplares en comparación a los 3 929 deE. gula, 547 a D. rhombeus y 165 deE. argenteus; sin embargo, el valor de biomasa mayor deE. plumieri se debe a que fueron colectadas en su mayoría tallas adultas con un peso superior con respecto al conjunto de juveniles de las otras especies. Por lo tanto E. plumierireviste importancia comercial en el área. Reséndez (1970 y 1973) ha reportado para las Lagunas de Tamiahua y Alvarado, Ver., que esta especie es importante por su gran abundancia a lo largo de todo el año, representando para estas áreas un gran recurso económico. Chávez (1972), la encuentra bien representada para el Río Tuxpan y Laguna de Tampamachoco, Ver. Otros autores como Hildebrand (1958), Springer y Woodburn (1960), Darnell (1962) y Castro-Aguirre (1978), la citan para otras lagunas costeras del Golfo de México; sin embargo, no es tan abundante como en las Lagunas de Veracruz. Diapterus evermanni, Gerres cinereus, Eucinostomus melanopterus y Diapterus olisthostomus son especies raras y poco frecuentes en la Laguna de Términos, por tal motivo los registros de abundancia y biomasa son escasos y muy aislados. De las cuatro especies mencionadas solo D. olisthostomus reviste una gran importancia comercial por su considerable abundancia en otras lagunas costeras del Golfo de México, principalmente en Tamiahua y Alvarado (Reséndez, 1970 y 1973) en el Río Tuxpan y Laguna de Tampamachoco, Ver. Chávez (1972) Laguna Madre de Tamaulipas (Hildebrand, 1958) y Tampico, Tamaulipas (Castro-Aguirre, 1978). Conclusiones1. Las mojarras de la familia Gerridae están bien representadas en la Laguna de Términos, juegan un papel muy importante en la estructura y función de las comunidades ictiofaunísticas por su diversidad, distribución y abundancia. 2. Existen 8 especies en el área: Gerres cinereus, Eucinostomus gula, Eucinostomus argenteus, Eucinostomus melanopterus, Diapterus rhombeus, Diapterus evermanni, Diapterus olisthostomus y Eugerres Plumieri. 3.Eucinostomus gula, Eucinostomus argenteus, Eucinostomus malanopterus, Diapterus rhombeus y Eugerres plumieri, se distribuyen en los subsistemas del interior de la Isla del Carmen en áreas protegidas deRhizophora mangle y Thalassia testudinumy en el de los Sistemas Fluvio-Lagunares en ambientes de manglar y arrecifes deCrassostrea virginica, tolerando rangos de salididad de 2 a 39 ppm y temperaturas de 19 a 33°C. 4.Gerres cinereus y Diapterus evermanni, se distribuyen solo en el subsistema del interior de la Isla del Carmen en áreas con mayor influencia marina asociados a pastos marinos y ambientes de manglar, en salinidades mayores a 25 ppm. 5.Diapterus olisthostomus solo fue encontrado en los sistemas Fluvio-Lagunares en ambientes de manglar y arrecifes de ostión y puede tolerar rangos muy bajos de salinidad. 6. La distribución presentada permite establecer que las especies de la familia Gerridae tienen una gran capacidad euritermohalina. 7. La biomasa de las especies en orden de importancia y sus valores máximos fueron: Eugerres plumieri0.90 gm-² Eucinostomus gula 0.68 gm-² Diapterus rhombeus 0.42 gm-² Eucinostomus argenteus 0.076 gm-² Diapterus evermanni 0.05 gm-² Gerres cinereus 0.02 gm-² Eucinostomus melanopterus0.001 gm-² No se cuenta con un valor de biomasa para el caso de Diapterus olisthostomus. 8. Las especies, Gerres cinereus, Eucinostomus melanopterus, Diapterus evermanni yDiapterus olisthostomus son consideradas visitantes ocasionales de la Laguna de Términos. 9.Eucinostomus argenteus, Diapterus rhombeus y Eugerres plumieri utilizan la laguna como área de crianza y/o alimentación. 10. La única especie que es considerada como residente permanente de la laguna por su gran abundancia, alta frecuencia y con registros de ictioplancton es Eucinostomus gula. AgradecimientosLos autores agradecen a Agustín Ayala-Castañares, José Luis Rojas Galavíz, Antonio García-Cubas y Alfredo Laguarda Figueras, por la minuciosa revisión del manuscrito y por sus valiosos comentarios y sugerencias a este trabajo. A los compañeros del Laboratorio de Ictiología y Ecología Estuarina por sus críticas a lo largo de la realización de este estudio, especialmente a Silvia Díaz Ruiz, por su ayuda en la discusión taxonómica y en la confección de tablas y mapas; asimismo, a Irma Vargas Maldonado, Patricia Sánchez-Gil y Lía Mallard Colmenero por su cooperación en diversas etapas del procesamiento del material. El apoyo económico para la realización del presente estudio fue brindado por el Instituto de Ciencias del Mar y Limnología de la UNAM y parcialmente por el Programa Regional de Desarrollo Científico y Tecnológico de la Organización de los Estados Americanos (OEA) a través de su Oficina de Proyectos Especiales en Washington. LITERATURAAMEZCUA-LINARES, F.,Tesis profesional.Aportación al conocimiento de los peces de Agua Brava, Nayarit. Fac. Ciencias, Univ. Nal. Autón. México.1972. 209 p. ---, An. Centro Cienc. del Mar y Limnol. Univ. Nal. Autón. México Generalidades ictiológicas del sistema lagunar costero de Huizache-Caimanero, Sinaloa, México.1977.1-25.4 (1) AMEZCUA-LINARES, F. y A. YÁÑEZ-ARANCIBIAAn. Centro Cienc. del Mar y Límnol. Univ. Nal. Autón. MéxicoEcología de los sistemas fluvio-lagunares asociados a la Laguna de Términos. El habitat y estructura de las comunidades de peces.1980.69-118.7 (1) BAPAT, S. y V. y D. V. BALProc. Indian Acad. Sci., Sec. BThe food of some young fishes from Bombay.1952.78-92.35(2) BASHEERUDDIN, S. y K. NAGAPPAN NAYAR Indian J. Fish.,A preliminary study of the juveniles fishes of the coastal waters off the Madras. city.1961.168-188.8 (1) BEEBE, W. y J. TEE VANZoologica The fishes of Portand Prince, with a summary of the known species of marine fishes of the island of Haiti and Santo Domingo.1928.1-279.10 (1) BERDEGUE, J., Tesis profesional.Contribución al conocimiento de los peces de importancia comercial en la costa noroccidental de México.Esc. Nal. Ciencias Biológicas, IPNMéxico1954. 360 p. ---, Secretaría de Marina, Dir. Gral. Pes. Ind. Com, México Peces de importancia comercial en la costa noroccidental de México.1956.345 p. BOHLKE, J. E. y CH. G. CHAPLINFishes of the Bahamas and Adjacent Waters.Livingston Publishing, Co.,Pennsylvania1970. 771 p. BOSCHUNG, H. T., Ph. D. Dissertation Univ.The fishes of the Mobile Bay and the Gulf coast of Alabama.Alabama.1957a.626 p. ---, J. Alabama Acad. Sci., Some interesting records of marine fishes of Alabama.1957b.33-44.29 BRAVO-NÚÑEZ, E. y A. YÁÑEZ-ARANCIBIAAn. Centro Cienc. del Mar y Limnol. Univ. Nal. Autón. México Ecología de la Boca de Puerto Real, Laguna de Términos. I. Descripción del área y análisis estructural de las comunidades de peces.1979.125-182.6 (1) BROOK, J. M., Ph. D. Dissertation, Univ. of MiamiSome aspects of the trophic relationships among the higher consumers in a seagrass community (Thalassia testudinum Koning) in Card, Sound, Florida. 1975. 133 p. ---, Trans. Amer. Fish. Soc.,Trophic relationship in a seagrass community (Thalassia testudinum), in Card Sound, Florida. Fish diets in relation to macrobenthic and cryptic faunal abundance. 1977.219-229.106(3) CARR, W. E. S. y C. A. ADAMSTrans. Amer. Fisher. Soc., Food habits of juvenile marine fishes occupying seagrass beds in the estuarine zone near Crystal river, Florida.1973.511-540.102(3) CARRANZA, J., Informe Final Secretaría de Recursos Hidráulicos e Instituto de Biología, Univ. Nal. Autón. México. Contrato de estudios No. El69-51(Mimeografiado). Informe final sobre la primera etapa del estudio de la fauna ictiológica y depredadores del camarón en las lagunas y esteros de los planes pilotos Escuinapá y Yavaros. 1970.28 p. CARRANZA, J. y F. AMEZCUA-LINARES Informe Secretaría de Recursos Hidráulicos e Instituto de Biologia. Univ. Nal. Autón. México. Contrato de Estudios No. May-EST-7:58-80.(Mimeografiado). Plan Nayarit, S.R.H. Informe de avance de trabajo, incluyendo información ecológica básica, datos de distribución de postlarvas e informe preliminar sobre fauna ictiológica en el Sistema Teacapán-Agua Brava, 2da. Parte. 1971a. ---, Informe final Secretaría de Recursos Hidráulicos e Instituto de Biología. Univ. Nal. Autón. México. Contrato de Estudios No. May-EST-7:88-115. (Mimeografiado). Plan Nayarit, S.R.H. Resultados finales de hidrología, plancton y fauna ictiológica en el Sistema Teacapán-Agua Brava. 2da. Parte.1971b.177-199.1968 CASTRO-AGUIRRE, J. L.,Dir. Gral. Inst. Nal. Pesca, México. Serie Científica Catálogo sistemático de los peces marinos que penetran a las aguas continentales de México con aspecto zoogeográficos y ecológicos.1978.1-298.19 CERAME-VIVAS, M. J. Inc.,Mangroves of Puerto Rico.P. F. 2. Properties, Inc., y M. J. Cerame-Vivas, Inc.1974.64 p. CERVIGON, M. F., Los Peces Marinos de Venezuela. Estación de Investigación Marinas de Margarita, Fundación La Salle de Ciencias Naturales, Caracas, Monogr.1966.1-951. 11 y 12 CHACKO, P. L, Proc. Indian Acad. Sci., Sec. B:8397. Food and feeding habits of the fishes of the Gulf of Mannar. 1949.29(3) CHÁVEZ, E. A.,Mem. IV Congr. Nal. Ocean. México Notas acerca de la ictiofauna del estuario del río Tuxpan y sus relaciones con la temperatura y la salinidad. In: Carranza, J. (Ed.) 1972.177-199. CHÁVEZ, A. E., B. A. VELEZ, F. A. SÁNCHEZ Y J. S. CHÁVEZ Mem. I. Reunión Latinoamericana sobre Ciencia y Tecnología de los Océanos, Veracruz Prospección ecológica de las Lagunas de Mandinga, Veracruz.México1976.140-162. CURRAN, H. W., Ph. D. Dissertation, Univ. of Michigan A systematic revisíon of the gerrid fishes refered to the genus Eucinostomus, with a discussion of their distribution and speciation. 1942.183 p. DAHL, G., Los Peces del Norte de Colombia.INDERENABogotá1971. 391 p. DARNELL, R. M., Publ. Inst. Alar. Sci., Univ. Texas Fishes of the Rio Tamesi and related coastal lagoons in East-Central México.1962.299-365.8 DAY, F., Fishes of India. William Dawson and Sonst Ltd., (Rep. in 1958).London1878. DAY, J. W., W. G. SMITH, P. R. WAGNER, Y W. C. STOSVE, Publ. No. LSU-56-720-01 Center of Wetland Resources Louisiana State University, Baton Rouge, La.: Community structure and carbon budget of a salt marsh and shallow bay estuarine system in Louisiana.1973.70 p. FISCHER W. FAO Species Identification Sheets for Fishery Purpouses. Western Central Atlantic (Fishing area 31) FISCHER W. (Ed.) FAORoma1978.2. FLORES-COTO, C. y J. ÁLVAREZ-CADENA An. Centro Cienc. del Mar y Limnol. Univ. Nal. Autón. MéxicoEstudios Preliminares de distribución y Abundancia del Ictioplancton en la Laguna de Términos, Campeche.1980.67-68.7 (2) GALLAWEY, B. J., J. C. PARKER y D. MOORE Key to the Estuarine and Marine Fishes of Texas.Deparment of Wild life and Fisheries Sciences. Texas A & M. University1972.162 p. GIERLOFF-EMDEN, H. G.,In: Orbital Reinote Sensing of Coastal and Offshore Environments: A Mannual of Interpretation.Laguna de Terminos and Campeche Bay, Gulf of Mexico.Berlin1977.78-89. GUITART, J. D., Sinopsis de los Peces Marinos de Cuba.Serie OceanológicaAcademia de Ciencias de Cuba1977.325-608.3 HEAL, E. J., W. ODUM, y D. C. TABB Miami Geol. Soc. Mem.,Mangroves in the estuarine food chain.Environment of South Florida, Present and Past. In: Gleason, J. (Ed.) 1974.182-189.2 HERALD, E. S. y R. S. STRICKLANDQuart. Jour. Fla. Aca. Sci., An annoted list of fishes of Homosassa Springs, Florida.1949.99-109. 11(4) HILDEBRAND, H. H.,Publ. Inst. Mar. Sci. Univ. TexasA study of the fauna of the brown shrimp. (Pennaeus aztecus Ives) grounds in the western Gulf of Mexico. 1954.233-366.3(2) ---, Publ. Inst. Mar. Sci. Univ. Texas A study of the fauna of the pink shrimps (Penaeus duorarum Burkenroad) ground in the Gulf of Campeche.1955.1515-173.4 (1) ---, Ciencia. México.,Estudios biológicos preliminares sobre la Laguna Madre de Tamaulipas. 1958.151-173.17(7-9) HOESE, H. D. y R. H. MOOREFishes of the Gulf of México, Texas, Louisiana and Adjacent Waters. Texas A & M University Press. College Station and London1977. 327 p. JHINGRAN, V. G., Bull. Centr. Inl. Fish. Res. Inst.,Report on the fisheries of the Chilka lake 1963. 1-113.11957-60. JHINGRAN, V. G. y A. V. NATARAJANBull. Centr. Inl. Fish. Res. Inst., Final Report on the fisheries of the Chilka lake 1966.8.(1957-65). JOB, T. J., Rec. Indian Mus., An investigation on the nutrition of the perches of the Madras coast.1940.289-364.12 JORDAN, D. S. y B. W. EVERMANNBull. U.S. Nat. Mus., The Fishes of North and Middle America.1896-1960.1-3313.2 (47) ---, American Food and Game Fishes.Dover Publications, Inc., New YorkU.S.A.1969.two p. JORDAN, E. M., M. ANGOT y R. DE LA TORRE An. Centro Cienc. del Mar y Limnol. Univ. Nal. Autón. MéxicoProspección biológica de la Laguna de Nichupté (Cancún), Q. Roo, México: Nota científica.1978.179-188.5 (1) KILBY, J. D., Tul. Stud. Zool., The fishes of two Gulf coastal marsh arcas of Florida.1955.176-247 p.2(8) LONNBERG, A. J. E., Ofvers. Kongl. Akad. Forh., List of fishes observed and collected in South Florida.1894.109-131.3 MEEK, E. S. y S. F. HILDEBRAND., Field Mus. Nat. Hist. Publ., Zool. Ser., The marine fishes of Panama.1925.1-1045 p.15 (226) ODUM, W. E., Sea Grant Program Tech. Bull. Univ. Miami Pathways of energy flow in a South Florida estuary.1971.1-162.7 ODUM, W. E. y E. J. HEALDBull. Mar. Sci., Trophic analysis of and estuarine mangrove community.1972.671-738.22 (3) ---, Estuarine Research. Chemistry., Biology and the Estuarine System. The detritus-based food web of an estuarine mangrove community. In: Cronin, E. L. (Ed.) Academic Press Inc., New York1975.265-286.1 PERRY, J. A. II y S. D. PERRYLos Peces Comunes de la Costa Atlántica de Costa Rica.Univ. de Costa Rica. Fac. Cienc. y Letras. Departamento de Biología1974.1-224. (7) PHLEGER, F. B. y AYALA-CASTAÑARES Bull. Am. Ass. Petrol. Geol., Processes and history of Terminos Lagoon, Mexico.1971.2130-2140.55(2) PICCIOLO, A., Copeia The development of the anterior interhemal cone of Eucinostomus argenteus Baird y Girard.1960.70-71.(1) PRABHAKARO RAO, A. V.,J. Mar. Biol. Ass. IndiaObservations on the food and feeding habits of Gerres oyena (Forskal) and Gerres filamentosus Cuvier from the Pulicat Lake with notes on the food allied species. 1968.332-346.10 (2) RAMÍREZ-HERNÁNDEZ, E., An. Inst. Nal. Inv. Biol. Pesq., México Estudio preliminar sobre los peces marinos de México. 1965.258-292.1 RAMÍREZ-HERNÁNDEZ, E. y J. ARVIZU An. Inst. Nal. Inv. Biol. Pesq., México Investigaciones ictiológicas en las costas de Baja California. I.1965.293-324.1 RAMÍREZ-HERNÁNDEZ, E. y J. PÁEZ An. Inst. Nal. Inv. Biol. Pesq., México Investigaciones ictiológicas en las costas de Guerrero. I.1965.327-354.1 RANDALL, J. E., Caribbean Reef Fishes. T. H. F. Publications, Inc.New Jersey1968. 318 p. REID, G. K., Bull. Mar. Sci. Gulf Caribb., An ecological study of the Gulf of Mexico fishes in the vecinity of Cedar Key, Florida.1954.1-94.4 (1) ---, Texas J. Sci., A summer study of the biology and ecology of East Bay Texas.1955.316-343.7 (3) RESÉNDEZ, M. A., An. Inst. Biol. Univ. Nal. Autón. México, Ser. Cienc. del Mar y Limnol. Estudio de los peces de la Laguna de Tamiahua, Veracruz, México. 1970.79-146.11 (1) ---, An. Inst. Biol. Univ. Nal. Autón. México, Ser. Cienc. del Mar y Limnol., Peces del arrecife "La Blanquilla", Veracruz, México. 1971.1-64.12(1) ---, Revta. Soc. Mex. Hist. Nal.,Estudio de los peces de la Laguna de Alvarado, Veracruz, México. 1973.183-281.31 ---, An. Inst. Biol. Univ. Nal. Autón. México, Serie Zoológica Lista preliminar de los peces colectados en las Lagunas de Nichupté y Bojórquez, Q. Roo, México.1975.87-100.16 (1) SÁNCHEZ-GIL P., A. YÁÑEZ-ARANCIBIA y F. AMEZCUA-LINARES An. Instituto Cienc. del Mar y Limnol. Univ. Nal. Autón. México Diversidad, distribución y abundancia de las especies y poblaciones de peces demersales de la Sonda de Campeche (Verano, 1978).1981.209-240. 8(1) SMITH, H. M., North Carolina., Geology and Economics, Survey The fishes of North Carolina Raleigh.1907.1-453.2 SPRINGER, S. y H. R. BULLISFish. Wildl. Serv., Spec. Sci. Rept., Collections by the "Oregon" in the Gulf of Mexico. U.S., 1956.1-134.196 SPRINGER, V. G. y K. D. WOODBURNFla. St. Bd. Conserv. Alar. Lab. Prof. Pap., An ecological study of the fishes of Tampa Bay arca.1960.1-104.1 SPRINGER, V. G. y A. J. Mc ERLEAN Bull. Mar. Sci. Gulf Caribb.,Seasonality of fishes on a South Florida Shore.1962.39-60.12 (1) SUBRAHMANYAN, C. B. y S. H. DRAKEBull. Mar. Sci., Studies on the animal communities in two north Florida salt marshes. Part I: Fish communities.1975.445-465.25(4) SWINGLE, H. A., Alabama Mar. Res. Bull.,Biology of Alabama estuarine areas: Cooperative Gulf of México estuarine inventary.1971.1-128.5 TOLEDO, V. M., J. CABALLERO, A. ARGUETA, P. ROJAS, E. AGUIRRE, J. VICON, S. MARTÍNEZ y MA. E. DIAZBióticaEstudio Botánico y ecológico de la región del río Uxpanapa, Veracruz. El uso múltiple de la selva basado en el conocimiento tradicional.1978.85-101.3 (2) VARGAS MALDONADO, L, A. YÁÑEZ-ARANCIBIA, y F. AMEZCUA-LINARESAn. Inst. Cienc. del Mar y Limnol. Univ. Nal. Autón. México Ecología y estructura de las comunidades de peces en áreas de Rhizophora mangle y Thalassia testudinum de la Isla del Carmen, Laguna de Términos, Sur del Golfo de México.1981.241-266.8 (1) WALKER, T. H. y W. R. NELSON Alabama Dep. Conserv., Seafoods Div. Typed File. Rep., Occurrence of vertebrates in the 1963-64 estuarine survey. In: Preliminary Marine Ecological Study of Mobile Bay. 1964.138-184. YAÑÉZ-ARANCIBIA, A., An. Centro Cienc. del Mar y Limnol. Univ. Nal. Autón. México Sobre los estudios de peces en las Lagunas costeras: Nota Científica.1975a.53-60.2 (1) ---, In: Informe Final 2da. Etapa Programa Uso de la Zona Costera de Michoacán y Guerrero. Convenio Comisión del Río Balsas, S.R.H., y Centro Cienc. del Mar y Limnol. Univ. Nal. Autón. México. Contrato de Estudios No. OC-E-03-74Relaciones tróficas de la fauna ictiológicas del sistema lagunar costero de Guerrero y aspectos parciales de dinámica de poblaciones de los peces de importancia comercial, 230 p.,1975b.750 p. 71 figs. ---, Symposium on Progress in Marine Research in the Caribbean and Adjacent Regions. Fish culture in coastal lagoons: Perspectives in Mexico. In: Stewart, H. B. (Ed.) Papers on Fisheries, Aquaculture and Marine Biology. FAO Fish. Rep.,CaracasVenezuela1977.529-547.(200) 12-16 july 1976. ---, Centro Cienc. del Alar y Limnol. Univ. Nal. Autón. México, Publ. Esp.,Taxonomía, Ecología y Estructura de las Comunidades de Peces en Lagunas Costeras con Bocas Efímeras del Pacifico de México. 1978.1-306.2 YAÑÉZ-ARANCIBIA A. y R. S. NUGENT An. Centro Cienc. del Mar y Limnol. Univ. Nal. Autón. México El papel ecológico, de los peces en estuarios y lagunas costeras.1977.107-114.4 (1) YÁÑEZ-ARANCIBIA, A. y J. W. DAY, Jr.,Oceanologica Acta (en prensa). Ecological characterizadon of Terminos Lagoon a tropical lagoon-estuarine system in the Southern Gulf of México. Proc. International Symposium. on Coastal Lagoons, ISCOL-UNESCO '81BordeauxFrance1982. Sept. 7-14, 1981. YÁÑEZ-ARANCIBIA, A., F. AMEZCUA-LINARES Y J. W. DAY Estuarine Perspectives. Fish community structure and function in Terminos Lagoon, a tropical estuary in the Southern Gulf of México. In: V. Kennedy (Ed.) Academic Press Inc. New York1980a.465-482. YAÑÉZ-ARANCIBIA, L. A., F. AMEZCUA-LINARES, J. L. ROJAS GALAVIZ, P. SÁNCHEZ GIL, I. VARGAS MALDONADO, A. L. LARA DOMÍNGUEZ, S. DÍAZ Ruiz, A. AGUIRRE LEÓN y L. MALLARD COLMENERO In: Proyecto de Investigación Análisis Comparativo de las Poblaciones de Peces de la Sonda de Campeche y la Laguna de Términos Antes y Después del Derrame Petrolero del Pozo IXTOC-I (primer informe) (Mimeografiado). Evaluación de las Poblaciones de Peces de Importancia Comercial Antes del Derrame Petrolero del Pozo IXTOCI.PCEESC/UNAM/CCMI,(PI)1980b. 57 p. 15 tablas, 25 figs. YÁÑEZ-ARANCIBIA, L. A, F. AMEZCUA-LINARES, J. L, ROJAS GALAVIZ, A. L. LARA DOMÍNGUEZ P. SÁNCHEZ GIL, I. VARGAS MALDONADO, A. AGUIRRE LEÓN, S. DÍAZ Ruiz, M. ÁLVAREZ RUBIO, H. ÁLVAREZ GUILLÉN y M. TAPIA GARCÍAIn: Proyecto de Investigación Análisis Comparativo de las Poblaciones de Peces de la Sonda de Campeche y de la Laguna de Términos Antes y Después del Derrame Petrolero del Pozo IXTOC-I (Segundo Informe). (Mimeografiado). Análisis Preliminar de las Poblaciones de Peces de la Laguna de Términos y Sonda de Campeche durante las Campañas de Febrero a Agosto de 1980. PCEESC/UNAM/ CCMI,(SI)1980c.26 p., 6 tablas, 7 figs. ZARUR-MENEZ, A., Revta. Soc. Méx. Hist. Nat., Algunas consideraciones geobiológicas de la Laguna de Términos, Campeche, México.1962.51-70.23 ZAURANECH, J. B., Tesis Master of Science in Oceanography. The gerrid fishes of Eucinostomus in the Eastern Pacific. Univ. California, La jolla 1967.74 p.
|

