|
CONTRIBUCIÓN AL
CONOCIMIENTO DEL ICTIOPLANCTON DE LA LAGUNA DE ALVARADO, VERACRUZ
Trabajo recibido el 9 de diciembre de 1980 y aceptado para su
publicación el 2 de julio de 1981.
CÉSAR FLORES-COTO
Instituto de Ciencias del Mar y Limnología, UNAM, Laboratorio de
Zooplancton. Contribución 280 del Instituto de Ciencias del Mar y
Limnología, UNAM.
MA. DE LOURDES MÉNDEZ VARGAS
Instituto de
Ciencias del Mar y Limnología, UNAM, Laboratorio de Zooplancton.
Contribución 280 del Instituto de Ciencias del Mar y Limnología,
UNAM.
Se estudia la abundancia y distribución del
ictioplancton en la Laguna de Alvarado, Veracruz, en una serie de 17 estaciones
de muestreo a través de un ciclo anual. Se hicieron arrastres
horizontales con dos redes cónicas, ambas de 50 cm de diámetro de
boca, con mallas de 500 µ y 250 µ respectivamente. Atendiendo a
su hidrología se establecieron cuatro áreas en las cuales la
composición ictioplanctónica cualitativa y cuantitativa fue
distinta. Se obtuvieron 9,947 larvas de las que se determinaron 17 familias, 27
géneros y 26 especies. La condición hipohalina del sistema
lagunar determinó que la diversidad específica y la
proporción de larvas provenientes del mar hayan sido muy bajas. Se
estima que la laguna no es una área de crianza propicia para especies
marinas. Anchoa mitchilli, Dormitator maculatus y Gobiosoma
bosci, por su permanencia y abundancia durante todo el año,
son consideradas como los representantes más típicos de este
sistema.
The abundance and distribution
of ichthyoplankton in the Laguna de Alvarado, Veracruz, was studied at 17
sampling stations through an annual cyde. Two conical nets of 50 cm in diameter
of the mouth, with 250 and 500µ meshes were utilized in horizontal
draggings to obtaín the samples. According to hydrology, four arcas were
established: in such arcas the ichthyoplanktonic composition was different,
both qualitatively and quantitatively. There were obtained 9,947 larvae:
belonging to 17 families, 27 genera and 26 species. The hypohaline condition of
the lagoon determined that both the proportion or larvae and the diversity of
species comming from the sea were very low. It is estimated that the lagoon is
not adequate for nursering of marine species.Anchoa mitchilli,
Dormitator maculatus and Gobiosoma bosci, were abundantly and
constantly present in the lagoon throughout the year and are therefore
considered as the most typical representatives of this
system.
Es un hecho conocido que las lagunas costeras se encuentran entre las zonas de más alta productividad en el mundo (Margalef, 1969) y que representan áreas de gran potencial pesquero, sobre todo por la presencia de especies de importancia comercial entre las que destacan camarones, ostiones y diversas especies de peces. Ya que México posee 12,555 kilómetros cuadrados de lagunas costeras (Cárdenas, 1969), éstas podrán ser en la medida que se estudien, conozcan y manejen adecuadamente, una mayor fuente de alimento de lo que son actualmente. Algunos investigadores, Yáñez-Arancibia y Nugent (1977) entre otros, han señalado la importancia del papel ecológico de los peces en las lagunas costeras, así como la necesidad de incrementar las investigaciones en cuanto a su biología y ecología. Lo que resulta obvio en las investigaciones ictiológicas es que la dinámica de poblaciones, las interacciones ecológicas y en general la biología de las especies no podrá estar completa ni bien entendida sin el conocimiento de los estadios larvarios de éstas. La importancia y necesidad del conocimiento del ictioplancton en las lagunas costeras llevó al planteamiento del presente trabajo, que tiene como objetivos básicos, el estudio de la abundancia y distribución de las larvas de peces a través de un ciclo anual y el establecimiento en lo posible, de sus relaciones con factores abióticos tales como salinidad y temperatura. ANTECEDENTESEntre las más importantes lagunas costeras en el Golfo de México, tanto por su extensión como por sus pesquerías, se pueden mencionar la de Términos (Campeche), Alvarado (Veracruz), Tamiahua (Veracruz) y la Laguna Madre (Tamaulipas); de éstas la mas estudiada es la primera y en donde en la última década se han realizado el mayor número de investigaciones. De la Laguna de Alvarado, área de estudio del presente trabajo, se pueden mencionar los estudios de Villaloboset al. (1966) sobre hidrografía y productividad; Villalobos et al. (1969), acerca de las relaciones entre las postlarvas planctónicas dePenaeus sp y los caracteres ambientales; Villaloboset al. (1975), de estudios hidrobiológicos; Signoret (1969), que trabajó sobre las medusas; Reséndez (1973), cuyo estudio versó sobre los peces de dicha laguna y el de Gómez-Aguirre (1977) en el que compara el plancton de las lagunas de Alvarado, Términos y Tamiahua. Pocos trabajos se han realizado en nuestro país sobre ictioplancton, del Golfo de México y particularmente de la plataforma continental mexicana, se tiene referencia de los estudios de Juárez (1975); Olvera et al. (1975), Padilla (1975) y Ayala (1980). En relación a las lagunas costeras, sólo se puede referir el de Flores-Coto y Álvarez-Cadena (1980) realizado en la Laguna de Términos, fuera del cual no existen más antecedentes en el resto de tales cuerpos de agua. ÁREA DE ESTUDIOLa Laguna de Alvarado, está localizada al sureste del Estado de Veracruz, entre los paralelos 18°44 y 18°52'15'' de latitud norte y los meridianos 95°44' y 95°57' de longitud oeste (Fig. 1). Tiene forma alargada y es más o menos paralela a la línea de costa; su longitud aproximada es de 26 Km. desde la punta oeste de la Isla Vives, hasta el extremo noroeste de la Laguna Camaronera. En realidad el área de estudio es un complejo, lagunar que comprende un cuerpo de agua central que se comunica mediante la Boca de Tragadero hacia el sur, con la Laguna de Tlaexcoyacan en la que desembocan los ríos Blanco y Camarón; hacia el noroeste, pasando por la pequeña Laguna de Buen País y mediante un estrecho canal, se une con la Laguna Camaronera. Se conecta al mar mediante una sola boca, situada en su extremo noroeste. A la fecha está casi terminado un canal en la porción más estrecha de la barra arenosa que comunicará a la Laguna Camaronera directamente con el mar. Los principales ríos que desembocan en la laguna son el Papaloapan que lo hace en la porción sureste del sistema, los ríos Camarón y Blanco ya señalados y el Río Acula, que se conecta directamente con el cuerpo de agua central. La Laguna de Alvarado ha sido descrita por varios autores, como García (1970), Reséndez (1973) y Villalobos et al. (1966).
Figura 1 MATERIAL Y MÉTODOSEl material para el presente estudio provino de cuatro colectas trimestrales en la Laguna de Alvarado con lo que se cubrió un ciclo anual. Los cruceros de muestreo se efectuaron los días 13 y 14 de marzo, 19 y 20 de junio, 10 y 11 de septiembre y 3 y 4 de diciembre de 1979, que corresponden a las porciones finales de las estaciones de invierno, primavera, verano y otoño respectivamente. La red de estaciones fue diseñada de manera que se abarcó la totalidad de la laguna (el cuerpo de agua central y las lagunas de Tlalixcoyan y Camaronera) y áreas críticas como la boca y desembocadura de los principales ríos (Fig. 1). Para la obtención de las muestras se utilizaron dos redes tipo trapecio con 50 cm de diámetro de boca: una, con luz de malla de 500 µ y 150 cm de longitud; la otra, con malla de 250 µ y 200 cm de largo. La idea de utilizar dos tipos de malla fue obtener con la segunda información complementaria para la primera, en virtud de que muchas larvas pequeñas y huevos pueden escapar de la de 500 µ. En cada red se colocó un contador de flujo. Con el objeto de establecer si las diferencias en cuanto al número de larvas capturadas con los dos tipos de mallas era significativa, se aplicó la prueba estadística de análisis de varianza de clasificación doble. En los cuadros de resultados de este análisis (Tabla 1) se observa que la F experimental no rebasa el valor de la F teórica con un intervalo de confianza del 9517, en todos los cruceros, lo que indica que las diferencias en el número de larvas capturadas con ambas mallas no son significativas (P > .05). 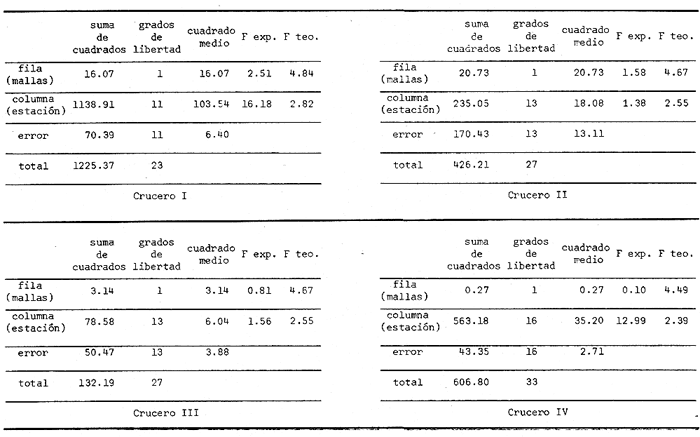 TABLA 1 CUADROS DE RESULTADOS DEL ANÁLISIS DE VARIANZA APLICADO AL NÚMERO DE LARVAS POR 100 m2 CAPTURADOS CON LAS MALLAS DE 250 my Y 500 my Los arrastres fueron horizontales y en círculo durante 5 minutos y a una profundidad de 5 a 10 cm de la superficie salvo algunas excepciones. Las muestras se fijaron con formalina al 5% neutralizada con borato de sodio. Los datos para la salinidad y temperatura fueron obtenidos de muestras colectadas con una botella Van-Dorn de 3 lts. La temperatura fue leída con un termómetro de cubeta, la salinidad mediante un refractómetro (American Optical). La profundidad se midió con una sondaleza. En el laboratorio se procedió a separar las larvas utilizando un microscopio estereoscópico, colocándolas en frascos homeopáticos con sus respectivas etiquetas para su ulterior identificación. Para poder realizar conteos de radios, espinas y vértebras, se empleó la siguiente técnica, modificada de Taylor (1967): se lavaron los organismos para quitarles el formol (durante 15 minutos aproximadamente), se tiñeron con alizarina y se sumergieron en sosa al 10% de 12 a 24 horas, hasta que las vértebras se vieran claramente. Posteriormente se colocaron en glicerina para su preservación. RESULTADOS Y DISCUSIÓN
CONDICIONES HIDROGRÁFICAS
Temperatura La temperatura a finales de invierno tuvo una variación de 22.5 a 27°C. Los registros más bajos se tuvieron en la zona que abarca Punta Chica y desembocadura del Río Acula, hacia el este del sistema. En el cuerpo central se obtuvo un núcleo de altos valores frente a Punta Grande (26°C) (Fig. 2A). A finales de primavera se tuvieron las temperaturas más altas de todos los cruceros; en esta ocasión la variación fue de 22.8 a 33°C y el área de mayor calentamiento se encontró en la ribera suroeste del cuerpo central de la laguna. Las aguas más frías vuelven a presentarse en la porción sureste de la laguna sobre todo frente a la desembocadura del Río Papaloapan (Fig. 2B). Durante el verano el registro térmico fue de 25 a 31°C Una masa de agua de alta temperatura se localizó hacia la parte central del cuerpo principal de la laguna, decreciendo hacia sus alrededores. Los valores más bajos se tuvieron en el extremo sureste del sistema (Fig. 2C). A finales de otoño la temperatura se presentó bastante homogénea en el cuerpo central de la laguna, fluctuando de 19.3 a 19.8°C y a diferencia de los cruceros anteriores es en la región sureste en donde se presentan los valores más altos (Fig. 2D). La variación anual de la temperatura muestra un claro ciclo con sus épocas cálidas en primavera-verano y las frías en otoño-invierno (Fig. 3). Es típico de las regiones templadas y frías tener los menores valores en invierno; sin embargo, como los muestreos del presente trabajo se efectuaron hacia finales de cada estación, ésto trajo como consecuencia que las temperaturas más bajas fueran registradas en el otoño (19.2 a 21.1°C) y no en el invierno (22.5 a 270). Parece obvio que no se muestreó durante el mes más frío ni el más cálido, que corresponden a enero y mayo respectivamente, como ha sido reportado por varios autores. La distribución de la temperatura esta influenciada por tres factores: el primero es el aporte de los ríos hacia la porción sureste del sistema; el segundo son las corrientes que introducen parte de las aguas marinas por la boca de la laguna y el tercer factor es la topografía. Este último determina el calentamiento superficial de las aguas, como parecen indicarlo los mayores registros de temperatura en las áreas someras, como la boca de la Laguna Camaronera o cualquier otra área de las riberas. Salinidad La distribución de la salinidad durante el invierno mostró dos áreas básicamente distintas (Fig. 4A): la primera al este de Punta Chica, con 0 a 2%, en la zona de influencia del Papaloapan y la boca de la laguna. La porción oeste tuvo un núcleo de alta salinidad (8%) frente a Punta Grande; los valores de isohalinas que se extienden en líneas más o menos paralelas a la ribera, decrecen en dirección suroeste desde el mencionado núcleo. La Laguna de Buen País estuvo claramente influenciada por esta masa de agua. Tlalixcoyan presentó 2.0%, tanto en la superficie como en el fondo, mientras que en la Laguna Camaronera los registros de 2.0% en la superficie se localizaron cerca de su boca y 0.0%, hacia su parte media., En el fondo también se encontró 2.0%. 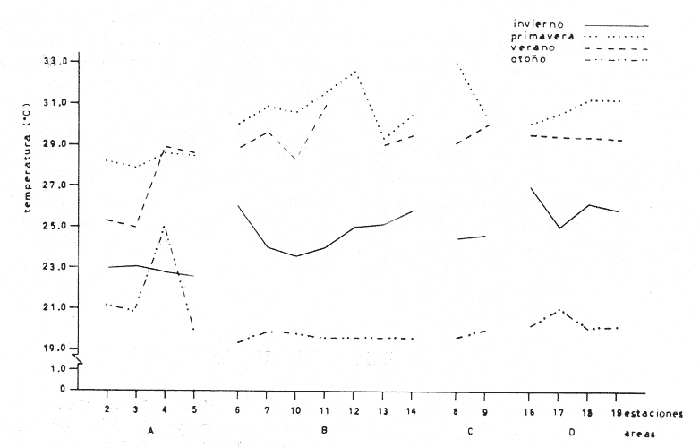 Fig. 3. Variación anual de la temperatura en el sistema lagunar de Alvarado. La salinidad durante la primavera (Fig. 4B) mostró una zona que va de Punta Pepe hasta la Laguna de Buen País, con. 5.0%; desde esta localidad y hasta la porción sureste se presentó una dilución con los registros más "bajos en la Boca de Tragadero con 1.0%. También en esta ocasión y en la porción este, a partir de Punta Chica, los valores decrecieron desde 2.0%, hasta 0.0%, tanto en la desembocadura del Papaloapan como en la boca de la laguna. La distribución de la salinidad en el fondo mostró un claro gradiente norte-sur, con una amplia área de 4.0%, valor que decreció hacia la Boca de Tragadero en donde se registraron 0.0%. Cabe señalar que en el fondo de la estación 2 se tuvo el, registro más alto de salinidad durante todo el ciclo anual con 30.0%. En Tlalixcoyan se encontraron 2.0%, en el fondo en tanto que en superficie solo alcanzó 1.0%;la Laguna Camaronera resultó muy homogénea con 4.0%. Durante el verano, la salinidad tanto en superficie como en fondo presentó un gradiente casi perpendicular al eje mayor de la laguna con su máximo valor de 4.0% en la Laguna de Buen País, desde donde decreció hacia el extremo este del sistema con 2.0%, (Fig. 4C). 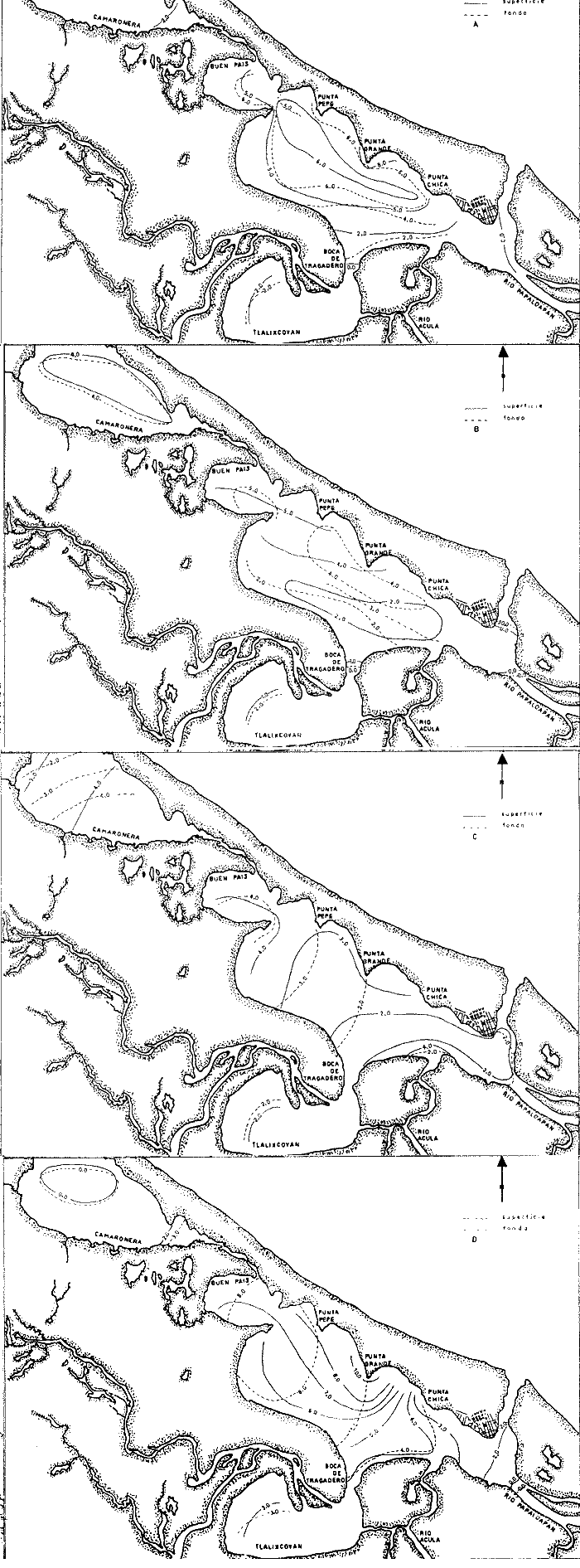 Fig. 2. Isotermas de superficie y fondo: A, invierno; B, primavera; C, varano; y D, otoño. 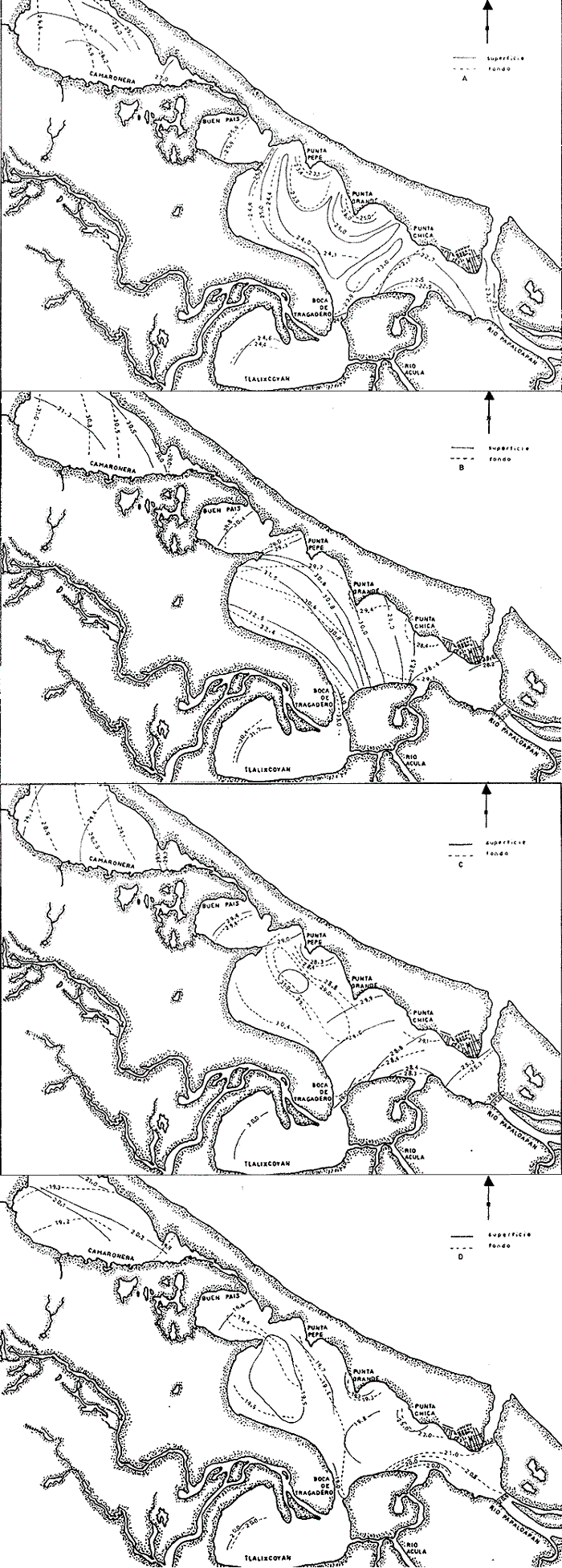 Fig. 4. Isohalinas de superficie y fondo: A, invierno; B, primavera; C, varano; y D, otoño. La Laguna de Tlalixcoyan, desde la Boca de Tragadero, presentó 2.0%. La Laguna Camaronera se mostró uniforme en su porción este con 4.0%, decreciendo hacia el oeste tanto en superficie como en el fondo, hasta alcanzar 2.0%. En el otoño, el patrón de distribución de la salinidad superficial es muy semejante al descrito Para marzo, se encontró también una masa de agua con altos valores frente a Punta Grande, que decreció en forma radial hacia el resto de la laguna. En la porción sureste, a partir de Punta Chica, se tuvieron las menores concentraciones, alcanzándose hasta 0.0%, frente a Isla Vives (Fig. 4D). La salinidad de fondo difiere básicamente del patrón superficial ya que presentó sus líneas en sentido perpendicular al eje principal de la laguna con 10.0% a nivel de las estaciones 6 y 7. En las estaciones 10, 11 y 121 la salinidad alcanzó 8.0% y se mantuvo constante hasta el interior de la Laguna de Buen País. La Laguna de Tlalixcoyan tuvo una salinidad de 3.0% en superficie y fondo. En la parte central de la Laguna Camaronera se registraron 0.0% en superficie y fondo; en tanto en su boca se encontraron valores de 2.0 y 3.0% respectivamente. La variación estacional de la salinidad mostró que, a partir de finales de invierno en donde se registraron 8.0% frente a Punta Grande y un promedio de 6.0% en el cuerpo principal de la laguna, sufre una dilución hacia finales de primavera, cuando de acuerdo con García (1970) se inicia la época de lluvias (Fig. 5). Un ligero decremento se presentó hacia el verano para incrementarse posteriormente a finales de otoño en que se encontraron los valores más altos. Este esquema no se mantuvo en todo el sistema, lo cual sin duda es debido a la alteración que genera el régimen de lluvias selectivamente sobre las áreas de descarga de los ríos. Según García (1970), las mayores precipitaciones se presentan de junio a septiembre, lo que traería como consecuencia una dilución general en el sistema; sin embargo, los datos obtenidos mostraron que las diferencias de salinidad entre los dos periodos de colecta efectuados en la época de lluvias (junio y septiembre), no difieren en gran forma con los registros de marzo, época comprendida dentro del periodo de secas. Lo que resulta evidente es que hacia el mes de diciembre, cuando las lluvias ya han cesado, la penetración de las aguas neríticas al sistema lagunar incrementa la salinidad corno lo indican los datos de las estaciones 6, 10, 11, 12, 13 y 14 que quedan fuera de la influencia y corriente de los ríos Acula, Blanco y Papaloapan. La Laguna de Tlalixcoyan en su parte interna, tuvo muy poca variación a través del año, cambiando desde 1.0% en junio hasta 3.0% en diciembre. Finalmente, la Laguna Camaronera presentó su máxima salinidad en junio con una distribución homogénea de 4.0%, Hacia septiembre se ha iniciado apenas parte de la dilución que sufrirá por causa de las escurrentías dentro de este cuerpo de agua, en tanto que en el resto del complejo lagunar, se alcanzan los menores valores promedio. En diciembre la Laguna Camaronera presentó 0.0%, lo que se interpreta como un retraso en la dilución de su salinidad, debido a la falta de grandes afluentes de agua dulce como sucede en la porción sureste del sistema lagunar. Las concentraciones de 2.0 y 3.07, en superficie y fondo respectivamente en la boca de la Camaronera, parecen señalar el inicio del incremento de la salinidad en este cuerpo de agua a través del estrecho canal que la comunica con el resto de la laguna. La distribución de la salinidad está influenciada por los mismos factores que la temperatura: el primero y más importante es el aporte del Papaloapan que mantiene valores superficiales muy bajos sobre todo en el extremo sureste de la laguna (a partir de Punta Chica) así como también las descargas de los ríos Camarón y Acula que tienen su mayor influencia hacia la misma región. El segundo factor son las corrientes que llevan parte de las aguas marinas que penetran por la boca de la laguna y surcan el litoral interior de la barra hasta surgir frente a Punta Grande, como lo sugieren los registros de 8.0 a 10.0%, en los meses de marzo y diciembre respectivamente. Estas corrientes generadas por las mareas, traen como consecuencia que incluso en la Laguna Camaronera, un cuerpo relativamente aislado del sistema lagunar, se alcancen hasta de 4.0%, El tercer factor es la topografía, pues como puede verse, la zona más profunda en el cuerpo central, se presenta en una línea entre las estaciones 7 y 13 actuando como una barra dinámica entre ambas riberas. Obviamente la región más profunda de todo el sistema corresponde a la propia boca de la laguna y el canal que la conecta con la desembocadura del Río Papaloapan. Las salinidades siempre bajas de la Laguna de Tlalixcoyan, menores incluso que las registradas en la Laguna Camaronera, a pesar de su aparente mejor comunicación con el cuerpo principal de la Laguna de Alvarado, son sin duda resultado del mayor aporte de agua dulce a esta área. 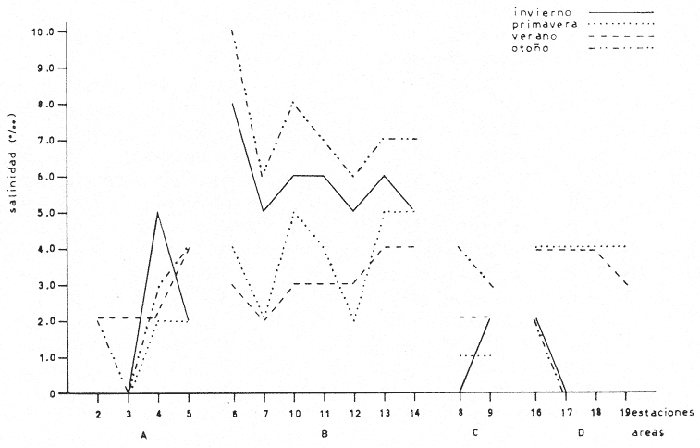 Fig. 5. Variación anual de la salinidad en el sistema lagunar de Alvarado. Consideraciones generales Intencionalmente se ha dejado fuera de la discusión anterior cualquier señalamiento de la hidrología presentada en otros trabajos, particularmente los de Villalobos et al. (1966); Villalobos et al. (1969) y Villalobos et al. (1975). La razón de lo antes expuesto, es que en virtud de las variaciones climatológicas no puede establecerse una comparación de mes a mes; sin embargo, las condiciones cíclicas generadas por éstas permiten una serie de observaciones que en seguida se señalan. De acuerdo con García (1970), las épocas de mayor y menor temperatura corresponden a los meses de mayo-junio y enero-febrero respectivamente; asimismo la de mayor precipitación pluvial ocurre en agosto-septiembre. Este esquema general es reflejado en las condiciones hidrológicas y así lo muestran los registros hechos por Villalobos et al. (1975) y los del presente trabajo. Aunque la tendencia de la variación de la salinidad a partir de valores muy bajos generados durante la época de lluvias y su paulatino incremento al término de éstas se mantiene, llama la atención que en nuestras observaciones nunca se encontraron concentraciones mayores del 10.0%, (excepto en el fondo de la boca de la laguna que comunica al mar) en tanto que Villalobos et al. (1966), reporta algunas mayores de 30.0%, frente a Punta Chica. A pesar de que el patrón de distribución no es estrictamente comparable, sí lo son por un lado, que las salinidades más altas aparezcan frente a Punta Grande en ambos trabajos, y que en la Laguna de Tlalixcoyan se mantengan siempre bajas a pesar de su proximidad con el cuerpo principal de la laguna. Por otro lado, los valores de salinidad registrados en este trabajo concuerdan con la condición hipohalina que menciona Lankford (1977) para la Laguna de Alvarado. La distribución de la salinidad básicamente y parcialmente la temperatura, permiten considerar al sistema lagunar dividido en cuatro áreas distintas (Fig. 6). La primera (Área A) corresponde a la porción sureste, con su límite noroeste en una línea imaginaria que iría desde Punta Chica hasta de Boca de Tragadero. Esta región estaría caracterizada básicamente por su constante baja salinidad a través del año, la que junto con la temperatura se vería influenciada por los aportes de los ríos Acula y Papaloapan. (Estaciones 2, 3, 4 y 5). La segunda (Área B), quedaría comprendida desde la línea imaginaria señalada anteriormente, hasta la Laguna de Buen País inclusive, caracterizada por fuertes gradientes de salinidad. (Estaciones 6, 7, 10, 11, 12, y 13 y 14). La tercera (Área C), corresponde a la Laguna de Tlalixcoyan, relativamente bien comunicada con el cuerpo principal de la laguna y que sin embargo siempre mantiene bajas salinidades (máxima registrada 3%). (Estaciones 8 y 9). La Laguna Camaronera o Área D, está caracterizada por una escasa comunicación con el resto del sistema y por ende presentó bajos valores de salinidad, 4%, los cuales sin embargo son mayores que los del área, C. Asimismo se caracteriza por presentar un retraso en su desalinización y salinización respecto al cuerpo principal de la laguna. (Estaciones 16, 17, 18 y 19). ICTIOPLANCTON
Distribución y abundancia estacional Durante los cuatro muestreos realizados en la laguna, se colectaron 9,947 larvas de peces de las cuales 4,480 quedaron identificadas a nivel de género y/o especie y las 5,467 restantes, sólo se identificaron a nivel de familia, debido a su pequeño tamaño. Se obtuvieron 17 familias, 27 géneros y 26 especies (Tabla 2). Las familias más abundantes fueron: Engraulidae con 5,754 organismos (57.85%) y Gobiidae con 3,297 (33.15%). Les siguieron en orden de abundancia Clupeidae con 463 (4.65%) y Sciaenidae con 143 (1.44%); las 13 restantes representaron en conjunto solamente el 2.9% del total. La abundancia del ictioplancton tuvo marcadas variaciones durante los cuatro periodos de muestreo (Tabla 2, Fig. 7). En la primera época de colecta (invierno) se registró la presencia de 10 familias, de las cuales la Engraulidae fue dominante representando más del 80% del total, la familia Gobiidae, ocupó el segundo lugar, con un 10% y el porcentaje restante estuvo dado por las familias Elopidae, Syngnathidae, Clupeidae, Sciaenidae, Atherinidae, Gobiesocidae, Soleidae y Pomadasyidae (Tabla 3). En el análisis de la distribución de los Engraulidae, se pudo observar que aunque Anchoa mitchilli y Anchoa lamprotaenia se encontraron en toda la laguna, difirieron sus núcleos de concentración. Así, fue más abundante A. mitchilli en el área C, en tanto que A. lamprotaenia apareció dominante en las áreas A y B; en la D ambas fueron muy escasas. 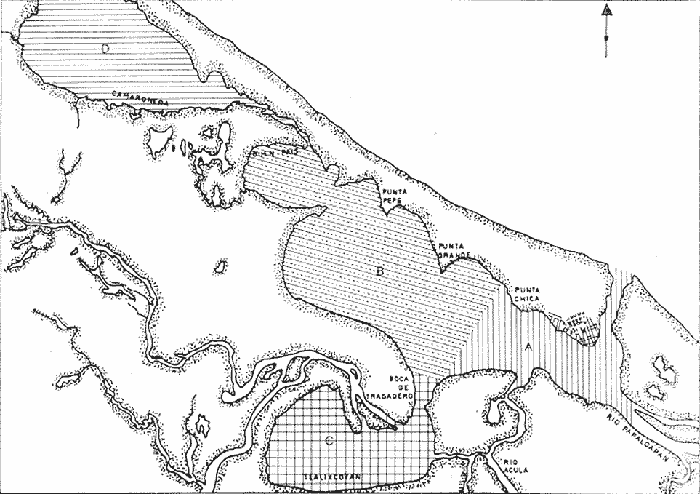 Fig. 6. Localización de las áreas A, B, C y D en el sistema lagunar de Alvarado. 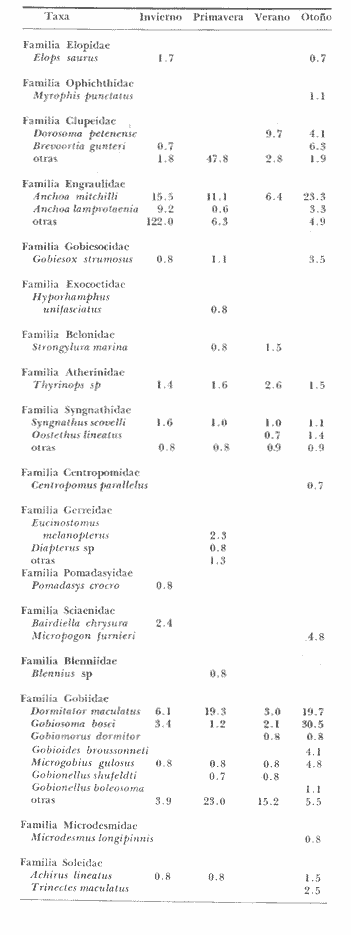 TABLA 2 VALORES PROMEDIO DE LAS CAPTURAS CON LAS REDES DE 250 g Y 500 pt, EXPRESADOS COMO NÚMERO DE INDIVIDUOS POR 100 m3 PARA CADA ESPECIE, EN LAS DISTINTAS ÉPOCAS DE MUESTREO Los Gobidos están entre los representantes más característicos y numerosos del componente lagunar y suponemos que la cantidad obtenida a través de los muestreos, no refleja sus verdaderos valores de abundancia en virtud de que sus hábitos les llevan a ocupar áreas más cercanas a la ribera a donde no se tuvo acceso con el tipo de muestreo realizado. Lo anterior se fundamenta en que sus huevecillos son depositados sobre vegetación sumergida (Wang y Kernehan, 1979) y por lo señalado en el trabajo de Flores y Zavala (1980) en donde reportan gran abundancia de larvas en las partes sombreadas de las riberas. Los ejemplares de la familia Gobiidae, estuvieron representados básicamente por dos especies, Dormitator maculatus yGobiosoma bosci, abundantes en las áreas C y D, siendo muy escasas en el resto del sistema. En la estación 2 se detectó una tercera especie, Microgobius gulosus. Las especies correspondientes a las familias restantes fueron sumamente escasas y no se puede hablar de áreas de mayor o menor abundancia, o de un patrón de distribución; sin embargo se puede mencionar que Gobiesox strumosus, Thyrinops sp y Syngnathus scovelli, son parte del componente lagunar y predominaron en las áreas B, C y D.Elops saurus, Brevoortia gunteri, Bairdiella chrysura y Pomadasys crocro, de quienes se sabe desovan en las áreas costeras, tuvieron diferentes grados de penetración en el sistema. Se reconocieron diferentes fases larvarias, de Elops saurus, encontrándose en las estaciones 2 y 14 la fase I, en la 9 la fase II y en la 19 la fase III. 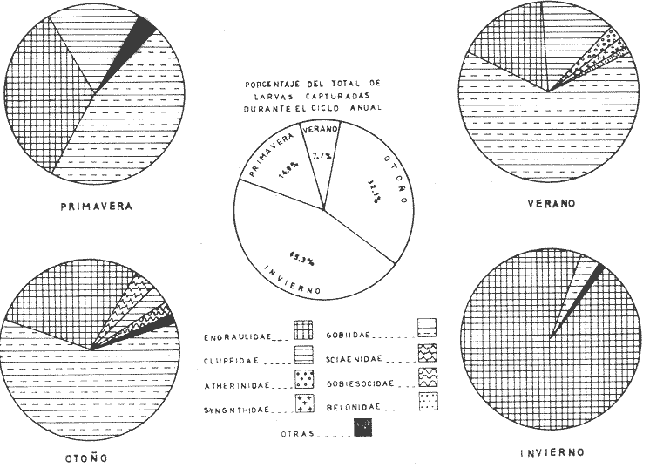 Fig. 7. Relación de abundancia del ictioplancton durante el ciclo anual y de familias para cada estación. Durante la primavera se capturaron 11 familias, de las cuales la Gobiidae, Engraulidae y Clupeidae ocuparon más del 80% (Tabla 4). Las demás fueron Atherinidae, Syngnathidae, Gobiesocidae, Gerreidae, Exocoetidae, Belonidae, Soleidae y Blenniidae. La familia Gobiidae fue muy abundante en el área A, pero la mayoría de las larvas no pudieron ser identificadas genérica o específicamente por su pequeño tamaño. El resto de los especímenes correspondieron en su mayor parte a D. maculatus que sólo se encontró en las áreas A y C. De la familia Engraulidae A. mitchilli mostró una distribución de abundancia similar a la del crucero anterior con núcleos de alta concentración en el área B (estación 12) y con los valores máximos en el área C.A. lamprotaenia estuvo restringida al área A. De la familia Clupeidae no fue posible determinar géneros ni especies por el pequeño tamaño de las larvas; sin embargo cabe señalar que se capturaron gran cantidad de especímenes y únicamente en el área A. En este muestreo se encontraron los únicos representantes de la familia Gerreidae. Su número de larvas fue bajo y se capturaron principalmente en la parte sureste de la laguna, identificándose aDiapterus sp y a Eucinostomus melanopterus. La familia Blenniidae, estuvo representada por el género Blennius sp del que sólo se encontró un ejemplar en la estación 2 y fue el único espécimen a través del ciclo anual. Durante la colecta de verano, se tuvo el número más bajo de larvas de todo el ciclo con 766 pertenecientes a 6 familias que fueron en orden de abundancia: Gobiidae, Clupeidae, Engraulidae, Syngnathidae, Atherinidae y Belonidae, correspondiendo a las tres primeras más del 80% del total (Tabla 5). D. maculatus, G. bosci, G. dormitor, M. gulosus y Gobionellus shufeldtifueron las cinco especies representantes de la familia Gobiidae, de las cuales las dos últimas fueron muy escasas. D. maculatusestuvo presente en las áreas B y C. G.bosci, se presentó únicamente en el cuerpo principal de la laguna (área B) y en la Laguna Camaronera. La mayor parte de las larvas de esta familia correspondió a especímenes pequeños que no fue posible identificar. Dorosoma petenense , única especie identificada de la familia Clupeidae en este muestreo, estuvo restringida básicamente a las lagunas de Tlalixcoyan y Camaronera. De los Engraulidos, A. mitchilli fue la única especie que se presentó durante este muestreo, en cantidades bajas y con una distribución básicamente restringida al cuerpo central de la laguna. De la colecta de otoño se identificaron 12 familias predominando Gobiidae y Engraulidae que alcanzaron más del 80% (Tabla 6), las demás fueron: Clupeidae, Syngnathidae, Atherinidae, Gobiesocidae y Elopidae. Se hallaron por primera ocasión en el ciclo aMyrophis punctatus(Ophichthidae), Centropomus parallelus (Centropomidae),Micropogon furnieri(Sciaenidae), Microdesmus longipinnis (Microdesmidae) yTrinectes maculatus(Soleidae). La familia Gobiidae estuvo representada por 6 especies con una distribución más o menos amplia, excepto paraGobiomorus dormitor, de la que únicamente se encontró un espécimen en la estación 17 (área D). La especie más numerosa fueG. bosci con su mayor concentración desde la estación 14 en la Laguna de Buen País hasta la 19, situada en el extremo noroeste de la Laguna Camaronera. D. maculatus tuvo una abundancia relativa en la misma zona con respecto a la especie anterior, pero sus mayores valores fueron en la Laguna de Tlalixcoyan (estaciones 8 y 9).G. broussonneti y M. gulosus ampliaron su zona de distribución a todas las áreas. G. boleosoma, especie que sólo se capturó en este crucero, mostró una distribución restringida al área A. A. mitchilli estuvo ampliamente distribuida pero con claros núcleos de concentración en el área C y porción noroeste del área B (estaciones 13 y 14) siendo aquí mucho más numerosa. En el resto de las estaciones se encontró con valores comparativamente muy bajos. A. lamprotaenia, aunque aparece nuevamente durante este muestreo, fue escasa y su mayor concentración fue en el área A y porción colindante de la B. Los Clupeidos estuvieron representados por las dos especies identificadas en muestreos anteriores, D. petenensey B. gunteri, con una clara diferencia en su distribución, ya que la primera se restringe a la Laguna Camaronera y la segunda a la porción sureste del sistema, aunque penetró en las áreas B y C. La familia Sciaenidae estuvo representada en esta ocasión por Micropogon furnieri, especie que tiene una alta penetración en el sistema, incluyendo la boca de la Laguna Camaronera. Las especies Myrophis punctatus, Centropomus parallelus, Microdesmus longipinnis, representantes del componente marino, tuvieron distintos grados de penetración en la laguna. Distribución y abundancia anual De las 9,947 larvas colectadas a través del ciclo anual de muestreo, el 45.3% correspondió al crucero de invierno, porcentaje que decreció hacia la primavera (14.9%) y verano (7.7%) incrementándose hacia el otoño (32.1%), (Fig. 7). La variación cuantitativa del ictioplancton aparece entonces bien marcada, con los picos de desove y por lo tanto el mayor número de larvas en invierno; sin embargo este esquema de variación anual, no es general para todas las áreas y si los valores promedio parecen mostrarlo, la realidad es que la gran cantidad de larvas de Engraulidos capturados durante el primer crucero enmascara dicha variación; asimismo, los picos de abundancia para las distintas áreas obedecen a diversas familias. Para tener una idea más clara de la variación estacional en las áreas que se han señalado con anterioridad, se utilizaron en el siguiente análisis los valores promedio de larvas capturadas en cada una de ellas (Fig. 8). En el área A, la mayor abundancia se registró en primavera, con un fuerte decremento hacia el verano y cantidades intermedias en otoño e invierno. Los altos valores de primavera, se debieron sobre todo a la gran cantidad de larvas de Gobidos y Clupeidos que por su pequeño tamaño no pudieron ser identificados y que por salir del esquema de variación estacional de las especies sí identificadas, suponemos se trata de otras.  TABLA 3 RELACIÓN DE FAMILIAS, GÉNEROS Y ESPECIES PARA CADA ESTACIÓN DE MUESTREO EXPRESADA EN NÚMERO DE INDIVIDUOS POR 100 m3. - CRUCERO II (INVIERNO) . DE 500* y 250 ** µ 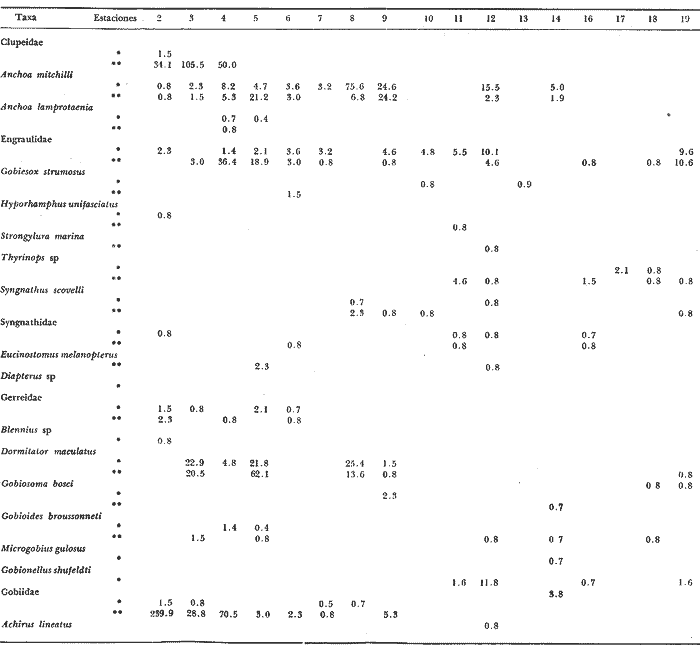 TABLA 4 RELACIÓN DE FAMILIAS, GÉNEROS Y ESPECIES PARA CADA ESTACIÓN DE MUESTREO EXPRESADA EN NÚMERO DE INDIVIDUOS POR 100 m3. - CRUCERO II (PRIMAVERA) . DE 500* y 250 ** µ 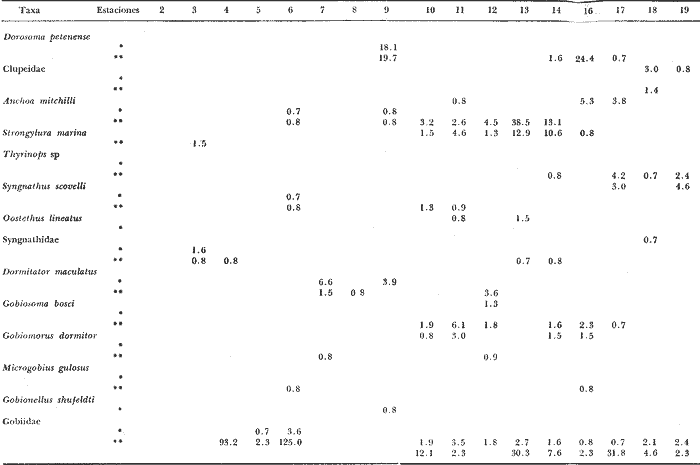 TABLA 5 RELACIÓN DE FAMILIAS, GÉNEROS Y ESPECIES PARA CADA ESTACIÓN DE MUESTREO EXPRESADA EN NÚMERO DE INDIVIDUOS POR 100 m3. - CRUCERO II (VERANO) . DE 500* y 250 ** µ 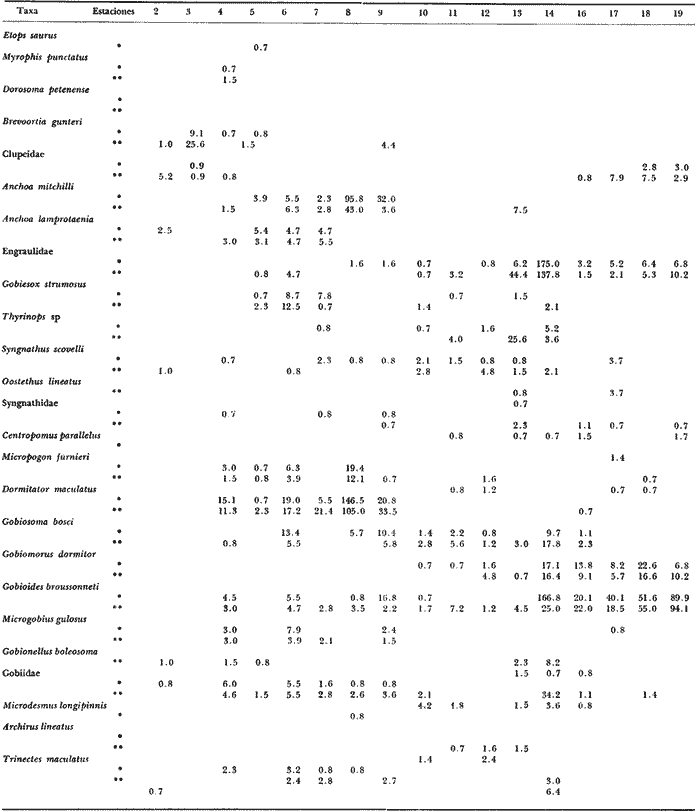 TABLA 6 RELACIÓN DE FAMILIAS, GÉNEROS Y ESPECIES PARA CADA ESTACIÓN DE MUESTREO EXPRESADA EN NÚMERO DE INDIVIDUOS POR 100 m3. - CRUCERO IV (OTOÑO) . DE 500* y 250 ** µ 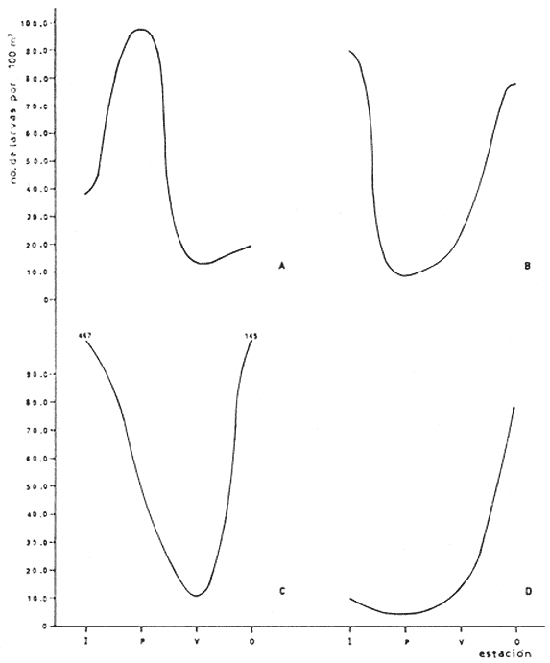 Fig. 8. Variación anual del ictioplancton en las distintas áreas, expresada como N° de larvas/100 m3. El área B presentó su mayor cuantía en invierno decreciendo hacia la primavera y aumentando posteriormente hacia el verano-otoño. El área C tuvo su máxima abundancia en el invierno y decreció hacia la primavera-verano, volviéndose a incrementar hacía el otoño; en ésta es en donde se presentó la máxima numerosidad de todas las áreas. Tanto en la B como en la C, la mayor profusión larvaria de invierno correspondió a Engraulidos y la de otoño a Gobidos. Cabe llamar la atención sobre la relación inversa que se establece en las áreas B y C entre el bajo número de larvas y las altas temperaturas, pues en las regiones tropicales y subtropicales como podría considerarse ésta, los incrementos de temperatura juegan un papel importante en la determinación de la época de desove, de forma que quizá la mayor abundancia de Gobiidae hacia el otoño sea resultado de las fuertes precipitaciones que trajeran como consecuencia que algunas de las especies que viven en la parte alta de los ríos, desciendan durante ese periodo y desoven, como lo señalan para D. maculatusFlores-Coto y Zavala (1980). La gran cantidad de Engraulidos a finales de invierno y principios de primavera no puede ser explicada, sino como consecuencia del periodo de desove de estas especies, sin conocer las causas que lo determinan. El área D presentó un ciclo distinto con sus mínimos valores en primavera, ascendiendo para el verano-otoño y decreciendo en el invierno. No obstante, las diferencias a través del ciclo son mínimas (excepto para el otoño), lo que la señala como el área más pobre dentro del sistema. Esta área se muestra diferente tanto desde el punto de vista biológico como hidrológico; ésto último ya ha sido discutido en su oportunidad, y biológicamente, porque es el área en donde se encontró el menor número de especies que fue de 14, de las cuales 4 tuvieron sólo un espécimen. Fue el único sitio en donde se encontró una relación inversa en el número de larvas y la salinidad; así de junio a diciembre en que ésta desciende hasta cero, es justo la época en que se tiene el mayor número de larvas. Finalmente, y atendiendo a aquellas familias que desovan en el mar y cuyas larvas pueden ocupar las lagunas como áreas de crianza, se pudo observar que durante la época de lluvias (junio-septiembre), el número de ellas fue solamente de 3 (Exocoetidae, Belonidae y Soleidae) representándolas únicamente 6 especímenes, además de tener muy poca penetración en la laguna. Durante la época de secas que comprendió los muestreos I y IV, el número de largas de familias marinas que entró en el sistema fue mucho mayor que en la época de lluvias y su penetración alcanzó incluso la estación 19, situada en el extremo noroeste de la Laguna Camaronera. Ecología de las especies Hasta aquí se ha tratado de Mostrar en virtud de los resultados obtenidos, cual es el posible esquema de distribución y abundancia del ictioplancton, a través de un ciclo anual; sin embargo, es necesario señalar una serie de aspectos inherentes a las especies, más que al ictioplancton en general. La familia Engraulidae, que resultó ser uno de los componentes más numerosos, estuvo representada al menos por dos especies, Anchoa mitchilli yA. lamprotaenia además de pequeños especímenes que presumiblemente corresponden a cualquiera de estas especies, excepto quizá aquellas que se localizaron en la boca de la laguna y que pudieron corresponder a alguna otra. Anchoa mitchilli tuvo una amplia distribución a través del ciclo anual, con sus mayores valores en otoño e invierno, particularmente en las lagunas de Tlalixcoyan y Buen País (Fig. 9A). El rango de salinidad en que se halló fue de 0 a 10% y el de temperatura de 19.3 a 33°C. De los adultos se sabe que habitan en aguas someras y de hecho se le conoce vulgarmente como anchoa de bahía. Lippson y Moran (1974) entre otros autores han reportado que el desove ocurre de mayo a septiembre en aguas de baja salinidad lo que concuerda con lo aquí reportado. Mansueti y Hardy (1967) la mencionan como un organismo eurihalino cuyas larvas se pueden hallar en aguas salobres y sus juveniles pueden llegar a penetrar en los ríos. Reséndez (1973) reporta esta especie en la Laguna de Alvarado, pero como carece de importancia comercial poco se sabe sobre ella; sin embargo, como se deduce de la información aquí presentada, en cuanto a su abundancia, distribución y frecuencia, A. mitchillies típicamente lagunar (al menos la población de la Laguna de Alvarado), desovando durante todo el año. A. lamprotaenia es una especie cuyos adultos no están reportados para la Laguna de Alvarado. Castro (1978) menciona que habitan en aguas continentales donde la salinidad no sea muy baja, no habiéndose capturado en zonas sin influencia marina. Sus estadios larvarios se encontraron en mayor cantidad a finales de invierno abarcando las cuatro áreas; no se presentaron en verano, y en primavera y otoño estuvieron restringidas al cuerpo principal de la laguna (Fig. 9B). El rango de salinidad en que se hallaron fue de 0 a 8%, y el de temperatura de 19.7 a 28.5°C. Por el esquema de distribución temporal y espacial, puede proponerse que las larvas de esta especie penetran en la laguna en otoño y permanecen hasta la primavera. La familia Gobiidae fue la que estuvo más ampliamente representada, no solo por el número de individuos, sino por la mayor cantidad de especies. Dormitator maculatus es una de las tres especies que estuvo presente todo el año con su máxima abundancia a finales de otoño, principalmente en el área C, aunque se encontró en toda la laguna (Fig. 9C). Los rangos de salinidad y temperatura fueron de 0 a 10%, y 19.3 a 33°C respectivamente. Esta especie ha sido reportada para el área de estudio por Reséndez (1973) Hoese y Moore (1973) mencionan que es común en estuarios y según Castro (1978) es una de las especies más abundantes y características de la ictiofauna estuarina, siendo común en la desembocadura de ríos donde habita semienterrada, pudiéndosele encontrar asociada con pastos marinos. Flores y Zavala (1980) han señalado que los adultos viven en las cuencas de los ríos y bajan a desovar durante la época de lluvias, pudiendo capturarse grandes cardúmenes. Asimismo, mencionan haber encontrado elevadas concentraciones de larvas en las zonas de remanso y partes sombreadas de las riberas de la Laguna de Alvarado. Esto, aunado al hecho de que sus huevecillos se adhieren a vegetación sumergida, raíces o cualquier objeto en el fondo, da la posibilidad de que la mayor parte de la población larvaria viva cerca de riberas, lo que las llevaría a escapar del muestreo. No obstante, y de acuerdo a la información aquí presentada, esta especie desova todo el año y aunque su mayor abundancia se registró a finales de otoño, podría esperarse que el culmen de desove se encuentre entre septiembre y diciembre. Gobiosoma bosci fue otra de las especies que estuvo presente todo el año; en otoño e invierno se presentó en mayor cantidad, comparativamente a primavera y verano. Su mayor abundancia se registró en las lagunas Camaronera y Buen País, mientras que en el área A fue muy escasa aún en otoño (Fig. 9D). Tal distribución indica que es (al menos para la población de Alvarado) una especie típicamente lagunar. Los rangos de temperatura y salinidad fueron de 19.3 a 31.7°C y 0 a 10% respectivamente. 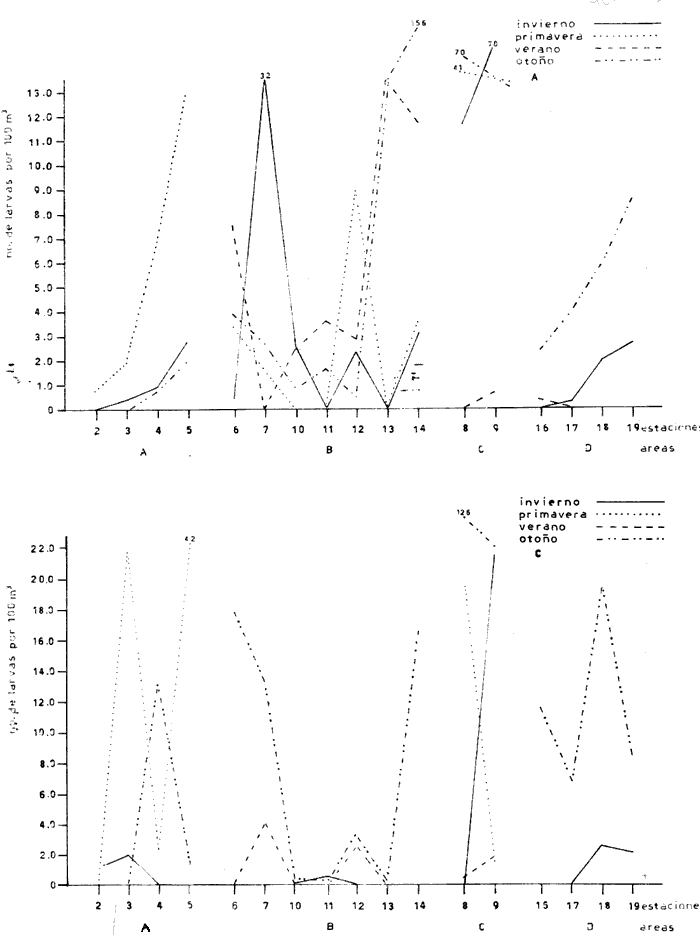 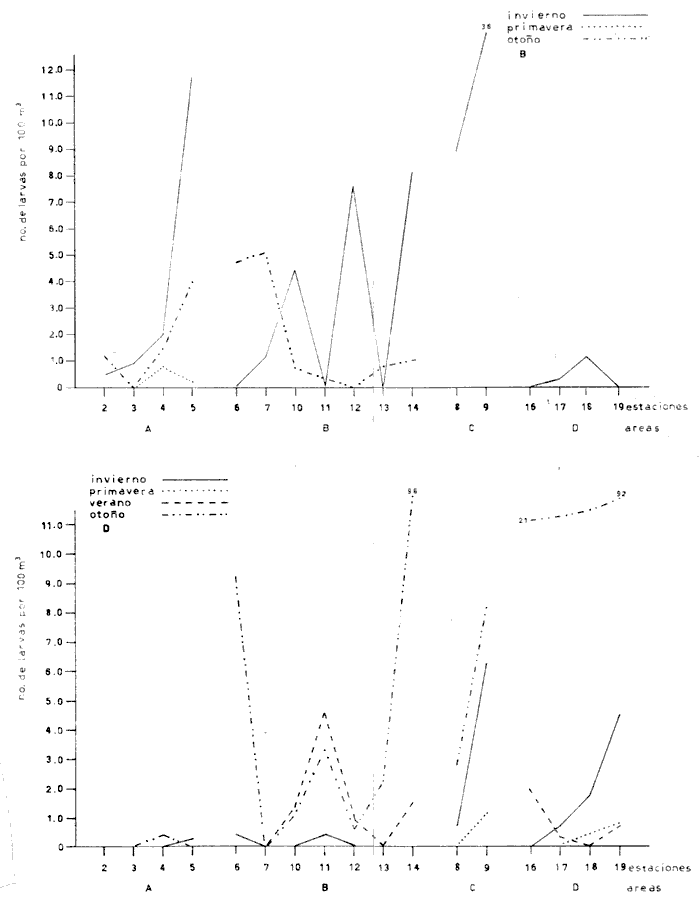 Figura 9 Variación anual de la abundancia de A, Anchoa mitchilli; B, Anchoa lamprotaenia; C, Dormitator maculatus y D, Gobiosoma bosci. Los adultos de esta especie han sido reportados para la Laguna de Alvarado, viviendo entre bancos de ostión (Reséndez, 1973), o en aguas costeras, pudiendo habitar en salinidades de 0 a 45.5%, (Castro op. cit.). Wang y Kernehan (1979) señalan la época de desove de mayo a septiembre en aguas meso y polihalinas de estuarios, época en la que justamente se encontró el menor número de larvas en Alvarado; por los datos obtenidos en esta laguna, el pico principal de desove debe ocurrir durante el otoño. Microgobius gulosus fue la tercera especie de la familia Gobiidae que se presentó todo el año, pero a diferencia de las anteriores, resultó sumamente escasa. Dentro de su pobreza fue más abundante en otoño, abarcando las 4 áreas de la laguna, con un rango de temperatura de 19.3 a 32.5°C y salinidad de 0 a 10%. No se puede hablar de un patrón de distribución en ningún sentido para estos organismos. Su ciclo de vida se desconoce y se carece de información acerca del habitat de sus larvas. Los adultos, según los trabajos de Walls (1975) y Hoese y Moore (1977), son comunes en aguas estuarinas, bahías poco profundas y en fondos lodosos. Probablemente el mayor número de larvas en diciembre sea reflejo de su época principal de desove. De las especies restantes, Gobioides broussonneti y Gobiomorus dormitor, han sido reportadas para el área de estudio por Reséndez (1973), señalando que ambas presentan cierta importancia económica por su pesca en la laguna, aunque en el caso de la primera se restringe a octubre y noviembre. Castro (1978) las menciona como especies eurihalinas que habitan en la desembocadura de ríos y lagunas costeras, pero no existe información sobre sus estadios larvarios. El pequeño número de larvas capturado durante el presente trabajo no permite establecer que sea la laguna su sitio de desove aunque tampoco la descarta, ya que los hábitos de los adultos con preferencia a zonas someras y lodosas, o sobre vegetación sumergida pueden estar ligados a hábitos similares de sus larvas, escapando a los muestreos. Las dos últimas especies de esta familia,Gobionellus boleosoma y Gobionellus shufeldti no han sido reportadas en su fase de adulto en la, laguna, y el bajo número de larvas capturadas no permite consideraciones de ninguna naturaleza. La familia Clupeidae estuvo representada por 2 especies de las cualesDorosoma petenense solo se presentó en verano y otoño, en rangos de 0 a 4%, de salinidad y temperaturas de 20.1 a 30°C. Se reporta como organismo dulceacuícola que entra comunmente en aguas salobres durante verano y otoño (Walls, 1975 y Hoese y Moore, 1977). También Reséndez (1973) menciona haber encontrado a esos organismos a bajas salinidades (2.2%). Los datos del presente trabajo concuerdan con tales señalamientos pues esta especie solo fue colectada en las lagunas Camaronera, de Tlalixcoyan y Buen País, con poca influencia marina. Brevoortia gunteri es la otra especie de la familia Clupeidae, de la cual se obtuvieron muy pocos ejemplares, solo en las épocas de otoño e invierno, con rangos de salinidad de 0 a 7%, y 19.5 y 25°C de temperatura. Los adultos habitan en aguas costeras someras (Walls, 1975), pudiendo penetrar considerablemente en aguas continentales aún sin influencia marina (Castro, 1978). De acuerdo a los datos obtenidos se puede señalar que estos organismos pasan del mar a la laguna en las épocas antes referidas. Thyrinops sp, género de la familia Atherinidae, se encontró en las áreas B y D en todas las épocas y además en la C en invierno. Los rangos de salinidad y temperatura en que se halló fueron de 0 a 7%, y 19.5 a 32.5°C respectivamente. Reséndez (1973) capturó adultos en las bocas del Río Acula y de Tlalixcoyan en salinidades de 2.2 a 6%, Parece ser una especie más bien de hábitos salobres, de baja salinidad y de acuerdo a la distribución de las larvas puede establecerse que desova durante todo el año, en las partes internas de la laguna. Syngnathus scovelli de la familia Syrignathidae, se encontró durante todo el año en diversas zonas de la laguna y siempre estuvo asociada a hojas de fanerógamas marinas suspendidas en las aguas, entre las que pasaba desapercibida a simple vista. Castro (1978) menciona esta especie como eurihalina en un rango que va de 3.2 a 45%. Por la información obtenida se deduce que la población de Alvarado de esta especie es típica del sistema viviendo entre vegetación sumergida en donde desova, lo que hace durante todo el año, con su época máxima en el verano-otoño. Las larvas de Oostethus lineatus muy escasas, solo se encontraron en verano y otoño en la Laguna Camaronera, también entre vegetación de fanerógamas. Castro (1978) indica que se trata de una especie marina que invade corrientes fluviales y estuarios, hasta zonas de salinidad muy baja entre bancos de Thalassia; los machos con huevos frecuentan las zonas de baja salinidad más que las aguas marinas adyacentes. A pesar del bajo número delarvas capturadas, pero en virtud de su localización hasta el fondo del sistema lagunar, se puede establecer que esta especie ocupa esta área como sitio de desove. Las especies de la familia Soleidae, Achirus lineatus yTrinectes maculatus ya han sido reportadas en sus formas adultas por Reséndez (1973) para la laguna. La primera se capturó todo el año excepto en verano en el área B principalmente. La segunda, solo a finales de otoño. Lippson y Moran (1974) señalan aT. maculatus como una especie que puede desovar en aguas de baja salinidad, las que utilizan como áreas de crianza. A. lineatus, especie también con hábitos estuarinos, puede desovar en este tipo de aguas y los estadios pequeños hallados en el presente trabajo así parecen indicarlo. Las larvas de Gobiesox strumosus, única especie de la familia Gobiesocidae, fueron encontradas durante todo el año, excepto en verano. Esto puede ser resultado de los hábitos de los adultos que podrían reflejarse en los de sus estadios larvarios, viviendo en zonas muy someras y entre conchas. Esta es una especie típicamente lagunar con un claro culmen de desove a finales de otoño. Bairdiella chrysura (Sciaenidae) solo se capturó en invierno en las áreas A y B en rangos de temperatura y salinidad de 22.5 a 25°C y 0 a 6%, respectivamente. Por su distribución con poca penetración al sistema lagunar, se considera que esta especie desova en el mar, migrando las larvas al interior de la laguna, lo que concuerda con lo señalado por Wang y Kernehan (1979) quienes indican que el desove ocurre en bahías y océanos a salinidades mayores de 25%, y que los juveniles migran hacia aguas someras. Cabe señalar sin embargo lo reportado por Reséndez (1973); según este autor los adultos se pescan durante todo el año en la Laguna de Alvarado. Micropogon furnieri en cambio, solo se encontró en otoño distribuida en las 4 áreas. Reséndez (1973) encontró también adultos en la laguna y señala que son más abundantes de julio a septiembre. Por los datos obtenidos, parece claro que la época de desove de esta especie debe ser alrededor de diciembre, única época en que se presentó en nuestras colectas y con una relativa abundancia. Por su distribución suponemos que esta especie también desova en la laguna. De la familia Gerreidae hay una gran carencia de información en cuanto a los huevos y larvas, y por consiguiente de su hábitat. De las colectas de Alvarado se pudo identificar aEucinostomus melanopterus y Diapterus sp capturados solamente en primavera en las áreas A y B. De los adultos deE. melanopterus se menciona que son eurihalinos, encontrándose tanto en aguas marinas como en ríos. DeDiapterus sp, la información que se tiene es acerca de D. rhombeus y D. olisthostomus, las cuáles son frecuentes en estuarios y aguas dulces. Los representantes de las familias Ophichthidae, Belonidae, Centropomidae, Exocoetidae, Microdesmidae y Pomadasyidae, se reportan como organismos marinos que comúnmente entran en bahías y aguas costeras, soportando salinidades bajas. Por el reducido número de especímenes obtenidos durante los cuatro cruceros, se puede decir que son visitantes ocasionales en la laguna. De la familia Elopidae también se capturaron muy pocos ejemplares en otoño e invierno. Según Mansueti y Hardy (1967), estos organismos desovan durante todo el año, probablemente en el mar, y utilizan las lagunas costeras y estuarios como áreas de crianza. Finalmente, se han ordenado en la Tabla 7 en una serie de listas, las 29 especies encontradas y que de acuerdo a nuestros datos y literatura precedente pueden considerarse correspondiendo a aquellas: - Típicamente estuarinas (12) - Marinas que ocupan la laguna como área de crianza (7) - Marinas que penetran en forma ocasional al sistema lagunar (8) - Dulceacuícolas que ocupan la laguna como área de crianza (1) - Dulceacuícolas que penetran en forma ocasional (1) Es conveniente aclarar que este ordenamiento se refiere únicamente a los estadios larvarios, ya que muchas de las especies consideradas aquí como estuarinas, pueden vivir en sus estadios adultos en aguas dulces (Ej.Dormitator maculatus) o marinas (Ej.Anchoa mitchilli). Asimismo entre las especies marinas enlistadas como aquellas que ocupan la laguna para área de crianza o que penetran ocasionalmente, han sido reportadas viviendo en su estado adulto en el propio sistema lagunar.  TABLA 7 RELACION DE COMUNIDADES DEL ICTIOPLANTON ENCONTRADAS EN EL SISTEMA LAGUNAR DE ALVARADO. ConclusionesLa distribución de la salinidad y la temperatura está influenciada por tres factores: El primero es el aporte siempre importante del Río Papaloapan cuyas aguas son generalmente más frías que las del sistema lagunar y que mantienen salinidades superficiales muy bajas en el extremo sureste de la laguna a partir de Punta Chica; los ríos Blanco, Camarón y Acula tienen su mayor influencia hacia esta misma región. El segundo son las corrientes generadas por marcas, que llevan parte de las aguas marinas que penetran por la boca de la laguna y surcan el litoral interior de la barra hasta surgir frente a Punta Grande, como lo sugieren los máximos valores registrados ahí de 8 y 10% en los meses de marzo y diciembre respectivamente. La influencia sobre la temperatura es menor que para la salinidad. El tercero es la topografía y profundidad, que permite el mayor calentamiento de las aguas en áreas someras, la circulación y mezcla de las aguas. El ciclo salino de la laguna permite constatarla como un sistema de carácter hipohalino. Debido principalmente a la salinidad, y en parte a la temperatura, se pueden distinguir cuatro áreas en el sistema lagunar: Área A, corresponde a la porción sureste con su límite noroeste en una línea imaginaria que iría desde Punta Chica a la Boca Tragadero, caracterizada por su baja salinidad superficial a través del año, así como temperaturas menores que en las otras áreas. Área B, desde la línea imaginaria señalada para el área A, hasta la Laguna de Buen País inclusive, caracterizada por fuertes gradientes de salinidad. Área C (Laguna de Tlalixcoyan), con bajas salinidades a través del año, a pesar de su aparente amplía comunicación con el cuerpo principal de la laguna, lo que parece resultado de su condición somera y constantes aportes de agua dulce. Área D (Laguna Camaronera), caracterizada por ser un cuerpo de agua semiaislado y por carecer de aportes de agua dulce como arroyos y ríos, particularidades que traen como consecuencia bajas salinidades durante el año y un retraso en los procesos de salinización y desalinización con respecto al cuerpo principal de la laguna. El condicionamiento hidrológico de las áreas tuvo como consecuencia una composición ictioplanctónica distinta. En el área A, se presentó una alta diversidad. Debido a que es la zona en donde se halla la boca de la laguna, se capturaron varias de las especies marinas que migran hacia el interior del sistema. Por otro lado, las fuertes corrientes en esta parte impiden que las poblaciones de larvas puedan establecerse. El área B tuvo la más alta abundancia y diversidad de todo el sistema. En virtud de ser la zona de mayor salinidad, así como de menores corrientes comparativamente al área A, y por tanto más estable, permite instalarse a las poblaciones ictioplanctónicas marinas y lagunares. El área C fue la de menor acceso a las especies marinas particularmente durante la época de lluvias y bajas salinidades, cuando no se encontró ningún espécimen, en tanto en la época de secas algunos pueden alcanzar esta área. Su población ictioplanctónica es básicamente lagunar. El área D resultó ser la más pobre y con menor diversidad de especies y familias a través del año, como consecuencia de la escasa comunicación con el cuerpo principal del sistema. Durante el ciclo de muestreo del ictioplancton se determinaron 17 familias, 27 géneros y 26 especies. Los representantes de las familias Engraulidae (57.85%) y Gobiidae (33.15%) predominaron sobre las demás a lo largo del año. La mayor abundancia ictioplanctónica en el complejo lagunar ocurre en otoño-invierno con un notorio mínimo en verano, contrariamente a lo esperado para áreas semitropicales como Alvarado, donde la temperatura juega un papel preponderante en la reproducción de los organismos. El esquema de abundancia no es igual para las cuatro áreas señaladas en este trabajo. La condición hipohalina del sistema lagunar, tiene como consecuencia que la proporción de larvas que penetraron en él provenientes del mar (aguas ultrahalinas) haya sido muy baja; notoriamente durante la época de lluvias no solo la cantidad, sino la diversidad, resultaron muy reducidas. El componente ictioplanctónico lagunar está representado por una serie de especies de las cuales pueden considerarse las más típicas aAnchoa mitchilli, Dormitator maculatus y Gobiosoma bosci.Aunque se presentaron durante todo el año sus épocas de mayor abundancia correspondieron a otoño-invierno para la primera, septiembre a diciembre para la segunda, aparentemente condicionada por la época de lluvias y el otoño para la tercera. En términos generales, las lagunas costeras como zonas de alta productividad, tienden a ser áreas de crianza para gran cantidad de organismos marinos; no obstante y al menos para el ictioplancton, la Laguna de Alvarado no lo es, lo que se atribuye a su condición hipohalina. Por otro lado, la gran abundancia de larvas deAnchoa mitchilli y Dormitator maculatus (cuyos adultos tienen muy poca o ninguna importancia económica), sugiere que deben jugar un papel preponderante como fuente de alimento para los juveniles y adultos de peces carnívoros. AgradecimientosLos autores manifiestan su agradecimiento a Juan José Abreu y Armando Paredes, Director y Subdirector respectivamente de la Escuela Secundaria Técnica Pesquera de Alvarado, Veracruz, por las facilidades otorgadas durante el trabajo de campo. LITERATURAAYALA, D. E., Tesis profesional Contribución al conocimiento del ictioplancton de la región suroccidental del Golfo de México. Fac. de Ciencias. Univ. Nal. Autón. México.1980. 66 p. CÁRDENAS, F. M.,Lagunas Costeras un Simposio. Mem. Símp. Intern. Lagunas Costeras. Pesquerías en las lagunas litorales de México. In: Ayala-Castañares A. y F. B. Phleger (Eds.)UNAM-UNESCOMéxico1969. 645-652.Nov. 28-30, 1967 CASTRO, A. J. L.,Catálogo Sistemático de los Peces Marinos que Penetran en las Aguas Continentales de México con Aspectos Zoogeográficos y Ecológicos. Serie Científica Departamento de Pesca.México1978. 298 p.No. 19. CLOTHIER, C. R., Calif. Div. Fish and Game, Fish Bull., A key to some southern California fishes based on vertebral characters.1950.1-83.(79) FLORES-COTO, C. Y ÂLVAREZ-CADENA An. Centro de Cienc. del Mar y Limnol. Univ. Nal. Autón. MéxicoEstudios preliminares sobre la abundancia y distribución del ictioplacton en la Laguna de Términos, Campeche.1980.67-78.7 (2) FLORES-COTO, C. y F. ZAVALAAn. Inst. de Cienc. del Mar y Limnol. Univ. Nal. Autón. MéxicoDescripción de huevos y larvas de Dormitator maculatus, de la Laguna de Alvarado, Veracruz (Pisces, Gobiidae).1982.127-140.9 (1) GARCÍA, E., An. Inst. Biol. Univ. Nal. Autón. México. Ser. Botánica Los climas del Estado de Veracruz (según el sistema de clasificación climática de Köppen modificado por la autora).1970.3-42.41 (1) GÓMEZ-AGUIRRE, S.,In: Mem. II Simp. Lat-Amer. Oceanogr. Biol. Univ. de Oriente Observaciones comparativas de resultados de estudios del plancton de lagunas costeras del Golfo de México.CumanáVenezuela1977.19-33.1 24-28 nov. 1975. HOESE, D. y R. H. MOOREFishes of the Gulf of Mexico. Texas, Louisiana and Adjacent Waters. Texas A & M University PressTexas1977. 327 p. JUÁREZ, M., Rev. Invest., Inst. Nal. de Pesca. Cuba Distribución cuantitativa y algunos aspectos cualitativos del ictioplancton del Banco de Campeche.1975.27-71.1 (1) LANKFORD, R. R.,Estuarine Processes Circulation, Sediments and Transfer of Material in the Estuary. Coastal lagoons of Mexico. Their origin and classification. In: Cronin, L. E. (Ed.)Academic Press Inc. Nueva York1977.182-215.2 LIPSON, J. A. y L. R. MORANManual for Identification of Early Development Stages of Fishes of the Potomac River Estuary.Power Plant Siting Program of the Maryland Department of Natural Resources Baltimore1974. 282 p. MANSUETI, J. A. y J. D. HARDYDevelopment of Fishes of the Chesapeake Bay Region. An Atlas of Egg, Larval, and Juvenile Stages Part I. Natural Resources InstituteUniversity of MarilandBaltimore1967.202 p. MARGALEF, R., Lagunas Costeras un Simposio. Mem. Simp. Intern. Lagunas Costeras.Comunidades planctónicas en lagunas litorales. In: Ayala-Castañares A. y F. B. Phleger (Eds.)UNAM-UNESCOMéxico1969.645-652.Nov. 28-30, 1967 OLVERA, L. R. M., T. CASTRO y E. E. VILLANUEVAIdentificación y distribución de larvas de Mugil ceplialus (Mugilidae), Thunnus atlanticus y Auxis thazard (Thunnidae) en el Golfo de México. Reporte de Ciencias MarinasSecretaría de Marina, Secretaría de Industria y Comercio, Subsecretaria de Pesca, Instituto Nacional de Pesca. 1975.74 p. No. 17 (NP) PADILLA, G. M. A., Larvas de peces colectadas en el crucero VU/72-02. Secretaría de Marina, Secretaría de Industria y Comercio, Subsecretaria de Pesca, Instituto Nacional de Pesca. Reporte de Ciencias Marinas1975.17 p. No. 16 (NP) RESÉNDEZ, M. A.,Revta. Soc. Mex. Hist. Nat., Estudio de los peces de la Laguna de Alvarado, Veracruz, México.1973.183-281.31 SIGNORET, P. M., Tesis profesional.Contribución al conocimiento de las medusas de las lagunas de Tamiahua y Alvarado, Ver., México. Fac. de Ciencias Univ. Nal. Autón. México1969. 91 p. VILLALOBOS, A., J. A. SUÁREZ, S. GÓMEZ, G. DE LA LANZA, M. ACEVES, F. MANRIQUE Y J. CABRERAProc. Gulf. Caríb. Fish. Inst. Nineteenth Anual Sess., Considerations on the hydrography and productivity of Alvarado Lagoon, Veracruz, México. 1966. 75-85. VILLALOBOS, A., J. CABRERA, F. MANRIQUE, S. GÓMEZ, V. ARENAS y G. DE LA LANZA Lagunas Costeras un Simposio. Mem. Simp. Intern. Lagunas Costeras Relaciones entre postlarvas planctónicas de Penaeus sp y caracteres ambientales en la Laguna de Alvarado, Veracruz, México. In: Ayala-Castañares, A. y F. G. Phleger (Eds.)UNAM-UNESCOMéxico1969.601-620. Nov. 28-30, 1967 VILLALOBOS, A., S. GÓMEZ V. ARENAS, A. RESÉNDEZ Y G. DE LA LANZA An. Inst. Estudios hidrobiológicos en la Laguna de Alvarado (Febrero-Agosto, 1966).1975.1-34. WALLS, J. G., Fishes of the Northern Gulf of México. T. F. H. Publications Nueva Jersey1975. 432 p. WANG, J. C. S. y R. J. KERNEHANFishes of the Delaware Estuaries. A Guide to the Early Life Histories. E. A. Communications, Ecological Analysts, Nueva York 1979.410 p. YÁÑEZ-ARANCIBIA, A. y R. S. NUGENT An. Centro Cienc. del Mar y Limnol. Univ. Nal. Autón. MéxicoEl papel ecológico de los peces en estuarios y lagunas costeras.1977.107-114.4 (1)
|

