|
OBSERVACIONES SOBRE LA
DISTRIBUCIÓN ESPACIAL Y EL COMPORTAMIENTO DE SIPHONARIA GIGAS SOWERBY,
1825 EN LA COSTA PACÍFICA DE COSTA RICA (GASTROPODA:
SIPHONARIIDAE)
Trabajo recibido el 12 de noviembre de 1980 y aceptado
para su publicación el 2 de julio de
1981.
ENRIQUE J. LAHMANN
Escuela de Biología, Universidad de Costa Rica.
Dirección actual: Division of Biology and Living Resources, Rosenstiel
School of Marine and Atmospheric Science, Miami, Florida 33149.
WALTER GONZÁLEZ
Escuela de Biología, Universidad de Costa Rica.
Dirección actual: 406 24th St. N.E. Salem, Oregon 97301.
La distribución de las poblaciones de Siphonaria
gigas en la costa Pacífica de Costa Rica, está
determinada por la interacción de diversos factores. Por análisis
de regresión múltiple escalonada se determinó que la
altura y la distancia vertical a la playa explican un 17.1% de la
gradación de tamaños de este molusco.
Los
análisis de contenido estomacal demuestran que estos gastrópodos
no tienen una preferencia marcada por determinado organismo. Diatómeas y
cianobacterias en general, integran su espectro
trópico.
Se observó la existencia de un
comportamiento de habitáculo. Dichos habitáculos no son
permanentes, por lo que se les puede considerar como "nichos de
ocupación temporal".
The distribution of populations ofSiphonaria gigas
in the Pacific Coast of Costa Rica is determined by the interaction of several
factors. The height and vertical distribution with respect to the beach was
determined, by step-wise multiple regression analysis, to account for 17.1% of
the size distribution of this gastropod.
The gut content
analyses show that the limpets do not have a specific preference for particular
species of diatoms and/or cianobacterias, which constitute part of its trophic
spectrum.
Observations on homing behavior were
made.
Siphonariaes un género de gastrópodos de la familia Siphonariidae con amplia distribución latitudinal (Hubendick, 1946). Ocurre entre rocas y sedimentos consolidados de la zona de mareas, que se encuentran en playas de costa abierta (Stephenson and Stephenson, 1950). En la Costa Pacífica de Costa Rica se encuentran dos especies de este género: Siphonaria gigas Sowerby, 1825 ySiphonaria maura Sowerby, 1835. La primera es más abundante, de mayor tamaño y con las estrías de la concha menos marcadas que la segunda. Siphonaria tiene importancia para los habitantes costeros quienes la utilizan como complemento alimenticio, y por ello el hombre es un predador importante. La literatura sobre investigaciones en Siphonariade latitudes subtropicales y templadas es abundante (e.g. Voss, 1959; Oliver y Penshaszadeh, 1968; y referencias en dichos artículos). Sin embargo, es poco lo que se sabe de la biología deSiphonaria gigas, cuya distribución es principalmente tropical (Keen, 1971). En el presente estudio se analiza la estructura de una población de S. gigas, tomando en cuenta el tamaño de los individuos y la relación que existe entre éste y la posición vertical y horizontal que ocupa en las rocas y en la zona de mareas respectivamente. ÁREA DE ESTUDIOEl área de trabajo está localizada en la playa Cocal, aproximadamente a 2 Km. S.E. del pueblo de Montezuma, provincia de Puntarenas, Península de Nicoya, Costa Rica, a 9°40'N y 86°05'O. La zona está constituida por basaltos del Complejo de Nicoya, con rocas consolidadas y fragmentadas. La fauna de mareas está representada por varios grupos de organismos entre los que se destacan varias especies de anfineuros, gastrópodos, tales como Acanthina brevidentada Acmaea sp., Chama echinata, Fisurella sp., Littorina áspera, L. modesta, Nerita scabricosta, Planaxis planicostatus, Púrpura patula pansa, Siphonaria gigas, S. maura, Thais melones; los cirripedios Chthamalus panamensis y Tetraclita stalactifera; varios cangrejos grápsidos y holotúridos. Por ser una costa abierta, presenta una influencia muy marcada del oleaje sobre el sustrato (rocas, fragmentos de conchas y arena). Se caracteriza esta zona por un régimen de mareas semidiurnas. El clima de la zona presenta una época seca, desde diciembre hasta abril y otra lluviosa, de mayo a noviembre. La precipitación anual es de 2200 mm, con un máximo en el mes de octubre. La temperatura ambiental anual oscila entre los 17°C y 35°C. (Datos obtenidos de la estación meteorológica que tiene el proyecto de "Recursos Bióticos en Lagunas Costeras, Manglares y Áreas adyacentes en América Latina" en Pochete, Bahía Ballena, Península de Nicoya). MATERIALES Y MÉTODOSEl presente estudio se realizó del 27 de noviembre al 14 de diciembre de 1978 en la región mesolitoral rocosa. Se efectuaron doce transecciones verticales a la costa, distantes entre sí diez metros, las cuales se extendían desde el punto más alto de la marea alta, hasta el más bajo durante la marea baja. Estas transecciones consistieron de cuadrículas continuas de un metro cuadrado. En cada una se contaron y midieron todos los individuos deS. gigasencontrados; además se anotó la altura en la roca y la distancia a la línea de pleamar de cada uno de ellos. En la medición del tamaño de los individuos se consideró la distancia más larga existente entre dos puntos extremos de la concha. Para tal efecto se utilizó un compás de dos puntas y una regla milimétrica; el tamaño se expresó en milímetros. La altura de la concha no fue medida. La altura a que cada individuo se encontraba en la zona de mareas fue medida, utilizando una cinta métrica. Esta medida se tomó desde el punto más bajo en el sustrato hasta el sitio donde se localizó al individuo. Se marcaron 275 organismos, escogidos al azar, para cuantificar su desplazamiento dentro del área de estudio. Se confeccionaron etiquetas de cartulina de seis milímetros de diámetro, numeradas y por duplicado. En la concha de cada individuo se pegó una de las etiquetas. con resina Epoxi (Poxy putty, Permalite Plastic Corporation) y luego se cubrió con una película de pintura plástica transparente (Varathane, Efecto Company, Inc.), para impermeabilizarlas y evitar la pérdida del número. A dos centímetros del individuo marcado se colocó la otra etiqueta replicada, con el número en la misma dirección que el de la concha, para controlar la posición original exacta. Por espacio de once días, durante las mareas bajas, se anotó la cantidad de centímetros desplazados, la ubicación de acuerdo con los puntos cardinales, y la dirección del desplazamiento (arriba, abajo u horizontal). De los 275 individuos marcados originalmente, 243 son considerados dentro del estudio, pues los restantes 32 perdieron sus marcas. En ocho sitios diferentes se tomaron muestras de algas por medio de raspados en las rocas. Los raspados incluyeron tanto rocas en las que habían individuos, como en las que no se encontraban. Estas muestras fueron preservadas en formalina al 5%, y posteriormente identificadas hasta nivel de género, utilizando las claves de Desikarchary (1959) Taylor (1960), Dawson (1962) y Cupp (1971). Se colectaron y preservaron 20 individuos provenientes de tres sitios diferentes para identificar los contenidos estomacales. Para la preservación de los individuos en el campo se utilizó formalina al 10%. Los contenidos estomacales en el laboratorio se preservaron en alcohol al 70%. Se considera contenido estomacal a toda la materia que se obtuvo desde inmediatamente después de la rádula hasta el comienzo del recto. Los datos sobre el tamaño, altura y posición de los 1464 individuos examinados, fueron procesados en un computador IBM-360 del Centro de Informática de la Universidad de Costa Rica. Se utilizaron para su análisis los programas "Regression and Frequencies" SPSS y "Regression" SAS. RESULTADOSUn total de 91 individuos (37.5% de los individuos marcados) manifestaron un movimiento efectivo; es decir, mostraron un cambio de la posición original en que fueron marcados. De éstos, diez individuos no se consideran dentro del estudio ya que, o perdieron sus marcas después de haberse anotado su movimiento, o bien éste se percibió el último día de observaciones. Del grupo en estudio, el 84% regresó la posición original en la observación siguiente (entre cada observación hubo cuando menos un ciclo de mareas), posición que fue comprobada, además de las cicatrices de reposo, por la concordancia en la dirección del número del individuo y el de la roca; es decir, mostraron claramente la existencia de un comportamiento de habitáculo (homing behavior, Abe, 1940). Trece individuos (16%) no presentaron este comportamiento, pero luego de varios días de movimiento indefinido, se asentaron en un sitio determinado. Ciento cincuenta y tres centímetros fue la mayor distancia recorrida por un individuo, el cual no regresó a su posición original. A ciento cincuenta y dos individuos (62.5%) de la población no fue posible determinarles movimiento aparente (ver Discusión). La tabla 1 muestra el análisis de regresión múltiple escalonado realizado para determinar la posible influencia de las variables altura y distancia sobre el tamaño. Ambas variables muestran una fuerte asociación con la variable dependiente, tamaño (nivel de significación < 0.001). Los coeficientes de regresión dan un resultado negativo para el sentido de esta dependencia; el tamaño disminuye con el aumento de la altura y la distancia. El análisis descriminante entre las variables independientes indica que la altura es el factor más importante. El coeficiente de determinación señala que esta variable explica el 16.3% de la varianza existente. 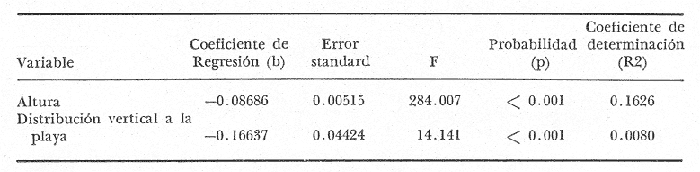 TABLA 1 ANÁLISIS DE REGRESIÓN MÚLTIPLE ESCALONADA DE UNA POBLACIÓN DE SIPHONARIA GIGAS EN PLAYA COCAL, MOCTEZUMA, COSTA RICA, 1978. Por otra parte, cuando se correlacionan las variables en estudio se obtienen coeficientes de correlación significantes: distancia y tamaño (R = -0.35101, P < 0.01); altura y tamaño (R = -0.40331, P < 0.01) y altura y distancia (R = -0.71502, P < 0.01). Estos valores se muestran gráficamente en las figuras 1, 2 y 3. La tabla 2 contiene los géneros de algas y cianobacterias encontradas en cada roca muestreada, el tamaño de la roca, la posición a que ésta se encontró con respecto a la línea de marca alta y la presencia o ausencia de Siphonaria gigas. En tres de las ocho rocas muestreadas no se encontraronS. gigas; en dos de éstas (S-1 y S-6) las algas y/o cianobacterias son, o muy escasas o completamente ausentes (probablemente debido a factores de desecación en un caso, y en el otro a periodos largos de inmersión; siendoHerposiphonia sp., una Rhodophyta macroscópica, dominante en esta roca). La tercera de estas rocas (S-5), a pesar de presentar condiciones apropiadas como sustrato para las algas y cianobacterias, es de tamaño bastante pequeño. 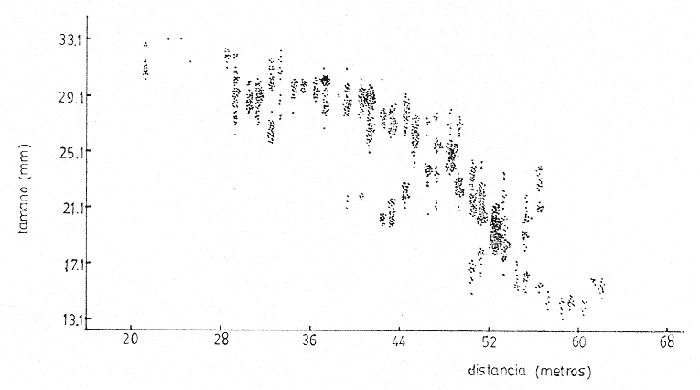 Fig. 1. Relación inversa existente entre el tamaño de Siphonaria gigas y la distancia vertical en la playa, a partir de la línea de pleamar en Play Cocal, Montezuma, Costa Rica, 1978 (R = -0.40331, P d 0.01). 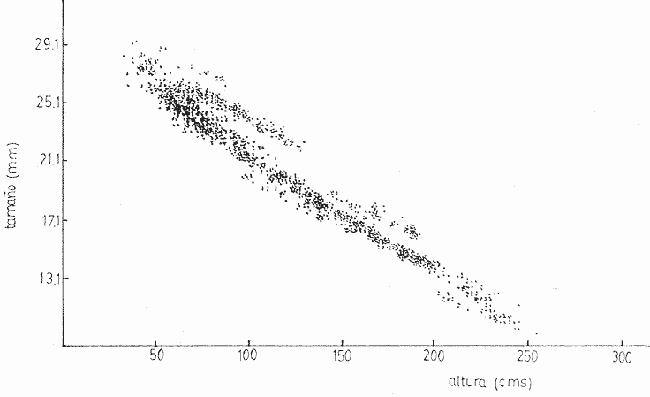 Fig. 2. Relación inversa existente entre el tamaño de Siphonaria gigas y la altura a la que se encuentran en la roca en Plata Cocal, Montezuma, Costa Rica, 1978 (R = -0.40331, P d 0.01). 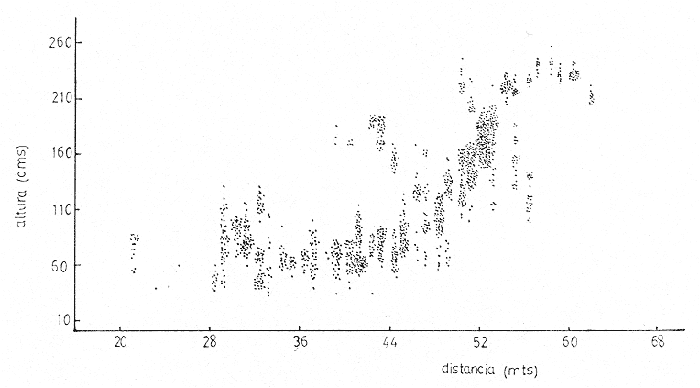 Fig. 3. Relación directa existente entre la altura a la que se encuentran los individuos de Siphonaria gigas, y la distancia vertical en la playa, a parrtir de la línea de pleamar e Playa Cocal, Montezuma, Costa Rica, 1978 (R = 0.71502, P d O.C1) La tabla 3 muestra los contenidos estomacales de los individuos estudiados. Diatómeas y cianobacterias constituyen su espectro trópico más importante. Durante los días de estudio se observaron varios especímenes desovando. Para tal efecto, abandonaron su habitación durante el periodo de marea baja y, a una distancia variable, depositaron la masa ovígera en forma espiral. Luego de realizar el proceso todas regresaron a su habitáculo. Villalobos (com. pers.) observó dichas ovoposiciones durante el mes de septiembre de 1978. DISCUSIÓN Y CONCLUSIONESCook (1969, 1971), Marcus y Marcus (1960) y Abe (1940) se han referido ampliamente a la tendencia de varias especies de lapas de prosobranquios y pulmonados de la región de mareas a regresar a lugares determinados de descanso o habitáculo en las rocas. Estas lapas se mueven de sus habitáculos presumiblemente para alimentarse de las algas presentes en las superficies de las rocas y retornan al mismo sitio luego de alimentarse. Este comportamiento de regreso se observó asimismo cuando se desplazaron para ovopositar. Cook (1971) observó que especies deSiphonaria regresan a su habitáculo cuando las rocas están completamente cubiertas por el agua en marca alta o cuando las rocas empiezan a secarse al bajar la marca. Marcus y Marcus (1960) observaron que estos individuos se mueven y alimentan mientras están cubiertos por el agua y aún fuera de ella mientras las rocas se mantengan húmedas. Por el fuerte embate de las olas en la zona de estudio, no fue posible hacer observaciones durante la marea alta; pero es factible, si se toma en cuenta lo observado por Marcus y Marcus (1960), que las lapas hayan tenido algún tipo de movimiento durante la marea alta y hayan regresado a su habitáculo durante el mismo ciclo de mareas sin que fuese posible determinarles movimiento alguno. Lo que sí es posible asegurar, es que durante las revisiones diarias mantuvieron un lugar definido. 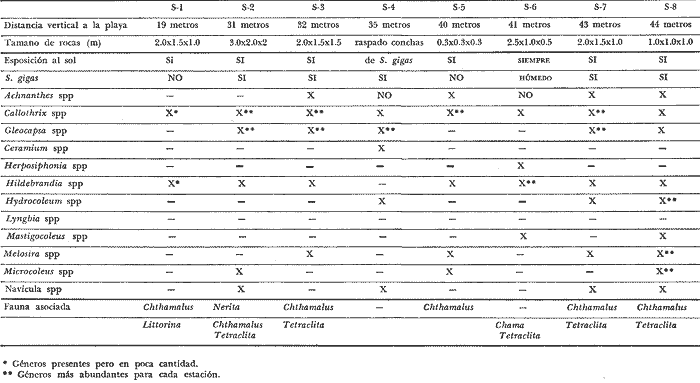 TABLA 2 GÉNEROS DE LOS ORGANISMOS IDENTIFICADOS EN LAS MUESTRAS ADQUIRIDAS POR RASPADO DE ROCAS Y CONCHAS DE SIPHONARIA GIFAS, EN LA PLAYA COCAL, MOCTEZUMA, COSTA RICA 1978  TABLA 3 ANÁLISIS DEL CONTENIDO ESTOMACAL DE 20 INDIVIDUOS DE SIPHONARIA GIGAS DE PLAYA COCAL, MONTEZUMA, COSTA RICA, 1978. Cuatro hipótesis se han propuesto para explicar el comportamiento de habitáculo de las lapas. La primera hipótesis indica que los organismos regresan siguiendo claves externas a las rocas. La segunda es que utilizan información cinestética para navegar por un desplazamiento de reversa o "dead-reckoning system" (regresan realizando en reversa exactamente el mismo movimiento de desplazamiento); la tercera hipótesis se refiere a la utilización de memoria fotográfica por las lapas. La cuarta hipótesis plantea que los animales siguen las pistas que han dejado en las rocas; dichas pistas pueden incluir caminos de mucus o senderos raspados en la cobertura de algas sobre las rocas. Cook (1971) ha aportado evidencias para desestimar las tres primeras hipótesis y reforzar la cuarta. Sin embargo, existe aun más incertidumbre sobre las causas que mueven a varias especies de lapas a presentar este comportamiento de habitáculo. El hecho de que un cierto número de lapas haya cambiado de habitáculo hace suponer que éstos no son permanentes y pueden considerarse como "nichos de ocupación temporal" y que cambios en diversos factores (alimento, periodo de desecación, efecto del oleaje, crecimiento del individuo) los obliguen a trasladarse. Esta opinión se ve reforzada al analizar la estructura de tamaños de los organismos. Los resultados obtenidos con el análisis de regresión múltiple evidencian que, conforme aumenta la distancia vertical a la playa, aumenta la altura a que se encuentran, disminuyendo el tamaño de los individuos (Fig. 3). Así, en la zona cercana al límite de marea alta se encuentran los organismos de mayor tamaño y conforme se aproximan al mar, los individuos son de menor tamaño. Esta gradación de tamaños ha sido señalada para S. hispida(Marcus y Marcus, 1960 y para S. lessoni(Olivier y Penchaszadeli, 1968). El primero de estos autores sugiere como causa principal de esta segregación la relación superficial del pie/volumen del cuerpo, ya que los individuos más pequeños pierden proporcionalmente más agua que los individuos más grandes. Siguiendo este patrón sería de esperar que los de mayor tamaño ocuparan siempre las posiciones más altas, lo que no ocurre, de acuerdo a la relación inversa entre tamaño y altura (Fig. 2). Esta inversión en la tendencia se hace más evidente al acercarse al mar, donde son más frecuentes los de menor tamaño, los cuales a su vez ocupan las posiciones más altas. Esta inversión puede deberse a que, estando garantizada la no desecación de los pequeños (por la cercanía al mar) y, asumiendo que la fuerza de adhesión del individuo es proporcional a la relación superficie del pie/ volumen, estos individuos más pequeños pasarían a ocupar los niveles superiores donde, según Jones y Demetropoulos (1958), el embate de las olas es más fuerte, pudiendo las lapas de menor tamaño resistir más exitosamente el impacto violento de las olas, evitando así la competencia con los individuos de mayor tamaño. Los resultados indicados en la tabla 2 sugieren la existencia de cierta relación entre las algas encontradas en el sustrato y la presencia o ausencia de S. gigas. En dos de las tres rocas en que no se encontró S. gigas las algas son, o muy escasas, o completamente ausentes y la tercera roca, a pesar de presentar un espectro ficológico similar al de las rocas en que sí se encontraronS. gigas, por su reducido tamaño es fácilmente movida por el oleaje, cambiando constantemente su orientación, lo cual es peligroso para los moluscos que podrían ser despedazados al rodar la pequeña roca. Esta opinión se ve reforzada al considerar la escasa fauna asociada que se encuentra en la roca. Al analizar los contenidos estomacales de los moluscos es evidente que éstos no tienen una preferencia marcada por determinadas algas. Diatomeas y cianobacterias, en general integran su espectro trópico (Tabla 3). El resultado paradójico de las tablas 2 y 3 sugieren que la dominancia de cualquier grupo alimenticio en un individuo dado puede deberse a dos factores, no excluyentes entre sí: 1) a la abundancia relativa de determinadas algas o cianobacterias en el medio (más aún considerando que son animales raspadores, difícilmente pueden seleccionar entre una y otra especie y/o 2) debido al alto grado de digestión del contenido estomacal de ciertos individuos, los valores relativos de las algas y cianobacterias pudieron haber sido sobreestimados en favor de aquellos cuya digestión es más lenta. La distribución de las algas y cianobacterias variará según sean las necesidades de cada especie; y si esta variación se encuentra dentro de los límites ecológicos y fisiológicos de S. gigas ésta podrá disponer de aquellas que se encuentren ahí para su alimentación, sin realmente importar de qué especie se trata. De acuerdo con el coeficiente de determinación (R2) obtenido del análisis de regresión (Tabla 1), la altura y la distancia vertical a la playa explican un 17.1% de la gradación de tamaños de S. gigas, donde la altura es el factor más importante, influyendo en un 16.3%. Esto quiere decir que existen factores no incluidos en la regresión, que pueden estar influenciando la gradación de tamaños. Consideramos que estos factores pueden ser, como se deduce de, los resultados obtenidos, la presencia de algas que constituyen su espectro trópico, el periodo de desecación y la fuerza del embate de las olas, el efecto de predadores (Menge, 1973), así como otros factores aún no determinados, incluso aleatorios, que en conjunto determinan la distribución de Siphonaria gigas. AgradecimientosLos autores desean expresar su agradecimiento a los siguientes profesores de la Universidad de Costa Rica: Ramiro Barrantes, Jesús Camacho, Ricardo Soto y Carlos Villalobos; y a Gilbert y Nancy Voss de la Universidad de Miami, cuya valiosa ayuda y sugerencia hicieron posible la realización de este estudio. LITERATURAABE, N.,Sci. Rep. Tohoku Univ. Sendai The homing, spawning and other habitats of a limpet, Siphonaria japonica Donovan.1940.59-95.15 COOK, S. B., Siphonaria normalis. Anim. Behav.,Experiments of homing in the limpet 1969.330-339.17 - Siphonaria alternata. Biol. Bull.,A study of homing behavior in the limpet1971.449-457.141 CUPP, E. C., Bull. Scripps Inst. of Ocy., Technical SeriesMarine plankton diatoms of the West Coast.1971.1-237.5 DAWSON, E. Y., Pac. Nat., Una clave ilustrada de los géneros de algas bénticas del Pacífico de América Central.1962.167-231.3 (4) DESIKACHARY, T. U.,Cyanophyta. Indian Council of Agricultural Research. Nueva Delhi1959. 660 p. HUBBENDICK, B., Kungl. Svenska Vetenskapsahademiens Handlingur. Ser. 3 Systematic monograph of the Patelliformia. 1946.1-93.23(5) JONES, W. I. and A. DEMETROPOULOS J. exp. mar. Biol. Ecol.,Exposure to wave action: Measurements of an important ecological parameter on rocky shores on Anglessey.1968. 44-63.2 KEEN, A. M., Sea shells of Tropical West America. Stanford University Press.California1971.1064 p MARCUS, E. and E, MARCUS On Siphonaria hispida. Univ. of Sao Paulo. Fac. Filos., Cienc. e Letras. Bol. Zool.,1960.107-140.23 MENGE, B. Z., The Veliger Effect of predation and environmental patchiness on the body size of a tropical pulmonate limpet.1973.87-91.16(1) OLIVIER, S. R. y P. E. PENCHASZADEH Cahiers de Biologie MarineObservaciones sobre la ecología y biología de Siphonaria (Pachysiphonaria) lessoni (Blainivlle, 1824) (Gastropoda, Siphonariidae) en el litoral rocoso del Mar del Plata (Buenos Aires). 1968.469-491.9 TAYLOR, W. R., Marine Algae of the Eastern Tropical and Subtropical Coast of the Americas.Ann Arbor: Univ. of Michigan PressMichigan1960.870 p. VOSS, N. A., Bull. Mar. Sci., Studies on the pulmonata gastropod Siphonaria pectinata (Linnaeus) from the Southeast coast of Florida.1959.84-99.9 (1)
|

